Method Article
Subkultur und Kryokonservierung von Ösophagus-Adenokarzinom-Organoiden: Vor- und Nachteile für die Einzelzellverdauung
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Methoden der Subkultur und Kryokonservierung von Ösophagus-Adenokarzinom-Organoiden mit und ohne Einzelzellaufschluss, um es den Forschern zu ermöglichen, geeignete Strategien auf der Grundlage ihres experimentellen Designs auszuwählen.
Zusammenfassung
Der Mangel an geeigneten translationalen Forschungsmodellen, die Primärerkrankungen widerspiegeln, um die Tumorentstehung und therapeutische Strategien zu erforschen, ist ein großes Hindernis beim Ösophagus-Adenokarzinom (EAC). Patientenabgeleitete Organoide (PDOs) haben sich kürzlich als bemerkenswertes präklinisches Modell bei einer Vielzahl von Krebsarten herausgestellt. Für die Entwicklung von EAC-PDOs stehen jedoch noch begrenzte Protokolle zur Verfügung. Sobald die g.U. etabliert sind, sind die Vermehrung und Kryokonservierung für weitere nachgelagerte Analysen unerlässlich. Hier wurden zwei verschiedene Methoden für EAC-PDOs Subkultur und Kryokonservierung standardisiert, d.h. mit und ohne Einzelzellaufschluss. Beide Methoden können zuverlässig eine geeignete Zelllebensfähigkeit erreichen und sind für einen vielfältigen Versuchsaufbau geeignet. Die aktuelle Studie zeigte, dass die Subkulturierung von EAC-PDOs mit Einzelzellaufschluss für die meisten Experimente geeignet ist, die eine Kontrolle der Zellzahl, eine gleichmäßige Dichte und eine hohle Struktur erfordern, die die Größenverfolgung erleichtert. Die Einzelzell-basierte Methode zeigt jedoch ein langsameres Wachstum sowohl in der Kultur als auch nach der Rekultivierung aus gefrorenen Beständen. Außerdem ist die Subkulturation mit einzelliger Verdauung durch die Bildung von Hohlstrukturen mit einem hohlen Kern gekennzeichnet. Im Gegensatz dazu ist die Verarbeitung von EAC-PDOs ohne Einzelzellverdauung günstig für die Kryokonservierung, Expansion und histologische Charakterisierung. In diesem Protokoll werden die Vor- und Nachteile der Subkulturierung und Kryokonservierung von EAC-PDOs mit und ohne Einzelzellaufschluss beschrieben, um es den Forschern zu ermöglichen, eine geeignete Methode zur Verarbeitung und Untersuchung ihrer Organoide zu wählen.
Einleitung
Speiseröhrenkrebs (EC) ist die zehnthäufigste und die sechsthäufigste Todesursache durch Krebsweltweit 1. Das Ösophagus-Adenokarzinom (EAC) ist einer der wichtigsten histologischen Subtypen von EC und tritt hauptsächlich in westlichen Ländern auf2. In den letzten zehn Jahren hat die EAC-Inzidenz in vielen Industrieländern, einschließlich Deutschland, deutlich zugenommen3. Aufgrund der Aggressivität von Krebs und des Fehlens von Symptomen im frühen Stadium der Tumorentwicklung ist die Gesamtprognose bei EAC-Patienten schlecht und zeigt eine 5-Jahres-Überlebensrate von etwa 20%2,4,5.
Seit dem späten zwanzigsten Jahrhundert haben sich mehrere Modelle für die biomedizinische Forschung der EAC etabliert. Die klassischen humanen EAC-Zelllinien, die in den 1990er Jahren etabliert wurden6, erweitern unser Wissen über EAC-Tumorbiologie, Tumorgenetik sowie Anti-Tumor-Strategien und werden häufig in der EAC-Forschung eingesetzt. Außerdem haben einige Forschungsgruppen erfolgreich Tiermodelle der EAC oder Barrett-Speiseröhre entwickelt, indem sie die Tiere bekannten Risikofaktoren wie gastroösophagealen Reflux durch chirurgische oder entzündliche Ansätze ausgesetzt haben 7,8,9. Darüber hinaus wurden patientenabgeleitete Xenotransplantat-Modelle (PDX) entwickelt, die EAC-Primärkrebsgewebe subkutan oder orthotopisch in immundefiziente Mäuse transplantieren, um das biologische Verhalten des menschlichen EAC-Tumors und die Tumorumgebung zu simulieren10,11,12. Obwohl diese Modelle die klinischen Anwendungen und unser Verständnis der molekularen Mechanismen hinter der EAC-Tumorentstehung und -progression verbessern, besteht immer noch eine große Herausforderung, die Ergebnisse dieser Forschungsmodelle auf den Menschen zu extrapolieren.
Patientenabgeleitete Tumororganoide (PDOs) werden in einem 3D-Kultursystem gezüchtet, das die menschliche Entwicklung und Organregeneration in vitro nachahmt. Aus dem Primärgewebe der Patienten gewonnen, rekapitulieren PDOs die molekularen und phänotypischen Eigenschaften des menschlichen Tumors und haben vielversprechende Anwendungen in der Arzneimittelentwicklung und personalisierten Krebsbehandlunggezeigt 13,14. Durch den Vergleich von zehn Fällen von EAC-PDOs mit ihrem gepaarten Tumorgewebe wird berichtet, dass EAC-PDOs ähnliche histopathologische Merkmale und eine genomische Landschaft mit dem Primärtumor teilen, die Heterogenität innerhalb des Tumors beibehalten und ein effizientes Arzneimittelscreening in vitroermöglichen 15. EAC-PDOs wurden auch bei der Untersuchung der Interaktion von EAC-Tumorzellen mit patientenabgeleiteten Krebs-assoziierten Fibroblasten (CAFs) verwendet, was auf eine leistungsstarke Anwendung im Bereich der Tumormikroumgebungsforschunghinweist 16. Leider gibt es nur begrenzte Protokolle für die Entwicklung und Verbreitung von EAC-PDOs. Hier werden zwei verschiedene Methoden zur Subkulturation und Konservierung von EAC-PDOs im Detail beschrieben: mit und ohne Einzelzellverdauung. Die standardisierten Methoden zur Aufrechterhaltung von EAC-PDOs und deren Anwendungen können Forscher dabei unterstützen, geeignete Methoden für verschiedene Zwecke in ihrer EAC-PDO-Forschung zu wählen.
Protokoll
Eine etablierte und gut wachsende DOP-Kultur stellt die Grundlage für eine erfolgreiche Subkultur und Kryokonservierung dar, die in diesem Protokoll beschrieben wird. Hier wurden EAC-PDOs aus dem primären Tumorgewebe von EAC-Patienten unter Verwendung des von Karakasheva T. A. et al17 beschriebenen Protokolls erzeugt. EAC-Gewebe wurden aus der Biobank unter der Genehmigung von BioMaSOTA (genehmigt von der Ethikkommission der Universität zu Köln, ID: 13-091) gesammelt.
HINWEIS: EAC-g.U. wurden in einem befeuchteten Inkubator bei 37 °C und 5% CO2 unter Verwendung eines PDO-Kulturmediums kultiviert (Tabelle 1). In den folgenden Schritten werden zwei Methoden der Subkultur detailliert beschrieben. Eine 12-Well-Platte wird empfohlen, um die PDOs mit einer Seeding-Dichte von drei extrazellulären Matrix (ECM) -Geldomen pro Well zu subkultivieren, da sie eine flexible Verwendung jedes Wells und eine angemessene Menge an PDOs für verschiedene Zwecke ermöglicht. Eine aseptische Technik ist bei der Handhabung der PDOs obligatorisch.
1. Vorbereitungen im Vorfeld
- Vorwärmen Sie eine 12-Well-Platte vor, indem Sie sie über Nacht vor der Subkultur in einen 37 °C CO 2-Inkubator legen, um eine vollständige Erwärmung der Platte zu gewährleisten. Falls verfügbar, verwenden Sie leere Vertiefungen von einer Platte mit der aktuellen PDO-Kultur.
HINWEIS: Für eine flexible Subkulturplanung empfiehlt sich die kontinuierliche Lagerung von 1-2 frischen Platten bei 37 °C. - Vorkühlende 1.000 μL und 200 μL Spitzen mit einer breiten Blende bei -20 °C (kontinuierliche Lagerung empfohlen). Vorkühlzentrifuge bei 4 °C.
- Stellen Sie die Temperatur des rotierenden Inkubators auf 37 °C ein (wenn ein Einzelzellaufschluss durchgeführt wird).
- Inkubieren Sie ein angemessenes Volumen ECM-Gel für 1 h auf Eis, um es zu verflüssigen. Legen Sie die Zellwiederherstellungslösung auf Eis.
2. Organoide ernten
- Entfernen Sie die Platte mit wachsenden PDOs aus dem CO2-Inkubator.
- Natives Medium mit einer Vakuumpumpe abpumpen.
HINWEIS: Vermeiden Sie es, die Kuppeln zu berühren. - Geben Sie ein geeignetes Volumen eiskalter Zellrückgewinnungslösung (500 μl / Dome) in das Bohrloch.
- Zerlegen Sie das ECM-Gel, indem Sie mehrmals nach oben und unten pipettieren, um ECM-Gel-Kuppeln mit 1.000 μL-Spitzen mit einer breiten Öffnung in kleine Stücke zu fragmentieren.
- Kombinieren Sie die Mischung aus PDO, ECM-Gel und Zellrückgewinnungslösung aus maximal zwei Vertiefungen (sechs Kuppeln) und übertragen Sie sie in ein 5-ml-Low-Bind-Röhrchen (verwenden Sie ein zweites Röhrchen, falls mehr Vertiefungen für die Subkultur verwendet werden).
HINWEIS: Wenn ECM-Gel nicht vollständig aufgelöst wurde, fügen Sie optional eine zusätzliche 1,5 ml Zellwiederherstellungslösung zu der Mischung aus PDO, ECM-Gel und Zellwiederherstellungslösung hinzu. - Inkubieren Sie die Tube mit der Mischung in Schritt 2.5 auf Eis für 20 min, mischen Sie alle 5 Minuten, indem Sie die Tube fünfmal umkehren, um die Verflüssigung des ECM-Gels sicherzustellen.
- Zentrifuge bei 500 x g für 4 min bei 4° C.
- Wenn nach der Zentrifugation ein sichtbares und stabiles Pellet vorhanden ist, fahren Sie mit Schritt 2.10 fort. Fahren Sie andernfalls mit Schritt 2.9 fort.
- Wenn kein sichtbares Pellet vorhanden ist und die PDOs immer noch in einer Gelphase stecken zu bleiben scheinen, entfernen Sie den Überstand vorsichtig mit einer Vakuumpumpe, bis die Phase mit ECM-Gel-PDO-Lösung erreicht ist, und fügen Sie 3 ml eiskalte Zellrückgewinnungslösung hinzu.
- Drehen Sie die Röhre einige Male um und inkubieren Sie sie weitere 10 Minuten auf Eis. Mischen Sie, indem Sie das Rohr von Zeit zu Zeit umkehren.
- Bei 500 x g für 4 min bei 4 °C zentrifugieren und mit Schritt 2.10 fortfahren.
- Entsorgen Sie den Überstand vorsichtig mit einer Vakuumpumpe oder einer 1.000-μL-Pipette. Versuchen Sie, den Überstand so weit wie möglich zu entfernen.
HINWEIS: Aufgrund der geringen Bindungsfläche des Rohres ist das Pellet nicht so stabil wie üblich. - Lagern Sie das DOP-Pellet auf Eis und fahren Sie mit Schritt 3 (ohne Verdauung) oder Schritt 4 (mit Einzelzellaufschluss) fort, abhängig von den verschiedenen Zwecken.
3. Subkultivieren ohne Verdauung
HINWEIS: Diese Methode zielt darauf ab, die Größe und Dichte der g.U. zu erhöhen. Die größere Größe und höhere Dichte erleichtern den Einbettungsprozess, die histologische Charakterisierung und die PDO-Expansion. Abhängig von den PDO-Split-Verhältnissen (basierend auf der Dichte von PDOs wird ein Verhältnis zwischen 1:3 und 1:6 empfohlen), resuspendiert das Pellet aus Schritt 2.8 in einem geeigneten Volumen flüssigen ECM-Gels.
- Entfernen Sie vorgekühlte 200 μL und 1.000 μL Spitzen mit einer breiten Öffnung aus dem -20 °C Gefrierschrank und legen Sie sie auf eine saubere Bank.
- Resuspendiert das Pellet aus Schritt 2.11 in ECM-Gel mit vorgekühlten 1.000 μL Spitzen. Mischen Sie, indem Sie etwa 10 Mal nach oben und unten pipettieren, um sicherzustellen, dass die PDOs nicht verklumpen und gleichmäßig im ECM-Gel verteilt sind.
HINWEIS: Verwenden Sie 50 μL ECM-Gel/Dome. Berechnen Sie für eine Kuppel immer mehr als erforderlich (z. B. für neun Kuppeln (d. h. drei Vertiefungen), resuspendieren Sie das Pellet in 500 μL flüssigem ECM-Gel (450 + 50 μL extra). Versuchen Sie, Blasen während der Reanimation zu vermeiden! - Entfernen Sie die vorgewärmte 12-Well-Platte direkt vor dem Aussäen der Kuppeln aus dem Inkubator.
- Samendome mit 50 μL ECM-Gel in die warme Platte (drei Kuppeln/Well). Vermeiden Sie es, Blasen in die ECM-Gel-Domes zu pipettieren.
- Legen Sie die Platte wieder in den 37 °C und 5% CO2Inkubator und inkubieren Sie für 20-30 Minuten, um das ECM-Gel zu verfestigen.
- Vorgewärmtes PDO-Medium (Tabelle 1) vorsichtig hinzufügen, ohne die Kuppeln zu stören.
- Kultur der PDOs für 7-14 Tage, bis die erforderliche Dichte und Morphologie auftreten.
4. Subkulturation mit Einzelzellverdauung
HINWEIS: Die folgenden Schritte zielen darauf ab, die Anzahl der g.U. pro Kuppel zu erhöhen. Der Einzelzellaufschluss erleichtert die Kontrolle der Zellzahl und die PDO-Expansion.
- Bereiten Sie das Aufschlussmedium vor, indem Sie 2 ml 0,25% Trypsin-EDTA und 20 μL DNase I (für die Verdauung von drei Kuppeln) mischen.
- Resuspendiert das Pellet aus Schritt 2.11 mit einem geeigneten Volumen von vorerwärmten 0,25% Trypsin-EDTA + DNase I und mischen Sie es etwa 10 Mal, indem Sie es mit einer 1.000-μL-Pipette auf und ab pipettieren (normale 1.000-μL-Spitzen verwenden).
- 10 min bei 37 °C in einem rotierenden Inkubator mit einer Drehzahl von mindestens 28 U/min inkubieren.
- Bereiten Sie ein 15-ml-Röhrchen mit 6 ml Sojabohnen-Trypsin-Inhibitor-Lösung (STI, Tabelle 2) vor (pro 2 ml 0,25% Trypsin-EDTA).
- Mischen Sie die verdauten PDOs nach der Verdauung einige Male gründlich mit einer 1.000-μL-Pipette, um die PDOs zu stören.
- Übertragen Sie die verdauten PDOs in das 15-ml-Röhrchen, das die STI-Lösung enthält, um den Aufschlussprozess zu stoppen.
- Zentrifuge bei 500 x g für 4 min bei 4 °C. Entsorgen Sie den Überstand vorsichtig mit einer Vakuumpumpe oder einer 1.000-μL-Pipette. Resuspendiert das Pellet in 1 ml Basalmedium (Tabelle 3).
- Bestimmen Sie die Zellkonzentration und -lebensfähigkeit mit einem automatisierten Zellzähler oder einem Hämozytometer.
- Samen verdaut DOP in eine 12-Well-Platte mit 2 x 104 Zellen pro Kuppel.
- Berechnen Sie die Zellzahl entsprechend den für die Aussaat geplanten Kuppeln und übertragen Sie sie auf ein frisches 1,5 ml niedriges Binderohr.
HINWEIS: Berechnen Sie für eine Dome mehr (+ 2 x 104 Zellen extra). Zum Beispiel, um drei Kuppeln in eine Vertiefung zu säen, nehmen Sie 8 x 10 4 (2 x 10 4 * 3 + 2 x 104 extra) Zellen. - Zentrifuge bei 500 x g für 4 min bei 4 °C.
- Falls kein sichtbares Pellet vorhanden ist, erinnern Sie sich an die Ausrichtung des Röhrchens in der Zentrifuge, um zu wissen, wo sich das Pellet befindet.
- Entsorgen Sie den Überstand vorsichtig mit einer 1.000 μL Pipette. Entfernen Sie den Überstand so weit wie möglich, ohne das Pellet zu stören.
- Fügen Sie dem Pellet ein angemessenes Volumen an ECM-Gel hinzu, indem Sie eine 1.000 μL-Pipette mit vorgekühlter 1.000 μL breiter Blendenspitze (50 μL / Dome + 50 μL extra) verwenden.
- Führen Sie die Schritte 3.3-3.7 aus.
- Berechnen Sie die Zellzahl entsprechend den für die Aussaat geplanten Kuppeln und übertragen Sie sie auf ein frisches 1,5 ml niedriges Binderohr.
5. Kryokonservierung der verdauten und unverdauten g.U.
HINWEIS: Einzelzellige verdaute und unverdaute PDOs eignen sich für die Herstellung von gefrorenen Backup-Beständen. Es ist zu beachten, dass rekultivierte g.U. aus den einzelligen gefrorenen Beständen eine längere Zeit benötigen, um sich zu erholen und eine bestimmte Größe zu erreichen.
- Kryokonservierung der unverdauten g.U..
- Starten Sie den Kryokonservierungsprozess mit dem Pellet ab Schritt 2.8. Verwenden Sie 500 μL kaltes Gefriermedium, um das Pellet zu resuspendieren und in eine kryogene Durchstechflasche zu überführen.
HINWEIS: Bewahren Sie zwei Kuppeln pro Durchstechflasche auf. - Einfrieren Sie PDOs über Nacht in einem Gefrierschrank von -80 °C mit einem geeigneten Zellgefrierbehälter.
- Starten Sie den Kryokonservierungsprozess mit dem Pellet ab Schritt 2.8. Verwenden Sie 500 μL kaltes Gefriermedium, um das Pellet zu resuspendieren und in eine kryogene Durchstechflasche zu überführen.
- Kryokonservierung der einzelligen verdauten PDOs
- Beginnen Sie nach der Ernte und Verdauung von g.U. mit der Kryokonservierung ab Schritt 4.8.
- Zur Lagerung einer kryogenen Durchstechflasche werden 4-5 x 10 5 Zellen in ein frisches1,5 ml niedriges Bindröhrchen übertragen.
HINWEIS: Lagern Sie drei Kuppeln / Fläschchen. - Zentrifuge bei 500 x g für 4 min bei 4 °C. Entsorgen Sie den Überstand vorsichtig mit einer 1.000 μL Pipette. Entfernen Sie den Überstand so weit wie möglich, ohne das Pellet zu stören.
- Das Pellet wird in einem geeigneten Volumen Gefriermedium (500 μL/Durchstechflasche) resuspendiert und in ein kryogenes Fläschchen überführt.
- Einfrieren Sie PDOs über Nacht in einem -80 °C Gefrierschrank mit einem geeigneten Zellgefrierbehälter ein und geben Sie sie zur Langzeitlagerung in einen -150 °C Gefrierschrank oder flüssigen Stickstoff.
Ergebnisse
Dieses Protokoll stellt die Verfahren einschließlich Subkultur und Kryokonservierung von EAC-PDOs mit und ohne Einzelzellaufschluss vor.
Abbildung 1 zeigt repräsentative Phasenkontrastbilder der beiden unterschiedlichen Subkulturstrategien. EAC-PDOs erreichten eine angemessene Dichte für die Subkulturation (Abbildung 1, links). Die Subkulturation ohne Einzelzellverdauung benötigt weniger Zeit, um eine vergleichbare Dichte zu erreichen, und führt hauptsächlich zu kompakten Strukturen (Abbildung 1, obere Reihe). Im Gegensatz dazu zeigen die einzelligen verdauten PDOs hohle Strukturen mit einem hohlen Kern (Abbildung 1, untere Reihe). Abbildung 2 zeigt die Hämatoxylin-Eosin (H&E)-Färbung und Immunhistochemie (IHC)-Färbung von paraffineingebetteten EAC-PDOs mit kompakten und hohlen Strukturen. Das Pan-Cytokeratin (Pan-CK) ermöglicht die Identifizierung von epithelialen Tumorzellen18. Das Cytokeratin 7 (CK7) hebt die drüsendifferenzierten Tumorzellenhervor 19. Die kompakte Struktur (obere Reihe) existiert überwiegend in der unverdauten Kultur, während die hohle Struktur (untere Reihe) in der Kultur, die einer einzelligen Verdauung unterzogen wurde, dominant ist.
Abbildung 3 zeigt die Immunfluoreszenzfärbung (IHC) von gepaartem EAC-Gewebe und PDOs mit kompakter Struktur und Hohlstruktur. Der Ki67 hebt die Zellpopulationen mit höherer zellulärer Proliferationhervor 20. Der Ki67 (rot) und der Pan-CK (grün) waren in ähnlicher Weise auf EAC-Primärgewebe, EAC-PDO-Kompaktstruktur und EAC-PDO-Hohlstruktur verteilt. Abbildung 4 zeigt die morphologischen Eigenschaften von EAC-PDOs am ersten Tag der Erholung aus gefrorenem Bestand mit Einzelzell-basierter Kryokonservierung (links) und unverdauter PDO-basierter Kryokonservierung (rechts).
Abbildung 5 fasst ein Flussdiagramm des Subkulturprozesses von EAC-PDOs mit und ohne Einzelzellaufschluss zusammen. Kurz gesagt, eine gut wachsende EAC-g.U. ist bereit, verabschiedet zu werden. EAC-g.U. wurden geerntet und pelletiert. Für die Einzelzellverdauung wurden PDOs für 5-10 Minuten enzymatisch verdaut, um einzelne Zellen zu erhalten, die wahrscheinlich zu hohlen Strukturen heranwuchsen, die Experimente erleichtern, die eine Kontrolle der Zellzahl, eine gleichmäßige Dichte und Größenverfolgung erfordern. Für unverdaute Subkulturen wurden PDOs gespalten, um mehr Wachstumsraum ohne enzymatische Unterbrechung zu gewinnen, die wahrscheinlich zu kompakten Strukturen heranwuchsen, die histologische Analysen, schnelle Expansion und schnellere Erholung von der Kryokonservierung erleichtern.
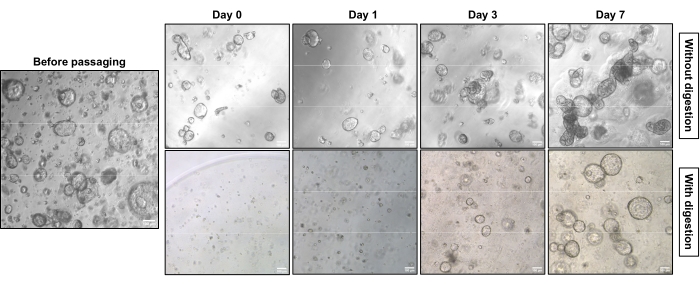
Abbildung 1: Morphologische Eigenschaften von EAC-PDOs-Subkulturen mit und ohne Einzelzellaufschluss unter einem Phasenkontrastmikroskop. EAC-PDOs wachsen vor der Subkultur auf eine gewisse Dichte (links). Bei der Subkulturation von EAC-PDOs ohne Einzelzellverdauung wachsen PDOs allmählich von hohlen Strukturen zu kompakten Strukturen (rechts, obere Reihe), während PDOs, die aus Einzelzellen gezüchtet werden, überwiegend hohle Strukturen zeigen (rechts, untere Reihe). Die Bilder wurden mit einem inversen Lichtmikroskop mit einem 5-fachen Objektiv aufgenommen. Maßstabsbalken: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
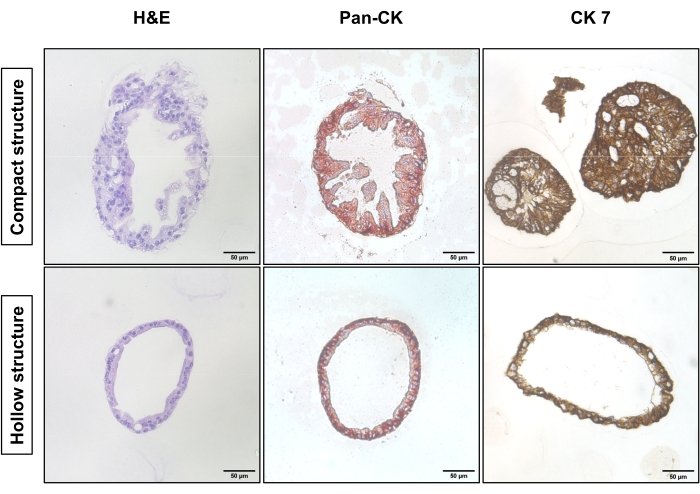
Abbildung 2: Histologische Merkmale der kompakten Struktur und Hohlstruktur von EAC-PDOs. Die H & E-Färbung (links), die Pan-CK-Färbung (Mitte) und die CK7-Färbung (rechts) der kompakten Struktur (obere Reihe) und der hohlen Struktur (untere Reihe). Die Bilder wurden mit einem inversen Lichtmikroskop mit einem 20-fachen Objektiv aufgenommen. Maßstabsbalken: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Immunhistochemische Färbung von gepaartem EAC-Gewebe und PDOs. Die Immunfluoreszenzfärbung (IF) von gepaartem EAC-Gewebe (obere Reihe), kompakte Struktur (mittlere Reihe) und hohle Struktur (untere Reihe) mit Pan-CK (grün), Ki67 (rot) und DAPI (blau). Die Bilder wurden mit einem invertierten automatisierten Fluoreszenzmikroskop unter Verwendung eines 20-fachen Objektivs aufgenommen. Maßstabsbalken: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Morphologische Merkmale von EAC-g.U. am ersten Tag der Erholung aus gefrorenen Beständen. Phasenkontrastbilder der Rekultivierung aus einzelzellbasierter Kryokonservierung (links) und unverdauter PDO-basierter Kryokonservierung (rechts) am ersten Tag der Genesung. Die Bilder wurden mit einem inversen Lichtmikroskop mit einem 5-fachen Objektiv aufgenommen. Maßstabsbalken: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Das Flussdiagramm des Subkulturprozesses von EAC-PDOs mit und ohne Einzelzellaufschluss. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Lager | Endkonzentration | 50 ml | |||
| Basales Medium (siehe Tabelle 3) | 24 ml | ||||
| Wnt-3A konditioniertes Medium | 12 ml | ||||
| R-Spondin1 konditioniertes Medium aus Cultrex R-Spondin Zellen | 12 ml | ||||
| N-2 | 100x | 1x | 500 μL | ||
| B-27 | 50-fach | 1x | 1 ml | ||
| N-Acetylcystein | 0,5 Mio. | 1 mM | 100 μL | ||
| CHIR-99021 | 5 mM | 0,5 μM | 5 μL | ||
| Rekombinanter humaner epidermaler Wachstumsfaktor (EGF) | 100 μg/ml | 250 ng/ml | 125 μL | ||
| A83-01 | 25 mM | 0,5 μM | 1 μL | ||
| SB202190 | 10 mM | 1 μM | 5 μL | ||
| Gastrin | 100 μM | 0,1 μM | 50 μL | ||
| Nicotinamid | 1 Mio. | 20 μM | 1 ml | ||
| Gentamicin | 50 mg/ml | 10 μM | 5 μL | ||
| Penicillin/Streptomycin | 100x | 1x | 500 μL | ||
| Amphotericin B | 250 μg/ml | 0.60% | 300 μL | ||
| Frisch einfüllen: | |||||
| Birne | 100 μg/ml | 50 μL | |||
| Y-27632 | 10,5 mM | 50 μL | |||
| Hinzufügen bei der Etablierung neuer g.U. aus Primärgewebe oder der Erholung aus gefrorenen Beständen | |||||
| FGF-10a | 100 μg/ml | 100 ng/ml | 50 μL | ||
Tabelle 1: Erstellung des EAC-Kulturmediums g.U.
| Sojabohnen-Trypsin-Inhibitor (STI) | 12,5 mg |
| Mit DPBS auf 50 ml einstellen | |
| Filter durch 0,2 μm Sterilfilter |
Tabelle 2: Herstellung einer Sojabohnen-Trypsin-Inhibitor-Lösung (STI)
| Reagenz | Volumen | Endkonzentration |
| Erweitertes DMEM/F-12 | 48,2 ml | |
| HEPES (1 M) | 500 μL | 10 mM |
| L-Glutamin (100X) | 500 μL | 1X |
| Penicillin-Streptomycin (100X) | 500 μL | 1X |
| Amphotericin B | 300 μL | 0.60% |
| Gentamicin (50 mg/ml) | 5 μL | 5 μg/ml |
Tabelle 3: Herstellung von Basalmedium.
| Einzelzelliger Aufschluss | |
| Profis | Nachteile |
| Zellennummernsteuerung | Zerbrechlich beim Einbetten |
| Prüfung der Lebensfähigkeit | Längerer Zeitaufwand zwischen den Passagen |
| Anwendbar z.B. für Drug Screening, Durchflusszytometrie | Längere Erholungszeit aus Tiefkühlbeständen |
| Ohne Einzelzellverdauung | |
| Profis | Nachteile |
| Morphologie ist vorteilhaft für histologische Analysen | Erweiterung der g.U. mehr in der Größe als in der Anzahl |
| Höhere Stabilität im Einbettungsprozess | Nicht anwendbar für Analysen, bei denen Einzelzellsuspension obligatorisch ist |
| Schnelle Erholung von Tiefkühlbeständen | Fehlende Zellennummernkontrolle und Größenverfolgung |
Tabelle 4: Vor- und Nachteile der Subkulturation von EAC-PDOs mit und ohne Einzelzellverdauung.
Diskussion
In diesem Protokoll werden zwei verschiedene Subkultur- und Kryokonservierungsmethoden von EAC-PDOs beschrieben, d.h. mit und ohne Einzelzellverdauung. Mehrere Studien empfahlen, EAC-PDOs mit Einzelzellverdauung15,17 zu passieren, was für die meisten Experimente von Vorteil ist, die eine Kontrolle der Zellzahl, eine gleichmäßige Dichte und eine hohle Struktur erfordern, die die Größenverfolgung erleichtert. Die Einzelzellmethode zeichnet sich jedoch durch ein langsameres Wachstum nach der Rekultivierung aus gefrorenen Beständen und eine weniger kompakte Morphologie während der Kulturperiode aus. Die Erfahrung zeigt 2-3 Wochen für die einzelzellbasierte Rekultivierung, um die anwendbare Dichte für den Subkulturprozess zu erreichen. Im Gegensatz dazu können gefrorene EAC-PDOs ohne Einzelzellverdauung in kürzerer Zeit (ca. 1 Woche) nach der Rekultivierung die gleiche Größe erreichen. Ein Grund könnte der zusätzliche Stress durch die Trypsin-Verdauung für eine relativ lange Zeit (10 min) sein. Daher wird empfohlen, unverdaute EAC-PDOs im Verhältnis 1:1,5 zu konservieren (zwei Kuppeln unverdauter EAC-PDOs einzufrieren und für die Rekultivierung wieder in drei Kuppeln zu säen). Darüber hinaus wird die Verwendung von unverdauten EAC-PDOs für eine schnelle Expansion und histologische Charakterisierung durch IHC- oder IF-Färbung aufgrund der kompakten Struktur empfohlen. Die Vor- und Nachteile der beiden Subkulturmethoden sind in Tabelle 4 zusammengefasst.
Mehrere kritische Schritte erfordern Aufmerksamkeit in diesem Protokoll. Erstens müssen die Platten für die DOP-Kultur über Nacht in einem 37 °C Inkubator vorgewärmt werden, um den Erstarrungsprozess von frisch ausgesäten ECM-Gel-Domes zu gewährleisten. Es wird empfohlen, eine Kochplatte zu verwenden, um die Platte bei 37 ° C zu halten, während Sie eine längere Aussaatdauer haben. Zweitens sind während des Subkulturprozesses Röhrchen mit geringer Bindung erforderlich, um einen signifikanten PDO-Verlust zu vermeiden. Um einen ECM-Gelverlust zu vermeiden, können Spitzen mit einer breiten Bohrungsöffnung vor Gebrauch im -20 °C Gefrierschrank vorgekühlt werden. Hier vermeidet die weite Öffnung der Spitzen die Beschädigung von DOP-Strukturen während des Ernteschritts. Als nächstes wird empfohlen, die PDOs vor dem ersten Zentrifugationsschritt 20 Minuten lang auf Eis zu inkubieren, um eine vollständige Verflüssigung des ECM-Gels zu gewährleisten. Beachten Sie, dass die Zentrifuge während der Zentrifugationsschritte auf 4 °C eingestellt werden muss, um das restliche ECM-Gel im flüssigen Zustand zu halten. Darüber hinaus wird für die Einzelzellmethode empfohlen, die PDOs nach der Trypsin-Inkubation gründlich mit einer normalen 1.000-μL-Spitze zu mischen, um Zellklumpen vor Zugabe der STI zu brechen, anstatt die Zellsuspension direkt mit Zellsieben zu filtern, um Zellverlust zu vermeiden.
Einige Änderungen können in diesem Protokoll vorgenommen werden. Die Zellrückgewinnungslösung kann durch eiskalte DPBS ersetzt werden, um das ECM-Gel im Ernteschritt aufzulösen. Die Erfahrungen zeigten jedoch eine bessere Fähigkeit, das ECM-Gel mit der Zellwiederherstellungslösung aufzulösen. Daher empfiehlt sich eiskaltes DPBS eher nur als alternative Backup-Methode. Wenn das Labor nicht mit einem rotierenden Inkubator ausgestattet ist, können EAC-PDOs mit Trypsin in einem 37 ° C-Wasserbad zusammen mit dem Mischen durch Invertieren des Röhrchens alle 2-3 Minuten inkubiert werden. 10% DMSO mit fetalem Rinderserum (FBS) können als Alternative zum Einfrieren von Medien zur Herstellung von gefrorenen PDO-Beständen verwendet werden. Aufgrund einer besseren PDO-Rückgewinnung wird jedoch ein handelsübliches Gefriermedium mit niedrigerem oder keinem Serum bevorzugt.
Einige Einschränkungen müssen in diesem Protokoll behoben werden. Da diese Methoden nur in EAC-PDOs getestet wurden, ist die Anwendung dieses Protokolls auf andere Arten von PDOs nicht klar. Obwohl Verfahren für die Weitergabe von PDOs mit und ohne Einzelzellverdauung für die meisten Organoidtypen21,22 standardisiert sind, besteht immer noch die Notwendigkeit, aktuelle Protokolle für andere Krebsarten zu versuchen, um die Reproduzierbarkeit zu gewährleisten. Darüber hinaus kann eine 10-minütige 0,25%ige Trypsinkubation die Zellen während der Verdauung belasten; Daher kann die Inkubationszeit je nach PDO-Bedingung vor der Subkultur und der individuellen PDO-Diversität variieren. Bei frühen Versuchen wird empfohlen, für jede EAC-PDO unterschiedliche Trypsinkubationszeiten festzulegen.
Zusammenfassend ist dies das erste Protokoll, das Subkultur und Kryokonservierung von EAC-PDOs mit und ohne Einzelzellverdauung beschreibt und diskutiert. Die Subkulturierung von EAC-PDOs mit Einzelzellverdauung eignet sich für Vergleichsexperimente zwischen Gruppen, während unverdaute EAC-PDOs für die histologische Charakterisierung, Kryokonservierung und schnelle Expansion von Vorteil sind. Hier ist die routinemäßige Wartung von EAC-PDOs standardisiert und bietet Forschern einen Leitfaden zur Auswahl geeigneter Methoden für die Generierung von EAC-Organoiden.
Offenlegungen
Die Autorinnen und Autoren erklären keine Interessenkonflikte an diesem Werk.
Danksagungen
Diese Arbeit wurde vom Köln Fortune Program/Medizinische Fakultät der Universität zu Köln unterstützt. Wir danken der technischen Unterstützung von Susanne Neiss, Michaela Heitmann und Anke Wienand-Dorweiler. Ningbo Fan wurde vom Guangzhou Elite Scholarship Council (GESC) finanziell unterstützt. Die Autoren danken Dr. Joshua D'Rozario für seine Unterstützung bei der linguistischen Bearbeitung.
Materialien
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| -20°C Freezer | Bosch | Economic | |
| -80°C Freezer | Panasonic | MDF DU500VH-PE | |
| Automated Cell counter | Thermo Fisher | AMQAX1000 | Countess II |
| Biological Safety Cabinet Class II | Thermo Scientific | 51022482 | Herasafe KS12 |
| Centrifuge | Heraeus | 75003060 | Megafuge 1.0R |
| CO2 Incubator | Thermo Scientific | 50116048 | Heracell 150i |
| Inverted automated fluorescence microscope | Olympus | IX83 | |
| Inverted light microscope | Leica | DMIL LED Fluo | |
| Pipette 1000 µL | Eppendorf | 3123000063 | Research Plus |
| Pipette 200 µL | Eppendorf | 3123000039 | Research Plus |
| Rotating Incubator | Scientific Industries, sc. | SI-1200 | Enviro-genie |
| Shaker | Eppendorf | 5355 000.011 | Thermomixer Comfort |
| Vacuum pump | Vacuubrand | 20727200 | BVC control |
| Waterbath | Medingen | p2725 | W22 |
| Material | |||
| 15 mL tube | Sarstedt | 62.554.502 | Inc Screw cap tube PP 15 mL |
| Cryo vial 2 mL | Sarstedt | 72.379 | CryoPure 2.0 mL tube |
| Low bind tube 1.5 mL | Sarstedt | 72.706.600 | Micro tube 1.5 mL protein LB |
| Low bind tube 5 mL | Eppendorf | 0030 108.302 | Protein LoBind Tube 5.0 mL |
| Pipette tip 200 µL | Starlab | E1011-8000 | 200 µL Graduated tip, wide orifice |
| Pipette tip 1000 µL | Starlab | E1011-9000 | 1000 µL Graduated tip, wide orifice |
| Pipette tip 1000 µL | Sarstedt | 70.3050 | Pipette tip 1000 µL |
| Sterile filter 0.2 µm | Sarstedt | 83.1826.001 | Filtropur 0.2 µm sterile filter |
| Tissue culture plate | Sarstedt | 83.3921 | 12 well-plate |
| Reagent/Chemical | |||
| A83-01 | Tocris | 2939 | |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634010 | |
| Amphotericin B | Thermo Fisher Scientific | 15290026 | |
| B-27 | Thermo Fisher Scientific | 17504001 | |
| Cell Recovery Solution | Corning | 354253 | |
| CHIR-99021 | MedChemExpress | HY-10182/CS-0181 | |
| DNase I grade II, from bovine pancreas | Sigma-Aldrich | 10104159001 | |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190094 | |
| Extracellular matrix (ECM) gel: Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 356231 | |
| FGF-10a | Peprotech | 100-26-100 | |
| Freezing medium: Recovery Cell Freezing Medium | Thermo Fisher Scientific | 12648010 | |
| Gastrin | Sigma | G9020 | |
| Gentamicin-25 (25 mg/ 500 µL) | PromoCell | C-36030 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15630080 | |
| L-Glutamine 200 mM (100X) | Thermo Fisher Scientific | 25030024 | |
| N-2 | Thermo Fisher Scientific | 17502-048 | |
| N-Acetylcysteine | Sigma | A9165 | |
| Nicotinamide | Sigma | N0636-100 | |
| Noggin | Peprotech | 120-10C-50 | |
| Penicillin-Streptomycin 10,000 U/ mL (100X) | Thermo Fisher Scientific | 15140122 | |
| Recombinant human epidermal growth factor (EGF) | Peprotech | AF-100-15 | |
| R-Spondin1 conditioned medium from Cultrex R-Spondin Cells | Biotechne | 3710-001-01 | |
| SB202190 | MedChemExpress | 152121-30-7 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma-Aldrich | 93620-1G | |
| Trypsin-EDTA (0.25 %), phenol red | Thermo Fisher Scientific | 25200056 | |
| Wnt-3A conditioned medium | Wnt-3A expressing cell line was kindly provided by Prof. Hans Clevers' group | ||
| Y-27632 | Sigma | Y0503 |
Referenzen
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Coleman, H. G., Xie, S. -. H., Lagergren, J. The epidemiology of esophageal adenocarcinoma. Gastroenterology. 154 (2), 390-405 (2018).
- Rumgay, H., et al. International trends in esophageal squamous cell carcinoma and adenocarcinoma incidence. The American Journal of Gastroenterology. 116 (5), 1072-1076 (2021).
- Qian, H., et al. Clinical characteristics, prognosis, and nomogram for esophageal cancer based on adenosquamous carcinoma: a seer database analysis. Frontiers in Oncology. 11, 603349 (2021).
- Lagergren, J., Smyth, E., Cunningham, D., Lagergren, P. Oesophageal cancer. Lancet. 390 (10110), 2383-2396 (2017).
- Rockett, J. C., Larkin, K., Darnton, S. J., Morris, A. G., Matthews, H. R. Five newly established oesophageal carcinoma cell lines: phenotypic and immunological characterization. British Journal of Cancer. 75 (2), 258-263 (1997).
- Hashimoto, N. Expression of COX2 and p53 in rat esophageal cancer induced by reflux of duodenal contents. ISRN Gastroenterology. 2012, 1-5 (2012).
- Quante, M., et al. Bile acid and inflammation activate gastric cardia stem cells in a mouse model of barrett-like metaplasia. Cancer Cell. 21 (1), 36-51 (2012).
- Kapoor, H., Lohani, K. R., Lee, T. H., Agrawal, D. K., Mittal, S. K. Animal models of Barrett's esophagus and esophageal adenocarcinoma-past, present, and future. Clinical and Translational Science. 8 (6), 841-847 (2015).
- Lan, T., Xue, X., Dunmall, L. C., Miao, J., Wang, Y. Patient-derived xenograft: a developing tool for screening biomarkers and potential therapeutic targets for human esophageal cancers. Aging. 13 (8), 12273-12293 (2021).
- Liu, D. S. H., et al. APR-246 potently inhibits tumour growth and overcomes chemoresistance in preclinical models of oesophageal adenocarcinoma. Gut. 64 (10), 1506-1516 (2015).
- Ebbing, E. A., et al. Esophageal adenocarcinoma cells and xenograft tumors exposed to Erb-b2 receptor tyrosine kinase 2 and 3 inhibitors activate transforming growth factor beta signaling, which induces epithelial to mesenchymal transition. Gastroenterology. 153 (1), 63-76 (2017).
- Simian, M., Bissell, M. J. Organoids: A historical perspective of thinking in three dimensions. The Journal of Cell Biology. 216 (1), 31-40 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Li, X., et al. Organoid cultures recapitulate esophageal adenocarcinoma heterogeneity providing a model for clonality studies and precision therapeutics. Nature Communications. 9, 2983 (2018).
- Ebbing, E. A., et al. Stromal-derived interleukin 6 drives epithelial-to-mesenchymal transition and therapy resistance in esophageal adenocarcinoma. Proceedings of the National Academy of Sciences of the United States of America. 116 (6), 2237-2242 (2019).
- Karakasheva, T. A., et al. Generation and characterization of patient-derived head and neck, oral, and esophageal cancer organoids. Current Protocols in Stem Cell Biology. 53 (1), 109 (2020).
- Ordóñez, N. G. Broad-spectrum immunohistochemical epithelial markers: a review. Human Pathology. 44 (7), 1195-1215 (2013).
- Maniar, K. P., Umpires, B. Cytokeratin 7 (CK7, K7). Pathology Outlines.com website. , (2021).
- Sun, X., Kaufman, P. D. Ki-67: more than a proliferation marker. Chromosoma. 127 (2), 175-186 (2018).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 3380-3409 (2020).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten