Method Article
תת-תרבות ושימור בהקפאה של אורגנואידים אדנוקרצינומה של הוושט: יתרונות וחסרונות לעיכול תאים בודדים
In This Article
Summary
פרוטוקול זה מתאר את השיטות של תת-תרבות ושימור בהקפאה של אורגנואידים אדנוקרצינומה של הוושט עם ובלי עיכול של תאים בודדים כדי לאפשר לחוקרים לבחור אסטרטגיות מתאימות על סמך התכנון הניסויי שלהם.
Abstract
היעדרם של מודלים מחקריים תרגומיים מתאימים המשקפים מחלה ראשונית כדי לחקור גידולים ואסטרטגיות טיפוליות הוא מכשול מרכזי באדנוקרצינומה של הוושט (EAC). אורגנואידים שמקורם בחולה (PDOs) התגלו לאחרונה כמודל פרה-קליני יוצא דופן במגוון סוגי סרטן. עם זאת, ישנם עדיין פרוטוקולים מוגבלים הזמינים לפיתוח מחשבי כף יד מסוג EAC. לאחר התבססות ה-PDOs, ההתפשטות וההקפאה החיוניות לניתוחים נוספים במורד הזרם. כאן, שתי שיטות שונות תוקנו עבור תת-תרבות של EAC PDOs ושימור בהקפאה, כלומר עם ובלי עיכול של תאים בודדים. שתי השיטות יכולות להשיג באופן אמין את כדאיות התא המתאימה והן ישימות עבור מערך ניסויי מגוון. המחקר הנוכחי הראה כי תת-תרבות של PDOs EAC עם עיכול של תאים בודדים מתאימה לרוב הניסויים הדורשים בקרת מספר תאים, צפיפות אחידה ומבנה חלול המאפשר מעקב אחר גודל. עם זאת, השיטה המבוססת על תאים בודדים מראה צמיחה איטית יותר בתרבית, כמו גם לאחר גידול מחדש ממלאי קפוא. חוץ מזה, תת-תרבות עם עיכול של תאים בודדים מאופיינת ביצירת מבנים חלולים עם ליבה חלולה. לעומת זאת, עיבוד PDOs EAC ללא עיכול של תאים בודדים הוא חיובי עבור שימור בהקפאה, הרחבה ואפיון היסטולוגי. בפרוטוקול זה מתוארים היתרונות והחסרונות של תת-תרבות ושימור בהקפאה של PDOs EAC עם ובלי עיכול של תאים בודדים כדי לאפשר לחוקרים לבחור שיטה מתאימה לעיבוד וחקירה של האורגנואידים שלהם.
Introduction
סרטן הוושט (EC) הוא הגורם העשירי בשכיחותו והשישי המוביל למוות מסרטן ברחבי העולם1. אדנוקרצינומה של הוושט (EAC) היא אחד מתתי-הסוגים ההיסטולוגיים העיקריים של EC ומתרחשת בעיקר במדינות המערב2. בעשור האחרון, שכיחות ה- EAC עלתה באופן משמעותי במדינות מפותחות רבות, כולל גרמניה3. בשל האגרסיביות של הסרטן וחוסר הסימפטומים בשלב המוקדם של התפתחות הגידול, הפרוגנוזה הכוללת בחולי EAC גרועה, ומראה שיעור הישרדות של 5 שנים של כ -20%2,4,5.
מאז סוף המאה העשרים הוקמו מספר מודלים למחקר הביו-רפואי של EAC. קווי תאי ה-EAC האנושיים הקלאסיים שהוקמו בשנות ה-90 שלהמאה ה-20, מרחיבים את הידע שלנו על ביולוגיה של גידולי EAC, גנטיקה של גידולים כמו גם אסטרטגיות נגד גידולים, ומשמשים בדרך כלל במחקר EAC. חוץ מזה, כמה קבוצות מחקר פיתחו בהצלחה מודלים של בעלי חיים של EAC או הוושט של בארט על ידי חשיפת בעלי החיים לגורמי סיכון ידועים כגון ריפלוקס גסטרו-וושט באמצעות גישות כירורגיות או דלקתיות 7,8,9. בנוסף, מודלים של xenograft (PDX) שמקורם בחולה, אשר משרים רקמות סרטן ראשוניות של EAC באופן תת עורי או אורתוטופי בעכברים אימונודיים, פותחו כדי לדמות התנהגות ביולוגית של גידול EAC אנושי וסביבת הגידול 10,11,12. עם זאת, למרות שהמודלים הללו משפרים את היישומים הקליניים ואת ההבנה שלנו את המנגנונים המולקולריים שמאחורי גידולי EAC והתקדמותם, עדיין קיים אתגר גדול להמחשת תוצאות ממודלים מחקריים אלה לבני אדם.
אורגנואידים של גידול שמקורם בחולה (PDOs) גדלים במערכת תרביות תלת-ממדית המחקה התפתחות אנושית והתחדשות איברים במבחנה. ה-PDOs, שנוצרו מהרקמה הראשונית של המטופלים, משחזרים את המאפיינים המולקולריים והפנוטיפיים של הגידול האנושי והראו יישומים מבטיחים בפיתוח תרופות ובטיפול מותאם אישית בסרטן13,14. על ידי השוואת עשרה מקרים של PDOs EAC עם רקמת הגידול הזוגית שלהם, מדווחים כי EAC PDOs חולקים תכונות היסטופתולוגיות דומות ונוף גנומי עם הגידול הראשוני, שומרים על הטרוגניות תוך גידולית ומאפשרים סינון תרופות יעיל במבחנה15. EAC PDOs שימשו גם בחקר האינטראקציה של תאי גידול EAC עם פיברובלסטים הקשורים לסרטן שמקורם בחולה (CAFs), מה שמצביע על יישום רב עוצמה בתחום המחקר של מיקרו-סביבה של הגידול16. למרבה הצער, היו פרוטוקולים מוגבלים זמינים לפיתוח והפצה של מחשבי כף יד של EAC. כאן מתוארות שתי שיטות שונות לתת-תרבות ולשימור של מחשבי כף יד מסוג EAC בפירוט: עם ובלי עיכול של תאים בודדים. השיטות הסטנדרטיות לתחזוקה של מחשבי כף יד מסוג EAC ויישומיהם יכולות לתמוך בחוקרים לבחור שיטות מתאימות למטרות שונות במחקר ה-EAC PDO שלהם.
Protocol
תרבות PDO מבוססת וצומחת היטב מייצגת את הבסיס לתת-תרבות מוצלחת ולשימור בהקפאה המתוארים בפרוטוקול זה. כאן, מחשבי כף יד של EAC נוצרו מרקמת הגידול העיקרית של חולי EAC באמצעות הפרוטוקול שתואר על ידי Karakasheva T. A. et al17. רקמות EAC נאספו מביובנק באישור BioMaSOTA (אושר על ידי ועדת האתיקה של אוניברסיטת קלן, ID: 13-091).
הערה: מחשבי כף יד של EAC עברו תרבית באינקובטור לח בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 באמצעות מדיום תרבית PDO (טבלה 1). בשלבים הבאים מתוארות בפירוט שתי שיטות של תת-התרבות. צלחת של 12 בארות מומלצת לתת-תרבות של ה-PDOs עם צפיפות זריעה של שלוש כיפות ג'ל מטריצה חוץ-תאית (ECM) לכל באר, מכיוון שהיא מאפשרת שימוש גמיש בכל באר וכמות מתאימה של PDOs למטרות שונות. טכניקה אספטית היא חובה בעת הטיפול ב- PDOs.
1. הכנות מראש
- מחממים מראש צלחת של 12 בארות על ידי הכנסתה לחממת CO2 של 37 מעלות צלזיוס לילה לפני תת-התרבות כדי להבטיח חימום מלא של הצלחת. אם זמין, השתמש בבארות ריקות מצלחת עם תרבות ה- PDO הנוכחית.
הערה: אחסון רציף של 1-2 צלחות טריות בטמפרטורה של 37 מעלות צלזיוס מומלץ לתכנון גמיש של תת-תרבות. - קצוות קירור מראש של 1,000 μL ו- 200 μL עם פתח רחב בטמפרטורה של -20 °C (מומלץ אחסון רציף). צנטריפוגה טרום-מגניבה ב-4 מעלות צלזיוס.
- הגדר את הטמפרטורה של החממה המסתובבת ל -37 °C (אם מתבצע עיכול של תאים בודדים).
- דגירה בנפח מתאים של ג'ל ECM למשך שעה אחת על קרח לנזילה. הניחו את תמיסת שחזור התאים על הקרח.
2. קצירת אורגנואידים
- הסר את הצלחת עם PDOs גדלים מחממת CO2.
- לשאוף למדיום ישן באמצעות משאבת ואקום.
הערה: הימנע מלגעת בכיפות. - הוסיפו נפח מתאים של תמיסת שחזור תאים קרים כקרח (500 μL/dome) לתוך הבאר.
- פירקו את ג'ל ה-ECM על ידי צנרת למעלה ולמטה מספר פעמים כדי לפצל כיפות ג'ל ECM לחתיכות קטנות באמצעות קצוות של 1,000 μL עם פתח רחב.
- שלבו את התערובת של PDO, ג'ל ECM ותמיסת שחזור תאים משתי בארות לכל היותר (שש כיפות) והעבירו אותה לצינור 5 מ"ל בעל קשירה נמוכה (השתמשו בצינור שני למקרה שבו בארות נוספות ישמשו לתת-תרבות).
הערה: לחלופין, אם ג'ל ECM לא היה מומס לחלוטין, הוסף תמיסת שחזור תאים נוספת של 1.5 מ"ל לתערובת של PDO, ג'ל ECM ותמיסת שחזור תאים. - דגירה של הצינור המכיל את התערובת בשלב 2.5 על קרח למשך 20 דקות, ערבבו כל 5 דקות על ידי היפוך הצינור חמש פעמים כדי להבטיח את ההנזלה של ג'ל ECM.
- צנטריפוגה ב 500 x g במשך 4 דקות ב 4° צלזיוס.
- אם יש גלולה גלויה ויציבה לאחר צנטריפוגה, המשך עם שלב 2.10. אחרת, המשך עם שלב 2.9.
- אם אין גלולה נראית לעין ונראה שה-PDOs עדיין תקועים בפאזת ג'ל, הסר בזהירות את הסופרנטנט באמצעות משאבת ואקום עד שתגיע לשלב המכיל ECM gel-PDO-Solution והוסף 3 מ"ל של תמיסת התאוששות תאים קרים כקרח.
- הפוך את הצינור כמה פעמים ודגרר על קרח עוד 10 דקות. מערבבים על ידי היפוך הצינור מעת לעת.
- צנטריפוגה ב 500 x g במשך 4 דקות ב 4 ° C ולהמשיך עם שלב 2.10.
- יש להשליך את ה-supernatant בזהירות באמצעות משאבת ואקום או פיפטה של 1,000 μL. נסה להסיר את supernatant ככל האפשר.
הערה: בשל משטח הקשירה הנמוך של הצינור, הכדור לא יהיה יציב כרגיל. - אחסנו את גלולת ה-PDO על קרח והמשיכו עם שלב 3 (ללא עיכול) או שלב 4 (עם עיכול של תאים בודדים) בהתאם למטרות השונות.
3. תת-תרבות ללא עיכול
הערה: שיטה זו נועדה להגדיל את הגודל והצפיפות של ה-PDOs. הגודל הגדול יותר והצפיפות הגבוהה יותר מאפשרים את תהליך ההטבעה, האפיון ההיסטולוגי והרחבת ה-PDO. בהתאם ליחסי הפיצול של PDO (בהתבסס על צפיפות ה-PDOs, מומלץ יחס בין 1:3 ל-1:6), יש לבצע החייאה של הכדור משלב 2.8 בנפח מתאים של ג'ל ECM נוזלי.
- הסר קצוות מקוררים מראש של 200 μL ו- 1,000 μL עם פתח רחב מהמקפיא בטמפרטורה של -20 מעלות צלזיוס והנח אותם על ספסל נקי.
- בצעו החייאה של הכדור משלב 2.11 בג'ל ECM באמצעות קצוות מקוררים מראש של 1,000 μL. יש לערבב על ידי צנרת למעלה ולמטה כ-10 פעמים כדי לוודא ש-PDOs אינם מגושמים ומופצים באופן שווה בג'ל ECM.
הערה: השתמש בג'ל /כיפה ECM 50 μL. חשבו תמיד עבור כיפה אחת יותר מהנדרש (למשל, עבור תשע כיפות (כלומר, שלוש בארות), בצעו החייאה של הכדור ב-500 μL של ג'ל ECM נוזלי (450 + 50 μL נוסף). נסו להימנע מייצור בועות במהלך החייאה! - מוציאים את צלחת 12 הקידוחים שחוממה מראש מהאינקובטור ממש לפני זריעת הכיפות.
- כיפות זרעים המכילות ג'ל ECM 50 μL לתוך הצלחת החמה (שלוש כיפות / באר). הימנעו מצנרת בועות לכיפות הג'ל של ECM.
- החזירו את הצלחת לחממה של 37 מעלות צלזיוס ו-5% CO2למשך 20-30 דקות כדי לחזק את הג'ל ECM.
- הוסיפו את מדיום ה-PDO המחומם מראש (טבלה 1) בזהירות מבלי להפריע לכיפות.
- תרבית את ה-PDOs במשך 7-14 יום עד להתרחשות הצפיפות והמורפולוגיה הנדרשות.
4. תת-תרבות עם עיכול של תאים בודדים
הערה: השלבים הבאים נועדו להגדיל את מספר ה- PDOs לכל כיפה. עיכול התא הבודד מאפשר שליטה במספרי התאים והרחבת ה-PDO.
- הכינו את מדיום העיכול על ידי ערבוב של 2 מ"ל של 0.25% טריפסין-EDTA ו-20 μL DNase I (לעיכול של שלוש כיפות).
- בצעו מחדש את הכדור משלב 2.11 עם נפח מתאים של 0.25% טריפסין-EDTA + DNase I שחומם מראש וערבבו אותו כ-10 פעמים על ידי צנרת למעלה ולמטה באמצעות פיפטה של 1,000 μL (השתמשו בטיפים רגילים של 1,000 μL).
- אינקובציה למשך 10 דקות ב-37 מעלות צלזיוס באינקובטור מסתובב עם מהירות סיבוב של מינימום 28 סל"ד.
- הכינו צינור 15 מ"ל המכיל 6 מ"ל של תמיסת מעכב טריפסין סויה (STI, טבלה 2) (לכל 2 מ"ל של 0.25% טריפסין-EDTA).
- לאחר העיכול, ערבבו היטב את ה-PDOs המעוכלים כמה פעמים עם פיפטה של 1,000 μL כדי לשבש את ה-PDOs.
- העבר את ה-PDOs המעוכלים לצינור 15 מ"ל המכיל תמיסת STI כדי לעצור את תהליך העיכול.
- צנטריפוגה ב 500 x g במשך 4 דקות ב 4 ° C. יש להשליך את ה-supernatant בזהירות באמצעות משאבת ואקום או פיפטה של 1,000 μL. בצעו החייאה של הכדור ב-1 מ"ל של תווך בסיסי (טבלה 3).
- קבעו את ריכוז התאים ואת יכולת הכדאיות שלהם באמצעות מונה תאים אוטומטי או המוסיטומטר.
- זרעים עיכלו PDO לתוך צלחת של 12 בארות עם 2 x 104 תאים לכל כיפה.
- חשב את מספר התא על פי הכיפות המתוכננות לזריעה והעביר אותן לצינור טרי של 1.5 מ"ל עם קשירה נמוכה.
הערה: חשב עבור כיפה אחת יותר (+ 2 x 104 תאים נוספים). לדוגמה, עבור זריעת שלוש כיפות לבאר אחת, קח 8 x 104 (2 x 104 * 3 + 2 x 104 תאים נוספים). - צנטריפוגה ב 500 x g במשך 4 דקות ב 4 ° C.
- במקרה שאין גלולה נראית לעין, זכור את כיוון הצינור בתוך הצנטריפוגה כדי לדעת היכן נמצא הכדור.
- יש להשליך בזהירות את ה-supernatant באמצעות פיפטה של 1,000 μL. מוציאים את ה-supernatant ככל האפשר מבלי להפריע לכדור.
- הוסיפו נפח מתאים של ג'ל ECM לכדור באמצעות פיפטה של 1,000 μL עם קצה פתח ברוחב 1,000 μL מקורר מראש (50 μL/כיפה + תוספת של 50 μL).
- בצע את השלבים 3.3-3.7.
- חשב את מספר התא על פי הכיפות המתוכננות לזריעה והעביר אותן לצינור טרי של 1.5 מ"ל עם קשירה נמוכה.
5. שימור בהקפאה של ה-PDOs המעוכלים והלא מעוכלים
הערה: מחשבי כף יד מעוכלים ולא מעוכלים של תא יחיד מתאימים להכנת מלאי גיבוי קפוא. שים לב ש-PDOs שטופחו מחדש מהמלאי הקפוא של התא הבודד דורשים זמן רב יותר כדי להתאושש ולהגיע לגודל מסוים.
- שימור בהקפאה של ה-PDOs הלא מעוכלים.
- התחל תהליך שימור בהקפאה עם הכדור משלב 2.8. השתמשו ב-500 μL של מדיום הקפאה קר כדי להחיות את הכדור ולהעביר אותו לבקבוקון קריוגני.
הערה: אחסן שתי כיפות לכל בקבוקון. - הקפיאו את ה-PDOs למשך הלילה במקפיא של -80 מעלות צלזיוס באמצעות מיכל הקפאת תאים מתאים.
- התחל תהליך שימור בהקפאה עם הכדור משלב 2.8. השתמשו ב-500 μL של מדיום הקפאה קר כדי להחיות את הכדור ולהעביר אותו לבקבוקון קריוגני.
- שימור בהקפאה של ה-PDOs המעוכלים של התא הבודד
- לאחר קצירה ועיכול של PDOs, התחילו בשמירת ההקפאה מהשלב 4.8.
- לאחסון בקבוקון קריוגני אחד, העבירו 4-5 x 105 תאים לתוך צינור טרי של 1.5 מ"ל עם קשירה נמוכה.
הערה: אחסן שלוש כיפות / בקבוקון. - צנטריפוגה ב 500 x g במשך 4 דקות ב 4 ° C. השליכו את הסופרנאטנט בזהירות באמצעות פיפטה של 1,000 μL. מוציאים את ה-supernatant ככל האפשר מבלי להפריע לכדור.
- יש לבצע החייאה של הכדור בנפח מתאים של מדיום הקפאה (500 μL/בקבוקון) ולהעביר אותו לבקבוקון קריוגני.
- הקפיאו את ה-PDOs למשך הלילה במקפיא של -80 מעלות צלזיוס באמצעות מיכל הקפאת תאים מתאים והעבירו אותם למקפיא של -150 מעלות צלזיוס או לחנקן נוזלי לאחסון לטווח ארוך.
תוצאות
פרוטוקול זה מציג את ההליכים הכוללים תת-תרבות ושימור בהקפאה של PDOs EAC עם וללא עיכול של תאים בודדים.
איור 1 מציג תמונות מייצגות של ניגודיות פאזה של שתי אסטרטגיות תת-תרבות שונות. ה-EAC PDOs הגיעו לצפיפות המתאימה לתת-תרבות (איור 1, משמאל). תת-תרבות ללא עיכול של תאים בודדים לוקחת פחות זמן להגיע לצפיפות דומה ומובילה בעיקר למבנים קומפקטיים (איור 1, שורה עליונה). לעומת זאת, ה-PDOs המעוכלים של תא יחיד מראים מבנים חלולים עם ליבה חלולה (איור 1, שורה תחתונה). איור 2 מראה את צביעת ההמטוקסילין-אוזין (H&E) ואת הכתם האימונוהיסטוכימיה (IHC) של מחשבי כף יד מסוג EAC משובצי פרפין עם מבנים קומפקטיים וחלולים. הפאן-ציטוקראטין (Pan-CK) מאפשר זיהוי של תאי גידול אפיתל18. הציטוקראטין 7 (CK7) מדגיש את תאי הגידול המובחנים הבלוטיים19. המבנה הקומפקטי (שורה עליונה) קיים בעיקר בתרבית הלא מעוכלת, ואילו המבנה החלול (השורה התחתונה) דומיננטי בתרבית שעברה עיכול של תא בודד.
איור 3 מראה את הכתם האימונופלואורסצנטי (IHC) של רקמת EAC ו-PDOs מזווגים עם מבנה קומפקטי ומבנה חלול. ה-Ki67 מדגיש את אוכלוסיות התאים עם התפשטות תאית גבוהה יותר20. ה-Ki67 (אדום) וה-Pan-CK (ירוק) התפלגו באופן דומה בין הרקמה הראשונית של EAC, המבנה הקומפקטי EAC PDO והמבנה החלול של EAC PDO. איור 4 מראה את המאפיינים המורפולוגיים של מחשבי כף יד מסוג EAC ביום הראשון להחלמה ממלאי קפוא עם שימור בהקפאה על בסיס תא יחיד (משמאל) ובשימור בהקפאה מבוססת PDO לא מעוכלת (מימין).
איור 5 מסכם תרשים זרימה של תהליך תת-התרבות של PDOs EAC עם ובלי עיכול של תאים בודדים. בקצרה, EAC PDO גדל היטב מוכן לעבור. ה-PDOs של EAC נקטפו ונפלטו. עבור עיכול של תאים בודדים, PDOs עוכלו באופן אנזימטי במשך 5-10 דקות כדי לקבל תאים בודדים, אשר היו צפויים לגדול למבנים חלולים המאפשרים ניסויים הדורשים שליטה במספרי תאים, צפיפות אחידה ומעקב אחר גודל. עבור תת-תרבות לא מעוכלת, PDOs פוצלו כדי להשיג מרחב גדל יותר מבלי לשבש באופן אנזימטי, אשר היו צפויים לגדול למבנים קומפקטיים המאפשרים ניתוחים היסטולוגיים, התרחבות מהירה והתאוששות מהירה יותר משמירה על ההקפאה.
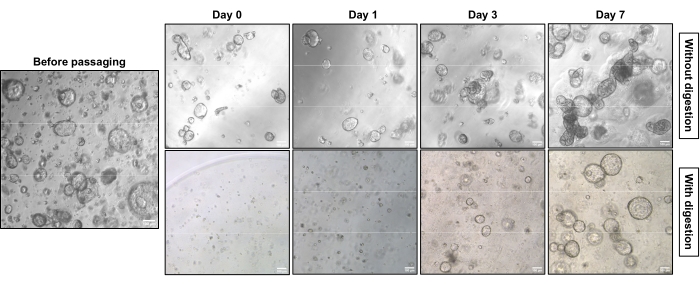
איור 1: מאפיינים מורפולוגיים של תת-תרבות ה-EAC PDOs עם ובלי עיכול של תאים בודדים תחת מיקרוסקופ של ניגודיות פאזה. מחשבי כף יד מסוג EAC גדלים לצפיפות מסוימת לפני תת-התרבות (משמאל). עם תת-תרבות של מחשבי כף יד מסוג EAC ללא עיכול של תאים בודדים, PDOs גדלים בהדרגה ממבנים חלולים למבנים קומפקטיים (ימין, שורה עליונה), בעוד ש-PDOs הגדלים מתאים בודדים מראים בעיקר מבנים חלולים (ימין, שורה תחתונה). התמונות צולמו במיקרוסקופ אור הפוך באמצעות מטרה פי 5. סרגל קנה מידה: 100 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
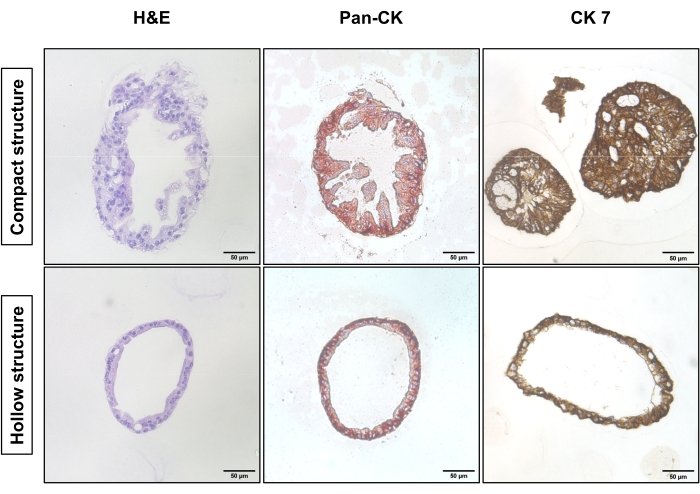
איור 2: מאפיינים היסטולוגיים של המבנה הקומפקטי והמבנה החלול של EAC PDOs. צביעת H&E (משמאל), צביעת Pan-CK (באמצע) וצביעת CK7 (מימין) של המבנה הקומפקטי (שורה עליונה) ומבנה חלול (שורה תחתונה). התמונות צולמו במיקרוסקופ אור הפוך באמצעות מטרה של פי 20. סרגל קנה מידה: 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: צביעה אימונוהיסטו-כימית של רקמת EAC ו-PDOs מזווגים. צביעת אימונופלואורסצנציה (IF) של רקמת EAC מזווגת (שורה עליונה), מבנה קומפקטי (שורה אמצעית) ומבנה חלול (שורה תחתונה) עם Pan-CK (ירוק), Ki67 (אדום) ו-DAPI (כחול). התמונות צולמו עם מיקרוסקופ פלואורסצנטי אוטומטי הפוך באמצעות מטרה של פי 20. סרגל קנה מידה: 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: מאפיינים מורפולוגיים של מחשבי כף יד מסוג EAC ביום הראשון להתאוששות ממלאי קפוא. תמונות של ניגודיות פאזה של רה-טיבציה מהקפאה מבוססת-תאים בודדים (משמאל) ומשמירת הקפאה מבוססת PDO לא מעוכלת (מימין) ביום הראשון להחלמה. התמונות צולמו במיקרוסקופ אור הפוך באמצעות מטרה פי 5. סרגל קנה מידה: 100 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: תרשים הזרימה של תהליך תת-התרבות של מחשבי כף יד מסוג EAC עם ובלי עיכול של תאים בודדים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| מניות | ריכוז סופי | 50 מ"ל | |||
| מדיום בסיסי (ראו טבלה 3) | 24 מ"ל | ||||
| Wnt-3A בינוני מותנה | 12 מ"ל | ||||
| R-Spondin1 בינוני מותנה מתאי Cultrex R-Spondin | 12 מ"ל | ||||
| N-2 | 100x | 1x | 500 μL | ||
| ב-27 | פי 50 | 1x | 1 מ"ל | ||
| N-אצטילציסטאין | 0.5 מ' | 1 מ"מ | 100 μL | ||
| CHIR-99021 | 5 מ"מ | 0.5 מיקרומטר | 5 מיקרול | ||
| גורם גדילה אפידרמלי אנושי רקומביננטי (EGF) | 100 מיקרוגרם/מ"ל | 250 ננוגרם/מ"ל | 125 μL | ||
| A83-01 | 25 mM | 0.5 מיקרומטר | 1 μL | ||
| SB202190 | 10 mM | 1 מיקרומטר | 5 מיקרול | ||
| גסטרין | 100 מיקרומטר | 0.1 מיקרומטר | 50 מיקרול | ||
| ניקוטינמיד | 1 מ' | 20 מיקרומטר | 1 מ"ל | ||
| גנטמיצין | 50 מ"ג/מ"ל | 10 מיקרומטר | 5 מיקרול | ||
| פניצילין/סטרפטומיצין | 100x | 1x | 500 μL | ||
| אמפוטריצין ב' | 250 מיקרוגרם/מ"ל | 0.60% | 300 μL | ||
| הוסף טרי לבאר: | |||||
| נוג'ין | 100 מיקרוגרם/מ"ל | 50 מיקרול | |||
| Y-27632 | 10.5 מ"מ | 50 מיקרול | |||
| יש להוסיף בעת יצירת PDOs חדשים מרקמה ראשונית או התאוששות ממלאי קפוא | |||||
| FGF-10a | 100 מיקרוגרם/מ"ל | 100 ננוגרם/מ"ל | 50 מיקרול | ||
טבלה 1: הכנת מדיום תרבות EAC PDO.
| מעכב טריפסין סויה (STI) | 12.5 מ"ג |
| התאם ל- 50 מ"ל עם DPBS | |
| סינון דרך מסנן סטרילי 0.2 מיקרומטר |
טבלה 2: הכנת תמיסת מעכב טריפסין סויה (STI).
| מגיב | נפח | ריכוז סופי |
| DMEM/F-12 מתקדם | 48.2 מ"ל | |
| HEPES (1 M) | 500 μL | 10 mM |
| L-גלוטמין (100X) | 500 μL | פי 1 |
| פניצילין-סטרפטומיצין (100X) | 500 μL | פי 1 |
| אמפוטריצין ב' | 300 μL | 0.60% |
| גנטמיצין (50 מ"ג/מ"ל) | 5 מיקרול | 5 מיקרוגרם/מ"ל |
טבלה 3: הכנת מדיום בסיסי.
| עיכול תא בודד | |
| מקצוענים | האסירים |
| בקרת מספר תא | שביר במהלך ההטבעה |
| בדיקת כדאיות | דרוש זמן ארוך יותר בין המעברים |
| ישים למשל, בדיקת סמים, ציטומטריה של זרימה | זמן התאוששות ארוך יותר ממלאי קפוא |
| ללא עיכול של תא בודד | |
| מקצוענים | האסירים |
| מורפולוגיה מועילה לניתוחים היסטולוגיים | הרחבת ה-PDOs בגודל גדול יותר מאשר במספר |
| יציבות גבוהה יותר בתהליך ההטבעה | לא ישים לניתוחים שבהם מתלה של תא יחיד הוא חובה |
| התאוששות מהירה ממלאי קפוא | היעדר שליטה במספרי תאים ומעקב אחר גודל |
טבלה 4: יתרונות וחסרונות עבור תת-תרבות של PDOs EAC עם ובלי עיכול של תאים בודדים.
Discussion
בפרוטוקול זה מתוארות שתי תת-תרבויות שונות ושיטות שימור בהקפאה של PDOs EAC, כלומר, עם ובלי עיכול של תאים בודדים. מספר מחקרים המליצו על העברת PADO EAC עם עיכול של תאים בודדים15,17, מה שמועיל לרוב הניסויים הדורשים שליטה במספר התאים, צפיפות אחידה ומבנה חלול המאפשר מעקב אחר גודל. עם זאת, השיטה המבוססת על תא יחיד מאופיינת בצמיחה איטית יותר לאחר התאוששות ממלאי קפוא ומורפולוגיה פחות קומפקטית בתקופת התרבית. הניסיון מצביע על 2-3 שבועות עד שהתרבות מבוססת תאים בודדים תגיע לצפיפות המתאימה לתהליך תת-התרבות. לעומת זאת, מחשבי כף יד קפואים של EAC ללא עיכול של תאים בודדים יכולים להגיע לאותו גודל בתקופה קצרה יותר (כשבוע) לאחר ההשבה. סיבה אחת יכולה להיות הלחץ הנוסף מעיכול הטריפסין במשך זמן רב יחסית (10 דקות). לכן, מומלץ לשמר PDOs EAC לא מעוכלים ביחס של 1:1.5 (הקפאת שתי כיפות של מחשבי כף יד של EAC לא מעוכלים וזריעה חזרה לשלוש כיפות לצורך ההשבה). בנוסף, מומלץ להשתמש ב-EAC PDOs לא מעוכלים להרחבה מהירה ואפיון היסטולוגי על ידי IHC או צביעת IF בשל המבנה הקומפקטי. היתרונות והחסרונות של שתי שיטות תת-התרבות מסוכמים בטבלה 4.
מספר שלבים קריטיים דורשים תשומת לב בפרוטוקול זה. ראשית, יש לחמם מראש את הצלחות לתרבית PDO במהלך הלילה באינקובטור של 37 מעלות צלזיוס כדי להבטיח את תהליך ההתמצקות של כיפות ג'ל ECM שנזרעו זה עתה. מומלץ להשתמש בצלחת חמה לשמירה על הצלחת בטמפרטורה של 37 מעלות צלזיוס תוך התמודדות עם משך זריעה ממושך. שנית, צינורות קשירה נמוכים נדרשים במהלך תהליך תת-התרבות כדי למנוע אובדן PDO משמעותי. כדי למנוע אובדן ג'ל ECM, ניתן לקרר מראש טיפים עם פתח בור רחב במקפיא של -20 מעלות צלזיוס לפני השימוש. כאן, הפתיחה הרחבה של הטיפים מונעת את הנזק של מבני PDO במהלך שלב הקציר. לאחר מכן, מומלץ לאגור PDOs במשך 20 דקות על קרח לפני שלב הצנטריפוגה הראשון, כדי להבטיח נזילות מלאה של ג'ל ECM. שים לב שיש להגדיר את הצנטריפוגה ב-4 °C (4 °F) במהלך שלבי הצנטריפוגה כדי לשמור על שאריות ג'ל ECM במצב נוזלי. בנוסף, עבור השיטה החד-תאית, מומלץ לערבב ביסודיות את ה-PDOs לאחר הדגירה של טריפסין באמצעות קצה רגיל של 1,000 μL כדי לשבור את גושי התאים לפני הוספת ה-STI, במקום לסנן ישירות את תרחיף התא עם מסנני התאים, כדי למנוע אובדן תאים.
כמה שינויים ניתן לבצע בפרוטוקול זה. ניתן להחליף את תמיסת שחזור התאים ב-DPBS קר כקרח להמסת ג'ל ה-ECM בשלב הקטיף. עם זאת, החוויות הראו יכולת טובה יותר להמיס את ג'ל ה-ECM באמצעות תמיסת שחזור התאים. לכן, DPBS קר כקרח מומלץ למדי רק כשיטת גיבוי חלופית. אם המעבדה אינה מצוידת באינקובטור מסתובב, ניתן לדגום PDOs של EAC עם טריפסין באמבט מים של 37 מעלות צלזיוס יחד עם ערבוב על ידי היפוך הצינור כל 2-3 דקות. 10% DMSO עם סרום בקר עוברי (FBS) יכול לשמש כחלופה למדיום הקפאה להכנת מלאי PDO קפוא. עם זאת, מדיום הקפאה מסחרי עם סרום נמוך יותר או ללא סרום עדיף בשל התאוששות PDO טובה יותר.
יש להתייחס למגבלות מסוימות בפרוטוקול זה. מכיוון ששיטות אלה נבדקו רק ב- EAC PDOs, היישום של פרוטוקול זה על סוגים אחרים של PDOs אינו ברור. למרות שנהלים להעברת PDOs עם ובלי עיכול של תאים בודדים מתוקננים עבור רוב סוגי האורגנואידים 21,22, עדיין יש צורך לנסות את הפרוטוקולים הנוכחיים על סוגי סרטן אחרים כדי להבטיח יכולת שכפול. בנוסף, 10 דקות 0.25% טריפסין הדגירה עלולה להלחיץ את התאים במהלך העיכול; לכן, זמן הדגירה עשוי להשתנות בהתאם למצב ה-PDO שלפני תת-התרבות ולמגוון ה-PDO האינדיבידואלי. במהלך ניסיונות מוקדמים, מוצע לקבוע זמני דגירה שונים של טריפסין עבור כל EAC PDO.
לסיכום, זהו הפרוטוקול הראשון המתאר ודן בתת-תרבות ובשימור בהקפאה של PDOs EAC עם וללא עיכול של תאים בודדים. תת-תרבות של EAC PDOs עם עיכול של תאים בודדים ישימה לניסויים בהשוואה בין קבוצות, בעוד ש-EAC PDOs לא מעוכלים מועילים לאפיון היסטולוגי, שימור בהקפאה והרחבה מהירה. כאן, התחזוקה השוטפת של PDOs EAC מתוקננת, ומספקת מדריך לחוקרים לבחור שיטות מתאימות לייצור אורגנואידים של EAC.
Disclosures
המחברים מצהירים על היעדר ניגודי עניינים ביצירה זו.
Acknowledgements
עבודה זו נתמכה על ידי תוכנית קלן פורצ'ן / הפקולטה לרפואה, אוניברסיטת קלן. אנו מודים על הסיוע הטכני של סוזן נייס, מיכאלה הייטמן ואנקה ויננד-דורוויילר. נינגבו פאן נתמך כספית על ידי מועצת מלגות העילית של גואנגג'ואו (GESC). המחברים מודים לד"ר יהושע ד'רוזאריו על עזרתו בעריכה לשונית.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| -20°C Freezer | Bosch | Economic | |
| -80°C Freezer | Panasonic | MDF DU500VH-PE | |
| Automated Cell counter | Thermo Fisher | AMQAX1000 | Countess II |
| Biological Safety Cabinet Class II | Thermo Scientific | 51022482 | Herasafe KS12 |
| Centrifuge | Heraeus | 75003060 | Megafuge 1.0R |
| CO2 Incubator | Thermo Scientific | 50116048 | Heracell 150i |
| Inverted automated fluorescence microscope | Olympus | IX83 | |
| Inverted light microscope | Leica | DMIL LED Fluo | |
| Pipette 1000 µL | Eppendorf | 3123000063 | Research Plus |
| Pipette 200 µL | Eppendorf | 3123000039 | Research Plus |
| Rotating Incubator | Scientific Industries, sc. | SI-1200 | Enviro-genie |
| Shaker | Eppendorf | 5355 000.011 | Thermomixer Comfort |
| Vacuum pump | Vacuubrand | 20727200 | BVC control |
| Waterbath | Medingen | p2725 | W22 |
| Material | |||
| 15 mL tube | Sarstedt | 62.554.502 | Inc Screw cap tube PP 15 mL |
| Cryo vial 2 mL | Sarstedt | 72.379 | CryoPure 2.0 mL tube |
| Low bind tube 1.5 mL | Sarstedt | 72.706.600 | Micro tube 1.5 mL protein LB |
| Low bind tube 5 mL | Eppendorf | 0030 108.302 | Protein LoBind Tube 5.0 mL |
| Pipette tip 200 µL | Starlab | E1011-8000 | 200 µL Graduated tip, wide orifice |
| Pipette tip 1000 µL | Starlab | E1011-9000 | 1000 µL Graduated tip, wide orifice |
| Pipette tip 1000 µL | Sarstedt | 70.3050 | Pipette tip 1000 µL |
| Sterile filter 0.2 µm | Sarstedt | 83.1826.001 | Filtropur 0.2 µm sterile filter |
| Tissue culture plate | Sarstedt | 83.3921 | 12 well-plate |
| Reagent/Chemical | |||
| A83-01 | Tocris | 2939 | |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634010 | |
| Amphotericin B | Thermo Fisher Scientific | 15290026 | |
| B-27 | Thermo Fisher Scientific | 17504001 | |
| Cell Recovery Solution | Corning | 354253 | |
| CHIR-99021 | MedChemExpress | HY-10182/CS-0181 | |
| DNase I grade II, from bovine pancreas | Sigma-Aldrich | 10104159001 | |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190094 | |
| Extracellular matrix (ECM) gel: Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 356231 | |
| FGF-10a | Peprotech | 100-26-100 | |
| Freezing medium: Recovery Cell Freezing Medium | Thermo Fisher Scientific | 12648010 | |
| Gastrin | Sigma | G9020 | |
| Gentamicin-25 (25 mg/ 500 µL) | PromoCell | C-36030 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15630080 | |
| L-Glutamine 200 mM (100X) | Thermo Fisher Scientific | 25030024 | |
| N-2 | Thermo Fisher Scientific | 17502-048 | |
| N-Acetylcysteine | Sigma | A9165 | |
| Nicotinamide | Sigma | N0636-100 | |
| Noggin | Peprotech | 120-10C-50 | |
| Penicillin-Streptomycin 10,000 U/ mL (100X) | Thermo Fisher Scientific | 15140122 | |
| Recombinant human epidermal growth factor (EGF) | Peprotech | AF-100-15 | |
| R-Spondin1 conditioned medium from Cultrex R-Spondin Cells | Biotechne | 3710-001-01 | |
| SB202190 | MedChemExpress | 152121-30-7 | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma-Aldrich | 93620-1G | |
| Trypsin-EDTA (0.25 %), phenol red | Thermo Fisher Scientific | 25200056 | |
| Wnt-3A conditioned medium | Wnt-3A expressing cell line was kindly provided by Prof. Hans Clevers' group | ||
| Y-27632 | Sigma | Y0503 |
References
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Coleman, H. G., Xie, S. -. H., Lagergren, J. The epidemiology of esophageal adenocarcinoma. Gastroenterology. 154 (2), 390-405 (2018).
- Rumgay, H., et al. International trends in esophageal squamous cell carcinoma and adenocarcinoma incidence. The American Journal of Gastroenterology. 116 (5), 1072-1076 (2021).
- Qian, H., et al. Clinical characteristics, prognosis, and nomogram for esophageal cancer based on adenosquamous carcinoma: a seer database analysis. Frontiers in Oncology. 11, 603349 (2021).
- Lagergren, J., Smyth, E., Cunningham, D., Lagergren, P. Oesophageal cancer. Lancet. 390 (10110), 2383-2396 (2017).
- Rockett, J. C., Larkin, K., Darnton, S. J., Morris, A. G., Matthews, H. R. Five newly established oesophageal carcinoma cell lines: phenotypic and immunological characterization. British Journal of Cancer. 75 (2), 258-263 (1997).
- Hashimoto, N. Expression of COX2 and p53 in rat esophageal cancer induced by reflux of duodenal contents. ISRN Gastroenterology. 2012, 1-5 (2012).
- Quante, M., et al. Bile acid and inflammation activate gastric cardia stem cells in a mouse model of barrett-like metaplasia. Cancer Cell. 21 (1), 36-51 (2012).
- Kapoor, H., Lohani, K. R., Lee, T. H., Agrawal, D. K., Mittal, S. K. Animal models of Barrett's esophagus and esophageal adenocarcinoma-past, present, and future. Clinical and Translational Science. 8 (6), 841-847 (2015).
- Lan, T., Xue, X., Dunmall, L. C., Miao, J., Wang, Y. Patient-derived xenograft: a developing tool for screening biomarkers and potential therapeutic targets for human esophageal cancers. Aging. 13 (8), 12273-12293 (2021).
- Liu, D. S. H., et al. APR-246 potently inhibits tumour growth and overcomes chemoresistance in preclinical models of oesophageal adenocarcinoma. Gut. 64 (10), 1506-1516 (2015).
- Ebbing, E. A., et al. Esophageal adenocarcinoma cells and xenograft tumors exposed to Erb-b2 receptor tyrosine kinase 2 and 3 inhibitors activate transforming growth factor beta signaling, which induces epithelial to mesenchymal transition. Gastroenterology. 153 (1), 63-76 (2017).
- Simian, M., Bissell, M. J. Organoids: A historical perspective of thinking in three dimensions. The Journal of Cell Biology. 216 (1), 31-40 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Li, X., et al. Organoid cultures recapitulate esophageal adenocarcinoma heterogeneity providing a model for clonality studies and precision therapeutics. Nature Communications. 9, 2983 (2018).
- Ebbing, E. A., et al. Stromal-derived interleukin 6 drives epithelial-to-mesenchymal transition and therapy resistance in esophageal adenocarcinoma. Proceedings of the National Academy of Sciences of the United States of America. 116 (6), 2237-2242 (2019).
- Karakasheva, T. A., et al. Generation and characterization of patient-derived head and neck, oral, and esophageal cancer organoids. Current Protocols in Stem Cell Biology. 53 (1), 109 (2020).
- Ordóñez, N. G. Broad-spectrum immunohistochemical epithelial markers: a review. Human Pathology. 44 (7), 1195-1215 (2013).
- Maniar, K. P., Umpires, B. Cytokeratin 7 (CK7, K7). Pathology Outlines.com website. , (2021).
- Sun, X., Kaufman, P. D. Ki-67: more than a proliferation marker. Chromosoma. 127 (2), 175-186 (2018).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 3380-3409 (2020).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved