Method Article
Un protocollo migliorato per purificare e direttamente mono-biotinyare recombinante BDNF in un tubo per gli studi sul traffico cellulare nei neuroni
In questo articolo
Riepilogo
Il BDNF ricombinante contenente una sequenza Avi (BDNFAvi) viene prodotto nelle cellule HEK293 in modo conveniente ed è purificato dalla cromatografia di affinità. BDNFavi viene quindi direttamente mono-biotinylated con l'enzima BirA in un tubo. BDNFavi e BDNFavi monobionlate mantengono la loro attività biologica rispetto al BDNF disponibile in commercio.
Abstract
Il BDNF ricombinante contenente una sequenza Avi (BDNFAvi) viene prodotto nelle cellule HEK293 e quindi purificato in modo conveniente dalla cromatografia di affinità. È stato sviluppato un protocollo riproducibile per mono-biotinylate BDNFAvi direttamente monobiolare con l'enzima BirA in un tubo. In questa reazione, BDNFAvi monobiolato mantiene la sua attività biologica.
Le neurotrofie sono fattori di crescita derivati dagli obiettivi che svolgono un ruolo nello sviluppo e nella manutenzione neuronali. Essi richiedono meccanismi di trasporto rapido lungo il percorso endocitico per consentire la segnalazione a lunga distanza tra diversi compartimenti neuronali. Lo sviluppo di strumenti molecolari per studiare il traffico di neurotrofinelle ha permesso il monitoraggio preciso di queste proteine nella cellula utilizzando la registrazione in vivo. In questo protocollo, abbiamo sviluppato una procedura ottimizzata ed economica per la produzione di BDNF monobionlate. Una variante BDNF ricombinante contenente una sequenza avi biotinyilable (BDNFAvi) viene prodotta in cellule HEK293 nell'intervallo di microgrammi e quindi purificata in una procedura facilmente scalabile utilizzando la cromatografia di affinità. Il BDNF purificato può quindi essere omogeneamente mono-biotinylated da una reazione diretta in vitro con l'enzima BirA in un tubo. L'attività biologica del BDNF monobiolato (mbtBDNF) può essere coniugata a streptavidin-conjugated a diversi fluorofori. BDNFAvi e mbtBDNF mantengono la loro attività biologica dimostrata attraverso il rilevamento di bersagli fosforillati a valle utilizzando macchie occidentali e l'attivazione del fattore di trascrizione CREB, rispettivamente. Utilizzando i punti streptavidin-quantum, siamo stati in grado di visualizzare l'internalizzazione mbtBDNF concomitante con l'attivazione del CREB, che è stato rilevato con un anticorpo specifico fosforo-CREB. Inoltre, mbtBDNF coniugato ai punti streptavidin-quantum era adatto per l'analisi del trasporto retrogrado nei neuroni corticali coltivati in camere microfluidiche. Così, in tubo prodotto mbtBDNF è uno strumento affidabile per studiare la dinamica endosomica di segnalazione fisiologica e il traffico di neuroni.
Introduzione
I neuroni sono le unità funzionali del sistema nervoso in possesso di una morfologia complessa e specializzata che consente la comunicazione sinaptica, e quindi la generazione di un comportamento coordinato e complesso in risposta a diversi stimoli. Proiezioni neuronali come dendriti e assoni sono caratteristiche strutturali critiche coinvolte nella comunicazione neuronale, e le neurotrofie sono fattori cruciali per determinare la loro morfologia e funzione1. Le neurotrofie sono una famiglia di fattori di crescita secreti che includono NGF, NT-3, NT-4 e fattore neurotrofico derivato dal cervello (BDNF)2. Nel sistema nervoso centrale (CNS), BDNF partecipa a diversi processi biologici tra cui neurotrasmissione, arborizzazione dendritica, maturazione delle spine dendritiche, potenziamento a lungo termine, tra gli altri3,4. Pertanto, BDNF svolge un ruolo critico nella regolazione della funzione neuronale.
Diversi processi cellulari regolano le dinamiche e le funzioni del BDNF. Sulla superficie neuronale, BDNF lega il recettore tropomiosina chinasi B (TrkB) e/o il recettore neurotrofiina p75 (p75). I complessi BDNF-TrkB e BDNF-p75 sono endocitosi e ordinati in diversi organelli endocitici5,6,77,8. Il corretto traffico intracellulare del complesso BDNF/TrkB è necessario per una corretta segnalazione BDNF in circuiti neuronali diversi9,10,11. Per questo motivo, una profonda comprensione delle dinamiche del traffico BDNF e delle sue alterazioni nei processi patofisiologici è essenziale per comprendere la segnalazione BDNF in salute e malattia. Lo sviluppo di nuovi e specifici strumenti molecolari per monitorare questo processo contribuirà a portare avanti questo campo e permetterà una migliore comprensione dei meccanismi normativi coinvolti.
Ci sono diversi strumenti disponibili per lo studio del traffico di BDNF nei neuroni. Una metodologia comunemente usata prevede la trasfezione di BDNF ricombinante etichettato con molecole fluorescenti come la proteina fluorescente verde (GFP) o la variante fluorescente fluorescente monomerica di GFP mCherry12,13. Tuttavia, una grave carenza di sovraespressione BDNF è che elimina la possibilità di fornire concentrazioni note di questa neurotrofia. Inoltre, può provocare tossicità cellulare, oscurando l'interpretazione dei risultati14. Una strategia alternativa è la trasfezione di un TrkB con etichetta epitope, come Flag-TrkB. Questa metodologia consente lo studio delle dinamiche di internalizzazione TrkB15, ma comporta anche la trasfezione, che potrebbe provocare alterata funzione TrkB e tossicità cellulare. Per superare questi ostacoli metodologici, sono state sviluppate varianti ricombinanti di NGF e BDNF contenenti una sequenza Avi (BDNFAvi), che può essere monobiota dall'enzima biotina-ligase BirA, sono state sviluppate16,17. Il BDNF ricombinante biotinylato può essere accoppiato a diversi strumenti legati alla streptavidina, che includono fluorofori, perline, nanoparticelle paramagnetiche tra gli altri per il rilevamento. In termini di imaging a cellule vive, i punti quantici (QD) sono diventati fluorofori usati di frequente, in quanto hanno caratteristiche desiderabili per il tracciamento di singole particelle, come una maggiore luminosità e resistenza al fotobleaching rispetto ai piccoli fluorofori molecolari18.
La produzione di BDNF monobiotinylata (mbtBDNF) utilizzando BDNFAvi è stata ottenuta mediante co-trasfezione di plasmidi guidando l'espressione di BDNFAvi e BirA, seguito dalla purificazione della proteina ricombinante mediante cromatografia di affinità con una resa di 1-2 g di BDNF per 20 mL di supporti di coltura con condizioni HEK29317. Qui, proponiamo una modifica di questo protocollo che consente la purificazione BDNFAvi da 500 mL di supporti con condizione HEK293, che cerca di massimizzare il recupero delle proteine in un protocollo basato su colonna cromatografia per facilità di manipolazione. L'agente di trasfezione usato, la polietileneimina (PEI), garantisce un metodo conveniente senza sacrificare la resa della trasfezione. La fase di monobiozione è stata adattata a una reazione in vitro per evitare le complicazioni associate alla co-transfections e per garantire un'etichettatura omogenea del BDNF. L'attività biologica del mbtBDNF è stata dimostrata da esperimenti di microscopia a macchia e fluorescenza occidentali, tra cui l'attivazione del pCREB e l'imaging a cellule vive per studiare il trasporto assonale retrogrado del BDNF in camere microfluidiche. L'uso di questo protocollo consente una produzione ottimizzata e ad alto rendimento di BDNF omogeneo monobio-biobiolato e biologicamente attivo.
Protocollo
Tutti gli esperimenti sono stati effettuati in conformità con le linee guida approvate di CONICYT (Commissione nazionale cilene per la ricerca scientifica e tecnologica). I protocolli utilizzati in questo studio sono stati approvati dai Comitati di Biosicurezza e Bioetica e Benessere Animale della Pontificia Universidad Catalica del Cile. Gli esperimenti riguardanti i vertebrati sono stati approvati dal Comitato per il benessere bioetico e animale della Pontificia Universidad Catalia de Chile.
NOTA: il seguente protocollo è stato progettato per purificare BDNFAvi da un volume totale di 500 mL di mezzo condizionato prodotto nelle celle HEK293. La quantità di mezzo condizionato che viene prodotto e trasformato per purificare BDNFAvi può essere aumentato o ridimensionato in base alle esigenze. Tuttavia, in queste circostanze potrebbe essere necessaria un'ulteriore ottimizzazione. La composizione dei mezzi di coltura e dei buffer utilizzati in tutto il protocollo si trova in materiali supplementari.
1. Produzione e purificazione di BDNFAvi da supporti con condizioni HEK293
- Trasfezione di cellule HEK293
- Coltivare le cellule HEK293 al 70% di confluenza nel mezzo DMEM integrato (10% di siero fetale bovino, 1x integratore di glutammato, 1x antibiotico/antimicotico) in 15 cm piatti di coltura a 37 oC.
- Modificare il buffer medio in disfezione.
- Preparare la miscela PEI-DNA per la trasfezione. Utilizzare due diversi tubi conici da 15 mL per diluire rispettivamente il DNA e il PEI 25 K. Diluire 20 g di DNA plasmico in un volume finale di 500 gradi in un tubo. Diluire 60 g di PEI 25K lineare in un volume finale di 500 l nell'altro tubo. Incubare a temperatura ambiente per 5 min.
- Pipette con attenzione la soluzione del DNA nel tubo PEI, mescolando una volta per movimento up-down. Incubare a temperatura ambiente per 25 min.
- Gocciola 1 mL della miscela PEI-DNA in ogni piatto di 15 cm. Incubare le cellule con la miscela PEI-DNA per 3 h a 37 oC.
- Modificare il buffer di incubazione medio-nuovo.
- Raccolta e archiviazione dei supporti
- Raccogliere il mezzo da tutti i piatti 48 h dopo la trasfezione delle cellule HEK293. Preparare le scorte concentrate delle soluzioni descritte nella sezione "supernatant modification buffer" del File supplementare 1 e aggiungerle al supernatante HEK293 per ottenere le concentrazioni finali elencate.
NOTA: le celle possono essere scartate o recuperate per ulteriori analisi. - Incubare il mezzo nel ghiaccio per 15 min.
- Aliquota il mezzo in tubi di centrifuga.
- Centrifugare il mezzo a 10.000 x g per 45 min in una centrifuga a 4 gradi centigradi. Questo passaggio consente l'eliminazione di detriti cellulari e cellule morte sospese nel supporto.
- Raccogliere i supernatanti, aggiungere BSA ad una concentrazione finale di 0.1%. e poi conservare a -20 gradi centigradi. Il supporto può essere sponsorizzato prima del congelamento per uno scongelamento più veloce durante la fase di purificazione.
NOTA: i tempi di conservazione dei supporti congelati fino a 2 mesi hanno prodotto risultati positivi, non sono stati valutati tempi di conservazione più lunghi.
- Raccogliere il mezzo da tutti i piatti 48 h dopo la trasfezione delle cellule HEK293. Preparare le scorte concentrate delle soluzioni descritte nella sezione "supernatant modification buffer" del File supplementare 1 e aggiungerle al supernatante HEK293 per ottenere le concentrazioni finali elencate.
- Concentrazione e purificazione dei media
- Scongelare i mezzi di comunicazione in un bagno termoregolato a 37 gradi centigradi.
- Aliquota il supporto in tubi di centrifuga.
- Centrifugare il mezzo per 1 h a 3.500 x g in una centrifuga raffreddata a 4 gradi centigradi. Questo passaggio consente l'eliminazione dei detriti cellulari rimanenti per garantire un flusso adeguato attraverso la colonna della cromatografia.
- Utilizzare i concentratori di proteine con un cutoff di 10 kDa per ridurre il supporto da 500 mL a 100 mL. Seguire i parametri di centrifugazione raccomandati dal produttore per una concentrazione ottimale.
- Aggiungere 500 l di perline di agarose Ni-NTA al supporto concentrato e incubare pernottandosi per una notte a 4 gradi centigradi in un rocker.
- Assemblare l'apparato cromatografia e versare i media in esso. Lasciare riposare per 5 min e quindi aprire il stopcock a 2 vie per far scorrere il mezzo.
- Lavare le perline con 5 mL di tampone di lavaggio per 5 min. Assicurarsi di rispendere le perline nella colonna. Scolare il tampone di lavaggio aprendo il tappo a 2 vie. Ripetere 3 volte.
- Aggiungere 1 mL di buffer di eluizione alla colonna. Assicurati di risospendere le perline nella colonna. Incubare per 15 min, e poi raccogliere l'eluato in un tubo di microcentrifuga da 1,5 ml. Ripetere questo passaggio 3 volte per l'eluzione completa di BDNFAvi.
- Caricare 5 l di ogni eluate e diverse concentrazioni di BDNF (40-160 ng) disponibili in tutto il 15% in un gel poliacrilammide del 15%. Rilevare la proteina purificata dal gonfiore occidentale utilizzando un anticorpo anti-BDNF.
- Determinare la concentrazione del BDNFAvi purificato in ogni eluato utilizzando la curva di concentrazione preparata con il BDNF disponibile in commercio.
- Aliquota e conservare il BDNFAvi purificato a -80 gradi centigradi.
2. Monobiolazione in vitro di BDNFAvi utilizzando l'enzima BirA
-
Reazione monobiolazione in vitro
- Preparare soluzioni di stock concentrato dei reagenti del buffer di biotinylazione. L'uso di scorte concentrate ridurrà al minimo la diluizione della proteina ricombinante.
- Prendere un 800 ng di BDNFAvi e aggiungere il reagenti buffer biotinylation e l'enzima BirA in una relazione molare 1:1 con BDNF. Ad esempio, per un'aggiunta di volume di reazione finale di 200 l; 100 litri di soluzione che contiene 800 ng di BDNFAvi, 20 M Bicine 0,5 M pH 8,3, 20 ATP 100 mM, 20L MgOAc 100 mM, 20 d-biotin 500 M, da 0,8 a 1 g a 1 l di BirA-GST, e completare fino a 200 gradi con acqua ultrapura.
NOTA: Sono state eseguite reazioni di biotinylazione riuscite con aliquote di 400 gradi contenenti una concentrazione di circa 30 ng/ BDNFAvi, con conseguente BDNFAvi omogeneamente biotinyato ad una concentrazione finale di 20 ng/ . - Mescolare la miscela a 30 gradi centigradi in un forno di ibridazione per 1 h. Mescolare il contenuto per inversione del tubo ogni 15 min.
- Aggiungere lo stesso volume di ATP e BirA come nel passaggio 2.1.2 e ripetere il passaggio 2.1.3.
- Conservare a -80 gradi centigradi per analisi future o conservare il ghiaccio per un uso immediato (ad esempio, il controllo della qualità della biotinylazione).
- Analisi della biotinylazione
- Blocco 30 -L di perline magnetiche streptavidin per ogni campione BDNF in 1 mL di buffer di blocco. Incubare a temperatura ambiente per 1 h in un rotore tubo di microcentrifuga.
- Precipitare le perline magnetiche utilizzando un rack di separazione magnetica per 3 a 5 minuti o fino a quando il buffer appare completamente cancellato dalle perline e scartare il buffer di blocco.
- Aggiungere alle perline 50 l di nuovo buffer di blocco e 80 ng di bDNFAvi monobionlate (mbtBDNF) alle perline, assicurandosi di risospenderle completamente con la pippeting.
- Incubare a 4 gradi centigradi per 1 h in un tubo di microcentrifuga rotatore a circa 20 giri/min.
- Raccogliere le perline utilizzando il rack di separazione magnetica per 3-5 minuti, e raccogliere il supernatante, mantenendo un 30 aliquota per l'analisi.
- Lavare le perline una volta con 500 ll di PBS, quindi raccoglierle utilizzando il rack di separazione magnetica per 3-5 minuti. Recuperare il supernatante e mantenere un 30 l per l'analisi dell'aliquota.
- Aggiungere 10 lofan di 4 volte di buffer di carico alle perline.
- Riscaldare i campioni a 97 gradi centigradi per 7 minuti per eluire il mbtBDNF.
- Rilevare mbtBDNF utilizzando un anticorpo specifico anti-BDNF19.
3. Verifica dell'attività biologica mbtBDNF
- Rilevamento di pTrkB e pERK da macchia occidentale.
- Seme 2 milioni di neuroni corticali di ratto in piatti di coltura 60 mm.
- Cultura i neuroni per 7 giorni (DIV7). Quindi, cambiare il medio a mediun neurobasal non integrato quando si avvia l'esperimento.
- Un'ora dopo il cambiamento medio, aggiungere mbtBDNF a una concentrazione finale di 50 ng/mL. Incubare per 30 min a 37 oC. Tenere una parabola di controllo negativo (non stimolata con BDNF) e una parabola di controllo positiva (trattata con 50 ng/mL di BDNF disponibile in commercio).
- Raccogliere il mezzo e lavare delicatamente ogni piatto con 1x PBS. Raccogliere e scartare il 1x PBS.
- Disporre i piatti sul ghiaccio e aggiungere 50-80 l'l di tampone di lisi ad ogni piatto. Utilizzare un raschietto cellulare per losizzare le cellule.
NOTA: Il passo di lisi deve essere eseguito il più rapidamente possibile per evitare la deptolorylazione e la degradazione delle proteine. 1-2 minuti di raschiatura vigorosa sono sufficienti per visualizzare le proteine di interesse da gonfiore occidentale. - Raccogliere il tampone di lisi e mescolare in un mixer vortice alla massima velocità per 5 s.
- Centrifugare il buffer di lisi a 14.000 x g (4 gradi centigradi) per 10 min. Raccogliere il supernatante.
- Quantificare il contenuto proteico del supernatante mediante protocollo di quantificazione delle proteine BCA20.
- Aggiungere il buffer di carico a un'aliquota contenente 30-50 g di proteine per condizione e caricarlo in un gel poliacrilammide 12% per il gonfiore occidentale. Rilevare il pTrkB e il pERK usando anticorpi fosforo specifici per verificare l'attività biologica di BDNFAvi.
- Verifica dell'attività biologica BDNF-QD mediante immunofluorescenza pCREB.
- Seme 40.000 neuroni corticali ratti in 10 mm coprinti, precedentemente autoclaved e trattati con poli-L-lysina come descritto in precedenza21.
- Cultura i neuroni per 7-8 giorni in tampone di manutenzione neuronale (vedi materiali supplementari) a 37 oC.
- Per iniziare l'esperimento, cambiare il mezzo neurobasale medio a non integrato e incubare a 37 oC per 1 h.
- Preparare il mbtBDNF coniugato ai punti quantici (BDNF-QD) aggiungendo ad un mbtBDNFF, il volume necessario del coniugato di streptavidina del punto quantico (streptavidin-QD) per ottenere un rapporto molare 1:1 BDNF-QD. Quindi, diluire a 20 l con mezzo neurobasal. Avvolgere il tubo in un foglio di alluminio per proteggerlo dalla luce.
NOTA: Preparare un altro tubo con lo stesso volume di streptavidin a punti quantici coniugato e diluirlo a 20 l con mezzo neurobasale come controllo negativo. - Incubare la miscela mbtBDNF / streptavidin-QD per 30 min a temperatura ambiente in un rocker.
- Diluire il BDNF-QD alla concentrazione finale desiderata (200 pM e 2 nM) nel mezzo neurobasale.
- Dopo 1 h di incubazione con mezzo neurobasale non integrato, stimolare i neuroni con BDNF-QD o streptavidin-QD (controllo) ad una concentrazione finale di 200 pM e 2 nM di BDNF per 30 min a 37 .
- Lavare i coperchi 3 volte con 1x PBS (37 gradi centigradi) e fissare le cellule per 15 min trattando il coperchio con una soluzione di paraformaldeide del 4% contenente inibitori del fosfosi.
- Lavare le cellule 3 volte con PBS, quindi incubare con buffer di blocco/permeabilizzazione (BSA 5%, Triton X-100 0,5%, 1x inibitore del fosfosi) per 1 h.
- Incubare con anticorpo anti-pCREB 1:500 (nel 3% BSA, 0,1% Triton X-100) durante la notte a 4 gradi centigradi.
- Il giorno seguente, lavare 3 volte con 1x PBS, e incubare per 1 h con l'anticorpo secondario 1:500 (3% BSA, 0.1% Triton X-100).
- Lavare 3 volte con 1x PBS. Aggiungere la soluzione di macchia nucleare di Hoechst (5 g/mL) per 7 min.
- Lavare 3 volte con 1x PBS e montare.
- Visualizzazione del trasporto assonale retrogrado di BDNF-QD nei neuroni vivi
- Preparare camere microfluidiche e neuroni dei semi come descritto in precedenza16.
- Dopo 7-8 giorni in coltura, cambiare il mezzo medio a mezzo neurobasale non integrato.
- Preparare il mbtBDNF coniugato ai punti quantici (BDNF-QD) aggiungendo ad un mbtBDNFF, il volume necessario del coniugato di streptavidina del punto quantico (streptavidin-QD) per ottenere un rapporto molare 1:1 BDNF-QD. Quindi, diluire a 20 l con mezzo neurobasal. Avvolgere il tubo in un foglio di alluminio per proteggerlo dalla luce.
NOTA: Preparare un altro tubo con lo stesso volume di streptavidin a punti quantici coniugato e diluirlo a 20 l con mezzo neurobasale come controllo. - Incubare la miscela mbtBDNF / streptavidin-QD per 30 min a temperatura ambiente in un rocker.
- Diluire il BDNF-QD alla concentrazione finale desiderata (2 nM).
- Dopo 1 h di incubazione con mezzo neurobasale non integrato aggiungere il BDNF-QD o la miscela di controllo ai compartimenti assonali della camera microfluidica. Incubare per 210 min a 37 s per garantire un trasporto retrogrado netto di BDNF-QD.
- Per l'imaging a celle vive, visualizzare il trasporto retrogrado assonale nel segmento dei microgroove che è prossimale al compartimento del corpo cellulare utilizzando un obiettivo 100x utilizzando un microscopio adatto a questi scopi (37 e 5% di CO2). Acquisire immagini a 1 fotogramma/s.
Risultati
L'uso di un protocollo cromatografico basato su colonne consente l'elaborazione di volumi significativi di supporti condizionati HEK293. Nella Figura 1vengono visualizzati i risultati della purificazione di BDNFAvi da 500 mL di supporti condizionati. Le luzioni consecutive di BDNFAvi dalle perline di agarose Ni-NTA producono concentrazioni decrescenti di BDNFAvi(Figura 1A). Dopo quattro eluzioni consecutive (ognuna della durata di 15 min), la maggior parte del BDNF catturato dalle perline viene recuperato. Le concentrazioni degli eluati vanno da 6 a 28 ng/L, e la resa totale è stata di circa 60 g di BDNFAvi (Tabella 1). Il BDNFAvi prodotto è stato poi biotinylated in modo efficiente da una reazione in vitro mediata da BirA-GST, come dimostra la mancanza di BDNFAvi non biotinylata nel supernatale (Figura 1B). Si prega di notare che la biotinylation presentata nella figura 1B corrisponde ad un'aliquota del BDNF totale prodotto, ma la reazione può essere scalata per volumi più grandi.
Quindi, l'attività biologica di mbtBDNF è stata valutata utilizzando 2 diversi approcci sperimentali. In primo luogo, i neuroni corticali seminano in piastre da 60 mm (2 milioni di neuroni, DIV7) sono stati stimolati con 50 ng/mL di mbtBDNF per 30 min, e quindi le proteine sono state preparate per l'analisi delle macchie occidentali. L'attività biologica del mbtBDNF è stata quantificata rilevando pTrkB (Y515) e pERK (T202/Y204). L'associazione di BDNF a TrkB innesca l'attivazione del recettore attraverso una reazione di autoforphosphorylation nel suo dominio intracellulare, e ERK è un bersaglio noto del percorso di segnalazione BDNF22. Le bande per entrambe le proteine fosforolate avevano un'intensità simile nei neuroni trattati con BDNF commerciale e mbtBDNF, ed entrambe mostravano un segnale più forte della condizione di controllo (Figura 2A). Quindi, è stata valutata l'attività biologica di mbtBDNF accoppiata a streptavidin-QD per dimostrare che possono essere utilizzati in esperimenti di imaging dal vivo. I neuroni corticali sono stati seminati in coperture da 10 mm (40.000 cellule per copertura, DIV7) e trattati con una concentrazione finale di 200 pM o 2 nM BDNF-QD per 30 min prima di fissare e colorare per il pCREB. CREB è un fattore di trascrizione che è preso di mira da attivato ERK1/2 nei neuroni corticali22,23. Stimolando i neuroni con crescenti concentrazioni di BDNF-QD ha provocato un aumento dipendente dalla dose di fosforilazione del CREB e la presenza di particelle di QD che circondano il nucleo (Figura 2B), indicando che le particelle BDNF-QD sono state endocilizzati e ha innescato l'attivazione delle vie di segnalazione associate all'attivazione TrkB mediata da BDNF. Un duplice aumento del segnale pCREB è stato rilevato quando si stimolavano i neuroni con una bassa concentrazione di BDNF-QD (200 pM), mentre stimolante con 2 nM ha provocato un aumento di 3,5 volte del segnale pCREB (Figura 2C). Questi risultati dimostrano che il BDNFAvi biotinylato è biologicamente attivo e che non perde la sua attività quando accoppiato con streptavidin-QD, rendendolo adatto per l'immunofluorescenza e l'imaging di cellule vive.
Infine, il potenziale di imaging di BDNF-QD è stato valutato in colture compartimentate utilizzando camere microfluidiche. I neuroni corticali erano semi in camere microfluidiche (coperture da 15 mm, 50.000 neuroni per camera microfluidica, DIV7) per separare i compartimenti assonali e somatodendrici e sono stati stimolati con 2 nM BDNF-QD per 3,5 h. La microscopia a cellule vive è stata eseguita e i kymografi risultanti sono stati utilizzati per quantificare la velocità del BDNF-QD contenente organelli(Figura 3A). È stata rilevata una velocità media mobile di 0,91 m/s (Figura 3B), in linea con le precedenti analisi del trasporto mediato dalla dineina citoplasmica7,16. Le camere microfluidiche trattate con 2 nM streptavidin-QD non mostravano QD mobili nei microgroove, come mostrato dal kymograph (Figura 3A). Le cellule coltivate nelle stesse condizioni sono state stimolate con 500 pM o 2 nM BDNF-QD per 210 min, quindi fissate ed etichettate con una colorazione nucleare. Come mostrato nella Figura 3C,i neuroni mostrano un accumulo dipendente dalla dose di BDNF-QD in tutti i sottocomparti analizzati, comprese le parti prossimali e distali del microgroove e il compartimento somatodendritico. Al contrario, i neuroni di controllo non hanno mostrato quasi alcun segnale QD in tutta la camera. Pertanto, il BDNF-QD può essere rilevato nelle cellule vive e fisse nelle camere microfluidiche.
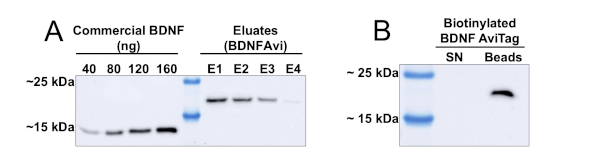
Figura 1: Produzione e monobiolazione di BDNFAvi nelle cellule HEK293. Le cellule HEK293 sono state trafettate utilizzando il reagente PEI e un plasmide di codifica BDNFAvi e il supporto condizionato è stato raccolto dopo 48 h. BDNFAvi contiene un tag di istidina 6x che consente la purificazione utilizzando la cromatografia dell'acido nickel-nitrilotriacetic (Ni-NTA). Il BDNF umano ricombinante disponibile in commercio ha un peso molecolare previsto di 13 kDa, mentre BDNFAvi mostra un peso molecolare di 18 kDa. BDNFAvi legato alla resina è stato completamente eluito con quattro fasi di eluizione consecutive. (A) Macchia occidentale che utilizza anticorpi anti-BDNF per rilevare in casa il BDNF ricombinante preparato in casa e il BDNF commerciale. Le aliquote contenenti quantità note di BDNF umano disponibili in commercio e 5-L di ogni eluato sono state caricate in un gel SDS-PAGE per il rilevamento di BDNFAvi utilizzando un anticorpo contro BDNF. La tabella 1 indica le concentrazioni di BDNFAvi presenti in ogni eluato. La quantità e la concentrazione di BDNF in ogni eluate è stata ottenuta mediante analisi densitometrica e interpolazione dalla curva di concentrazione di BDNF disponibile in commercio. (B) Verifica della biotinylazione BDNFAvi. Ottanta nanogrammi di BDNFAvi biotinylati (mbtBDNF) sono stati incubati con 30 -L di streptavidin accoppiati a perline magnetiche (20% di liquami) per 1 ora a 4 gradi centigradi. Poi, le perline magnetiche sono state isolate usando un separatore magnetico. Le perle streptavidin sono state riscaldate con tampone di carico per eluire il BDNFAvi biotinylato (corsia delle perline). Il supernatante (sN lane) è stato anche trattato con tampone di carico, riscaldato e caricato nel gel (sN lane). Fare clic qui per visualizzare una versione più grande di questa figura.
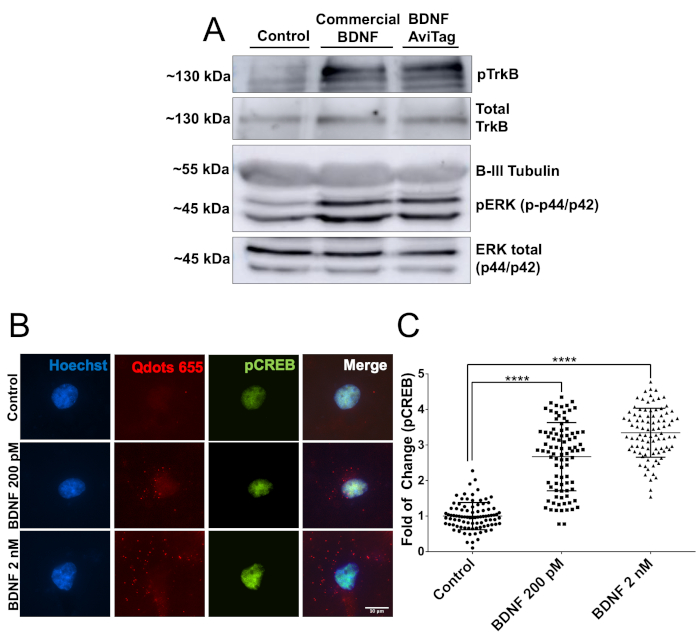
Figura 2: Verifica dell'attività biologica mbtBDNF. (A) I neuroni corticali DIV7 sono stati siero affamati di 1 h, e poi stimolato con 50 ng/mL di BDNF disponibile in commercio o mbtBDNF per 30 min. Le proteine sono state estratte e caricate in un gel SDS-PAGE per l'analisi del fosforo TrkB e ERK1/2 utilizzando anticorpi specifici per il fosforo e rispetto ai livelli totali della proteina che utilizzano anticorpi contro il TrkB totale e l'ERK1/2. (B) I neuroni corticali DIV7 sono stati siero affamati per 1 h, e poi stimolati con una concentrazione finale di 200 pM o 2 nM di mbtBDNF accoppiato a streptavidin-QD (BDNF-QD) per 30 min. Quindi, le cellule sono state fisse e pCREB è stato etichettato per l'analisi della microscopia a fluorescenza. (C) Quantificazione dell'intensità di fluorescenza della pNU Nucleare. I risultati corrispondono a 90 neuroni raggruppati tra loro da 3 esperimenti indipendenti, mostrati come media : SEM. L'analisi statistica corrisponde a un'ANOVA unidirezionale con il test di confronto multiplo di Tukey (Sezione < 0,0001). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Visualizzazione del BDNF-QD in celle live e fisse. (A) I neuroni corticali DIV7 coltivati in camere microfluidiche sono stati stimolati nel compartimento assonale con una concentrazione finale di 2 nM BDNF-QD per 3,5 ore, e quindi la porzione prossimale dei microgrooves è stata creata utilizzando un'impostazione di microscopia a cellule vive. Sono mostrati i kymografi rappresentativi per le condizioni di controllo (trattati con streptavidin-QD) e al momento del trattamento con BDNF-QD. (B) Quantificazione della velocità di movimento BDNF-QD. I puncta mobili sono stati definiti come quelli che si muovevano più di 10 m nei 120 s di registrazione. (C) I neuroni corticali DIV7 coltivati in camere microfluidiche sono stati stimolati nel compartimento assonale con una concentrazione finale di BDNF-QD di 500 pM o 2 nM per 3,5 ore, quindi fissi ed etichettati con Hoechst per visualizzare i nuclei. Vengono mostrate immagini rappresentative del compartimento somatodendritico e delle porzioni dissitali e prossimali dei microgroove. Fare clic qui per visualizzare una versione più grande di questa figura.
| Eluate | BDNF (ng) in 5l | [ng/zl] | Totale BDNF [-g] |
| E1 (in vie tla | 142.2 | 28.4 | 28.4 |
| E2 (in questo modo) | 101.2 | 20.2 | 20.2 |
| E3 (in questo stato del sistema | 65.6 | 13.1 | 13.1 |
| E4 | 30.4 | 6.1 | 6.1 |
| 67.8 |
Tabella 1: Quantificazione della resa di purificazione di BDNFAvi (relativa alla Figura 1A). Le cellule HEK293 sono state trascate con un plasmide che guida l'espressione BDNFAvi, e la proteina è stata purificata dalla cromatografia di affinità Ni-NTA. La concentrazione delle proteine e la resa finale sono state calcolate mediante analisi densitometrica e interpolazione nella curva di concentrazione nota del BDNF umano ricombinante disponibile in commercio.
File supplementare 1: Componenti dei supporti di coltura e del buffer Fare clic qui per scaricare questo file.
Discussione
In questo articolo viene descritta una metodologia ottimizzata per la produzione e la purificazione di mbtBDNF in una procedura basata sulla cromatografia di affinità, basata sul lavoro di Sung e dei collaboratori17. Le ottimizzazioni includono l'uso di una reagente di trasfezione conveniente (PEI) pur mantenendo l'efficienza di metodi di trasfezione più costosi come la lipofectamine. Questa ottimizzazione si traduce in una significativa riduzione dei costi nel protocollo, consentendo una scalabilità pur mantenendo un'elevata redditività. Il protocollo include anche considerazioni di facilità d'uso, tra cui il congelamento dei supporti condizionati per un massimo di 2 mesi. Queste ottimizzazioni rendono la procedura adattabile alle esigenze di ogni laboratorio, migliorano l'efficacia in termini di costi e producono BDNF ricombinante omogeneo e biologicamente attivo. Il protocollo può anche essere adattato a produzioni su scala più piccola sostituendo l'uso dell'apparato cromatografico con precipitazioni gravitazionali delle perline in tubi conici. Ciò costituisce una metodologia praticabile, ma meno efficiente in termini di tempo e ha portato a minori rendimenti nella nostra esperienza. Il BDNF con etichetta biotina può quindi essere accoppiato a diverse sonde legate alla streptavidina, tra cui fluorofori e nanoparticelle paramagnetiche, rendendolo uno strumento prezioso per eseguire diversi tipi di esperimenti per l'analisi del traffico post-endocitico BDNF. Pertanto, un protocollo di produzione ottimizzato e semplice per questa proteina è molto utile per i laboratori che lavorano in questo campo.
La produzione di proteine ricombinanti con complesse modifiche post-traduzionali, come BDNF24, nei sistemi procariotici spesso si traduce in proteine che non sono piegate correttamente e quindi hanno scarsa attività biologica25. Pertanto, l'espressione nelle cellule dei mammiferi è necessaria per ottenere una proteina bioattiva. L'uso del PEI è stato descritto in precedenza come una valida alternativa per la produzione su larga scala di proteine ricombinanti nelle cellule di mammiferi trafetti25,26, e la sua efficienza nella trasfezione delle cellule HEK293 nel contesto dei laboratori accademici è stata evidenziata27. Pertanto, l'uso di questa linea cellulare rappresenta un'opzione valida per produrre BDNFAvi su una scala che può essere gestita da un laboratorio accademico. Il protocollo proposto potrebbe essere ulteriormente ottimizzato dalla generazione di una linea cellulare HEK293 stabilmente trasinfezione di BDNFAvi, che eliminerebbe la fase di trasfezione transitoria, risparmiando così tempo e risorse. Un'altra potenziale fonte di ottimizzazione è l'uso di cellule in sospensione invece di cellule aderenti. Le cellule HEK293 possono essere mantenute in sospensione, generando quantità significative di proteine ricombinanti nell'intervallo di grammi per litro28.
Un altro miglioramento del protocollo è la biotinylazione della proteina BDNFAvi utilizzando una strategia in vitro, sostituendo il precedente protocollo di co-transfezione in vivo. La co-trasfezione transitoria può avere risultati imprevisti in termini di espressione dei costrutti, come è stato dimostrato in più linee cellulari e con diversi reagenti di trasfezione29. Vari fattori possono influenzare l'espressione delle proteine trafette in un contesto di co-trasfezione, tra cui vettori, tipi di cellule e concentrazione plasmide. Questa molteplicità di fattori rende l'ottimizzazione e la riproducibilità un'attività complessa. D'altra parte, una metodologia in vitro consente un migliore controllo sulle condizioni in cui avviene la reazione biotinylation. Questa metodologia si traduce in un'etichettatura riproducibile e omogenea del BDNF ricombinante.
Come dimostrato dagli esperimenti di verifica dell'attività biologica, il mbtBDNF prodotto utilizzando questo protocollo è paragonabile al BDNF umano ricombinante disponibile in commercio in termini di attivazione del percorso di segnalazione BDNF-TrkB. I dati mostrano anche che l'accoppiamento BDNF a streptavidin-QD non interferisce con la segnalazione BDNF-TrkB. Inoltre, abbiamo dimostrato che bDNF-QD può essere rilevato mediante microscopia a epiorescenza nelle cellule vive e fisse. Pertanto, mbtBDNF rappresenta uno strumento prezioso per studiare il traffico assonale retrogrado e presenta16vantaggi significativi rispetto alle sonde alternative, come BDNF-GFP16 . Il protocollo descritto in questo articolo fornisce una metodologia affidabile e coerente per la produzione di mbtBDNF, che può quindi essere utilizzato in studi di dinamica post-endocitica in diversi modelli neuronali che esprimono TrkB o p75. La segnalazione BDNF ha effetti potenti sulla morfologia neuronale e sulla funzione3,,4,21ed è stata recentemente proposta come potenziale strumento terapeutico per migliorare la rigenerazione neuronale30,31, rendendo il suo studio rilevante nei campi della biologia cellulare e della biomedicina. Lo studio degli effetti della segnalazione e del traffico BDNF farà progredire ulteriormente la nostra comprensione della biologia cellulare neuronale e potrebbe consentire lo sfruttamento del suo potenziale rigenerativo in ambienti clinici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori riconoscono con gratitudine il sostegno finanziario di Fondecyt (1171137) (FCB), il Basal Center of Excellence in Science and Technology (AFB 170005) (FCB), Millenium-Nucle (P07/011-F) (FCB), il Wellcome Trust Senior Investigator Award (107116 / 15 / s) (GS) e un premio UK Dementia Research Institute Foundation (GS). Questo lavoro è stato supportato dall'Unidad de Microscopa Avanzada UC (UMA UC).
Materiali
| Name | Company | Catalog Number | Comments |
| 2 way stopcock | BioRad | 7328102 | Chromatography apparatus component |
| 2-mercaptoethanol | Sigma | M6250 | BDNF elution buffer |
| Acrylamide/Bisacrylamide | BioRad | 1610154 | SDS-PAGE gel preparation |
| Amicon Ultra-15 10K | Millipore | UFC901024 | BDNF concentration |
| Ammonium Persulfate | Sigma | A9164 | SDS-PAGE gel preparation |
| anti B-III-Tubulin antibody | Sigma | T8578 | Western blot assays for BDNF biological activity detection |
| anti BDNF antibody | Alomone | AGP-021 | Western blot assays for BDNF quantification |
| anti BDNF antibody | Alomone | ANT-010 | Western blot assays for BDNF quantification |
| Anti ERK antibody | Cell Signaling | 9102 | Western blot assays for BDNF biological activity detection |
| anti pCREB antibody (S133) | Cell Signaling | 9198 | Western blot assays for BDNF biological activity detection |
| anti pERK antibody (T202, Y204) | Cell Signaling | 4370 | Western blot assays for BDNF biological activity detection |
| anti pTrkB antibody (Y515) | Abcam | ab109684 | Western blot assays for BDNF biological activity detection |
| Antibiotic/Antimycotic | Gibco | 15240-062 | HEK293 maintenance |
| ATP | Sigma | A26209 | BDNF monobiotinylation buffer |
| B-27 Supplement | Gibco | 17504-044 | Neuron maintenance |
| Bicine | Sigma | B3876 | BDNF monobiotinylation buffer |
| BirA-GST | BPS Bioscience | 70031 | Enzyme for BDNF AviTag monobiotinylation |
| Bovine Fetal Serum | HyClone | HC.SH30396.02 | HEK293 maintenance |
| Bovine Serum Albumin | Jackson ImmunoResearch | 001-000-162 | BDNF buffer modification component, blocking buffer for western blot and immunofluorescence |
| D-Biotin | Sigma | B4639 | BDNF monobiotinylation buffer |
| DMEM High Glucose Medium | Gibco | 11965-092 | Neuron seeding |
| DMEM Medium | Gibco | 11995-081 | HEK293 maintenance |
| Econo Column Funnel | BioRad | 7310003 | Chromatography apparatus component |
| EDTA | Merck | 108418 | |
| EZ-ECL Kit | Biological Industries | 1633664 | Protein detection by western blotting |
| Glutamax | Gibco | 35050-061 | Neuron and HEK293 maintenance |
| Glycerol | Merck | 104094 | BDNF elution buffer, lysis buffer for western blot assays |
| Hettich Rotina 46R Centrifuge | Hettich | Discontinued | Centrifuge used for clearing the medium of debris |
| Hettich Universal 32R Centrifuge | Hettich | Discontinued | Centrifuge used for protein concentrator centrifugation |
| Horse Serum | Gibco | 16050-122 | Neuron seeding |
| ImageQuant LAS 500 | GE Healthcare Life Sciences | 29005063 | Western blot image acquisition |
| Imidazole | Sigma | I55513 | BDNF buffer modification component |
| KCl | Winkler | BM-1370 | PBS component |
| KH2PO4 | Merck | 104873 | PBS component |
| Laminin | Invitrogen | 23017-015 | Cover coating for compartmentalized neurons |
| Luer Tubing Adaptor | BioRad | 7323245 | Chromatography apparatus component |
| Luminata™ Forte Western HRP Substrate | Millipore | WBLUF0100 | Protein detection by western blotting |
| Mg(CH3COO)2 | Merck | 105819 | BDNF monobiotinylation buffer |
| Mowiol 4-88 | Calbiochem | 475904 | Mounting reagent for immunofluorescence assays |
| MyOne C1 Streptavidin Magnetic Beads | Invitrogen | 65001 | Biotinylation verification |
| Na2HPO4 | Merck | 106586 | BDNF buffer modification component |
| NaCl | Winkler | BM-1630 | PBS component, BDNF buffer modification component |
| NaH2PO4 | Merck | 106346 | BDNF buffer modification component |
| Neurobasal Medium | Gibco | 21103-049 | Neuron maintenance |
| Ni-NTA Agarose Beads | Qiagen | 30210 | BDNF AviTag purification |
| Nikon Ti2-E | Nikon | Microscope for fluorescence imaging | |
| Nitrocellulose Membrane | BioRad | 1620115 | Protein transfer for western blotting |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | C13440-20CU | Camera for epifluorescence imaging |
| P8340 Protease Inhibitor Cocktail | Sigma | P8340 | BDNF buffer modification component |
| Paraformaldehyde | Merck | 104005 | Fixative for immunofluorescence assays |
| Penicillin/Streptomycin | Gibco | 15140-122 | Neuron maintenance |
| Poli-D-Lysine | Corning | DLW354210 | Cover coating for compartmentalized neurons |
| Poli-L-Lysine | Millipore | P2363 | Cover coating for non-compartmentalized neurons |
| Poly-Prep Chromatography Column | BioRad | 7311550 | Chromatography apparatus component |
| Polyethyleneimine 25K | Polysciences Inc. | PLY-0296 | HEK293 transfection |
| Quantum Dots 655 streptavidin conjugate | Invitrogen | Q10121MP | Monobiotinylated BDNF AviTag label for live and fixed cell experiments |
| Saponin | Sigma | S4521 | Detergent for immunofluorescence assays |
| Syldgard 184 silicone elastomer base | Poirot | 4019862 | Microfluidic chamber preparation |
| TEMED | Sigma | T9281 | SDS-PAGE gel preparation |
| Tris | Winkler | BM-2000 | Lysis buffer component |
| Triton X100 | Merck | 108603 | Cell permeabilization in immunofluorescence and western blot assays |
| Trypsin-EDTA 0.5% | Gibco | 15400-054 | HEK293 passaging |
Riferimenti
- Huang, E., Reichardt, L. Neurotrophins: Roles in Neuronal Development and Function. Annual Review of Neuroscience. 24, 677-736 (2001).
- Skaper, S. D. The neurotrophin family of neurotrophic factors: an overview. Methods in Mollecular Biology. 846, 1-12 (2012).
- Gonzalez, A., Moya-Alvarado, G., Gonzalez-Billault, C., Bronfman, F. C. Cellular and molecular mechanism regulating neuronal growth by brain-derived neurotrophic factor. Cytoskeleton. 73 (10), 612-628 (2016).
- Cunha, C., Brambilla, R., Thomas, K. A simple role for BDNF in learning and memory. Frontiers in Mollecular Neuroscience. 3, 1(2010).
- Bronfman, F. C., Lazo, O. M., Flores, C., Escudero, C. A. Spatiotemporal intracelular dynamics of neurotrophin and its receptors. Implications for neurotrophin signaling and neuronal function. Neurotrophic Factor. Handbook of Experimental Pharmacology. Lewin, G., Carter, B. 220, Springer. Berlin, Heidelberg. (2014).
- Ascano, M., Bodmer, D., Kuruvilla, R. Endocytic trafficking of neurotrophins in neural development. Trends in Cell Biology. 22 (5), 266-273 (2012).
- Deinhardt, K., Salinas, S., Verastegui, C., Watson, R., Worth, D., Hanrahan, S., Bucci, C., Schiavo, G. Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway. Neuron. 52 (2), 293(2006).
- Escudero, C. A., et al. c-Jun N-terminal kinase (JNK)-dependent internalization and Rab5-dependent endocytic sorting medaited long-distance retrograde neuronal death induced by axonal BDNF-p75 signaling. Scientific Reports. 9, 6070(2019).
- Vrabec, J. P., Levin, L. A. The neurobiology of cell death in glaucoma. Eye. 21, Suppl 1 11-14 (2007).
- Liot, G., Zala, D., Pla, P., Mottet, G., Piel, M., Saudou, F. Mutant huntingtin alters retrograde transport of TrkB receptors in striatal dendrites. Journal of Neuroscience. 33 (15), 6298-6309 (2013).
- Zhou, B., Cai, Q., Xie, Y., Sheng, Z. H. Snapin recruits dynein to BDNF-TrkB signaling endosomes for retrograde axonal transport and is essential for dendrite growth of cortical neurons. Cell Reports. 2 (1), 42-51 (2012).
- Haubensak, W., Narz, F., Heumann, R., Lessmann, V. BDNF-GFP containing secretory granules are localized in the vicinity of synaptic junctions of cultured cortical neurons. Journal of Cell Science. 111 (11), 1483-1493 (1998).
- Adachi, N., et al. Glucocorticoid affects dendritic transport of BDNF-containing vesicles. Scientific Reports. 5, 12684(2015).
- Biocompare: The Buyer's Guide for Life Scientists. Mirus Bio. Cellular Toxicity Caused by Transfection: Why is it important. , Available from: https://www.biocompare.com/Bench-Tips/121111-Cellular-Toxicity-Caused-by-Transfection-Why-is-it-important/ (2012).
- Zhao, L., et al. Mechanism underlying activity-dependent insertion of TrkB into the neuronal surface. Journal of Cell Science. 122 (17), 3123-3136 (2009).
- Zhao, X., Zhou, Y., Weissmiller, A., Pearn, M., Mobley, W., Wu, C. Real-time imaging of axonal transport of quantum dot-labeled BDNF in primary neurons. Journal of Visualized Experiments. 91, 51899(2014).
- Sung, K., Maloney, M., Yang, J., Wu, C. A novel method for producing mono-biotinylated, biologically active neurotrophic factors: an essential reagent for single molecule study of axonal transport. Journal of Neuroscience Methods. 200 (2), 121-128 (2011).
- Deerinck, T. The application of fluorescent quantum dots to confocal, multiphoton and electron microscopic imaging. Toxicologic Pathology. 36 (1), 112-116 (2008).
- Unsain, N., Nuñez, N., Anastasia, A., Mascó, D. H. Status epilepticus induces a TrkB to p75 neurotrophin receptor switch and increases brain-derived neurotrophic factor interaction with p75 neurotrophon receptor: an initial event in neuronal injury induction. Neuroscience. 154 (3), 978-993 (2008).
- Walker, J. M. The bicinchoninic acid (BCA) assay for protein quantitation. Methods Mol Biol. 32, 5-8 (1994).
- Moya-Alvarado, G., Gonzalez, A., Stuardo, N., Bronfman, F. C. Brain-derived neurotrophic factor (BDNF) regulates Rab5-positive early endosomes in hippocampal neurons to induce dendritic branching. Frontiers in Cellular Neuroscience. 12, 493(2018).
- Sasi, M., Vignoli, B., Canossa, M., Blum, R. Neurobiology of local and intercellular BDNF signaling. Pflugers Archiv European Journal of Physiology. 469 (5), 593-610 (2017).
- Gonzalez, A., Lazo, O. M., Bronfman, F. C. The Rab5-Rab11 endosomal pathway is required for BDNF-induced CREB transcriptional regulation in neurons. , Available from: https://www.biorxiv.org/content/10.1101/844720v1 (2019).
- Mowla,, et al. Biosynthesis and post-translational processing of the precursor to brain-derived neurotrophic factor. Journal of Biological Chemistry. 276 (16), 12660-12666 (2001).
- Longo, P., Kavran, J., Kim, M. S., Leahy, D. Transient Mammalian Cell Transfection with Polyethyleneimine (PEI). Methods in Enzymology. 529, 227-240 (2013).
- Raymond, C., Tom, R., Perret, S., Moussouami, P., L'Abbé, D., St-Laurent, G., Durocher, Y. A simplified polyethyleneimine-mediated transfection process for large-scale and high-throughput applications. Methods. 55 (1), 44-51 (2011).
- Dalton, A., Barton, W. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Hunter, M., Yuan, P., Vavilala, D., Fox, M. Optimization of protein expression in mammalian cells. Current Protocols in Protein Science. 95 (1), 77(2019).
- Stepanenko, A. A., Heng, H. H. Transient and stable vector transfection: Pitfalls, off-target effects, artifacts. Mutation Research. 773, 91-103 (2017).
- Guerzoni, L. P., Nicolas, V., Angelova, A. In vitro modulation of TrkB receptor signaling upon sequential delivery of curcumin-DHA loaded carriers towards promoting neuronal survival. Pharmaceutical Research. 34 (2), 492-505 (2017).
- Angelova, A., Angelov, B. Dual and multi-drug delivery nanoparticles towards neuronal survival and synaptic repair. Neural Regeneration Research. 12 (6), 886-889 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon