Method Article
Ein verbessertes Protokoll zur Reinigung und direkt Mono-Biotinylat Rekombinanten BDNF in einer Tube für Zelllandhandel Studien in Neuronen
In diesem Artikel
Zusammenfassung
Rekombinantes BDNF, das eine Avi-Sequenz (BDNFAvi) enthält, wird in HEK293-Zellen kostengünstig hergestellt und durch Affinitätschromatographie gereinigt. BDNFavi wird dann direkt mit dem Enzym BirA in einer Röhre mono-biotinyliert. BDNFavi und monobiotinyd BDNFavi behalten ihre biologische Aktivität im Vergleich zu kommerziell erhältlichen BDNF.
Zusammenfassung
Rekombinantes BDNF, das eine Avi-Sequenz (BDNFAvi) enthält, wird in HEK293-Zellen hergestellt und dann kostengünstig durch Affinitätschromatographie gereinigt. Ein reproduzierbares Protokoll wurde entwickelt, um BDNFAvi direkt mit dem Enzym BirA in einer Röhre zu monobiotinylatieren. In dieser Reaktion behält monobiotinylierte BDNFAvi seine biologische Aktivität bei.
Neurotrophine sind zielorientierte Wachstumsfaktoren, die eine Rolle bei der neuronalen Entwicklung und Wartung spielen. Sie erfordern schnelle Transportmechanismen entlang des endozytischen Weges, um Fernsignale zwischen verschiedenen neuronalen Kompartimenten zu ermöglichen. Die Entwicklung molekularer Werkzeuge zur Untersuchung des Handels mit Neurotrophinen hat die präzise Verfolgung dieser Proteine in der Zelle mit Hilfe von In-vivo-Aufnahmen ermöglicht. In diesem Protokoll haben wir ein optimiertes und kostengünstiges Verfahren zur Herstellung von monobiotinyliertem BDNF entwickelt. Eine rekombinante BDNF-Variante, die eine biotinylable Avi-Sequenz (BDNFAvi) enthält, wird in HEK293-Zellen im Mikrogrammbereich hergestellt und dann in einem leicht skalierbaren Verfahren mittels Affinitätschromatographie gereinigt. Der gereinigte BDNF kann dann durch eine direkte In-vitro-Reaktion mit dem Enzym BirA in einer Röhre homogen mono-biotinyliert werden. Die biologische Aktivität des monobiotinylierten BDNF (mbtBDNF) kann zu Streptavidin-konjugiert werden. BDNFAvi und mbtBDNF behalten ihre biologische Aktivität, die durch den Nachweis nachgeschalteter phosphorylierter Targets unter Verwendung von Western Blot bzw. Aktivierung des Transkriptionsfaktors CREB nachgewiesen wurde. Mit Streptavidin-Quantenpunkten konnten wir mbtBDNF-Internalisierung gleichzeitig mit der Aktivierung von CREB visualisieren, die mit einem Phospho-CREB-spezifischen Antikörper nachgewiesen wurde. Darüber hinaus eignete sich mbtBDNF konjugiert zu Streptavidin-Quantenpunkten für retrograde Transportanalysen in kortikalen Neuronen, die in mikrofluidischen Kammern angebaut wurden. So ist mbtBDNF in Derröhre ein zuverlässiges Werkzeug, um physiologische Signalisierungsdynamik und Handel mit Neuronen zu untersuchen.
Einleitung
Neuronen sind die funktionellen Einheiten des Nervensystems, die über eine komplexe und spezialisierte Morphologie verfügen, die synaptische Kommunikation und damit die Erzeugung von koordiniertem und komplexem Verhalten als Reaktion auf verschiedene Reize ermöglicht. Neuronale Projektionen wie Dendriten und Axone sind kritische strukturelle Merkmale, die in der neuronalen Kommunikation beteiligt sind, und Neurotrophine sind entscheidende Akteure bei der Bestimmung ihrer Morphologie und Funktion1. Neurotrophine sind eine Familie von sezernierten Wachstumsfaktoren, die NGF, NT-3, NT-4 und Gehirn-abgeleiteten neurotrophen Faktor (BDNF)2umfassen. Im Zentralnervensystem (ZNS) beteiligt sich BDNF an verschiedenen biologischen Prozessen wie Neurotransmission, dendritische Arborisierung, Reifung der dendritischen Stacheln, Langzeitpotenzierung, unter anderem3,4. Daher spielt BDNF eine entscheidende Rolle bei der Regulierung der neuronalen Funktion.
Verschiedene zelluläre Prozesse regulieren die Dynamik und Funktion des BDNF. Auf der neuronalen Oberfläche bindet BDNF die Tropomyosin-Rezeptorkinase B (TrkB) und/oder den p75-Neurotrophinrezeptor (p75). BDNF-TrkB und BDNF-p75 Komplexe sind endocytosed und sortiert in verschiedenen endozytischen Organellen5,6,7,8. Korrekter intrazellulärer Handel des BDNF/TrkB-Komplexes ist für die korrekte BDNF-Signalisierung in verschiedenen neuronalen Schaltkreisen9,10,11erforderlich. Aus diesem Grund ist ein tiefes Verständnis der BDNF-Handelsdynamik und ihrer Veränderungen in pathophysiologischen Prozessen unerlässlich, um BDNF-Signale in Gesundheit und Krankheit zu verstehen. Die Entwicklung neuer und spezifischer molekularer Instrumente zur Überwachung dieses Prozesses wird dazu beitragen, diesen Bereich voranzubringen und ein besseres Verständnis der beteiligten Regulierungsmechanismen zu ermöglichen.
Es gibt mehrere Werkzeuge für die Studie des BDNF-Handels mit Neuronen. Eine häufig verwendete Methodik beinhaltet die Transfektion von rekombinantem BDNF, das mit fluoreszierenden Molekülen wie grünem fluoreszierendem Protein (GFP) oder der monomeren fluoreszierenden rot verschiebbaren Variante von GFP mCherry12,13getaggt ist. Jedoch, ein großes Manko der BDNF Überexpression ist, dass es die Möglichkeit der Bereitstellung bekannter Konzentrationen dieses Neurotrophin eliminiert. Auch, Es kann zu zellulären Toxizität führen, verdecken die Interpretation der Ergebnisse14. Eine alternative Strategie ist die Transfektion eines mit Epitopen markierten TrkB, wie Flag-TrkB. Diese Methode ermöglicht die Untersuchung der TrkB Internalisierungsdynamik15, aber es beinhaltet auch Transfektion, die zu veränderten TrkB-Funktion und zellulärer Toxizität führen könnte. Um diese methodischen Hürden zu überwinden, wurden rekombinante Varianten von NGF und BDNF mit einer Avi-Sequenz (BDNFAvi), die durch das Biotinligase-Enzym BirA monobiotinyliert werden kann,entwickelt 16,17. Biotinyliertes rekombinantes BDNF kann mit verschiedenen Streptavidin-gebundenen Werkzeugen gekoppelt werden, darunter Fluorophore, Perlen, paramagnetische Nanopartikel, unter anderem zum Nachweis. In Bezug auf die Live-Zell-Bildgebung sind Quantenpunkte (QD) häufig verwendete Fluorophore geworden, da sie wünschenswerte Eigenschaften für die Verfolgung von Einzelpartikeln haben, wie erhöhte Helligkeit und Beständigkeit gegen Photobleichungen im Vergleich zu kleinen Molekülfluorophoren18.
Die Produktion von monobiotinyliertem BDNF (mbtBDNF) mit BDNFAvi wurde durch ko-Transfektion von Plasmiden erreicht, die die Expression von BDNFAvi und BirA antreiben, gefolgt von der Reinigung des rekombinanten Proteins durch Affinitätschromatographie mit einer Ausbeute von 1-2 g BDNF pro 20 ml HEK293-konditionierte Kulturmedien17. Hier schlagen wir eine Änderung dieses Protokolls vor, die eine BDNFAvi-Reinigung von 500 ml HEK293-konditionierten Medien ermöglicht, die darauf abzielt, die Proteinrückgewinnung in einem chromatographie-spaltenbasierten Protokoll zu maximieren, um die Manipulation zu erleichtern. Das verwendete Transfektionsmittel Polyethylenimimin (PEI) sorgt für ein kostengünstiges Verfahren ohne Einbußen bei der Transfektionsausbeute. Der Monobiotinylisierungsschritt wurde an eine In-vitro-Reaktion angepasst, um die Mittransfektionen zu vermeiden und eine homogene Kennzeichnung von BDNF zu gewährleisten. Die biologische Aktivität des mbtBDNF wurde durch western blot und fluorescence mikroskopische Experimente demonstriert, einschließlich der Aktivierung von pCREB und Live-Zell-Bildgebung, um retrograde axonale Transport von BDNF in mikrofluidischen Kammern zu untersuchen. Die Verwendung dieses Protokolls ermöglicht eine optimierte, ertragreiche Produktion homogener monobiotinylierter und biologisch aktiver BDNF.
Protokoll
Alle Versuche wurden in Übereinstimmung mit den genehmigten Leitlinien von CONICYT (Chilean National Commission for Scientific and Technological Research) durchgeführt. Die in dieser Studie verwendeten Protokolle wurden von den Ausschüssen für Biosicherheit und Bioethik und Tierschutz der Pontificia Universidad Catélica de Chile genehmigt. Versuche mit Wirbeltieren wurden vom Ausschuss für Bioethik und Tierschutz der Pontificia Universidad Catélica de Chile genehmigt.
HINWEIS: Das folgende Protokoll wurde entwickelt, um BDNFAvi von einem Gesamtvolumen von 500 ml konditioniertem Medium zu reinigen, das in HEK293-Zellen hergestellt wird. Die Menge an konditioniertem Medium, das zur Reinigung von BDNFAvi produziert und verarbeitet wird, kann bei Bedarf hoch- oder herunterskaliert werden. Unter diesen Umständen kann jedoch eine weitere Optimierung erforderlich sein. Die Zusammensetzung der Kulturmedien und Puffer, die im gesamten Protokoll verwendet werden, finden sich in ergänzenden Materialien.
1. Herstellung und Reinigung von BDNFAvi aus HEK293-konditionierten Medien
- Transfektion von HEK293-Zellen
- Wachsen Sie HEK293-Zellen bis 70% Zusammenfluss in ergänztem DMEM-Medium (10% Rinder-fetales Serum, 1x Glutamat-Ergänzung, 1x Antimycotic) in 15 cm Kulturgerichten bei 37 oC.
- Ändern Sie das Medium in den Transfektionspuffer.
- Bereiten Sie die PEI-DNA-Mischung für die Transfektion vor. Verwenden Sie zwei verschiedene 15 ml konische Röhren, um DNA bzw. PEI 25 K zu verdünnen. Verdünnen Sie 20 g Plasmid-DNA in einem Endvolumen von 500 l in einem Röhrchen. Verdünnen Sie 60 g lineares PEI 25K in einem Endvolumen von 500 l in der anderen Röhre. Bei Raumtemperatur 5 min inkubieren.
- Pipette die DNA-Lösung vorsichtig in das PEI-Rohr, einmal durch Up-Down-Bewegung mischen. Bei Raumtemperatur 25 min inkubieren.
- 1 ml der PEI-DNA-Mischung durch jede 15 cm Schale abtropfen lassen. Inkubieren Sie die Zellen mit der PEI-DNA-Mischung für 3 h bei 37 oC.
- Ändern Sie den mittleren in einen neuen Inkubationspuffer.
- Mediensammlung und -speicherung
- Sammeln Sie das Medium von allen Gerichten 48 h nach der Transfektion von HEK293 Zellen. Bereiten Sie konzentrierte Bestände der Lösungen vor, die im Abschnitt "Überstand-Modifikationspuffer" der Zusatzdatei 1 beschrieben sind, und fügen Sie sie dem HEK293-Überstand hinzu, um die aufgeführten Endkonzentrationen zu erreichen.
HINWEIS: Zellen können zur weiteren Analyse verworfen oder wiederhergestellt werden. - Inkubieren Sie das Medium im Eis für 15 min.
- Aliquot das Medium in Zentrifugenröhren.
- Zentrifugieren Sie das Medium bei 10.000 x g für 45 min in einer 4 °C Zentrifuge. Dieser Schritt ermöglicht die Beseitigung von Zellablagerungen und abgestorbenen Zellen, die in den Medien ausgesetzt sind.
- Sammeln Sie die Überräube, fügen Sie BSA bei einer endletzten Konzentration von 0,1%. und dann bei -20 °C lagern. Die Medien können vor dem Einfrieren für ein schnelleres Auftauen während des Reinigungsschritts aliquotediert werden.
HINWEIS: Lagerzeiten von gefrorenen konditionierten Medien von bis zu 2 Monaten haben zu positiven Ergebnissen geführt, längere Lagerzeiten wurden nicht ausgewertet.
- Sammeln Sie das Medium von allen Gerichten 48 h nach der Transfektion von HEK293 Zellen. Bereiten Sie konzentrierte Bestände der Lösungen vor, die im Abschnitt "Überstand-Modifikationspuffer" der Zusatzdatei 1 beschrieben sind, und fügen Sie sie dem HEK293-Überstand hinzu, um die aufgeführten Endkonzentrationen zu erreichen.
- Medienkonzentration und -reinigung
- Das Medium in einem 37 °C thermoregulierten Bad auftauen.
- Aliquot die Medien in Zentrifugenröhren.
- Zentrifugieren Sie das Medium für 1 h bei 3.500 x g in einer 4 °C gekühlten Zentrifuge. Dieser Schritt ermöglicht die Beseitigung der verbleibenden Zellablagerungen, um einen ausreichenden Durchfluss durch die Chromatographiesäule zu gewährleisten.
- Verwenden Sie die Proteinkonzentratoren mit einem 10 kDa Cutoff, um die Medien von 500 ml auf 100 ml zu reduzieren. Befolgen Sie die vom Hersteller empfohlenen Zentrifugationsparameter für eine optimale Konzentration.
- Fügen Sie den konzentrierten Medien 500 L Ni-NTA-Agaroseperlen hinzu und in einer Wippe über Nacht bei 4 °C inkubieren.
- Montieren Sie das Chromatographiegerät und gießen Sie die Medien hinein. Lassen Sie es für 5 min ruhen und öffnen Sie dann den 2-Wege-Stopphahn, um das Medium durchfließen zu lassen.
- Waschen Sie die Perlen mit 5 ml Waschpuffer für 5 min. Achten Sie darauf, die Perlen in der Säule wieder auszusetzen. Entleeren Sie den Waschpuffer, indem Sie den 2-Wege-Stopphahn öffnen. Wiederholen Sie dies 3 Mal.
- Fügen Sie der Spalte 1 ml Elutionspuffer hinzu. Stellen Sie sicher, dass die Perlen in der Spalte erneut angehalten werden. 15 min inkubieren und dann das Eluat in einem 1,5 ml Mikrozentrifugenrohr sammeln. Wiederholen Sie diesen Schritt 3 Mal für die vollständige Elution von BDNFAvi.
- Laden Sie jeweils 5 l l und verschiedene Konzentrationen von handelsüblichem BDNF (40-160 ng) in ein 15% Polyacrylamid-Gel. Erkennen Sie das gereinigte Protein durch Western-Blotting mit einem Anti-BDNF-Antikörper.
- Bestimmen Sie die Konzentration des gereinigten BDNFAvi in jedem Eluat anhand der mit dem handelsüblichen BDNF erstellten Konzentrationskurve.
- Aliquot und lagern Sie den gereinigten BDNFAvi bei -80 °C.
2. In vitro In-vitro-Monobiotinylierung von BDNFAvi mit dem BirA-Enzym
-
In vitro In-vitro-Monobiotinylierungsreaktion
- Bereiten Sie konzentrierte Lagerlösungen der Biotinylierungspufferreagenzien vor. Die Verwendung konzentrierter Bestände wird die Verdünnung des rekombinanten Proteins minimieren.
- Nehmen Sie ein Aliquot von 800 ng BDNFAvi und fügen Sie die Biotinylierungspufferreagenzien und das Enzym BirA in einem 1:1-Molaren-Verhältnis zu BDNF hinzu. Zum Beispiel für eine 200 L Endreaktionsvolumen hinzufügen; 100 l Lösung mit 800 ng BDNFAvi, 20 l Bicine 0,5 M pH 8,3, 20 l ATP 100 mM, 20 l MgOAc 100 mM, 20 l d-Biotin 500 m, 0,8-1 bis 1 l BirA-GST und komplett auf 200 l mit Ultrareinstwasser.
HINWEIS: Erfolgreiche Biotinylierungsreaktionen wurden mit Aliquots von 400 l durchgeführt, die eine Konzentration von etwa 30 ng/L BDNFAvi enthielten, was zu einer homogen biotinylierten BDNFAvi zu einer Endkonzentration von 20 ng/l in der Endreaktion führte. - Inkubieren Sie die Mischung bei 30 °C in einem Hybridisierungsofen für 1 h. Mischen Sie den Inhalt durch Rohrinversion alle 15 min.
- Fügen Sie das gleiche Volumen von ATP und BirA wie in Schritt 2.1.2 hinzu und wiederholen Sie Schritt 2.1.3.
- Bei -80 °C für zukünftige Analysen aufbewahren oder für den sofortigen Gebrauch auf Eis halten (z.B. Qualitätskontrolle der Biotinylierung).
- Biotinylierungsanalyse
- Block 30 l Streptavidin magnetische Perlen pro BDNF-Probe in 1 ml Sperrpuffer. Inkubieren Bei Raumtemperatur für 1 h in einem Mikrozentrifugenrohrrotator.
- Die magnetischen Perlen mit einem magnetischen Trennträger für 3 bis 5 Minuten oder bis der Puffer vollständig von den Perlen gelöscht erscheint, austreten und den Sperrpuffer entsorgen.
- Fügen Sie den Perlen 50 L frischen Sperrpuffer und 80 ng monobiotinylierte BDNFAvi (mbtBDNF) Probe hinzu, um sie vollständig durch Rohrleitung wieder auszusetzen.
- Inkubieren Bei 4 °C für 1 h in einem Mikrozentrifugenrohrrotator, der sich bei ca. 20 U/min dreht.
- Sammeln Sie die Perlen mit dem magnetischen Trennträger für 3 bis 5 Minuten, und sammeln Sie den Überstand, wobei ein 30 L Aliquot für die Analyse gehalten wird.
- Waschen Sie die Perlen einmal mit 500 L PBS, und sammeln Sie sie dann mit dem magnetischen Trennträger für 3 bis 5 Minuten. Stellen Sie den Überstand wieder her und halten Sie einen 30-L-Aliquot für die Analyse.
- Fügen Sie den Perlen 10 L 4x Ladepuffer hinzu.
- Erhitzen Sie die Proben auf 97 °C für 7 min, um den mbtBDNF zu elute.
- Detektieren MbtBDNF mit einem Anti-BDNF-spezifischen Antikörper19.
3. Überprüfung der biologischen Aktivität von mbtBDNF
- Detektion von pTrkB und pERK durch Western Blot.
- Samen 2 Millionen Ratte kortikale Neuronen in 60 mm Kulturgerichte.
- Kultur die Neuronen für 7 Tage (DIV7). Ändern Sie dann das Medium zu nicht-supplementierten neurobasalen Mediun, wenn Sie das Experiment starten.
- Eine Stunde nach mittlerem Wechsel, fügen Sie mbtBDNF zu einer endgültigen Konzentration von 50 ng/ml hinzu. 30 min bei 37 oC inkubieren. Bewahren Sie eine negative Kontrollschale (nicht stimuliert mit BDNF) und eine Positivkontrollschale (behandelt mit 50 ng/ml handelsüblichen BDNF).
- Sammeln Sie das Medium und waschen Sie jede Schale vorsichtig mit 1x PBS. Sammeln und entsorgen Sie die 1x PBS.
- Legen Sie die Gerichte auf Eis und fügen Sie 50-80 L LysePuffer zu jedem Gericht. Verwenden Sie einen Zellschaber, um die Zellen zu lysieren.
HINWEIS: Der Lyseschritt sollte so schnell wie möglich durchgeführt werden, um Proteindephosphorylierung und Abbau zu vermeiden. 1-2 Minuten kräftiges Kratzen reichen aus, um die Proteine von Interesse durch western Blotting zu visualisieren. - Sammeln Sie den Lysepuffer und rühren Sie einen Wirbelmischer mit höchster Geschwindigkeit für 5 s.
- Zentrifugieren Sie den Lysepuffer bei 14.000 x g (4 °C) für 10 min. Den Überstand sammeln.
- Quantifizieren Sie den Proteingehalt des Überstandes durch bcA-Proteinquantifizierungsprotokoll20.
- Fügen Sie einen Ladepuffer zu einem Aliquot hinzu, der 30-50 g Protein pro Zustand enthält, und laden Sie es in ein 12% Polyacrylamid-Gel für die westliche Blotting. Nachweis von pTrkB und pERK mit spezifischen Phospho-Antikörpern zur Überprüfung der biologischen Aktivität von BDNFAvi.
- Überprüfung der biologischen BdNF-QD-Aktivität durch pCREB-Immunfluoreszenz.
- Samen 40.000 kortikale Minenkern in 10 mm Abdeckungen, zuvor autoklaviert und mit Poly-L-Lysin behandelt, wie zuvor beschrieben21.
- Kultur die Neuronen für 7-8 Tage in neuronalen Erhaltungspuffer (siehe zusätzliche Materialien) bei 37 oC.
- Um das Experiment zu starten, ändern Sie das Medium auf ein unkompestiertes neurobasales Medium und brüten bei 37 oC für 1 h.
- Bereiten Sie mbtBDNF konjugiert mit Quantenpunkten (BDNF-QD) vor, indem Sie zu einem mbtBDNF aliquot das notwendige Volumen des Quantenpunkt-Streptavidin-Konjugats (Streptavidin-QD) hinzufügen, um ein 1:1 BDNF-QD-Molar-Verhältnis zu erreichen. Dann mit neurobasalem Medium auf 20 l verdünnen. Wickeln Sie das Rohr in Aluminiumfolie, um es vor dem Licht zu schützen.
ANMERKUNG: Bereiten Sie eine weitere Röhre mit dem gleichen Volumen von Quantenpunkt-Streptavidin-Konjugat vor und verdünnen Sie sie auf 20 l mit neurobasalem Medium als Negativkontrolle. - Die mbtBDNF/ streptavidin-QD-Mischung 30 min bei Raumtemperatur in einer Wippe inkubieren.
- Den BDNF-QD im neurobasalen Medium auf die gewünschte Endkonzentration (200 pM und 2 nM) verdünnen.
- Nach 1 h Inkubation mit nicht-supplementiertem neurobasalen Medium, stimulieren Sie die Neuronen mit BDNF-QD oder Streptavidin-QD (Kontrolle) zu einer Endkonzentration von 200 pM und 2 nM BDNF für 30 min bei 37 °C.
- Waschen Sie die Deckellipsen dreimal mit 1x PBS (37 °C) und fixieren Sie die Zellen 15 min, indem Sie den Deckelmitrutsch mit 4% Paraformaldehydlösung behandeln, die Phosphatase-Inhibitoren enthält.
- Waschen Sie die Zellen 3 Mal mit PBS und inkubieren Sie dann mit Blockierung/Permeabilisierungspuffer (BSA 5%, Triton X-100 0.5%, 1x Phosphatase-Inhibitor) für 1 h.
- Inkubieren Sie mit Anti-PCREB-Antikörper 1:500 (in 3% BSA, 0,1% Triton X-100) über Nacht bei 4 °C.
- Am nächsten Tag 3 mal mit 1x PBS waschen und 1 h mit dem Sekundärantikörper 1:500 (3% BSA, 0,1% Triton X-100) inkubieren.
- Waschen Sie 3 mal mit 1x PBS. Fügen Sie Hoechst Kernflecklösung (5 g/ml) für 7 min.
- Waschen Sie 3 mal mit 1x PBS und montieren.
- Visualisierung des retrograden axonalen Transports von BDNF-QD in lebenden Neuronen
- Bereiten Sie mikrofluidische Kammern und Samenneuronen wie zuvor beschrieben16.
- Nach 7-8 Tagen in der Kultur, ändern Sie das Medium zu nicht-supplementierten neurobasalen Medium.
- Bereiten Sie mbtBDNF konjugiert mit Quantenpunkten (BDNF-QD) vor, indem Sie zu einem mbtBDNF aliquot das notwendige Volumen des Quantenpunkt-Streptavidin-Konjugats (Streptavidin-QD) hinzufügen, um ein 1:1 BDNF-QD-Molar-Verhältnis zu erreichen. Dann mit neurobasalem Medium auf 20 l verdünnen. Wickeln Sie das Rohr in Aluminiumfolie, um es vor dem Licht zu schützen.
ANMERKUNG: Bereiten Sie eine weitere Röhre mit dem gleichen Volumen von Quantenpunkt-Streptavidin-Konjugat vor und verdünnen Sie sie auf 20 l mit neurobasalem Medium als Steuerung. - Die mbtBDNF/ streptavidin-QD-Mischung 30 min bei Raumtemperatur in einer Wippe inkubieren.
- Den BDNF-QD auf die gewünschte Endkonzentration (2 nM) verdünnen.
- Nach 1 h Inkubation mit nicht-supplementiertem neurobasalen Medium fügen Sie den BDNF-QD oder die Kontrollmischung in die axonalen Fächer der mikrofluidischen Kammer ein. Inkubieren Sie für 210 min bei 37 °C, um einen Netto-Retrograde-Transport von BDNF-QD zu gewährleisten.
- Für die Live-Zell-Bildgebung visualisieren Sie den axonalen Retrograde-Transport im Segment der Mikrogrooves, das proximal zum Zellkörperfach ist, mit einem 100-fachen Objektiv mit einem dafür geeigneten Mikroskop (37 °C und 5% CO2). Erfassen Sie Bilder mit 1 Frame/s.
Ergebnisse
Die Verwendung eines chromatographischen säulenbasierten Protokolls ermöglicht die Verarbeitung signifikanter Volumina von HEK293 konditionierten Medien. In Abbildung 1werden die Ergebnisse der Reinigung von BDNFAvi aus 500 ml konditionierter Medien dargestellt. Konselutionen von BDNFAvi aus den Ni-NTA Agarose Perlen ergeben abnehmende Konzentrationen von BDNFAvi (Abbildung 1A). Nach vier aufeinanderfolgenden Elutionen (jeweils 15 min) wird der Großteil der von den Perlen erfassten BDNF wiederhergestellt. Die Konzentrationen der Eluate liegen zwischen 6 und 28 ng/l, und die Gesamtausbeute betrug ca. 60 g BDNFAvi (Tabelle 1). Der produzierte BDNFAvi wurde dann effizient durch eine von BirA-GST vermittelte In-vitro-Reaktion biotinyliert, wie der Mangel an nicht-biotinyliertem BDNFAvi im Überstand zeigt (Abbildung 1B). Bitte beachten Sie, dass die in Abbildung 1B dargestellte Biotinylierung einem Aliquot des gesamten produzierten BDNF entspricht, die Reaktion jedoch für größere Volumina skaliert werden kann.
Anschließend wurde die biologische Aktivität von mbtBDNF anhand von 2 verschiedenen experimentellen Ansätzen bewertet. Zuerst wurden kortikale Neuronen, die in 60 mm Platten (2 Millionen Neuronen, DIV7) gesät waren, mit 50 ng/ml mbtBDNF für 30 min stimuliert und dann Proteine für die Western-Blot-Analyse vorbereitet. Die biologische Aktivität des mbtBDNF wurde durch den Nachweis von pTrkB (Y515) und pERK (T202/Y204) quantifiziert. Die Bindung von BDNF an TrkB löst die Aktivierung des Rezeptors durch eine Autophosphorylierungsreaktion in seiner intrazellulären Domäne aus, und ERK ist ein bekanntes Ziel des BDNF-Signalwegs22. Die Bänder für beide phosphorylierten Proteine hatten eine ähnliche Intensität in Neuronen, die mit kommerziellen BDNF und mbtBDNF behandelt wurden, und beide zeigten ein stärkeres Signal als kontrollierbar (Abbildung 2A). Anschließend wurde die biologische Aktivität von mbtBDNF gekoppelt mit Streptavidin-QD ausgewertet, um zu zeigen, dass sie in Live-Bildgebungsexperimenten verwendet werden können. Kortikale Neuronen wurden in 10 mm Abdeckungen (40.000 Zellen pro Abdeckung, DIV7) gesät und mit einer Endkonzentration von 200 pM oder 2 nM BDNF-QD für 30 min behandelt, bevor sie pCREB fixieren und färben. CREB ist ein Transkriptionsfaktor, der von aktivierten ERK1/2 in kortikalen Neuronen22,23ins Visier genommen wird. Die Stimulierung von Neuronen mit zunehmenden Konzentrationen von BDNF-QD führte zu einer dosisabhängigen Erhöhung der Phosphorylierung von CREB und dem Vorhandensein von QD-Partikeln, die den Zellkern umgeben (Abbildung 2B), was darauf hindeutet, dass die BDNF-QD-Partikel endozytosiert waren und die Aktivierung von Signalwegen im Zusammenhang mit der BDNF-vermittelten TrkB-Aktivierung auslösten. Bei der Stimulierung von Neuronen mit einer geringen Konzentration von BDNF-QD (200 pM) wurde eine zweifache Erhöhung des pCREB-Signals festgestellt, während die Stimulierung mit 2 nM zu einer 3,5-fachen Erhöhung des pCREB-Signals führte (Abbildung 2C). Diese Ergebnisse zeigen, dass der biotinylatierte BDNFAvi biologisch aktiv ist und dass es seine Aktivität nicht verliert, wenn es an Streptavidin-QD gekoppelt ist, was es für Immunfluoreszenz und Live-Zell-Bildgebung geeignet macht.
Schließlich wurde das bildgebende Potenzial von BDNF-QD in kompartalisierten Kulturen mit mikrofluidischen Kammern untersucht. Kortikale Neuronen wurden in mikrofluidischen Kammern (15 mm Abdeckungen, 50.000 Neuronen pro mikrofluidischer Kammer, DIV7), um die axonalen und somatodendritischen Fächer zu trennen und wurden mit 2 nM BDNF-QD für 3,5 h stimuliert. Es wurde eine Live-Zellmikroskopie durchgeführt, und die resultierenden Kymographen wurden verwendet, um die Geschwindigkeit von BDNF-QD mit Organellen zu quantifizieren (Abbildung 3A). Es wurde eine durchschnittliche gleitende Geschwindigkeit von 0,91 m/s festgestellt (Abbildung 3B), was im Einklang mit früheren Analysen des zytoplasmatischen Dynein-vermittelten Transports7,16entspricht. Mikrofluidische Kammern, die mit 2 nM Streptavidin-QD behandelt wurden, zeigten keine sich bewegenden QDs in den Mikronuten, wie der Kymograph zeigt (Abbildung 3A). Zellen, die unter den gleichen Bedingungen angebaut wurden, wurden mit 500 pM oder 2 nM BDNF-QD für 210 min stimuliert und dann fixiert und mit einer nuklearen Färbung gekennzeichnet. Wie in Abbildung 3Cdargestellt, zeigen Neuronen eine dosisabhängige Akkumulation von BDNF-QD in allen analysierten Unterabteilungen, einschließlich der proximalen und distalen Teile der Mikronut und des somatodendritischen Fachs. Im Gegensatz dazu zeigten Kontrollneuronen fast kein QD-Signal in der gesamten Kammer. Daher kann der BDNF-QD in lebenden und festen Zellen in mikrofluidischen Kammern nachgewiesen werden.
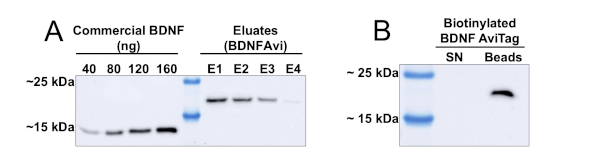
Abbildung 1: Produktion und Monobiotinylierung von BDNFAvi in HEK293-Zellen. HEK293-Zellen wurden mit dem PEI-Reagenz und einem BDNFAvi-Kodierungsplasmid transfiziert und das konditionierte Medium wurde nach 48 h gesammelt. BDNFAvi enthält ein 6-faches Histidin-Tag, das eine Reinigung mittels Nickel-Nitrilotriatsäure (Ni-NTA)-Chromatographie ermöglicht. Kommerziell erhältliche rekombinante humane BDNF hat ein erwartetes Molekulargewicht von 13 kDa, während BDNFAvi ein Molekulargewicht von 18 kDa anzeigt. BDNFAvi, das an das Harz gebunden war, wurde mit vier aufeinanderfolgenden Elutionsschritten vollständig eluiert. (A) Western Blot mit Anti-BDNF-Antikörpern, um im Haus vorbereitete rekombinante BDNF und kommerzielle BDNF zu erkennen. Aliquots, die bekannte Mengen an kommerziell erhältlichem humanem BDNF und 5 l jedes Eluats enthalten, wurden in ein SDS-PAGE-Gel geladen, um BDNFAvi mit einem Antikörper gegen BDNF zu detektieren. Tabelle 1 zeigt die Konzentrationen von BDNFAvi, die in jedem Eluat vorhanden sind. Die Menge und Konzentration von BDNF in jedem Eluat wurde durch densitometrische Analyse und Interpolation aus der Konzentrationskurve des kommerziell erhältlichen BDNF ermittelt. (B) Überprüfung der BDNFAvi-Biotinylierung. Achtzig Nanogramm biotinylierter BDNFAvi (mbtBDNF) wurden mit 30 L Streptavidin gekoppelt mit magnetischen Perlen (20% Gülle) für 1 Stunde bei 4 °C inkubiert. Dann wurden magnetische Perlen mit einem magnetischen Separator isoliert. Die Streptavidinperlen wurden mit Ladepuffer erhitzt, um die biotinylierte BDNFAvi (Perlengasse) zu entleeren. Der Überstand (SN-Spur) wurde ebenfalls mit Ladepuffer behandelt, erhitzt und im Gel (SN-Spur) geladen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
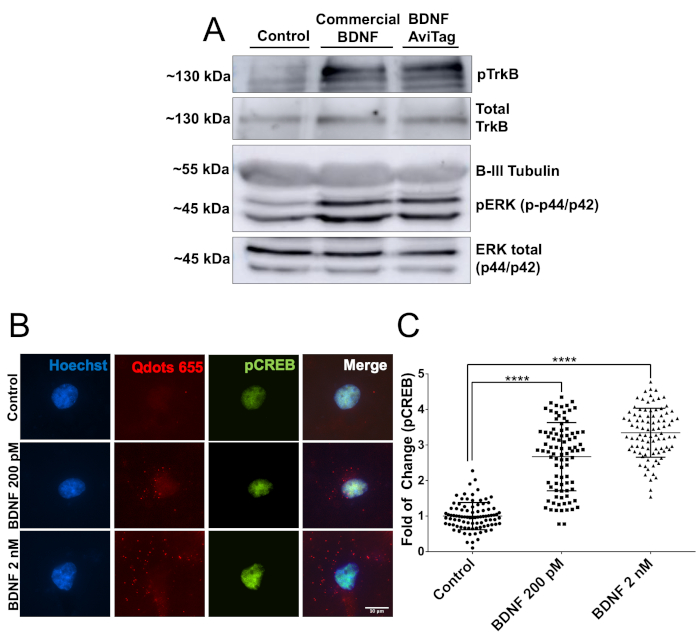
Abbildung 2: Überprüfung der biologischen Aktivität von mbtBDNF. (A) DIV7 kortikale Neuronen wurden 1 h lang verhungert, und dann mit 50 ng/ml handelsüblichen BDNF oder mbtBDNF für 30 min stimuliert. Proteine wurden extrahiert und in ein SDS-PAGE-Gel zur Analyse von TrkB- und ERK1/2-Phosphorylierung mit phosphospezifischen Antikörpern geladen und im Vergleich zu den Gesamtmengen des Proteins mit Antikörpern gegen die gesamte TrkB und ERK1/2. (B) DIV7 kortikale Neuronen wurden 1 h lang serumgehungert und dann mit einer Endkonzentration von 200 pM oder 2 nM mbtBDNF gekoppelt an Streptavidin-QD (BDNF-QD) für 30 min stimuliert. Dann wurden Zellen fixiert und pCREB für die Fluoreszenzmikroskopie-Analyse gekennzeichnet. (C) Quantifizierung der nuklearen pCREB-Fluoreszenzintensität. Die Ergebnisse entsprechen 90 Neuronen, die aus 3 unabhängigen Experimenten zusammengefügt werden, die als Mittelwert -SEM dargestellt werden. Die statistische Analyse entspricht einer einseitigen ANOVA mit Tukeys Mehrfachvergleichstest (****p < 0.0001). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Visualisierung von BDNF-QD in lebenden und festen Zellen. (A) DIV7 kortikale Neuronen, die in mikrofluidischen Kammern angebaut wurden, wurden im axonalen Fach mit einer Endkonzentration von 2 nM BDNF-QD für 3,5 Stunden stimuliert, und dann wurde der proximale Teil der Mikrogrooves mit einer Live-Zellmikroskopie-Einstellung abgebildet. Repräsentative Kymographen für den Kontrollzustand (behandelt mit Streptavidin-QD) und bei behandlung mit BDNF-QD werden gezeigt. (B) Quantifizierung der Geschwindigkeit des Bewegens von BDNF-QD. Mobile Puncta wurden definiert als solche, die sich in den 120 s der Aufnahme mehr als 10 m bewegten. (C) DIV7-Kortikale, die in mikrofluidischen Kammern angebaut wurden, wurden im axonalen Fach mit einer Endkonzentration von 500 pM oder 2 nM für 3,5 Stunden stimuliert und dann mit Hoechst fixiert und gekennzeichnet, um die Kerne zu visualisieren. Repräsentative Bilder des somatodendritischen Fachs und der distalen und proximalen Teile der Mikrorillen werden gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Eluate | BDNF (ng) in 5 l | [ng/l] | BdNF insgesamt [g] |
| E1 | 142.2 | 28.4 | 28.4 |
| E2 | 101.2 | 20.2 | 20.2 |
| E3 | 65.6 | 13.1 | 13.1 |
| E4 | 30.4 | 6.1 | 6.1 |
| 67.8 |
Tabelle 1: Quantifizierung der BDNFAvi-Reinigungsausbeute (bezogen auf Abb. 1A). HEK293-Zellen wurden mit einem Plasmid transfiziert, das die BDNFAvi-Expression antreibt, und das Protein wurde durch Ni-NTA-Affinitätschromatographie gereinigt. Die Proteinkonzentration und endausbeute wurde durch densitometrische Analyse und Interpolation in der bekannten Konzentrationskurve des kommerziell erhältlichen rekombinanten humanen BDNF berechnet.
Ergänzende Datei 1: Kulturmedien und Pufferkomponenten Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In diesem Artikel wird eine optimierte Methodik für die Herstellung und Reinigung von mbtBDNF in einem Affinitätschromatographie-basierten Verfahren beschrieben, basierend auf der Arbeit von Sung und Mitarbeitern17. Die Optimierungen umfassen die Verwendung eines kostengünstigen Transfektionsreagenzes (PEI) unter Beibehaltung der Effizienz teurerer Transfektionsmethoden wie Lipofectamin. Diese Optimierung führt zu einer erheblichen Kostensenkung im Protokoll, die Skalierbarkeit bei gleichzeitig hoher Wirtschaftlichkeit ermöglicht. Das Protokoll enthält auch Überlegungen zur Benutzerfreundlichkeit, einschließlich des Einfrierens von konditionierten Medien für bis zu 2 Monate. Diese Optimierungen machen das Verfahren an die Bedürfnisse jedes Labors anpassbar, verbessern die Wirtschaftlichkeit und ergeben homogenes und biologisch aktives rekombinantes BDNF. Das Protokoll kann auch an kleinere Produktionen angepasst werden, indem der Einsatz des Chromatographiegeräts durch die Gravitationsfällung der Perlen in konischen Röhren ersetzt wird. Dies stellt eine praktikable Methode dar, ist aber weniger zeitsparend und hat in unserer Erfahrung zu geringeren Erträgen geführt. Das biotinmarkierte BDNF kann dann an verschiedene streptavidingebundene Sonden gekoppelt werden, einschließlich Fluorophoren und paramagnetischen Nanopartikeln, was es zu einem wertvollen Werkzeug für die Durchführung verschiedener Arten von Experimenten für die Analyse des postendozytischen Handels von BDNF macht. Daher ist ein optimiertes und einfaches Produktionsprotokoll für dieses Protein für Laboratorien, die in diesem Bereich arbeiten, sehr nützlich.
Die Produktion von rekombinanten Proteinen mit komplexen posttranslationalen Modifikationen, wie BDNF24, in prokaryotischen Systemen führt oft zu Proteinen, die nicht richtig gefaltet sind und daher eine schlechte biologische Aktivität haben25. Daher ist die Expression in Säugetierzellen notwendig, um ein bioaktives Protein zu erhalten. Die Verwendung von PEI wurde zuvor als eine praktikable Alternative für die großflächige Produktion von rekombinanten Proteinen in transfizierten Säugetierzellenbeschrieben 25,26, und seine Effizienz bei der Transfektion der HEK293-Zellen im Kontext akademischer Laboratorien wurde27hervorgehoben. Daher stellt die Verwendung dieser Zelllinie eine gültige Option dar, UM BDNFAvi in einem Maßstab zu produzieren, der von einem akademischen Labor verwaltet werden kann. Das vorgeschlagene Protokoll könnte durch die Erzeugung einer HEK293-Zelllinie, die stabil mit BDNFAvi transfiziert wurde, weiter optimiert werden, wodurch der transiente Transfektionsschritt eliminiert würde, wodurch Zeit und Ressourcen gespart würden. Eine weitere mögliche Quelle der Optimierung ist die Verwendung von Zellen in Suspension anstelle von anhaftenden Zellen. HEK293 Zellen können in Suspension gehalten werden, erzeugung erhebliche Mengen an rekombinantem Protein im Bereich von Gramm pro Liter28.
Eine weitere Verbesserung des Protokolls ist die Biotinylierung des BDNFAvi-Proteins mit einer In-vitro-Strategie, die das bisherige In-vivo-Co-Transfektionsprotokoll ersetzt. in vivo Transiente Kotransfektion kann unerwartete Ergebnisse in Bezug auf die Expression der Konstrukte haben, wie in mehreren Zelllinien und mit mehreren Transfektionsreagenzien29nachgewiesen wurde. Verschiedene Faktoren können die Expression transfizierter Proteine in einem Kotransfektionskontext beeinflussen, einschließlich Vektoren, Zelltypen und Plasmidkonzentration. Diese Vielzahl von Faktoren macht Optimierung und Reproduzierbarkeit zu einer komplexen Aufgabe. Andererseits ermöglicht eine In-vitro-Methodik eine bessere Kontrolle der Bedingungen, unter denen die Biotinylierungsreaktion stattfindet. Diese Methode führt zu einer reproduzierbaren und homogenen Kennzeichnung des rekombinanten BDNF.
Wie die mit diesem Protokoll hergestellten biologischen Aktivitätsüberprüfungsexperimente zeigen, ist der mit diesem Protokoll hergestellte mbtBDNF mit dem kommerziell erhältlichen rekombinanten humanen BDNF in Bezug auf die Aktivierung des BDNF-TrkB-Signalwegs vergleichbar. Die Daten zeigen auch, dass die Kopplung von BDNF an Streptavidin-QD die BDNF-TrkB-Signalisierung nicht beeinträchtigt. Darüber hinaus haben wir gezeigt, dass BDNF-QD durch Epifluoreszenzmikroskopie in lebenden und festen Zellen nachgewiesen werden kann. MbtBDNF stellt daher ein wertvolles Instrument zur Untersuchung des retrograden axonalen Handels dar und bietet erhebliche Vorteile gegenüber alternativen Sonden wie BDNF-GFP16. Das in diesem Artikel beschriebene Protokoll bietet eine zuverlässige und konsistente Methodik für die Produktion von mbtBDNF, die dann in post-endozytischen Dynamikstudien in verschiedenen neuronalen Modellen verwendet werden kann, die TrkB oder p75 exemitzen. BDNF Signalisierung hat starke Auswirkungen auf neuronale Morphologie und Funktion3,4,21, und wurde vor kurzem als ein potenzielles therapeutisches Werkzeug vorgeschlagen, um neuronale Regeneration zu verbessern30,31, so dass seine Studie relevant in den Bereichen der Zellbiologie und Biomedizin. Die Untersuchung der Auswirkungen von BDNF-Signalisierung und Menschenhandel wird unser Verständnis der neuronalen Zellbiologie weiter voranbringen und es ermöglichen, sein regeneratives Potenzial im klinischen Umfeld zu nutzen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren würdigen die finanzielle Unterstützung von Fondecyt (1171137) (FCB), dem Basal Center of Excellence in Science and Technology (AFB 170005) (FCB), Millenium-Nucleus (P07/011-F) (FCB), dem Wellcome Trust Senior Investigator Award (107116/Z/15/Z) (GS) und einem UK Dementia Research Foundation (GS). Diese Arbeit wurde von der Unidad de Microscopa Avanzada UC (UMA UC) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2 way stopcock | BioRad | 7328102 | Chromatography apparatus component |
| 2-mercaptoethanol | Sigma | M6250 | BDNF elution buffer |
| Acrylamide/Bisacrylamide | BioRad | 1610154 | SDS-PAGE gel preparation |
| Amicon Ultra-15 10K | Millipore | UFC901024 | BDNF concentration |
| Ammonium Persulfate | Sigma | A9164 | SDS-PAGE gel preparation |
| anti B-III-Tubulin antibody | Sigma | T8578 | Western blot assays for BDNF biological activity detection |
| anti BDNF antibody | Alomone | AGP-021 | Western blot assays for BDNF quantification |
| anti BDNF antibody | Alomone | ANT-010 | Western blot assays for BDNF quantification |
| Anti ERK antibody | Cell Signaling | 9102 | Western blot assays for BDNF biological activity detection |
| anti pCREB antibody (S133) | Cell Signaling | 9198 | Western blot assays for BDNF biological activity detection |
| anti pERK antibody (T202, Y204) | Cell Signaling | 4370 | Western blot assays for BDNF biological activity detection |
| anti pTrkB antibody (Y515) | Abcam | ab109684 | Western blot assays for BDNF biological activity detection |
| Antibiotic/Antimycotic | Gibco | 15240-062 | HEK293 maintenance |
| ATP | Sigma | A26209 | BDNF monobiotinylation buffer |
| B-27 Supplement | Gibco | 17504-044 | Neuron maintenance |
| Bicine | Sigma | B3876 | BDNF monobiotinylation buffer |
| BirA-GST | BPS Bioscience | 70031 | Enzyme for BDNF AviTag monobiotinylation |
| Bovine Fetal Serum | HyClone | HC.SH30396.02 | HEK293 maintenance |
| Bovine Serum Albumin | Jackson ImmunoResearch | 001-000-162 | BDNF buffer modification component, blocking buffer for western blot and immunofluorescence |
| D-Biotin | Sigma | B4639 | BDNF monobiotinylation buffer |
| DMEM High Glucose Medium | Gibco | 11965-092 | Neuron seeding |
| DMEM Medium | Gibco | 11995-081 | HEK293 maintenance |
| Econo Column Funnel | BioRad | 7310003 | Chromatography apparatus component |
| EDTA | Merck | 108418 | |
| EZ-ECL Kit | Biological Industries | 1633664 | Protein detection by western blotting |
| Glutamax | Gibco | 35050-061 | Neuron and HEK293 maintenance |
| Glycerol | Merck | 104094 | BDNF elution buffer, lysis buffer for western blot assays |
| Hettich Rotina 46R Centrifuge | Hettich | Discontinued | Centrifuge used for clearing the medium of debris |
| Hettich Universal 32R Centrifuge | Hettich | Discontinued | Centrifuge used for protein concentrator centrifugation |
| Horse Serum | Gibco | 16050-122 | Neuron seeding |
| ImageQuant LAS 500 | GE Healthcare Life Sciences | 29005063 | Western blot image acquisition |
| Imidazole | Sigma | I55513 | BDNF buffer modification component |
| KCl | Winkler | BM-1370 | PBS component |
| KH2PO4 | Merck | 104873 | PBS component |
| Laminin | Invitrogen | 23017-015 | Cover coating for compartmentalized neurons |
| Luer Tubing Adaptor | BioRad | 7323245 | Chromatography apparatus component |
| Luminata™ Forte Western HRP Substrate | Millipore | WBLUF0100 | Protein detection by western blotting |
| Mg(CH3COO)2 | Merck | 105819 | BDNF monobiotinylation buffer |
| Mowiol 4-88 | Calbiochem | 475904 | Mounting reagent for immunofluorescence assays |
| MyOne C1 Streptavidin Magnetic Beads | Invitrogen | 65001 | Biotinylation verification |
| Na2HPO4 | Merck | 106586 | BDNF buffer modification component |
| NaCl | Winkler | BM-1630 | PBS component, BDNF buffer modification component |
| NaH2PO4 | Merck | 106346 | BDNF buffer modification component |
| Neurobasal Medium | Gibco | 21103-049 | Neuron maintenance |
| Ni-NTA Agarose Beads | Qiagen | 30210 | BDNF AviTag purification |
| Nikon Ti2-E | Nikon | Microscope for fluorescence imaging | |
| Nitrocellulose Membrane | BioRad | 1620115 | Protein transfer for western blotting |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | C13440-20CU | Camera for epifluorescence imaging |
| P8340 Protease Inhibitor Cocktail | Sigma | P8340 | BDNF buffer modification component |
| Paraformaldehyde | Merck | 104005 | Fixative for immunofluorescence assays |
| Penicillin/Streptomycin | Gibco | 15140-122 | Neuron maintenance |
| Poli-D-Lysine | Corning | DLW354210 | Cover coating for compartmentalized neurons |
| Poli-L-Lysine | Millipore | P2363 | Cover coating for non-compartmentalized neurons |
| Poly-Prep Chromatography Column | BioRad | 7311550 | Chromatography apparatus component |
| Polyethyleneimine 25K | Polysciences Inc. | PLY-0296 | HEK293 transfection |
| Quantum Dots 655 streptavidin conjugate | Invitrogen | Q10121MP | Monobiotinylated BDNF AviTag label for live and fixed cell experiments |
| Saponin | Sigma | S4521 | Detergent for immunofluorescence assays |
| Syldgard 184 silicone elastomer base | Poirot | 4019862 | Microfluidic chamber preparation |
| TEMED | Sigma | T9281 | SDS-PAGE gel preparation |
| Tris | Winkler | BM-2000 | Lysis buffer component |
| Triton X100 | Merck | 108603 | Cell permeabilization in immunofluorescence and western blot assays |
| Trypsin-EDTA 0.5% | Gibco | 15400-054 | HEK293 passaging |
Referenzen
- Huang, E., Reichardt, L. Neurotrophins: Roles in Neuronal Development and Function. Annual Review of Neuroscience. 24, 677-736 (2001).
- Skaper, S. D. The neurotrophin family of neurotrophic factors: an overview. Methods in Mollecular Biology. 846, 1-12 (2012).
- Gonzalez, A., Moya-Alvarado, G., Gonzalez-Billault, C., Bronfman, F. C. Cellular and molecular mechanism regulating neuronal growth by brain-derived neurotrophic factor. Cytoskeleton. 73 (10), 612-628 (2016).
- Cunha, C., Brambilla, R., Thomas, K. A simple role for BDNF in learning and memory. Frontiers in Mollecular Neuroscience. 3, 1(2010).
- Bronfman, F. C., Lazo, O. M., Flores, C., Escudero, C. A. Spatiotemporal intracelular dynamics of neurotrophin and its receptors. Implications for neurotrophin signaling and neuronal function. Neurotrophic Factor. Handbook of Experimental Pharmacology. Lewin, G., Carter, B. 220, Springer. Berlin, Heidelberg. (2014).
- Ascano, M., Bodmer, D., Kuruvilla, R. Endocytic trafficking of neurotrophins in neural development. Trends in Cell Biology. 22 (5), 266-273 (2012).
- Deinhardt, K., Salinas, S., Verastegui, C., Watson, R., Worth, D., Hanrahan, S., Bucci, C., Schiavo, G. Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway. Neuron. 52 (2), 293(2006).
- Escudero, C. A., et al. c-Jun N-terminal kinase (JNK)-dependent internalization and Rab5-dependent endocytic sorting medaited long-distance retrograde neuronal death induced by axonal BDNF-p75 signaling. Scientific Reports. 9, 6070(2019).
- Vrabec, J. P., Levin, L. A. The neurobiology of cell death in glaucoma. Eye. 21, Suppl 1 11-14 (2007).
- Liot, G., Zala, D., Pla, P., Mottet, G., Piel, M., Saudou, F. Mutant huntingtin alters retrograde transport of TrkB receptors in striatal dendrites. Journal of Neuroscience. 33 (15), 6298-6309 (2013).
- Zhou, B., Cai, Q., Xie, Y., Sheng, Z. H. Snapin recruits dynein to BDNF-TrkB signaling endosomes for retrograde axonal transport and is essential for dendrite growth of cortical neurons. Cell Reports. 2 (1), 42-51 (2012).
- Haubensak, W., Narz, F., Heumann, R., Lessmann, V. BDNF-GFP containing secretory granules are localized in the vicinity of synaptic junctions of cultured cortical neurons. Journal of Cell Science. 111 (11), 1483-1493 (1998).
- Adachi, N., et al. Glucocorticoid affects dendritic transport of BDNF-containing vesicles. Scientific Reports. 5, 12684(2015).
- Biocompare: The Buyer's Guide for Life Scientists. Mirus Bio. Cellular Toxicity Caused by Transfection: Why is it important. , Available from: https://www.biocompare.com/Bench-Tips/121111-Cellular-Toxicity-Caused-by-Transfection-Why-is-it-important/ (2012).
- Zhao, L., et al. Mechanism underlying activity-dependent insertion of TrkB into the neuronal surface. Journal of Cell Science. 122 (17), 3123-3136 (2009).
- Zhao, X., Zhou, Y., Weissmiller, A., Pearn, M., Mobley, W., Wu, C. Real-time imaging of axonal transport of quantum dot-labeled BDNF in primary neurons. Journal of Visualized Experiments. 91, 51899(2014).
- Sung, K., Maloney, M., Yang, J., Wu, C. A novel method for producing mono-biotinylated, biologically active neurotrophic factors: an essential reagent for single molecule study of axonal transport. Journal of Neuroscience Methods. 200 (2), 121-128 (2011).
- Deerinck, T. The application of fluorescent quantum dots to confocal, multiphoton and electron microscopic imaging. Toxicologic Pathology. 36 (1), 112-116 (2008).
- Unsain, N., Nuñez, N., Anastasia, A., Mascó, D. H. Status epilepticus induces a TrkB to p75 neurotrophin receptor switch and increases brain-derived neurotrophic factor interaction with p75 neurotrophon receptor: an initial event in neuronal injury induction. Neuroscience. 154 (3), 978-993 (2008).
- Walker, J. M. The bicinchoninic acid (BCA) assay for protein quantitation. Methods Mol Biol. 32, 5-8 (1994).
- Moya-Alvarado, G., Gonzalez, A., Stuardo, N., Bronfman, F. C. Brain-derived neurotrophic factor (BDNF) regulates Rab5-positive early endosomes in hippocampal neurons to induce dendritic branching. Frontiers in Cellular Neuroscience. 12, 493(2018).
- Sasi, M., Vignoli, B., Canossa, M., Blum, R. Neurobiology of local and intercellular BDNF signaling. Pflugers Archiv European Journal of Physiology. 469 (5), 593-610 (2017).
- Gonzalez, A., Lazo, O. M., Bronfman, F. C. The Rab5-Rab11 endosomal pathway is required for BDNF-induced CREB transcriptional regulation in neurons. , Available from: https://www.biorxiv.org/content/10.1101/844720v1 (2019).
- Mowla,, et al. Biosynthesis and post-translational processing of the precursor to brain-derived neurotrophic factor. Journal of Biological Chemistry. 276 (16), 12660-12666 (2001).
- Longo, P., Kavran, J., Kim, M. S., Leahy, D. Transient Mammalian Cell Transfection with Polyethyleneimine (PEI). Methods in Enzymology. 529, 227-240 (2013).
- Raymond, C., Tom, R., Perret, S., Moussouami, P., L'Abbé, D., St-Laurent, G., Durocher, Y. A simplified polyethyleneimine-mediated transfection process for large-scale and high-throughput applications. Methods. 55 (1), 44-51 (2011).
- Dalton, A., Barton, W. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Hunter, M., Yuan, P., Vavilala, D., Fox, M. Optimization of protein expression in mammalian cells. Current Protocols in Protein Science. 95 (1), 77(2019).
- Stepanenko, A. A., Heng, H. H. Transient and stable vector transfection: Pitfalls, off-target effects, artifacts. Mutation Research. 773, 91-103 (2017).
- Guerzoni, L. P., Nicolas, V., Angelova, A. In vitro modulation of TrkB receptor signaling upon sequential delivery of curcumin-DHA loaded carriers towards promoting neuronal survival. Pharmaceutical Research. 34 (2), 492-505 (2017).
- Angelova, A., Angelov, B. Dual and multi-drug delivery nanoparticles towards neuronal survival and synaptic repair. Neural Regeneration Research. 12 (6), 886-889 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten