Method Article
Un protocolo mejorado para purificar y directamente monobiocalinato recombinante BDNF en un tubo para estudios de tráfico celular en neuronas
En este artículo
Resumen
BDNF recombinante que contiene una secuencia Avi (BDNFAvi) se produce en células HEK293 de una manera rentable y se purifica mediante cromatografía de afinidad. BDNFavi es entonces directamente monobiontilado con la enzima BirA en un tubo. BDNFavi y BDNFavi monobionicionados conservan su actividad biológica en comparación con BDNF disponible comercialmente.
Resumen
BdNF recombinante que contiene una secuencia Avi (BDNFAvi) se produce en células HEK293 y luego se purifica de manera rentable mediante cromatografía de afinidad. Se desarrolló un protocolo reproducible para directamente el monobiotinilato BDNFAvi con la enzima BirA en un tubo. En esta reacción, el BDNFAvi monobionitilado conserva su actividad biológica.
Las neurotrofinas son factores de crecimiento derivados de objetivos que juegan un papel en el desarrollo y mantenimiento neuronal. Requieren mecanismos de transporte rápido a lo largo de la vía endocítica para permitir la señalización de larga distancia entre diferentes compartimentos neuronales. El desarrollo de herramientas moleculares para estudiar el tráfico de neurotrofinas ha permitido el seguimiento preciso de estas proteínas en la célula utilizando la grabación in vivo. En este protocolo, desarrollamos un procedimiento optimizado y rentable para la producción de BDNF monobionitilado. Una variante BDNF recombinante que contiene una secuencia avi biotinipilable (BDNFAvi) se produce en células HEK293 en el rango de microgramos y luego se purifica en un procedimiento fácilmente escalable utilizando cromatografía de afinidad. El BDNF purificado puede ser homogéneamente monobioniizado por una reacción in vitro directa con la enzima BirA en un tubo. La actividad biológica del BDNF monobiotinilado (mbtBDNF) se puede conjugar con estreptavidina conjugada con diferentes fluoróforos. BDNFAvi y mbtBDNF conservan su actividad biológica demostrada mediante la detección de objetivos fosforilados aguas abajo utilizando la mancha occidental y la activación del factor de transcripción CREB, respectivamente. Usando puntos estreptavidina-cuánticos, pudimos visualizar la internalización mbtBDNF concomitante con la activación de CREB, que se detectó con un anticuerpo específico fosfo-CREB. Además, mbtBDNF conjugado con puntos estreptavidina-cuánticos era adecuado para el análisis de transporte retrógrado en neuronas corticales cultivadas en cámaras microfluídicas. Por lo tanto, en tubo producido mbtBDNF es una herramienta fiable para estudiar la señalización fisiológica dinámica endosome y el tráfico de neuronas.
Introducción
Las neuronas son las unidades funcionales del sistema nervioso que poseen una morfología compleja y especializada que permite la comunicación sináptica, y por lo tanto, la generación de comportamiento coordinado y complejo en respuesta a diversos estímulos. Las proyecciones neuronales como las dendritas y los axones son características estructurales críticas implicadas en la comunicación neuronal, y las neurotrofinas son actores cruciales para determinar su morfología y función1. Las neurotrofinas son una familia de factores de crecimiento secretados que incluyen NGF, NT-3, NT-4 y factor neurotrófico derivado del cerebro (BDNF)2. En el sistema nervioso central (CNS), BDNF participa en diversos procesos biológicos incluyendo neurotransmisión, arborización dendrítica, maduración de espinas dendríticas, potenciación a largo plazo, entre otros3,,4. Por lo tanto, BDNF desempeña un papel crítico en la regulación de la función neuronal.
Diversos procesos celulares regulan la dinámica y la función de BDNF. En la superficie neuronal, BDNF une la quinasa del receptor de tropomiosina B (TrkB) y/o el receptor de neurotrofina p75 (p75). Los complejos BDNF-TrkB y BDNF-p75 están endocytosed y ordenados en diferentes orgánulos endocíticos5,6,7,8. Se requiere un tráfico intracelular correcto del complejo BDNF/TrkB para la señalización adecuada de BDNF en diferentes circuitos neuronales9,10,11. Por esta razón, una comprensión profunda de la dinámica de tráfico de BDNF y sus alteraciones encontradas en los procesos fisiopatológicos es esencial para entender la señalización de BDNF en la salud y la enfermedad. El desarrollo de herramientas moleculares novedosas y específicas para monitorear este proceso ayudará a impulsar este campo y permitirá una mejor comprensión de los mecanismos regulatorios involucrados.
Hay varias herramientas disponibles para el estudio del tráfico de BDNF en las neuronas. Una metodología de uso común implica la transfección de BDNF recombinante etiquetado con moléculas fluorescentes como la proteína fluorescente verde (GFP) o la variante monomérica fluorescente desplazada en rojo de GFP mCherry12,13. Sin embargo, una deficiencia importante de la sobreexpresión de BDNF es que elimina la posibilidad de entregar concentraciones conocidas de esta neurotrofina. También, puede resultar en toxicidad celular, oscureciendo la interpretación de los resultados14. Una estrategia alternativa es la transfección de un TrkB con etiqueta de epítopo, como Flag-TrkB. Esta metodología permite el estudio de la dinámica de internalización TrkB15,pero también implica transfección, que podría resultar en la alteración de la función TrkB y toxicidad celular. Para superar estos obstáculos metodológicos, se desarrollaron variantes recombinantes de NGF y BDNF que contienen una secuencia Avi (BDNFAvi), que pueden ser monobiocrizadas por la enzima biotina-ligasa BirA,16,17. El BDNF recombinante biotinilado se puede acoplar a diferentes herramientas unidas a estreptavidina, que incluyen fluoróforos, perlas, nanopartículas paramagnéticas entre otras para su detección. En términos de imágenes de células vivas, los puntos cuánticos (QD) se han convertido en fluoróforos de uso frecuente, ya que tienen características deseables para el seguimiento de una sola partícula, como el aumento del brillo y la resistencia al fotoblanqueo en comparación con los fluoróforos de moléculas pequeñas18.
La producción de BDNF monobiocrílico (mbtBDNF) utilizando BDNFAvi se ha logrado mediante la co-transfección de plásmidos que impulsan la expresión de BDNFAvi y BirA, seguida de la purificación de la proteína recombinante por17cromatografía de afinidad con un rendimiento de 1-2 g de BDNF por 20 mL de HEK293- Aquí, proponemos una modificación de este protocolo que permite la purificación DE BDNFAvi a partir de 500 ml de medios condicionados por HEK293, que busca maximizar la recuperación de proteínas en un protocolo basado en cromatografía-columna para facilitar la manipulación. El agente de transfección utilizado, la polietilenimina (PEI), garantiza un método rentable sin sacrificar el rendimiento de la transfección. La etapa de monobiocriilación se ha adaptado a una reacción in vitro para evitar las complicaciones asociadas con las co-transfecciones y para garantizar un etiquetado homogéneo de BDNF. La actividad biológica del mbtBDNF fue demostrada por experimentos de microscopía de borla occidental y fluorescencia, incluyendo la activación de pCREB y la imagen de células vivas para estudiar el transporte axonal retrógrado de BDNF en cámaras microfluídicas. El uso de este protocolo permite una producción optimizada y de alto rendimiento de BDNF homogénea monobionitilada y biológicamente activa.
Protocolo
Todos los experimentos se llevaron a cabo de acuerdo con las directrices aprobadas del CONICYT (Comisión Nacional Chilena de Investigación Científica y Tecnológica). Los protocolos utilizados en este estudio fueron aprobados por los Comités de Bioseguridad y Bioética y Bienestar Animal de la Pontificia Universidad Católica de Chile. Los experimentos con vertebrados fueron aprobados por el Comité de Bioética y Bienestar Animal de la Pontificia Universidad Católica de Chile.
NOTA: El siguiente protocolo fue diseñado para purificar BDNFAvi a partir de un volumen total de 500 ml de medio acondicionado producido en células HEK293. La cantidad de medio condicionado que se produce y procesa para purificar BDNFAvi puede reducirse según sea necesario. Sin embargo, puede ser necesaria una optimización adicional en estas circunstancias. La composición de los medios de cultivo y los tampones utilizados en todo el protocolo se puede encontrar en materiales complementarios.
1. Producción y purificación de BDNFAvi a partir de medios condicionados por HEK293
- Transfección de células HEK293
- Cultivar células HEK293 al 70% de confluencia en medio DMEM suplementado (10% suero fetal bovino, 1x suplemento de glutamato, 1x antibiótico/antimicótico) en platos de cultivo de 15 cm a 37 oC.
- Cambie el búfer de media a transfección.
- Preparar la mezcla PEI-ADN para la transfección. Utilice dos tubos cónicos diferentes de 15 ml para diluir el ADN y PEI 25 K, respectivamente. Diluir 20 g de ADN plásmido en un volumen final de 500 l en un tubo. Diluir 60 g de PEI lineal 25K en un volumen final de 500 l en el otro tubo. Incubar a temperatura ambiente durante 5 min.
- Pipetear cuidadosamente la solución de ADN en el tubo PEI, mezclando una vez por movimiento arriba-abajo. Incubar a temperatura ambiente durante 25 min.
- Goteo 1 mL de la mezcla PEI-ADN a lo largo de cada plato de 15 cm. Incubar las células con la mezcla PEI-ADN durante 3 h a 37 oC.
- Cambie el tampón de incubación de medio a fresco.
- Recopilación y almacenamiento de medios
- Recoger el medio de todos los platos 48 h después de la transfección de células HEK293. Preparar las existencias concentradas de las soluciones descritas en la sección "buffer de modificación sobrenadante" del archivo suplementario 1 y agregarlas al sobrenadante HEK293 para alcanzar las concentraciones finales enumeradas.
NOTA: Las celdas se pueden descartar o recuperar para su posterior análisis. - Incubar el medio en hielo durante 15 min.
- Aliquot el medio en tubos centrífugos.
- Centrifugar el medio a 10.000 x g durante 45 min en una centrífuga de 4oC. Este paso permite la eliminación de desechos celulares y células muertas suspendidas en los medios.
- Recoger los sobrenadantes, añadir BSA a una concentración final de 0.1%. y luego almacenar a -20 oC. Los medios se pueden alicuerar antes de congelarse para un descongelamiento más rápido durante la etapa de purificación.
NOTA: Los tiempos de almacenamiento de medios acondicionados congelados de hasta 2 meses han dado resultados positivos, los tiempos de almacenamiento más largos no se han evaluado.
- Recoger el medio de todos los platos 48 h después de la transfección de células HEK293. Preparar las existencias concentradas de las soluciones descritas en la sección "buffer de modificación sobrenadante" del archivo suplementario 1 y agregarlas al sobrenadante HEK293 para alcanzar las concentraciones finales enumeradas.
- Concentración y purificación de medios
- Descongelar los medios en un baño termorregulado de 37oC.
- Aliquot los medios en tubos centrífugos.
- Centrifugar el medio durante 1 h a 3.500 x g en una centrífuga refrigerada de 4 oC. Este paso permite la eliminación de los residuos celulares restantes para asegurar un flujo adecuado a través de la columna de cromatografía.
- Utilice los concentradores de proteínas con un límite de 10 kDa para reducir los medios de 500 ml a 100 ml. Siga los parámetros de centrifugación recomendados por el fabricante para una concentración óptima.
- Añadir 500 l de cuentas de agarosa de Ni-NTA a los medios concentrados e incubar durante la noche a 4oC en un balancín.
- Montar el aparato de cromatografía y verter los medios en él. Deje reposar durante 5 minutos y luego abra la llave de 2 vías para dejar que el medio fluya a través.
- Lavar las perlas con 5 ml de tampón de lavado durante 5 min. Asegúrese de resuspender las perlas en la columna. Escurra el tampón de lavado abriendo la llave de 2 vías. Repita 3 veces.
- Agregue 1 ml de búfer de elución a la columna. Asegúrese de resuspender las cuentas en la columna. Incubar durante 15 min, y luego recoger el eluido en un tubo de microcentrífuga de 1,5 ml. Repita este paso 3 veces para la elución completa de BDNFAvi.
- Cargue 5 l de cada eluido y diferentes concentraciones de BDNF disponible comercialmente (40-160 ng) en un gel de poliacrilamida al 15%. Detectar la proteína purificada por hinchazón occidental utilizando un anticuerpo anti-BDNF.
- Determinar la concentración del BDNFAvi purificado en cada eluido utilizando la curva de concentración preparada con el BDNF disponible comercialmente.
- Aliquot y almacenar el BDNFAvi purificado a -80 oC.
2. Monobiotinilación in vitro de BDNFAvi utilizando la enzima BirA
-
Reacción monobionitilación in vitro
- Preparar soluciones de stock concentrado de los reactivos tampón de biotinilación. El uso de poblaciones concentradas minimizará la dilución de la proteína recombinante.
- Tome una alícuota de 800 ng de BDNFAvi y agregue los reactivos tampón de biotinilación y la enzima BirA en una relación molar 1:1 con BDNF. Por ejemplo, para un volumen de reacción final de 200 l add; 100 l de solución que contiene 800 ng de BDNFAvi, 20 l de Bicine 0,5 M pH 8,3, 20 l de ATP 100 mM, 20 l de MgOAc 100 mM, 20 l de biotina de 500 m, 0,8-1 g a 1 l de BirA-GST, y completo a 200 l con agua ultrapura.
NOTA: Las reacciones de biotinilación exitosas se han realizado con alícuotas de 400 l que contienen una concentración de aproximadamente 30 ng/L BDNFAvi, lo que da como resultado un BDNFVi biotinilado homogéneamente a una concentración final de 20 ng/L en la reacción final. - Incubar la mezcla a 30oC en un horno de hibridación durante 1 h. Mezclar el contenido por inversión de tubo cada 15 min.
- Agregue el mismo volumen de ATP y BirA que en el paso 2.1.2 y repita el paso 2.1.3.
- Conservar a -80 oC para análisis futuros o mantener el hielo para su uso inmediato (p. ej., control de calidad de biotinilación).
- Análisis de biotinilación
- Bloque 30 l de perlas magnéticas de estreptavidina por muestra de BDNF en 1 ml de búfer de bloqueo. Incubar a temperatura ambiente durante 1 h en un rotador de tubo de microcentrífuga.
- Precipite las perlas magnéticas utilizando un bastidor de separación magnética durante 3 a 5 minutos o hasta que el búfer aparezca completamente despejado de las perlas y deseche el búfer de bloqueo.
- Agregue 50 l de tampón de bloqueo fresco y 80 ng de muestra de BDNFAvi monobioniado (mbtBDNF) a las perlas, asegurándose de resuspenderlas completamente por pippeting.
- Incubar a 4oC durante 1 h en un rotador de tubo de microcentrífuga girando a aproximadamente 20 RPM.
- Recoger las perlas utilizando el bastidor de separación magnética durante 3 a 5 minutos, y recoger el sobrenadante, manteniendo una alícuota de 30 l para el análisis.
- Lave las perlas una vez con 500 oL de PBS y luego recórrelas usando el bastidor de separación magnética durante 3 a 5 minutos. Recuperar el sobrenadante y mantener una alícuota de 30 l para su análisis.
- Agregue 10 l de búfer de carga 4x a las perlas.
- Calentar las muestras a 97 oC durante 7 minutos para eluir el mbtBDNF.
- Detectar mbtBDNF utilizando un anticuerpo específico anti-BDNF19.
3. Verificación de la actividad biológica mbtBDNF
- Detección de pTrkB y pERK por western blot.
- Semilla 2 millones de neuronas corticales de rata en platos de cultivo de 60 mm.
- Cultivar las neuronas durante 7 días (DIV7). Luego, cambie el medio a mediun neurobasal no complementado al iniciar el experimento.
- Una hora después del cambio medio, agregue mbtBDNF a una concentración final de 50 ng/mL. Incubar durante 30 min a 37 oC. Mantener un plato de control negativo (no estimulado con BDNF) y un plato de control positivo (tratado con 50 ng/ml de BDNF disponible comercialmente).
- Recoger el medio y lavar suavemente cada plato con 1x PBS. Recoja y deseche el 1x PBS.
- Coloca los platos sobre hielo y añade 50-80 l de tampón de licencia a cada plato. Utilice un rascador de celdas para anlicer las celdas.
NOTA: La etapa de la lelisis debe realizarse lo antes posible para evitar la desfosforilación y degradación de las proteínas. 1-2 minutos de raspado vigoroso son suficientes para visualizar las proteínas de interés por la hinchazón occidental. - Recoger el tampón de lelisis y agitar en un mezclador de vórtice a la velocidad más alta durante 5 s.
- Centrifugar el tampón de lysis a 14.000 x g (4 oC) durante 10 min. Recoger el sobrenadante.
- Cuantificar el contenido proteico del sobrenadante mediante el protocolo de cuantificación de proteínas BCA20.
- Añadir tampón de carga a una alícuota que contenga 30-50 g de proteína por condición y cargarla en un gel de poliacrilamida del 12% para la hinchazón occidental. Detectar pTrkB y pERK utilizando fosfo-anticuerpos específicos para verificar la actividad biológica de BDNFAvi.
- Verificación de la actividad biológica BDNF-QD por inmunofluorescencia pCREB.
- Semilla 40.000 neuronas corticales de rata en tapapsos de 10 mm, previamente autoclavadas y tratadas con poli-L-lisina como se describió anteriormente21.
- Cultivo de las neuronas durante 7-8 días en tampón de mantenimiento neuronal (ver materiales suplementarios) a 37 oC.
- Para iniciar el experimento, cambie el medio a medio neurobasal no desaprobado e incubar a 37 oC durante 1 h.
- Preparar mbtBDNF conjugado a puntos cuánticos (BDNF-QD) añadiendo a una alícuota mbtBDNF, el volumen necesario de punto cuántico streptavidina conjugado (streptavidin-QD) para lograr una relación molar 1:1 BDNF-QD. A continuación, diluir a 20 l con medio neurobasal. Envuelva el tubo en papel de aluminio para protegerlo de la luz.
NOTA: Preparar otro tubo con el mismo volumen de punto cuántico conjugado de estreptavidina y diluirlo a 20 l con medio neurobasal como control negativo. - Incubar la mezcla mbtBDNF/streptavidin-QD durante 30 min a temperatura ambiente en un balancín.
- Diluir el BDNF-QD a la concentración final deseada (200 pM y 2 nM) en medio neurobasal.
- Después de 1 h de incubación con medio neurobasal no suplementado, estimular las neuronas con BDNF-QD o streptavidin-QD (control) a una concentración final de 200 pM y 2 nM de BDNF durante 30 min a 37 oC.
- Lavar los cubreobjetos 3 veces con 1 PBS (37 oC) y fijar las células durante 15 minutos mediante el tratamiento del cubreobjetos con una solución de paraformaldehído al 4% que contiene inhibidores de la fosfatasa.
- Lavar las células 3 veces con PBS, y luego incubar con tampón de bloqueo/permeabilización (BSA 5%, Triton X-100 0.5%, 1x inhibidor de fosfatasa) durante 1 h.
- Incubar con anticuerpos anti-pCREB 1:500 (en 3% de BSA, 0,1% Tritón X-100) durante la noche a 4oC.
- Al día siguiente, lavar 3 veces con 1x PBS, e incubar durante 1 h con el anticuerpo secundario 1:500 (3% BSA, 0.1% Tritón X-100).
- Lavar 3 veces con 1x PBS. Añadir la solución de tinción nuclear de Hoechst (5 g/ml) durante 7 min.
- Lavar 3 veces con 1x PBS y montar.
- Visualización del transporte axonal retrógrado de BDNF-QD en neuronas vivas
- Preparar cámaras microfluídicas y neuronas de semillas como se describió anteriormente16.
- Después de 7-8 días en el cultivo, cambiar el medio a medio neurobasal no complementado.
- Preparar mbtBDNF conjugado a puntos cuánticos (BDNF-QD) añadiendo a una alícuota mbtBDNF, el volumen necesario de punto cuántico streptavidina conjugado (streptavidin-QD) para lograr una relación molar 1:1 BDNF-QD. A continuación, diluir a 20 l con medio neurobasal. Envuelva el tubo en papel de aluminio para protegerlo de la luz.
NOTA: Preparar otro tubo con el mismo volumen de punto cuántico conjugado de estreptavidina y diluirlo a 20 l con medio neurobasal como control. - Incubar la mezcla mbtBDNF/streptavidin-QD durante 30 min a temperatura ambiente en un balancín.
- Diluir el BDNF-QD a la concentración final deseada (2 nM).
- Después de 1 h de incubación con medio neurobasal no suplementado añadir el BDNF-QD o la mezcla de control a los compartimentos axonales de la cámara microfluídica. Incubar durante 210 min a 37oC para garantizar un transporte neto retrógrado de BDNF-QD.
- Para la toma de imágenes de células vivas, visualice el transporte retrógrado axonal en el segmento de las microgrooves que es proximal al compartimiento del cuerpo celular utilizando un objetivo de 100x utilizando un microscopio adecuado para estos fines (37 oC y 5% de CO2). Adquiera imágenes a 1 fotograma/s.
Resultados
El uso de un protocolo cromatográfico basado en columnas permite el procesamiento de volúmenes significativos de medios condicionados HEK293. En la Figura 1se muestran los resultados de la purificación de BDNFAvi a partir de 500 ml de medios acondicionados. Las eluciones consecutivas de BDNFAvi de las cuentas de agarosa de Ni-NTA producen concentraciones decrecientes de BDNFAvi (Figura 1A). Después de cuatro eluciones consecutivas (cada una con una duración de 15 min), se recupera la mayoría de los BDNF capturados por las cuentas. Las concentraciones de los eluidos oscilan entre 6 y 28 ng/L, y el rendimiento total ascendió a aproximadamente 60 g de BDNFAvi (Tabla 1). El BDNFAvi producido fue entonces biotinilado eficientemente por una reacción in vitro mediada por BirA-GST, como lo demuestra la falta de BDNFAvi no biotinilo en el sobrenadante (Figura 1B). Tenga en cuenta que la biotinilación presentada en la Figura 1B corresponde a una alícuota del TOTAL de BDNF producido, pero la reacción se puede escalar para volúmenes más grandes.
Luego, la actividad biológica de mbtBDNF se evaluó utilizando 2 enfoques experimentales diferentes. En primer lugar, las neuronas corticales sembradas en placas de 60 mm (2 millones de neuronas, DIV7) se estimularon con 50 ng/ml de mbtBDNF durante 30 minutos, y luego se prepararon proteínas para el análisis de manchas occidentales. La actividad biológica del mbtBDNF se cuantificó mediante la detección de pTrkB (Y515) y pERK (T202/Y204). La unión de BDNF a TrkB desencadena la activación del receptor a través de una reacción de autofosforilación en su dominio intracelular, y ERK es un objetivo conocido de la vía de señalización BDNF22. Las bandas para ambas proteínas fosforiladas tenían una intensidad similar en las neuronas tratadas con BDNF comercial y mbtBDNF, y ambas mostraron una señal más fuerte que la condición de control (Figura 2A). Luego, se evaluó la actividad biológica de mbtBDNF acoplada a streptavidin-QD para demostrar que se pueden utilizar en experimentos de imágenes en vivo. Las neuronas corticales se sembraron en cubiertas de 10 mm (40.000 células por cubierta, DIV7) y se trataron con una concentración final de 200 pM o 2 nM BDNF-QD durante 30 min antes de fijar y manchar para pCREB. CREB es un factor de transcripción que está dirigido por ERK1/2 activado en neuronas corticales22,,23. La estimulación de las neuronas con el aumento de las concentraciones de BDNF-QD dio lugar a un aumento dependiente de la dosis de fosforilación de CREB y la presencia de partículas QD alrededor del núcleo (Figura 2B), lo que indica que las partículas BDNF-QD fueron endocadastadas y desencadenaron la activación de vías de señalización asociadas con la activación de TrkB mediada por BDNF. Se detectó un aumento doble en la señal pCREB al estimular las neuronas con una baja concentración de BDNF-QD (200 pM), mientras que la estimulación con 2 nM dio lugar a un aumento de 3,5 veces en la señal pCREB(Figura 2C). Estos resultados demuestran que el BDNFAvi biotinilado es biológicamente activo, y que no pierde su actividad cuando se acopla a streptavidin-QD, por lo que es adecuado para la inmunofluorescencia y la imagen de células vivas.
Por último, se evaluó el potencial de diagnóstico por imágenes de BDNF-QD en cultivos compartimentados utilizando cámaras microfluídicas. Las neuronas corticales se sembraron en cámaras microfluídicas (cubiertas de 15 mm, 50.000 neuronas por cámara microfluídica, DIV7) para separar los compartimentos axonal y somatodendrítico y se estimularon con 2 nM BDNF-QD para 3.5 h. Se realizó la microscopía de células vivas, y los cifógrafos resultantes se utilizaron para cuantificar la velocidad de BDNF-QD que contiene orgánulos(Figura 3A). Se detectó una velocidad móvil media de 0,91 m/s(Figura 3B),que está en línea con los análisis previos del transporte mediado por la citoplasma de la sinerina7,16. Las cámaras microfluídicas tratadas con estreptavidina-QD de 2 nM no mostraron QDs móviles en los microgrooves, como lo muestra el cifógrafo (Figura 3A). Las células cultivadas en las mismas condiciones fueron estimuladas con 500 pM o 2 nM BDNF-QD durante 210 min, y luego fijadas y etiquetadas con una tinción nuclear. Como se muestra en la Figura 3C,las neuronas muestran una acumulación dependiente de la dosis de BDNF-QD en todos los subcontexilos analizados, incluidas las porciones proximales y distales de la microgroove y el compartimento somatodendrítico. Por el contrario, las neuronas de control mostraron casi ninguna señal QD en toda la cámara. Por lo tanto, el BDNF-QD se puede detectar en células vivas y fijas en cámaras microfluídicas.
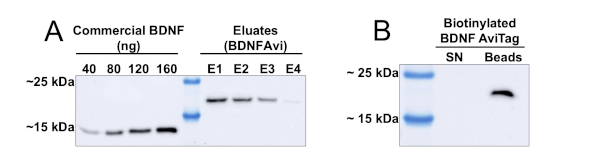
Figura 1: Producción y monobioniización de BDNFAvi en células HEK293. Las células HEK293 fueron transfectadas utilizando el reactivo PEI y un plásmido codificador BDNFAvi y los medios acondicionados fueron recogidos después de 48 h. BDNFAvi contiene una etiqueta de Histidina 6x que permite la purificación utilizando cromatografía de ácido níquel-nitrilotriacetico (Ni-NTA). El BDNF humano recombinante disponible comercialmente tiene un peso molecular esperado de 13 kDa, mientras que EL BDNFAvi muestra un peso molecular de 18 kDa. BDNFAvi unido a la resina fue completamente eluido con cuatro pasos consecutivos de elución. (A) Mancha occidental utilizando anticuerpos anti-BDNF para detectar en casa recombinante BDNF y BDNF comercial. Las alícuotas que contenían cantidades conocidas de BDNF humano disponible comercialmente y 5 ml de cada eluido se cargaron en un gel SDS-PAGE para la detección de BDNFAvi utilizando un anticuerpo contra BDNF. El Cuadro 1 indica las concentraciones de BDNFAvi presentes en cada eluido. La cantidad y concentración de BDNF en cada eluido se obtuvo mediante el análisis densitométrico y la interpolación a partir de la curva de concentración de BDNF disponible comercialmente. (B) Verificación de la biotinilación BDNFAvi. Ochenta nanogramos de BDNFAvi biotinilado (mbtBDNF) se incubaron con 30 l de estreptavidina acopladas a cuentas magnéticas (20% de lodos) durante 1 hora a 4oC. Luego, las cuentas magnéticas se aislaron usando un separador magnético. Las perlas de estreptavidina se calentaron con tampón de carga para eluir el BDNFAvi biotinilado (carril de perlas). El sobrenadante (carril SN) también fue tratado con búfer de carga, calentado y cargado en el gel (carril SN). Haga clic aquí para ver una versión más grande de esta figura.
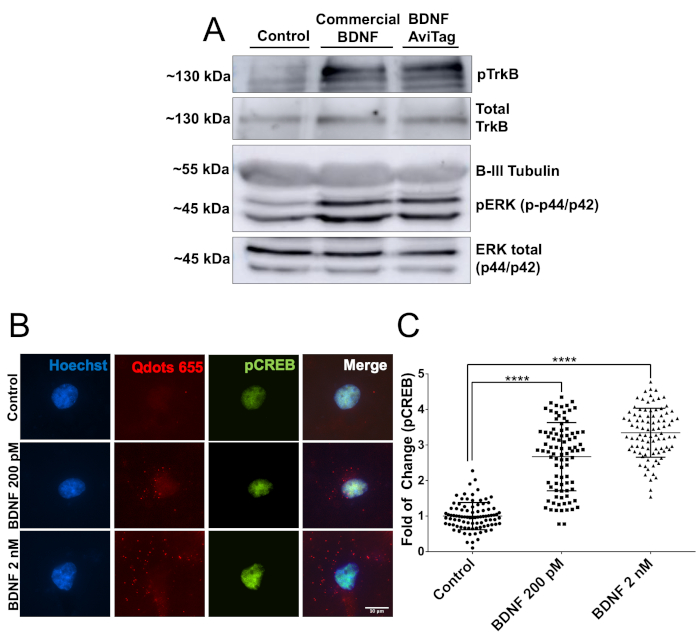
Figura 2: Verificación de la actividad biológica mbtBDNF. (A) Las neuronas corticales DIV7 se murieron de hambre durante 1 h, y luego estimulado con 50 ng/ml de BIOSNF o mbtBDNF disponibles comercialmente durante 30 min. Las proteínas se extrajeron y cargaron en un gel SDS-PAGE para el análisis de la fosforilación TrkB y ERK1/2 utilizando anticuerpos específicos para fosfo y en comparación con los niveles totales de la proteína utilizando anticuerpos contra el total de TrkB y ERK1/2. (B) Las neuronas corticales DIV7 se hambre de suero durante 1 h, y luego estimuladas con una concentración final de 200 pM o 2 nM de mbtBDNF acopladas a streptavidin-QD (BDNF-QD) durante 30 min. Luego, las células fueron fijadas y pCREB fue etiquetado para el análisis de microscopía de fluorescencia. (C) Cuantificación de la intensidad de fluorescencia de pCREB nuclear. Los resultados corresponden a 90 neuronas agrupadas entre 3 experimentos independientes, que se muestran como medias de SEM. El análisis estadístico corresponde a un ANOVA unidireccional con la prueba de comparaciones múltiples de Tukey (****p < 0.0001). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Visualización de BDNF-QD en celdas activas y fijas. (A) Las neuronas corticales DIV7 cultivadas en cámaras microfluídicas se estimularon en el compartimiento axonal con una concentración final de 2 nM de BDNF-QD durante 3,5 horas, y luego la porción proximal de los microgrooves se hizo una imagen utilizando un ajuste de microscopía de células vivas. Se muestran cifógrafos representativos para la afección de control (tratados con estreptavidina-QD) y en el tratamiento con BDNF-QD. (B) Cuantificación de la velocidad de movimiento de BDNF-QD. La puncta móvil se definió como aquellas que se movieron más de 10 m en los 120 s de grabación. C Las neuronas corticales DIV7 cultivadas en cámaras microfluídicas se estimularon en el compartimento axonal con una concentración final de BDNF-QD de 500 pM o 2 nM durante 3,5 horas, y luego fijadas y etiquetadas con Hoechst para visualizar los núcleos. Se muestran imágenes representativas del compartimento somatodendrítico y de las porciones distales y proximales de los microgrooves. Haga clic aquí para ver una versión más grande de esta figura.
| Eluido | BDNF (ng) en 5 l | [ng/l] | Total BDNF [g] |
| E1 | 142.2 | 28.4 | 28.4 |
| E2 | 101.2 | 20.2 | 20.2 |
| E3 | 65.6 | 13.1 | 13.1 |
| E4 | 30.4 | 6.1 | 6.1 |
| 67.8 |
Tabla 1: Cuantificación del rendimiento de purificación de BDNFAvi (relacionado con la Fig. 1A). Las células HEK293 fueron transfectadas con un plásmido que impulsaba la expresión BDNFAvi, y la proteína fue purificada por cromatografía de afinidad Ni-NTA. La concentración de proteínas y el rendimiento final se calcularon mediante el análisis densitométrico y la interpolación en la curva de concentración conocida de BDNF humano recombinante disponible comercialmente.
Archivo suplementario 1: Medios de referencia cultural y componentes de búfer Haga clic aquí para descargar este archivo.
Discusión
En este artículo, se describe una metodología optimizada para la producción y purificación de mbtBDNF en un procedimiento basado en cromatografía de afinidad, basada en el trabajo de Sung y colaboradores17. Las optimizaciones incluyen el uso de un reactivo de transfección (PEI) rentable mientras se mantiene la eficiencia de métodos de transfección más caros como la lipofectamina. Esta optimización se traduce en una reducción significativa de los costos en el protocolo, lo que permite la escalabilidad mientras se mantiene una alta rentabilidad. El protocolo también incluye consideraciones de facilidad de uso, incluida la congelación de medios condicionados durante un máximo de 2 meses. Estas optimizaciones hacen que el procedimiento se adapte a las necesidades de cada laboratorio, mejoran la rentabilidad y producen BDNF recombinante homogéneo y biológicamente activo. El protocolo también se puede adaptar a producciones a menor escala sustituyendo el uso del aparato de cromatografía por precipitación gravitacional de las perlas en tubos cónicos. Esto constituye una metodología viable, pero es menos eficiente en el tiempo y ha dado lugar a menores rendimientos en nuestra experiencia. El BDNF con etiqueta de biotina se puede acoplar a diferentes sondas ligadas a la estreptavidina, incluyendo fluoróforos y nanopartículas paramagnéticas, lo que lo convierte en una herramienta valiosa para realizar diversos tipos de experimentos para el análisis del tráfico post-endocítico bdNF. Por lo tanto, un protocolo de producción optimizado y simple para esta proteína es muy útil para los laboratorios que trabajan en este campo.
La producción de proteínas recombinantes con modificaciones post-traduccionales complejas, como BDNF24, en sistemas procarioticos a menudo da lugar a proteínas que no están correctamente dobladas y por lo tanto tienen una actividad biológica deficiente25. Por lo tanto, la expresión en las células de los mamíferos es necesaria para obtener una proteína bioactiva. El uso de PEI se ha descrito anteriormente como una alternativa viable para la producción a gran escala de proteínas recombinantes en células de mamíferos trans infectados25,26, y su eficiencia en la transfección de las células HEK293 en el contexto de laboratorios académicos se ha destacado27. Por lo tanto, el uso de esta línea celular representa una opción válida para producir BDNFAvi en una escala que puede ser administrada por un laboratorio académico. El protocolo propuesto podría optimizarse aún más mediante la generación de una línea celular HEK293 transfectada de forma estable con BDNFAvi, lo que eliminaría el paso de transfección transitoria, ahorrando así tiempo y recursos. Otra fuente potencial de optimización es el uso de células en suspensión en lugar de células adherentes. Las células HEK293 se pueden mantener en suspensión, generando cantidades significativas de proteína recombinante en el rango de gramos por litro28.
Otra mejora en el protocolo es la biotinilación de la proteína BDNFAvi utilizando una estrategia in vitro, sustituyendo el protocolo de co-transfección in vivo anterior. La co-transfección transitoria puede tener resultados inesperados en términos de la expresión de las construcciones, como se ha demostrado en varias líneas celulares y con varios reactivos de transfección29. Varios factores pueden afectar la expresión de proteínas trans infectadas en un contexto de co-transfección, incluyendo vectores, tipos de células y concentración de plásmido. Esta multiplicidad de factores hace que la optimización y la reproducibilidad sean una tarea compleja. Por otro lado, una metodología in vitro permite un mejor control sobre las condiciones en las que se produce la reacción de biotinilación. Esta metodología da como resultado un etiquetado reproducible y homogéneo de BDNF recombinante.
Como lo demuestran los experimentos de verificación de la actividad biológica, el mbtBDNF producido utilizando este protocolo es comparable al BDNF humano recombinante disponible comercialmente en términos de activación de la vía de señalización BDNF-TrkB. Los datos también muestran que el acoplamiento de BDNF a streptavidin-QD no interfiere con la señalización BDNF-TrkB. Además, mostramos que EL BDNF-QD puede ser detectado por microscopía de epifluorescencia en células vivas y fijas. Por lo tanto, mbtBDNF representa una herramienta valiosa para estudiar el tráfico de axonal retrógrado y presenta ventajas significativas sobre las sondas alternativas, como BDNF-GFP16. El protocolo descrito en este artículo proporciona una metodología fiable y consistente para la producción de mbtBDNF, que luego se puede utilizar en estudios de dinámica post-endocítica en diferentes modelos neuronales que expresan TrkB o p75. La señalización BDNF tiene efectos potentes sobre la morfología neuronal y la función3,4,21, y se ha propuesto recientemente como una herramienta terapéutica potencial para mejorar la regeneración neuronal30,31, haciendo que su estudio relevante en los campos de la biología celular y la biomedicina. El estudio de los efectos de la señalización y el tráfico de BDNF avanzará aún más nuestra comprensión de la biología celular neuronal y puede permitir el aprovechamiento de su potencial regenerativo en entornos clínicos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen el apoyo financiero de Fondecyt (1171137) (FCB), el Centro Basal de Excelencia en Ciencia y Tecnología (AFB 170005) (FCB), Millenium-Nucleus (P (FCB), el Wellcome Trust Senior Investigator Award (107116/Z/15/Z) (GS) y un premio de la Fundación del Instituto de Investigación de la Demencia del Reino Unido (GS). Este trabajo fue apoyado por la Unidad de Microscopía Avanzada UC (UMA UC).
Materiales
| Name | Company | Catalog Number | Comments |
| 2 way stopcock | BioRad | 7328102 | Chromatography apparatus component |
| 2-mercaptoethanol | Sigma | M6250 | BDNF elution buffer |
| Acrylamide/Bisacrylamide | BioRad | 1610154 | SDS-PAGE gel preparation |
| Amicon Ultra-15 10K | Millipore | UFC901024 | BDNF concentration |
| Ammonium Persulfate | Sigma | A9164 | SDS-PAGE gel preparation |
| anti B-III-Tubulin antibody | Sigma | T8578 | Western blot assays for BDNF biological activity detection |
| anti BDNF antibody | Alomone | AGP-021 | Western blot assays for BDNF quantification |
| anti BDNF antibody | Alomone | ANT-010 | Western blot assays for BDNF quantification |
| Anti ERK antibody | Cell Signaling | 9102 | Western blot assays for BDNF biological activity detection |
| anti pCREB antibody (S133) | Cell Signaling | 9198 | Western blot assays for BDNF biological activity detection |
| anti pERK antibody (T202, Y204) | Cell Signaling | 4370 | Western blot assays for BDNF biological activity detection |
| anti pTrkB antibody (Y515) | Abcam | ab109684 | Western blot assays for BDNF biological activity detection |
| Antibiotic/Antimycotic | Gibco | 15240-062 | HEK293 maintenance |
| ATP | Sigma | A26209 | BDNF monobiotinylation buffer |
| B-27 Supplement | Gibco | 17504-044 | Neuron maintenance |
| Bicine | Sigma | B3876 | BDNF monobiotinylation buffer |
| BirA-GST | BPS Bioscience | 70031 | Enzyme for BDNF AviTag monobiotinylation |
| Bovine Fetal Serum | HyClone | HC.SH30396.02 | HEK293 maintenance |
| Bovine Serum Albumin | Jackson ImmunoResearch | 001-000-162 | BDNF buffer modification component, blocking buffer for western blot and immunofluorescence |
| D-Biotin | Sigma | B4639 | BDNF monobiotinylation buffer |
| DMEM High Glucose Medium | Gibco | 11965-092 | Neuron seeding |
| DMEM Medium | Gibco | 11995-081 | HEK293 maintenance |
| Econo Column Funnel | BioRad | 7310003 | Chromatography apparatus component |
| EDTA | Merck | 108418 | |
| EZ-ECL Kit | Biological Industries | 1633664 | Protein detection by western blotting |
| Glutamax | Gibco | 35050-061 | Neuron and HEK293 maintenance |
| Glycerol | Merck | 104094 | BDNF elution buffer, lysis buffer for western blot assays |
| Hettich Rotina 46R Centrifuge | Hettich | Discontinued | Centrifuge used for clearing the medium of debris |
| Hettich Universal 32R Centrifuge | Hettich | Discontinued | Centrifuge used for protein concentrator centrifugation |
| Horse Serum | Gibco | 16050-122 | Neuron seeding |
| ImageQuant LAS 500 | GE Healthcare Life Sciences | 29005063 | Western blot image acquisition |
| Imidazole | Sigma | I55513 | BDNF buffer modification component |
| KCl | Winkler | BM-1370 | PBS component |
| KH2PO4 | Merck | 104873 | PBS component |
| Laminin | Invitrogen | 23017-015 | Cover coating for compartmentalized neurons |
| Luer Tubing Adaptor | BioRad | 7323245 | Chromatography apparatus component |
| Luminata™ Forte Western HRP Substrate | Millipore | WBLUF0100 | Protein detection by western blotting |
| Mg(CH3COO)2 | Merck | 105819 | BDNF monobiotinylation buffer |
| Mowiol 4-88 | Calbiochem | 475904 | Mounting reagent for immunofluorescence assays |
| MyOne C1 Streptavidin Magnetic Beads | Invitrogen | 65001 | Biotinylation verification |
| Na2HPO4 | Merck | 106586 | BDNF buffer modification component |
| NaCl | Winkler | BM-1630 | PBS component, BDNF buffer modification component |
| NaH2PO4 | Merck | 106346 | BDNF buffer modification component |
| Neurobasal Medium | Gibco | 21103-049 | Neuron maintenance |
| Ni-NTA Agarose Beads | Qiagen | 30210 | BDNF AviTag purification |
| Nikon Ti2-E | Nikon | Microscope for fluorescence imaging | |
| Nitrocellulose Membrane | BioRad | 1620115 | Protein transfer for western blotting |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | C13440-20CU | Camera for epifluorescence imaging |
| P8340 Protease Inhibitor Cocktail | Sigma | P8340 | BDNF buffer modification component |
| Paraformaldehyde | Merck | 104005 | Fixative for immunofluorescence assays |
| Penicillin/Streptomycin | Gibco | 15140-122 | Neuron maintenance |
| Poli-D-Lysine | Corning | DLW354210 | Cover coating for compartmentalized neurons |
| Poli-L-Lysine | Millipore | P2363 | Cover coating for non-compartmentalized neurons |
| Poly-Prep Chromatography Column | BioRad | 7311550 | Chromatography apparatus component |
| Polyethyleneimine 25K | Polysciences Inc. | PLY-0296 | HEK293 transfection |
| Quantum Dots 655 streptavidin conjugate | Invitrogen | Q10121MP | Monobiotinylated BDNF AviTag label for live and fixed cell experiments |
| Saponin | Sigma | S4521 | Detergent for immunofluorescence assays |
| Syldgard 184 silicone elastomer base | Poirot | 4019862 | Microfluidic chamber preparation |
| TEMED | Sigma | T9281 | SDS-PAGE gel preparation |
| Tris | Winkler | BM-2000 | Lysis buffer component |
| Triton X100 | Merck | 108603 | Cell permeabilization in immunofluorescence and western blot assays |
| Trypsin-EDTA 0.5% | Gibco | 15400-054 | HEK293 passaging |
Referencias
- Huang, E., Reichardt, L. Neurotrophins: Roles in Neuronal Development and Function. Annual Review of Neuroscience. 24, 677-736 (2001).
- Skaper, S. D. The neurotrophin family of neurotrophic factors: an overview. Methods in Mollecular Biology. 846, 1-12 (2012).
- Gonzalez, A., Moya-Alvarado, G., Gonzalez-Billault, C., Bronfman, F. C. Cellular and molecular mechanism regulating neuronal growth by brain-derived neurotrophic factor. Cytoskeleton. 73 (10), 612-628 (2016).
- Cunha, C., Brambilla, R., Thomas, K. A simple role for BDNF in learning and memory. Frontiers in Mollecular Neuroscience. 3, 1(2010).
- Bronfman, F. C., Lazo, O. M., Flores, C., Escudero, C. A. Spatiotemporal intracelular dynamics of neurotrophin and its receptors. Implications for neurotrophin signaling and neuronal function. Neurotrophic Factor. Handbook of Experimental Pharmacology. Lewin, G., Carter, B. 220, Springer. Berlin, Heidelberg. (2014).
- Ascano, M., Bodmer, D., Kuruvilla, R. Endocytic trafficking of neurotrophins in neural development. Trends in Cell Biology. 22 (5), 266-273 (2012).
- Deinhardt, K., Salinas, S., Verastegui, C., Watson, R., Worth, D., Hanrahan, S., Bucci, C., Schiavo, G. Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway. Neuron. 52 (2), 293(2006).
- Escudero, C. A., et al. c-Jun N-terminal kinase (JNK)-dependent internalization and Rab5-dependent endocytic sorting medaited long-distance retrograde neuronal death induced by axonal BDNF-p75 signaling. Scientific Reports. 9, 6070(2019).
- Vrabec, J. P., Levin, L. A. The neurobiology of cell death in glaucoma. Eye. 21, Suppl 1 11-14 (2007).
- Liot, G., Zala, D., Pla, P., Mottet, G., Piel, M., Saudou, F. Mutant huntingtin alters retrograde transport of TrkB receptors in striatal dendrites. Journal of Neuroscience. 33 (15), 6298-6309 (2013).
- Zhou, B., Cai, Q., Xie, Y., Sheng, Z. H. Snapin recruits dynein to BDNF-TrkB signaling endosomes for retrograde axonal transport and is essential for dendrite growth of cortical neurons. Cell Reports. 2 (1), 42-51 (2012).
- Haubensak, W., Narz, F., Heumann, R., Lessmann, V. BDNF-GFP containing secretory granules are localized in the vicinity of synaptic junctions of cultured cortical neurons. Journal of Cell Science. 111 (11), 1483-1493 (1998).
- Adachi, N., et al. Glucocorticoid affects dendritic transport of BDNF-containing vesicles. Scientific Reports. 5, 12684(2015).
- Biocompare: The Buyer's Guide for Life Scientists. Mirus Bio. Cellular Toxicity Caused by Transfection: Why is it important. , Available from: https://www.biocompare.com/Bench-Tips/121111-Cellular-Toxicity-Caused-by-Transfection-Why-is-it-important/ (2012).
- Zhao, L., et al. Mechanism underlying activity-dependent insertion of TrkB into the neuronal surface. Journal of Cell Science. 122 (17), 3123-3136 (2009).
- Zhao, X., Zhou, Y., Weissmiller, A., Pearn, M., Mobley, W., Wu, C. Real-time imaging of axonal transport of quantum dot-labeled BDNF in primary neurons. Journal of Visualized Experiments. 91, 51899(2014).
- Sung, K., Maloney, M., Yang, J., Wu, C. A novel method for producing mono-biotinylated, biologically active neurotrophic factors: an essential reagent for single molecule study of axonal transport. Journal of Neuroscience Methods. 200 (2), 121-128 (2011).
- Deerinck, T. The application of fluorescent quantum dots to confocal, multiphoton and electron microscopic imaging. Toxicologic Pathology. 36 (1), 112-116 (2008).
- Unsain, N., Nuñez, N., Anastasia, A., Mascó, D. H. Status epilepticus induces a TrkB to p75 neurotrophin receptor switch and increases brain-derived neurotrophic factor interaction with p75 neurotrophon receptor: an initial event in neuronal injury induction. Neuroscience. 154 (3), 978-993 (2008).
- Walker, J. M. The bicinchoninic acid (BCA) assay for protein quantitation. Methods Mol Biol. 32, 5-8 (1994).
- Moya-Alvarado, G., Gonzalez, A., Stuardo, N., Bronfman, F. C. Brain-derived neurotrophic factor (BDNF) regulates Rab5-positive early endosomes in hippocampal neurons to induce dendritic branching. Frontiers in Cellular Neuroscience. 12, 493(2018).
- Sasi, M., Vignoli, B., Canossa, M., Blum, R. Neurobiology of local and intercellular BDNF signaling. Pflugers Archiv European Journal of Physiology. 469 (5), 593-610 (2017).
- Gonzalez, A., Lazo, O. M., Bronfman, F. C. The Rab5-Rab11 endosomal pathway is required for BDNF-induced CREB transcriptional regulation in neurons. , Available from: https://www.biorxiv.org/content/10.1101/844720v1 (2019).
- Mowla,, et al. Biosynthesis and post-translational processing of the precursor to brain-derived neurotrophic factor. Journal of Biological Chemistry. 276 (16), 12660-12666 (2001).
- Longo, P., Kavran, J., Kim, M. S., Leahy, D. Transient Mammalian Cell Transfection with Polyethyleneimine (PEI). Methods in Enzymology. 529, 227-240 (2013).
- Raymond, C., Tom, R., Perret, S., Moussouami, P., L'Abbé, D., St-Laurent, G., Durocher, Y. A simplified polyethyleneimine-mediated transfection process for large-scale and high-throughput applications. Methods. 55 (1), 44-51 (2011).
- Dalton, A., Barton, W. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Hunter, M., Yuan, P., Vavilala, D., Fox, M. Optimization of protein expression in mammalian cells. Current Protocols in Protein Science. 95 (1), 77(2019).
- Stepanenko, A. A., Heng, H. H. Transient and stable vector transfection: Pitfalls, off-target effects, artifacts. Mutation Research. 773, 91-103 (2017).
- Guerzoni, L. P., Nicolas, V., Angelova, A. In vitro modulation of TrkB receptor signaling upon sequential delivery of curcumin-DHA loaded carriers towards promoting neuronal survival. Pharmaceutical Research. 34 (2), 492-505 (2017).
- Angelova, A., Angelov, B. Dual and multi-drug delivery nanoparticles towards neuronal survival and synaptic repair. Neural Regeneration Research. 12 (6), 886-889 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados