Method Article
Un protocole amélioré pour purifier et directement mono-biotinylate recombinant BDNF dans un tube pour les études de trafic cellulaire dans les neurones
Dans cet article
Résumé
Le BDNF recombinant contenant une séquence Avi (BDNFAvi) est produit dans les cellules HEK293 d’une manière rentable et est purifié par la chromatographie d’affinité. BDNFavi est alors directement mono-biotinylé avec l’enzyme BirA dans un tube. BDNFavi et BDNFavi mono-biotinylés conservent leur activité biologique par rapport au BDNF disponible dans le commerce.
Résumé
Le BDNF recombinant contenant une séquence Avi (BDNFAvi) est produit dans des cellules HEK293, puis purifié de manière rentable par chromatographie d’affinité. Un protocole reproductible a été développé pour mono-biotinylate directement BDNFAvi avec l’enzyme BirA dans un tube. Dans cette réaction, le BDNFAvi mono-biotinylé conserve son activité biologique.
Les neurotrophines sont des facteurs de croissance dérivés de la cible qui jouent un rôle dans le développement et l’entretien des neurones. Ils nécessitent des mécanismes de transport rapide le long de la voie endocytique pour permettre la signalisation longue distance entre les différents compartiments neuronaux. Le développement d’outils moléculaires pour étudier le trafic de neurotrophines a permis le suivi précis de ces protéines dans la cellule à l’aide de l’enregistrement in vivo. Dans ce protocole, nous avons développé une procédure optimisée et rentable pour la production de BDNF mono-biotinylée. Une variante recombinante de BDNF contenant une séquence d’avi biotinylable (BDNFAvi) est produite dans les cellules HEK293 dans la gamme de microgrammes, puis purifiée dans une procédure facilement évolutive utilisant la chromatographie d’affinité. Le BDNF purifié peut alors être homogènement mono-biotinylé par une réaction in vitro directe avec l’enzyme BirA dans un tube. L’activité biologique du BDNF mono-biotinylé (mbtBDNF) peut être conjuguée à la streptavidine-conjuguée à différents fluorophores. BDNFAvi et mbtBDNF conservent leur activité biologique démontrée par la détection de cibles phosphorylyées en aval à l’aide de la tache occidentale et de l’activation du facteur de transcription CREB, respectivement. En utilisant des points streptavidine-quantiques, nous avons pu visualiser l’internalisation mbtBDNF concomitante à l’activation du CREB, qui a été détecté avec un anticorps spécifique au phospho-CREB. En outre, mbtBDNF conjugué aux points streptavidin-quantum était approprié pour l’analyse rétrograde de transport dans les neurones corticaux cultivés dans les chambres microfluidiques. Ainsi, dans le tube produit mbtBDNF est un outil fiable pour étudier la dynamique de signalisation physiologique endosome et le trafic dans les neurones.
Introduction
Les neurones sont les unités fonctionnelles du système nerveux possédant une morphologie complexe et spécialisée qui permet la communication synaptique, et donc, la génération de comportements coordonnés et complexes en réponse à divers stimuli. Les projections neuronales telles que les dendrites et les axones sont des caractéristiques structurelles essentielles impliquées dans la communication neuronale, et les neurotrophines sont des acteurs essentiels pour déterminer leur morphologie et leur fonction1. Les neurotrophines sont une famille de facteurs de croissance sécrétés qui incluent NGF, NT-3, NT-4, et le facteur neurotrophique cerveau-dérivé (BDNF)2. Dans le système nerveux central (SNC), BDNF participe à divers processus biologiques, y compris la neurotransmission, l’arborisation dendritique, la maturation des épines dendritiques, la potentialisation à long terme, entre autres3,4. Par conséquent, BDNF joue un rôle essentiel dans la régulation de la fonction neuronale.
Divers processus cellulaires régulent la dynamique et la fonction de BDNF. Sur la surface neuronale, le BDNF lie le récepteur de la tropomyosine kinase B (TrkB) et/ou le récepteur de la neurotrophine p75 (p75). Les complexes BDNF-TrkB et BDNF-p75 sont endocytosés et triés dans différentes organites endocytiques5,6,7,8. Le trafic intracellulaire correct du complexe BDNF/TrkB est nécessaire pour la signalisation BDNF appropriée dans différents circuits neuronaux9,10,11. Pour cette raison, une compréhension profonde de la dynamique du trafic BDNF et de ses altérations trouvées dans les processus pathophysiologiques est essentielle pour comprendre la signalisation BDNF dans la santé et la maladie. La mise au point d’outils moléculaires nouveaux et spécifiques pour surveiller ce processus aidera à faire avancer ce domaine et permettra de mieux comprendre les mécanismes de réglementation impliqués.
Il existe plusieurs outils disponibles pour l’étude du trafic BDNF dans les neurones. Une méthodologie couramment utilisée implique la transfection du BDNF recombinant marqué avec des molécules fluorescentes telles que la protéine fluorescente verte (GFP) ou la variante monomérique fluorescente de GFP mCherry12,13. Cependant, une lacune majeure de la surexpression BDNF est qu’elle élimine la possibilité de fournir des concentrations connues de cette neurotrophine. En outre, il peut entraîner la toxicité cellulaire, obscurcissant l’interprétation des résultats14. Une stratégie alternative est la transfection d’un TrkB marqué par épitope, tel que Flag-TrkB. Cette méthodologie permet l’étude de la dynamique d’internalisation TrkB15, mais elle implique également la transfection, qui pourrait entraîner une altération de la fonction TrkB et la toxicité cellulaire. Pour surmonter ces obstacles méthodologiques, des variantes recombinantes de NGF et bdnf contenant une séquence Avi (BDNFAvi), qui peuvent être mono-biotinylées par l’enzyme biotin-ligase BirA, ont été développées16,17. Le BDNF recombinant biotinylé peut être couplé à différents outils liés à la streptavidine, qui comprennent des fluorophores, des perles, des nanoparticules paramagnétiques, entre autres, pour la détection. En termes d’imagerie des cellules vivantes, les points quantiques (QD) sont devenus fréquemment utilisés fluorophores, car ils ont des caractéristiques souhaitables pour le suivi des particules uniques, tels que la luminosité accrue et la résistance au photobleaching par rapport aux fluorophores de petites molécules18.
La production de BDNF mono-biotinylée (mbtBDNF) à l’aide de BDNFAvi a été réalisée par co-transfection de plasmides conduisant à l’expression de BDNFAvi et BirA, suivie par la purification de la protéine recombinante par chromatographie d’affinité avec un rendement de 1-2 μg de BDNF par 20 mL de 20 mL de milieux de culture17HEK293-conditionnés . Ici, nous proposons une modification de ce protocole qui permet la purification BDNFAvi à partir de 500 mL de supports conditionnés HEK293, qui vise à maximiser la récupération des protéines dans un protocole basé sur la chromatographie-colonne pour faciliter la manipulation. L’agent de transfection utilisé, la polyéthylèneimine (Î.-P.-É.), assure une méthode rentable sans sacrifier le rendement de la transfection. L’étape mono-biotinylation a été adaptée à une réaction in vitro afin d’éviter les complications associées aux co-transfections et d’assurer l’étiquetage homogène du BDNF. L’activité biologique du mbtBDNF a été démontrée par des expériences occidentales de microscopie de tache et de fluorescence, y compris l’activation du PCREB et de l’imagerie cellulaire vivante pour étudier le transport axonal rétrograde du BDNF dans les chambres microfluidiques. L’utilisation de ce protocole permet une production optimisée et à haut rendement de BDNF mono-biotinylée homogène et biologiquement active.
Protocole
Toutes les expériences ont été réalisées conformément aux directives approuvées par le CONICYT (Commission nationale chilienne pour la recherche scientifique et technologique). Les protocoles utilisés dans cette étude ont été approuvés par les Comités de biosécurité et de bioéthique et de bien-être animal de la Pontificia Universidad Católica de Chile. Des expériences impliquant des vertébrés ont été approuvées par le Comité de bioéthique et de bien-être animal de la Pontificia Universidad Católica de Chile.
REMARQUE : Le protocole suivant a été conçu pour purifier BDNFAvi à partir d’un volume total de 500 mL de milieu conditionné produit dans les cellules HEK293. La quantité de milieu conditionné qui est produite et traitée pour purifier BDNFAvi peut être à la hausse ou à la baisse au besoin. Toutefois, une optimisation supplémentaire peut être nécessaire dans ces circonstances. La composition des supports culturels et des tampons utilisés tout au long du protocole se trouve dans les documents supplémentaires.
1. Production et purification de BDNFAvi à partir de supports conditionnés HEK293
- Transfection des cellules HEK293
- Développer les cellules HEK293 à 70% confluence dans le milieu complété de DMEM (10% sérum foetal bovin, supplément de glutamate 1x, 1x antibiotique/antimycotique) dans les plats de culture de 15 cm à 37 ºC.
- Modifiez la mémoire tampon de protection du milieu à la transfection.
- Préparer le mélange PEI-ADN pour la transfection. Utilisez deux tubes coniques différents de 15 mL pour diluer l’ADN et 25 K de l’Île-du-Prince-Édouard, respectivement. Diluer 20 μg d’ADN plasmide dans un volume final de 500 μL dans un tube. Diluer 60 μg de 25 K.-O. linéaire dans un volume final de 500 μL dans l’autre tube. Incuber à température ambiante pendant 5 min.
- Pipette soigneusement la solution d’ADN dans le tube de l’Île-du-Prince-Édouard, en mélangeant une fois par mouvement descendant. Incuber à température ambiante pendant 25 min.
- Égoutter 1 mL du mélange PEI-ADN dans chaque plat de 15 cm. Incuber les cellules avec le mélange PEI-ADN pendant 3 h à 37 ºC.
- Modifiez le tampon d’incubation moyen à frais.
- Collecte et stockage multimédia
- Recueillir le milieu de tous les plats 48 h après la transfection des cellules HEK293. Préparer les stocks concentrés des solutions décrites dans la section « tampon de modification supernatant » du fichier supplémentaire 1 et les ajouter au supernatant HEK293 pour atteindre les concentrations finales énumérées.
REMARQUE : Les cellules peuvent être jetées ou récupérées pour une analyse plus approfondie. - Incuber le milieu dans la glace pendant 15 min.
- Aliquot le milieu dans des tubes de centrifugeuse.
- Centrifuger le milieu à 10 000 x g pendant 45 min dans une centrifugeuse de 4 °C. Cette étape permet l’élimination des débris cellulaires et des cellules mortes suspendues dans les médias.
- Recueillir les supernatants, ajouter BSA à une concentration finale de 0,1%. puis conserver à -20 °C. Les supports peuvent être aliquotés avant de geler pour un dégel plus rapide pendant l’étape de purification.
REMARQUE : Les temps de stockage des supports conditionnés gelés jusqu’à 2 mois ont donné des résultats positifs, des temps de stockage plus longs n’ont pas été évalués.
- Recueillir le milieu de tous les plats 48 h après la transfection des cellules HEK293. Préparer les stocks concentrés des solutions décrites dans la section « tampon de modification supernatant » du fichier supplémentaire 1 et les ajouter au supernatant HEK293 pour atteindre les concentrations finales énumérées.
- Concentration et purification des médias
- Décongeler le milieu dans un bain thermorégulé à 37 °C.
- Aliquot le milieu dans des tubes de centrifugeuse.
- Centrifuger le milieu pendant 1 h à 3 500 x g dans une centrifugeuse refroidie à 4 °C. Cette étape permet l’élimination des débris cellulaires restants afin d’assurer un débit adéquat à travers la colonne de chromatographie.
- Utilisez les concentrateurs de protéines avec une coupure de 10 kDa pour réduire le milieu de 500 mL à 100 mL. Suivez les paramètres de centrifugation recommandés par le fabricant pour une concentration optimale.
- Ajouter 500 μL de perles d’agarose Ni-NTA au milieu concentré et incuber toute la nuit à 4 °C dans un rocker.
- Assemblez l’appareil de chromatographie et versez le support dedans. Laissez reposer pendant 5 min, puis ouvrez le robinet d’arrêt à 2 voies pour laisser passer le milieu.
- Laver les perles avec 5 mL de tampon de lavage pendant 5 min. Assurez-vous de resuspender les perles dans la colonne. Égoutter le tampon de lavage en ouvrant le robinet à 2 voies. Répéter 3 fois.
- Ajoutez 1 mL de tampon d’élution à la colonne. Assurez-vous de résuspender les perles dans la colonne. Incuber pendant 15 min, puis recueillir l’éluate dans un tube de microcentrifuge de 1,5 m L. Répétez cette étape 3 fois pour l’élution complète de BDNFAvi.
- Chargez 5 μL de chaque eluate et différentes concentrations de BDNF disponible dans le commerce (40-160 ng) dans un gel polyacrylamide de 15 %. Détecter la protéine purifiée par ballonnement occidental à l’aide d’un anticorps anti-BDNF.
- Déterminer la concentration du BDNFAvi purifié dans chaque éluate à l’aide de la courbe de concentration préparée avec le BDNF disponible dans le commerce.
- Aliquot et entreposez le BDNFAvi purifié à -80 °C.
2. Mono-biotinylation in vitro de BDNFAvi à l’aide de l’enzyme BirA
-
Réaction in vitro de mono-biotinylation
- Préparer des solutions de stock concentré des réactifs tampons de biotinylation. L’utilisation de stocks concentrés minimisera la dilution de la protéine recombinante.
- Prenez un aliquot de 800 ng de BDNFAvi et ajoutez les réactifs tampons de biotinylation et l’enzyme BirA dans une relation molaire 1:1 à BDNF. Par exemple, pour un volume de réaction finale de 200 μL ajouter; 100 μL de solution contenant 800 ng de BDNFAvi, 20 μL Bicine 0,5 M pH 8,3, 20 μL ATP 100 mM, 20 μL MgOAc 100 mM, 20 μL d-biotine 500 μM, 0,8-1 μg à 1 μL de BirA-GST, et complète à 200 μL avec de l’eau ultrapure.
REMARQUE : Des réactions de biotinylation réussies ont été effectuées avec des aliquots de 400 μL contenant une concentration d’environ 30 ng/ μL BDNFAvi, résultant en un BDNFAvi homogènement biotinylé à une concentration finale d'~20 ng/μL dans la réaction finale. - Incuber le mélange à 30 °C dans un four d’hybridation pendant 1 h. Mélanger le contenu par inversion de tube toutes les 15 minutes.
- Ajoutez le même volume d’ATP et de BirA qu’à l’étape 2.1.2 et répétez l’étape 2.1.3.
- Conserver à -80 °C pour les analyses futures ou conserver sur la glace pour une utilisation immédiate (p. ex., contrôle de la qualité de la biotinylation).
- Analyse de la biotinylation
- Bloc 30 μL de perles magnétiques streptavidine par échantillon BDNF dans 1 mL de tampon de blocage. Incuber à température ambiante pendant 1 h dans un rotateur de tube microcentrifuge.
- Précipitez les perles magnétiques à l’aide d’un support de séparation magnétique pendant 3 à 5 minutes ou jusqu’à ce que le tampon semble complètement dégagé des perles et jeter le tampon de blocage.
- Ajouter 50 μL de tampon de blocage frais et 80 ng d’échantillon bdnfavi mono-biotinylé (mbtBDNF) aux perles, en veillant à les résuspender complètement par tuyauterie.
- Incuber à 4 °C pendant 1 h dans un rotateur de tube microcentrifuge tournant à environ 20 tr/min.
- Recueillir les perles à l’aide de la grille de séparation magnétique pendant 3 à 5 minutes, et recueillir le supernatant, en gardant un aliquot 30 μL pour analyse.
- Laver les perles une fois avec 500 μL de PBS, puis les recueillir à l’aide de la grille de séparation magnétique pendant 3 à 5 minutes. Récupérez le supernatant et conservez un aliquot de 30 μL pour analyse.
- Ajouter 10 μL de tampon de chargement 4x aux perles.
- Chauffer les échantillons à 97 °C pendant 7 min pour élute le mbtBDNF.
- Détecter le mbtBDNF à l’aide d’un anticorps spécifique à l’anti-BDNF19.
3. Vérification de l’activité biologique du mbtBDNF
- Détection de pTrkB et pERK par tache occidentale.
- Semence 2 millions de neurones corticaux de rat dans des plats de culture de 60 mm.
- Culture des neurones pendant 7 jours (DIV7). Ensuite, changez le mediun neurobasal moyen à non-complété lors du démarrage de l’expérience.
- Une heure après changement moyen, ajouter le mbtBDNF à une concentration finale de 50 ng/mL. Incuber pendant 30 min à 37 ºC. Gardez un plat de contrôle négatif (non stimulé avec BDNF) et un plat de contrôle positif (traité avec 50 ng/mL de BDNF disponible dans le commerce).
- Recueillir le milieu et laver doucement chaque plat avec 1x PBS. Recueillir et jeter le PBS 1x.
- Déposer les plats sur de la glace et ajouter 50 à 80 μL de tampon de lyse à chaque plat. Utilisez un grattoir cellulaire pour lyser les cellules.
REMARQUE : L’étape de lyse doit être effectuée le plus rapidement possible afin d’éviter la déphosphorylation et la dégradation des protéines. 1-2 minutes de grattage vigoureux suffisent à visualiser les protéines d’intérêt par le ballonnement occidental. - Recueillir le tampon de lyse et remuer dans un mélangeur vortex à la vitesse la plus élevée pendant 5 s.
- Centrifuger le tampon de lyse à 14 000 x (4 °C) pendant 10 min. Recueillir le supernatant.
- Quantifier la teneur en protéines du supernatant par le protocole de quantification des protéines BCA20.
- Ajoutez un tampon de chargement à un aliquot contenant 30 à 50 μg de protéines par condition et chargez-le dans un gel polyacrylamide de 12 % pour le blotting occidental. Détecter pTrkB et pERK à l’aide d’anticorps phospho spécifiques pour vérifier l’activité biologique de BDNFAvi.
- Vérification de l’activité biologique bdnf-qd par immunofluorescence pCREB.
- Graine 40.000 neurones corticaux de rat dans des couvercles de 10 mm, précédemment autoclaved et traité avec la poly-L-lysine comme décrit précédemment21.
- Culturez les neurones pendant 7-8 jours dans le tampon d’entretien neuronal (voir matériaux supplémentaires) à 37 ºC.
- Pour commencer l’expérience, modifiez le milieu à un milieu neurobasal non approvisionnement et incuber à 37 ºC pendant 1 h.
- Préparez mbtBDNF conjugué aux points quantiques (BDNF-QD) en ajoutant à un aliquot mbtBDNF, le volume nécessaire de point quantique streptavidin conjugué (streptavidin-QD) pour atteindre un rapport molaire BDNF-QD 1:1. Puis, diluer à 20 μL avec le milieu neurobasal. Enveloppez le tube dans du papier d’aluminium pour le protéger de la lumière.
REMARQUE : Préparez un autre tube avec le même volume de streptavidine à point quantique conjugué et diluez-le à 20 μL avec le milieu neurobasal comme contrôle négatif. - Incuber le mélange mbtBDNF/streptavidin-QD pendant 30 min à température ambiante dans un rocker.
- Diluer le BDNF-QD à la concentration finale souhaitée (200 pM et 2 nM) dans le milieu neurobasal.
- Après 1 h d’incubation avec un milieu neurobasal non complété, stimuler les neurones avec BDNF-QD ou streptavidine-QD (contrôle) à une concentration finale de 200 pM et 2 nM de BDNF pendant 30 min à 37 °C.
- Laver les couvercles 3 fois avec 1x PBS (37 °C) et fixer les cellules pendant 15 min en traitant la couverture avec une solution de paraformaldéhyde de 4 % contenant des inhibiteurs de la phosphatase.
- Laver les cellules 3 fois avec PBS, puis incuber avec le tampon de blocage/permeabilisation (BSA 5%, Triton X-100 0,5%, inhibiteur 1x phosphatase) pendant 1 h.
- Incuber avec un anticorps anti-pCREB 1:500 (en BSA à 3%, 0,1% Triton X-100) pendant la nuit à 4 °C.
- Le lendemain, laver 3 fois avec 1x PBS, et incuber pendant 1 h avec l’anticorps secondaire 1:500 (3% BSA, 0,1% Triton X-100).
- Laver 3 fois avec 1x PBS. Ajouter la solution de tache nucléaire Hoechst (5 μg/mL) pendant 7 min.
- Laver 3 fois avec 1x PBS et monter.
- Visualisation du transport axonal rétrograde de BDNF-QD dans les neurones vivants
- Préparer les chambres microfluidiques et les neurones de graines comme décrit précédemment16.
- Après 7-8 jours dans la culture, changer le milieu au milieu non-complété de neurobasal.
- Préparez mbtBDNF conjugué aux points quantiques (BDNF-QD) en ajoutant à un aliquot mbtBDNF, le volume nécessaire de point quantique streptavidin conjugué (streptavidin-QD) pour atteindre un rapport molaire BDNF-QD 1:1. Puis, diluer à 20 μL avec le milieu neurobasal. Enveloppez le tube dans du papier d’aluminium pour le protéger de la lumière.
REMARQUE : Préparez un autre tube avec le même volume de streptavidine à points quantiques conjugué et diluez-le à 20 μL avec un milieu neurobasal comme un contrôle. - Incuber le mélange mbtBDNF/streptavidin-QD pendant 30 min à température ambiante dans un rocker.
- Diluer le BDNF-QD à la concentration finale souhaitée (2 nM).
- Après 1 h d’incubation avec le milieu neurobasal non complété ajouter le BDNF-QD ou le mélange de commande aux compartiments axonaux de la chambre microfluidique. Incuber pendant 210 min à 37 °C pour assurer un transport net rétrograde de BDNF-QD.
- Pour l’imagerie à cellules vivantes, visualisez le transport rétrograde axonal dans le segment des microgrooves qui est proximal au compartiment du corps cellulaire à l’aide d’un objectif 100x à l’aide d’un microscope adapté à ces fins (37 °C et 5% de CO2). Acquérir des images à 1 cadre/s.
Résultats
L’utilisation d’un protocole chromatographique basé sur les colonnes permet le traitement de volumes importants de supports conditionnés HEK293. Dans la figure 1, les résultats de la purification de BDNFAvi à partir de 500 mL de support conditionné sont affichés. Les élutions consécutives de BDNFAvi des perles d’agarose Ni-NTA donnent des concentrations décroissantes de BDNFAvi (Figure 1A). Après quatre ellutions consécutives (chacune d’une durée de 15 min), la majorité du BDNF capturé par les perles est récupérée. Les concentrations des eluates varient de 6 à 28 ng/μL, et le rendement total s’élevait à environ 60 μg de BDNFAvi (tableau 1). Le BDNFAvi produit a ensuite été efficacement biotinylé par une réaction in vitro médiée par BirA-GST, comme en témoigne l’absence de BDNFAvi non biotinylé dans le supernatant (figure 1B). Veuillez noter que la biotinylation présentée à la figure 1B correspond à un aliquot du montant total produit par BDNF, mais la réaction peut être intensifiée pour des volumes plus importants.
Ensuite, l’activité biologique du mbtBDNF a été évaluée à l’aide de 2 approches expérimentales différentes. Tout d’abord, les neurones corticaux ensemencés dans des plaques de 60 mm (2 millions de neurones, DIV7) ont été stimulés avec 50 ng/mL de mbtBDNF pendant 30 min, puis des protéines ont été préparées pour l’analyse occidentale de tache. L’activité biologique du mbtBDNF a été quantifiée en détectant pTrkB (Y515) et pERK (T202/Y204). La liaison de BDNF à TrkB déclenche l’activation du récepteur par une réaction d’autophosphorylation dans son domaine intracellulaire, et ERK est une cible connue de la voie de signalisation BDNF22. Les bandes des deux protéines phosphorylées présentaient une intensité similaire dans les neurones traités par le BDNF et le mbtBDNF commerciaux, et les deux montraient un signal plus fort que l’état témoin (figure 2A). Ensuite, l’activité biologique du mbtBDNF couplée à la streptavidine-QD a été évaluée pour démontrer qu’ils peuvent être utilisés dans des expériences d’imagerie vivante. Les neurones corticaux ont été ensemencés en couvertures de 10 mm (40 000 cellules par couverture, DIV7) et traités avec une concentration finale de 200 pM ou 2 nM BDNF-QD pendant 30 min avant de fixer et de tacher pour pcreb. CREB est un facteur de transcription qui est ciblé par activé ERK1/2 dans les neurones corticaux22,23. La stimulation des neurones avec des concentrations croissantes de BDNF-QD a entraîné une augmentation dépendante de la dose de la phosphorylation de CREB et la présence de particules QD entourant le noyau (Figure 2B), ce qui indique que les particules BDNF-QD ont été endocytosées et ont déclenché l’activation des voies de signalisation associées à l’activation du TrkB à médiation BDNF. Une double augmentation du signal pCREB a été détectée lors de la stimulation des neurones avec une faible concentration de BDNF-QD (200 pM), tandis que la stimulation avec 2 nM a entraîné une augmentation de 3,5 fois du signal pcreb (figure 2C). Ces résultats démontrent que le BDNFAvi biotinylé est biologiquement actif, et qu’il ne perd pas son activité lorsqu’il est couplé à la streptavidine-QD, ce qui le rend approprié pour l’immunofluorescence et l’imagerie cellulaire vivante.
Enfin, le potentiel d’imagerie de BDNF-QD a été évalué dans les cultures compartimentées à l’aide de chambres microfluidiques. Les neurones corticaux ont été ensemencés dans des chambres microfluidiques (couvertures de 15 mm, 50 000 neurones par chambre microfluidique, DIV7) pour séparer les compartiments axonal et somatodendritiques et ont été stimulés avec 2 nM BDNF-QD pour 3,5 h. La microscopie cellulaire vivante a été effectuée, et les kymographes résultants ont été utilisés pour quantifier la vitesse de BDNF-QD contenant des organites (Figure 3A). Une vitesse mobile moyenne de 0,91 μm/s a été détectée (figure 3B), ce qui est conforme aux analyses antérieures du transport cytoplasmique à médiation de la dyneine7,16. Les chambres microfluidiques traitées avec 2 nM streptavidin-QD n’ont pas montré les QDs mobiles dans les microgrooves, comme le montre le kymographe (Figure 3A). Les cellules cultivées dans les mêmes conditions ont été stimulées avec 500 pM ou 2 nM BDNF-QD pendant 210 min, puis fixées et étiquetées avec une coloration nucléaire. Comme le montre la figure 3C, les neurones montrent une accumulation dose-dépendante de BDNF-QD dans tous les sous-compartiments analysés, y compris les parties proximales et distales du microgroove et du compartiment somatodendritique. En revanche, les neurones témoins n’ont montré presque aucun signal QD dans toute la chambre. Par conséquent, le BDNF-QD peut être détecté dans les cellules vivantes et fixes dans les chambres microfluidiques.
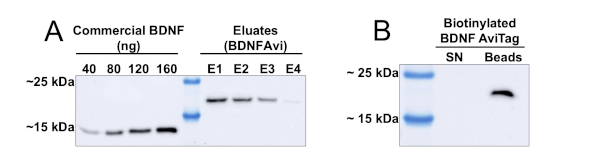
Figure 1 : Production et mono-biotinylation de BDNFAvi dans les cellules HEK293. Les cellules HEK293 ont été transfectées à l’aide du réactif de l’Île-du-Prince-Édouard et d’un plasmide d’encodage BDNFAvi et le milieu conditionné a été recueilli après 48 h. BDNFAvi contient une étiquette d’hétidine 6x permettant la purification à l’aide de la chromatographie de l’acide nickel-nitrilotriacétique (Ni-NTA). Le BDNF humain recombinant disponible dans le commerce a un poids moléculaire attendu de ~13 kDa, tandis que BDNFAvi affiche un poids moléculaire de ~18 kDa. BDNFAvi lié à la résine a été entièrement éluté avec quatre étapes d’élution consécutives. (A) Tache occidentale utilisant des anticorps anti-BDNF pour détecter dans la maison préparé recombinant BDNF et BDNF commercial. Des aliquots contenant des quantités connues de BDNF humaine disponible dans le commerce et 5 μL de chaque eluate ont été chargés dans un gel SDS-PAGE pour la détection de BDNFAvi à l’aide d’un anticorps contre le BDNF. Le tableau 1 indique les concentrations de BDNFAvi présentes dans chaque éluate. La quantité et la concentration de BDNF dans chaque eluate ont été obtenues par analyse et interpolation densitométriques à partir de la courbe de concentration du BDNF disponible dans le commerce. (B) Vérification de la biotinylation BDNFAvi. Quatre-vingts nanogrammes de BDNFAvi biotinylé (mbtBDNF) ont été incubés avec 30 μL de streptavidine couplés à des perles magnétiques (20% de lisier) pendant 1 heure à 4 °C. Ensuite, les perles magnétiques ont été isolées à l’aide d’un séparateur magnétique. Les perles de streptavidine ont été chauffées avec tampon de chargement pour élute le BDNFAvi biotinylé (voie de perles). Le supernatant (voie SN) a également été traité avec un tampon de chargement, chauffé et chargé dans le gel (voie SN). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
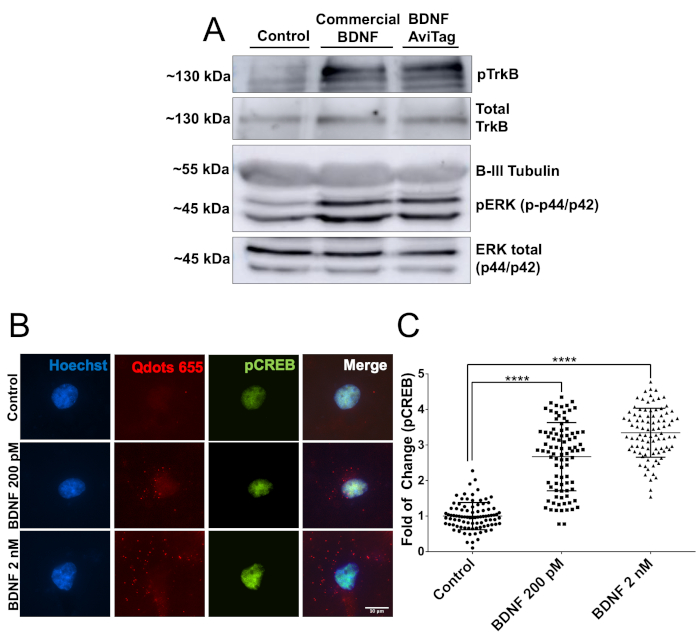
Figure 2 : Vérification de l’activité biologique du mbtBDNF. (A) Les neurones corticaux DIV7 étaient des sérums affamés pendant 1 h, puis stimulés avec 50 ng/mL de BDNF ou mbtBDNF disponibles dans le commerce pendant 30 min. Les protéines ont été extraites et chargées dans un gel SDS-PAGE pour analyse de TrkB et ERK1/2 phosphorylation à l’aide d’anticorps spécifiques au phospho et comparées aux niveaux totaux de la protéine utilisant des anticorps contre le TrkB et ERK1/2. (B) Les neurones corticaux de DIV7 étaient affamés de sérum pendant 1 h, et alors stimulés avec une concentration finale de 200 pM ou 2 nM de mbtBDNF couplé à streptavidin-QD (BDNF-QD) pendant 30 min. Ensuite, les cellules ont été fixes et le PCREB a été étiqueté pour l’analyse de microscopie de fluorescence. (C) Quantification de l’intensité de fluorescence du PCREB nucléaire. Les résultats correspondent à 90 neurones regroupés à partir de 3 expériences indépendantes, présentées sous forme de ± SEM moyen. L’analyse statistique correspond à un ANOVA à sens unique avec le test de comparaisons multiples de Tukey (p &p; 0,0001). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Visualisation du BDNF-QD dans les cellules vivantes et fixes. (A) Les neurones corticaux DIV7 cultivés dans des chambres microfluidiques ont été stimulés dans le compartiment axonal avec une concentration finale de 2 nM BDNF-QD pendant 3,5 heures, puis la partie proximale des microgrooves a été imaged utilisant un réglage de microscopie cellulaire vivante. Des kymographes représentatifs pour l’état de commande (traités avec la streptavidin-QD) et sur le traitement avec BDNF-QD sont montrés. (B) Quantification de la vitesse de déplacement du BDNF-QD. Les punctas mobiles ont été définis comme ceux qui ont déplacé plus de 10 μm dans les 120 s d’enregistrement. (C) Les neurones corticaux DIV7 cultivés dans des chambres microfluidiques ont été stimulés dans le compartiment axonal avec une concentration finale de BDNF-QD de 500 pM ou 2 nM pendant 3,5 heures, puis fixés et étiquetés avec Hoechst pour visualiser les noyaux. Des images représentatives du compartiment somatodendritique et des parties distales et proximales des microgrooves sont montrées. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Éluat | BDNF (ng) en 5μl | [ng/μl] | BdNF total [μg] |
| E1 | 142.2 | 28.4 | 28.4 |
| E2 | 101.2 | 20.2 | 20.2 |
| E3 | 65.6 | 13.1 | 13.1 |
| E4 | 30.4 | 6.1 | 6.1 |
| 67.8 |
Tableau 1 : Quantification du rendement de purification BDNFAvi (lié à la figure 1A). Les cellules HEK293 ont été transfectées avec une expression bdnfavi de conduite de plasmide, et la protéine a été purifiée par la chromatographie d’affinité de Ni-NTA. La concentration de protéines et le rendement final ont été calculés par analyse et interpolation densitométrique dans la courbe de concentration connue du BDNF humain recombinant disponible dans le commerce.
Fichier supplémentaire 1 : Médias culturels et composants tampons Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans cet article, une méthodologie optimisée pour la production et la purification du mbtBDNF dans une procédure basée sur la chromatographie d’affinité est décrite, basée sur le travail de Sung et collaborateurs17. Les optimisations comprennent l’utilisation d’un réactif transfection rentable (Î.-P.-É.) tout en maintenant l’efficacité de méthodes de transfection plus coûteuses comme la lipofectamine. Cette optimisation se traduit par une réduction significative des coûts du protocole, permettant l’évolutivité tout en maintenant un rapport coût-efficacité élevé. Le protocole comprend également des considérations de facilité d’utilisation, y compris le gel des supports conditionnés pour un temps pouvant aller jusqu’à 2 mois. Ces optimisations rendent la procédure adaptable aux besoins de chaque laboratoire, améliorent la rentabilité et produisent un BDNF recombinant homogène et biologiquement actif. Le protocole peut également être adapté aux productions à plus petite échelle en remplaçant l’utilisation de l’appareil de chromatographie par des précipitations gravitationnelles des perles dans les tubes coniques. Cela constitue une méthodologie viable, mais son moins efficace en temps et a entraîné des rendements inférieurs dans notre expérience. Le BDNF étiqueté biotine peut ensuite être couplé à différentes sondes liées à la streptavidine, y compris les fluorophores et les nanoparticules paramagnétiques, ce qui en fait un outil précieux pour effectuer divers types d’expériences pour l’analyse du trafic post-endocytique bdnf. Par conséquent, un protocole de production optimisé et simple pour cette protéine est très utile aux laboratoires travaillant dans ce domaine.
La production de protéines recombinantes avec des modifications post-translationnelles complexes, telles que BDNF24, dans les systèmes procaryotes se traduit souvent par des protéines qui ne sont pas correctement pliées et ont donc une faible activité biologique25. Par conséquent, l’expression dans les cellules de mammifères est nécessaire pour obtenir une protéine bioactive. L’utilisation de l’Île-du-Prince-Édouard a déjà été décrite comme une alternative viable pour la production à grande échelle de protéines recombinantes dans les cellules de mammifères transfectés25,26, et son efficacité dans la transfection des cellules HEK293 dans le contexte des laboratoires universitaires a été mis en évidence27. Par conséquent, l’utilisation de cette ligne cellulaire représente une option valable pour produire BDNFAvi sur une échelle qui peut être gérée par un laboratoire universitaire. Le protocole proposé pourrait être encore optimisé par la génération d’une ligne cellulaire HEK293 transfectée avec BDNFAvi, ce qui éliminerait l’étape transitoire de transfection, ce qui permettrait d’économiser du temps et des ressources. Une autre source potentielle d’optimisation est l’utilisation de cellules en suspension au lieu de cellules adhérentes. Les cellules HEK293 peuvent être maintenues en suspension, générant des quantités significatives de protéines recombinantes dans la gamme des grammes par litre28.
Une autre amélioration du protocole est la biotinylation de la protéine BDNFAvi à l’aide d’une stratégie in vitro, remplaçant le protocole de co-transfection in vivo précédent. La co-transfection transitoire peut avoir des résultats inattendus en termes d’expression des constructions, comme cela a été démontré dans plusieurs lignées cellulaires et avec plusieurs réactifs de transfection29. Divers facteurs peuvent influer sur l’expression des protéines transfectées dans un contexte de co-transfection, y compris les vecteurs, les types de cellules et la concentration de plasmide. Cette multiplicité de facteurs fait de l’optimisation et de la reproductibilité une tâche complexe. D’autre part, une méthodologie in vitro permet un meilleur contrôle sur les conditions dans lesquelles la réaction de biotinylation a lieu. Cette méthodologie se traduit par un étiquetage reproductible et homogène du BDNF recombinant.
Comme l’ont démontré les expériences de vérification de l’activité biologique, le mbtBDNF produit à l’aide de ce protocole est comparable à la BDNF humaine recombinante disponible dans le commerce en termes d’activation de la voie de signalisation BDNF-TrkB. Les données montrent également que le couplage BDNF à streptavidin-QD n’interfère pas avec la signalisation BDNF-TrkB. En outre, nous avons montré que BDNF-QD peut être détecté par microscopie d’épifluorescence dans les cellules vivantes et fixes. Par conséquent, mbtBDNF représente un outil précieux pour étudier le trafic axonal rétrograde et il présente des avantages significatifs par rapport aux sondes alternatives, telles que BDNF-GFP16. Le protocole décrit dans cet article fournit une méthodologie fiable et cohérente pour la production de mbtBDNF, qui peut ensuite être utilisé dans les études de dynamique post-endocytique dans différents modèles neuronaux exprimant TrkB ou p75. La signalisation BDNF a des effets puissants sur la morphologie neuronale et la fonction3,4,21, et a été récemment proposé comme un outil thérapeutique potentiel pour améliorer la régénération neuronale30,31, ce qui rend son étude pertinente dans les domaines de la biologie cellulaire et de la biomédecine. L’étude des effets de la signalisation et du trafic de BDNF fera progresser notre compréhension de la biologie des cellules neuronales et pourrait permettre l’exploitation de son potentiel régénératif dans les milieux cliniques.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs reconnaissent avec gratitude le soutien financier de Fondecyt (1171137) (FCB), du Centre basal d’excellence en science et technologie (AFB 170005) (FCB), Millenium-Nucleus (P07/011-F) (FCB), le Wellcome Trust Senior Investigator Award (107116/Z/15/Z) (GS) et un prix de la Uk Dementia Research Institute Foundation (GS). Ce travail a été soutenu par l’Unidad de Microscopía Avanzada UC (UMA UC).
matériels
| Name | Company | Catalog Number | Comments |
| 2 way stopcock | BioRad | 7328102 | Chromatography apparatus component |
| 2-mercaptoethanol | Sigma | M6250 | BDNF elution buffer |
| Acrylamide/Bisacrylamide | BioRad | 1610154 | SDS-PAGE gel preparation |
| Amicon Ultra-15 10K | Millipore | UFC901024 | BDNF concentration |
| Ammonium Persulfate | Sigma | A9164 | SDS-PAGE gel preparation |
| anti B-III-Tubulin antibody | Sigma | T8578 | Western blot assays for BDNF biological activity detection |
| anti BDNF antibody | Alomone | AGP-021 | Western blot assays for BDNF quantification |
| anti BDNF antibody | Alomone | ANT-010 | Western blot assays for BDNF quantification |
| Anti ERK antibody | Cell Signaling | 9102 | Western blot assays for BDNF biological activity detection |
| anti pCREB antibody (S133) | Cell Signaling | 9198 | Western blot assays for BDNF biological activity detection |
| anti pERK antibody (T202, Y204) | Cell Signaling | 4370 | Western blot assays for BDNF biological activity detection |
| anti pTrkB antibody (Y515) | Abcam | ab109684 | Western blot assays for BDNF biological activity detection |
| Antibiotic/Antimycotic | Gibco | 15240-062 | HEK293 maintenance |
| ATP | Sigma | A26209 | BDNF monobiotinylation buffer |
| B-27 Supplement | Gibco | 17504-044 | Neuron maintenance |
| Bicine | Sigma | B3876 | BDNF monobiotinylation buffer |
| BirA-GST | BPS Bioscience | 70031 | Enzyme for BDNF AviTag monobiotinylation |
| Bovine Fetal Serum | HyClone | HC.SH30396.02 | HEK293 maintenance |
| Bovine Serum Albumin | Jackson ImmunoResearch | 001-000-162 | BDNF buffer modification component, blocking buffer for western blot and immunofluorescence |
| D-Biotin | Sigma | B4639 | BDNF monobiotinylation buffer |
| DMEM High Glucose Medium | Gibco | 11965-092 | Neuron seeding |
| DMEM Medium | Gibco | 11995-081 | HEK293 maintenance |
| Econo Column Funnel | BioRad | 7310003 | Chromatography apparatus component |
| EDTA | Merck | 108418 | |
| EZ-ECL Kit | Biological Industries | 1633664 | Protein detection by western blotting |
| Glutamax | Gibco | 35050-061 | Neuron and HEK293 maintenance |
| Glycerol | Merck | 104094 | BDNF elution buffer, lysis buffer for western blot assays |
| Hettich Rotina 46R Centrifuge | Hettich | Discontinued | Centrifuge used for clearing the medium of debris |
| Hettich Universal 32R Centrifuge | Hettich | Discontinued | Centrifuge used for protein concentrator centrifugation |
| Horse Serum | Gibco | 16050-122 | Neuron seeding |
| ImageQuant LAS 500 | GE Healthcare Life Sciences | 29005063 | Western blot image acquisition |
| Imidazole | Sigma | I55513 | BDNF buffer modification component |
| KCl | Winkler | BM-1370 | PBS component |
| KH2PO4 | Merck | 104873 | PBS component |
| Laminin | Invitrogen | 23017-015 | Cover coating for compartmentalized neurons |
| Luer Tubing Adaptor | BioRad | 7323245 | Chromatography apparatus component |
| Luminata™ Forte Western HRP Substrate | Millipore | WBLUF0100 | Protein detection by western blotting |
| Mg(CH3COO)2 | Merck | 105819 | BDNF monobiotinylation buffer |
| Mowiol 4-88 | Calbiochem | 475904 | Mounting reagent for immunofluorescence assays |
| MyOne C1 Streptavidin Magnetic Beads | Invitrogen | 65001 | Biotinylation verification |
| Na2HPO4 | Merck | 106586 | BDNF buffer modification component |
| NaCl | Winkler | BM-1630 | PBS component, BDNF buffer modification component |
| NaH2PO4 | Merck | 106346 | BDNF buffer modification component |
| Neurobasal Medium | Gibco | 21103-049 | Neuron maintenance |
| Ni-NTA Agarose Beads | Qiagen | 30210 | BDNF AviTag purification |
| Nikon Ti2-E | Nikon | Microscope for fluorescence imaging | |
| Nitrocellulose Membrane | BioRad | 1620115 | Protein transfer for western blotting |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | C13440-20CU | Camera for epifluorescence imaging |
| P8340 Protease Inhibitor Cocktail | Sigma | P8340 | BDNF buffer modification component |
| Paraformaldehyde | Merck | 104005 | Fixative for immunofluorescence assays |
| Penicillin/Streptomycin | Gibco | 15140-122 | Neuron maintenance |
| Poli-D-Lysine | Corning | DLW354210 | Cover coating for compartmentalized neurons |
| Poli-L-Lysine | Millipore | P2363 | Cover coating for non-compartmentalized neurons |
| Poly-Prep Chromatography Column | BioRad | 7311550 | Chromatography apparatus component |
| Polyethyleneimine 25K | Polysciences Inc. | PLY-0296 | HEK293 transfection |
| Quantum Dots 655 streptavidin conjugate | Invitrogen | Q10121MP | Monobiotinylated BDNF AviTag label for live and fixed cell experiments |
| Saponin | Sigma | S4521 | Detergent for immunofluorescence assays |
| Syldgard 184 silicone elastomer base | Poirot | 4019862 | Microfluidic chamber preparation |
| TEMED | Sigma | T9281 | SDS-PAGE gel preparation |
| Tris | Winkler | BM-2000 | Lysis buffer component |
| Triton X100 | Merck | 108603 | Cell permeabilization in immunofluorescence and western blot assays |
| Trypsin-EDTA 0.5% | Gibco | 15400-054 | HEK293 passaging |
Références
- Huang, E., Reichardt, L. Neurotrophins: Roles in Neuronal Development and Function. Annual Review of Neuroscience. 24, 677-736 (2001).
- Skaper, S. D. The neurotrophin family of neurotrophic factors: an overview. Methods in Mollecular Biology. 846, 1-12 (2012).
- Gonzalez, A., Moya-Alvarado, G., Gonzalez-Billault, C., Bronfman, F. C. Cellular and molecular mechanism regulating neuronal growth by brain-derived neurotrophic factor. Cytoskeleton. 73 (10), 612-628 (2016).
- Cunha, C., Brambilla, R., Thomas, K. A simple role for BDNF in learning and memory. Frontiers in Mollecular Neuroscience. 3, 1(2010).
- Bronfman, F. C., Lazo, O. M., Flores, C., Escudero, C. A. Spatiotemporal intracelular dynamics of neurotrophin and its receptors. Implications for neurotrophin signaling and neuronal function. Neurotrophic Factor. Handbook of Experimental Pharmacology. Lewin, G., Carter, B. 220, Springer. Berlin, Heidelberg. (2014).
- Ascano, M., Bodmer, D., Kuruvilla, R. Endocytic trafficking of neurotrophins in neural development. Trends in Cell Biology. 22 (5), 266-273 (2012).
- Deinhardt, K., Salinas, S., Verastegui, C., Watson, R., Worth, D., Hanrahan, S., Bucci, C., Schiavo, G. Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway. Neuron. 52 (2), 293(2006).
- Escudero, C. A., et al. c-Jun N-terminal kinase (JNK)-dependent internalization and Rab5-dependent endocytic sorting medaited long-distance retrograde neuronal death induced by axonal BDNF-p75 signaling. Scientific Reports. 9, 6070(2019).
- Vrabec, J. P., Levin, L. A. The neurobiology of cell death in glaucoma. Eye. 21, Suppl 1 11-14 (2007).
- Liot, G., Zala, D., Pla, P., Mottet, G., Piel, M., Saudou, F. Mutant huntingtin alters retrograde transport of TrkB receptors in striatal dendrites. Journal of Neuroscience. 33 (15), 6298-6309 (2013).
- Zhou, B., Cai, Q., Xie, Y., Sheng, Z. H. Snapin recruits dynein to BDNF-TrkB signaling endosomes for retrograde axonal transport and is essential for dendrite growth of cortical neurons. Cell Reports. 2 (1), 42-51 (2012).
- Haubensak, W., Narz, F., Heumann, R., Lessmann, V. BDNF-GFP containing secretory granules are localized in the vicinity of synaptic junctions of cultured cortical neurons. Journal of Cell Science. 111 (11), 1483-1493 (1998).
- Adachi, N., et al. Glucocorticoid affects dendritic transport of BDNF-containing vesicles. Scientific Reports. 5, 12684(2015).
- Biocompare: The Buyer's Guide for Life Scientists. Mirus Bio. Cellular Toxicity Caused by Transfection: Why is it important. , Available from: https://www.biocompare.com/Bench-Tips/121111-Cellular-Toxicity-Caused-by-Transfection-Why-is-it-important/ (2012).
- Zhao, L., et al. Mechanism underlying activity-dependent insertion of TrkB into the neuronal surface. Journal of Cell Science. 122 (17), 3123-3136 (2009).
- Zhao, X., Zhou, Y., Weissmiller, A., Pearn, M., Mobley, W., Wu, C. Real-time imaging of axonal transport of quantum dot-labeled BDNF in primary neurons. Journal of Visualized Experiments. 91, 51899(2014).
- Sung, K., Maloney, M., Yang, J., Wu, C. A novel method for producing mono-biotinylated, biologically active neurotrophic factors: an essential reagent for single molecule study of axonal transport. Journal of Neuroscience Methods. 200 (2), 121-128 (2011).
- Deerinck, T. The application of fluorescent quantum dots to confocal, multiphoton and electron microscopic imaging. Toxicologic Pathology. 36 (1), 112-116 (2008).
- Unsain, N., Nuñez, N., Anastasia, A., Mascó, D. H. Status epilepticus induces a TrkB to p75 neurotrophin receptor switch and increases brain-derived neurotrophic factor interaction with p75 neurotrophon receptor: an initial event in neuronal injury induction. Neuroscience. 154 (3), 978-993 (2008).
- Walker, J. M. The bicinchoninic acid (BCA) assay for protein quantitation. Methods Mol Biol. 32, 5-8 (1994).
- Moya-Alvarado, G., Gonzalez, A., Stuardo, N., Bronfman, F. C. Brain-derived neurotrophic factor (BDNF) regulates Rab5-positive early endosomes in hippocampal neurons to induce dendritic branching. Frontiers in Cellular Neuroscience. 12, 493(2018).
- Sasi, M., Vignoli, B., Canossa, M., Blum, R. Neurobiology of local and intercellular BDNF signaling. Pflugers Archiv European Journal of Physiology. 469 (5), 593-610 (2017).
- Gonzalez, A., Lazo, O. M., Bronfman, F. C. The Rab5-Rab11 endosomal pathway is required for BDNF-induced CREB transcriptional regulation in neurons. , Available from: https://www.biorxiv.org/content/10.1101/844720v1 (2019).
- Mowla,, et al. Biosynthesis and post-translational processing of the precursor to brain-derived neurotrophic factor. Journal of Biological Chemistry. 276 (16), 12660-12666 (2001).
- Longo, P., Kavran, J., Kim, M. S., Leahy, D. Transient Mammalian Cell Transfection with Polyethyleneimine (PEI). Methods in Enzymology. 529, 227-240 (2013).
- Raymond, C., Tom, R., Perret, S., Moussouami, P., L'Abbé, D., St-Laurent, G., Durocher, Y. A simplified polyethyleneimine-mediated transfection process for large-scale and high-throughput applications. Methods. 55 (1), 44-51 (2011).
- Dalton, A., Barton, W. Over-expression of secreted proteins from mammalian cell lines. Protein Science. 23 (5), 517-525 (2014).
- Hunter, M., Yuan, P., Vavilala, D., Fox, M. Optimization of protein expression in mammalian cells. Current Protocols in Protein Science. 95 (1), 77(2019).
- Stepanenko, A. A., Heng, H. H. Transient and stable vector transfection: Pitfalls, off-target effects, artifacts. Mutation Research. 773, 91-103 (2017).
- Guerzoni, L. P., Nicolas, V., Angelova, A. In vitro modulation of TrkB receptor signaling upon sequential delivery of curcumin-DHA loaded carriers towards promoting neuronal survival. Pharmaceutical Research. 34 (2), 492-505 (2017).
- Angelova, A., Angelov, B. Dual and multi-drug delivery nanoparticles towards neuronal survival and synaptic repair. Neural Regeneration Research. 12 (6), 886-889 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon