Method Article
Un modello immunologico per il trapianto di cellule cardiache e cardiache cardiache cardiache cardiache cardiache cardiache
In questo articolo
Riepilogo
Descriviamo un modello di trapianto di cuore addominale eterotopico nei ratti, implicando modifiche delle strategie attuali, che portano a un approccio chirurgico semplificato. Inoltre, descriviamo un nuovo modello di rigetto mediante iniezione in-ear di cellule muscolari cardiache vitali, consentendo ulteriori analisi immunologiche dei trapianti nei ratti.
Abstract
Il trapianto di cuore eterotopico nei ratti è stato un modello comunemente usato per diversi studi immunologici per più di 50 anni. Dalla prima descrizione del 1964 sono state segnalate diverse modifiche. Dopo 30 anni di esecuzione trapianto di cuore eterotopico nei ratti, abbiamo sviluppato un approccio chirurgico semplificato, che può essere facilmente insegnato ed eseguito senza ulteriore formazione chirurgica o sfondo.
Dopo la dissezione dell'aorta ascendente e l'arteria polmonare e la legatura delle vene cavalleria e polmonare superiori e inferiori, il cuore del donatore viene raccolto e successivamente perfuso con soluzione salina ghiacciata integrata con eparina. Dopo aver bloccato e incitato i vasi addominali ricitati, l'aorta ascendente del donatore e l'arteria polmonare vengono anastomused all'aorta addominale ricevente e vena cava inferiore, rispettivamente, utilizzando suture di corsa continue.
A seconda delle diverse combinazioni donatore-ricevente, questo modello consente di analizzare il rifiuto acuto o cronico degli alloinnesti. Il significato immunologico di questo modello è ulteriormente rafforzato da un nuovo approccio di iniezione nell'orecchio di cellule muscolari cardiache vitali e dalla successiva analisi del tessuto linfatico cervicale drenante.
Introduzione
Il trapianto di cuore eterotopico è un modello sperimentale spesso usato per diverse indagini riguardanti la tolleranza ai trapianti, il rigetto degli alloinnesti acuti e cronici, la lesione da ischemia-reperfusione, la perfusione di macchine o il rimodellamento cardiaco. Tra gli altri vantaggi, la funzione di innesto può essere monitorata in modo non invasivo dalla palpazione e l'insufficienza dell'innesto non comporta una compromissione vitale del ricevente in contrasto con altri organi, come reni o fegati.
Nel 1964, Abbott et al. inizialmente descrisse il trapianto di cuore addominale eterotopico nei ratti1. Più tardi, nel 1966, la tecnica end-to-side per le anastomosi è stata descritta da Tomita et al.2. Le basi per il modello attualmente utilizzato sono state riportate da Ono e Lindsey nel 19693. Nel corso degli ultimi decenni, sono state pubblicate diverse modifiche per creare diversi tipi di innesti cardiaci ventricolari lasciati scaricati, parzialmente caricati o caricati, tra cui il trapianto combinato di cuore eterotopico4,5,6. Per le analisi immunologiche, un trapianto di innesto cardiaco caricato non in volume viene più comunemente eseguito. In questo caso, il flusso sanguigno entra retrogradamente nell'aorta ascendente del donatore e successivamente nelle arterie coronarie. Il drenaggio venoso si verifica lungo il seno coronarico nell'atrio destro e nel ventricolo (Figura 1A-B). Pertanto, il ventricolo sinistro è escluso dal flusso sanguigno, a parte le quantità marginali di sangue dalle vene tebesi. Questo lo rende anche un modello utile per studiare i meccanismi patofisiologici durante la terapia dispositivo di assistenza ventricolare sinistra7.
Il trapianto di cuore eterotopico è stato eseguito in varie specie tra cui topi, conigli, maiali ed è stato anche utilizzato come dispositivo di assistenza uni- o biventricolare in esseri umani8,9,10,11. Il ratto rappresenta ancora un popolare animale sperimentale per i modelli di trapianto, soprattutto perché i tempi di sopravvivenza dell'innesto per diverse combinazioni di ceppo di ratto sono stati ben definiti in passato e un gran numero di reagenti immunologici sono accessibili12,13. A differenza dei topi, i ratti sono più grandi rendendo la chirurgia e l'accesso al tessuto linfatico per analisi immunologiche più fattibile12. Inoltre, l'introduzione di tecnologie di clonazione commerciale nei ratti negli ultimi anni porterà molto probabilmente ad un interesse ricorrente per i modelli sperimentali di ratto14.
In generale, gli innesti cardiaci eterotopici possono essere attaccati ai vasi riceventi eseguendo anastomosi cervicale o addominale. Tuttavia, alcuni studi suggeriscono che un anastomosi femorale facilita un migliore monitoraggio grazie a un migliore accesso per la palpazione manuale o l'ecocardiografia transfemorale e permette quindi un rilevamento più preciso del fallimento dell'innesto15,16.
È stato dimostrato che non vi è alcuna differenza per quanto riguarda il tempo di funzionamento, il tasso di complicanza, il risultato e il tempo di sopravvivenza dell'innesto tra entrambe le tecniche di anastomosis17. Chiaramente, la disponibilità di un numero sufficiente di linfonodi drenanti deve essere menzionata come un beneficio dell'anastomosi cervicale; tuttavia, sono necessari periodi di formazione più lunghi. Al contrario, l'anastomosi addominale è meno complicata e altrettanto preziosa per le indagini immunologiche, soprattutto se combinata con i risultati di un nuovo metodo di iniezione in orecchio di cellule muscolari cardiache allogeniche e successiva linfadenectomia cervicale. Una combinazione di entrambi i modelli offre un ampio spettro di analisi immunologiche post-interventistiche.
Il seguente protocollo si riferisce al funzionamento in coppie di chirurghi al fine di ridurre il tempo di ischemia. Tuttavia, tutti gli esperimenti possono essere eseguiti da una singola persona. L'installazione di strumenti e materiali per l'espianto e l'impianto del cuore è esposta nella figura 2A-B.
Protocollo
Tutte le esperienze sugli animali sono state effettuate secondo le linee guida del comitato locale Ethics Animal Review Board delle autorità regionali per la protezione dei consumatori e la sicurezza alimentare della Bassa Sassonia (LAVES, Oldenburg, Germania) con le ID di approvazione 12/0768 e 17/2472.
1. Espianto e perfusione cardiaco
NOTA: Come donatori di innesto, sono stati utilizzati ratti maschi o femmine all'età di 7-22 settimane.
- Anestesizzare il ratto donatore per inalazione isoflurane (induzione al 5% e manutenzione al 3% con un flusso O2 di 1 L/min). Iniettare 5 mg di Carprofen sottocutaneamente per kg di peso corporeo per analgesia perioperatoria e verificare l'assenza del riflesso di ritiro del pizzico.
- Applicare il lubrificante per gli occhi e rimuovere la pelliccia addominale e toracica utilizzando un clipper meccanico.
- Mettere il donatore in posizione supina, fissare gli arti alla base del tavolo di funzionamento con elastici e sterilizzare la pelle con il 70% di etanolo o un'altra alternativa sufficiente.
- Incise la pelle in direzione longitudinale e dopo l'applicazione dell'anestetico locale (ad esempio, lidocaine 0,2%) eseguire una laparotomia mediana utilizzando le forbici.
- Inserire retrattili, mobilitare l'intestino a sinistra del donatore ed esporre la vena cava inferiore con tamponi di cotone sterilizzati.
- Per l'anticoagulazione, iniettare 500 U.U. di eparina sciolti in 1 mL di soluzione salina isotonica ghiacciata per via endovenosa forando la vena cava inferiore. Fermare l'emorragia nel sito di puntura mediante compressione leggera con un tampone di cotone dopo la retrazione dell'ago (Figura 3A).
- Incitare il diaframma ed eseguire la toracotomia laterale su entrambi i lati del donatore.
- Pin la parete ventrale mobilitata del torace sul tavolo dell'operazione.
- Rimuovere il pericardio e il nervo vagale con una preparazione smussata utilizzando due supporti micro-aghi.
- Eseguire la transezione dei vasi addominali al fine di esanguinare il donatore e scaricare il cuore.
- Inserire il ramo smussato di una sonda a forbici appuntite nel sinuspero pericardico trasversale e separare l'aorta ascendente e l'arteria polmonare il più possibile sotto la leggera trazione caudale del cuore con un impacco bagnato (Figura 3B).
- Posizionare una singola legatura 5-0 intorno alla vena cava superiore e inferiore e alle vene polmonari e stringerla il più dorsale possibile (Figura 3C).
- Sever il tessuto dorsale alla legatura ed estrarre il cuore (Figura 3D).
- Perfuso il cuore espiantato con una cannula da 18 G da un catetere per via endovenosa attraverso l'aorta ascendente e l'arteria polmonare con 30 mL di ghiaccio freddo, soluzione salina isotona integrata con 1000 I.U. di eparina e posizionare il cuore in un tubo da 15 mL riempito con soluzione salina su ghiaccio (Figura 3E-F).
2. Impianto cardiaco
NOTA: Come destinatari, sono stati utilizzati ratti maschi o femmine di 10-14 settimane. I donatori e i destinatari hanno avuto un peso approssimativamente abbinato.
- Eseguire l'anestesia del ratto ricevente utilizzando anche l'inalazione isoflurano (induzione al 5% e manutenzione all'1,5-2% con un flusso O2 di 1 L/min). Iniettare 5 mg di Carprofen sottocutaneamente per kg di peso corporeo per analgesia perioperatoria e verificare l'assenza del riflesso di ritiro del pizzico.
- Applicare il lubrificante per gli occhi, rimuovere la pelliccia addominale, fissare gli arti e sterilizzare la pelle analogamente alla preparazione del donatore. Per un risultato postoperatorio ottimale, eseguire l'operazione su un tappetino riscaldante per prevenire l'ipotermia intraoperatoria.
- Dopo l'incisione longitudinale della pelle, applicare un anestetico locale, come la lidocaina (0,2%), sulla fascia addominale. Aprire la cavità addominale per laparotomia mediana e inserire retrattori.
- Mobilitare l'intestino sul lato superiore sinistro del destinatario e metterlo in un impacco caldo e bagnato.
- Dopo aver mobilitato il duodenum e il jejunum prossimale, rispettivamente, utilizzando il microscopio chirurgico (o occhiali di ingrandimento) con un ingrandimento 5-7x, esporre l'aorta addominale e la vena cava inferiore per la preparazione smussata con tamponi di cotone. Non separare i vasi addominali.
- Sollevare i vasi addominali utilizzando due micro supporti ad ago senza ferire le vene lombari e posizionare il morsetto vascolare Cooley (Figura 4A).
- Forare i vasi addominali con una cannula ad arco di 27 G(Figura 4B)30-45 gradi ad arco.
- Allargare il sito di puntura utilizzando le forbici Potts per creare un'incisione longitudinale che corrisponda alle dimensioni del lume dei vasi donatori(Figura 4C-D) e perfondere i vasi destinatari con soluzione salina per rimuovere i coaguli e prevenire la trombosi postoperatoria.
- Mettere l'innesto nel situs e fissare l'aorta ascendente del donatore all'aorta addominale ricevente con due semplici punti interrotti (8-0 sutura non riassorbibile) all'angolo cranico e caudale dell'incisione longitudinale (Figura 4E).
- Anastomose l'aorta ascendente del donatore con l'aorta addominale del ricevente da un 8-0 in esecuzione sutura monofilamento in due fasi: in primo luogo, posizionare l'innesto a destra dei recipienti ed eseguire la prima metà dell'anastomosi (Figura 4E). Successivamente, posizionare l'innesto a sinistra dei recipienti ed eseguire la seconda metà dell'anastomosi (Figura 4F).
- Fissare l'arteria polmonare del donatore alla vena cava inferiore analogamente all'anastomosi aortale (8-0 sutura non riassorbibile). Suturare la prima metà dell'anastomosi venosa dal lato intraluminale della nave (Figura 4G-H).
- Sciacquare le anastomomes con la salina direttamente prima di stringere i nodi per prevenire l'embolia periferica.
- Posizionare una garza emostatica intorno a entrambe le anastomosi e rilasciare con attenzione il morsetto vascolare Cooley in modo che la reperfusione dell'innesto possa iniziare. Gestire il sanguinamento lungo le anastomosi mediante compressione leggera con tamponi di cotone sterilizzato.
NOTA: L'innesto dovrebbe iniziare a battere dopo circa 60 s. - Sostituire l'intestino in un meandro come la moda. Assicurarsi che non ci siano malrotazioni della radice mesenterica per prevenire la necrosi intestinale o l'ostruzione meccanica.
- Chiudere i muscoli/fascia addominali e la pelle separatamente utilizzando suture continue 3-0 di corsa polifilamento.
3. Cura postoperatoria
- Per l'analgesia postoperatoria, fornire ai destinatari un'iniezione sottocutanea aggiuntiva di 5 mg di Carprofen per kg di peso corporeo nel primo giorno postoperatorio (POD). Inoltre, aggiungere 1 g di Metamizol a 500 mL di acqua potabile fino al terzo POD.
- Iniziare a monitorare la funzione di innesto cardiaco da palpazione addominale quotidiana sul terzo POD.
NOTA: In caso di insufficienza di innesto prima del terzo POD, è necessario considerare un guasto chirurgico piuttosto che immunologico. Tuttavia, questo ovviamente dipende dalla combinazione di deformazione scelta e dal rispettivo modello immunologico (ad esempio, il rigetto iperacuto dopo l'immunizzazione precedente). - Dopo il rigetto del trapianto, estrarre tessuti come i linfonodi retroperitoneali drenanti cranici delle anastomosi, della milza, del sangue, del timo e dell'innesto per ulteriori analisi immunologiche tramite citometria di flusso o immunosofia.
4. digestione ezimatica del cuore e iniezione sottocutanea di cellule cardiache nell'orecchio
- Eseguire l'espianto cardiaco e la perfusione in modo analogo al trapianto di cuore eterotopico (vedere il punto 1).
- Tritare il cuore in blocchi da 3 mm x 3 mm utilizzando un bisturi sterile o forbici sterili e incubarlo per 30 min a 37 gradi centigradi in mezzo di coltura contenente 0,5 mg/mL di collagenasi.
NOTA: È importante utilizzare un mezzo di coltura contenente penicillina, streptomicina e glutammina senza siero di vitello fetale (FCS) in particolare perché FCS inibisce la digestione del collagenase. - Aggiungere il tessuto digerito a un setaccio di grandi dimensioni, rimuovendo accuratamente il mezzo di coltura e il trito per ottenere una sospensione delle cellule muscolari cardiache vitali, per lo più cellule cardiache singole morte e cellule del sangue rimanenti. Lavare due volte la sospensione cellulare con una soluzione salina isotonica sterile.
NOTA: Impostazioni di centrifugazione: 10 min, 200 x g, 20 . - Filtrare la sospensione utilizzando un colino cellulare da 40 m e raccogliere le connie cellulari vitali lavando il colino cellulare con 5-10 mL di soluzione salina isotonica.
- Dopo la centrifugazione, risospendere le cellule cerebrali cardiache in soluzione salina disciolte ad una concentrazione di 5x105 cellule/mL e disegnare la soluzione cellulare in una siringa da 1 mL.
- Eseguire l'anestesia in modo analogo al protocollo descritto per la narcosi ricevente (vedere il punto 2) per il trapianto di cuore eterotopico.
- Posizionare il destinatario in posizione laterale e fissare l'orecchio con un dito utilizzando nastro a doppio lato (Figura 5A).
- Iniettare 20 -L della soluzione della cellula muscolare cardiaca (contenente 1 x 104 cellule) tramite un cannula s.c. da 27 G vicino ai vasi capillari visivi nell'orecchio del ricevente (Figura 5B).
- Dopo un periodo di osservazione definito (a seconda della combinazione di deformazione scelta e della forza di rifiuto), estrarre i linfonodi cervicali drenanti ed eseguire ulteriori analisi come citometria di flusso o co-culture (Figura 5C).
NOTA: Inoltre, l'analisi istologica della pinna può essere eseguita per determinare l'infiltrazione cellulare.
Risultati
In passato, diverse questioni immunologiche sono state affrontate sulla base del modello, che è stato convalidato nel gruppo di lavoro da più di 500 trapianti con un tasso di sopravvivenza superiore al 95%13,18,19,20,21,22,2323,24. I tempi di funzionamento totali (compresi l'espianto e l'impianto di innesto) di solito non superavano i 60 minuti, mentre i tempi di ischemia fredda e calda combinati erano di circa 30 minuti. Le combinazioni di deformazione applicate erano basate principalmente sullo sfondo di Lewis (Lew). I trapianti sigenici sono sopravvissuti fino a 100 giorni senza segni di insufficienza dell'innesto, ma significativo peso e riduzione delle dimensioni all'espianto di innesto. Più di recente, abbiamo eseguito il trapianto di cuore eterotopico in due diverse combinazioni donatore-ricevente simulando un modello di rifiuto rapido e prolungato: Lew.1a - Lew wt che porta a un rapido rigetto (tempo medio di sopravvivenza di 7,4 giorni) e Lew.1u-7B - Lew.1a che porta ad un rigetto più prolungato (tempo di sopravvivenza medio di 42,5 giorni)(Figura 6). Macroscopicamente, gli innesti respinti mostravano una trombosi accompagnata da una scolorimento livido e gonfiore, mentre gli innesti non respinti mostrano una netta atrofia, molto probabilmente come conseguenza di un ventricolo sinistro scaricato. Inoltre, abbiamo elaborato sezioni criostatiche di cuori trapiantati al fine di rilevare l'infiltrazione cellulare utilizzando un metodo di colorazione fosfosasi-antialcaloalinae -aPAAP (APAAP). I singoli fotogrammi con un ingrandimento 50x sono stati uniti a un'immagine composita, fornendo una panoramica dell'innesto completo e della distribuzione delle cellule infiltranti. L'analisi istologica ha mostrato un aumento dell'infiltrazione delle cellule immunitarie (ad es., CD4,TCR, o NKR-P1A/B+) negli innesti allogenici, mentre gli innesti sigenici erano in gran parte privi di infiltrazioni cellulari ( Figura7A-C).
La linglia cervicale e la ri-stimolazione dei saggi delle cellule dei linfonodi drenanti dopo l'iniezione nell'orecchio di cellule muscolari cardiache nelle combinazioni di ceppo sopra menzionate hanno rivelato risposte immunitarie distinte specifiche del ceppo nei confronti del tessuto cardiaco allogenico e hanno consentito ulteriori analisi immunologiche, come la profilazione delle citochine (Figura 8A-C).
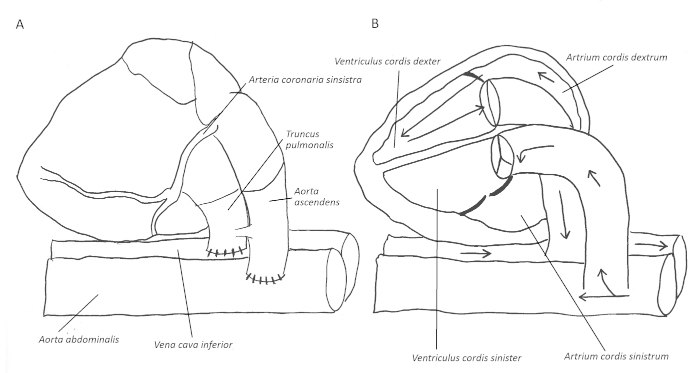
Figura 1: Presentazione schematica delle anastomosi end-to-side e del flusso sanguigno risultante attraverso il cuore. Dopo aver anastomomoing il donatore ascendente aorta end-to-side al ricevente aorta addominale e analogamente l'arteria polmonare al destinatario vena cava inferiore (A), il flusso di sangue entra nelle arterie coronarie attraverso l'aorta ascendente. Il drenaggio venoso avviene attraverso il seno coronario nell'atrio destro e ventricolo e attraverso l'arteria polmonare nella vena cava inferiore ricevente (B). Fare clic qui per visualizzare una versione più grande di questa figura.
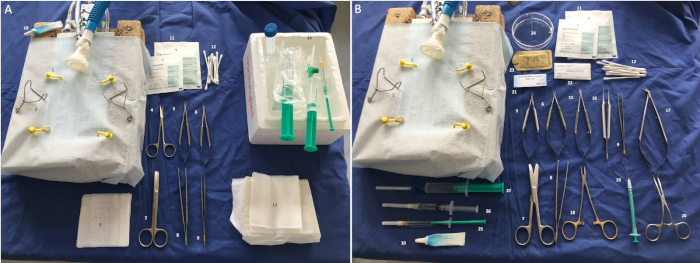
Figura 2: Strumenti e materiali chirurgici necessari. (A) Explantation: 1: fascia elastica, 2: retrattori, 3: legatura 5-0, 4: forbici a punta a sonda, 5-6: porta microbi, 7: forbici, 8: pinze chirurgiche, 9: micro pinze, 10: lubrificante per gli occhi, 11: comprime, 12: tamponi di cotone, 13: base perfusione, 14: soluzione saline sul ghiaccio. (B) Impianto: 1: fascia elastica, 2: retrattili, 5-6: micro aghi, 7: forbici di cotone, 8: pinze, 9: micropine, 10: lubrificante per gli occhi, 11: compresse, 12: tamponi di cotone, 15: micro forbici, 16: micropine, 17: Forbici Potts, 18: porta aghi, 19: cannula arcuata, 20: Clamp vascolare cool, 21: 81 suture monofilamento, 22: garza emostatica, 23: 3-0 suture polifilamento, 24: piatto Petri, 25: Carprofen (5 mg/mL), 26: anestetico locale (lidocaine 0,2%), 27: soluzione salina. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Espianto cardiaco. Dopo l'eparinizzazione (A), la toracotomia viene eseguita e l'aorta ascendente e l'arteria polmonare vengono recisi il più possibile distale (B). Con una singola legatura polmonare ed entrambe le vene di cavalco sono occluse (C) e il cuore viene rimosso dalla cavità toracica (D). (E) mostra il cuore prima e (F) dopo la perfusione con soluzione salina da 30 mL contenente l'eparina. Fare clic qui per visualizzare una versione più grande di questa figura.
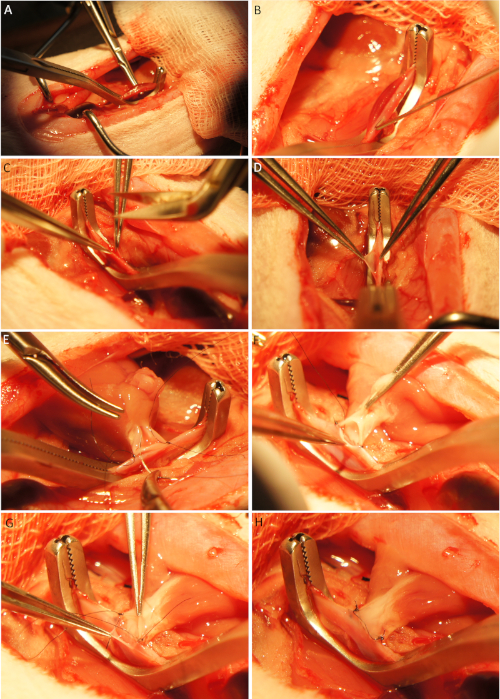
Figura 4: Impianto cardiaco. Dopo l'esposizione di vasi addominali e il posizionamento di un morsetto vascolare Cooley (A) i vasi sono cannulati (B) e un'incisione longitudinale viene eseguita utilizzando forbici Potts (C-D). L'aorta ascendente del donatore è fissato con un nodo ciascuno all'angolo cranico e caudale dell'incisione dell'aorta addominale ricevente (E) e l'anastomosi viene eseguita eseguendo continuamente suture (E-F). Si noti che l'innesto è posto sul lato destro dei vasi per la prima metà dell'anastomosi (E) e sul lato sinistro dei vasi per la seconda metà dell'anastomosi (F) e la successiva anastomosi venosa. La prima metà dell'anastomosi venosa viene eseguita da una sutura intraluminale (G). Dopo aver terminato la seconda metà dell'anastomosi venosa, l'innesto è pronto per la riperfusione (H). Fare clic qui per visualizzare una versione più grande di questa figura.
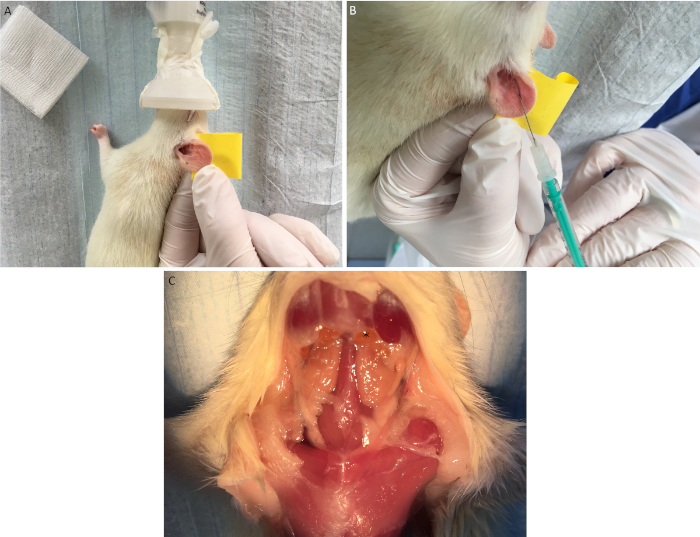
Figura 5: Iniezione in-orecchio di cellule muscolari cardiache allogeniche. Dopo aver fissato l'orecchio del destinatario su un dito utilizzando nastro adesivo a due lati (A) le cellule muscolari cardiache vitali allogeniche vengono iniettate sottocutaneamente vicino ai vasi capillari visivi (B). Dopo un periodo di osservazione che drena i linfonodi cervicali ()vengono estratti (C). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Sopravvivenza del cuore in diverse combinazioni donatore-donatore singeniche e allogeniche. L'analisi di Kaplan-Meier mostra la sopravvivenza del modello di rifiuto rapido di n. 10 (modello di rifiuto rapido n. 10; modello di rifiuto prolungato n.5) e di innesti allogenici (modello di rifiuto rapido n. 11; modello di rifiuto prolungato n. 14). Nel modello di rifiuto prolungato sei dei 14 destinatari hanno raggiunto la fine del periodo di osservazione (60 giorni) senza innesto, portando ad una sopravvivenza prolungata dell'innesto in questo gruppo. Fare clic qui per visualizzare una versione più grande di questa figura.
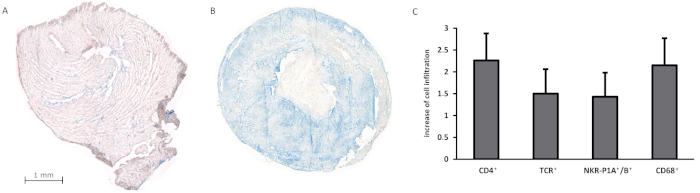
Figura 7: Analisi istologica degli innesti cardiaci singenici e allogenici. (A-B) mostrano l'infiltrazione di cellule CD4- utilizzando il metodo di colorazione APAAP in un innesto singenico (A) e un innesto allogenico al momento del rifiuto (B). (C) presenta l'aumento dell'infiltrazione cellulare negli innesti allogenici rispetto agli innesti singenici (che fungono da gruppo di riferimento) per diversi sottoinsiemi di cellule immunitarie. La classificazione applicata per quantificare l'infiltrazione cellulare è stata modificata da Hirschburger et al.25: 0 - infiltrazione paragonabile agli innesti singenici; 0,5 - lieve aumento delle cellule colorate nelle sezioni di tessuto isolato; 1 - aumento delle singole cellule colorate su tutta la sezione del tessuto; 1,5 - aumento dei grappoli di cellule macchiate uniformemente distribuiti su tutta la sezione del tessuto; 2 - forte; 2,5 - molto forte; 3 - più forte aumento di ammassi di cellule macchiate in tutta la sezione dei tessuti. Le sezioni istologiche degli innesti sono state analizzate utilizzando un ingrandimento 50x. Nell'analisi sono stati inclusi cinque innesti per gruppo (rispettivamente sigenici e allogenici). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Analisi delle cellule dei linfonodi drenanti dopo l'iniezione in-ear delle cellule muscolari cardiache allogeniche. Ristimolazione specifica (con 2 x 105 splenociti del rispettivo ceppo donatore) di 2 x 105 linfociti raccolti da linfonodi cervicali o mesenterici drenanti (LN) di respingere rapidamente Lew wt e il rifiuto prolungato dei destinatari di Lew.1a ha mostrato una proliferazione significativamente ridotta delle cellule dei linfonodi drenanti nei destinatari di Lew.1a (A), mentre la capacità proliferare in generale era ancora osservabile dopo una stimolazione non specifica con l'anticorpo CD3/CD28 (B). Sorprendentemente, la profilazione delle citochine ha rivelato un aumento delle citochine infiammatorie nei linfonodi dei destinatari di scarto prolungati (C). I risultati sono presentati come media: SEM di almeno 4 animali per gruppo. L'importanza è indicata con il simbolo , per i valori di p, ovvero 0,05 e , per i valori di p, ovvero 0,0001. (Questa cifra è stata modificata da Beetz et al.24). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il metodo precedentemente descritto per il trapianto cardiaco eterotopico nei ratti si basa principalmente sulla descrizione di Ono e Lindsey nel 19693. Da allora, sono state introdotte diverse modifiche in varie specie che hanno portato ad un'ampia varietà di questo modello. Combinando molte di queste modifiche e introducendo la nostra esperienza derivante da oltre 30 anni di esecuzione di trapianti di cuore eterotopici in laboratorio, abbiamo creato un approccio chirurgico fattibile, che non richiede lunghi periodi di formazione o background chirurgico. Di seguito verranno illustrate le limitazioni generali di questo modello e verranno sottolineate le fasi critiche del protocollo. Inoltre, sottolineeremo i vantaggi della combinazione del trapianto di cuore eterotopico con un nuovo metodo di iniezione all'interno dell'orecchio delle cellule muscolari cardiache.
Anestesia e complicazioni generali
Anche se è stato segnalato che l'anestesia isoflurana è superiore all'anestesia di iniezione per quanto riguarda la sopravvivenza precoce dopo il trapianto di cuore eterotopico, la depressione respiratoria intraoperatoria rappresenta ancora una delle complicanze più comuni e richiede quindi un'attenta gestione della narcosia26. Invece dell'espianto seriale di innesto e dell'impianto, rispettivamente, consigliamo di iniziare la preparazione del ricevente e dei vasi addominali subito dopo la toracotomia dell'animale donatore, in particolare perché i tempi di funzionamento di meno di un'ora sono associati a un risultato migliore per quanto riguarda l'innesto e la sopravvivenza del destinatario26,27. Oltre a complicazioni già menzionate come l'ipotermia a causa di lunghi tempi di funzionamento e stuoie di riscaldamento mancanti, e necrosi intestinale o ostruzione da posizionamento non fisiologico dell'intestino, una paresi degli arti di ostacolo rappresenta un'ulteriore complicazione, che può essere prevenuta da un bloccaggio vascolare atraumatico e lo scolo completo delle anastomosi per evitare l'embolismo periferico28,29.
Legatura delle vene polmonari e di cavalco e complicazioni emorragiche
Al fine di ridurre il tempo caldo ischemia, usiamo una singola legatura sia per caval che per tutte e quattro le vene polmonari. Come possibile complicazione derivante da un posizionamento troppo prossimale/ventrale della legatura, deve essere menzionata la rottura del riflusso venoso per occlusione del seno coronario. In caso di sanguinamento grave dopo la rimozione del morsetto Cooley e battito visibile dell'innesto, la legatura deve essere controllata immediatamente per verificare l'insufficienza. Abbiamo osservato questo tipo di complicazione soprattutto se la dissezione delle vene polmonari è stata eseguita troppo vicino alla legatura durante la rimozione dell'innesto dalla cavità toracica. In caso contrario, il sanguinamento grave è causato principalmente dall'insufficienza delle anastomosi vascolari. Inoltre, un'arteria coronaria che corre lungo l'aorta ascendente che viene spesso recisa durante l'espianto è descritta per causare sanguinamento letale su reperfusione27.
Ischemia tempo e perfusione
Indipendentemente dal modello di trapianto, è sempre indispensabile ridurre il tempo di ischemia, soprattutto perché il cuore è considerato come un organo vulnerabile per quanto riguarda i danni da ischemia. Eseguendo un intervento chirurgico con due chirurghi, siamo in grado di raggiungere un tempo ischemico minimo caldo e freddo e quindi rinunciare all'uso di soluzioni cardioplegiche al fine di ridurre i danni da ischemia-reperfusione30. Generalmente, la perfusione dell'innesto svolge un ruolo chiave ed è essenziale per raffreddare l'innesto e rimuovere le cellule del sangue, che potrebbero provocare trombosi o embolia. Mentre le basse pressioni di perfusione portano a una perfusione insufficiente e quindi ad una rimozione incompleta delle cellule del sangue, alte pressioni di perfusione possono causare danni endoteliali31,32. Consigliamo la perfusione dell'arteria polmonare e dell'aorta ascendente fino a quando le arterie coronarie non sono visibilmente lavate.
Incisione di recipienti
Un passo critico nel protocollo costituisce l'incisione dei vasi destinatari senza danneggiare la parete posteriore dei vasi: Schmid e altri hanno descritto il beneficio dell'aortotomia o della venotomia che esegue una piccola incisione trasversale seguita dall'allargamento longitudinale in direzione cranica e caudale, che porta ulteriormente a un tasso di stenosi ridotto di antaltomosi33. Nel nostro modello, i vasi riceventi vengono forati utilizzando una piccola cannula. Successivamente, il sito di foratura viene ingrandito utilizzando le forbici Potts per creare un'incisione longitudinale. Per una migliore fattibilità, si consiglia di piegare la punta della cannula ad un angolo di 30-45 gradi, con conseguente riduzione del rischio di danneggiare la parete posteriore dei vasi. Non abbiamo osservato stenosi vascolari clinicamente rilevanti in nessuno dei nostri destinatari. Benefici simili dell'apertura dei recipienti forando l'aorta addominale e la vena cava inferiore con una cannula sono stati descritti da Shan et al.34.
Padroneggiare il modello di trapianto di cuore eterotopico
Durante l'ultimo decennio, il modello è stato eseguito da ricercatori del reparto con poco o nessun background chirurgico. Come detto sopra, operiamo in coppie di chirurghi, mentre il ricercatore più esperto è incaricato di garantire il successo del trapianto e allo stesso tempo di migliorare gradualmente l'insieme di abilità del ricercatore inesperto. Dopo un breve periodo di allenamento di circa dieci estraimenti e impianti di innesto in animali morti, il ricercatore inesperto è incaricato di eseguire l'espianto cardiaco e di assistere l'impianto dell'innesto in circa dieci animali vivi. Successivamente, il ricercatore inesperto esegue attivamente le anastomosi vascolari, in modo che dopo circa dieci ulteriori trapianti, l'ex ricercatore inesperto è di solito in grado di eseguire tutti i passaggi critici del modello.
Applicando questo concetto di formazione, le pubblicazioni passate del nostro dipartimento utilizzando il trapianto di cuore eterotopico nei ratti non hanno mostrato differenze per quanto riguarda la morbilità, la mortalità o la funzione di innesto di mortalità nonostante diverse squadre di chirurghi13,18,19,20,21,22,23,24.
Da notare, l'esecuzione delle anastomosi vascolari rappresenta il passo più critico in questo protocollo e modelli di trapianto di organi solidi in generale. Pertanto, raccomandiamo periodi di allenamento prolungati utilizzando animali morti fino a quando le anastomosi non vengono eseguite con precisione e velocità, soprattutto se un ricercatore esperto non è disponibile per la guida negli animali vivi.
Vantaggi e svantaggi generali del modello
Mentre l'induzione spontanea della tolleranza è spesso descritta come un fenomeno nel trapianto di fegato e osservata anche nel trapianto di rene, il cuore è considerato come un organo piuttosto immunogenico e consente quindi un rigetto affidabile nei modelli di trapianto35,36. Contrariamente a questi risultati, potremmo anche notare la sopravvivenza a lungo termine e l'assenza di rigetto dopo il trapianto di cuore eterotopico in alcune combinazioni donatore-ricevente, nonostante la completa disparità complessa di imparità di itocompatibilità.
Una critica spesso menzionata del trapianto di cuore eterotopico è la soggettività del monitoraggio dell'innesto mediante palpazione manuale. Pertanto, il modello è stato esteso alle tecniche di anastomosi femorale al fine di facilitare l'accesso alla palpazione e introdurre ulteriori tecniche di monitoraggio come l'ecocardiografia transfemorale15,16. D'altra parte, Mottram et al. ha dimostrato che il monitoraggio dell'innesto tramite palpazione è ben correlato con le misurazioni elettrocardiografiche37. Pertanto, la palpazione manuale nei trapianti di cuore eterotopico sembra sufficiente per monitorare la funzione di innesto in un modello di rigetto acuto.
Come conseguenza del posizionamento eterotopico e dello scarico ventricolare sinistro, il cuore non funziona in condizioni anatomiche o fisiologiche supponendo che ciò non influisca sulle analisi immunologiche. Contrariamente a questa ipotesi, era stato dimostrato che il rimodellamento cardiaco derivante dallo scarico ventricolare sinistro durante la terapia del dispositivo di assistenza ventricolare sinistra porta a una diminuzione del rilascio di citochine38,39. D'altra parte, Tang-Quan et al. ha descritto l'impostazione scaricata come un approccio più appropriato per l'analisi immunologica, poiché è stato osservato un danno ischemico a lungo termine dell'innesto derivante dalla perfusione con sangue parzialmente deossigenato nel modello ventricolare sinistrocaricato 40.
Anche se il posizionamento addominale degli innesti offre benefici chirurgici in termini di praticabilità, è difficile raccogliere un numero sufficiente di linfonodi retroperitoneali drenanti al momento del rifiuto dell'innesto compromissione di ulteriori analisi. Per questo motivo, abbiamo introdotto un nuovo metodo di iniezione in-ear delle cellule muscolari cardiache allogeniche. Originario della ricerca parasitologica, questo concetto non è stato applicato per analisi immunologiche nel trapianto, nonostante la sua fattibilità41,42. Il vantaggio di questo modello è la possibilità di identificare e raccogliere un numero significativo di linfonodi drenanti, che offre la possibilità di eseguire complesse analisi immunologiche. Da notare che entrambi i modelli potrebbero essere combinati in un unico destinatario offrendo ulteriori approfondimenti sui meccanismi di rigetto e tolleranza nel trapianto di cellule e organi nei ratti.
I nostri modelli di trapianto di cuore di ratto e cellule muscolari cardiache rappresentano un approccio praticabile e ben studiato e possono essere eseguiti senza ulteriore allenamento chirurgico o sfondo. Di fronte al fatto che sono state introdotte e sviluppate di recente nuove tecnologie di clonazione per i ratti, questi modelli offrono vaste opportunità ai ricercatori immunologici dei trapianti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Vogliamo ringraziare Britta Trautewig, Corinna Làbbert e Ingrid Meder per il loro impegno.
Materiali
| Name | Company | Catalog Number | Comments |
| Anesthesia device (including isoflurane vaporizer) | Summit Anesthesia Solutions | No Catalog Number available | |
| Cannula (27 G) | BD Microlance | 302200 | |
| Carprofen | Pfizer | Rimadyl 50 mg/mL | |
| Cellstar Tubes (15 mL) | GreinerBioOne | 188271 | |
| Cell strainer (40 µm) | BD Falcon | 2271680 | |
| Collagenase Type CLSII | Biochrome | C2-22 | |
| Compresses 5x5 cm | Fuhrmann | 31501 | |
| Compresses 7.5x7.5 cm | Fuhrmann | 31505 | |
| Cotton swabs | Heinz Herenz Medizinalbedarf | 1032128 | |
| Dexpathenol (5 %) | Bayer | "Bepanthen" | |
| DPBS BioWhittaker | Lonza | 17-512F | |
| Forceps | B. Braun | Aesculap BD557R | |
| Forceps | B. Braun | Aesculap BD313R | |
| Forceps | B. Braun | Aesculap BD35 | |
| Heating mat | Gaymar Industries | "T/Pump" | |
| Hemostatic gauze | Ethicon | Tabotamp | |
| Heparin-Natrium 25 000 I.E. | Ratiopharm | No Catalog Number available | |
| Isofluran CP | CP-Pharma | No Catalog Number available | |
| Large-pored sieve (stainless steel) | Forschungswerkstätten Hannover Medical School | No Catalog Number available | |
| Lidocaine | Astra Zeneca | 2 % Xylocain | |
| Metamizol-Natrium | Ratiopharma | Novaminsulfon 500 mg/mL | |
| Micro forceps | B. Braun | Aesculap BD3361 | |
| Micro needle holder | Codman, Johnson & Johnson Medical | Codmann 80-2003 | |
| Micro needle holder | B. Braun | Aesculap BD336R | |
| Micro needle holder | B. Braun | Aesculap FD241R | |
| Micro scissors | B. Braun | Aesculap FD101R | |
| Micro scissors | B. Braun | Aesculap FM471R | |
| Needle holder | B. Braun | Aesculap BM221R | |
| Penicillin/Streptomycin/Glutamine (100x) | PAA | P11-010 | |
| Peripheral venous catheter (18 G) | B. Braun | 4268334B | |
| Peripheral venous catheter (22 G) | B. Braun | 4268091B | |
| Probe pointed scissors | B. Braun | Aesculap BC030R | |
| Retractors | Forschungswerkstätten Hannover Medical School | No Catalog Number available | |
| RPMI culture medium | Lonza | BE12-702F | |
| Saline solution (NaCl 0.9 %) | Baxter | No Catalog Number available | |
| Scissors | B. Braun | Aesculap BC414 | |
| Surgical microscope | Carl-Zeiss | OPMI-MDM | |
| Sutures (anastomoses) | Catgut | Mariderm 8-0 monofil | |
| Sutures (ligature) | Resorba | Silk 5-0 polyfil | |
| Sutures (skin, fascia) | Ethicon | Mersilene 3-0 | |
| Syringe (1 mL) | B. Braun | 9166017V | |
| Syringe (10 mL) | B. Braun | 4606108V | |
| Syringe (20 mL) | B. Braun | 4606205V | |
| Vascular clamp | B. Braun | Aesculap FB708R |
Riferimenti
- Abbott, C. P., et al. A Technique for Heart Transplantation In the Rat. Archives of Surgery. 89 (4), 645-652 (1964).
- Tomita, F. Heart homotransplantation in the rat. Sapporo igaku zasshi. The Sapporo Medical Journal. 30 (4), 165-183 (1966).
- Ono, K., Lindsey, E. S. Improved technique of heart transplantation in rats. The Journal of Thoracic and Cardiovascular Surgery. 57 (2), 225-229 (1969).
- Wen, P., et al. A simple technique for a new working heterotopic heart transplantation model in rats. Transplantation Proceedings. 45 (6), 2522-2526 (2013).
- Benke, K., et al. Heterotopic abdominal rat heart transplantation as a model to investigate volume dependency of myocardial remodeling. Transplantation. 101 (3), 498-505 (2017).
- Kearns, M. J., et al. Rat Heterotopic Abdominal Heart/Single-lung Transplantation in a Volume-loaded Configuration. Journal of Visualized Experiments. (99), 52418 (2015).
- Ibrahim, M., et al. Heterotopic abdominal heart transplantation in rats for functional studies of ventricular unloading. The Journal of Surgical Research. 179 (1), e31-e39 (2013).
- Liu, F., Kang, S. M. Heterotopic heart transplantation in mice. Journal of Visualized Experiments. (6), 238 (2007).
- Lu, W., et al. A new simplified volume-loaded heterotopic rabbit heart transplant model with improved techniques and a standard operating procedure. Journal of Thoracic Disease. 7 (4), 653-661 (2015).
- Kitahara, H., et al. Heterotopic transplantation of a decellularized and recellularized whole porcine heart. Interactive Cardiovascular and Thoracic Surgery. 22 (5), 571-579 (2016).
- Kadner, A., et al. Heterotopic heart transplantation: experimental development and clinical experience. European Journal of Cardiothoracic Surgery. 17 (4), 474-481 (2000).
- Zinöcker, S., et al. Immune reconstitution and graft-versus-host reactions in rat models of allogeneic hematopoietic cell transplantation. Frontiers in Immunology. 3 (NOV), 1-12 (2012).
- Klempnauer, J., et al. Genetic control of rat heart allograft rejection: effect of different MHC and non-MHC incompatibilities. Immunogenetics. 30, 81-88 (1989).
- Huang, G., et al. Genetic manipulations in the rat: Progress and prospects. Current Opinion in Nephrology and Hypertension. 20 (4), 391-399 (2011).
- Gordon, C. R., et al. Pulse doppler and M-mode to assess viability of cardiac allografts using heterotopic femoral heart transplantation in rats. Microsurgery. 27 (4), 240-244 (2007).
- Gordon, C. R., et al. A new modified technique for heterotopic femoral heart transplantation in rats. The Journal of Surgical Research. 139 (2), 157-163 (2007).
- Ma, Y., Wang, G. Comparison of 2 heterotopic heart transplant techniques in rats: cervical and abdominal heart. Experimental and Clinical Transplantation. 9 (2), 128-133 (2011).
- Bektas, H., et al. Differential effect of donor-specific blood transfusions after kidney, heart, pancreas, and skin transplantation in major histocompatibility complex-incompatible rats. Transfusion. 37 (2), 226-230 (1997).
- Saiho, K. O., et al. Long-term allograft acceptance induced by single dose anti-leukocyte common antigen (RT7) antibody in the rat. Transplantation. 71 (8), 1124-1131 (2001).
- Bektas, H., et al. Blood transfers infectious immunologic tolerance in MHC-incompatible heart transplantation in rats. Journal of Heart and Lung Transplantation. 24 (5), 614-617 (2005).
- Jäger, M. D., et al. Sirolimus promotes tolerance for donor and recipient antigens after MHC class II disparate bone marrow transplantation in rats. Experimental Hematology. 35 (1), 164-170 (2007).
- Timrott, K., et al. Application of allogeneic bone marrow cells in view of residual alloreactivity: Sirolimus but not cyclosporine evolves tolerogenic properties. PLoS ONE. 10 (4), 1-16 (2015).
- Hadamitzky, M., et al. Memory-updating abrogates extinction of learned immunosuppression. Brain, Behavior, and Immunity. 52, 40-48 (2016).
- Beetz, O., et al. Recipient natural killer cells alter the course of rejection of allogeneic heart grafts in rats. Plos One. 14 (8), e0220546 (2019).
- Hirschburger, M., et al. Nicotine Attenuates Macrophage Infiltration in Rat Lung Allografts. The Journal of Heart and Lung Transplantation. 28 (5), 493-500 (2009).
- Ruzza, A., et al. Heterotopic heart transplantation in rats: improved anesthetic and surgical technique. Transplantation Proceedings. 42 (9), 3828-3832 (2010).
- Wang, D., et al. A simplified technique for heart transplantation in rats: abdominal vessel branch-sparing and modified venotomy. Microsurgery. 26 (6), 470-472 (2006).
- Wang, C., et al. A modified method for heterotopic mouse heart transplantion. Journal of Visualized Experiments. (88), (2014).
- Al-Amran, F. G., Shahkolahi, M. M. Total arterial anastomosis heterotopic heart transplantation model. Transplantation Proceedings. 45 (2), 625-629 (2013).
- Hoerstrup, S. P., et al. Modified technique for heterotopic rat heart transplantation under cardioplegic arrest. Journal of Investigative Surgery. 13 (2), 73-77 (2000).
- Fry, D. L. Acute vascular endothelial changes associated with increased blood velocity gradients. Circulation Research. 22 (2), 165-197 (1968).
- Ahmadi, A. R., et al. Orthotopic Rat Kidney Transplantation: A Novel and Simplified Surgical Approach. Journal of Visualized Experiments. (147), (2019).
- Schmid, C., et al. Successful heterotopic heart transplantation in rat. Microsurgery. 15 (4), 279-281 (1994).
- Shan, J., et al. A modified technique for heterotopic heart transplantation in rats. Journal of Surgical Research. 164 (1), 155-161 (2010).
- Moris, D., et al. Mechanisms of liver-induced tolerance. Current Opinion in Organ Transplantation. 22 (1), 71-78 (2017).
- Bickerstaff, A. A., et al. Murine renal allografts: spontaneous acceptance is associated with regulated T cell-mediated immunity. Journal of Immunology. 167 (9), 4821-4827 (2001).
- Mottram, P. L., et al. Electrocardiographic monitoring of cardiac transplants in mice. Cardiovascular Research. 22 (5), 315-321 (1988).
- Torre-Amione, G., et al. Decreased expression of tumor necrosis factor-α in failing human myocardium after mechanical circulatory support: A potential mechanism for cardiac recovery. Circulation. 100 (11), 1189-1193 (1999).
- Goldstein, D. J., et al. Circulatory resuscitation with left ventricular assist device support reduces interleukins 6 and 8 levels. The Annals of Thoracic Surgery. 63 (4), 971-974 (1997).
- Tang-Quan, K. R., et al. Non-volume-loaded heart provides a more relevant heterotopic transplantation model. Transplant Immunology. 23 (1-2), 65-70 (2010).
- Lakhal-Naouar, I., et al. Transcutaneous immunization using SLA or rLACK skews the immune response towards a Th1 profile but fails to protect BALB/c mice against a Leishmania major challenge. Vaccine. 37 (3), 516-523 (2019).
- Sousa-Batista, A. J., et al. Novel and safe single-dose treatment of cutaneous leishmaniasis with implantable amphotericin B-loaded microparticles. International Journal for Parasitology: Drugs and Drug Resistance. , (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon