Method Article
大鼠异位心脏和心肌细胞移植的免疫模型
摘要
我们描述了大鼠异位腹心移植的模型,这意味着对当前策略的修改,从而导致简化的手术方法。此外,我们还描述了一种新的排斥模型,通过注射重要的心肌细胞的耳朵内,允许进一步的移植免疫学分析在大鼠。
摘要
50多年来,大鼠异位心脏移植一直是各种免疫学研究的常用模型。自1964年第一次描述以来,已经报告了若干修改。在大鼠进行异位心脏移植30年后,我们开发了一种简化的手术方法,无需进一步手术训练或背景,即可轻松教授和进行。
在解剖上升主动脉和肺动脉和上等类腔和肺静脉结扎后,供体心脏被收获,然后注入冰冷盐水溶液补充肝素。在夹紧和切开受体腹血管后,捐赠者提升主动脉和肺动脉分别被麻醉到受体腹部主动脉和劣质的vena卡瓦,使用连续的导联。
根据不同的供体-受体组合,此模型允许分析异体移植的急性或慢性排斥。该模型的免疫意义进一步增强,通过一种新的注射重要心肌细胞的耳内注射方法,以及随后对排空颈淋巴组织的分析, 进一步增强了该模型的免疫意义。
引言
异位心脏移植是一种常用的实验模型,用于不同研究移植耐受性、急性和慢性异体移植排斥、缺血再灌注损伤、机器灌注或心脏重塑等。除其他优点外,移植功能可以通过触觉进行非侵入性监测,移植失败不会导致接受者与其他器官(如肾脏或肝脏)相比的重要损伤。
1964年,Abbott等人最初描述了大鼠1的异位腹心移植。后来,在1966年,原子塔等人对阿纳斯托莫的端到端技术作了描述。1969年,奥诺和林赛报告了目前使用的模型的基础。在过去的几十年中,已经发表了一些修改,以创建不同类型的卸载,部分加载或加载左心室心脏移植,包括联合异位心肺移植44,5,6。5,6对于免疫分析,最常见的是非体积加载心脏移植移植。在这种情况下,血流逆行进入供体上升主动脉,随后进入冠状动脉。静脉排水沿冠状窦进入右中庭和心室(图1A-B)。因此,除了来自Thebesian静脉的少量血液外,左心室被排除在血流之外。这也使它成为研究左心室辅助装置治疗7期间的病理生理机制的有用模型。
异位心脏移植已在各种物种中进行,包括小鼠、兔子、猪,甚至被用作,人类8、9、10、119的单体或双心形辅助8装置。10,11大鼠仍然是移植模型的流行实验动物,特别是因为不同大鼠菌株组合的移植存活时间在过去已经明确,大量的免疫试剂是可访问的12,13。12,与老鼠不同,大鼠做手术和获得淋巴组织进行免疫分析更可行12。此外,近年来在大鼠身上引入商业性克隆技术,很可能导致对实验鼠模型14的反复关注。
一般来说,异位心脏移植可以通过进行宫颈或腹部麻醉附着在受体血管上。然而,一些研究表明,由于更好的获得手动触觉或跨体波他心动图,因此可以更精确地检测移植失败15,16,因此,股骨性麻醉有助于改善监测。15,
结果表明,两种阿生虫技术在操作时间、并发症率、结果和移植生存时间上没有差异。显然,必须提及有足够的排空淋巴结,作为宫颈麻醉的好处;但是,需要较长的培训期。相反,腹部麻醉对于免疫学研究来说不那么复杂,同样有价值,特别是当结合一种新疗法的异源性心肌细胞和随后的宫颈淋巴切除术的结果时。两种模型的组合提供了广泛的干预后免疫分析。
以下协议是指对外科医生进行手术,以减少缺血时间。但是,所有实验都可以由一个人执行。图2A-B显示了心脏外植和植入仪器和材料的设置。
研究方案
所有动物经验均按照下萨克森州(德国奥尔登堡州拉维斯)消费者保护和食品安全区域当局当地道德动物审查委员会的准则进行,并经批准,12/0768 和 17/2472。
1. 心脏外植和灌注
注:作为移植捐赠者,使用7-22周年龄的雌性或雄性大鼠。
- 通过吸入的二氟拉纳对供体大鼠进行麻醉(感应5%,维持3%,O2流量为1升/分钟)。注射5毫克Carprofen下皮每公斤体重的围手术性肛门,并检查脚趾捏退反射的缺失。
- 使用眼部润滑剂,使用机械钳去除腹部和胸皮。
- 将供体置于支撑位置,用弹性带固定手术台底部的四肢,用70%乙醇或其他足够的替代品对皮肤进行消毒。
- 在纵向方向和应用局部麻醉剂后(例如,利多卡因0.2%)将皮肤切开使用剪刀进行中位腹腔切除术。
- 插入缩回器,将肠子动员到供体左侧,用消毒棉签露出劣质的维纳卡瓦。
- 对于抗凝,通过刺穿劣质的静脉注射,将500I.U.肝素溶解在1mL的冰冷同声镇盐溶液中。在针头回缩后,用棉签用光压缩停止穿刺部位的出血(图3A)。
- 切开隔膜,对捐赠者的两侧进行侧胸膜切除术。
- 将胸腔的动员通风墙固定到操作台上。
- 使用两个微针支架,通过钝化制剂去除心外膜和血管神经。
- 进行腹部血管的截面,以排泄供体和卸载心脏。
- 将探头钝枝尖剪刀插入透射器围腹正射,用湿润的压缩将上升主动脉和肺动脉尽可能远地分开心脏的轻胸牵引下(图3B)。
- 在上等和劣质的静脉和肺静脉周围放置一个5-0连字,并尽可能收紧背带(图3C)。
- 将组织背对条塞与结扎切断并提取心脏(图3D)。
- 通过上升的主动脉和肺动脉,用静脉导管的18 G导管填充被植入的心脏,并辅以1000 I.U.肝素,并将心脏置于15 mL管中,在冰上充满盐水溶液(图3E-F)。
2. 心脏植入
注:作为接受者,使用10-14周大的雌性或雄性大鼠。捐助者和受助人的体重大致相当。
- 使用异氟拉涅吸入(感应时为5%,维持1.5-2%,O2流量为1升/分钟),对受体大鼠进行麻醉。注射5毫克Carprofen下皮每公斤体重的围手术性肛门,并检查脚趾捏退反射的缺失。
- 涂抹眼睛润滑剂,去除腹部毛皮,固定四肢,对皮肤进行与供体准备类似的消毒。为获得最佳术后效果,在加热垫上执行操作,以防止术中体温过低。
- 皮肤纵向切口后,在腹部筋膜上涂抹局部麻醉剂,如利多卡因(0.2%)。通过中位腹腔切除术打开腹腔并插入缩回器。
- 将肠子调动到受体的左上角,并将其置于温暖、湿润的压缩中。
- 在调动十二指肠和近端的假象后,分别使用手术显微镜(或放大眼镜)与5-7倍放大倍率,暴露腹部主声和劣质的维纳卡瓦通过钝化准备与棉签。不要分离腹血管。
- 使用两个微型针夹抬起腹血管,而不会伤害腰静脉,并定位库利血管夹(图4A)。
- 用30-45°拱形27G管子刺穿腹部血管(图4B)。
- 使用Potts剪刀扩大穿刺部位,形成一个纵向切口,与供体容器的流明大小相匹配(图4C-D),并用盐水溶液注入受体容器,以去除血栓,防止术后血栓。
- 将移植物放入原位,并通过两个简单的中断缝合(8-0)固定供体提升主从到受体腹部主主塔在纵向切口的颅角和切口角处的单丝不可再索缝合(图4E)。
- Anastomos 通过运行 8-0 使捐赠者的提升主主塔与接受者的腹部主塔单丝缝合分两步:第一,将移植物放在受体容器的右侧,并执行前半部分的麻醉(图4E)。随后,将移植物放在接收容器的左侧,并执行阿通莫他症的后半部分(图4F)。
- 将供体肺动脉固定在与主动脉麻醉类似的劣质静脉腔(8-0)单丝非可再索性缝合)。从容器的铝内侧缝合静脉单声道的半部分(图4G-H)。
- 在拧紧结之前,直接用盐水冲洗阿他托曼,以防止周围栓塞。
- 在两个阿他托器周围放置止血纱布,并小心地释放冷血管夹,以便开始移植物的再灌注。用消毒棉签进行光压缩,沿阿曲剂处理出血。
注:移植物应在60s左右开始跳动。 - 像这种蜿蜒的方式替换肠子。确保甲流半径没有异常旋转,以防止肠道坏死或机械阻塞。
- 使用连续 3-0 多丝跑步缝合线分别关闭腹部肌肉/筋膜和皮肤。
3. 术后护理
- 对于术后性肛门,在术后第一天(POD)为接受者提供每公斤体重每公斤5毫克卡普罗芬的额外皮下注射。此外,在第三次 POD 之前,将 1 克 Metamizol 添加到 500 mL 饮用水中。
- 开始监测心脏移植功能,通过每天的腹部触觉在第三个POD。
注:在第三个POD之前移植失败的情况下,应考虑手术而不是免疫衰竭。然而,这当然取决于所选择的菌株组合和相应的免疫学模型(例如,先前免疫后超急性排斥)。 - 移植排斥后,提取组织,如排泄的逆转录入淋巴结颅骨的麻醉剂,脾脏,血液,胸腺和移植物,通过流动细胞学或免疫组织化学进一步免疫分析。
4. 心脏酶消化和耳皮下心脏细胞注射
- 进行心脏外植和灌注类似于异位心脏移植(参见步骤1)。
- 使用无菌手术刀或无菌剪刀将心脏粉碎 3 mm x 3 mm 块,并在含有 0.5 mg/mL 胶原蛋白酶的培养介质中 37°C 孵育 30 分钟心脏。
注:使用含有青霉素、链霉素和谷氨酰胺的培养基而不携带胎儿小牛血清(FCS)很重要,特别是因为FCS抑制胶原蛋白酶消化。 - 将消化的组织添加到大孔筛中,同时彻底去除培养基和薄荷,使重要的心肌细胞(大部分为死单心脏细胞和剩余血细胞)暂停。用无菌同质盐水溶液洗涤细胞悬浮液两次。
注:离心设置:10 分钟、200 x g、20°C - 使用 40 μm 细胞滤网过滤悬浮液,并通过用 5-10 mL 等同子盐水溶液冲洗细胞滤网来收集重要的细胞通结。
- 离心后,在盐水溶液中重新悬浮心脏肌肉细胞溶解,浓度为5x105细胞/mL,并将细胞溶液拉入1 mL注射器中。
- 进行麻醉,类似于为异位心脏移植为受体麻醉描述的协议(参见步骤 2)。
- 将接收者置于横向位置,并使用双面胶带用手指固定耳朵(图 5Figure 5A)。
- 通过靠近视觉毛细血管的27 G导管s.c.将20μL的心脏肌肉细胞溶液(包含1 x 104细胞)注射到接受者的耳朵(图5B)。
- 在定义的观察期(取决于所选的应变组合和抑制强度)后,提取排空的颈椎淋巴结,并执行进一步分析,如流细胞学或共培养(图5CC)。
注:此外,可以执行针图组织分析以确定细胞渗透。
结果
过去,不同的免疫问题都根据该模型得到解决,在工作小组中,500多例移植进行了验证,存活率超过95%,13、18、19、20、21、22、23、24。23,2413,18,19,20,21,22,总手术时间(包括移植外植和植入)通常不超过60分钟,而冷热缺血组合时间约为30分钟。应用的应变组合主要基于刘易斯(Lew)背景。Syngenic移植存活了100天,没有移植失败的迹象,但在移植外植后,其重量和大小显著缩小。最近,我们进行了异位心脏移植的两种不同的供体-受体组合,模拟快速和长时间的排斥模型:Lew.1a = Lew wt 导致快速排斥(平均生存时间为 7.4 天)和 Lew.1u-7B = Lew.1a 导致更长时间的排斥(平均存活时间为 42.5 天)(图 6)。从宏观上看,被排斥的移植物显示血栓形成,伴有青色变色和肿胀,而未拒绝的移植物则表现出明显的萎缩,很可能是由于左心室卸载的结果。此外,我们绘制了移植心脏的低温部分,以便使用碱性磷酸酶-抗碱性磷酸酶(APAAP)染色法检测细胞渗透。具有 50 倍放大倍数的单帧合并到一个复合图像中,从而概述了整个移植和渗透细胞的分布。组织学分析表明,在异源移植物中(例如CD4+、TCR+或NKR-P1A/B+)免疫细胞的+渗透增加,而共生移植物基本上没有细胞渗透+(+图7A-C)。
颈椎淋巴切除术和淋巴结细胞的再刺激测定在耳注射后,在上述菌株组合中显示出对异源性心脏组织的不同应变特异性免疫反应,并允许进一步的免疫分析,如细胞因子分析(图8A-C)。
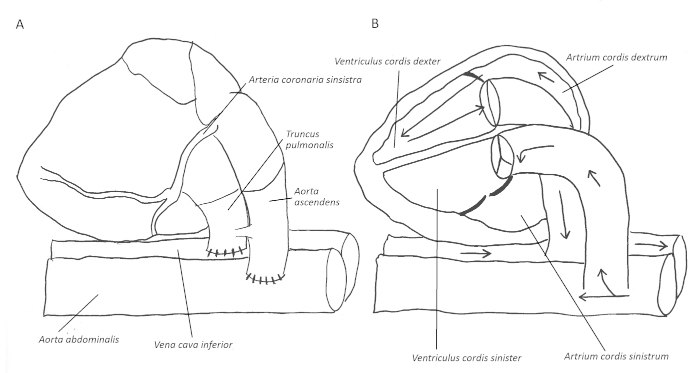
图1:端对端的阿托莫和由此产生的血液流经心脏的原理图。在使供体从主动脉端对端到受体腹部主动脉,并类似于肺动脉到接受者劣质的vena卡瓦(A)后,血流通过上升主动脉进入冠状动脉。静脉排泄通过窦冠状动脉进入右心房和心室,并通过肺动脉进入接受者劣质静脉卡瓦(B)。请点击此处查看此图形的较大版本。
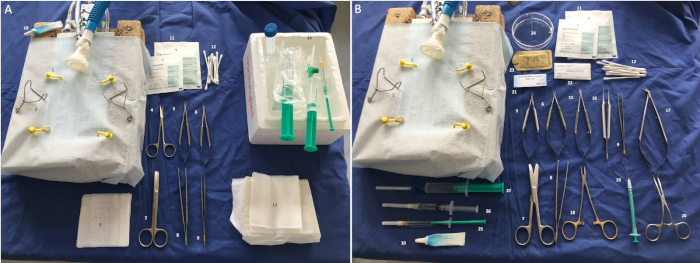
图2:所需的手术器械和材料。(A) 外植: 1: 弹性肢体带, 2: 缩回器, 3:5-0 连扎, 4: 探头尖剪刀, 5-6: 微针支架, 7: 剪刀, 8: 手术钳子, 9: 微钳, 10: 眼睛润滑剂, 11: 压缩, 12: 棉签, 13: 灌注碱, 14: 冰上盐碱液.(B) 植入: 1: 弹性肢体带, 2: 缩回器, 5-6: 微针支架, 7: 剪刀, 8: 钳子, 9: 微钳, 10: 眼睛润滑剂, 11: 压缩, 12: 棉签, 15: 微型剪刀, 16: 微型钳子, 17: 波茨剪刀, 18: 针架, 19: 拱形套管, 20: 库利血管夹, 21: 8-0单丝缝合, 22: 止血纱布, 23: 3-0 多丝缝合, 24: Petri 菜, 25: 卡普罗芬 (5 毫克/mL), 26: 局部麻醉剂 (利多卡因 0.2%), 27: 盐水溶液.请点击此处查看此图形的较大版本。

图3:心脏外植。肝素化后 (A), 进行胸科切除术,提升主动脉和肺动脉尽可能远地切断 (B)。单连结肺和两个腔静脉被阻塞 (C), 心脏从胸腔 (D) 去除 .(E) 在灌注含有肝素的 30 mL 盐水溶液后显示心脏之前和 (F) .请点击此处查看此图形的较大版本。
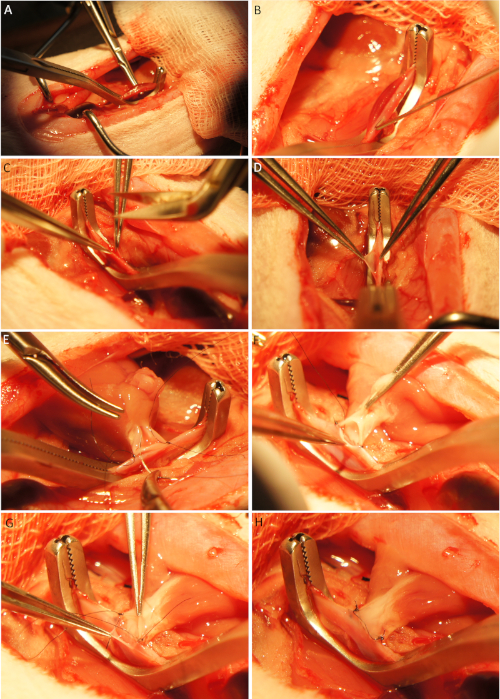
图4:心脏植入。在解释腹血管和放置一个冷血管夹 (A) 后,血管被切开 (B), 并使用波茨剪刀 (C-D) 进行纵向切口.捐赠者提升主声固定在受体腹部主主塔(E)切口的颅角和切口角各一个结,并且通过连续运行缝合线(E-F) 进行麻醉。请注意,在麻醉(E)的前半部分,移植物被放置在容器的右侧,在麻醉 (F) 和随后的静脉性麻醉的后半部分放置在容器的左侧。静脉单声通气的上半部分由铝内缝合线(G) 执行。完成静脉性单反渗透的后半部分后,移植物已准备好再灌注(H)。请点击此处查看此图形的较大版本。
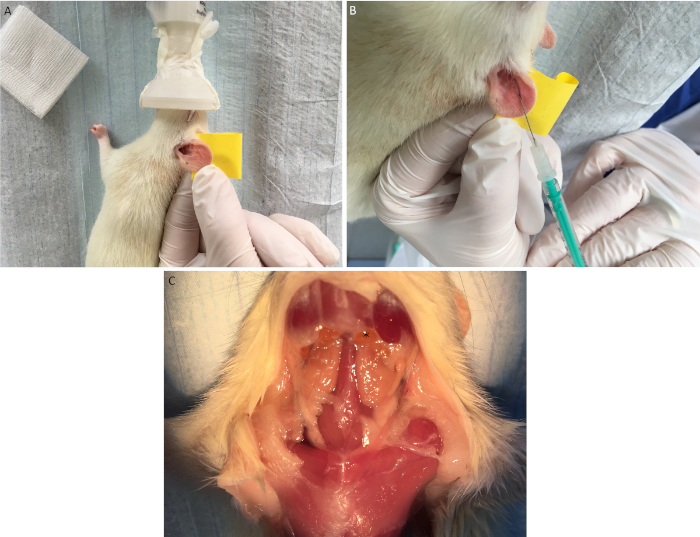
图5:异源性心肌细胞的耳内注射。使用双面胶带(A) 异位生命心肌细胞将接受者的耳朵固定在手指上后,将皮下注射到视觉毛细血管(B) 附近。观察期后排空宫颈淋巴结(*) 被提取 (C).请点击此处查看此图形的较大版本。

图6:不同合成和异源供体受体组合中的心脏存活率。Kaplan-Meier 分析表明,合成基因(n=10 快速排斥模型;n=5 长期排斥模型)和异源移植(n=11 快速排斥模型;n=14 长期排斥模型)的存活率。在长期排斥模型中,14名接受者中有6人未出现移植衰竭,达到观察期(60天),导致该组移植存活期延长。请点击此处查看此图形的较大版本。
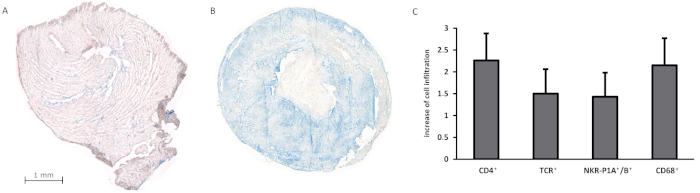
图7:合成和异源性心脏移植组织分析。(A-B) 显示 CD4+细胞的渗透,使用 APAAP 染色方法在合成移植 (A) 和异位移植在排斥 (B)(C) 与不同免疫细胞子集的合成移植物(作为参考组)相比,在异源移植物中细胞渗透的增加。Hirschburger等人25:0对用于量化细胞渗透的分类进行了修改, 渗透与合成移植相当;0.5 = 分离组织部分染色细胞略有增加;1 = 在整个组织部分增加奇异染色细胞;1.5 = 在整个组织部分均匀分布的染色细胞簇的增加;2 = 强;2.5 = 非常强大;3 = 在整个组织部分中染色细胞簇的最强增加。使用 50 倍的放大倍率对移植物的组织学部分进行了分析。分析中包括每组5个移植物(分别为合成和异位)。请点击此处查看此图形的较大版本。

图8:在注射异形心肌细胞的耳内注射后排出淋巴结细胞的分析。从排空颈颈或淋巴结(LN)中采集的2 x 105淋巴细胞的特定再刺激(与各供体菌株的2 x 105个淋巴细胞)快速排斥的Lew wt和 长期拒绝Lew.1a受体显示,在Lew.1a受体(A)中,淋巴结细胞的增殖显著减少,而一般在CD3/CD28抗体(B)进行非特异性刺激后,一般仍可观察到增殖能力。令人惊讶的是,细胞因子特征分析显示,长期拒绝接受者(C)淋巴结的炎症细胞因子增加。结果以每组至少4只动物的均值和SEM形式呈现。表示显著性为 p 值 * 0.05 和 p 值 = 0.0001 。(这个数字是从比兹等人24号修改的。请点击此处查看此图形的较大版本。
讨论
先前描述的大鼠异位心脏移植方法主要基于1969年对小野和林赛的描述。自那时以来,对各种物种进行了若干修改,导致该模型的广泛多样性。结合其中几个修改,并介绍我们自己的经验,在实验室进行了超过30年的异位心脏移植,我们创造了一个可行的手术方法,不需要长时间的训练或手术背景。在下面,我们将讨论此模型的一般限制,并强调协议的关键步骤。此外,我们将强调将异位心脏移植与心脏肌肉细胞的耳内注射新方法相结合的好处。
麻醉和一般并发症
虽然有报道称异位心脏移植后的早期存活,异体麻醉优于注射麻醉,但术中呼吸抑郁仍是最常见的并发症之一,因此需要仔细的麻醉管理26。我们建议在供体动物胸腔切除术后立即开始准备受体和腹血管,而不是序列移植外植和植入,特别是因为手术时间少于一小时,与移植和受体生存的,更好结果有关。除了已经提到的并发症,如由于长时间操作和缺少加热垫,肠道坏死或阻碍的肠道非生理位置,阻塞四肢的分离代表进一步复杂化,可以通过创伤性血管夹紧和彻底冲洗阿曲质,以避免周围栓塞28,29。28,
肺和气管结扎和出血并发症
为了减少热缺血时间,我们使用一个单一的连扎法,用于腔和四个肺静脉。由于连扎过于接近/透水放置,必须提及因颅冠闭塞而造成静脉回流的中断。在去除冷夹和可看见的移植物跳动后严重出血时,必须立即检查结扎是否不足。我们观察到这种类型的并发症,特别是如果肺静脉的解剖进行太接近结扎,同时从胸腔取出移植物。否则,严重出血主要是由血管性麻醉剂不足引起的。此外,沿着上升主动脉运行的冠状动脉,在开园期间经常被割断,描述在再灌注27时引起致命的出血。
缺血时间和灌注
无论移植模式如何,减少缺血时间总是不可或缺的,特别是因为心脏被认为是缺血损伤的脆弱器官。通过与两名外科医生进行手术,我们能够达到最少的冷热和冷缺血时间,因此放弃使用心绞痛溶液,以减少缺血-再灌注损伤30。一般来说,移植物的灌注起起关键作用,对移植物冷却和去除血细胞至关重要,这可能导致血栓形成或栓塞。低灌注压力导致灌注不足,从而导致血细胞完全去除,高灌注压力可造成内皮损伤31,32。31,我们建议灌注肺动脉以及上升主动脉,直到冠状动脉明显冲洗清楚。
接收容器切口
议定书中的一个关键步骤是接收容器的切口,而不会对后壁造成损坏:Schmid等人描述了主动脉切除术或角膜切除术的益处,即进行小横向切口,然后纵向扩大颅内和腹腔方向,进一步导致肛门肛门病33的狭窄率下降。在我们的模型中,接收容器使用小管刺穿。之后,使用波茨剪刀创建纵向切口,将穿刺部位扩大。为了更好的可行性,我们建议将导管的尖端弯曲到 30-45° 的角度,从而降低损坏后壁的风险。我们没有在任何接受者中观察到临床相关的血管硬鼻涕。Shan等人34日描述了通过用腹主塔和劣质的vena卡瓦用套管来打开接收器的同样好处。
掌握异位心脏移植模型
在过去十年中,该模型由几乎没有或根本没有手术背景的部门研究人员进行。如上所述,我们成对外科医生,而更有经验的研究人员负责保证移植的成功,同时逐步提高没有经验的研究人员的技能集。经过大约10次移植外植和对死动物的植入的短暂训练期,这位没有经验的研究者负责对大约10只活体动物进行心脏外植和协助移植植入。随后,这位没有经验的研究者积极执行血管性麻醉剂,因此,经过大约十次进一步的移植,这位前没有经验的研究者通常能够执行模型的所有关键步骤。
应用这个训练理念,我们系过去在大鼠身上进行异位心脏移植的出版物,在发病率、死亡率或移植功能方面没有差异,尽管有数组不同的外科医生13、18、19、20、21、22、23、24。13,18,19,20,21,22,23,24
值得注意的是,执行血管性组织是本协议和实体器官移植模型中最关键的步骤。因此,我们建议延长使用死动物的训练时间,直到对动物进行准确和快速的演奏,特别是如果有经验的研究人员不能指导活体动物。
模型的一般优点和缺点
自发容差诱导常被描述为肝移植中的一种现象,在肾移植中也观察到,心脏被认为是一种相当免疫性的器官,因此在移植模型35、36,36中能够可靠地排斥。与这些发现相反,我们还可以注意到,尽管完全的主要共感复杂差异,但在某些供体受体组合中,异位心脏移植后长期存活和没有排斥。
异位心脏移植的一个经常被提及的批评是通过人工触觉进行移植监测的主观性。因此,该模型已扩展到股骨造影技术,以方便获得触觉,并引入进一步监测技术,如跨体波他心动图15,16。15,另一方面,Mottram等人证明,通过触觉对移植物的监测与心电图测量37密切相关。因此,异位心脏移植中的手动触觉似乎足以监测急性排斥模型中的移植功能。
由于异位放置和左心室卸载,心脏在解剖学或生理条件下不起作用,假设这不会影响免疫分析。与这个假设相反,已经表明,左心室辅助装置治疗过程中左心室卸载引起的心脏重塑导致细胞因子释放减少38,39。,39另一方面,唐全等人将卸载设置描述为免疫分析的一种更合适的方法,因为观察到左心室加载模型中透注部分脱氧血液导致移植的长期缺血损伤。
虽然移植的腹部放置在实用性方面具有手术效益,但在移植排斥后很难收获足够数量的排泄性逆转录淋巴结,从而影响进一步分析。为此,我们引进了一种新型的耳内注射异源心肌细胞的方法。这一概念源于寄生虫学研究,尽管其可行性为41,42,,42但一直没有应用于移植中的免疫分析。该模型的优点是识别和收获大量排空淋巴结,从而有可能进行复杂的免疫分析。值得注意的是,这两种模型可以合并到一个接受者中,进一步深入了解大鼠细胞和器官移植中的排斥和耐受机制。
我们的大鼠心脏和心肌细胞移植模型代表了一种切实可行的、研究良好的方法,无需进一步的外科培训或背景即可进行。面对最近引进和开发新的大鼠克隆技术的事实,这些模型为移植免疫学研究人员提供了巨大的机会。
披露声明
作者没有什么可透露的。
致谢
我们要感谢布里塔·特劳特维格、科林娜·勒伯特和英格丽德·梅德的承诺。
材料
| Name | Company | Catalog Number | Comments |
| Anesthesia device (including isoflurane vaporizer) | Summit Anesthesia Solutions | No Catalog Number available | |
| Cannula (27 G) | BD Microlance | 302200 | |
| Carprofen | Pfizer | Rimadyl 50 mg/mL | |
| Cellstar Tubes (15 mL) | GreinerBioOne | 188271 | |
| Cell strainer (40 µm) | BD Falcon | 2271680 | |
| Collagenase Type CLSII | Biochrome | C2-22 | |
| Compresses 5x5 cm | Fuhrmann | 31501 | |
| Compresses 7.5x7.5 cm | Fuhrmann | 31505 | |
| Cotton swabs | Heinz Herenz Medizinalbedarf | 1032128 | |
| Dexpathenol (5 %) | Bayer | "Bepanthen" | |
| DPBS BioWhittaker | Lonza | 17-512F | |
| Forceps | B. Braun | Aesculap BD557R | |
| Forceps | B. Braun | Aesculap BD313R | |
| Forceps | B. Braun | Aesculap BD35 | |
| Heating mat | Gaymar Industries | "T/Pump" | |
| Hemostatic gauze | Ethicon | Tabotamp | |
| Heparin-Natrium 25 000 I.E. | Ratiopharm | No Catalog Number available | |
| Isofluran CP | CP-Pharma | No Catalog Number available | |
| Large-pored sieve (stainless steel) | Forschungswerkstätten Hannover Medical School | No Catalog Number available | |
| Lidocaine | Astra Zeneca | 2 % Xylocain | |
| Metamizol-Natrium | Ratiopharma | Novaminsulfon 500 mg/mL | |
| Micro forceps | B. Braun | Aesculap BD3361 | |
| Micro needle holder | Codman, Johnson & Johnson Medical | Codmann 80-2003 | |
| Micro needle holder | B. Braun | Aesculap BD336R | |
| Micro needle holder | B. Braun | Aesculap FD241R | |
| Micro scissors | B. Braun | Aesculap FD101R | |
| Micro scissors | B. Braun | Aesculap FM471R | |
| Needle holder | B. Braun | Aesculap BM221R | |
| Penicillin/Streptomycin/Glutamine (100x) | PAA | P11-010 | |
| Peripheral venous catheter (18 G) | B. Braun | 4268334B | |
| Peripheral venous catheter (22 G) | B. Braun | 4268091B | |
| Probe pointed scissors | B. Braun | Aesculap BC030R | |
| Retractors | Forschungswerkstätten Hannover Medical School | No Catalog Number available | |
| RPMI culture medium | Lonza | BE12-702F | |
| Saline solution (NaCl 0.9 %) | Baxter | No Catalog Number available | |
| Scissors | B. Braun | Aesculap BC414 | |
| Surgical microscope | Carl-Zeiss | OPMI-MDM | |
| Sutures (anastomoses) | Catgut | Mariderm 8-0 monofil | |
| Sutures (ligature) | Resorba | Silk 5-0 polyfil | |
| Sutures (skin, fascia) | Ethicon | Mersilene 3-0 | |
| Syringe (1 mL) | B. Braun | 9166017V | |
| Syringe (10 mL) | B. Braun | 4606108V | |
| Syringe (20 mL) | B. Braun | 4606205V | |
| Vascular clamp | B. Braun | Aesculap FB708R |
参考文献
- Abbott, C. P., et al. A Technique for Heart Transplantation In the Rat. Archives of Surgery. 89 (4), 645-652 (1964).
- Tomita, F. Heart homotransplantation in the rat. Sapporo igaku zasshi. The Sapporo Medical Journal. 30 (4), 165-183 (1966).
- Ono, K., Lindsey, E. S. Improved technique of heart transplantation in rats. The Journal of Thoracic and Cardiovascular Surgery. 57 (2), 225-229 (1969).
- Wen, P., et al. A simple technique for a new working heterotopic heart transplantation model in rats. Transplantation Proceedings. 45 (6), 2522-2526 (2013).
- Benke, K., et al. Heterotopic abdominal rat heart transplantation as a model to investigate volume dependency of myocardial remodeling. Transplantation. 101 (3), 498-505 (2017).
- Kearns, M. J., et al. Rat Heterotopic Abdominal Heart/Single-lung Transplantation in a Volume-loaded Configuration. Journal of Visualized Experiments. (99), 52418 (2015).
- Ibrahim, M., et al. Heterotopic abdominal heart transplantation in rats for functional studies of ventricular unloading. The Journal of Surgical Research. 179 (1), e31-e39 (2013).
- Liu, F., Kang, S. M. Heterotopic heart transplantation in mice. Journal of Visualized Experiments. (6), 238 (2007).
- Lu, W., et al. A new simplified volume-loaded heterotopic rabbit heart transplant model with improved techniques and a standard operating procedure. Journal of Thoracic Disease. 7 (4), 653-661 (2015).
- Kitahara, H., et al. Heterotopic transplantation of a decellularized and recellularized whole porcine heart. Interactive Cardiovascular and Thoracic Surgery. 22 (5), 571-579 (2016).
- Kadner, A., et al. Heterotopic heart transplantation: experimental development and clinical experience. European Journal of Cardiothoracic Surgery. 17 (4), 474-481 (2000).
- Zinöcker, S., et al. Immune reconstitution and graft-versus-host reactions in rat models of allogeneic hematopoietic cell transplantation. Frontiers in Immunology. 3 (NOV), 1-12 (2012).
- Klempnauer, J., et al. Genetic control of rat heart allograft rejection: effect of different MHC and non-MHC incompatibilities. Immunogenetics. 30, 81-88 (1989).
- Huang, G., et al. Genetic manipulations in the rat: Progress and prospects. Current Opinion in Nephrology and Hypertension. 20 (4), 391-399 (2011).
- Gordon, C. R., et al. Pulse doppler and M-mode to assess viability of cardiac allografts using heterotopic femoral heart transplantation in rats. Microsurgery. 27 (4), 240-244 (2007).
- Gordon, C. R., et al. A new modified technique for heterotopic femoral heart transplantation in rats. The Journal of Surgical Research. 139 (2), 157-163 (2007).
- Ma, Y., Wang, G. Comparison of 2 heterotopic heart transplant techniques in rats: cervical and abdominal heart. Experimental and Clinical Transplantation. 9 (2), 128-133 (2011).
- Bektas, H., et al. Differential effect of donor-specific blood transfusions after kidney, heart, pancreas, and skin transplantation in major histocompatibility complex-incompatible rats. Transfusion. 37 (2), 226-230 (1997).
- Saiho, K. O., et al. Long-term allograft acceptance induced by single dose anti-leukocyte common antigen (RT7) antibody in the rat. Transplantation. 71 (8), 1124-1131 (2001).
- Bektas, H., et al. Blood transfers infectious immunologic tolerance in MHC-incompatible heart transplantation in rats. Journal of Heart and Lung Transplantation. 24 (5), 614-617 (2005).
- Jäger, M. D., et al. Sirolimus promotes tolerance for donor and recipient antigens after MHC class II disparate bone marrow transplantation in rats. Experimental Hematology. 35 (1), 164-170 (2007).
- Timrott, K., et al. Application of allogeneic bone marrow cells in view of residual alloreactivity: Sirolimus but not cyclosporine evolves tolerogenic properties. PLoS ONE. 10 (4), 1-16 (2015).
- Hadamitzky, M., et al. Memory-updating abrogates extinction of learned immunosuppression. Brain, Behavior, and Immunity. 52, 40-48 (2016).
- Beetz, O., et al. Recipient natural killer cells alter the course of rejection of allogeneic heart grafts in rats. Plos One. 14 (8), e0220546 (2019).
- Hirschburger, M., et al. Nicotine Attenuates Macrophage Infiltration in Rat Lung Allografts. The Journal of Heart and Lung Transplantation. 28 (5), 493-500 (2009).
- Ruzza, A., et al. Heterotopic heart transplantation in rats: improved anesthetic and surgical technique. Transplantation Proceedings. 42 (9), 3828-3832 (2010).
- Wang, D., et al. A simplified technique for heart transplantation in rats: abdominal vessel branch-sparing and modified venotomy. Microsurgery. 26 (6), 470-472 (2006).
- Wang, C., et al. A modified method for heterotopic mouse heart transplantion. Journal of Visualized Experiments. (88), (2014).
- Al-Amran, F. G., Shahkolahi, M. M. Total arterial anastomosis heterotopic heart transplantation model. Transplantation Proceedings. 45 (2), 625-629 (2013).
- Hoerstrup, S. P., et al. Modified technique for heterotopic rat heart transplantation under cardioplegic arrest. Journal of Investigative Surgery. 13 (2), 73-77 (2000).
- Fry, D. L. Acute vascular endothelial changes associated with increased blood velocity gradients. Circulation Research. 22 (2), 165-197 (1968).
- Ahmadi, A. R., et al. Orthotopic Rat Kidney Transplantation: A Novel and Simplified Surgical Approach. Journal of Visualized Experiments. (147), (2019).
- Schmid, C., et al. Successful heterotopic heart transplantation in rat. Microsurgery. 15 (4), 279-281 (1994).
- Shan, J., et al. A modified technique for heterotopic heart transplantation in rats. Journal of Surgical Research. 164 (1), 155-161 (2010).
- Moris, D., et al. Mechanisms of liver-induced tolerance. Current Opinion in Organ Transplantation. 22 (1), 71-78 (2017).
- Bickerstaff, A. A., et al. Murine renal allografts: spontaneous acceptance is associated with regulated T cell-mediated immunity. Journal of Immunology. 167 (9), 4821-4827 (2001).
- Mottram, P. L., et al. Electrocardiographic monitoring of cardiac transplants in mice. Cardiovascular Research. 22 (5), 315-321 (1988).
- Torre-Amione, G., et al. Decreased expression of tumor necrosis factor-α in failing human myocardium after mechanical circulatory support: A potential mechanism for cardiac recovery. Circulation. 100 (11), 1189-1193 (1999).
- Goldstein, D. J., et al. Circulatory resuscitation with left ventricular assist device support reduces interleukins 6 and 8 levels. The Annals of Thoracic Surgery. 63 (4), 971-974 (1997).
- Tang-Quan, K. R., et al. Non-volume-loaded heart provides a more relevant heterotopic transplantation model. Transplant Immunology. 23 (1-2), 65-70 (2010).
- Lakhal-Naouar, I., et al. Transcutaneous immunization using SLA or rLACK skews the immune response towards a Th1 profile but fails to protect BALB/c mice against a Leishmania major challenge. Vaccine. 37 (3), 516-523 (2019).
- Sousa-Batista, A. J., et al. Novel and safe single-dose treatment of cutaneous leishmaniasis with implantable amphotericin B-loaded microparticles. International Journal for Parasitology: Drugs and Drug Resistance. , (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。