Method Article
Un modelo inmunológico para el trasplante heterotópico de células musculares cardíacas y cardíacas en ratas
En este artículo
Resumen
Describimos un modelo de trasplante de corazón abdominal heterotópico en ratas, lo que implica modificaciones de las estrategias actuales, que conducen a un enfoque quirúrgico simplificado. Además, describimos un nuevo modelo de rechazo mediante inyección en la oreja de células musculares cardíacas vitales, permitiendo análisis inmunológicos de trasplante adicionales en ratas.
Resumen
El trasplante de corazón heterotópico en ratas ha sido un modelo comúnmente utilizado para diversos estudios inmunológicos durante más de 50 años. Se han notificado varias modificaciones desde la primera descripción en 1964. Después de 30 años de realizar un trasplante de corazón heterotópico en ratas, hemos desarrollado un enfoque quirúrgico simplificado, que se puede enseñar y realizar fácilmente sin más entrenamiento quirúrgico o antecedentes.
Después de la disección de la aorta ascendente y la arteria pulmonar y la ligadura de venas carales y pulmonares superiores e inferiores, el corazón del donante se cosecha y posteriormente se recoge con solución salina helada suplementada con heparina. Después de sujetar e incentivar los vasos abdominales receptores, la aorta ascendente del donante y la arteria pulmonar se anastomosed a la aorta abdominal receptora y vena cava inferior, respectivamente, utilizando suturas de funcionamiento continuo.
Dependiendo de las diferentes combinaciones donante-receptor, este modelo permite analizar el rechazo agudo o crónico de aloinjertos. La importancia inmunológica de este modelo se ve reforzada por un enfoque novedoso de la inyección en la oreja de células musculares cardíacas vitales y el análisis posterior del drenaje del tejido linfático cervical.
Introducción
El trasplante de corazón heterotópico es un modelo experimental frecuentemente utilizado para diferentes investigaciones sobre tolerancia al trasplante, rechazo agudo y crónico de aloinjertos, lesión isquérica-reperfusión, perfusión de máquinas o remodelación cardíaca. Entre otras ventajas, la función del injerto puede ser monitoreada no invasivamente por palpación y la falla del injerto no conduce a un deterioro vital del receptor en contraste con otros órganos, como riñones o hígados.
En 1964, Abbott et al. describieron inicialmente el trasplante de corazón abdominal heterotópico en ratas1. Más tarde, en 1966, la técnica de extremo a lado para las anastomosis fue descrita por Tomita et al.2. Las bases para el modelo utilizado actualmente fueron reportadas por Ono y Lindsey en 19693. Durante las últimas décadas, se han publicado varias modificaciones para crear diferentes tipos de injertos cardíacos ventriculares izquierdos descargados, parcialmente cargados o cargados, incluyendo el trasplante heterotópico combinado de corazón-pulmón4,5,6. Para los análisis inmunológicos se realiza con mayor frecuencia un trasplante de injerto cardíaco cargado sin volumen. En este caso, el flujo sanguíneo entra retrógradamente en la aorta ascendente del donante y posteriormente en las arterias coronarias. El drenaje venoso ocurre a lo largo del seno coronario en la aurícula derecha y el ventrículo(Figura 1A-B). Por lo tanto, el ventrículo izquierdo está excluido del flujo sanguíneo, aparte de las cantidades marginales de sangre de las venas de Tebesía. Esto también lo convierte en un modelo útil para estudiar los mecanismos fisiopatológicos durante la terapia del dispositivo de asistencia ventricular izquierda7.
El trasplante de corazón heterotópico se ha realizado en diversas especies, incluyendo ratones, conejos, cerdos e incluso se ha utilizado como dispositivo de asistencia uni- o biventricular en humanos8,9,10,11. La rata todavía representa un animal experimental popular para los modelos de trasplante, especialmente porque los tiempos de supervivencia del injerto para diferentes combinaciones de cepas de rata han sido bien definidos en el pasado y un gran número de reactivos inmunológicos son accesibles12,13. A diferencia de los ratones, las ratas son más grandes, lo que hace que la cirugía y el acceso al tejido linfático para análisis inmunológicos sean más factibles12. Además, la introducción de tecnologías de clonación comercial en ratas en los últimos años probablemente conducirá a un interés recurrente en los modelos experimentales de ratas14.
En general, los injertos cardíacos heterotópicos se pueden unir a los vasos receptores ya sea mediante la realización de anastomosis cervical o abdominal. Sin embargo, algunos estudios sugieren que una anastomosis femoral facilita una mejor monitorización debido a un mejor acceso a la palpación manual o ecocardiografía transfemoral y, por lo tanto, permite una detección más precisa de la falla del injerto15,,16.
Se ha demostrado que no hay diferencia con respecto al tiempo de operación, la tasa de complicaciones, el resultado y el tiempo de supervivencia del injerto entre ambas técnicas de anastomosis17. Evidentemente, debe mencionarse la disponibilidad de un número suficiente de ganglios linfáticos drenantes como un beneficio de la anastomosis cervical; sin embargo, se requieren períodos de entrenamiento más largos. Por el contrario, la anastomosis abdominal es menos complicada e igualmente valiosa para las investigaciones inmunológicas, especialmente cuando se combina con los resultados de un método novedoso de inyección en la oreja de células musculares cardíacas alogénicas y posterior linfadenectomía cervical. Una combinación de ambos modelos ofrece un amplio espectro de análisis inmunológicos postintervencionales.
El siguiente protocolo se refiere a operar en pares de cirujanos con el fin de reducir el tiempo de isquemia. Sin embargo, todos los experimentos pueden ser realizados por una sola persona. La configuración de instrumentos y materiales para la explantación e implantación de los corazones se muestra en la Figura 2A-B.
Protocolo
Todas las experiencias animales se han realizado de acuerdo con las directrices de la Junta local de revisión de animales de ética de las autoridades regionales para la protección de los consumidores y la seguridad alimentaria de Baja Sajonia (LAVES, Oldenburg, Alemania) con las instrucciones de aprobación 12/0768 y 17/2472.
1. Explantación y perfusión de corazón
NOTA: Como donantes de injertos, se utilizaron ratas hembra o macho según una edad de 7-22 semanas.
- Anestetizar la rata donante por inhalación de isoflurano (inducción al 5% y mantenimiento al 3% con un flujo O2 de 1 L/min). Inyectar 5 mg de Carprofeno por vía subcutánea por kg de peso corporal para la analgesia perioperatoria y comprobar la ausencia del reflejo de abstinencia de pellizcar del dedo del dedo del dedo del dedo del tiempo.
- Aplique lubricante para los ojos y retire el pelaje abdominal y torácico con una cortadora mecánica.
- Colocar el donante en posición supina, fijar las extremidades en la base de la mesa de operaciones con bandas elásticas y esterilizar la piel con 70% de etanol u otra alternativa suficiente.
- Incisar la piel en dirección longitudinal y después de la aplicación de anestésicos locales (p. ej., lidocaína 0,2%) realizar una laparotomía mediana mediante tijeras.
- Inserte retractores, movilice el intestino a la izquierda del donante y exponga la vena cava inferior con hisopos de algodón esterilizados.
- Para la anticoagulación, inyectar 500 UI de heparina disuelta en 1 ml de solución salina isotónica helada por vía intravenosa mediante la perforación de la vena cava inferior. Detener el sangrado en el lugar de la punción por compresión ligera con un hisopo de algodón después de la retracción de la aguja(Figura 3A).
- Incise el diafragma y realice toracotomía lateral a ambos lados del donante.
- Ancle la pared ventral movilizada del tórax a la mesa de operaciones.
- Retire el pericardio y el nervio vagal mediante una preparación contundente utilizando dos soportes de microagujas.
- Realizar la transección de los vasos abdominales con el fin de exsanguinar al donante y descargar el corazón.
- Inserte la rama contundente de una sonda apuntando tijeras en los transvers pericárdicos senos parano y separe la aorta ascendente y la arteria pulmonar lo más distal posible bajo la tracción caudal ligera del corazón con una compresa humecida(Figura 3B).
- Colocar una sola ligadura 5-0 alrededor de la vena cava superior e inferior y las venas pulmonares y apretarla lo más dorsal posible(Figura 3C).
- Cortar el tejido dorsal a la ligadura y extraer el corazón (Figura 3D).
- Perfunde el corazón explantado con una cánula de 18 G de un catéter intravenoso a través de la aorta ascendente y la arteria pulmonar con 30 ml de solución salina de isotona helada suplementada con 1000 UI de heparina y coloque el corazón en un tubo de 15 ml lleno de solución salina en hielo(Figura 3E-F).
2. Implantación del corazón
NOTA: Como receptores, se utilizaron ratas hembra o macho de 10-14 semanas de edad. Los donantes y los receptores coincidían aproximadamente con el peso.
- Realizar anestesia de la rata receptora utilizando también inhalación de isoflurano (inducción al 5% y mantenimiento al 1,5-2% con un flujo de O2 de 1 L/min). Inyectar 5 mg de Carprofeno por vía subcutánea por kg de peso corporal para la analgesia perioperatoria y comprobar la ausencia del reflejo de abstinencia de pellizcar del dedo del dedo del dedo del dedo del tiempo.
- Aplicar lubricante para los ojos, quitar el pelaje abdominal, fijar las extremidades y esterilizar la piel de forma análoga a la preparación del donante. Para obtener un resultado postoperatorio óptimo, realice la operación en una estera de calentamiento para evitar la hipotermia intraoperatoria.
- Después de la incisión longitudinal de la piel, aplicar un anestésico local, como lidocaína (0,2%), en la fascia abdominal. Abra la cavidad abdominal mediante la laparotomía mediana e inserte retractores.
- Movilice el intestino a la parte superior izquierda del receptor y colóquelo en una compresa caliente y húmeda.
- Después de movilizar el duodeno y el jejunum proximal, respectivamente, utilizando el microscopio quirúrgico (o gafas de aumento) con un aumento de 5-7x, exponer la aorta abdominal y la vena cava inferior mediante una preparación contundente con hisopos de algodón. No separe los vasos abdominales.
- Elevar los vasos abdominales utilizando dos micro portaagujas sin dañar las venas lumbares y colocar la abrazadera vascular Cooley(Figura 4A).
- Perforar los vasos abdominales con una cánula arqueada de 30-45o de 27 G(Figura 4B).
- Agrandar el sitio de punción utilizando tijeras Potts para crear una incisión longitudinal que coincida con el tamaño del lumen de los vasos donantes(Figura 4C-D)y perfumar los vasos receptores con solución salina con el fin de eliminar coágulos y prevenir la trombosis postoperatoria.
- Coloque el injerto en el situs y fije la aorta ascendente del donante a la aorta abdominal receptora por dos simples puntos interrumpidos (8-0 monofilamento sutura no resorbable) en la esquina craneal y caudal de la incisión longitudinal(Figura 4E).
- Anastomosa la aorta ascendente del donante con la aorta abdominal del receptor por un correr 8-0 sutura monofilamento en dos pasos: en primer lugar, colocar el injerto a la derecha de los vasos receptores y realizar la primera mitad de la anastomosis(Figura 4E). Posteriormente, coloque el injerto a la izquierda de los vasos receptores y realice la segunda mitad de la anastomosis(Figura 4F).
- Fijar la arteria pulmonar del donante a la vena cava inferior de forma análoga a la anastomosis aortal (8-0 monofilamento sutura no resorbable). Suturar la primera mitad de la anastomosis venosa del lado intraluminal del recipiente(Figura 4G-H).
- Enjuague las anastomosas con salina directamente antes de apretar los nudos para evitar la embolia periférica.
- Coloque una gasa hemostática alrededor de ambas anastomosas y suelte cuidadosamente la abrazadera vascular Cooley para que pueda comenzar la reperfusión del injerto. Manipule el sangrado a lo largo de las anastomosas mediante una ligera compresión con hisopos de algodón esterilizados.
NOTA: El injerto debe comenzar a latir después de alrededor de 60 s. - Reemplazar el intestino en un meandro como la moda. Asegúrese de que no haya malrotaciones del radio mesentérico para prevenir la necrosis intestinal u obstrucción mecánica.
- Cierre los músculos abdominales/fascia y la piel por separado usando suturas continuas de 3-0 polifilamento.
3. Cuidado postoperatorio
- Para la analgesia postoperatoria, suministre a los receptores una inyección subcutánea adicional de 5 mg de Carprofeno por kg de peso corporal el primer día postoperatorio (POD). Además, añadir 1 g de Metamizol a 500 ml de agua potable hasta el tercer POD.
- Comience a monitorear la función del injerto cardíaco por palpación abdominal diaria en el tercer POD.
NOTA: En caso de fallo del injerto antes del tercer POD, se debe considerar una falla quirúrgica en lugar de inmunológica. Sin embargo, esto, por supuesto, depende de la combinación de cepas elegida y del modelo inmunológico respectivo (por ejemplo, el rechazo hiperagudo después de la inmunización previa). - Después del rechazo del injerto, extraiga tejidos como los ganglios linfáticos retroperitoneales drenantes craneales de las anastomosas, el bazo, la sangre, el timo y el injerto para análisis inmunológicos adicionales a través de la citometría de flujo o inmunohistoquímica.
4. Digestión enzimática del corazón y inyección subcutánea de células cardíacas en el oído
- Realizar la explantación cardíaca y la perfusión de forma análoga al trasplante de corazón heterotópico (ver paso 1).
- Triturar el corazón en bloques de 3 mm x 3 mm usando un bisturí estéril o tijeras estériles e incubarlo durante 30 min a 37 oC en medio de cultivo que contenga 0,5 mg/ml de colágeno.
NOTA: Es importante utilizar un medio de cultivo que contenga penicilina, estreptomicina y glutamina sin suero fetal de ternero (FCS), especialmente porque fcS inhibe la digestión de la colagenasa. - Agregue el tejido digerido a un tamiz de poros grandes, mientras que la eliminación del medio de cultivo y la pica a fondo para obtener una suspensión de las células musculares cardíacas vitales, en su mayoría células cardíacas muertas y las células sanguíneas restantes. Lave la suspensión celular dos veces con solución salina isotónica estéril.
NOTA: Ajustes de centrifugación: 10 min, 200 x g, 20 oC - Filtrar la suspensión con un colador de células de 40 m y recoger las fugas celulares vitales mediante el lavado del colador celular con 5-10 ml de solución salina isotónica.
- Después de la centrifugación, resuspenda las células musculares cardíacas en solución salina disuelta a una concentración de 5x105 células/ml y extraiga la solución celular en una jeringa de 1 ml.
- Realizar anestesia de forma análoga al protocolo descrito para la narcosis receptora (ver paso 2) para el trasplante cardíaco heterotópico.
- Coloque el recipiente en una posición lateral y fije la oreja con un dedo con cinta adhesiva de doble cara(Figura 5A).
- Inyectar 20 l de la solución de células musculares cardíacas (que contiene 1 x 104 células) a través de una cánula de 27 G s.c. cerca de los vasos capilares visuales en el oído del receptor(Figura 5B).
- Después de un período de observación definido (dependiendo de la combinación de tensión elegida y la fuerza del rechazo), extraiga los ganglios linfáticos cervicales drenantes y realice análisis adicionales como citometría de flujo o cocultivos(Figura 5C).
NOTA: Además, se puede realizar un análisis histológico del pinna para determinar la infiltración celular.
Resultados
En el pasado, se han abordado diferentes cuestiones inmunológicas sobre la base del modelo, que fue validado en el grupo de trabajo por más de 500 trasplantes con una tasa de supervivencia de más del 95%13,,18,,19,,20,,21,,22,,23,24. Los tiempos de funcionamiento totales (incluyendo la explantación e implantación del injerto) generalmente no superaron los 60 minutos, mientras que los tiempos combinados de isquemia fría y cálida fueron de alrededor de 30 minutos. Las combinaciones de cepas aplicadas se basaron principalmente en el fondo de Lewis (Lew). Los trasplantes singénicos sobrevivieron hasta 100 días sin signos de fallo del injerto, pero la reducción significativa del peso y el tamaño al explantar el injerto. Más recientemente, realizamos trasplantes de corazón heterotópicos en dos combinaciones diferentes de donante-receptor que simulan un modelo de rechazo rápido y prolongado: Lew.1a - Lew wt que conduce a un rechazo rápido (tiempo medio de supervivencia de 7,4 días) y Lew.1u-7B- Lew.1a que conduce a un rechazo más prolongado (tiempo medio de supervivencia de 42,5 días)(Figura 6). Macroscópicamente, los injertos rechazados mostraron una trombosis acompañada de una decoloración lívida y hinchazón, mientras que los injertos no rechazados muestran una atrofia distinta, probablemente como consecuencia de un ventrículo izquierdo descargado. Además, elaboramos secciones criostastes de corazones trasplantados con el fin de detectar la infiltración celular utilizando un método de tinción de fosfatasa-anticalina alcalina (APAAP). Los fotogramas individuales con un aumento de 50x se fusionaron en una imagen compuesta, dando una visión general del injerto completo y la distribución de las células infiltrantes. El análisis histológico mostró una mayor infiltración de (por ejemplo, CD4+, TCR+, o NKR-P1A/B+) células inmunitarias en los injertos alogénicos, mientras que los injertos singénicos estaban en gran medida libres de infiltración celular(Figura 7A-C).
La linfadenectomía cervical y los ensayos de reestimulación de células de ganglios linfáticos que drenan después de la inyección de oído de células musculares cardíacas en las combinaciones de tensión mencionadas anteriormente revelaron respuestas inmunitarias específicas de tensión distintas hacia el tejido cardíaco alogénico y permitieron más análisis inmunológicos, como el perfilado de citoquinas(Figura 8A-C).
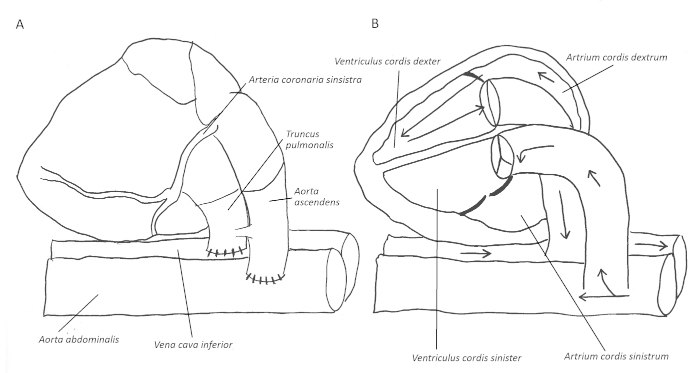
Figura 1: Presentación esquemática de las anastomosas de extremo a lado y el flujo sanguíneo resultante a través del corazón. Después de anastomosing el donante ascendente aorta de extremo a lado de la aorta abdominal receptora y análogamente la arteria pulmonar al receptor vena cava inferior(A),el flujo sanguíneo entra en las arterias coronarias a través de la aorta ascendente. El drenaje venoso se produce a través del seno coronario en la aurícula y ventrículo derecho y a través de la arteria pulmonar en la vena cava inferior del receptor (B). Haga clic aquí para ver una versión más grande de esta figura.
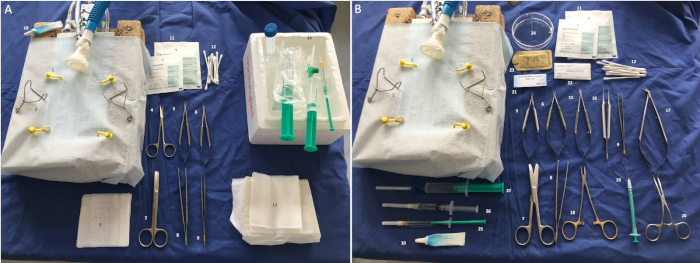
Figura 2: Instrumentos y materiales quirúrgicos requeridos. (A) Explantación: 1: banda elástica de las extremidades, 2: retractores, 3: ligadura 5-0, 4: tijeras puntiagudas de sonda, 5-6: soportes de microagujas, 7: tijeras, 8: fórceps quirúrgicos, 9: microfórceps, 10: lubricante para los ojos, 11: compresa, 12: hisopos de algodón, 13: base de perfusión, 14: solución salina sobre hielo. (B) Implantación: 1: banda elástica de las extremidades, 2: retractores, 5-6: micro soportes de agujas, 7: tijeras, 8: fórceps, 9: micro fórceps, 10: lubricante para ojos, 11: compresa, 12: hisopos de algodón, 15: microtijeras, 16: micro fórceps, 17: Tijeras Potts, 18: soporte de aguja, 19: cánula arqueada, 20: Abrazadera vascular Cooley, 21: 8-0 suturas monofilamento, 22: gasa hemostática, 23: 3-0 suturas de polifilamento, 24: plato Petri, 25: Carprofeno (5 mg/ml), 26: anestésico local (lidocaína 0,2%), 27: solución salina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Explantación de corazón. Después de la heparinización (A), se realiza toracotomía y la aorta ascendente y la arteria pulmonar se cortan lo más distales posible (B). Con una sola ligadura pulmonar y ambas venas de la cavidad se ocluyen (C) y el corazón se extrae de la cavidad torácica (D). (E) muestra el corazón antes y (F) después de la perfusión con 30 ml de solución salina que contiene heparina. Haga clic aquí para ver una versión más grande de esta figura.
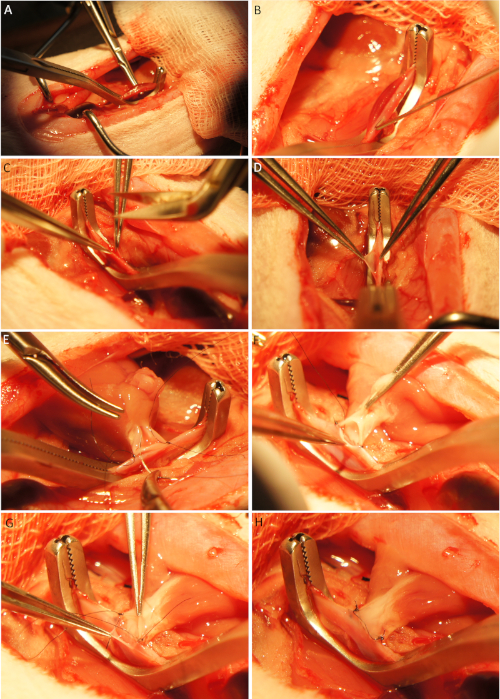
Figura 4: Implantación del corazón. Después de la exposición de los vasos abdominales y la colocación de una abrazadera vascular Cooley (A) los vasos se pueden canular (B) y se realiza una incisión longitudinal utilizando tijeras Potts (C-D). La aorta ascendente del donante se fija con un nudo cada uno en la esquina craneal y caudal de la incisión de la aorta abdominal receptora (E) y la anastomosis se realiza mediante suturas de funcionamiento continuo (E-F). Tenga en cuenta que el injerto se coloca en el lado derecho de los vasos para la primera mitad de la anastomosis (E) y en el lado izquierdo de los vasos para la segunda mitad de la anastomosis (F) y la posterior anastomosis venosa. La primera mitad de la anastomosis venosa se realiza mediante una sutura intraluminal (G). Después de terminar la segunda mitad de la anastomosis venosa, el injerto está listo para la reperfusión (H). Haga clic aquí para ver una versión más grande de esta figura.
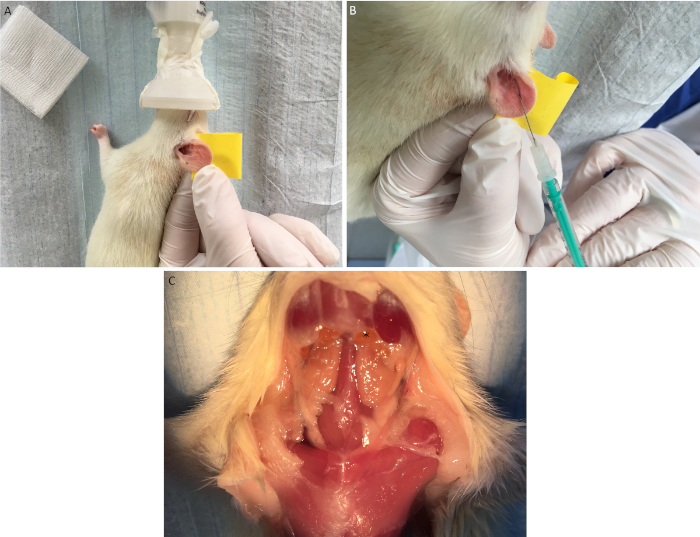
Figura 5: Inyección en la oreja de células musculares cardíacas alogénicas. Después de fijar la oreja del receptor en un dedo utilizando cinta adhesiva de doble cara (A) las células vitales cardíacas musculares alogénicas se inyectan subcutáneamente cerca de los vasos capilares visuales (B). Después de un período de observación drenando los ganglios linfáticos cervicales (*) se extraen (C). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Supervivencia cardíaca en diferentes combinaciones singénicas y alogénicas de donante-receptor. El análisis de Kaplan-Meier muestra la supervivencia de los injertos de rechazo rápido singénicos (modelo de rechazo rápido n-10; modelo de rechazo prolongado n-5) y los injertos alogénicos (modelo de rechazo rápido n-11; modelo de rechazo prolongado n-14). En el modelo de rechazo prolongado, seis de 14 receptores llegaron al final del período de observación (60 días) sin fallo de injerto, lo que llevó a una supervivencia prolongada del injerto en este grupo. Haga clic aquí para ver una versión más grande de esta figura.
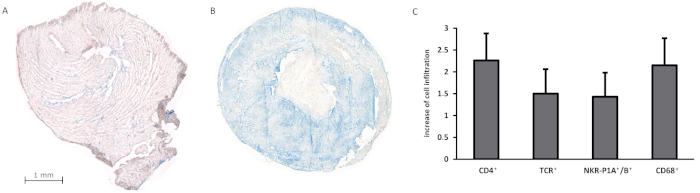
Figura 7: Análisis histológico de injertos cardíacos singénicos y alogénicos. (A-B) muestra nódrenla infiltración de CÉLULAs CD4+ utilizando el método de tinción APAAP en un injerto singénico (A) y un injerto alogénico tras el rechazo (B). (C) presenta el aumento de la infiltración celular en injertos alogénicos en comparación con los injertos singénicos (que sirven como grupo de referencia) para diferentes subconjuntos de células inmunitarias. La clasificación aplicada para cuantificar la infiltración celular se modificó a partir de Hirschburger et al.25: 0 o infiltración comparable a los injertos singénicos; 0.5 - ligero aumento de células manchadas en secciones de tejido aislado; 1 - aumento de células manchadas singulares sobre toda la sección del tejido; 1.5 - aumento de los racimos de células manchadas distribuidos uniformemente sobre toda la sección del tejido; 2o fuerte; 2.5 o muy fuerte; 3 - mayor aumento de los racimos de células manchadas en toda la sección del tejido. Las secciones histológicas de los injertos se analizaron utilizando un aumento de 50x. En el análisis se incluyeron cinco injertos por grupo (singénicos y alogénicos, respectivamente). Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Análisis de drenar las células de los ganglios linfáticos después de la inyección en la oreja de células musculares cardíacas alogénicas. Reestimulación específica (con 2 x 105 esplenocitos de la cepa de donante respectiva) de 2 linfocitos 105 cosechados de ganglios linfáticos cervicales o mesentéricos (LN) drenantes de Lew wt que rechazan rápidamente el Lew wt y prolongados los receptores de Lew.1a que rechazaban mostraron una proliferación significativamente reducida de células de ganglios linfáticos drenantes en los receptores de Lew.1a (A), mientras que la capacidad proliferativa en general seguía siendo observable después de una estimulación inespecífica con el anticuerpo CD3/CD28 (B). Sorprendentemente, el perfil de citoquinas reveló un aumento de las citoquinas inflamatorias en los ganglios linfáticos de los receptores rechazados prolongados (C). Los resultados se presentan como media s NM de al menos 4 animales por grupo. La significancia se indica con * para los valores p de 0,05 y **** para los valores p a 0,0001. (Esta cifra ha sido modificada de Beetz et al.24). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método descrito anteriormente de trasplante cardíaco heterotópico en ratas se basa principalmente en la descripción de Ono y Lindsey en 19693. Desde entonces, se han introducido varias modificaciones en varias especies que conducen a una amplia diversidad de este modelo. Combinando varias de estas modificaciones e introduciendo nuestra propia experiencia resultante de más de 30 años de realización de trasplantes de corazón heterotópicos en el laboratorio, creamos un enfoque quirúrgico factible, que no requiere largos períodos de entrenamiento o antecedentes quirúrgicos. A continuación, discutiremos las limitaciones generales de este modelo y subrayaremos los pasos críticos del protocolo. Además, destacaremos los beneficios de combinar el trasplante de corazón heterotópico con un novedoso método de inyección en la oreja de células musculares cardíacas.
Anestesia y complicaciones generales
Aunque se ha informado de que la anestesia con isoflurano es superior a la anestesia inyectable con respecto a la supervivencia temprana después del trasplante de corazón heterotópico, la depresión respiratoria intraoperatoria todavía representa una de las complicaciones más comunes y por lo tanto requiere un manejo cuidadoso de la narcosis26. En lugar de la explantación e implantación de injertos en serie, respectivamente, aconsejamos comenzar la preparación del receptor y los vasos abdominales inmediatamente después de la toracotomía del animal donante, especialmente porque los tiempos de operación de menos de una hora se asocian con un mejor resultado con respecto a la supervivencia del injerto y el receptor26,27. Además de complicaciones ya mencionadas como hipotermia debido a los largos tiempos de funcionamiento y la falta de esteras de calentamiento, y necrosis intestinal u obstrucción por colocación no fisiológica del intestino, una parosis de extremidades de hinder representa una complicación adicional, que puede prevenirse mediante la sujeción vascular atraumática y el lavado exhaustivo de los anastomoses para evitar embolia periférica28,,29.
Ligadura de venas pulmonares y de la cavidad y complicaciones hemorrágicos
Con el fin de reducir el tiempo de isquemia caliente, utilizamos una sola ligadura para la cavidad y las cuatro venas pulmonares. Como posible complicación resultante de una colocación demasiado proximal/ventral de la ligadura, se debe mencionar la interrupción del contraflujo venoso por oclusión del seno coronario. En caso de sangrado grave después de la extracción de la abrazadera Cooley y golpe visible del injerto, la ligadura debe comprobarse inmediatamente para la insuficiencia. Observamos este tipo de complicación, especialmente si la disección de las venas pulmonares se realizó demasiado cerca de la ligadura mientras se retiraba el injerto de la cavidad torácica. De lo contrario, el sangrado intenso se debe principalmente a la insuficiencia de las anastomosas vasculares. Además, se describe que una arteria coronaria que corre a lo largo de la aorta ascendente que a menudo se corta durante el trasplante causa sangrado letal al reperfusión27.
Tiempo de isquemia y perfusión
Independientemente del modelo de trasplante, siempre es indispensable reducir el tiempo de isquemia, especialmente porque el corazón se considera como un órgano vulnerable con respecto al daño por isquemia. Mediante la realización de la cirugía con dos cirujanos, somos capaces de lograr un tiempo isquémico cálido y frío mínimo y por lo tanto renunciar al uso de soluciones cardiopléjicos con el fin de reducir el daño isquemia-reperfusión30. Generalmente, la perfusión del injerto juega un papel clave y es esencial para enfriar el injerto y eliminar las células sanguíneas, lo que podría resultar en trombosis o embolia. Mientras que las bajas presiones de perfusión conducen a una perfusión insuficiente y, por lo tanto, a una extracción incompleta de las células sanguíneas, las presiones de perfusión elevadas pueden causar daño endotelial31,32. Aconsejamos la perfusión de la arteria pulmonal, así como la aorta ascendente hasta que las arterias coronarias se enjuaguen visiblemente.
Incisión de los vasos receptores
Un paso crítico en el protocolo constituye la incisión de los vasos receptores sin causar daños en la pared posterior de los vasos: Schmid et al. describieron el beneficio de la aortotomía o venotomía realizando una pequeña incisión transversal seguida de agrandamiento longitudinal en la dirección craneal y caudal, lo que conduce además a una disminución de la tasa de estenosis de la anastomosis aortal33. En nuestro modelo, los recipientes receptores se perforan con una pequeña cánula. Después, el sitio de la punción se agranda mediante el uso de tijeras Potts para crear una incisión longitudinal. Para una mejor viabilidad, recomendamos doblar la punta de la cánula a un ángulo de 30-45o, lo que reduce el riesgo de dañar la pared posterior de los vasos. No observamos estenosis vascular clínicamente relevante en ninguno de nuestros receptores. Shan et al.34han descrito beneficios similares de la apertura de vasos receptores mediante la punción de la aorta abdominal y la vena cava inferior con cánula.
Dominar el modelo de trasplante de corazón heterotópico
Durante la última década, el modelo ha sido realizado por investigadores en el departamento con poco o ningún traste quirúrgico. Como se ha indicado anteriormente, operamos en pares de cirujanos, mientras que el investigador más experimentado se encarga de garantizar el éxito del trasplante y al mismo tiempo de mejorar gradualmente el conjunto de habilidades del investigador sin experiencia. Después de un breve período de entrenamiento de aproximadamente diez trasplantes e implantes de injertos en animales muertos, el investigador sin experiencia se encarga de realizar la explantación del corazón y ayudar a la implantación del injerto en aproximadamente diez animales vivos. Posteriormente, el investigador sin experiencia realiza activamente las anastomosas vasculares, de modo que después de aproximadamente diez trasplantes adicionales, el ex investigador sin experiencia suele ser capaz de realizar todos los pasos críticos del modelo.
Aplicando este concepto de formación, publicaciones pasadas de nuestro departamento utilizando trasplante de corazón heterotópico en ratas no mostraron diferencias con respecto a la morbilidad, mortalidad o función de injerto a pesar de varios equipos diferentes de cirujanos13,,18,,19,,20,,21,,22,,23,,24.
Cabe destacar que la realización de las anastomosas vasculares representa el paso más crítico en este protocolo y los modelos de trasplante de órganos sólidos en general. Por lo tanto, recomendamos períodos de entrenamiento prolongados utilizando animales muertos hasta que las anastomosas se realicen de forma precisa y rápida, especialmente si un investigador experimentado no está disponible para la orientación en animales vivos.
Ventajas y desventajas generales del modelo
Mientras que la inducción de tolerancia espontánea se describe a menudo como un fenómeno en el trasplante de hígado y también se observa en el trasplante de riñón, el corazón se considera como un órgano bastante inmunogénico y, por lo tanto, permite un rechazo fiable en los modelos de trasplante35,36. Contrariamente a estos hallazgos, también podríamos notar la supervivencia a largo plazo y la ausencia de rechazo después del trasplante de corazón heterotópico en ciertas combinaciones donantes-receptores a pesar de la completa disparidad compleja de histocompatibilidad.
Una crítica a menudo mencionada del trasplante de corazón heterotópico es la subjetividad de la monitorización del injerto por palpación manual. Por lo tanto, el modelo se ha extendido a las técnicas de anastomosis femoral con el fin de facilitar el acceso a la palpación e introducir otras técnicas de monitoreo como la ecocardiografía transfemoral15,,16. Por otro lado, Mottram et al. demostraron que el seguimiento del injerto a través de la palpación se correlaciona bien con las mediciones electrocardiográficas37. Por lo tanto, la palpación manual en trasplantes de corazón heterotópicos parece suficiente para controlar la función del injerto en un modelo de rechazo agudo.
Como consecuencia de la colocación heterotópica y la descarga ventricular izquierda, el corazón no funciona en condiciones anatómicas o fisiológicas asumiendo que esto no afecta los análisis inmunológicos. Contrariamente a esta suposición, se había demostrado que la remodelación cardíaca resultante de la descarga ventricular izquierda durante la terapia del dispositivo de asistencia ventricular izquierda conduce a una disminución de la liberación de citoquinas38,39. Por otro lado, Tang-Quan et al. describieron el entorno descargado como un enfoque más apropiado para el análisis inmunológico, ya que se observó un daño isquémico a largo plazo del injerto resultante de la perfusión con sangre parcialmente desoxigenada en el modelo de carga ventricular izquierda40.
Aunque la colocación abdominal de los injertos ofrece beneficios quirúrgicos en términos de practicabilidad, es difícil cosechar un número suficiente de ganglios linfáticos retroperitoneales drenantes al rechazo del injerto que deteriora los análisis posteriores. Por esta razón, introdujimos un método novedoso de inyección en la oreja de células musculares cardíacas alogénicas. Originario de la investigación parasitológica, este concepto no se ha aplicado a los análisis inmunológicos en trasplante, a pesar de su viabilidad41,,42. La ventaja de este modelo es la posibilidad de identificar y cosechar un número significativo de ganglios linfáticos drenantes, lo que ofrece la posibilidad de realizar análisis inmunológicos complejos. Cabe destacar que ambos modelos podrían combinarse en un receptor ofreciendo más información sobre los mecanismos de rechazo y tolerancia en el trasplante de células y órganos en ratas.
Nuestros modelos de trasplante de células musculares cardíacas y de corazón de rata representan un enfoque práctico y bien estudiado y se pueden realizar sin más entrenamiento quirúrgico o antecedentes. Frente al hecho de que recientemente se han introducido y desarrollado nuevas tecnologías de clonación para ratas, estos modelos ofrecen amplias oportunidades para los investigadores inmunológicos de trasplantes.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Queremos agradecer a Britta Trautewig, Corinna L'bbert e Ingrid Meder por su compromiso.
Materiales
| Name | Company | Catalog Number | Comments |
| Anesthesia device (including isoflurane vaporizer) | Summit Anesthesia Solutions | No Catalog Number available | |
| Cannula (27 G) | BD Microlance | 302200 | |
| Carprofen | Pfizer | Rimadyl 50 mg/mL | |
| Cellstar Tubes (15 mL) | GreinerBioOne | 188271 | |
| Cell strainer (40 µm) | BD Falcon | 2271680 | |
| Collagenase Type CLSII | Biochrome | C2-22 | |
| Compresses 5x5 cm | Fuhrmann | 31501 | |
| Compresses 7.5x7.5 cm | Fuhrmann | 31505 | |
| Cotton swabs | Heinz Herenz Medizinalbedarf | 1032128 | |
| Dexpathenol (5 %) | Bayer | "Bepanthen" | |
| DPBS BioWhittaker | Lonza | 17-512F | |
| Forceps | B. Braun | Aesculap BD557R | |
| Forceps | B. Braun | Aesculap BD313R | |
| Forceps | B. Braun | Aesculap BD35 | |
| Heating mat | Gaymar Industries | "T/Pump" | |
| Hemostatic gauze | Ethicon | Tabotamp | |
| Heparin-Natrium 25 000 I.E. | Ratiopharm | No Catalog Number available | |
| Isofluran CP | CP-Pharma | No Catalog Number available | |
| Large-pored sieve (stainless steel) | Forschungswerkstätten Hannover Medical School | No Catalog Number available | |
| Lidocaine | Astra Zeneca | 2 % Xylocain | |
| Metamizol-Natrium | Ratiopharma | Novaminsulfon 500 mg/mL | |
| Micro forceps | B. Braun | Aesculap BD3361 | |
| Micro needle holder | Codman, Johnson & Johnson Medical | Codmann 80-2003 | |
| Micro needle holder | B. Braun | Aesculap BD336R | |
| Micro needle holder | B. Braun | Aesculap FD241R | |
| Micro scissors | B. Braun | Aesculap FD101R | |
| Micro scissors | B. Braun | Aesculap FM471R | |
| Needle holder | B. Braun | Aesculap BM221R | |
| Penicillin/Streptomycin/Glutamine (100x) | PAA | P11-010 | |
| Peripheral venous catheter (18 G) | B. Braun | 4268334B | |
| Peripheral venous catheter (22 G) | B. Braun | 4268091B | |
| Probe pointed scissors | B. Braun | Aesculap BC030R | |
| Retractors | Forschungswerkstätten Hannover Medical School | No Catalog Number available | |
| RPMI culture medium | Lonza | BE12-702F | |
| Saline solution (NaCl 0.9 %) | Baxter | No Catalog Number available | |
| Scissors | B. Braun | Aesculap BC414 | |
| Surgical microscope | Carl-Zeiss | OPMI-MDM | |
| Sutures (anastomoses) | Catgut | Mariderm 8-0 monofil | |
| Sutures (ligature) | Resorba | Silk 5-0 polyfil | |
| Sutures (skin, fascia) | Ethicon | Mersilene 3-0 | |
| Syringe (1 mL) | B. Braun | 9166017V | |
| Syringe (10 mL) | B. Braun | 4606108V | |
| Syringe (20 mL) | B. Braun | 4606205V | |
| Vascular clamp | B. Braun | Aesculap FB708R |
Referencias
- Abbott, C. P., et al. A Technique for Heart Transplantation In the Rat. Archives of Surgery. 89 (4), 645-652 (1964).
- Tomita, F. Heart homotransplantation in the rat. Sapporo igaku zasshi. The Sapporo Medical Journal. 30 (4), 165-183 (1966).
- Ono, K., Lindsey, E. S. Improved technique of heart transplantation in rats. The Journal of Thoracic and Cardiovascular Surgery. 57 (2), 225-229 (1969).
- Wen, P., et al. A simple technique for a new working heterotopic heart transplantation model in rats. Transplantation Proceedings. 45 (6), 2522-2526 (2013).
- Benke, K., et al. Heterotopic abdominal rat heart transplantation as a model to investigate volume dependency of myocardial remodeling. Transplantation. 101 (3), 498-505 (2017).
- Kearns, M. J., et al. Rat Heterotopic Abdominal Heart/Single-lung Transplantation in a Volume-loaded Configuration. Journal of Visualized Experiments. (99), 52418 (2015).
- Ibrahim, M., et al. Heterotopic abdominal heart transplantation in rats for functional studies of ventricular unloading. The Journal of Surgical Research. 179 (1), e31-e39 (2013).
- Liu, F., Kang, S. M. Heterotopic heart transplantation in mice. Journal of Visualized Experiments. (6), 238 (2007).
- Lu, W., et al. A new simplified volume-loaded heterotopic rabbit heart transplant model with improved techniques and a standard operating procedure. Journal of Thoracic Disease. 7 (4), 653-661 (2015).
- Kitahara, H., et al. Heterotopic transplantation of a decellularized and recellularized whole porcine heart. Interactive Cardiovascular and Thoracic Surgery. 22 (5), 571-579 (2016).
- Kadner, A., et al. Heterotopic heart transplantation: experimental development and clinical experience. European Journal of Cardiothoracic Surgery. 17 (4), 474-481 (2000).
- Zinöcker, S., et al. Immune reconstitution and graft-versus-host reactions in rat models of allogeneic hematopoietic cell transplantation. Frontiers in Immunology. 3 (NOV), 1-12 (2012).
- Klempnauer, J., et al. Genetic control of rat heart allograft rejection: effect of different MHC and non-MHC incompatibilities. Immunogenetics. 30, 81-88 (1989).
- Huang, G., et al. Genetic manipulations in the rat: Progress and prospects. Current Opinion in Nephrology and Hypertension. 20 (4), 391-399 (2011).
- Gordon, C. R., et al. Pulse doppler and M-mode to assess viability of cardiac allografts using heterotopic femoral heart transplantation in rats. Microsurgery. 27 (4), 240-244 (2007).
- Gordon, C. R., et al. A new modified technique for heterotopic femoral heart transplantation in rats. The Journal of Surgical Research. 139 (2), 157-163 (2007).
- Ma, Y., Wang, G. Comparison of 2 heterotopic heart transplant techniques in rats: cervical and abdominal heart. Experimental and Clinical Transplantation. 9 (2), 128-133 (2011).
- Bektas, H., et al. Differential effect of donor-specific blood transfusions after kidney, heart, pancreas, and skin transplantation in major histocompatibility complex-incompatible rats. Transfusion. 37 (2), 226-230 (1997).
- Saiho, K. O., et al. Long-term allograft acceptance induced by single dose anti-leukocyte common antigen (RT7) antibody in the rat. Transplantation. 71 (8), 1124-1131 (2001).
- Bektas, H., et al. Blood transfers infectious immunologic tolerance in MHC-incompatible heart transplantation in rats. Journal of Heart and Lung Transplantation. 24 (5), 614-617 (2005).
- Jäger, M. D., et al. Sirolimus promotes tolerance for donor and recipient antigens after MHC class II disparate bone marrow transplantation in rats. Experimental Hematology. 35 (1), 164-170 (2007).
- Timrott, K., et al. Application of allogeneic bone marrow cells in view of residual alloreactivity: Sirolimus but not cyclosporine evolves tolerogenic properties. PLoS ONE. 10 (4), 1-16 (2015).
- Hadamitzky, M., et al. Memory-updating abrogates extinction of learned immunosuppression. Brain, Behavior, and Immunity. 52, 40-48 (2016).
- Beetz, O., et al. Recipient natural killer cells alter the course of rejection of allogeneic heart grafts in rats. Plos One. 14 (8), e0220546 (2019).
- Hirschburger, M., et al. Nicotine Attenuates Macrophage Infiltration in Rat Lung Allografts. The Journal of Heart and Lung Transplantation. 28 (5), 493-500 (2009).
- Ruzza, A., et al. Heterotopic heart transplantation in rats: improved anesthetic and surgical technique. Transplantation Proceedings. 42 (9), 3828-3832 (2010).
- Wang, D., et al. A simplified technique for heart transplantation in rats: abdominal vessel branch-sparing and modified venotomy. Microsurgery. 26 (6), 470-472 (2006).
- Wang, C., et al. A modified method for heterotopic mouse heart transplantion. Journal of Visualized Experiments. (88), (2014).
- Al-Amran, F. G., Shahkolahi, M. M. Total arterial anastomosis heterotopic heart transplantation model. Transplantation Proceedings. 45 (2), 625-629 (2013).
- Hoerstrup, S. P., et al. Modified technique for heterotopic rat heart transplantation under cardioplegic arrest. Journal of Investigative Surgery. 13 (2), 73-77 (2000).
- Fry, D. L. Acute vascular endothelial changes associated with increased blood velocity gradients. Circulation Research. 22 (2), 165-197 (1968).
- Ahmadi, A. R., et al. Orthotopic Rat Kidney Transplantation: A Novel and Simplified Surgical Approach. Journal of Visualized Experiments. (147), (2019).
- Schmid, C., et al. Successful heterotopic heart transplantation in rat. Microsurgery. 15 (4), 279-281 (1994).
- Shan, J., et al. A modified technique for heterotopic heart transplantation in rats. Journal of Surgical Research. 164 (1), 155-161 (2010).
- Moris, D., et al. Mechanisms of liver-induced tolerance. Current Opinion in Organ Transplantation. 22 (1), 71-78 (2017).
- Bickerstaff, A. A., et al. Murine renal allografts: spontaneous acceptance is associated with regulated T cell-mediated immunity. Journal of Immunology. 167 (9), 4821-4827 (2001).
- Mottram, P. L., et al. Electrocardiographic monitoring of cardiac transplants in mice. Cardiovascular Research. 22 (5), 315-321 (1988).
- Torre-Amione, G., et al. Decreased expression of tumor necrosis factor-α in failing human myocardium after mechanical circulatory support: A potential mechanism for cardiac recovery. Circulation. 100 (11), 1189-1193 (1999).
- Goldstein, D. J., et al. Circulatory resuscitation with left ventricular assist device support reduces interleukins 6 and 8 levels. The Annals of Thoracic Surgery. 63 (4), 971-974 (1997).
- Tang-Quan, K. R., et al. Non-volume-loaded heart provides a more relevant heterotopic transplantation model. Transplant Immunology. 23 (1-2), 65-70 (2010).
- Lakhal-Naouar, I., et al. Transcutaneous immunization using SLA or rLACK skews the immune response towards a Th1 profile but fails to protect BALB/c mice against a Leishmania major challenge. Vaccine. 37 (3), 516-523 (2019).
- Sousa-Batista, A. J., et al. Novel and safe single-dose treatment of cutaneous leishmaniasis with implantable amphotericin B-loaded microparticles. International Journal for Parasitology: Drugs and Drug Resistance. , (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados