Method Article
Indurre lesioni acute al fegato nei ratti tramite Carbon Tetrachloride (CCl4) Esposizione attraverso un tubo orogastrico
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un metodo comune e fattibile per indurre lesioni epatiche acute (ALI) tramite l'esposizione di CCl4 attraverso un tubo orogastrico. L'esposizione a CCl4 induce ALI attraverso la formazione di specie reattive dell'ossigeno durante la sua biotrasformazione nel fegato. Questo metodo viene utilizzato per analizzare la fisiopatologia di ALI ed esaminare diverse strategie eaptoprotettive.
Abstract
Lesione epatica acuta (ALI) svolge un ruolo cruciale nello sviluppo dell'insufficienza epatica, che è caratterizzata da grave disfunzione epatica tra cui complicazioni come encefalopatia epatica e alterata sintesi proteica. Modelli animali appropriati sono fondamentali per testare il meccanismo e la fisiofisiologia dell'ALI e studiare diverse strategie epatoprotettive. Grazie alla sua capacità di eseguire trasformazioni chimiche, il tetracloruro di carbonio (CCl4) è ampiamente usato nel fegato per indurre ALI attraverso la formazione di specie reattive dell'ossigeno. L'esposizione al CCl4 può essere eseguita per via intraperita, per inalazione o attraverso un tubo nasogastrico o orogastrico. Qui, descriviamo un modello di roditore, in cui l'ALI è indotta dall'esposizione cCl4 attraverso un tubo orogastrico. Questo metodo è economico, facile da eseguire e presenta un rischio minimo. Il modello è altamente riproducibile e può essere ampiamente utilizzato per determinare l'efficacia di potenziali strategie epatiche e valutare i marcatori della lesione epatica.
Introduzione
La frequenza degli insulti tossici al fegato, soprattutto a causa dell'abuso di alcol e droghe, è in aumento. Lesione epatica acuta (ALI) è associato ad alti tassi di mortalità e ha causato preoccupazioni cliniche1,2. La lesione tossico porta alla morte segnalare vie nel fegato, con conseguente apoptosi epatocite, necrosi, o piroptosi. ALI svolge un ruolo cruciale nello sviluppo dell'insufficienza epatica, che è caratterizzata da grave disfunzione epatica tra cui complicazioni come l'encefalopatia epatica e la alterata sintesi proteica3,4. Anche se recenti ricerche hanno aumentato le nostre conoscenze sui cambiamenti fisiologici e patologici che accompagnano il fallimento epatico, non ha completamente spiegato le caratteristiche patologiche che influenzano i meccanismi della morte cellulare. Inoltre, nessun farmaco è attualmente disponibile per invertire il progressivo deterioramento nei pazienti con ALI. Attualmente, l'unico trattamento significativamente efficace è il trapianto di fegato5,6.
Al fine di studiare il meccanismo e la fisiopatologia dell'ALI e per testare diverse strategie epatiche, vengono utilizzati diversi modelli animali per indurre l'ALI. Un modello animale preferito di ALI dovrebbe imitare il processo patologico della malattia attraverso un metodo affidabile, convalidato, poco costoso e facile da applicare. Esempi di modelli sperimentali includono agenti epatotossici, procedure chirurgiche come l'epatitectomia totale o parziale, devascizzazione completa o transitoria e procedure infettive7,8,9.9 Sostanze epatossiche conosciute includono galactosamina, acetaminofene, tioacetamide, azoxymetano e CCl4. Di questi, CCl4 è ampiamente utilizzato anche se non è ancora stato ben caratterizzato10,11,12,13.
CCl4 è un composto liquido organico incolore con un odore dolce e quasi nessuna infiammabilità a temperature più basse. L'esposizione ad alte concentrazioni di CCl4 può causare danni al sistema nervoso centrale, compreso il deterioramento del fegato e dei reni. CCl4 induce ALI attraverso la sua biotrasformazione nel fegato, che forma specie reattive di ossigeno. Ciò avviene tramite l'enzima citocromatico P450 2E1, formando un metabolita attivo e causando danni alle cellule da legante macromolecola, miglioramento della perossidazione dei lipidi e disturbo dell'omeostasi del calcio intracellulare14. Inoltre, il modello CCl4 può essere utilizzato per stimolare gli astrociti a livello di sintesi dell'RNA15. Questa epatotossina è stata amministrata dalle rotte intraperitoneali, intraportali, orali e intragastrici16.
In questo protocollo, descriviamo in dettaglio CCl4-indotto ALI nei ratti tramite un tubo orogastrico. Questo metodo induce ALI robusto e riproducibile che può essere utilizzato per studiare la patogenesi di ALI. La determinazione della gravità della malattia epatica è monitorata dalla misurazione della traminare siero-pyruvate (GPT), degli enzimi glutaloe tranamicici (GOT) e della bilirubina totale (TB) e della diagnosi istologica definitiva da parte di tessuti epatici macchiati di ematossina ed eosina (H&E). L'esposizione a CCl4 attraverso un accesso intragastrico consente un metodo pratico, economico e minimamente invasivo con un rischio minimo di rischio.
Protocollo
Gli esperimenti sono stati condotti secondo le raccomandazioni delle dichiarazioni di Helsinki e Di Oleuatori e agli orientamenti per l'uso degli animali sperimentali della Comunità europea. Gli esperimenti sono stati approvati dal Comitato per la cura degli animali dell'Università Ben-Gurion del Negev.
NOTA: il modello CCl4 è stato generato e utilizzato in uno studio precedente17. La sequenza temporale del protocollo è illustrata nella tabella 1.
1. Preparazione dei ratti per la procedura sperimentale
NOTA: Selezionare i ratti Maschi Adulti Sprague Dawley del peso di 300-350 g.
- Ottenere l'approvazione per gli esperimenti da Institutional Animal Care and Use Committee (IACUC).
- Mantenete i ratti a temperatura ambiente (22 gradi centigradi), con 12 h di luce e 12 h di cicli scuri. Fornire ratto chow e acqua ad libitum.
- Eseguire tutti gli esperimenti tra le 6:00 e le 12:00 p.m.
- Rasare il topo e disinfettare la pelle con alcol.
2. Determinazione dei livelli di base GOT, GPT e TB del siero
- Anestesia
- Preparare un sistema di amministrazione isoflurano continuo per indurre l'anestesia. Assicurarsi che il sistema vaporizzatore sia riempito con isoflurane.
- Anestesizzare il ratto con 2% isoflurane. Confermare che il ratto è completamente anestetizzato osservando il movimento e il riflesso del pedale in risposta agli stimoli esterni.
NOTA: Utilizzare l'1/5% di isoflurane per l'induzione e la manutenzione dell'anestesia.
- Cannula la vena posteriore con un catetere da 22 G.
- Raccogliere un campione di sangue di 0,5 mL al basale. Assicurarsi che il volume sanguigno recuperato non superi le linee guida IACUC.
- Eseguire analisi biochimiche del sangue, incluse le misurazioni del siero GOT, GPT e TB, come descritto in precedenza18.
NOTA: Gli esami degli enzimi epatici e del livello di TB sono stati effettuati nel laboratorio biochimico del Soroka Medical Center. Campioni di sangue sono stati analizzati utilizzando un metodo di fluorescenza su un analizzatore chimico (Tabella dei materiali).
3. Induzione di lesioni epatiche acute nei ratti
AVVISO: l'esposizione ad alte concentrazioni di CCl4, compreso l'assorbimento attraverso il vapore o la pelle, può avere effetti negativi sul sistema nervoso centrale e causare la degenerazione del fegato e dei reni. L'esposizione prolungata può causare coma o morte.
- Preparare una soluzione del 50% di CCl4 (Table of Materials) mescolando CCl4 con olio d'oliva come veicolo in un rapporto 1:1.
NOTA: La soluzione deve essere preparata secondo le linee guida IACUC per i composti di grado non farmaceutico. - Indurre l'epatotossicità in vivo dalla somministrazione CCl4 tramite un tubo orogastrico.
- Inserire un tubo orogastrico da 16 G (3 pollici di profondità) attraverso la cavità orale del ratto.
- Esporre il ratto a diverse dosi di CCl4 iniettando una siringa con una delle seguenti soluzioni diluite nello stomaco del ratto: 1 mL/kg (MILD ALI), 2,5 mL/kg (ALI moderato), o 5 mL/kg (ALI grave) della soluzione 50%. Per il gruppo di controllo con finta, esporre il ratto a 5 mL/kg di olio d'oliva solo.
4. Determinazione dei livelli di siero GOT, GPT e TB dopo 24 h
- Anestesia
- Preparare un sistema di amministrazione isoflurano continuo per indurre l'anestesia. Assicurarsi che il sistema vaporizzatore sia riempito con isoflurane.
- Anestesizzare i ratti con 2% isoflurane. Confermare che il ratto è completamente anestetizzato osservando il movimento e il riflesso del pedale in risposta agli stimoli esterni.
- Raccogliere campioni di sangue a 24 ore dall'esposizione a CCl4.
- Eseguire analisi biochimiche del sangue, incluse le misurazioni del siero GOT, GPT e TB.
5. Raccolta del fegato per l'esame istologico
- Eutanasia il ratto sostituendo la miscela di gas ispirata con 20% O2/ 80% CO2. Assicurarsi checo2 venga erogata a un tasso predeterminato in conformità alle linee guida IACUC.
- Garantire la morte controllando la mancanza di battito cardiaco e confermare con un metodo secondario in conformità con le linee guida IACUC.
- Posizionare il ratto su una tavola di dissezione con la superficie dorsale rivolta verso il basso e l'addome rivolto verso l'alto. Rasare l'addome del topo.
- Con un bisturi, incisi l'intera lunghezza della pelle di ventrum dall'ano al mento. Separare la pelle. Incise la parete addominale con un bisturi dall'ano alla cartilagine xifoide, esponendo le viscere addominali.
- Usando forbici e pinze, isolare il fegato sezionandolo dai suoi legamenti e attaccamenti. A partire dall'hilum del fegato, eseguire con attenzione un'epatitectomia rilasciando tutti i lobi epatici dagli attacchi. Dissezionare e tagliare tutti i legamenti e vasi sanguigni.
- Trasferire il fegato in un piatto Petri. Fissare il fegato in una soluzione di formaldeide tamponella tampolata del 4% (Tabella dei materiali) per almeno 24 h.
6. Esame istologico
- Preparazione del campione
- Dopo la fissazione, tagliare il campione in serie di fette spesse 5 m mediante sezionamento di microtomi.
- Posizionare delicatamente le fette su vetrini di vetro con un pennello morbido, 1 fetta per diapositiva.
- Eseguire la colorazione H&E come descritto in precedenza19.
- Esaminate le fette al microscopio a un ingrandimento di 200 x utilizzando una lente obiettivo di 20 mm (Tabella dei materiali).
NOTA: Le sezioni epatiche devono essere classificate da un patologo specializzato accecato al protocollo di trattamento. Un punteggio pari a 0 indica nessuna anomalia epatica, 1–2 indica lievi lesioni epatiche, 3-4 indica lesioni epatiche moderate e 5-6 indica gravi lesioni epatiche20,21,22.
Risultati
I livelli di TB, GOT e GPT sono aumentati in modo significativo di 24 h dopo aver indotto ALI (più a dosi più elevate di CCl4) rispetto ai controlli gestiti da sham (p < 0,001) (Figura 1). I livelli di TB, GOT e GPT al basale erano normali e non erano significativamente diversi rispetto ai controlli di finta. A 24 ore, tutti e tre i gruppi interventistici, 1 mL/kg CCl4 (1, 1,2), 2,5 mL/kg CCl4 (3, 3,4) e 5 mL/kg CCl4 (4, 4,5,75), aveva un punteggio di classificazione istologico significativamente più alto rispetto al gruppo di controllo operato da sham (0, 0-0) (p < 0,05, dati presentati come mediani, 25-75% di distanza). Le immagini H&E di un controllo con finta funzione (Figura 2A) e i gruppi esposti a diverse dosi di CCl4 (Figura 2B-D) mostrano le variazioni istopatologiche 24 h dopo l'esposizione a CCl4. L'interruzione dell'architettura epatocellulare da parte del CCl4 è stata dimostrata da un alto grado di lesione tissutale con grande deformazione fibrosa, estensione delle fibre, accumulo di collagene e separazione pseudolo stagiare nelle sezioni del fegato (Figura 2).
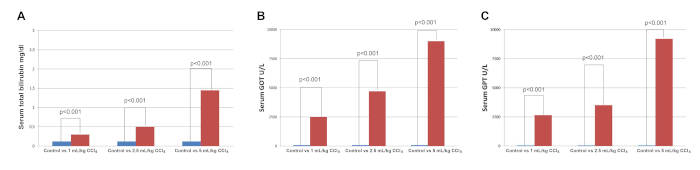
Figura 1: livelli di SIero TB (A), GOT (B) e GPT (C) nei campioni ematici 24 h dopo l'esposizione a diverse dosi di CCl4 rispetto ai controlli di sham. Barra blu: controllo; barra rossa: 24 h dopo l'esposizione a CCl4. Il significato dei confronti tra ratti esposti a CCl4e ratti non esposti viene determinato utilizzando il test Mann-Whitney. Un valore p di <0.05 è stato considerato significativo. Fare clic qui per visualizzare una versione più grande di questa figura.
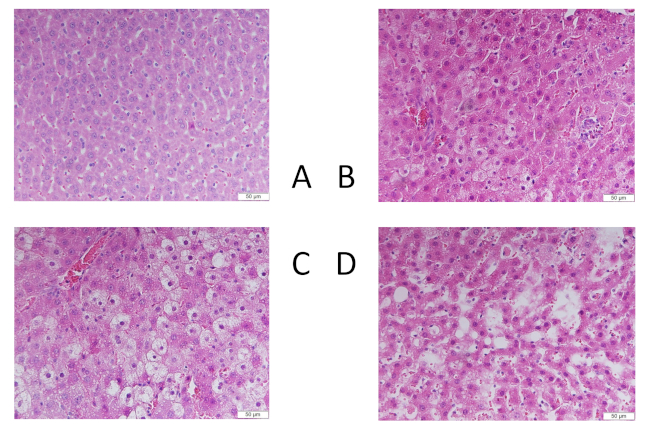
Figura 2: Cambiamenti istopatologici nel tessuto epatico macchiato con H&E dopo 24 h CCl4 intossicazione in varie dosi. (A) controllo operato in sham, (B) 1 mL/kg CCl4, (C) 2,5 mL/kg CCl4e (D) 5 mL/kg CCl4. Barra della scala: 50 m. La distribuzione dei risultati istologici è stata prevista per regressione lineare. Fare clic qui per visualizzare una versione più grande di questa figura.
| Gruppi | 0 ore | 24 ore su 24 |
| Sham (15 ratti) | LIVELLO di base GOT, GPT, TB | GOT, GPT, livello TB |
| AlI lieve (15 ratti) | ||
| Moderato ALI (15 ratti) | Esposizione CCl4 per gruppi ALI e olio d'oliva per gruppi fittizi | Esame istologico |
| Grave ALI (18 ratti) |
Tabella 1: dimostrazione della sequenza temporale del protocollo. I vari gruppi di ratti in tempi diversi includono un gruppo di controllo operato con sham, un lieve ALI (esposizione a 1 mL/kg CCl4), alI moderato (esposizione a 2,5 mL/kg CCl4) e alI grave (esposizione a 5 mL/kg CCl4). A tempo in time 24 h, siero GOT, GPT e TB i livelli sono stati misurati, e l'esame istologico è stato eseguito per tutti e quattro i gruppi.
Discussione
In questo protocollo, CCl4 è usato come una tossina epatica per indurre ALI nei ratti. AlI è caratterizzato da perdita di parenchyma epatico e successiva disregolazione delle funzioni metaboliche e sintetiche del fegato. Farmaci, virus, tossine, malattie autoimmuni, malattie metaboliche e disturbi vascolari inducono tutti la morte degli epatociti, e la successiva risposta infiammatoria contribuisce alla patogenesi dell'AlI.
L'insulto iniziale al fegato porta alla produzione di citochine, rilascio di chemiochine, e successiva infiltrazione di cellule infiammatorie nel fegato. Tre dei biomarcatori comunemente testati per la valutazione ALI sono i livelli GPT, GOT e TB. GPT e GOT sono enzimi misurati in base al livello di attività, mentre il livello di TB misura la funzione epatica in base alla concentrazione di siero. Quando elevato, i livelli di attività enzimatica siero denotano lesioni a epatociti o colgaliociti23. Il metodo spettrofotometrico rapido è stato riportato per la prima volta nel lavoro di Arthur Karmen nel 195524, che ha permesso la diffusa applicazione clinica della misurazione degli enzimi del siero. Da allora, sono state applicate anche misurazioni GOT e GPT per rilevare lesioni da epatociti. GPT viene utilizzato più frequentemente e i test GPT simultanei di solito rivelano risultati ridondanti. L'aumento dei livelli di attività di GOT e GPT tra i tassi di rilascio e i tassi di sgombero delle cellule ferite può essere utilizzato per misurare approssimativamente il tasso di lesione alle cellule. Quando le cellule epatiche ferite causano il fegato a fallire nelle sue normali attività, come l'elaborazione e la rimozione bilirubina come bile, questo indica che l'ALI è più grave.
Ci sono diversi passaggi nel protocollo che sono critici e merito attenzione considerazione. La maggior parte dei protocolli richiede il test dei biomarcatori del siero prima e dopo l'esposizione all'agente investigativo, poiché le elevazioni nei livelli di concentrazione degli enzimi del siero sono comuni. Tuttavia, a causa delle fluttuazioni nella tempistica dell'ALT elevato, è necessario eseguire periodicamente diversi test per rilevare eventuali elevazioni. In questo protocollo, abbiamo scelto di testare i livelli GOT, GPT e TB al basale e 24 h dopo l'esposizione alla tossina. Secondo studi recenti, i livelli di questi biomarcatori sono stati correlati bene con la gravità di ALI durante questo intervallo di tempo17. Come mostrato nella Figura 1, i livelli di sangue GOT, GPT, e TB sono stati elevati in tutti i campioni 24 h dopo l'induzione di ALI. Ciò indica che il modello ha quantificato i risultati in un intervallo di tempo molto breve dall'esposizione a CCl4. Si dovrebbe prendere in considerazione che in grave ALI il fegato perde la sua capacità di sintetizzare GOT e GPT. Pertanto, in questi casi questi enzimi possono mancare il loro valore predittivo, come dimostrato nella letteratura.
Le scoperte istologiche dei ratti esposti al CCl4 sono caratterizzate da mongolfiera di cellule, necrosi centribulareri e la presenza di corpi consiglieri25. In questo modello c'è stato un danno diffuso dimostrato di essere proporzionale alla dose di CCl4 somministrato.
Questo metodo di indurre ALI tramite l'esposizione orogastrico CCl4 ha numerosi vantaggi. È semplice, economico e con rischio minimo di pericolo. Il protocollo fornisce risultati significativi in un intervallo di tempo molto breve. Il modello è altamente riproducibile e può essere comunemente utilizzato per determinare l'efficacia di potenziali strategie epatiche e valutare marcatori di lesioni epatiche.
È importante notare che CCl4 colpisce principalmente la zona centrale del fegato, che non corrisponde alla necrosi massiccia tipicamente visto nell'insufficienza epatica umana. Inoltre, CCl4 non è completamente metabolizzato nel fegato, e alcuni dei non metabolizzati CCl4 possono danneggiare altri organi, tra cui polmoni e reni16. Inoltre, a causa di diversi livelli di sviluppo ed efficacia del P450 citocromatico, c'è una grande variazione di sensibilità a seconda delle specie e dei26anni. Nonostante queste limitazioni, il metodo di orgastrico CCl 4-indotto ALI serve ancora come un modello prezioso roditore.4
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori riconoscono con gratitudine Bertha Delgado, Dipartimento di Patologia, Soroka Medical Center, Facoltà di Scienze della Salute, Ben-Gurion University del Negev, per il suo aiuto in laboratorio così come nell'analisi istologica.
Materiali
| Name | Company | Catalog Number | Comments |
| 22 G catheter BD Neoflon TM | Becton Dickinson Infusion Therapy AB | ||
| 4% buffered formaldehyde solution | Sigma - Aldrich lab materials technologies | ||
| BD Microtainer SST TM Tubes | Becton Dickinson and Company | ||
| Carbone tetrachloride | Sigma - Aldrich lab materials technologies | CAS 56-23-5 | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | ||
| Olympus AU2700 Chemistry-Immuno Analyzer | Olympus (MN, USA) | Analysis of blood samples was done by the fluorescence method | |
| Olympus BX 40 microscope | Olympus | ||
| RAT Feeding Needles | ORCHID SCIENTIFICS | ||
| SYRINGE SET 1 and 2 ml MEDI -PLUS | Shandong Zibo Shanchuan Medical Instruments Co., Ltd |
Riferimenti
- Hoofnagle, J. H., Carithers, R. L., Shapiro, C., Ascher, N. Fulminant hepatic failure: Summary of a workshop. Hepatology. 21 (1), 240-252 (1995).
- Rakela, J., Lange, S. M., Ludwig, J., Baldus, W. P. Fulminant hepatitis: Mayo clinic experience with 34 cases. Mayo Clinic Proceedings. 60 (5), 289-292 (1985).
- Riordan, S. M., Williams, R. Treatment of hepatic encephalopathy. New England Journal of Medicine. 337, 473-479 (1997).
- Bernuau, J., Rueff, B., Benhamou, J. Fulminant and subfulminant liver failure: Definitions and causes. Seminars in Liver Disease. 6 (2), 97-106 (1986).
- Lidofsky, S. D. Liver transplantation for fulminant hepatic failure. Gastroenterology Clinics of North America. 22 (2), 257-269 (1993).
- Auzinger, G., Wendon, J. Intensive care management of acute liver failure. Current opinion in critical care. 14 (2), 179-188 (2008).
- Wu, Q., et al. Protection of regenerating liver after partial hepatectomy from carbon tetrachloride hepatotoxicity in rats: Roles of mitochondrial uncoupling protein 2 and ATP stores. Digestive Diseases and Sciences. 54 (9), 1918-1925 (2009).
- Tuñón, M. J., Alvarez, M., Culebras, J. M., González-Gallego, J. An overview of animal models for investigating the pathogenesis and therapeutic strategies in acute hepatic failure. World Journal of Gastroenterologyl. 15 (25), 3086-3098 (2009).
- van de Kerkhove, M. P., Hoekstra, R., van Gulik, T. M., Chamuleau, R. A. Large animal models of fulminant hepatic failure in artificial and bioartificial liver support research. Biomaterials. 25 (9), 1613-1625 (2004).
- Butterworth, R. F., et al. Experimental models of hepatic encephalopathy: ISHEN guidelines. Liver International. 29 (6), 783-788 (2009).
- Zhang, B., Gong, D., Mei, M. Protection of regenerating liver after partial hepatectomy from carbon tetrachloride hepatotoxicity in rats: Role of hepatic stimulator substance. Journal of Gastroenterology and Hepatology. 14 (10), 1010-1017 (1999).
- Ugazio, G., Danni, O., Milillo, P., Burdino, E., Congiu, A. M. Mechanism of protection against carbon tetrachloride toxicity. I. prevention of lethal effects by partial surgical hepatectomy. Drug and Chemical Toxicology. 5 (2), 115-124 (1982).
- Taniguchi, M., Takeuchi, T., Nakatsuka, R., Watanabe, T., Sato, K. Molecular process in acute liver injury and regeneration induced by carbon tetrachloride. Life Science. 75 (13), 1539-1549 (2004).
- Gordis, E. Lipid metabolites of carbon tetrachloride. Journal of Clinical Investigation. 48 (1), 203-209 (1969).
- Albrecht, J. Cerebral RNA synthesis in experimental hepatogenic encephalopathy. Journal of Neuroscience Research. 6 (4), 553-558 (1981).
- Terblanche, J., Hickman, R. Animal models of fulminant hepatic failure. Digestive Diseases and Sciences. 36 (6), 770-774 (1991).
- Gruenbaum, B. F., et al. Cell-free DNA as a potential marker to predict carbon tetrachloride-induced acute liver injury in rats. Hepatology International. 7 (2), 721-727 (2013).
- Juricek, J., et al. Analytical evaluation of the clinical chemistry analyzer Olympus AU2700 plus. Biochemia Medica. 20 (3), 334-340 (2010).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Wang, T., et al. Protective effects of dehydrocavidine on carbon tetrachloride-induced acute hepatotoxicity in rats. Journal of Ethnopharmacology. 117 (2), 300-308 (2008).
- Ye, X., et al. Hepatoprotective effects of coptidis rhizoma aqueous extract on carbon tetrachloride-induced acute liver hepatotoxicity in rats. Journal of Ethnopharmacology. 124 (1), 130-136 (2009).
- Wills, P. J., Asha, V. V. Protective effect of lygodium flexuosum (L.) sw. extract against carbon tetrachloride-induced acute liver injury in rats. Journal of Ethnopharmacology. 108 (3), 320-326 (2006).
- Senior, J. R. Monitoring for hepatotoxicity: What is the predictive value of liver "function" tests. Clinical Pharmacology & Therapeutics. 85 (3), 331-334 (2009).
- Karmen, A. A note on the spectrometric assay of glutamic-oxalacetic transaminase in human blood serum. Journal of Clinical Investigation. 34 (1), 131-133 (1955).
- Hubner, G. Ultrastructural liver damage caused by direct action of carbon tetrachloride in vivo and in vitro. Virchows Archiv fur Pathologische Anatomie und Physiologie und fur Klinische Medizin. 339 (3), 187-197 (1965).
- Newsome, P. N., Plevris, J. N., Nelson, L. J., Hayes, P. C. Animal models of fulminant hepatic failure: A critical evaluation. Liver Transplantation. 6 (1), 21-31 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon