Method Article
Coltivazione di microalghe verdi in bolla colonna fotobioreattori e un saggio di lipidi neutri
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per costruire su scala di laboratorio bolla colonna fotobioreattori e li usa per cultura microalghe. Esso fornisce inoltre un metodo per la determinazione del tasso di crescita della cultura e del contenuto di lipidi neutri.
Abstract
C'è notevole interesse per lo studio delle microalghe per applicazioni di ingegneria come la produzione di biocarburanti, prodotti di alto valore e per il trattamento dei rifiuti. Come la maggior parte nuovi sforzi di ricerca iniziano a scala di laboratorio, c'è la necessità di metodi economici per la coltura di microalghe in maniera riproducibile. Qui, comunichiamo un approccio efficace alla cultura microalghe in fotobioreattori su scala di laboratorio e per misurare la crescita e il contenuto di lipidi neutri di quello alghe. Anche per istruzioni su come impostare il sistema di fotobioreattore. Anche se gli organismi di esempio sono specie di clorella e Auxenochlorella, questo sistema può essere adattato per coltivare una vasta gamma di microalghe, tra cui co-colture di alghe con specie non-alghe. Colture di riserva prima sono coltivate in bottiglie per la produzione di inoculo per il sistema di fotobioreattore. Inoculo di alghe è concentrato e trasferito in fotobioreattori per la coltivazione in modalità batch. I campioni sono raccolti ogni giorno per le letture di densità ottica. Alla fine della cultura batch, le cellule vengono raccolte da centrifuga, lavata e liofilizzati per ottenere una concentrazione finale di peso a secco. La concentrazione finale di peso a secco viene utilizzata per creare una correlazione tra la densità ottica e la concentrazione di peso a secco. Un metodo modificato di Folch viene successivamente utilizzato per estrarre i lipidi totali dalla biomassa liofilizzata e l'estratto viene analizzato per il suo contenuto di lipidi neutri usando un'analisi di micropiastre. Questo saggio è stato pubblicato in precedenza ma passaggi protocollo sono stati inclusi qui per evidenziare i passaggi critici della procedura cui frequentemente si verificano errori. Il sistema di bioreattore descritto qui riempie una nicchia tra coltivazione semplice boccetta e bioreattori commerciale completamente controllato. Replica anche con solo 3-4 biologico per il trattamento, il nostro approccio alla coltura di alghe porta a strette deviazioni standard nelle analisi del lipido e di crescita.
Introduzione
L'applicazione di microalghe in ingegneria e biotecnologia ha attirato grande interesse negli ultimi anni. Microalghe sono allo studio per l'utilizzo in acque reflue trattamento1,2,3,4, biocarburanti produzione5,6,7,8e la produzione di prodotti nutraceutici e altri prodotti di alto valore9,10. Le alghe sono anche essendo geneticamente modificate al prezzo maggiore nel tentativo di migliorare la propria forma per ingegneria specifiche applicazioni11,12. Di conseguenza, c'è grande interesse nella sperimentazione con organismi industrialmente rilevanti nelle impostazioni controllate. Lo scopo di questo metodo è di comunicare un approccio efficace alla microalghe cultura in un ambiente di laboratorio controllato e per misurare la crescita e il contenuto di lipidi neutri di quello alghe. Migliorando la crescita tariffe e contenuto di lipidi neutri di microalghe sono stati identificati come due principali strozzature verso la commercializzazione dei biocarburanti alghe13.
Una vasta gamma di approcci sono stati utilizzati per le alghe di cultura per scopi sperimentali. In generale, questi approcci possono essere suddivisi tra coltivazione all'aperto su larga scala e su scala ridotta coltivazione indoor. Coltivazione all'aperto in fotobioreattori e stagni aperti è appropriato per la sperimentazione volta a scalare i processi che hanno già dimostrati a scala di laboratorio (ad esempio, per testare scale-up di un nuovo ceppo di alta-lipidico delle alghe)14. Tuttavia, la coltivazione su piccola scala indoor è opportuno durante lo sviluppo di ceppi di alghe nuove o migliorate o effettuando esperimenti volti a comprendere meccanismi biologici. In questi ultimi casi, per prendere in giro i cambiamenti sottili nel comportamento biologico è necessaria un'elevata di controllo sperimentale. A tal fine, colture axeniche sono spesso necessari al fine di ridurre al minimo i fattori biotici complessi connessi con altri organismi (per esempio batteri, altre alghe) che inevitabilmente crescono in grandi impianti all'aperto. Anche quando lo studio di interazioni tra le alghe e altri organismi, abbiamo trovato che uso di condizioni sperimentali altamente controllato è disponibile quando si esaminano scambio molecolare tra organismi15,16,17.
All'interno della categoria di coltivazione su piccola scala coperta di alghe, una gamma di approcci sono stati utilizzati. Forse l'approccio più comune è far crescere alghe in matracci di Erlenmeyer su una tabella di shaker sotto una luce banca18,19. Scambio di ossigeno e CO2 avviene per diffusione passiva attraverso una spina di schiuma nella parte superiore del pallone. Alcuni ricercatori hanno migliorato questo set-up attraverso aerazione attiva delle boccette20. Un altro approccio è quello di coltivare alghe in bottiglie, mixate da ancoretta e aerazione attiva. Nonostante la loro semplicità, abbiamo trovato che l'uso di bottiglie e boccette spesso porta a risultati incoerenti tra repliche biologiche. Presumibilmente questo è dovuto gli effetti di posizione - diverse posizioni ricevono diverse quantità di luce, che riguardano anche le temperature interne del reattore. Rotazione giornaliera dei reattori in nuove posizioni può aiutare ma non risolve il problema perché alcune fasi di crescita delle alghe (per esempio, presto esponenziale) sono più sensibili agli effetti posizionali rispetto ad altri (ad es., fase di log).
Sul lato opposto dello spettro di sofisticazione tecnologica sono completamente controllati commerciale fotobioreattori. Questi sistemi continuamente monitorare e regolare le condizioni nel reattore per ottimizzare la crescita delle alghe. Hanno illuminazione programmabili, controllo della temperatura in tempo reale e controllo del pH. Purtroppo, sono costosi e in genere costano diverse migliaia di dollari al reattore. Più riviste scientifiche e ingegneristiche richiedono la replica biologica dei risultati, rendendo necessario l'acquisto di più bioreattori. Presentiamo qui un sistema di reattore bolla colonna che colma il divario tra la semplice (pallone) e sofisticato (completamente controllato bioreattore) si avvicina per la coltivazione delle alghe su scala di laboratorio. Bolla colonne utilizzare delle bollicine di gas per facilitare lo scambio di gas e mescolare il reattore. Questo approccio fornisce un certo grado di controllo sull'illuminazione e temperatura ma lo fa in un modo che è conveniente. Inoltre, abbiamo trovato questo sistema per produrre risultati altamente coerenti tra replicati biologici, riducendo il numero delle ripetizioni biologici necessari al fine di ottenere risultati statisticamente significativi rispetto all'approccio fiasco o bottiglia. Abbiamo anche utilizzato questo sistema per coltivare con successo miscele di alghe e batteri21. Oltre alla coltivazione delle alghe, descriviamo una procedura per misurare il contenuto di lipidi neutri nelle alghe coltivate. Il metodo di quest'ultimo è stato pubblicato altrove22, ma includiamo la procedura qui per fornire istruzioni dettagliate su come impiegare con successo.
Protocollo
1. installazione di bolla colonna fotobioreattori
- Costruire un set di coperchi ventilati dai coperchi di plastica che è venuto con le bottiglie di vetro 1L e tubi di ibridazione (vedere la Figura 1 per schema e foto). Costruire coperchi per l'umidificatore, trappola, ogni fotobioreattore ascensore aria e ogni bottiglia reattore di miscelazione.
- ¼" fori nel coperchio: 2 fori sono necessari per coperchi bioreattore e umidificatore; 3 fori sono necessari per la trappola di miscelazione.
- Infilare un ¼" o-ring sopra i thread di un raccordo Luer Monte pannello da 1/8", quindi questo nel ¼" foro praticato sul coperchio (Figura 1A).
- Scivolare una seconda ¼" o-ring sopra i thread di modo che il coperchio è inserito tra i due O-ring. Scivolare un dado al thread e stringere per fissare il pannello Monte Luer in posizione.
- Anelli di blocco sulla proiezione esposta di Luer maschio dal coperchio a scatto. Ripetere i passaggi 1.1.2-1.1.4 per ogni foro nel coperchio.
- Per il collegamento di coperchi che verranno utilizzate su reattori di colonna e una bottiglia di bolla, 1/8" femmina Luer per raccordi filettati a 1.5" pezzi di 1/8" tubi in PVC ID. Collegare questi a ciascuno dei raccordi Luer maschi esposti sul coperchio.
- Collegare una valvola di ritegno (direzione opposta il coperchio) all'estremità libera di uno dei 1/8" pezzi.
Nota: Questo servirà come la porta di scarico per il bioreattore. - Collegare un maschio Luer barb raccordo al secondo pezzo di 1/8" tubi sporgenti dal coperchio. La ghiera girevole non scattano in posizione e fissare un filtro aria 0,2 mm a questo.
Nota: Questo servirà come la porta di ingresso per il reattore.
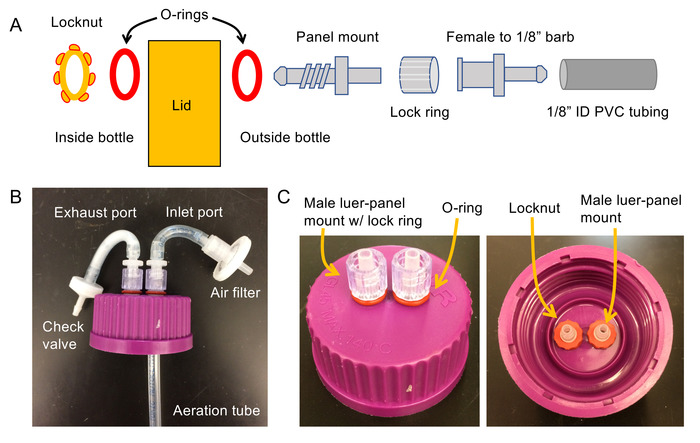
Figura 1. Schema elettrico e foto per la costruzione di bioreattori. (A) schema per la costruzione del bioreattore coperchi (B) foto del coperchio assemblato bioreattore e (C) foto del coperchio assemblato usato per l'umidificatore. Si noti che i raccordi di umidificatore dovrebbero essere rivestiti in silicone resistente all'acqua per garantire una chiusura ermetica con il coperchio. Clicca qui per visualizzare una versione più grande di questa figura.
- Assemblare il sistema di erogazione di aria (Vedi Figura 2A e 2B per un disegno schematico e foto).
- Fissare con filetto 1/8" NPT per raccordi filettati a Monte e a valle sul retro di ogni rotametro.
Nota: 200-2.500 cm3/min rotametri sono per la modulazione della pressione aria a monte dell'umidificatore, 100-1.000 cm3/min rotametri sono per i reattori a bottiglia, 50-500 cm3/min rotametri sono per aria ascensore bioreattori e 5-50 cm3/ rotemeters min sono per regolazione della portata di CO2 . Si raccomanda di Monte rotametri a una superficie fissa (es. foglio di plastica) così non cadono durante il funzionamento. - Spegnere la fonte di aria compressa, quindi collegare ¼" ID PVC tubi flessibili per la sorgente di aria compressa con una fascetta stringitubo. Step-down al diametro del tubo da 1/8" tubi flessibili in PVC ID utilizzando un ¼" femmina per montaggio di barb e un 1/8" maschio al raccordo di barb.
- Collegare l'estremità libera del tubo 1/8" ID verso l'ingresso di un 200-2.500 cm3/min rotametro.
Nota: L'uscita di questo rotametro avrà ad alimentare l'umidificatore via 1/8" ID tubatura. - Collegare il tubazione per un'insenatura ad un coperchio ventilato (uso un Luer femmina per montaggio per effettuare la connessione della sbavatura) 1/8". Quindi collegare un secondo pezzo di 1/8" tubi all'interno del supporto del pannello aderente.
Nota: Questo pezzo appenderà giù nell'umidificatore e aria bolla attraverso l'acqua. - Allegare 1/8" femmina Luer per raccordi a ciascuna estremità di un pezzo di 1/8" ID tubatura della sbavatura e utilizzare questo pezzo per collegare l'uscita dell'umidificatore con l'entrata della trappola miscelazione.
- Allo stesso modo come 1.2.5, collegare l'uscita del regolatore CO2 con una seconda porta sulla trappola miscelazione.
- Costruire un collettore utilizzando 1/8" tubi e 1/8" barb multiporta (Vedi Figura 2 C) aria alimentano le banche rotametro.
Nota: Questi rotametri verranno essere utilizzati per fornire i bioreattori. Evitare la costruzione di più di 6 rotametri in serie. Utilizzare banche parallele di rotametri per espandere il sistema. Assicurarsi che la richiesta di flusso totale per tutti i reattori sia meno di 2.500 cm3/min (o altrimenti sarà necessario un più grande rotametro a monte dell'umidificatore). - Collegare l'uscita (3rd porta) della trappola miscelazione con le banche di nuova costruzione rotametro usando 1/8" a 1/8" femmina a barb Luer e tubo.
- Collegare sufficientemente lungo 1/8" tubi alle prese di ogni rotametro in banca rotametro per fornire l'aria per i bioreattori. Etichettare le estremità del tubo, come pure i rotametri in banca.
- Applicare il silicone impermeabile intorno a tutte le porte su umidificatore e miscelazione trappola coperchi per assicurarsi che siano a tenuta d'aria.
- Fissare con filetto 1/8" NPT per raccordi filettati a Monte e a valle sul retro di ogni rotametro.

Figura 2. Schema elettrico e foto per bolla colonna sistema di montaggio. (A) schema della foto (B) sistema aerazione dell'umidificatore, miscelazione trappola e del rotametro della banca e (C) foto dei collettori utilizzati per collegare insieme le banche rotametro. Clicca qui per visualizzare una versione più grande di questa figura.
- Impostare la pagina di vasche di pesci, mescolare piastre e luci (Figura 3).
Attenzione: Questo sistema richiede un numero elevato di punti vendita e capacità circuito sufficiente a sostenere tutti i componenti. Evitare stringing insieme più prese multiple e prolunghe in una moda catena perché si tratta di un pericolo elettrico. Utilizzo di GFI tipo outlets e strisce di alimentazione è fortemente incoraggiato a causa della presenza di acqua nel sistema.- Organizzare gli agitatori magnetici a basso profilo su una superficie piana che è abbastanza forte per reggere il peso di acquari pieni d'acqua.
- Posto piccolo in legno o plastica blocchi (che sono leggermente più alti rispetto le piastre stir) intorno al perimetro delle piastre mescolare per sostenere il peso delle vasche dei pesci.
Attenzione: Evitare di posizionare i serbatoi di pesce direttamente sulle piastre mescolare come il peso li schiaccerà. - Posizionare i serbatoi di pesce sopra le piastre di mescolare e supporto blocchi e riempire i serbatoi con acqua.
- Tagliare un pezzo di un foglio di plastica rigido per adattarsi sopra il serbatoio di pesce come coperchio. Tagliare fori in questa copertura a scivolare dentro e fuori i tubi di ibridazione. Anche tagliare un buco per il riscaldamento del serbatoio di pesce.
- Organizzare le banche luce fluorescente accanto al serbatoio di pesce per fornire illuminazione orizzontale dei bioreattori. Consente di collegare la banca luce un luce timer per impostare un ciclo giorno/notte.

Figura 3. Sistema schematico per i bioreattori di bottiglia (a sinistra) e la bolla colonna fotobioreattori (a destra). Questa figura è stata modificata da Higgins et al. 17. Clicca qui per visualizzare una versione più grande di questa figura.
2. preparazione dell'inoculo da microalghe
- Ottenere microalghe inoculo da una cultura di crioconservazione, placcata o liquida.
Nota: È consigliabile che gli organismi crioconservati essere placcato prima dell'utilizzo come inoculo per garantire che le cellule sono vitali e che la cultura risultante è axenica. Media dell'agar (ad es., ATCC #5 sporulante agar)21 è un medium ricco che funziona bene per fare rivivere la specie di clorella e Auxenochlorella da cryo-deposito. - Preparare L 2,4 del mezzo minerale che è appropriato per le specie di microalghe particolare.
Nota: Esempi N8 medio23 specie di clorella, N8-NH4 medie21 specie di Auxenochlorella. Uso di un mezzo appropriato per il ceppo di alghe è uno dei più importanti passi verso assicurare la crescita di alghe robusto. - Aliquotare 2,4 L del mezzo minerale equamente in tre bottiglie di vetro di 1 L, aggiungere mescolare bar ad ogni bottiglia e montare i coperchi ventilati (Figura 1) per ogni bottiglia. Controllare che il tubo di aerazione è sul lato di aspirazione e ogni bottiglia ha un ancoretta in esso.
- Sterilizzare le bottiglie stock utilizzando una liquida sterilizzazione ciclo (121 ° C) per 30 min. Autoclave 100 mL di acqua deionizzata (dH2O) e alcune provette da 1,5 mL allo stesso tempo, che verrà successivamente utilizzato per la placcatura. Lasci che il media di fresco durante la notte. In alternativa, raffreddare il reattore a temperatura ambiente e poi aerare per 2 h prima dell'inoculazione.
- In una cappa di biosicurezza (BSC), inoculare microalghe da un piatto o coltura liquido nelle bottiglie stock. Usare una tecnica sterile per mantenere le colture axeniche nei passaggi seguenti.
- Aggiungere 20 mL di autoclavato dH2O a una provetta sterile 50 mL. Utilizzare un'ansa sterile monouso da 10 µ l di raccogliere diverse singole colonie dalla piastra dal punto 2.1. Immergere il ciclo nel tubo 50 mL e lavare le cellule delle alghe in 20 mL di autoclavato dH2O. Agitare la provetta da 50 mL per ottenere una soluzione omogenea microalghe.
- Pipettare 6 mL di soluzione di microalghe in ogni bottiglia di stock con una pipetta sierologica sterile da 10 mL. Agitare il flacone per mescolare in modo uniforme le microalghe nel mezzo.
- Utilizzare una pipetta sierologica sterile mL 2 disegnare ogni campione 1 mL di ciascuna bottiglia stock e trasferire in provette sterili da 1,5 mL.
Nota: Micropipette non sono consigliate per questo passo a causa del rischio di contaminazione. Serrare i coperchi ventilati su bottiglie. - Posizionare le bottiglie d'archivio sulle piastre di mescolare (~ 150 giri/min) e regolare la portata d'aria, CO2e livelli di illuminazione come adatti alla specie. Ruotare la posizione di stock bottiglia ogni giorno.
- Diluire i campioni 1 mL ottenuti durante passaggio 2.6 (100 volte diluizione in acqua sterile di solito funziona bene) e diffondere la piastra su un terreno agar ricco.
Nota: Queste piastre possono essere utilizzate per verificarne eventuali istanze di contaminazione anche come servire come una fonte di inoculo di alghe futuro per ulteriori esperimenti. - Prelevare campioni dalle bottiglie (in BSC) ogni due giorni per controllare la crescita di microalghe.
I campioni in una micropiastra a 96 pozzetti in triplice copia (200 µ l) e misurare la densità ottica (OD) a 550 nm e 680 nm ogni due giorni fino a OD raggiunge 0.2-0.3 (che in genere richiede 5-7 giorni). - Arresti l'incubazione e mettete le bottiglie stock su una panchina per 24-48 h per consentire le cellule delle alghe a stabilirsi per gravità.
Nota: Le cellule depositate utilizzerà successivamente per inoculare la bolla colonna fotobioreattori. Se si desidera una più rapida raccolta delle cellule, le cellule possono essere centrifugate a non più di 1.000 x g per raccogliere le cellule.
3. la coltivazione di microalghe in bolla colonna fotobioreattori
- Il giorno prima dell'inoculazione di bioreattore, preparare i supporti appropriati e trasferimento 200 mL (o volume desiderato) per la bolla colonna fotobioreattore tubi (tubi di ibridazione). Tubi di autoclave con supporti e coperchi ventilati in luogo.
Nota: Se l'uso delle acque reflue come mezzo di crescita, autoclave il vuoto bioreattori e aggiungere sterile filtrata delle acque reflue (volendo coltura axenica). - Concentrare il brodo di microalghe depositata rimuovendo il supernatante utilizzando una pompa a vuoto. Lasciare meno di 100 mL di terreno in ogni bottiglia, ma evitare la rimozione di alghe depositate.
Nota: Eseguire questa procedura all'interno di un BSC e seguire una tecnica sterile. Un semplice vuoto dell'apparato può essere costruito utilizzando un termos o bottiglia. Montare una pipetta sterile sierologica sull'estremità del tubo. - Sospendere e trasferire i residui di alghe per provette da centrifuga sterile 50 mL. Centrifugare a 1.000 x g per 5 min concentrare ulteriormente le alghe.
- In BSC, rimuovere abbastanza surnatante per raggiungere un volume totale di ~ 80 mL di concentrati di alghe per 12 photobioreacters. Evitare di aspirare il pellet. Trasferire il concentrato di alghe in un contenitore sterile (o la bottiglia di stock di alghe usate).
- Aggiungere 6 mL di liquami di alghe in ogni fotobioreattore con una pipetta sierologica sterile da 10 mL.
- Sterile (filtro 0,2 mm siringa o vuoto) e aggiungere la quantità appropriata di eventuali altri composti (ad esempio stocks vitamina) che non possono essere sterilizzati in autoclave.
- Turbinio di bioreattori per mescolare le alghe nel mezzo.
- Disegnare un campione di 2 mL da ogni bioreattore utilizzando una pipetta sierologica e trasferirlo in una provetta da 2 mL. Raccogliere un campione di 2 mL (in una BSC) ogni 24 h per monitorare i progressi di cultura. Controllare il campione per l'utilizzo di pH strisce reattive e regolare il reattore, se necessario con entrambi 3 NaOH M o 3 M HCl.
- Avvitare i coperchi di bioreattore e posizionare tutti i bioreattori nel bagno di acqua del serbatoio di pesce. Regolare l'aerazione, CO2e l'illuminazione al livello appropriato per la specie. Ruotare la posizione di bioreattore ogni giorno dopo il campionamento (punto 3.8).
- Applicare 200 µ l di ciascun campione di cultura in triplice copia dei pozzetti di una micropiastra a 96 ben. Misurare la densità ottica (OD) a 550 nm e 680 nm.
- L'ultimo giorno del periodo di cultura, misurare OD in fattori di diluizione diversa (ad es., un 1x, 2x, 4x, 8x, 16x e 32x) per stabilire una correlazione tra il diametro esterno e il peso secco reale dopo la raccolta (passaggio 4).
- Centrifugare la provetta 2 mL a 12.000 x g per 5 min.
- Filtrare il surnatante 0,2 µm non sterile siringa filtro e conservare il surnatante (e pellet se necessario) non superiore a-20 ° C per la conservazione a lungo termine e successive analisi dei cambiamenti nella composizione media.
4. raccogliere e liofilizzazione di biomassa microalgale
- Misurare un volume fisso di coltura di alghe da ogni bioreattore con un cilindro graduato (ad es., 160 mL da un bioreattore che originariamente contenuti 200 mL di terreno) e trasferire nelle bottiglie di centrifuga. Sciacquare il cilindro graduato con dH2O tra ogni misurazione.
- Centrifuga a 4.696 x g per 5 min, scartare il surnatante da con cautela un aspirapolvere fuori.
- Trasferire il pellet con etichetta 50 mL provette. Sciacquare le bottiglie di centrifuga con dH2O e contenuto di trasferimento per le provette da 50 mL. Il volume totale tubo non superi 45 mL.
- Lavare il pellet di alghe con dH2O rimuovere sali.
- Centrifugare le provette da 50 mL a 4.696 x g per 5 min e scartare il surnatante.
- Aggiungere mL 40 dH2O ad ogni provetta 50 mL; vortice di mescolare. Centrifugare nuovamente a 4.696 x g per 5 min ed eliminare il surnatante.
- Ripetere il passaggio 4.4.2.
- Etichettare e pesare di provette da centrifuga vuoto 15 mL su un equilibrio 4-decimale (etichetta sia il coperchio e tubo e pesare insieme). Pesare una provetta per coltura di alghe. Pesare ogni provetta da 15 mL due volte per minimizzare l'errore.
- Dopo l'ultimo lavaggio, scartare il surnatante e aggiungere 7,5 mL di dH2O ad ogni provetta da 50 mL. Vortice e trasferimento tubi i fanghi di alghe in pre-pesati 15 mL. Sciacquare le provette da 50 mL con ulteriori dH2O e trasferire le provette da 15 mL di liquido. Evitare di superare 12 mL di volume totale nelle provette da 15 mL.
- Centrifugare le provette da 15 mL a 4.696 x g per 5 min e decantare il supernatante. Congelare le provette con pellet a-80 ° C per almeno 30 min in preparazione per liofilizzazione.
- Congelamento a secco durante la notte o fino a quando essiccato.
- Pesare e registrare le provette da 15 mL liofilizzati con alghe.
5. lipidi estrazione utilizzando un metodo per volta Folch24
- Pesare 20 mg di liofilizzato biomassa algale in una provetta da 2 mL tappo a vite in polipropilene (controlli l'etichetta del produttore per garantire il prodotto è adatto per le estrazioni della perla).
- Aggiungere 1,5 mL di solvente Folch (2:1 cloroformio/metanolo) ad ogni provetta 2 mL (che contiene 20 mg di alghe liofilizzate). Versare ~0.5 perle di zirconia/silice mL (0,5 mm) in ogni provetta, fino a quando non raggiunge il livello del liquido nella provetta 2 mL.
Attenzione: Maneggiare cloroformio e metanolo in una cappa ed evitare di respirare vapori o contatto con la pelle. - Omogeneizzare i campioni di alghe in un laminatoio del branello per 20 s ad una velocità di tubi di trasferimento 6,5 m/s. in ghiaccio per 30 s per raffreddare i campioni. Ripetere cinque volte per estrarre completamente i lipidi.
- Filtrare l'omogenato attraverso una siringa da 5 mL contenente un disco di maglia di filo di acciaio (n. 60 maglia) al ceppo fuori le perline, raccogliere il filtrato in una provetta da 15 mL.
- Lavare le perle con 1,5 mL di solvente Folch, spingendo il liquido attraverso con la siringa come necessario. Ripetere questo lavaggio due volte e raccogliere tutti i filtrato nel tubo da 15 mL, ottenendo un volume finale di circa 6 mL.
- Aggiungere 1,2 mL di 0,9% NaCl soluzione all'Estratto di Folch nel tubo da 15 mL (w/v) e vortex per mescolare bene.
Nota: Se necessario, più Folch solvente può essere utilizzato per lavare Perline (uso 0,2 x il lavaggio totale volume di soluzione di NaCl 0,9% per indurre la separazione di fase). - Centrifugare le provette da 15 mL a 6.000 x g per 5 min Record il volume di fase (verde) del cloroformio di fondo per l'approssimazione di 0,1 mL utilizzando linee sul lato del tubo da 15 mL. Trasferire la fase di fondo per un flaconcino di vetro (con coperchio) usando un pipetta Pasteur di vetro.
- Memorizzare il lipide a-20 ° C o (-80 ° C se si prevede di utilizzare questo estratto per analisi dell'acido grasso).
6. neutrale del lipido analisi utilizzando un metodo di Microplate (adattato da Higgins et al 201422)
- Preparare soluzioni di riserva. Predisporre 10ml 1mg/mL olio vegetale standard in cloroformio e conservare a-20 ° C.
Nota: Qualsiasi olio vegetale può essere usato per questo test perché non è sensibile ai tipi di acidi grassi. Preparare 10 mL della soluzione di Nilo rosso in dimetilsolfossido (DMSO) 200 µ g/mL e conservare al buio a temperatura ambiente. - Blocco di pre-calore asciutto micropiastra a 55 ° C in una cappa aspirante. Mentre questo è il riscaldamento, diluire l'estratti del lipido e olio vegetale standard 3 volte con metanolo.
Nota: Questa diluizione può essere modificata in base al contenuto di lipidi delle alghe, ma questo livello funziona bene per la maggior parte clorella. - Per ciascun campione diluito, aggiungere 80 µ l di una micropiastra 96 ben in polipropilene in quadruplice copia.
Attenzione: Uso di polistirene plasticware è consigliabile per l'utilizzo con solventi organici. - Per il solvente in bianco, applicare 80 µ l di 2:1 Metanolo/Cloroformio in quadruplice copia. Per gli standard, aggiungere 10, 30, 60, 90 e 120 µ l di olio vegetale diluito standard in quadruplice copia.
- Posto la micropiastra in un asciutto blocco riscaldatore a 55 ° C per 20-30 minuti fino a quando tutti i solvente è evaporato. Mentre il solvente evapora, preparare il lavoro soluzione Nilo rosso (necessità 200 µ l di soluzione di 1 µ g/ml per piastra ben). Ad esempio, dodici campioni e un insieme completo di norme richiede 16 mL 1,0 µ g/mL di soluzione; preparate sciogliendo 80 µ l dello stock di 200 µ g/mL (in DMSO) in 16 mL dH2O.
- Rimuovere la micropiastra dal blocco riscaldante e lasciate raffreddare a temperatura ambiente. Aggiungere 30 µ l di alcool isopropilico in ciascun pozzetto e Miscelare pipettando su e giù. Garantire tutti i canali di pipetta sono la soluzione di miscelazione e risospendere i lipidi, producendo un liquido verde omogeneo.
- Aggiungere 200 µ l di soluzione di rosso del Nilo (1 µ g/mL) a ciascun pozzetto, pipettare su/giù 10 volte per mescolare. Incubare la piastra per 5 min a temperatura ambiente. Durante l'attesa, preparare una soluzione di candeggina al 50% con candeggina (ipoclorito di 6%) con dH sono necessari2O. 20 µ l per pozzetto. Preparazione di 3 mL di candeggina al 50% è sufficiente per 12 campioni e un insieme completo di norme.
- Aggiungere 20 µ l di soluzione di candeggina per ogni micropiastra bene e pipettare su e giù per 5 volte per mescolare bene. Incubare 30 min a temperatura ambiente.
- Dopo 30 min, leggere fluorescenza nei campioni ogni 5-10min a 530 nm eccitazione/575 nm di emissione con taglio automatico impostato a 570 nm fino a quando non si stabilizza il segnale dai campioni di alghe. In genere, 60 min di incubazione totale è sufficiente.
- Creare una curva di calibrazione per gli standard di olio vegetale (nella gamma di 0-40 ng/pozzo di petrolio).
Nota: Una lineare adatta funziona bene per basso (< 30 ng/pozzetto) concentrazioni di olio e un polinomio in forma possono essere utilizzati se il livello supera 30 ng/pozzetto. Utilizzare questa correlazione per quantificare i lipidi neutri in pozzetti.
Risultati
Questa procedura produce un corso di tempo dei dati di densità ottica algali a OD 550 nm (Figura 4A). La densità ottica e il peso a secco la concentrazione di dati possono essere correlata (Figura 4B). Questa operazione viene eseguita dal primo calcolo della concentrazione di alghe di peso secco finale dopo il passaggio di liofilizzazione. Successivamente, la densità ottica della diluizione seriale di cultura (eseguita l'ultimo giorno di campionamento) e le concentrazioni di effettivo peso a secco possa essere correlata. Concentrazioni di bassa delle cellule, una correlazione lineare può essere utilizzata mentre per concentrazioni più elevate di cella, è possibile utilizzare una seconda correlazione polinomiale di ordine. È consigliabile creare una correlazione separata per ogni condizione di cultura. Infine, la correlazione può essere applicata ai dati di densità ottica del corso di tempo per ottenere una curva di crescita di peso a secco (Figura 4). In questo esperimento di esempio, Auxenochlorella protothecoides (2341 UTEX25) è stato coltivato in quattro condizioni: colture axeniche controllo cresciute su fresco N8-NH4 medie21, in co-coltura con i batteri Azospirillum brasilense, in mezzo completati con 50 mg/L di acido indolo-3-acetico e speso in media da a. brasilense. A. brasilense è conosciuto per produrre acido indolo-3-acetico, ormone, che favorisce anche la crescita in alcune microalghe di promuovere una crescita delle piante. Tuttavia, a 50 mg/L, il trattamento di IAA completamente inibito la crescita di a. protothecoides . Di conseguenza, dati di densità ottica erano disponibili, ma la quantità di alghe era insufficiente per ottenere una concentrazione di preciso peso a secco. In questo caso, la correlazione per la coltura di controllo può essere applicata o densità ottica dati potrebbero essere segnalati direttamente. Perché OD dati sono stati raccolti a entrambi 550 nm e 680 nm assorbanza, entrambi dataset può essere utilizzato per la correlazione tra OD e peso a secco. In genere, OD 550 viene utilizzato perché esclude quasi completamente la capacità di assorbimento della clorofilla26, così sopprimendo bias da cambiamenti nel contenuto di clorofilla. Al contrario, OD 680 include la capacità di assorbimento della clorofilla e alti rapporti di OD 680/550 indicano il contenuto di clorofilla alta nelle alghe. Figura 4 Mostra un insieme di dodici colture di alghe crescono nella bolla colonna fotobioreattori. Anche con solo tre replicati biologici per il trattamento, sono stati raggiunti strette deviazioni standard, permettendo ad alta sensibilità alle differenze fra i trattamenti.
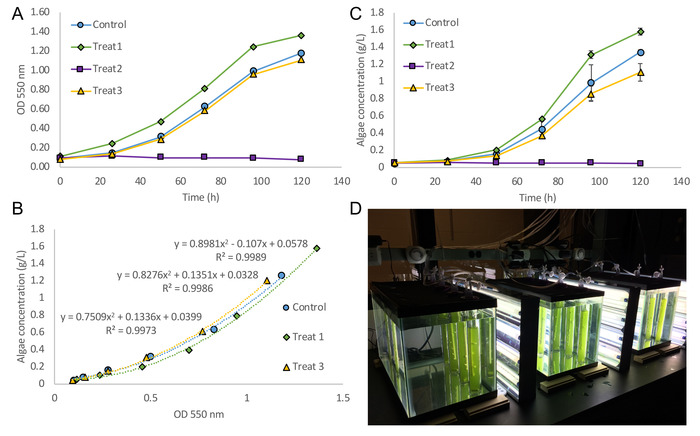
Figura 4. Crescita di alghe si traduce in bolla colonna fotobioreattori. (A), la densità ottica (550 nm) curva di crescita di Auxenochlorella protothecoides (UTEX 2341) Mostra culture entrare tardiva crescita logaritmica a 120 ore. Colture di controllo sono state coltivate su terreno di nuovo N8-NH4 , trattamento 1 è co-culture di a. protothecoides e Azospirillum brasilense coltivato su terreno di nuovo N8-NH4 , trattamento 2 è axenica a. protothecoides coltivate su N8-NH4 medium completato con 50 mg/L di acido indolo-3-acetico (IAA) e trattamento 3 è axenica a. protothecoides coltivate su medio speso da a. brasilense. Il mezzo ha trascorso è stato preparato da coltura a. brasilense per 96 ore su N8-NH4 medio completati con 2 g/L di acido malico. Le cellule sono state rimosse e il mezzo è stato ri-completato con ammonio per ripristinare il suo livello iniziale, pH è stato regolato e questo mezzo era sterile filtrata (0,2 μm). Si noti che il trattamento di 50 mg/L IAA completamente ha inibito la crescita di alghe. (B) correlazione curve tra OD 550 nm e concentrazione di peso secco finale utilizzando un secondo ordine polinomiale adatta. Nessuna correlazione è visualizzata per trattamento 2 perché non alghe potrebbero essere raccolte alla fine del periodo di cultura. (C) applicazione della correlazione polinomiale per i dati di densità ottica fornisce una curva di crescita con concentrazione di peso a secco sull'asse y. La correlazione di cultura di controllo è stata applicata ai dati OD per trattamento 2. Barre di errore sono deviazioni standard basate su 3 biologici replica. (D) foto della bolla colonna fotobioreattori poco dopo inoculazione di cultura. Clicca qui per visualizzare una versione più grande di questa figura.
Dati di lipido neutro sono indicati per due esperimenti di esempio nella Figura 5. Questo test ha dimostrato di correlano bene con contenuto di lipidi neutri, in particolare triacyglycerol (TAG) contenuto. Questo può essere visto confrontando il dosaggio dei lipidi neutri (Figura 5A) per un piatto di cromatografia di strato sottile corrispondente (figura 5B). La stessa tendenza può essere visto nel secondo esperimento (Figura 5 e 5D). In tutti questi esperimenti, olio di canola è stato utilizzato come standard e provocato una correlazione lineare (R2 di 0,98 per il primo esperimento e 0,99 per il secondo) tra fluorescenza e la massa di olio di canola nel pozzo. Si noti che se tutti i campioni hanno contenuto lipidico basso, quindi il punto più alto o due sullo standard possono essere eliminate. Questa correlazione può essere utilizzata per calcolare la quantità di lipidi neutri (µ g) in ciascuno dei pozzetti alghe. L'olio di massa può essere convertita ad una concentrazione nell'estratto lipidico applicato bene la micropiastra. Questo valore viene moltiplicato per il fattore di diluizione utilizzato (ad es., 3 x) per ottenere il contenuto di lipidi neutri dell'originale Folch estratti. Questa concentrazione è poi moltiplicata per il volume dell'estratto (dovrebbe essere vicino a 4 mL) e poi diviso per la massa totale di biomassa di alghe utilizzata per l'estrazione dei lipidi (dovrebbe essere vicino a 20 mg). Il risultato è il contenuto di lipidi neutri di microalghe.

Nella figura 5. Lipidi neutri dati ottenuti da colture di clorella sorokiniana (UTEX 2714). Contenuto di lipidi neutri (A) (% peso secco) per le alghe in esperimento 1 in cui le alghe sono state coltivate per 120 ore. La cultura di controllo era axeniche e coltivate su fresco N8 media23, trattamento 1 era una co-coltura di c. sorokiniana e a. brasilense su terreno nuovo N8, trattamento 2 era fresco N8 supplementato con 50 mg/L IAA e trattamento 3 è stato speso mezzo da a. brasilense. Il mezzo ha trascorso era preparato di coltura a. brasilense per 96 ore in N8 supplementato con 2 g/L di acido malico, la rimozione delle cellule, che integra perso nitrato, regolazione pH e sterile di filtraggio il mezzo (0,2 μm). A differenza di a. protothecoides, 50 mg/L di IAA non ha inibito la crescita di c. sorokiniana . (B), TLC immagine piastra per abbondanza di esperimento 1 visualizzati relativa TAG. Contenuto di lipidi neutri (C) (% peso secco) per le alghe nell'esperimento 2, che aveva gli stessi trattamenti come esperimento 1 ma le cellule sono state raccolte dopo 72 ore di crescita. (D), TLC immagine piastra per abbondanza di esperimento 2 visualizzati relativa TAG. Barre di errore sono deviazioni standard basate su 3 biologici replica. Clicca qui per visualizzare una versione più grande di questa figura.
Inoltre, è buona pratica per calcolare il coefficiente di variazione (deviazione standard divisa per la media) delle letture fluorescenza crudo attraverso tutti i replicati tecnici nell'analisi dei lipidi neutri. Supponendo che replicati tecnici sono stati effettuati nella micropiastra in quadruplice copia come indicato nella procedura, il coefficiente di variazione in genere non dovrebbe superare 10%. Elevati coefficienti di variazione sono solitamente il risultato di scarsa miscelazione (in particolare durante l'aggiunta di alcol isopropilico) e utilizzo potenzialmente improprio della pipetta multicanale.
Discussione
La considerazione più importante quando la coltura di alghe è la comprensione delle esigenze specifiche dell'organismo o del gruppo di organismi. Il sistema di coltivazione qui descritto può essere utilizzato per una vasta gamma di alghe ma gli specifici fattori abiotici (temperatura, media, pH, intensità luminosa, livello di CO2 , tasso di aerazione) della coltura di alghe devono essere adattati alle esigenze dell'organismo. Nota i parametri descritti qui sono stati utilizzati per la coltivazione di clorella e Auxenochlorella. Questi organismi sono di interesse industriale perché sono tolleranti ad alto nutrienti, luce e temperatura livelli27. Tuttavia, i livelli di luce possono essere ridotto attraverso la rimozione delle lampadine fluorescenti e il ciclo giorno/notte può essere registrato per rappresentare la stagionalità. Allo stesso modo, i riscaldatori di acqua possono essere attivati su o giù per controllo della temperatura del bagno di acqua nel sistema. Mentre il sistema qui descritto non impiegare tale caratteristica, è possibile rilassarsi le Terme di acqua serbatoio di pesce sotto temperatura ambiente mediante un sistema di raffreddamento di basso costo. Luogo un secchio d'acqua in un piccolo frigorifero e utilizzare un acqua di pompa a velocità variabile dal secchio con acqua freddo per il serbatoio di pesce e viceversa. Il più veloce tasso di pompaggio, diventerà tanto più freddo il serbatoio di serbatoio di pesce.
Anche se il sistema di coltivazione di alghe fornisce in genere risultati coerenti, ci sono alcuni aspetti importanti da considerare. Il primo è acqua sifonamento che si verifica nel caso che il sistema di aerazione si verifica una perdita improvvisa di pressione (ad es., un montaggio soffiato o un malfunzionamento del compressore di aria). Pressione che è negli umidificatori spingerà l'acqua umidificatore all'indietro attraverso il tubo, anche attraverso il rotametro. L'installazione di una trappola a Monte o il disconnettore può aiutare. Si noti che la sifonamento inciderà i bioreattori stessi non perché essi operano a pressione atmosferica. Ispezione di routine delle tubazioni e raccordi può contribuire ad alleviare gli errori di sistema. Un'altra considerazione importante è ordinariamente ispezionare e sostituire filtri aria e valvole di ritegno nei bioreattori. Assicurarsi di seguire le raccomandazioni del produttore per il numero di cicli di autoclave ammissibile. Ciò è particolarmente importante se la manutenzione delle colture axeniche è fondamentale per l'esperimento. Infine, si consiglia di acquistare o costruire un rack autoclavabile per il trasporto sicuro dei bioreattori tra i bagni d'acqua, autoclave e di biosicurezza. Una rastrelliera in acciaio inossidabile può servire a questo scopo.
Il sistema di bioreattore descritto qui ha diversi limiti. Una limitazione fondamentale è la necessità di gestire i reattori in un armadio di sicurezza biologica utilizzando una tecnica sterile. I reattori mancano una porta di campionatura anti-sifonamento, richiedendo all'utente di spostare il reattore in una cappa di biosicurezza per esempio senza contaminare la cultura. I reattori richiedono anche lettura pH manuale e regolazione che introduce la possibilità di errore umano.
Il sistema di bioreattore descritto qui riempie una nicchia tra coltivazione semplice boccetta e bioreattori completamente controllato. Il sistema di bioreattore è stato sviluppato in risposta ad un bisogno di risultati più consistenti di quanto fossero realizzabili utilizzando bottiglie. I dati mostrano che questo sistema genera risultati di crescita coerente quando si opera in modo appropriato. Si noti che aerate bottiglie sono state impiegate nella procedura per la coltivazione di stock di alghe, ma questo è stato fatto solo per la produzione di inoculo per l'esperimento. Questo è accettabile perché stock bottiglie sono state riunite per inoculazione e quindi la variabilità tra reattori non è un problema.
Come molti ricercatori di alghe sono interessati a controllare il contenuto di lipidi neutri sia la crescita, abbiamo incluso il nostro approccio alla misurazione di entrambi questi parametri qui. Uso della densità ottica per misurare la crescita è una pratica standard e non ha eguali nella sua semplicità. Tuttavia, le correlazioni tra peso secco e densità ottica cambiano nel tempo e dipendono dalle condizioni di coltura. Si raccomanda di produrre un'equazione di correlazione per ogni trattamento sperimentale all'interno di ogni lotto sperimentale. Questo è possibile nella procedura proposta perché liofilizzati alghe saranno ottenute dopo ogni esperimento di cultura. Un presupposto fondamentale dell'approccio densità ottica è che la correlazione tra la densità ottica e peso secco tiene costante nel corso della crescita di batch. Fintanto che le deviazioni da questo presupposto sono piccole, il risultato sarà ragionevolmente accurato. La precisione relativa può essere valutata confrontando la concentrazione del peso a secco di alghe calcolato al tempo zero. Supponendo che le colture erano ben miscelati e pipettaggio era preciso, che tutte le culture dovrebbero avere la stessa densità di inoculo iniziale. L'approccio di densità ottica può essere contestata anche quando dell'assorbanza di fondo del mezzo è alta (cioè, quando si lavora con determinate acque reflue). Sottrazione dell'assorbanza media (prima dell'inoculo) da ogni lettura OD può aiutare con questo problema.
Estrazione dei lipidi dalle alghe secche segue l'ormai consolidata Folch approccio21,24; Tuttavia, ci sono considerazioni importanti. Specie di alghe differenti hanno diverse pareti della cellula con vari gradi di durezza. Le perle di zirconia/silice usate qui sono taglienti e sono progettate per perforare forte, polisaccaride pareti cellulari. Un tipo di perlina più morbida (ad esempio, vetro) o meno cicli di rottura del tallone possono essere utilizzati sulle alghe con pareti cellulari più deboli. Tuttavia, una regola empirica è che il pellet cellulare risultante dopo l'estrazione deve essere privi di pigmento, che indica che è stata estratta la clorofilla tutti. Una delle fonti più comuni di errore durante la fase di estrazione dei lipidi si verifica a causa di improprio liofilizzazione. Se il campione si scioglie nel Congelamento essiccatore prima che sia completamente asciutto, il risultato sarà una pallina molto dura, scura, pruinosa. Questo è il risultato delle cellule lisate in condizioni di vuoto del blocco dell'essiccatore. Il pellet può essere pesato per ottenere un peso a secco, ma non può essere utilizzato per l'estrazione dei lipidi, come le particelle cerose non abbattere nel Folch solvente. Per garantire che liofilizzazione sempre rendimenti campioni morbido, polverosa, è essenziale per congelare tutti i campioni a-80 ° C e trasferirli tempestivamente il congelamento essiccatore. Inoltre, utilizzando parafilm (con un buco infilò in esso) piuttosto che tubo allentato coperchi farà in modo che l'umidità può essere rimosso continuamente dal campione prima che si scioglie.
Il dosaggio dei lipidi neutri descritto in questa procedura è stato pubblicato in precedenza e include una discussione di lipidi alternativi saggi22. Tuttavia, alcuni importanti miglioramenti apportati a tale procedura dalla pubblicazione. In particolare, la concentrazione della soluzione rosso del Nilo è stata aumentata da 0,5 µ g/mL a 1 µ g/mL. L'effetto di questo cambiamento era più alta intensità del segnale, una migliore ripetibilità e l'eliminazione del segnale declino nel tempo durante il periodo di incubazione. I risultati mostrano che il test confronta bene ai risultati da cromatografia su strato sottile qualitativa. Questo test è stato sviluppato e convalidato utilizzando varie specie di clorella e Auxenochlorella così non è stato determinato l'applicabilità alla specie di composizione significativamente differente. Tutto il pigmento verde deve essere completamente rimosso del dosaggio durante l'incubazione di candeggina, che conduce ai campioni che sono di colore giallo chiaro o molto pallido. Si noti inoltre che gli estratti dei lipidi che sono degradati (come indicato da un cambiamento da verde a colore marrone) in genere non riescono a fornire risultati accurati in questo test. È dunque assolutamente necessario conservare i campioni di lipidi non superiore a-20 ° C al buio.
I metodi qui presentati per la coltura di alghe, crescita di misurazione e quantificazione dei lipidi neutri sono utili per una varietà di applicazioni di ingegneria di alghe, ma sono particolarmente adatti per la ricerca sulla produzione di biocarburanti. Questi metodi sono anche utilizzati per studiare l'inibizione della crescita algale su acque reflue28 , nonché gli effetti di interazione organismo sulla crescita e composizione di microalghe.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Il supporto per questa ricerca è stato fornito dallo USDA National Institute of Food e agricoltura Hatch progetto ALA0HIGGINS e gli uffici di Università Auburn del Prevosto, il Vice Presidente per la ricerca e la Samuel Ginn College di ingegneria. Supporto è stato fornito anche da NSF concedere CBET-1438211.
Materiali
| Name | Company | Catalog Number | Comments |
| Supplies for airlift photobioreactor setup | |||
| 1 L Pyrex bottles | Corning | 16157-191 | For bottle reactors, humidifiers |
| 1/2" hose clamp | Home Depot | UC953A | or equivalent |
| 1/4" female luer to barb | Nordson biomedical | Nordson FTLL360-6005 | 1/4" ID, PP |
| 1/4" ID, 3/8" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-244 | 50' |
| 1/4" in O-rings | Grainger | 1REC5 | #010 Medium Hard Silicone O-Ring, 0.239" I.D., 0.379"O.D. |
| 1/8" Female luer to barb | Nordson biomedical | FTLL230-6005 | |
| 1/8" ID, 1/4" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-608 | 250' |
| 1/8" male spinning luer to barb | Nordson biomedical | MLRL013-6005 | |
| 1/8" multiport barb | Nordson biomedical | 4PLL230-6005 | 1/8" multiport barb |
| 1/8" NPT to barb | Nordson biomedical | 18230-6005 | 1/8" 200 series barb |
| 1/8" panel mount luer | Nordson biomedical | Nordson MLRLB230-6005 | 1/8", PP |
| 10 gallon fish tank | Walmart | 802262 | Can hold up to 8 bioreactors depending on layout |
| 100-1000 ccm flow meter | Dwyer | RMA-13-SSV | For bottle reactors |
| 2 ft fluorescent light bank | Agrobrite | FLT24 T5 | |
| 200-2500 ccm flow meter | Dwyer | RMA-14-SSV | For air regulation upstream of humidifier |
| 250 mL Pyrex bottles | Corning | 16157-136 | For gas mixing after humidifier |
| 50-500 ccm flow meter | Dwyer | RMA-12-SSV | For hybridization tube reactors |
| 5-50 ccm flow meter | Dwyer | RMA-151-SSV | For CO2 flow rate control |
| Air filters 0.2 µm | Whatman/ Fisher | 09-745-1A | Polyvent, 28 mm, 0.2 µm, PTFE, 50 pack |
| Check valves | VWR | 89094-714 | |
| Corning lids for pyrex bottles | VWR | 89000-233 | 10 GL45 lids |
| Female luer endcap | Nordson biomedical | Nordson FTLLP-6005 | Female stable PP |
| Hybridization tubes | Corning | 32645-030 | 35x300 mm, pack of 2 |
| Light timer | Walmart | 556393626 | |
| Locknuts | Nordson biomedical | Nordson LNS-3 | 1/4", red nylon |
| Low profile magnetic stirrer | VWR | 10153-690 | Low profile magnetic stirrer |
| Male luer endcap | Nordson biomedical | Nordson LP4-6005 | Male plug PP |
| Spinning luer lock ring | Nordson biomedical | Nordson FSLLR-6005 | |
| Stir bars - long | VWR | 58949-040 | 38.1 mm, for bottle reactors |
| Stir bars - medium | VWR | 58949-034 | 25 mm, for hyridization tubes |
| Supplies and reagents for culturing algae | |||
| 0.2 µm filters | VWR | 28145-491 | 13 mm, PTFE, for filtering spent media from daily culture sampling |
| 1 mL syringes | Air-tite | 89215-216 | For filtering spent media from daily culture sampling |
| 1.5 mL tubes | VWR | 87003-294 | Sterile (or equivalent) |
| 10 mL Serological pipettes | Greiner Bio-One | 82050-482 | Sterile (or equivalent) |
| 100 mm plates | VWR | 25384-342 | 100x15 mm stackable petri dishes, sterile |
| 15 mL tubes | Greiner Bio-One | 82050-276 | Sterile (or equivalent), polypropylene |
| 2 mL Serological pipette tips | Greiner Bio-One | 82051-584 | Sterile (or equivalent) |
| 2 mL tubes | VWR | 87003-298 | Sterile (or equivalent) |
| 50 mL tubes | Greiner Bio-One | 82050-348 | Sterile (or equivalent), polypropylene |
| 96 well microplate | Greiner Bio-One | 89089-578 | Polystyrene with lid, flat bottom |
| Inocculating loops | VWR | 80094-478 | Sterile (or equivalent) |
| Liquid carbon dioxide tank and regulator | Airgas | CD-50 | |
| Supplies and reagents for lipid extraction and neutral lipid assay | |||
| 2 mL bead tubes | VWR | 10158-556 | Polypropylene tube w/ lid |
| 96 well microplates | Greiner Bio-One | 82050-774 | Polypropylene, flat bottom |
| Bleach | Walmart | 550646751 | Only use regular bleach, not cleaning bleach |
| Chloroform | BDH | BDH1109-4LG | |
| Dimethyl sulfoxide | BDH | BDH1115-1LP | |
| Isopropyl alcohol | BDH | BDH1133-1LP | |
| Methanol | BDH | BDH20864.400 | |
| Nile red | VWR | TCN0659-5G | |
| Pasteur pipette tips | VWR | 14673-010 | |
| Sodium chloride | BDH | BDH9286-500G | |
| Vegetable oil | Walmart | 9276383 | Any vegetable oil should work as long as it is fresh |
| Zirconia/ silica beads (0.5 mm diameter) | Biospec products | 11079105z | |
| Equipment | |||
| Analytical balance | Mettler-Toledo | XS205DU | Capable of at least 4 decimal accuracy |
| Bead homogenizer | Omni | 19-040E | |
| Benchtop micro centrifuge | Thermo | Heraeus Fresco 21 with 24x2 | Including rotor capable of handling 1.5 and 2 mL tubes |
| Dry block heater | VWR | 75838-282 | Including dry block for a microplate |
| Freeze dryer | Labconco | 7670520 | 2.5L freeze drying system |
| Large benchtop centrifuge | Thermo | Heraeus Megafuge 16R Tissue | Including rotors capable of handling 400 mL bottles, 50 mL tubes, and 15 mL tubes |
| Microplate reader | Molecular Devices | SpectraMax M2 | Capable of reading absorbance and fluorescence |
| Vortex mixer | VWR | 10153-838 |
Riferimenti
- Prandini, J. M., et al. Enhancement of nutrient removal from swine wastewater digestate coupled to biogas purification by microalgae Scenedesmus spp. Bioresource Technology. , 67-75 (2016).
- Liu, C., et al. Phycoremediation of dairy and winery wastewater using Diplosphaera sp. MM1. Journal of Applied Phycology. 28 (6), 3331-3341 (2016).
- Passero, M., Cragin, B., Coats, E. R., McDonald, A. G., Feris, K. Dairy Wastewaters for Algae Cultivation, Polyhydroxyalkanote Reactor Effluent Versus Anaerobic Digester Effluent. BioEnergy Research. 8 (4), 1647-1660 (2015).
- Hodgskiss, L. H., Nagy, J., Barnhart, E. P., Cunningham, A. B., Fields, M. W. Cultivation of a native alga for biomass and biofuel accumulation in coal bed methane production water. Algal Research. 19, 63-68 (2016).
- Gao, C., et al. Oil accumulation mechanisms of the oleaginous microalga Chlorella protothecoides revealed through its genome, transcriptomes, and proteomes. BMC Genomics. 15, (2014).
- Burch, A. R., Franz, A. K. Combined nitrogen limitation and hydrogen peroxide treatment enhances neutral lipid accumulation in the marine diatom Phaeodactylum tricornutum. Bioresource Technology. 219, 559-565 (2016).
- Brennan, L., Owende, P. Biofuels from microalgae--A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable Sustainable Energy Reviews. 14 (2), 557-577 (2009).
- Branyikova, I., et al. Microalgae - Novel highly efficient starch producers. Biotechnology and Bioengineering. 108 (4), 766-776 (2010).
- Chalima, A., et al. Utilization of Volatile Fatty Acids from Microalgae for the Production of High Added Value Compounds. Fermentation. 3 (4), (2017).
- Harun, R., Singh, M., Forde, G. M., Danquah, M. K. Bioprocess engineering of microalgae to produce a variety of consumer products. Renewable and Sustainable Energy Reviews. 14 (3), 1037-1047 (2010).
- Liu, L., et al. Development of a new method for genetic transformation of the green alga Chlorella ellipsoidea. Molecular biotechnology. 54 (2), 211-219 (2013).
- Cheng, J., et al. Mutate Chlorella sp. by nuclear irradiation to fix high concentrations of CO2. Bioresource Technology. 136, 496-501 (2013).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Sales, C. M., Au, Comparison of Scale in a Photosynthetic Reactor System for Algal Remediation of Wastewater. Journal of Visualized Experiments. (121), e55256 (2017).
- Higgins, B. T., et al. Cofactor symbiosis for enhanced algal growth, biofuel production, and wastewater treatment. Algal Research. 17, 308-315 (2016).
- Higgins, B., et al. Algal-bacterial synergy in treatment of winery wastewater. Nature Clean Water. 1 (6), (2017).
- Higgins, B. T., et al. Impact of thiamine metabolites and spent medium from Chlorella sorokiniana on metabolism in the green algae Auxenochlorella prototheciodes. Algal Research. 33, 197-208 (2018).
- Lépinay, A., et al. First insight on interactions between bacteria and the marine diatom Haslea ostrearia: Algal growth and metabolomic fingerprinting. Algal Research. 31, 395-405 (2018).
- Franchino, M., Comino, E., Bona, F., Riggio, V. A. Growth of three microalgae strains and nutrient removal from an agro-zootechnical digestate. Chemosphere. 92 (6), 738-744 (2013).
- Choix, F. J., Lopez-Cisneros, C. G., Mendez-Acosta, H. O. Azospirillum brasilense Increases CO2 Fixation on Microalgae Scenedesmus obliquus, Chlorella vulgaris, and Chlamydomonas reinhardtii Cultured on High CO2 Concentrations. Microbial Ecology. 76 (2), 430-442 (2018).
- Higgins, B., VanderGheynst, J. Effects of Escherichia coli on mixotrophic growth of Chlorella minutissima and production of biofuel precursors. PLoS One. 9 (5), e96807 (2014).
- Higgins, B., Thornton-Dunwoody, A., Labavitch, J. M., VanderGheynst, J. S. Microplate assay for quantitation of neutral lipids in extracts from microalgae. Analytical Biochemistry. 465, 81-89 (2014).
- Tanadul, O. U., Vandergheynst, J. S., Beckles, D. M., Powell, A. L., Labavitch, J. M. The impact of elevated CO2 concentration on the quality of algal starch as a potential biofuel feedstock. Biotechnology and Bioengineering. 111 (7), 1323-1331 (2014).
- Folch, J., Lees, M., Sloane Stanley, G. H. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- Higgins, B. T., et al. Informatics for improved algal taxonomic classification and research: A case study of UTEX 2341. Algal Research. 12, 545-549 (2015).
- Garrett, R. H., Grisham, C. M. . Biochemistry. , 578-730 (2012).
- de-Bashan, L. E., Trejo, A., Huss, V. A. R., Hernandez, J. -. P., Bashan, Y. Chlorella sorokiniana UTEX 2805, a heat and intense, sunlight-tolerant microalga with potential for removing ammonium from wastewater. Bioresource Technology. 99 (11), 4980-4989 (2008).
- Wang, Q., Higgins, B., Ji, H., Zhao, D. . Annual International Meeting of the ASABE. , (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon