Method Article
Anbau von grünen Mikroalgen in Bubble Spalte Photobioreaktoren und ein Test für neutrale Lipide
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein Protokoll zur Labormaßstab Blase Spalte Photobioreaktoren zu konstruieren und zu Kultur Mikroalgen zu verwenden. Es bietet auch eine Methode zur Bestimmung der Wachstumsrate Kultur und neutrale Lipidgehalt.
Zusammenfassung
Es gibt großes Interesse an der Studie von Mikroalgen für technische Anwendungen wie etwa die Herstellung von Biokraftstoffen, hochwertigen Produkten, und für die Behandlung von Abfällen. Wie die meisten neuen Forschungsanstrengungen im Labormaßstab beginnen, gibt es eine Notwendigkeit für kostengünstige Methoden zur Kultivierung von Mikroalgen reproduzierbar. Hier kommunizieren wir einen effektiven Ansatz zur Kultur Mikroalgen im Labormaßstab Photobioreaktoren, und das Wachstum und die neutralen Lipidgehalt dieser Algen zu messen. Anweisungen sind auch zum Einrichten des Photobioreaktor-Systems enthalten. Obwohl die Beispiel Organismen Arten von Chlorella und Auxenochlorellasind, kann dieses System angepasst werden, um eine Vielzahl von Mikroalgen, einschließlich Ko-Kulturen von Algen mit Algenarten zu kultivieren. Stammkulturen sind zum ersten Mal in Flaschen, Inokulum für das Photobioreaktor-System zu produzieren angebaut. Algen-Inokulum ist konzentriert und in Photobioreaktoren zur Kultivierung im Batch-Modus übertragen. Proben werden täglich für die optische Dichte-Messwerte gesammelt. Am Ende der Batch-Kultur Zellen werden geerntet, indem Zentrifuge gewaschen, und gefriergetrocknet, eine endgültige Trockengewicht Konzentration zu erhalten. Die endgültige Trockengewicht Konzentration wird verwendet, um eine Korrelation zwischen der optischen Dichte und das Trockengewicht Konzentration zu erstellen. Eine modifizierte Folch Methode wird anschließend verwendet, um insgesamt Lipide aus gefriergetrockneten Biomasse zu extrahieren und der Extrakt ist für seine neutrale Fettgehalt mit einer Mikrotestplatte Assay untersucht. Dieser Assay ist bisher erschienen aber Protokoll Schritte wurden hier aufgenommen, um kritische Schritte des Verfahrens zu markieren, wo häufig Fehler auftreten. Die hier beschriebenen Bioreaktorsystem füllt eine Nische zwischen einfachen Flasche Anbau und kommerziellen Bioreaktoren vollständig kontrolliert. Sogar mit nur 3-4 biologische repliziert pro Behandlung, unser Ansatz zur Kultivierung von Algen führt zu engen Standardabweichungen in der Wachstums- und Lipid-Assays.
Einleitung
Die Anwendung von Mikroalgen in Technik und Biotechnologie hat großes Interesse in den letzten Jahren angezogen. Mikroalgen werden für den Einsatz in Abwasser Behandlung1,2,3,4, Biofuel Produktion5,6,7,8, untersucht und die Herstellung von Nutraceuticals und andere hochwertige Produkte9,10. Algen sind auch größere Preisen in dem Bemühen zur Verbesserung der Fitness für spezielle technische Anwendungen11,12genmanipuliert sein. Infolgedessen gibt es großes Interesse am Experimentieren mit industriell relevante Organismen in kontrollierter Einstellungen. Der Zweck dieser Methode ist, einen effektiven Ansatz zur Kultur Mikroalgen in einer kontrollierten Laborumgebung zu kommunizieren und um das Wachstum und die neutralen Lipidgehalt dieser Algen zu messen. Verbesserung des Wachstums raten und neutrale Lipidgehalt der Mikroalgen als zwei wichtigsten Engpässe in Richtung Kommerzialisierung von Algen Biokraftstoffe13eingestuft wurden.
Eine Vielzahl von Ansätzen wurden verwendet, um Kultur-Algen um zu Versuchszwecken. Im Allgemeinen können diese Ansätze großflächigen Anbau im Freien und kleine indoor-Anbau aufgeteilt werden. Freilandkultur in Photobioreaktoren und offene Teiche eignet sich für Experimente zur Aufstockung der Prozesse, die bereits im Labormaßstab (z. B. testen Sie Scale-Up von einen neuen High-Lipid-Stamm von Algen) nachweislich14. Aber kleine indoor-Anbau eignet sich bei der Entwicklung neuer oder verbesserter Algen Stämme oder Durchführung von Experimenten darauf abzielen, das Verständnis biologischer Mechanismen. In diesen letzteren Fällen ist eine hohe experimentelle Kontrolle erforderlich, um subtile Veränderungen im biologischen Verhalten herauskitzeln. Zu diesem Zweck müssen die axenic Kulturen häufig zur Minimierung der komplexen biotischen Faktoren im Zusammenhang mit anderen Organismen (z. B. Bakterien, andere Algen), die unweigerlich in Großanlagen im Freien wachsen. Auch wenn Wechselwirkungen zwischen Algen und andere Organismen zu studieren, haben wir festgestellt, dass Verwendung von hoch-kontrollierten Versuchsbedingungen hilfreich ist, bei der Untersuchung von molekularen Austausch zwischen Organismen15,16,17.
Innerhalb der Kategorie der kleinen indoor Algenkultivierung wurden verschiedene Ansätze verwendet. Vielleicht ist der am häufigsten verwendete Ansatz wachsen Algen im Erlenmeyerkolben auf einem Shaker Tisch unter einer leichten Bank18,19. Austausch von Sauerstoff und CO2 erfolgt durch passive Diffusion durch ein Schaum Plug-in der Spitze des Kolbens. Einige Forscher haben dieses Set-up durch aktive Lüftung der Kolben20verbessert. Ein anderer Ansatz ist, Algen in Flaschen, gemixt von Stir Bar und aktive Belüftung zu kultivieren. Trotz ihrer Schlichtheit haben wir festgestellt, dass die Verwendung von Flaschen und Flaschen oft zu inkonsistenten Ergebnissen unter biologischen repliziert führt. Dies ist vermutlich auf Positionseffekte - Positionen erhalten unterschiedliche Mengen an Licht, die auch interne Reaktor Temperaturen beeinflussen. Tägliche Rotation der Reaktoren auf neue Positionen können helfen, aber ist nicht das Problem lindern, weil bestimmte Stadien der Algenwachstum (z. B. früh exponentielle) sind empfindlicher gegenüber positionellen Effekte als andere (z. B. Log-Phase).
Auf der gegenüberliegenden Seite des Spektrums der technische Raffinesse sind kommerzielle Photobioreaktoren vollständig kontrolliert. Diese Systeme kontinuierlich überwachen und Anpassen von Bedingungen im Reaktor, Algenwachstum zu optimieren. Sie haben programmierbare Beleuchtung, Echtzeit-Temperaturregelung und die Kontrolle des pH-Werts. Leider, sie sind teuer und Kosten in der Regel mehrere tausend Dollar pro Reaktor. Die meisten wissenschaftliche und technische Zeitschriften erfordern biologische Replikation der Ergebnisse erfordern den Kauf mehrere Bioreaktoren. Wir stellen Ihnen hier eine Blase Spalte Reaktorsystem, Brücken, nähert sich die Kluft zwischen den einfachen (Kolben) und anspruchsvolle (vollständig kontrolliert Bioreaktor) für Labor-Maßstab Algenzucht. Blase Spalten verwenden steigende Gasblasen zu erleichtern Gasaustausch und Mischen des Reaktors. Dieser Ansatz bietet ein gewisses Maß an Kontrolle über die Beleuchtung und die Temperatur aber tut dies in einer Weise, die kostengünstig ist. Darüber hinaus fanden wir dieses System sehr konsistente Ergebnisse unter biologischen Wiederholungen reduziert die erforderliche Anzahl von biologischen Wiederholungen notwendig, um statistisch signifikante Ergebnisse im Vergleich zu der Flasche oder Flasche Ansatz zu erhalten. Wir haben dieses System auch verwendet, um Mischungen aus Algen und Bakterien21erfolgreich zu kultivieren. Neben der Algenzucht beschreiben wir ein Verfahren zur Messung der neutralen Fettgehalt in den kultivierten Algen. Die letztere Methode wurde an anderer Stelle veröffentlicht22, aber wir gehören das Verfahren hier um Schritt für Schritt Anleitungen wie man es erfolgreich einsetzen.
Protokoll
1. Aufbau der Blase Spalte Photobioreaktoren
- Konstruieren Sie eine Reihe von belüfteten Deckeln aus Kunststoff-Deckel, die kam mit 1 L Glasflaschen und Hybridisierung Rohre (siehe Abbildung 1 für Schaltplan und Fotos). Deckel für Luftbefeuchter, mischen, Trap, jede Luft-Lift-Photobioreaktor und jede Flasche-Reaktor zu bauen.
- ¼" Löcher in den Deckel Bohren: 2 Löcher sind erforderlich für Bioreaktor und Luftbefeuchter Deckel; 3 Löcher sind für die Rührschüssel Falle erforderlich.
- Stecke eine ¼" o-Ring über die Fäden eines 1/8"-Panel-Mount Luer Fittings und schieben Sie diese in die ¼" Bohrung im Deckel (Abbildung 1A).
- Rutschen Sie, eine zweite ¼" o-Ring über die Fäden so dass der Deckel zwischen die beiden O-Ringe eingeklemmt ist. Schieben Sie eine Kontermutter auf das Gewinde und ziehen Sie zur Befestigung der Panel Mount Luer.
- Sprengringe Sperre auf die exponierten männlichen Luer Projektion aus dem Deckel. Wiederholen Sie die Schritte 1.1.2-1.1.4 für jedes Loch im Deckel.
- Für Deckel, die auf Blase Spalte und Flasche Reaktoren verwendet werden, fügen Sie 1/8" weiblichen Luer mit Widerhaken Fittings bis 1.5" Stücke von 1/8" ID PVC-Schläuche. Fügen Sie diese zu jedem freigelegten männlichen Luer Fittings auf dem Deckel.
- Schließen Sie ein Rückschlagventil (den Deckel wegzeigt) an das freie Ende eines 1/8" Stücke.
Hinweis: Dies wird als der Auslass für den Bioreaktor dienen. - Verbinden Sie einen männlichen Luer mit Widerhaken passend zu dem zweiten Stück von 1/8" Schlauch, aus dem Deckel zu projizieren. Rasten Sie rotierende Sicherungsring ein und befestigen Sie einen 0,2 mm Luftfilter dazu.
Hinweis: Dies wird als die Einlassöffnung für den Reaktor dienen.
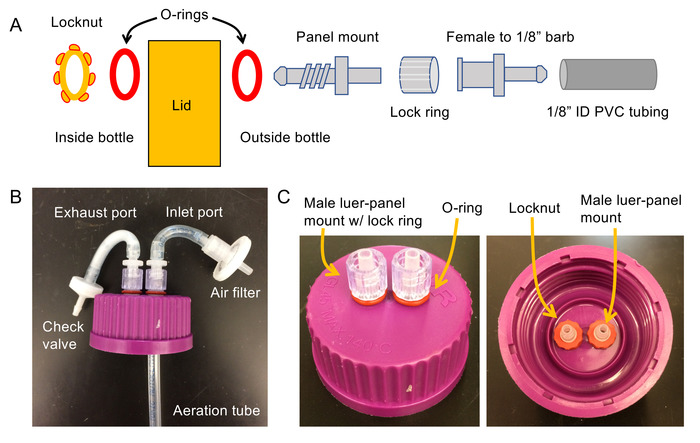
Abbildung 1: Schaltplan und Fotos für den Bau von Bioreaktoren. (A) Schaltplan für den Bau des Bioreaktors Deckel (B) Foto der montierten Bioreaktor-Deckel und (C) Foto der montierten Deckel für den Luftbefeuchter verwendet. Beachten Sie, dass die Luftbefeuchter Beschläge in wasserdichten Silikon luftdicht mit dem Deckel darauf beschichtet werden sollte. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Montieren Sie die Luft-Delivery-System (siehe Abb. 2A und 2 b für einen Schaltplan und Foto).
- Befestigen Sie 1/8" NPT-Gewinde an Barb Armaturen, die ein- und Ausgänge auf der Rückseite der einzelnen Rotameter.
Hinweis: 200-2.500 cm3/min Rotametern sind für Luft Druck Modulation stromaufwärts des Luftbefeuchters, 100-1.000 cm3/min Rotametern Flasche Reaktoren, 50-500 cm3/min Rotametern sind für Luft-Lift-Bioreaktoren und 5-50 cm3/ min Rotemeters sind zur CO2 Durchflussregulierung. Es wird empfohlen, Mount Rotametern an einer festen Oberfläche (z.B. Plastikfolie) so dass sie nicht während des Betriebs über fallen. - Die Druckluftquelle abgeschaltet, dann ¼" ID PVC Schlauch mit einer Schlauchschelle an der Druckluftquelle zu verbinden. Der Schlauchdurchmesser bis 1/8" ID PVC Schlauch mit einem ¼" weibliche Widerhaken Montage und ein 1/8" männlichen Barb Fitting zurücktreten.
- Verbinden Sie das freie Ende der ID Schlauch 1/8" mit dem Einlass ein 200-2.500 cm3/min Rotameter.
Hinweis: Das Outlet von diesem Rotameter fließen Befeuchterflasche über ID Schlauch 1/8". - Schließen Sie die 1/8" Schlauch zu einer Bucht eine belüftete Deckel (verwenden Sie einen weiblichen Luer, barb, passend zum herstellen die Verbindung). Schließen Sie ein zweites Stück 1/8" Schlauch an der Innenseite der Panel-Montage angebracht.
Hinweis: Dieses Stück wird in den Luftbefeuchter und Blase Luft durch das Wasser nach unten hängen. - Fügen Sie 1/8" weiblichen Luer barb Beschläge an jedem Ende eines Stückes ID Schlauch 1/8" und nutzen dieses Stück zum Einlass der mischenden Falle die Steckdose des Befeuchters herstellen.
- In der gleichen Weise wie 1.2.5 verbinden der Auslass des CO2 Regler an einen zweiten Anschluss an die Rührschüssel Falle.
- Konstruieren Sie einen Verteiler mit 1/8" Schlauch und 1/8" multiport Widerhaken (siehe Abbildung 2 C) die Rotameter Banken Luft zugeführt.
Hinweis: Diese Rotametern werden zur Bioreaktoren liefern. Mehr als 6 Rotametern in Serie bauen zu vermeiden. Verwenden Sie stattdessen parallele Banken Rotametern, um das System zu erweitern. Sicherzustellen, dass die Gesamtdurchsatz Nachfrage für alle Reaktoren weniger als 2.500 cm3/min ist (oder sonst eine größere Rotameter benötigt werden oberhalb des Befeuchters). - Schließen Sie Steckdose (3rd Port) der mischenden Falle an der neu errichteten Rotameter Banken mit 1/8" Schlauch und ein 1/8" weiblich zu Widerhaken Luer-Anschluss an.
- Verbinden Sie ausreichend lange 1/8" Schlauch zu den Outlets der einzelnen Rotameter in der Rotameter Bank zu Bioreaktoren Luftversorgung. Beschriften Sie die Enden der Schläuche sowie die Rotametern in der Bank.
- Tragen Sie wasserdicht Silikon rund um alle Ports auf den Luftbefeuchter und Mischung Falle Deckel um sicherzustellen, dass sie luftdicht sind.
- Befestigen Sie 1/8" NPT-Gewinde an Barb Armaturen, die ein- und Ausgänge auf der Rückseite der einzelnen Rotameter.

Abbildung 2: Schaltplan und Fotos zur Montage von Blase Trennsystem. (A) schematische Darstellung der Belüftung System (B) Foto des Luftbefeuchters, mischen, Trap, und Rotameter Bank und (C) Foto von der Verteilerrohre verwendet, um die Rotameter Banken miteinander zu verbinden. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Einrichten von Aquarien, rühren, Platten und Lichter (Abbildung 3).
Achtung: Dieses System erfordert eine große Anzahl von Outlets und ausreichende Kapazitäten, Schaltung um alle Komponenten zu unterstützen. Vermeiden Sie Aneinanderreihung mehrere Steckdosenleisten und Verlängerungskabel in einer Daisy-Chain-Mode, denn dies ist eine elektrische Gefahr. Einsatz von GFI Typ Steckdosen und Steckdosenleisten ist dringend empfohlen, wegen des Vorhandenseins des Wassers im System.- Ordnen Sie die flache magnetischen Rührer auf einer ebenen Fläche, die stark genug ist um das Gewicht des wassergefüllten Aquarien zu halten.
- Platzieren Sie kleine Holz- oder Blöcke (das sind etwas größer als die Aufregung-Platten) im Umkreis der rühren Platten, das Gewicht der Aquarien zu unterstützen.
Achtung: Vermeiden Sie die Aquarien direkt auf den Platten Aufsehen, da das Gewicht zerschlagen wird. - Legen Sie die Aquarien über die Aufregung Platten und unterstützen Sie Blöcke zu und füllen Sie die Tanks mit Wasser.
- Schneiden Sie ein Stück von einer steifen Plastikfolie zu passen auf das Aquarium als Deckel. Schneiden Sie Löcher in diese Abdeckung die Hybridisierung Rohre rein und raus schieben. Außerdem schneiden Sie ein Loch für den Fisch Tankheizung.
- Ordnen Sie die fluoreszierenden Licht Banken neben das Aquarium, horizontale Beleuchtung von Bioreaktoren bereitzustellen. Stecken Sie die leichte Bank in einen leichten Timer, legen Sie einen Tag/Nacht-Zyklus.

Abbildung 3. Anlagenschema für die Flasche Bioreaktoren (links) und die Blase Spalte Photobioreaktoren (rechts). Diese Zahl wurde von Higgins Et Al. modifiziert 17. Bitte klicken Sie hier für eine größere Version dieser Figur.
2. Vorbereitung der Mikroalgen Inokulum
- Cryo-konserviert, versilbert oder flüssigen Kultur Mikroalgen Inokulum einzuholen.
Hinweis: Es wird empfohlen, dass kryokonservierte Organismen beschichtet werden, vor der Verwendung als Inokulum zu gewährleisten, dass Zellen lebensfähig sind und die sich daraus ergebenden Kultur axenic ist. Agar-Medium (zB., ATCC #5 Sporen Agar)21 ist eine reiche Medium, das funktioniert gut für die Wiederbelebung der Arten von Chlorella und Auxenochlorella aus dem Cryo-Speicher. - Bereiten Sie 2,4 L Mineralwasser Medium, das für bestimmte Mikroalgen Arten geeignet ist.
Hinweis: Beispiele sind N8 mittlere23 Arten von Chlorella, N8-NH4 mittlere21 Arten von Auxenochlorella. Verwendung eines Mediums für die Algen Belastung geeignet ist einer der wichtigsten Schritte in Richtung robuste Algenwachstum zu gewährleisten. - Für jede Flasche hinzufügen aliquoten 2,4 L Mineralwasser Medium gleich in drei 1 L Glasflaschen, rühren Bars zu jeder Flasche und montieren die belüftete Deckel (Abbildung 1). Überprüfen, die die Belüftung-Röhre auf der Einlassseite und jede Flasche hat eine Stir Bar drin.
- Autoklaven die Vorratsflaschen mit einem flüssigen Sterilisation Zyklus (121 ° C) für 30 min. Autoklaven 100 mL entionisiertem Wasser (dH2O) und einige 1,5 mL Röhrchen zur gleichen Zeit, die später zur Beschichtung verwendet werden. Lassen Sie das Medium cool über Nacht. Alternativ den Reaktor auf Raumtemperatur abkühlen lassen und dann für 2 h vor der Inokulation belüften.
- Impfen Sie in eine biologische Kabinett (BSC) Mikroalgen aus einer Platte oder axenic Flüssigkultur in den Vorratsflaschen. Verwenden Sie sterilen Technik zur Wartung axenic Kulturen in den folgenden Schritten.
- Ein steril 50 mL Zentrifugenröhrchen 20 mL autoklaviert dH2O hinzufügen. Benutzen Sie eine sterile 10 µL Einweg Schleife um mehrere einzelne Kolonien von der Platte aus Schritt 2.1 holen. Tauchen Sie die Schleife in der 50 mL Tube und waschen Sie die Algenzellen in der 20 mL autoklaviert dH2O. Shake die 50 mL-Tube, eine homogene Mikroalgen-Lösung zu machen.
- 6 mL Mikroalgen-Lösung in jedem Lager Flasche mit einer sterilen serologische Pipette 10 mL Pipette. Schwenken Sie die Flasche, um die Mikroalgen in das Medium gleichmäßig zu mischen.
- Verwenden Sie eine 2 mL sterile serologische Pipette 1 mL Proben aus jedem Lager Flasche und Transfer in sterilen 1,5 mL Röhrchen zu zeichnen.
Hinweis: Mikropipetten sind für diesen Schritt aufgrund des Risikos einer Kontamination nicht empfohlen. Ziehen Sie die belüftete Deckel auf Vorratsflaschen. - Legen Sie die Vorratsflaschen auf rühren Platten (~ 150 u/min) und passen Sie Luftdurchsatz, CO2und Beleuchtung Ebenen je nach Bedarf für die Arten an. Drehen Sie die Position der Lager Flasche jeden Tag.
- Verdünnen Sie 1 mL-Proben während Schritt 2.6 (100-fold Verdünnung in sterilem Wasser in der Regel gut funktioniert) und Platte auf eine reiche Agar-Medium zu verbreiten.
Hinweis: Diese Platten können verwendet werden, auf Fälle von Kontamination sowie dienen als Quelle für zukünftige Algen Inokulum für weitere Experimente zu prüfen. - Nehmen Sie Proben aus den Flaschen (in der BSC) alle zwei Tage, um die Mikroalgen Wachstum zu überprüfen.
Proben in einer 96-Well-Mikrotestplatte in dreifacher Ausfertigung (200 µL) und Messen optische Dichte (OD) bei 550 nm und 680 nm alle zwei Tage bis OD erreicht 0,2-0,3 (das erfordert in der Regel 5-7 Tage). - Stoppen Sie die Inkubation zu und die Vorratsflaschen auf eine Sitzbank für 24-48 h um die Algenzellen sich durch die Schwerkraft zu ermöglichen.
Hinweis: Die sesshaften Zellen werden als nächstes die Blase Spalte Photobioreaktoren impfen verwendet werden. Wenn eine schnellere Zellentnahme gewünscht wird, können Zellen bei nicht mehr als 1.000 x g Zellen gesammelt zentrifugiert.
(3) die Kultivierung von Mikroalgen in Bubble Spalte Photobioreaktoren
- Am Vortag Bioreaktor Inokulation vorzubereiten geeignete Medien und Transfer 200 mL (oder gewünschte Lautstärke) auf die Blase Spalte Photobioreaktor Röhren (Hybridisierung Röhren). Autoklaven Rohre mit Medien und belüftete Deckel einkleben.
Hinweis: Bei Verwendung von Abwasser als ein Wachstumsmedium, Autoklaven die leeren Bioreaktoren und abschmecken steril filtriert Abwasser (axenic Kultur ist). - Den sesshaften Mikroalgen bestand durch Entfernen des Überstands mit Hilfe einer Vakuumpumpe zu konzentrieren. Lassen Sie weniger als 100 mL des Mediums in jeder Flasche aber vermeiden Sie, ständige Algen entfernen.
Hinweis: Führen Sie diese Prozedur innerhalb einer BSC und folgen Sie sterilen Technik. Eine einfache Vakuumapparatur kann mit entweder eine Thermoskanne oder Flasche konstruiert werden. Passen Sie eine sterile serologische Pipette auf das Ende des Schlauches. - Auszusetzen und die Algen Gülle auf steril 50 mL Zentrifuge Rohre übertragen. Zentrifugieren Sie bei 1.000 x g für 5 min weiter Algen konzentrieren.
- Entfernen Sie in der BSC genügend überstand um ein Gesamtvolumen von ca. 80 mL Algen-Konzentrate für 12 Photobioreacters zu erreichen. Vermeiden Sie Staubsaugen, das Pellet. Die Algen-Konzentrat auf einen sterilen Behälter (oder der verwendeten Algen Lager Flasche) übertragen.
- 6 mL Algen Gülle in jeder Photobioreaktor mit einer serologischen sterile 10-mL-Pipette hinzugeben.
- Sterilfilter (0,2 mm Spritze oder Vakuum-Filter) und fügen Sie entsprechende Mengen an anderen Verbindungen (z. B. Vitamin Bestände) die nicht autoklaviert werden können.
- Wirbel-Bioreaktoren Algen in das Medium zu mischen.
- Zeichnen Sie eine 2 mL Probe von jedem Bioreaktor mit einem serologischen Pipette und Übertragung auf eine 2 mL-Tube. Sammeln Sie eine 2 mL Probe (BSC) alle 24 h um Kultur Fortschritt zu überwachen. Das Beispiel für die Verwendung von pH Teststreifen und den Reaktor nach Bedarf anpassen, mit entweder 3 M NaOH oder 3 M HCl.
- Ziehen Sie die Bioreaktor-Deckel und legen Sie alle Bioreaktoren in der Fisch-Tank-Wasserbad. Passen Sie die Belüftung, CO2und Beleuchtung auf die entsprechende Ebene für die Spezies. Drehen Sie die Bioreaktor-Position jeden Tag nach der Probenahme (Schritt 3.8).
- Brunnen von einem 96 gut Mikrotestplatte 200 µL jeder Kultur Probe in dreifacher Ausfertigung zuweisen. Messen optische Dichte (OD) bei 550 nm und 680 nm.
- Am letzten Tag der Periode Kultur messen Sie OD unter verschiedenen Verdünnungsfaktoren (z. B. 1 X, 2 X, 4 X, 8 X, 16 X und 32 X), eine Korrelation zwischen der OD und das tatsächliche Trockengewicht nach der Ernte (Schritt 4) zu etablieren.
- Zentrifugieren Sie das Probenröhrchen 2 mL bei 12.000 x g für 5 min.
- Den Überstand durch 0,2 µm nicht sterile Spritze Filter filtern und speichern den überstand (und Pellet bei Bedarf) ohne über-20 ° C für langfristige Lagerung und späteren Analyse der Veränderungen in der Zusammensetzung der Medien.
4. Ernte und Gefriertrocknung von Mikroalgen Biomasse
- Messen Sie ein bestimmtes Volumen der Algenkultur aus jedem Bioreaktor mit einem Messzylinder (z. B. 160 mL aus einem Bioreaktor, dass ursprünglich enthaltenen 200 mL Medium) und in die Zentrifuge Flaschen übertragen. Spülen Sie den Messzylinder mit dH2O zwischen jeder Messung.
- Zentrifuge bei 4.696 x g für 5 min. verwerfen den Überstand durch sorgfältig Absaugen es heraus.
- Übertragen Sie die Pellets auf beschriftete 50 mL Röhrchen. Spülen Sie die Zentrifuge Flaschen mit dH2O und Transfer Inhalt 50 mL-Tuben. Stellen Sie sicher, dass das gesamte Rohr Volumen 45 mL nicht überschreitet.
- Waschen Sie die Algen Pellets mit dH2O Salze zu entfernen.
- Die 50 mL Röhrchen 4.696 x g für 5 min Zentrifugieren und den Überstand verwerfen.
- Jeweils 50 mL-Tube 40 mL dH2O hinzufügen; Vortex mischen. Wieder bei 4.696 x g für 5 min Zentrifugieren und überstand verwerfen.
- Wiederholen Sie Schritt 4.4.2.
- Beschriften und wiegen leer 15 mL Zentrifuge Röhren auf einem 4-dezimal-Gleichgewicht (beschriften Sie den Deckel und Schlauch und wiegen sie zusammen). Wiegen Sie eine Röhre pro Algenkultur. Wiegen Sie jedes 15 mL Röhrchen zweimal, um Fehler zu minimieren.
- Verwerfen Sie nach der letzten Wäsche überstand, und 7,5 mL dH2O zu jeweils 50 mL-Tube. Wirbel und Übertragung der Algen-Schlämme in der vorgewogene 15 mL Röhrchen. Spülen Sie die 50 mL Röhrchen mit zusätzlichen dH2O und 15 mL-Tuben übertragen Sie Flüssigkeit. Vermeiden von mehr als 12 mL Gesamtvolumen in 15 mL-Tuben.
- Zentrifugieren Sie die 15 mL Röhrchen 4.696 x g für 5 min und dekantieren Sie des Überstandes. Frieren Sie die Rohre mit Pellets bei-80 ° C für mindestens 30 min in der Vorbereitung für die Gefriertrocknung.
- Einfrieren, trocknen über Nacht oder bis getrocknet.
- Weigh und nimmt die gefriergetrocknete 15 mL Röhrchen mit Algen.
(5) Lipid-Extraktion mittels geändert Folch Methode24
- Wiegen Sie 20 mg gefriergetrocknetes Algenbiomasse in ein 2 mL Schraubverschluss aus Polypropylen Röhrchen (Check Hersteller Etikett um sicherzustellen, dass Produkt für Perle Extraktionen geeignet ist).
- Jeweils 2 mL-Tube (enthält 20 mg gefriergetrockneten Algen) fügen Sie 1,5 mL Folch Lösungsmittel (2:1 Chloroform/Methanol hinzu). Gießen Sie ~0.5 mL Zirkonia/Kieselsäure Perlen (0,5 mm) in jede Röhre bis Flüssigkeitsstand im Rohr 2 mL erreicht.
Achtung: Behandeln, Chloroform und Methanol in einer Dampfhaube und Einatmen der Dämpfe vermeiden oder Hautkontakt. - Homogenisieren der Algen-Proben in einer Korn-Mühle für 20 s mit einer Geschwindigkeit von 6,5 m/s-Rohrweiche zu Eis für 30 s Proben zu entspannen. Wiederholen Sie fünfmal mehr Lipide vollständig zu extrahieren.
- Filtern Sie das Homogenat durch eine 5 mL Spritze mit einem Edelstahl-Draht Mesh Datenträger (#60 Mesh) zu belasten, die Perlen sammeln Filtrat in einem 15 mL-Tube.
- Waschen Sie die Perlen mit 1,5 mL Folch Lösungsmittel, Flüssigkeit mit der Spritze bei Bedarf durchschieben. Wiederholen Sie diese waschen zweimal und sammeln Sie alle Filtrat in der 15 mL Tube, einem Endvolumen von ca. 6 mL nachgeben.
- Fügen Sie 1,2 mL 0,9 % (w/V) NaCl-Lösung zu den Folch-Extrakt in der 15 mL Tube und Wirbel um gut zu mischen.
Hinweis: Bei Bedarf kann weitere Folch Lösungsmittel Perlen (Nutzung 0,2 x total waschen Volumen von 0,9 % NaCl-Lösung induzieren Phasentrennung) Waschen verwendet werden. - Zentrifugieren Sie die 15 mL Röhrchen bei 6.000 x g für 5 min. Aufzeichnung der unteren Chloroform (grün) Phase Volumen auf die nächste 0,1 mL mit Linien auf der Seite der 15 mL Tube. Übertragen Sie die untere Phase zu einem Glasfläschchen (mit Deckel) mit einem Glas Pasteurpipette.
- Speichern Sie die Lipid bei-20 ° C oder (-80 ° C Wenn es geplant ist, diesen Auszug für die Fettsäure-Analyse verwenden).
(6) Neutral Lipid-Assay mit einer Mikrotestplatte Methode (adaptiert von Higgins Et Al. 201422( )
- Stammlösungen vorzubereiten. Vorbereitung 10 mL 1 mg/mL Pflanzenöl Standard in Chloroform und Lagerung bei-20 ° C.
Hinweis: Jedes Pflanzenöl kann in diesem Test verwendet werden, da es nicht auf die Arten von Fettsäuren reagiert. 10 mL von 200 µg/mL Nil Rote Lösungin Dimethyl Sulfoxid (DMSO) vorbereiten und im Dunkeln bei Raumtemperatur lagern. - Vorheizen trocken Mikrotestplatte Block auf 55 ° C in einer Dampfhaube. Während dieser Heizung ist, verdünnen Sie die Lipid-Extrakte und Pflanzenöl standard 3-Fach mit Methanol.
Hinweis: Diese Verdünnung kann geändert werden, basierend auf der Lipidgehalt der Algen, aber dieses Niveau eignet sich gut für die meisten Chlorella. - Fügen Sie für jede verdünnte Probe 80 µL einer 96 gut Polypropylen Mikrotestplatte in vervierfacht hinzu.
Achtung: Verwendung von Polystyrol Plasticware empfiehlt sich nicht für die Verwendung mit organischen Lösungsmitteln. - Beantragen Sie das Lösungsmittel leer 80 µL 2:1 Methanol/Chloroform in vervierfacht. Fügen Sie für Standards 10, 30, 60, 90 und 120 µL des verdünnten Pflanzenöls standard in vervierfacht.
- Legen Sie die Mikrotestplatte in eine trockene Block Heizung bei 55 ° C für 20-30 min, bis alle Lösungsmittel verdunstet ist. Während das Lösungsmittel verdampft, bereiten die Arbeiten Nile Red Lösung (Notwendigkeit 200 µL 1 µg/ml Lösung pro Platte gut). Als Beispiel erfordert zwölf Proben und eine ganze Reihe von Normen 16 mL 1,0 µg/mL Lösung; durch Auflösen der Bestand von 200 µg/mL (in DMSO) 80 µL in 16 mL dH2O. vorbereiten
- Entfernen Sie die Mikrotestplatte vom Heizblock und lassen Sie auf Raumtemperatur abkühlen. 30 µL Isopropanol in jede Vertiefung und Mischen von Pipettieren rauf und runter. Sicherzustellen, dass alle Pipette Kanäle mischen der Lösung und resuspending die Lipide, die eine homogene grüne Flüssigkeit nachgeben.
- Fügen Sie 200 µL Nil rot-Lösung (1 µg/mL), jeweils gut pipette, oben/unten 10 Mal zu mischen. Inkubieren Sie die Platte für 5 min bei Raumtemperatur. Während des Wartens, bereiten Sie eine 50 % Bleichmittel-Lösung durch Mischen Bleichmittel (6 % Hypochlorit) mit dH2O. 20 µL pro Bohrloch sind erforderlich. Vorbereitung von 3 mL 50 % Bleichmittel ist ausreichend für 12 Proben und eine ganze Reihe von Normen.
- Gut jeder Mikrotestplatte 20 µL Bleichmittel-Lösung hinzu und pipette rauf und runter 5 mal gut mischen. Inkubieren Sie 30 min bei Raumtemperatur.
- Nach 30 min lesen Fluoreszenz in den Proben alle 5-10 min bei 530 nm Anregung/575 nm Emission mit Auto Cut-off setzen auf 570 nm bis das Signal aus Algen Proben stabilisiert hat. 60 min der gesamten Inkubation ist in der Regel ausreichend.
- Erstellen einer Kalibrierkurve für den Pflanzenöl-Standards (im Bereich von 0-40 ng/Ölquelle).
Hinweis: Eine lineare passen eignet sich gut für niedrige (< 30 ng/Well) Öl-Konzentrationen und ein Polynom passen können verwendet werden, wenn der Standard 30 ng/Well übersteigt. Verwenden Sie diese Korrelation, um die neutralere Lipid in der Probe-Brunnen zu quantifizieren.
Ergebnisse
Diese Prozedur ergibt einen zeitlichen Verlauf der Algen optische Dichte Daten bei OD 550 nm (Abb. 4A). Die optische Dichte und Trockengewicht Konzentration Daten korreliert (Abbildung 4 b). Dies wird erreicht durch die erste Berechnung der endgültigen Trockengewicht Algen Konzentration nach der Gefriertrocknung Schritt. Als nächstes kann die optische Dichte der Kultur serielle Verdünnung (durchgeführt am letzten Tag der Probenahme) und die tatsächlichen Trockengewicht Konzentrationen korreliert werden. Für niedrige Zelle Konzentrationen kann eine lineare Korrelation verwendet werden, während für höhere Zelle Konzentrationen eine zweite Bestellung Polynom Korrelation verwendet werden kann. Es wird empfohlen, eine separate Korrelation für jede Kultur Bedingung zu erstellen. Schließlich kann die Korrelation auf die Zeitdaten Kurs optische Dichte zu einer Wachstumskurve Trockengewicht (Abbildung 4) angewendet werden. In diesem Beispiel-Experiment war Auxenochlorella Protothecoides (UTEX 234125) unter vier Bedingungen kultiviert: axenic Kontrolle Kulturen auf frischen N8-NH4 mittlere21, in Kokultur mit dem Bakterium Azospirillum angebaut Brasilense, ergänzt mit 50 mg/L von Indol-3-acetic Acid Medium und verbrachte von A. Brasilensemittlere. A. Brasilense ist bekanntermaßen Indol-3-acetic Säure, ein Hormon, das auch in einigen Mikroalgen fördert fördert Pflanzenwachstum zu produzieren. Jedoch bei 50 mg/L, die IAA-Behandlung völlig gehemmt, A. Protothecoides Wachstum. Folglich, optische Dichte Daten verfügbar waren, sondern die Menge der Algen nicht ausreichten, um eine genaue Trockengewicht Konzentration zu erhalten. In diesem Fall die Korrelation für die Kontrollkultur angewandt werden oder optische Dichte Daten können direkt gemeldet werden. Da OD bei beiden 550 Datenerhebung nm und 680 nm Absorption entweder Dataset für die Korrelation zwischen OD und Trockengewicht verwendet werden. In der Regel wird OD 550 verwendet, da es fast vollständig die Extinktion von Chlorophyll26, schließt damit unterdrücken Voreingenommenheit von Chlorophyll inhaltlichen Änderungen. Im Gegensatz dazu OD 680 umfasst die Extinktion des Chlorophylls und hohe Verhältnisse von OD 680/550 zeigen hohe Chlorophyllgehalt in den Algen. Abbildung 4 zeigt eine Reihe von zwölf Algen Kulturen wachsen in die Blase Spalte Photobioreaktoren. Auch bei nur drei biologische Wiederholungen pro Behandlung waren enge Standardabweichungen erreicht, ermöglicht hohe Sensibilität für Unterschiede zwischen den Behandlungen.
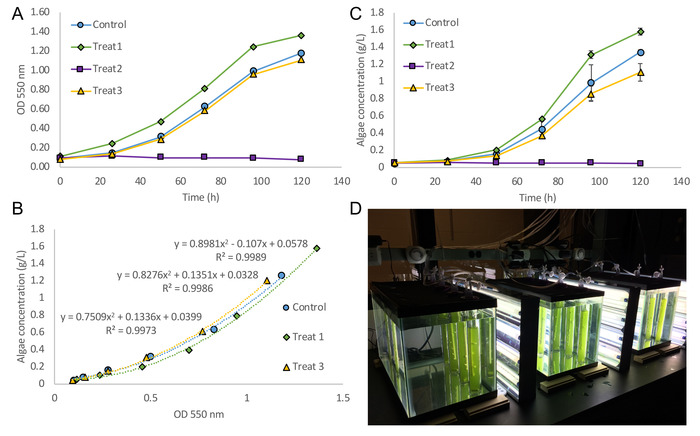
Abbildung 4. Algenwachstum führt Blase Spalte Photobioreaktoren. (A) die optische Dichte (550 nm) Wachstumskurve von Auxenochlorella Protothecoides (UTEX 2341) zeigt Kulturen in späten logarithmischen Wachstum bei 120 Stunden. Kontrolle Kulturen wurden angebaut, auf frischen N8-NH4 Medium, Behandlung 1 ist Ko-Kulturen von A. Protothecoides und Azospirillum Brasilense gewachsen auf frischen N8-NH4 Medium, Behandlung 2 axenic A. Protothecoides auf angebaut N8-NH4 Medium ergänzt mit 50 mg/L Indol-3-acetic Acid (IAA) und Behandlung 3 ist axenic A. Protothecoides auf abgebrannten Medium von A. Brasilenseangebaut. Das abgebrannte Medium wurde durch Kultivierung A. Brasilense für 96 Stunden auf N8-NH4 Medium ergänzt mit 2 g/L-Apfelsäure vorbereitet. Zellen wurden entfernt, und das Medium wurde erneut ergänzt mit Ammonium, seiner ersten Ebene wiederherzustellen, pH-Wert eingestellt wurde, und das Medium war steril gefiltert (0,2 μm). Beachten Sie, dass die 50 mg/L IAA-Behandlung komplett Algenwachstum gehemmt. (B) Korrelation zwischen OD 550 nm und endgültige Trockengewicht Konzentration über eine zweite Bestellung Polynom Passform Kurven. Keine Korrelation wird für die Behandlung 2 angezeigt, da keine Algen am Ende die Kulturdauer geerntet werden könnte. (C) Anwendung der Polynom Korrelation auf die optische Dichte Daten ergibt eine Wachstumskurve mit Trockengewicht Konzentration auf der y-Achse. Die Kontrolle Kultur Korrelation wurde auf die OD-Daten für die Behandlung 2 angewendet. Fehlerbalken sind Standardabweichungen basierend auf 3 biologische repliziert. (D) Foto von der Blase Spalte Photobioreaktoren kurz nach der Inokulation der Kultur. Bitte klicken Sie hier für eine größere Version dieser Figur.
Neutrales Lipid-Daten werden für zwei Beispiel-Experimente in Abbildung 5dargestellt. Dieser Test hat sich gezeigt, zu korrelieren gut mit neutralen Lipidgehalt, insbesondere Triacyglycerol (TAG) Inhalt. Dies kann durch den Vergleich der neutral Lipid-Assay (Abb. 5A) gesehen werden, an einer entsprechenden Dünnschicht-Chromatographie Platte (Abb. 5 b). Der gleiche Trend ist im zweiten Versuch (Abbildung 5 und 5D) ersichtlich. In allen diesen Experimenten war Rapsöl als Standard verwendet und führte zu eine lineare Korrelation (R2 von 0,98 für das erste Experiment und 0,99 für den zweiten) zwischen Fluoreszenz und Raps-Öl-Masse in den Brunnen. Beachten Sie, dass wenn alle Proben niedriger Fettgehalt haben, dann den höchsten Punkt oder zwei auf dem Standard abgelegt werden kann. Diese Korrelation kann verwendet werden, um die Menge der neutral Lipid (µg) in jedem der Algen Probe Brunnen zu berechnen. Die Öl kann werden dann zu einer Konzentration in der Lipid-Extrakt angewendet um die Mikrotestplatte gut umgewandelt. Dieser Wert ist der Verdünnungsfaktor verwendet multipliziert (z.B. 3 X), der neutrale Lipidgehalt der ursprünglichen Folch Extrakte zu erhalten. Diese Konzentration wird dann durch das Volumen des Extraktes (sollte nah an 4 mL) multipliziert und dann geteilt durch die Gesamtmasse des Algenbiomasse für Lipid-Extraktion (sollte in der Nähe von 20 mg) verwendet. Das Ergebnis ist der neutrale Fettgehalt die Mikroalgen.

Abbildung 5. Neutrales Lipid Daten aus Kulturen von Chlorella Sorokiniana (UTEX 2714). (A) neutrale Fettgehalt (% Trockengewicht) für Algen in experiment 1 in denen Algen wurden gezüchtet für 120 Stunden. Die Kontrollkultur war axenic und kultivierten auf frischen N8 mittlere23, Behandlung 1 war ein Kokulturen von C. Sorokiniana und A. Brasilense auf frischen N8 Medium, Behandlung 2 war frisches N8 Medium mit 50 mg/L IAA ergänzt und Behandlung 3 verbrachte Medium von A. Brasilense. Das abgebrannte Medium war vorbereitet durch Kultivierung A. Brasilense für 96 Stunden im N8 Medium ergänzt mit 2 g/L-Apfelsäure, entfernen von Zellen, Ergänzung verloren Nitrat, pH-Wert, und sterilen filtern das Medium (0,2 μm). Im Gegensatz zu A. Protothecoides50 mg/L der IAA nicht C. Sorokiniana Wachstum zu hemmen. (B) TLC Platte Bild für das Experiment 1 zeigt relative TAG Fülle. (C) neutrale Fettgehalt (% Trockengewicht) für Algen in Experiment 2 die gleichen Behandlungen wie 1 aber die Zellen experimentieren wurden nach 72 Stunden des Wachstums geerntet. (D) TLC Platte Bild für Experiment 2 zeigt relative TAG Fülle. Fehlerbalken sind Standardabweichungen basierend auf 3 biologische repliziert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Auch ist es empfehlenswert, der Variationskoeffizient (Standardabweichung dividiert durch den Mittelwert) berechnen der rohen Fluoreszenz Lesungen über alle technischen Wiederholungen in der neutral Lipid-Assay. Vorausgesetzt, dass technische Wiederholungen in der Mikrotestplatte in vervierfacht, wie bereits in dem Verfahren durchgeführt wurden, sollte der Variationskoeffizient in der Regel 10 % nicht überschreiten. Hohen Koeffizienten der Variation sind in der Regel das Ergebnis schlechter mischen (besonders während der Zugabe von Isopropylalkohol) und potenziell fehlerhafte Verwendung der Mehrkanal-Pipette.
Diskussion
Die wichtigste Überlegung bei der Kultivierung von Algen ist ein Verständnis für die spezifischen Bedürfnisse des Organismus oder der Gruppe von Organismen. Die Algen Anbausystem hier beschriebenen kann verwendet werden, um eine breite Palette von Algen aber die spezifischen abiotischen Faktoren (Temperatur, Medien, pH-Wert, Lichtintensität, CO-2 -Ebene, Belüftung Rate) Kultur auf die Bedürfnisse des Organismus angepasst werden müssen. Hinweis: die hier beschriebenen Parameter für den Anbau von Chlorella und Auxenochlorellaverwendet wurden. Diese Organismen sind von industriellen Interesse weil sie tolerant gegenüber hohen Nährstoff, Licht und Temperatur Level27. Allerdings Lichtverhältnisse durch Beseitigung von Leuchtstoffröhren reduziert werden können und die Tag/Nacht-Zyklus kann angepasst werden, um die Saisonalität darstellen. Ebenso können die Wasser-Heizungen nach oben oder unten Kontrolle Bad Wassertemperatur auf dem System gedreht werden. Während des hier beschriebenen Systems nicht solche Funktion beschäftigen, ist es möglich, die Fisch Tank Wasserbädern unterhalb der Raumtemperatur durch eine kostengünstige Kühlung chill. Legen Sie einen Eimer mit Wasser in einem kleinen Kühlschrank und eine drehzahlgeregelte Pumpe, Pumpe Wasser aus dem Kaltwasser Eimer verwenden, um das Aquarium und zurück. Je schneller der Förderrate werden je kältere das Fish Tank Reservoir.
Obwohl das Anbausystem der Algen in der Regel konsistente Ergebnisse liefert, gibt es ein paar wichtige Einschränkungen, die berücksichtigt werden sollten. Die erste ist Wasser absaugen, die im Falle, dass das Belüftungssystem einen plötzlichen Druckverlust erfährt auftritt (z. B. eine defekte Armatur oder ein Luft-Kompressor-Fehler). Druck, der in den Luftbefeuchter ist wird Befeuchterwasser rückwärts durch den Schlauch, unter anderem durch die Rotameter schieben. Installation eines vorgelagerten Falle oder Rückfluss-Verhinderer kann helfen. Beachten Sie, dass Absaugen nicht die Bioreaktoren selbst auswirken wird weil sie bei Atmosphärendruck arbeiten. Routine-Inspektion von Rohrleitungen und Armaturen kann Systemausfälle lindern. Ein weiterer wichtiger Aspekt ist die routinemäßig zu inspizieren und Luftfilter ersetzen und Rückschlagventile auf den Bioreaktoren. Achten Sie darauf, die Empfehlung des Herstellers für die Anzahl der zulässigen Autoklaven Zyklen folgen. Dies ist besonders wichtig, wenn die Wartung der axenic Kulturen für das Experiment von entscheidender Bedeutung ist. Zu guter Letzt empfiehlt es sich, kaufen oder bauen eine autoklavierbar Rack für den sicheren Transport von Bioreaktoren zwischen Wasserbäder, Autoklaven und Biosicherheit Kabinett. Ein Edelstahl-Gitterrost kann diesem Zweck dienen.
Die hier beschriebenen Bioreaktorsystem hat mehrere Einschränkungen. Eine wichtige Einschränkung ist die Notwendigkeit, die Reaktoren in einem Biosafety-Schrank mit steriler Technik zu behandeln. Die Reaktoren fehlt einen Anti-Absaugen Probenahme Anschluss, dass der Benutzer den Reaktor auf eine biologische Kabinett zur Probe zu bewegen, ohne Kontamination der Kulturkreis. Die Reaktoren erfordern auch manuelle pH Lesung und Anpassung der menschlichen Fehlerpotenzial einführt.
Die hier beschriebenen Bioreaktorsystem füllt eine Nische zwischen einfachen Flasche Anbau und vollständig kontrolliert Bioreaktoren. Der Bioreaktorsystem entwickelte sich als Reaktion auf ein Bedürfnis für konsistentere Ergebnisse als erreichbar mit Flaschen waren. Die Daten zeigen, dass dieses System stetiges Wachstum Ergebnisse generiert, wenn entsprechend betrieben. Beachten Sie, dass Porenbeton Flaschen waren in das Verfahren zur Kultivierung von Algen Lager eingesetzt, aber dies geschah nur um Inokulum für das Experiment zu produzieren. Dies ist akzeptabel, weil Vorratsflaschen zum Animpfen zusammengefasst wurden und Variabilität unter Reaktoren daher kein Problem ist.
Wie viele Algen Forscher Überwachung sowohl Wachstum als auch neutral Lipid Inhalt interessieren, haben wir unseren Ansatz zur Messung dieser Parameter hier aufgenommen. Verwendung von optischen Dichte, Wachstum zu messen ist gängige Praxis und ist einzigartig in seiner Einfachheit. Aber Zusammenhänge zwischen Trockengewicht und optische Dichte im Laufe der Zeit ändern und Kulturbedingungen abhängen. Es wird empfohlen, eine Korrelation Gleichung für jede experimentelle Behandlung innerhalb jeder experimentelle Charge zu produzieren. Dies ist möglich in dem vorgeschlagenen Verfahren denn gefriergetrocknete Algen erhalten werden, nach jeder Kultur-Experiment. Eine kritische Annahme des optischen Dichte-Ansatzes ist, dass der Zusammenhang zwischen Extinktion und Trockengewicht im Laufe der Partie Wachstum konstant hält. Solange Abweichungen von dieser Annahme klein sind, wird das Ergebnis recht genau sein. Die relative Genauigkeit kann durch den Vergleich der berechneten Algen Trockengewicht Konzentration zum Zeitpunkt Null bewertet werden. Unter der Annahme, dass Kulturen waren gut gemischt und Pipettieren war genau, alle Kulturen die gleiche Dichte erste Impfung haben sollte. Die optische Dichte Ansatz auch angefochten werden kann, wenn Hintergrund Absorption des Mediums hoch ist (z.B. bei der Arbeit mit bestimmten Abwässer). Subtraktion von der mittleren Extinktion (vor der Inokulation) aus jeder OD Lesung kann mit diesem Problem helfen.
Extraktion von Lipiden aus den trockenen Algen folgt der etablierten Folch Ansatz21,24; Es gibt jedoch wichtige Überlegungen. Verschiedenen Algenarten haben verschiedene Zellwände mit unterschiedlicher Härte. Die Zirkonia/Kieselsäure Perlen verwendet hier sind scharf und stark, Polysaccharid Zellwände durchdringen soll. Ein weicher Wulst-Typ (z. B. Glas) oder weniger Wulst Störung Zyklen können auf Algenbasis mit schwächeren Zellwände verwendet werden. Eine Faustregel ist jedoch, dass die daraus resultierenden Zelle Pellet nach der Extraktion sollte frei sein von Pigment, darauf hinweist, dass alle Chlorophyll extrahiert wurde. Eines der häufigsten Fehlerquellen während der Lipid-Extraktion-Schritt entsteht durch unsachgemäße Gefriertrocknung. Wenn die Probe in den Gefriertrockner schmilzt, bevor es vollständig trocken ist, wird das Ergebnis eine sehr harte, dunkle, wachsartige Pellet sein. Dies ist das Ergebnis von Zellen, die unter Vakuumbedingungen von der Gefriertrocknungsanlage lysiert. Das Pellet kann abgewogen werden, um ein Gewicht zu erhalten, aber es kann nicht für Lipid-Extraktion verwendet werden, da die wachsartige Partikel nicht in die Folch Lösungsmittel unten brechen. Um sicherzustellen, dass die Gefriertrocknung immer Renditen weichen, pulverförmige Proben, ist es wichtig, alle Proben bis-80 ° C eingefroren und prompt auf die Gefriertrocknungsanlage übertragen. Darüber hinaus wird mit Parafilm (mit einem Loch drin steckte) anstatt gelösten Rohr Deckel damit Feuchtigkeit kontinuierlich aus der Probe entfernt werden kann, bevor es taut.
In diesem Verfahren beschriebenen neutral Lipid-Assay ist bereits erschienen und schließt eine Diskussion über alternative Lipid-Assays22. Jedoch wurden einige wichtigen Verbesserungen für diese Prozedur seit Veröffentlichung vorgenommen. Vor allem war die Nil rote Lösungskonzentration von 0,5 µg/mL auf 1 µg/mL erhöht. Der Effekt dieser Änderung war höhere Signalintensität, verbesserte Wiederholbarkeit und eine Beseitigung der Signal-Rückgang im Laufe der Zeit während der Inkubationszeit. Die Ergebnisse zeigen, dass der Test auch zu Ergebnissen aus qualitativen Dünnschichtchromatographie vergleicht. Dieser Test wurde entwickelt und validiert, mit verschiedenen Arten von Chlorella und Auxenochlorella , so dass seine Anwendbarkeit auf Arten deutlich unterschiedlicher Zusammensetzung nicht feststeht. Alle grüne Pigment sollte aus der Test vollständig entfernt werden, während der Bleiche Inkubation, führt zu Proben, die klare oder sehr blass gelb sind. Beachten Sie auch, dass Lipid-Extrakte, die degradiert (wie durch einen Wechsel von Grün in braun) in der Regel sind nicht in diesem Assay genaue Ergebnisse liefern. Daher ist es unerlässlich, Lipid Proben ohne Speichern über-20 ° C im Dunkeln.
Die Methoden zur Kultivierung von Algen hier vorgestellten, Messung von Wachstum und Quantifizierung von neutralen Lipiden eignen sich für eine Vielzahl von technischen Anwendungen von Algen, aber eignen sich besonders für die Forschung auf die Produktion von Biokraftstoffen. Diese Methoden werden auch eingesetzt, um Algenwachstum Hemmung auf Abwässer28 sowie Auswirkungen des Organismus Interaktion auf das Wachstum und die Zusammensetzung der Mikroalgen zu studieren.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Forschung wurde von USDA nationalen Institut für Ernährung und Landwirtschaft Luke Projekt ALA0HIGGINS und Auburn Universität Büros der Propstei, Vizepräsident für Forschung und Samuel Ginn College of Engineering unterstützt. Auch wurde unterstützt durch NSF CBET 1438211 zu gewähren.
Materialien
| Name | Company | Catalog Number | Comments |
| Supplies for airlift photobioreactor setup | |||
| 1 L Pyrex bottles | Corning | 16157-191 | For bottle reactors, humidifiers |
| 1/2" hose clamp | Home Depot | UC953A | or equivalent |
| 1/4" female luer to barb | Nordson biomedical | Nordson FTLL360-6005 | 1/4" ID, PP |
| 1/4" ID, 3/8" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-244 | 50' |
| 1/4" in O-rings | Grainger | 1REC5 | #010 Medium Hard Silicone O-Ring, 0.239" I.D., 0.379"O.D. |
| 1/8" Female luer to barb | Nordson biomedical | FTLL230-6005 | |
| 1/8" ID, 1/4" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-608 | 250' |
| 1/8" male spinning luer to barb | Nordson biomedical | MLRL013-6005 | |
| 1/8" multiport barb | Nordson biomedical | 4PLL230-6005 | 1/8" multiport barb |
| 1/8" NPT to barb | Nordson biomedical | 18230-6005 | 1/8" 200 series barb |
| 1/8" panel mount luer | Nordson biomedical | Nordson MLRLB230-6005 | 1/8", PP |
| 10 gallon fish tank | Walmart | 802262 | Can hold up to 8 bioreactors depending on layout |
| 100-1000 ccm flow meter | Dwyer | RMA-13-SSV | For bottle reactors |
| 2 ft fluorescent light bank | Agrobrite | FLT24 T5 | |
| 200-2500 ccm flow meter | Dwyer | RMA-14-SSV | For air regulation upstream of humidifier |
| 250 mL Pyrex bottles | Corning | 16157-136 | For gas mixing after humidifier |
| 50-500 ccm flow meter | Dwyer | RMA-12-SSV | For hybridization tube reactors |
| 5-50 ccm flow meter | Dwyer | RMA-151-SSV | For CO2 flow rate control |
| Air filters 0.2 µm | Whatman/ Fisher | 09-745-1A | Polyvent, 28 mm, 0.2 µm, PTFE, 50 pack |
| Check valves | VWR | 89094-714 | |
| Corning lids for pyrex bottles | VWR | 89000-233 | 10 GL45 lids |
| Female luer endcap | Nordson biomedical | Nordson FTLLP-6005 | Female stable PP |
| Hybridization tubes | Corning | 32645-030 | 35x300 mm, pack of 2 |
| Light timer | Walmart | 556393626 | |
| Locknuts | Nordson biomedical | Nordson LNS-3 | 1/4", red nylon |
| Low profile magnetic stirrer | VWR | 10153-690 | Low profile magnetic stirrer |
| Male luer endcap | Nordson biomedical | Nordson LP4-6005 | Male plug PP |
| Spinning luer lock ring | Nordson biomedical | Nordson FSLLR-6005 | |
| Stir bars - long | VWR | 58949-040 | 38.1 mm, for bottle reactors |
| Stir bars - medium | VWR | 58949-034 | 25 mm, for hyridization tubes |
| Supplies and reagents for culturing algae | |||
| 0.2 µm filters | VWR | 28145-491 | 13 mm, PTFE, for filtering spent media from daily culture sampling |
| 1 mL syringes | Air-tite | 89215-216 | For filtering spent media from daily culture sampling |
| 1.5 mL tubes | VWR | 87003-294 | Sterile (or equivalent) |
| 10 mL Serological pipettes | Greiner Bio-One | 82050-482 | Sterile (or equivalent) |
| 100 mm plates | VWR | 25384-342 | 100x15 mm stackable petri dishes, sterile |
| 15 mL tubes | Greiner Bio-One | 82050-276 | Sterile (or equivalent), polypropylene |
| 2 mL Serological pipette tips | Greiner Bio-One | 82051-584 | Sterile (or equivalent) |
| 2 mL tubes | VWR | 87003-298 | Sterile (or equivalent) |
| 50 mL tubes | Greiner Bio-One | 82050-348 | Sterile (or equivalent), polypropylene |
| 96 well microplate | Greiner Bio-One | 89089-578 | Polystyrene with lid, flat bottom |
| Inocculating loops | VWR | 80094-478 | Sterile (or equivalent) |
| Liquid carbon dioxide tank and regulator | Airgas | CD-50 | |
| Supplies and reagents for lipid extraction and neutral lipid assay | |||
| 2 mL bead tubes | VWR | 10158-556 | Polypropylene tube w/ lid |
| 96 well microplates | Greiner Bio-One | 82050-774 | Polypropylene, flat bottom |
| Bleach | Walmart | 550646751 | Only use regular bleach, not cleaning bleach |
| Chloroform | BDH | BDH1109-4LG | |
| Dimethyl sulfoxide | BDH | BDH1115-1LP | |
| Isopropyl alcohol | BDH | BDH1133-1LP | |
| Methanol | BDH | BDH20864.400 | |
| Nile red | VWR | TCN0659-5G | |
| Pasteur pipette tips | VWR | 14673-010 | |
| Sodium chloride | BDH | BDH9286-500G | |
| Vegetable oil | Walmart | 9276383 | Any vegetable oil should work as long as it is fresh |
| Zirconia/ silica beads (0.5 mm diameter) | Biospec products | 11079105z | |
| Equipment | |||
| Analytical balance | Mettler-Toledo | XS205DU | Capable of at least 4 decimal accuracy |
| Bead homogenizer | Omni | 19-040E | |
| Benchtop micro centrifuge | Thermo | Heraeus Fresco 21 with 24x2 | Including rotor capable of handling 1.5 and 2 mL tubes |
| Dry block heater | VWR | 75838-282 | Including dry block for a microplate |
| Freeze dryer | Labconco | 7670520 | 2.5L freeze drying system |
| Large benchtop centrifuge | Thermo | Heraeus Megafuge 16R Tissue | Including rotors capable of handling 400 mL bottles, 50 mL tubes, and 15 mL tubes |
| Microplate reader | Molecular Devices | SpectraMax M2 | Capable of reading absorbance and fluorescence |
| Vortex mixer | VWR | 10153-838 |
Referenzen
- Prandini, J. M., et al. Enhancement of nutrient removal from swine wastewater digestate coupled to biogas purification by microalgae Scenedesmus spp. Bioresource Technology. , 67-75 (2016).
- Liu, C., et al. Phycoremediation of dairy and winery wastewater using Diplosphaera sp. MM1. Journal of Applied Phycology. 28 (6), 3331-3341 (2016).
- Passero, M., Cragin, B., Coats, E. R., McDonald, A. G., Feris, K. Dairy Wastewaters for Algae Cultivation, Polyhydroxyalkanote Reactor Effluent Versus Anaerobic Digester Effluent. BioEnergy Research. 8 (4), 1647-1660 (2015).
- Hodgskiss, L. H., Nagy, J., Barnhart, E. P., Cunningham, A. B., Fields, M. W. Cultivation of a native alga for biomass and biofuel accumulation in coal bed methane production water. Algal Research. 19, 63-68 (2016).
- Gao, C., et al. Oil accumulation mechanisms of the oleaginous microalga Chlorella protothecoides revealed through its genome, transcriptomes, and proteomes. BMC Genomics. 15, (2014).
- Burch, A. R., Franz, A. K. Combined nitrogen limitation and hydrogen peroxide treatment enhances neutral lipid accumulation in the marine diatom Phaeodactylum tricornutum. Bioresource Technology. 219, 559-565 (2016).
- Brennan, L., Owende, P. Biofuels from microalgae--A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable Sustainable Energy Reviews. 14 (2), 557-577 (2009).
- Branyikova, I., et al. Microalgae - Novel highly efficient starch producers. Biotechnology and Bioengineering. 108 (4), 766-776 (2010).
- Chalima, A., et al. Utilization of Volatile Fatty Acids from Microalgae for the Production of High Added Value Compounds. Fermentation. 3 (4), (2017).
- Harun, R., Singh, M., Forde, G. M., Danquah, M. K. Bioprocess engineering of microalgae to produce a variety of consumer products. Renewable and Sustainable Energy Reviews. 14 (3), 1037-1047 (2010).
- Liu, L., et al. Development of a new method for genetic transformation of the green alga Chlorella ellipsoidea. Molecular biotechnology. 54 (2), 211-219 (2013).
- Cheng, J., et al. Mutate Chlorella sp. by nuclear irradiation to fix high concentrations of CO2. Bioresource Technology. 136, 496-501 (2013).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Sales, C. M., Au, Comparison of Scale in a Photosynthetic Reactor System for Algal Remediation of Wastewater. Journal of Visualized Experiments. (121), e55256 (2017).
- Higgins, B. T., et al. Cofactor symbiosis for enhanced algal growth, biofuel production, and wastewater treatment. Algal Research. 17, 308-315 (2016).
- Higgins, B., et al. Algal-bacterial synergy in treatment of winery wastewater. Nature Clean Water. 1 (6), (2017).
- Higgins, B. T., et al. Impact of thiamine metabolites and spent medium from Chlorella sorokiniana on metabolism in the green algae Auxenochlorella prototheciodes. Algal Research. 33, 197-208 (2018).
- Lépinay, A., et al. First insight on interactions between bacteria and the marine diatom Haslea ostrearia: Algal growth and metabolomic fingerprinting. Algal Research. 31, 395-405 (2018).
- Franchino, M., Comino, E., Bona, F., Riggio, V. A. Growth of three microalgae strains and nutrient removal from an agro-zootechnical digestate. Chemosphere. 92 (6), 738-744 (2013).
- Choix, F. J., Lopez-Cisneros, C. G., Mendez-Acosta, H. O. Azospirillum brasilense Increases CO2 Fixation on Microalgae Scenedesmus obliquus, Chlorella vulgaris, and Chlamydomonas reinhardtii Cultured on High CO2 Concentrations. Microbial Ecology. 76 (2), 430-442 (2018).
- Higgins, B., VanderGheynst, J. Effects of Escherichia coli on mixotrophic growth of Chlorella minutissima and production of biofuel precursors. PLoS One. 9 (5), e96807 (2014).
- Higgins, B., Thornton-Dunwoody, A., Labavitch, J. M., VanderGheynst, J. S. Microplate assay for quantitation of neutral lipids in extracts from microalgae. Analytical Biochemistry. 465, 81-89 (2014).
- Tanadul, O. U., Vandergheynst, J. S., Beckles, D. M., Powell, A. L., Labavitch, J. M. The impact of elevated CO2 concentration on the quality of algal starch as a potential biofuel feedstock. Biotechnology and Bioengineering. 111 (7), 1323-1331 (2014).
- Folch, J., Lees, M., Sloane Stanley, G. H. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- Higgins, B. T., et al. Informatics for improved algal taxonomic classification and research: A case study of UTEX 2341. Algal Research. 12, 545-549 (2015).
- Garrett, R. H., Grisham, C. M. . Biochemistry. , 578-730 (2012).
- de-Bashan, L. E., Trejo, A., Huss, V. A. R., Hernandez, J. -. P., Bashan, Y. Chlorella sorokiniana UTEX 2805, a heat and intense, sunlight-tolerant microalga with potential for removing ammonium from wastewater. Bioresource Technology. 99 (11), 4980-4989 (2008).
- Wang, Q., Higgins, B., Ji, H., Zhao, D. . Annual International Meeting of the ASABE. , (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten