Method Article
Lentivirali terapia genica mediata da vettore di epatociti Ex Vivo per trapianto autologo nei suini
In questo articolo
Riepilogo
Questo protocollo è destinato per descrivere la consegna di porcino dell'epatocita isolamento ed ex vivo del gene per curare modelli di malattie metaboliche tramite trapianto autologous della cellula. Anche se questo particolare modello gode di vantaggi unici che favoriscono la riuscita terapia, l'applicazione è una Fondazione pertinente all'indirizzo di indicazioni e altre malattie.
Abstract
La terapia genica è una scelta ideale per curare molti errori congeniti del metabolismo del fegato. Ex-vivo, vettori lentivirali sono stati utilizzati con successo nel trattamento di molte malattie ematopoietiche in esseri umani, come il loro utilizzo offre l'espressione del transgene stabile grazie alla capacità del vettore di integrare nel genoma ospite. Questo metodo viene illustrata l'applicazione di ex vivo terapia genica degli epatociti a un grande modello animale della tirosinemia ereditaria di tipo I. Questo processo è costituito da 1) isolamento di epatociti primari dall'animale autologo donatore/ricevente, 2) ex vivo consegna del gene tramite trasduzione degli epatociti con un vettore lentivirale e 3) autologo trapianto di epatociti corretti tramite portale della vena di iniezione. Successo del metodo si basa generalmente su rimozione efficiente e sterile della resezione epatica, un'attenta gestione dell'esemplare asportato per l'isolamento degli epatociti vitali sufficienti per trasduzione del ri-innesto, ad alta percentuale di cellule isolate, e procedure chirurgiche asettiche in tutto per prevenire l'infezione. Guasto tecnico presso uno di questi passaggi si tradurrà in basso rendimento degli epatociti trasdotte praticabili per trapianto autologo o infezione dell'animale donatore/ricevente. Il modello di maiale di tirosinemia ereditaria di tipo 1 umano (HT-1) scelto per questo approccio è unicamente suscettibile di tale metodo, come anche una piccola percentuale di attecchimento di cellule corrette porterà alla ripopolazione del fegato con le cellule sane, basate su un potente vantaggio selettivo negli epatociti nativo-malato. Anche se questa selezione di crescita non sarà vera per tutte le indicazioni, questo approccio è una Fondazione per l'espansione in altre indicazioni e permette per la manipolazione di questo ambiente di affrontare ulteriori malattie, sia all'interno del fegato e oltre, controllo per l'esposizione al vettore virale e opportunità per fuori bersaglio tossicità e carcinogenicità.
Introduzione
Errori congeniti del metabolismo del fegato sono una famiglia di malattie genetiche che colpiscono collettivamente altretanto come 1 in 800 nati vivi1. Molte di queste malattie sono singolo gene difetti2 e può essere curate in modo funzionale con l'introduzione di una singola copia corretta del gene interessato in un numero sufficiente di epatociti3. La percentuale effettiva di epatociti che deve essere corretto varia a seconda della malattia4 e dipende in larga misura la natura della proteina che codifica, ad esempio, viene escreta proteine contro citoplasmico. Nella maggior parte dei casi, l'efficacia di qualsiasi trattamento per la malattia metabolica è facilmente analizzato attraverso la presenza di biomarcatori spesso disponibile nella circolazione.
HT-1 è un errore innato del metabolismo del fegato che deriva da un difetto in fumarylacetoacetate idrolasi (FAH)5, l'ultimo passaggio enzimatico in tirosina metabolismo6. Deficit di FAH conduce alla generazione di metaboliti tossici nel fegato che può causare morte e insufficienza epatica acuta o in forma cronica della malattia possono causare cirrosi e carcinoma epatocellulare. La malattia è clinicamente gestita dall'amministrazione di 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (NTBC), un inibitore di piccola molecola di un enzima a Monte di FAH nel metabolismo della tirosina. La malattia fornisce un ambiente ideale in cui sperimentare tecniche di terapia genica, come riuscita correzione di anche un piccolo numero di epatociti alla fine si tradurrà nel ripopolamento del fegato intero con cellule corrette nei modelli animali piccoli e grandi 7 , 8. ciò si verifica perché rettificato le cellule hanno un vantaggio di sopravvivenza profonda sopra cellule non corrette a causa dell'accumulo di metaboliti tossici in quest'ultimo. La perdita degli epatociti non corretti consente l'espansione selettiva degli epatociti corretti coerenza con la capacità rigenerativa del fegato. Il trattamento può essere seguito facilmente misurando la diminuzione nei livelli di tirosina ed eritrocitaria dopo trapianto di circolazione.
Al fine di giustificare la natura invasiva della procedura, che comprende un'epatectomia parziale, l'obiettivo di questo approccio deve essere una cura durevole. Pertanto, vettori lentivirali incompetente replica vengono utilizzati perché saranno integrati stabilmente nel genoma dell'epatocita9. garantire la consegna del gene corretto per tutte le cellule della figlia come il fegato cresce e si espande per sostituire la perdita rapida di cellule non rivedute. Questo è vantaggioso su vettori virali adeno associato (AAV), che esiste principalmente come episomi che possono essere passati solo a una singola cella della figlia durante la mitosi10 perdendo così qualsiasi effetto della terapia in poche settimane.
Anche se un corpo crescente di letteratura supporta la sicurezza di lentivirus11, preoccupazioni su eventi genotossici sono mitigati limitando la trasduzione di cellule dell'ospite in un ambiente controllato in vitro . Vettore libero mai sistemica è introdotto all'host quando questo metodo viene eseguito, limitando l'esposizione agli epatociti che sarà reintrodotto con trapianto autologo tramite la vena portale.
Questo rapporto descrive il metodo di chirurgica ed ex vivo le procedure utilizzate per isolare gli epatociti per terapia genica ex vivo e il conseguente trapianto autologo12 per il trattamento del maiale HT-18. Il processo completo include 1) un'epatectomia parziale che serve come fonte di epatociti e un stimolo di crescita per fegato dell'host, 2) isolamento degli epatociti dal fegato asportato seguita da ex vivo correzione genica e infine 3) reintroduzione della epatociti corretti nuovamente dentro l'host. Il metodo descritto è applicabile a tutti i grandi modelli animali con alcune modifiche, ma solo il maiale di FAH-carenti13 avrà il vantaggio dell'ambiente selettivo per gli epatociti corretti.
Protocollo
Animale tutte le procedure sono state eseguite in conformità con le linee guida istituzionali ed erano esaminate e approvate dal istituzionale Animal Care ed uso Committee (IACUC) prima di studio condotta. Le procedure descritte qui sono state effettuate su maschio e femmina grande bianco allevamento di maiali (background genetico di 50% Landrace/50% Large White) fino a 3 mesi di età che sono ritenuti sani e adatti per la chirurgia. Gli animali sono alloggiati socialmente se non considerato incompatibile dal personale istituzionale cure veterinarie. Gli animali sono alimentati livelli appropriati di chow due volte quotidiane e osservati per segni clinici di cura personale almeno una volta al giorno.
1. preparazione per la chirurgia
- Somministrare 5 mg/kg telazol e xilazina 2 mg/kg per via intramuscolare per indurre sedazione. Amministrare la buprenorfina SR per via sottocutanea alla dose di 0,18 mg/kg per l'analgesia post-operatoria (anticipato l'analgesia da questa dose sarà fino a 72 h). Controllare manualmente l'animale per le risposte verificare sedazione.
- Una volta sedata, inserire un catetere endovenoso in una vena periferica dell'orecchio per accesso farmacologico.
- Amministrare la cefazolina 25 mg/kg per via endovenosa ed intramuscolare 5 mg/kg di ceftiofur pre-operatively.
- Amministrare la normale soluzione salina per via endovenosa per mantenere la pressione sanguigna e la frequenza cardiaca entro i limiti fisiologici normali durante tutta la procedura.
- Posto un tubo orogastrico per decomprimere lo stomaco. Eseguire l'intubazione endotracheale con un tubo endotracheale di dimensione appropriate, verificare il corretto posizionamento comprimendo il petto manualmente per rilevare l'espirazione e quindi ventilare meccanicamente l'animale con isoflurane 1 – 3%.
- Posizionare l'elettrocardiogramma (ECG) conduce, polsino di pressione sanguigna, sonda di temperatura e pulsossimetro per monitorare e registrare i segni vitali. Metti l'animale in posizione supina, strofinare l'addome da gabbia toracica al bacino con betadine e drappo sterilmente.
- Ventilare soggetto con 1-3% isoflurane durante la procedura per mantenere un aereo chirurgico di anestesia. Continuare a monitorare i segni vitali per le modifiche e regolare di conseguenza isoflurano per mantenere la frequenza cardiaca a livelli pre-incisione se la pressione del sangue scende drasticamente, ridurre isoflurano e avviare gli agenti istituzionalmente approvato per ripristinare la vitalità, come epinefrina endovenosa.
- Registrare la frequenza cardiaca, frequenza respiratoria, pressione arteriosa e temperatura corporea su un record di procedura chirurgica per tenere traccia e mantenere il benessere degli animali secondo criteri di istituzione-specifiche per garantire la conformità con gli standard di benessere degli animali grandi.
2. laparoscopica Hepatectomy parziale
- Eseguire la voce del sito porta iniziale utilizzando una tecnica aperta Hassen cephalad al umbilicus. Quando viene visualizzata la finestra di peritoneo, introdurre in modo sicuro un trocar 12 millimetri nella cavità addominale. Passare un 5 mm, 30°, portata attraverso questa porta.
- Sniffare l'addome con CO2 a 15 mmHg. Sotto visualizzazione diretta con la telecamera laparoscopica, posizionare due porte aggiuntive 5 mm triangolando sul lobo laterale di sinistra del fegato. Posizionamento esatto dei porti dipenderà dalla dimensione e anatomia dell'animale.
- A questo punto, posizionare il laparoscopio in una delle porte 5 mm.
- Identificare il segmento laterale di sinistro del fegato sul punto della fessura principale del lobo di sinistra. Questa fenditura separa i segmenti laterali sinistro e medicali. Garantire le strutture portale insieme con la vena epatica lungo questa fessura usando una spillatrice chirurgica (Vedi Tabella materiali). Transetto del parenchima attraverso questa fessura utilizzando sequenziali infornamenti dalla graffatrice utilizzando 60, 45 o carichi lungo vascolare 30 mm.
- Quando la resezione parenchima è completa, è necessario valutare il fegato residuo per garantire un'adeguata emostasi. Controllare qualsiasi sanguinamento dal parenchima con cautery o sutura.
- Recuperare la sezione del fegato utilizzando atraumatiche endoscopici e un sacchetto di retrieval endoscopica del tessuto.
- Rimuovere le porte e chiudere l'incisione porta 12 mm a tre strati con sutura interrotta dimensione 0 per la fascia del midline, un suturare corrente 2-0 per lo strato cutaneo profondo e un suturare corrente di 4-0 per lo strato di subcuticular. Le porte di 5 mm possono essere chiuso in un unico strato con 2-0.
- Posizionare una garza sterile sulle incisioni (Vedi Tabella materiali).
- Quando le cellule sarà pronte in meno di 4 ore, mantenere gli animali in anestesia generale postoperatorio fino al momento del autotransplantation.
- In alternativa, se le manipolazioni delle cellule richiedono periodi più lunghi (tali da permettere la formazione di sferoidi degli epatociti o lunghi periodi di trasduzione/selezione basati su singole applicazioni di questo metodo) permettere all'animale di recuperare da anestesia e ripetere la passaggi di induzione anestetica prima del autotransplantation quando le cellule sono pronte.
3. dell'epatocita isolamento
- Collegare una pompa peristaltica con perfusione impostato per fornire soluzioni di dispersione caldo (mantenuti in bagno di acqua di 43 ° C) per cateteri siano disposti nei grandi vasi esposti della sezione del fegato, tale che la temperatura della soluzione è 38 ° C su Introduzione al tessuto. Tutti i tubi, attrezzature e soluzioni devono essere mantenute sterile affinché che le cellule sono adatte per il trapianto.
- Adescare la pompa e la tubazione con Per II fino a un rubinetto posizionato per passare ai e al II consegna al tessuto. Passare il rubinetto per il Per I Posizionare e adescare il resto del set di tubi, riempiendo un gorgogliatore in linea completamente per evitare l'introduzione di bolle d'aria nel tessuto.
- Preparare una trasversale pulita tagliata perpendicolarmente la circolazione epatica per rivelare le sezioni trasversali dei rami della vena portale e vene epatiche per cateterizzazione.
- Cateterismo disponibili vene esposte con un catetere aderente per evitare la fuoriuscita del perfusato. Incannulare almeno 1 portale e 1 della vena epatica per garantire un'adeguata perfusione del tessuto.
- Assicurarsi che i catheter(s) siano innescato/libero dell'aria prima di inserire il catetere in vena.
- Irrorare con il caldo Per I a 100 mL/min, passando il tubo di scarico da vena a vena ogni 30 secondi per 1 min. ciclo disponibili tutte le vene per 15 – 20 min. Durante Per I set di infusione, un tubo di evacuazione per svuotare il cassetto di routine in un contenitore per rifiuti sotto vuoto.
- Passare a Per II a 100 mL/min, escursioni in bicicletta attraverso le vene come con Per I, per un totale di 30 min. Durante Per II, è possibile utilizzare una pompa di ritorno per riciclare Per II Torna al serbatoio per Risomministrazione conservare la preparazione dell'enzima attivo. Impostare la pompa di ritorno a meno della pompa di efflusso (cioè, 94 mL/min), facendo attenzione a non rimettere eccessiva aria nel flacone di origine.
- Se si rompe la capsula del fegato, questo tempo può essere ridotto.
- Se il fegato non è completamente digerito (non rimane fossette con una leggera pressione focale) possono essere eseguite ulteriori 5 min di aspersione.
- Occasionalmente (circa ogni 5 minuti) documento temperatura superficiale il gorgogliatore e/o fegato affinché gli epatociti non si stanno raffreddando. Se il fegato sta facendo freddo (< 35 ° C) aumentare il calore del bagno d'acqua per ripristinare la temperatura del fegato più vicino a 38 ° C. Il fegato deve blanche come procede la perfusione.
- Rimuovere il fegato alla piastra sterile o capsula di Petri per il trasporto alla cappa di cultura cellulare. Copertura campo sterile con un telino sterile per mantenere l'integrità durante l'elaborazione dell'epatocita.
- Esporre la sezione del fegato da telo sterile e immergere il fegato con media di lavaggio freddo dell'epatocita (HWM). Interrompere la capsula trascinando le forbici nella parte superiore. Indossare guanti sterili, massaggiare delicatamente il fegato per rilasciare gli epatociti nel mezzo.
- Filtrare la HWM contenente gli epatociti attraverso una garza sterile in bottiglie da centrifuga grande (~ 200 mL). Lavare gli epatociti attraverso la procedura seguente in triplice copia, combinando il pellet cellulare dalle bottiglie multiple dopo la risospensione prima (come applicabile):
- Centrifugare a 50 x g, 5 min, 4 ° C.
- Aspirare e risospendere in 150 mL di HWM.
- Lasciare il pellet nella HWM dopo il lavaggio 3rd .
- Contare la concentrazione cellulare mediante un emocitometro o un altro dispositivo, come disponibile. Queste cellule sono ora pronte per manipolazione ex vivo di interesse, tra cui la terapia genica, ordinamento delle cellule o altra specializzazione prima del autotransplantation. Volume finale di HWM può essere regolata per una concentrazione specifica (cellule/mL) di destinazione.
4. dell'epatocita trasduzione
- Risospendere gli epatociti in media (medium di eagle modificate di Dulbecco [DMEM], 10% di siero fetale bovino [FB], penicillina-streptomicina, 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acido [HEPES], desametasone, fattore di crescita epidermico [EGF] e NTBC) a 1 – 2 milioni di cellule per mL in una provetta conica sul ghiaccio.
- Scongelare il vettore lentivirale a temperatura ambiente e aggiungere alla provetta conica sul ghiaccio presso il molteplicità 20 bersaglio dell'infezione (MOI) per associare le celle. Ruotare le cellule a 4 ° C a 10 giri/min per 90 min associare il vettore virale alla superficie delle cellule.
- Trasferimento tubi a 37 ° C per 30 – 40 min. Inverti per mescolare ogni 5 minuti per facilitare il vettore di trasduzione delle cellule associate.
- Centrifugare le cellule a 50 x g a 4 ° C per 4 min. pellet e risospendere in soluzione salina a concentrazione desiderata sul ghiaccio. Ripetere questo lavaggio per garantire la rimozione di qualsiasi vettore non associato dalla preparazione.
- Se possibile, piastra sufficiente aliquote delle cellule (cioè, 500.000 cellule per pozzetto in un 6 celle ben piastra di coltura) per verificare la redditività, efficienza di trasduzione, adesione, ecc.
Nota: Non è spesso possibile valutare questi parametri prima del autotransplantation, soprattutto per le procedure di stesso-giorno. Ad esempio, la procedura descritta nel presente documento impiegato un cDNA di Fah senza tag sotto il controllo del promotore epatocitari alfa-1 antitripsina, che non era prontamente saggiabili negli epatociti prima del trapianto. Tuttavia, queste cellule placcate possono essere analizzate dopo il autotransplantation come indicatore di successo di trasduzione (vale a dire, tramite Western blotting) o un predittore del successo generale della procedura.
5. dell'epatocita trapianto
- Identificare la vena portale mediante ultrasuoni utilizzando un trasduttore di 2 a 5 MHz. Dirigere un 18 G, ago 5 pollici verso la vena principale prossimale alla sua biforcazione.
- Iniziare infusione lenta manuale di a 1 x 109 epatociti (circa 10 g) utilizzando una siringa. Monitoraggio delle pressioni portale durante il trapianto usando un catetere di infusione.
- Se aumenta la pressione portale più di 8 mmHg di sopra della linea di base, sospendere infusione e permettere la pressione tornare ai livelli basali.
- Se portale pressioni non ritornano ai valori basali dopo una sospensione infusione per cinque minuti, interrompere l'infusione.
- Dopo trapianto e rimozione del catetere, è necessario utilizzare l'ecografia per valutare la presenza di eventi trombotici e inoltrare il flusso nella vena portale.
6. manutenzione e recupero postoperatorio
- Spostare soggette a un'area di ripristino corretto e osservare fino a quando l'animale è completamente ambulatoria, monitoraggio frequenza cardiaca, saturazione dell'ossigeno e la temperatura corporea ogni 15-30 min. Mantieni la temperatura corporea con coperte calde o un involucro di aria riscaldata, come necessario.
- Amministrare omeprazole 1 mg/kg per via orale al giorno (fino alla fine dello studio) per ridurre le possibilità di ulcerazione gastrica che può verificarsi con attacchi di inappetenza.
- Postoperatorio, l'animale è monitorato da vicino da lab e personale veterinario e in genere non richiede ulteriori antidolorifici separata dalla dose di buprenorfina pre-operative. Se si osservano segni di sofferenza/dolore da personale qualificato cure veterinarie (incisione a guardia, inappetenza, letargia), agenti anti-infiammatori (cioè, Carprofen) possono essere somministrati.
7. le ricette
- Vedere la tabella 1 per ricette utilizzate in questo protocollo.
| Reagente | HWM | Reagente | Per I (10x) | Per II (10x) |
| Williams'-E polvere (g/L) | 10,8 | NaCl (g/L) | 83 | 39 |
| NaHCO3 (g/L) | 2.2 | KCl (g/L) | 5 | 5 |
| HEPES (g/L) | 2.6 | HEPES (g/L) | 24 | 240 |
| Pen/Strep (100 x, mL/L) | 10 | EGTA (g/L) | 9.5 | - |
| Siero bovino fetale (mL/L) | 100 | N-acetile-L-cisteina | 8 | 8 |
| pH | 7.3 | (N-A-C, g/L) | ||
| Nitroglicerina (mL/L) | 5 | 5 | ||
| CaCl2 2 H2O (g/L) | - | 7 | ||
| Collagenasi D (mg/mL) | - | 0.2 | ||
| pH | 7.4 | 7.6 |
Tabella 1: Ricette per le soluzioni utilizzati nell'isolamento degli epatociti da sezioni del fegato.
Risultati
La resezione epatica e trapianto autologo sono rappresentati schematicamente in Figura 1. In un gruppo rappresentativo di 5 maiali che hanno subito la resezione epatica, la maggior parte avevano rendimenti di > 1 x 109 epatociti con circa 80% di vitalità (tabella 2), fornendo un sacco di cellule per qualsiasi tipo di desiderato manipolazioni, tra cui gene terapia. Successiva cultura della parte non sottoposti a trapianto di epatociti preparati da ciascuno di quei 5 maiali hanno mostrati buona redditività e di adesione, con morfologia tipica dell'epatocita 46 ore dopo trasduzione e placcatura iniziale (Figura 2). Questi risultati sono rappresentativi di una corretta preparazione, mentre scarsi risultati sarebbero indicati con basso numero di cellule, attuabilità o minima aderenza delle cellule in un monostrato.
Una biopsia del fegato prima del trattamento del maiale Fah- / - non mostra nessuna espressione di FAH tramite immunoistochimica (Figura 3). Attecchimento iniziale varia dalla quantità di cellule reintrodotta durante il trapianto. Frequenze di trasduzione di epatociti suina in vitro utilizzando lentivirus presso un MOI di 10 TU / dell'epatocita è tipicamente 70 – 100%. Le cellule engrafted clonally si espanderà nel fegato Fah- / - , fino a quando l'intero fegato viene ripopolato da cellule corrette. Le biopsie rappresentative a 2, 6 e 12 mesi dimostrano un diario dell'espansione delle cellule di FAH-positiva, che è in genere completa a 12 mesi dopo il trapianto (Figura 3). Anche una bassa percentuale di attecchimento dovrebbe alla fine ripopolare il fegato, anche se le tariffe effettive attecchimento iniziale non sono state valutate in questo esperimento.
I maiali sono attentamente monitorato post-trapianto per aumento di peso, come l'omissione di prosperare è un segno che non c'è abbastanza corretto gli epatociti è presente. In questo caso gli animali sono pedalati torna su NTBC finché la popolazione dell'epatocita corretta è sufficiente per consentire il completo svezzamento dalla droga. Valutazione di biomarcatori di circolazione offre un facile accesso per seguire la terapia. Una volta che un animale ha raggiunto circa il 20% ripopolamento degli epatociti corretti a livello di fegato, tirosina ed eritrocitaria normalizzerà rispetto agli animali di selvaggio-tipo (Figura 4A). Inoltre, il sotto-trattati o non trattato Fah- / - maiale dimostra i cambiamenti del fegato fibrotici simili visti negli esseri umani interessati, che possono essere seguiti da colorazione tricromica di Masson di biopsie di serie8. Indicatori sostitutivi di danno epatico in corso possono essere valutati analizzando fare circolare gli enzimi del fegato, quali aspartato aminotransferasi e fosfatasi alcalina. Mentre gli animali non riveduti Visualizza elevazione significativa in entrambi i parametri rispetto agli animali wild-type, la terapia genica ex vivo ritorna questi valori del siero normale (Figura 4B e 4C). Infine, generale salute metabolica del fegato è interrotto nella non trattata Fah- / - maiali, come indicato dalle elevazioni in circolazione ammoniaca. Ripopolamento del fegato con cellule corrette ristabilisce i livelli di selvaggio-tipo di ammoniaca (Figura 4).

Figura 1: Hepatectomy e trapianto autologo. (In senso orario dall'alto) Una resezione parziale del fegato viene eseguita sull'argomento per fornire una fonte degli epatociti e stimolare la rigenerazione del fegato. Gli epatociti sono isolati da fegato resecato (cellule blu), trasdotte ex vivo con il vettore lentivirale contenente il transgene di interesse (cellule marrone) e quindi le cellule trasdotte sono autologously trapiantato torna all'animale di origine tramite iniezione della vena portale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: epatociti primari maiale da sezioni del fegato. Epatociti sono stati coltivati dalle resezioni epatiche da 5 diversi maiali, transdotte con un vettore lentivirale e ha permesso di crescere per 48 h per dimostrare l'adesione ai piatti di cultura, vitalità, purezza e morfologia. Queste valutazioni qualitative in vitro servono come indicatori surrogati per la probabilità di successo di attecchimento in vivo per ogni preparazione. Clicca qui per visualizzare una versione più grande di questa figura.
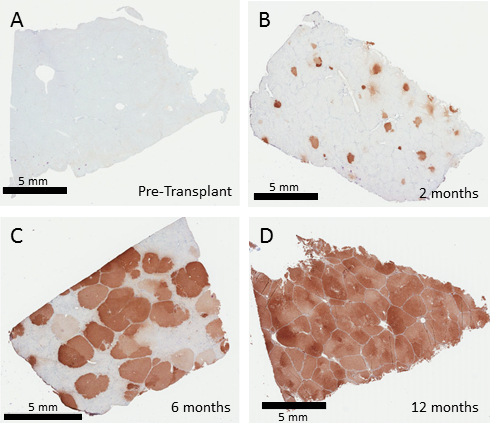
Figura 3: Epatociti corretti ripopolare il fegato di maiale Fah- / . FAH immunohistochemistry da mesi le biopsie del fegato 0, 2, 6 e 12 dopo terapia genica ex vivo degli epatociti autologhi. Non trattata Fah- / - Visualizza suini senza cellule di FAH-positive nel fegato (A). Due mesi dopo il trapianto (B), singoli fuochi degli epatociti positivi FAH sono veduti, che poi subiscono espansione per sostituire 50 – 60% del fegato a 6 mesi (C) seguite da sostituzione completa, visto a 12 mesi (D). Clicca qui per visualizzare una versione più grande di questa figura.
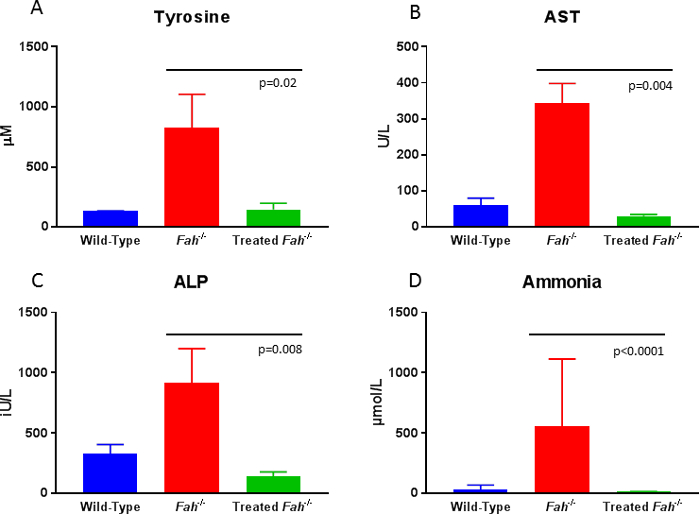
Figura 4: Biochimica del siero a 10 mesi dopo la terapia genica ex vivo nei suini Fah - / . 10 mesi dopo la terapia, tirosina, aspartato aminotransferasi14, fosfatasi alcalina (ALP) e livelli di ammoniaca sono significativamente più bassi di animali carenti di FAH non trattati e sono indistinguibili dai livelli di selvaggio-tipo. I dati sono stati analizzati per il significato utilizzando il test di Mann-Whitney U (valori dip come presentato). Clicca qui per visualizzare una versione più grande di questa figura.
| Maiale | Totale di cellule (x 106) | Cellule vive (x 106) | Vitalità (%) |
| 1 | 1.381 | 1.160 | 84 |
| 2 | 1.000 | 770 | 77 |
| 3 | 1.213 | 995 | 82 |
| 4 | 789 | 671 | 85 |
| 5 | 1318 | 975 | 74 |
| Media | 1.140 | 914 | 80 |
| St Dev | 244 | 194 | 5 |
Tabella 2: Rappresentante dell'epatocita risultati da isolamenti primari da 5 maiali.
Discussione
Questo rapporto descrive un ex vivo autologo approccio di terapia genica per curare un modello porcino di HT-1. Si tratta di un'epatectomia parziale, seguita da ex vivo dell'epatocita isolamento e trasduzione di epatociti isolati con lenti virus che trasportano il transgene correttivo. Corretti gli epatociti autologhi sono poi trapiantati torna all'animale carente di FAH attraverso la vena porta8. Anche se il metodo descritto è applicabile a tutti i grandi modelli animali con alcune modifiche, il maiale di FAH-carenti ha il vantaggio unico di un ambiente altamente selettivo per cellule corrette13,15. Questo metodo è una cura efficace per HT-1, come animali trattati mostrano crescita indipendente NTBC con normalizzazione dei metaboliti misurati biochimicamente e biomarcatori infiammatori del fegato, prevenzione della cirrosi e HCC e l'inversione completa di fibrosi precoce vista con NTBC in bicicletta. Inoltre, uno studio più recente che coinvolgono un'approfondita analisi istologica non ha dimostrato nessun rilevabile cellule non rivedute, fibrosi, cirrosi o carcinogenicità 3 anni post terapia (manoscritto nella recensione). Tuttavia, l'utilità dello sfondo FAH-null può servire come strumento per consentire la valutazione di una vasta gamma di interrogatori in epatocita fisiologia e malattia indicazioni oltre HT-1.
Relativo successo della procedura può essere valutato dal numero di cicli di NTBC richiesto prima che il soggetto può essere completamente svezzato da questo farmaco protettivo. Nelle numerose iterazioni con questo modello e in altri modelli animali piccoli di HT-1, circa il 20% di correzione è necessario prima crescita indipendente NTBC è raggiunto. Altre escursioni in bicicletta con NTBC è indicativo di attecchimento iniziale scarsa/vitalità, affezione epatica avanzata al momento dell'attecchimento iniziale, o l'espressione del transgene povero, anche se altri fattori possono anche svolgere un ruolo. Gli indicatori biochimici di salute del fegato (AST, ALT e ammoniaca) sono prontamente disponibili e offrono spaccato nella misura di espansione corretto dell'epatocita, ma verifica finale di cura fenotipica è meglio dimostrato tramite la normalizzazione della tirosina del siero e eritrocitaria e la conferma istologica di FAH-esprimendo gli epatociti in assenza di fibrosi. Questo avviene quando il fegato è stato ripopolato con epatociti corretti.
L'efficacia della procedura si basa maggiormente l'integrità degli epatociti, che deve essere mantenuta sterile e praticabile durante l'intero processo di isolamento, trasduzione e trapianto. Reintroduzione degli epatociti non vitali o non corretti non salverà il fenotipo, e un'infruttuosa procedura potrebbe richiedere mesi di osservazione del soggetto per verificare.
In questo modello, l'espressione del transgene buona dell'enzima FAH funzionale è un requisito minimo per il ripopolamento del fegato. Lentivirus è solo un modo per fornire un'efficace copia del transgene. Questo metodo permetterà la possibilità per l'utilizzo di altri sistemi di consegna inclusi sistemi di non-virali e quelle rivolte al difetto genomic specifico di editing. In definitiva, questo modello consentirà una vasta gamma di possibilità, tra cui la correzione di altri difetti nel bioreattore carente FAH. Fino a quando la cella trapiantata esprime un enzima funzionale di FAH, qualsiasi altra modificazione delle cellule ex vivo sarebbe anche essere propagata. Ciò consentirebbe uno qualsiasi degli errori congeniti del metabolismo del fegato per essere corretto in background FAH- / . Come l'espansione degli epatociti corretti ripopola in ultima analisi, il fegato, pertinenti numeri di epatociti per qualsiasi indicazione di malattia possono essere raggiunto, che sottolinea il valore di questo modello e procedura come una scienza di base e un modello preclinico di terapia.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori ringraziano Duane Meixner per competenza nell'eseguire l'iniezione della vena portale, Steve Krage, Joanne Pederson e Lori Hillin per assistenza durante le procedure chirurgiche. Questo lavoro è stato supportato dalla Fondazione dell'ospedale del Minnesota Minnesota di medicina rigenerativa e dei bambini. R.D.H. è stato finanziato attraverso un premio NIH K01 DK106056 e un Mayo Clinic Center per medicina rigenerativa Career Development Award.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (NTBC) | Yecuris | 20-0027 | |
| 12 mm Trocar | Covidien | B12STS | |
| 5 mm Trocar | Covidien | B5SHF | |
| Endo Surgical Stapler 60 | Covidien | EGIA60AMT | |
| Endo Surgical Stapler 45 | Covidien | EGIA45AVM | |
| Endo Surgical Stapler 30 | Covidien | SIG30AVM | |
| Endo catch bag | Covidien | 173050G | |
| 0 PDS | Ethicon | Z340H | |
| 2-0 Vicryl | Ethicon | J459H | |
| 4-0 Vicryl | Ethicon | J426H | |
| Dermabond | Ethicon | DNX12 | Sterile Dressing |
| Williams’-E Powder | Gibco | ME16060P1 | |
| NaHCO3 | Sigma Aldrich | S8875-1KG | |
| HEPES | Fisher | BP310-1 | |
| Pen/Strep | Gibco | 15140-122 | |
| Fetal Bovine Serum | Corning | 35-011-CV | |
| NaCl (g/L) | Sigma Aldrich | S1679-1KG | |
| KCl (g/L) | Sigma Aldrich | P3911-500G | |
| EGTA (g/L) | Oakwood Chemical | 45172 | |
| N-acetyl-L-cysteine | Oakwood Chemical | 3631 | |
| (N-A-C, g/L) | Sigma Aldrich | A9165-100G | |
| CaCl2 2H2O (g/L) | Sigma Aldrich | 223506-500G | |
| Collagenase D (mg/mL) | Crescent Chemical | 17456.2 | |
| Dulbecco's modified eagle medium (DMEM) | Corning | 15-013-CV | |
| Dexamethasone | Fresenius Kabi | NDC6337 | |
| Epidermal Growth Factor | Gibco | PHG0314 |
Riferimenti
- Mak, C. M., Lee, H. C., Chan, A. Y., Lam, C. W. Inborn errors of metabolism and expanded newborn screening: review and update. Critical Reviews in Clinical Laboratory Sciences. 50 (6), 142-162 (2013).
- Hansen, K., Horslen, S. Metabolic liver disease in children. Liver Transplantation. 14 (5), 713-733 (2008).
- Schneller, J. L., Lee, C. M., Bao, G., Venditti, C. P. Genome editing for inborn errors of metabolism: advancing towards the clinic. BMC Medicine. 15 (1), 43 (2017).
- Brunetti-Pierri, N. Gene therapy for inborn errors of liver metabolism: progress towards clinical applications. Italian Journal of Pediatrics. 34 (1), 2 (2008).
- Carlson, D. F., et al. Efficient TALEN-mediated gene knockout in livestock. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17382-17387 (2012).
- Lindblad, B., Lindstedt, S., Steen, G. On the enzymic defects in hereditary tyrosinemia. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4641-4645 (1977).
- Hickey, R. D., et al. Noninvasive 3-dimensional imaging of liver regeneration in a mouse model of hereditary tyrosinemia type 1 using the sodium iodide symporter gene. Liver Transplantation. 21 (4), 442-453 (2015).
- Hickey, R. D., et al. Curative ex vivo liver-directed gene therapy in a pig model of hereditary tyrosinemia type 1. Science Translational Medicine. 8 (349), (2016).
- Naldini, L., et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272 (5259), 263-267 (1996).
- Bouard, D., Alazard-Dany, D., Cosset, F. L. Viral vectors: from virology to transgene expression. British Journal of Pharmacology. 157 (2), 153-165 (2009).
- Sakuma, T., Barry, M. A., Ikeda, Y. Lentiviral vectors: basic to translational. Biochemical Journal. 443 (3), 603-618 (2012).
- Chowdhury, J. R., et al. Long-term improvement of hypercholesterolemia after ex vivo gene therapy in LDLR-deficient rabbits. Science. 254 (5039), 1802-1805 (1991).
- Elgilani, F., et al. Chronic Phenotype Characterization of a Large-Animal Model of Hereditary Tyrosinemia Type 1. The American Journal of Pathology. 187 (1), 33-41 (2017).
- Patyshakuliyeva, A., et al. Carbohydrate utilization and metabolism is highly differentiated in Agaricus bisporus. BMC Genomics. 14, 663 (2013).
- Hickey, R. D., et al. Fumarylacetoacetate hydrolase deficient pigs are a novel large animal model of metabolic liver disease. Stem Cell Research. 13 (1), 144-153 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon