Method Article
Des gènes induite par le vecteur de la thérapie génique des hépatocytes Ex Vivo pour Transplantation autologue chez le porc
Dans cet article
Résumé
Ce protocole vise à décrire l’isolement et ex vivo livraison de gène porcin hépatocytes pour guérir des modèles de maladies métaboliques par autogreffe de cellules. Bien que ce modèle particulier bénéficie d’avantages uniques qui favorisent une thérapie réussie, l’application est une base pertinente pour traiter les indications et autres maladies.
Résumé
La thérapie génique est un choix idéal pour soigner les nombreuses erreurs innées du métabolisme du foie. Ex vivo, vecteurs LENTIVIRAUX ont été utilisées avec succès dans le traitement de nombreuses maladies hématopoïétiques chez l’être humain, car leur utilisation offre l’expression TRANSGENIQUE stable en raison de la capacité du vecteur d’intégrer dans le génome hôte. Cette méthode illustre l’application de la thérapie génique ex vivo des hépatocytes à un grand modèle animal de la tyrosinémie héréditaire de type I. Ce processus se compose de 1) isolation des hépatocytes primaires de l’animal donneur/receveur autologue, 2) ex vivo la livraison de gène par l’intermédiaire de transduction d’hépatocytes avec un vecteur lentiviral et greffe 3) autologue des hépatocytes corrigés via portail injection de la veine. Succès de la méthode s’appuie généralement sur une suppression efficace et stérile de la résection hépatique, prudente, manipulation de l’échantillon excisé, isolation des hépatocytes viables permettant de re-après, le pourcentage élevé de transduction des cellules isolées, et procédures chirurgicales aseptiques partout pour prévenir l’infection. Une défaillance technique à n’importe lequel de ces étapes se traduira par le faible rendement des hépatocytes de transduite viables pour greffe autologue ou infection de l’animal donneur/receveur. Le modèle de cochon de tyrosinémie héréditaire de type humain 1 (HT-1) choisi pour cette approche est particulièrement favorable à une telle méthode, car même un faible pourcentage de prise de greffe de cellules corrigées conduira au repeuplement du foie avec des cellules saines, basés sur un puissant avantage sélectif sur les hépatocytes natif-malades. Bien que cette sélection de croissance ne sera pas vraie pour toutes les indications, cette approche est une Fondation pour l’expansion dans d’autres indications et permet pour la manipulation de cet environnement pour traiter des maladies supplémentaires, tant à l’intérieur du foie et au-delà, tout en contrôle d’exposition aux vecteurs viraux et possibilité de toxicité hors cible et de la tumorigénicité.
Introduction
Erreurs innées du métabolisme du foie sont une famille de maladies génétiques affectant collectivement autant que 1 dans 800 naissances vivantes1. Nombre de ces maladies sont monogéniques défauts2 et peuvent être fonctionnellement guéries en introduisant une seule copie corrigée du gène affecté dans un nombre suffisant d’hépatocytes3. Le pourcentage réel d’hépatocytes qui doit être corrigée varie selon la maladie4 et est largement tributaire de la nature de la protéine qu'il encode, par exemple, les protéines sécrétoires versus cytoplasmique. Dans la plupart des cas, l’efficacité d’un traitement pour une maladie métabolique est facilement dosée par la présence de biomarqueurs souvent disponibles dans la circulation.
HT-1 est une erreur innée du métabolisme du foie qui résulte d’un défaut de fumarylacetoacetate hydrolase (FAH)5, la dernière étape enzymatique dans le métabolisme de la tyrosine6. Carence en FAH mène à l’accumulation de métabolites toxiques dans le foie qui peut causer la mort et insuffisance hépatique aiguë ou dans la forme chronique de la maladie peut provoquer une cirrhose et le carcinome hépatocellulaire. Cliniquement, la maladie est gérée par l’administration de 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (NTBC), un inhibiteur d’une enzyme en amont de FAH dans le métabolisme de la tyrosine de petite molécule. La maladie fournit un environnement idéal permettant de tester les méthodes de thérapie génétique, comme correction réussie de même un petit nombre des hépatocytes entraînera finalement le repeuplement du foie entier avec cellules corrigées dans des modèles animaux petits et grands 7 , 8. cela se produit car le corrigé, les cellules ont un avantage de survie profond sur des cellules non corrigés en raison de l’accumulation de métabolites toxiques dans ce dernier. La perte des hépatocytes non corrigés permet une expansion sélective des hépatocytes corrigées compatible avec la capacité de régénération du foie. Traitement peut être facilement suivie en mesurant la diminution des taux de tyrosine et succinylacetone TRANSPLATATION circulants.
Afin de justifier le caractère invasif de la procédure, qui comprend une hépatectomie partielle, l’objectif de cette approche doit être un remède durable. Vecteurs LENTIVIRAUX incompétent de réplication ne sont donc utilisés parce qu’ils intégreront stablement dans l’hépatocyte génome9. assurer la prestation du gène a été corrigé à toutes les cellules de fille comme le foie se développe et s’agrandit pour remplacer la perte rapide de cellules non corrigés. C’est avantageux sur les vecteurs viraux adéno associé (AAV), qui existe principalement extrachromosomale ne pouvant être transmises à une seule cellule fille au cours de la mitose10 , perdant ainsi tout effet de la thérapie en quelques semaines.
Bien qu’un nombre croissant de publications prend en charge la sécurité des lentivirus11, préoccupations sur événements génotoxiques sont atténués en limitant la transduction des cellules de l’hôte dans un environnement contrôlé en vitro . Vecteur libre n’est jamais systémique introduit à l’hôte lorsque cette méthode est exécutée, limiter l’exposition aux hépatocytes qui sera réintroduit avec greffe autologue via la veine porte.
Ce rapport décrit la méthode de l’intervention chirurgicale et ex vivo les procédures utilisées pour isoler les hépatocytes pour la thérapie génique ex vivo et transplantation autologue ultérieure de12 pour le traitement de la HT-1 cochon8. Le processus complet comprend 1) une hépatectomie partielle qui sert de source d’hépatocytes et une stimulation de la croissance pour du foie de l’hôte, 2) isolation des hépatocytes du foie excisés suivie ex vivo correction de gène et enfin 3) la réintroduction de la hépatocytes corrigés de nouveau dans l’hôte. La méthode décrite est applicable à tous les grands modèles animaux avec quelques modifications, mais seulement la FAH-deficient cochon13 aura l’avantage du milieu sélectif pour les hépatocytes corrigées.
Protocole
Toutes les procédures d’animaux ont été effectuées conformément aux lignes directrices et ont été revus et approuvés par le Comité de l’emploi (IACUC) et d’institutionnels animalier avant étude conduite. Procédures décrites ici ont été réalisées sur des porcs mâles et femelles grande ferme blanche (bagage génétique de Piéride du chou Landrace/50% 50 %) vers le haut à 3 mois d’âge qui sont réputées être sain et adapté à la chirurgie. Animaux est logés socialement moins considérés comme incompatibles par le personnel de soins vétérinaires. Animaux sont nourris des niveaux appropriés de chow deux fois quotidienne et observé des signes cliniques par le personnel de soins au moins une fois par jour.
1. préparation pour la chirurgie
- Administrer 5 mg/kg telazol et xylazine 2 mg/kg par voie intramusculaire pour induire la sédation. Administrer la buprénorphine SR par voie sous-cutanée à une dose de 0,18 mg/kg pour l’analgésie postopératoire (prévoit une analgésie de cette dose sera jusqu'à 72 h). Vérifier manuellement l’animal pour les réponses vérifier la sédation.
- Une fois sous sédation, insérer un cathéter intraveineux dans une veine périphérique oreille pour accès pharmacologique.
- Administrer la céfazoline 25 mg/kg par voie intraveineuse et intramusculaire 5 mg/kg du ceftiofur pré-opératoire.
- Administrer le sérum physiologique par voie intraveineuse pour maintenir la pression artérielle et fréquence cardiaque dans les limites physiologiques normales pendant toute la procédure.
- Placer un tube orogastrique pour décompresser l’estomac. Effectuer une intubation endotrachéale avec une sonde endotrachéale Fluxsol, vérifier le placement correct en comprimant la poitrine manuellement pour détecter l’exhalation et ensuite mécaniquement ventiler l’animal à l’isoflurane 1 à 3 %.
- Placer le conduit de l’électrocardiogramme (ECG), brassard de tensiomètre, sonde de température et oxymètre de pouls à surveiller et enregistrer les signes vitaux. Placer l’animal dans une position en décubitus dorsal, frottez l’abdomen de la cage thoracique pour bassin avec betadine et drapé de sterilely.
- Ventilez sujet à l’isoflurane 1 à 3 % au cours de la procédure pour maintenir un plan chirurgical de l’anesthésie. Continuer à surveiller les signes vitaux des changements et ajuster l’isoflurane en conséquence pour maintenir la fréquence cardiaque au niveau de l’incision avant si la pression artérielle diminue considérablement, réduire l’isoflurane et initier les agents approuvés sur le plan institutionnel pour restaurer la vitalité, tels que adrénaline par voie intraveineuse.
- Enregistrer la fréquence cardiaque, fréquence respiratoire, la pression artérielle et la température corporelle sur un enregistrement de l’intervention chirurgicale pour suivre et maintenir le bien-être des animaux conformément à la politique propre à l’institution pour assurer la conformité avec les normes de bien-être animal grand.
2. laparoscopique hépatectomie partielle
- Effectuer la première entrée de site en utilisant une technique de Hassen ouverte céphalique de l’ombilic. Lorsque péritoine est visualisé, sans risque d’introduire un trocart de 12 mm dans la cavité abdominale. Passer un 5 mm, 30°, portée par ce port.
- Insuffler l’abdomen avec du CO2 à 15 mmHg. Sous visualisation directe avec la caméra laparoscopique, placez deux ports supplémentaires 5 mm triangulation sur le lobe latéral gauche du foie. L’emplacement exact des ports dépendra de la taille et l’anatomie de l’animal.
- À ce stade, placez le laparoscope dans les ports de 5 mm.
- Identifier le segment latéral gauche du foie au moment de la fissure majeure du lobe gauche. Cette fissure sépare les segments latéraux gauche et médicales. Sécuriser les structures portails ainsi que la veine hépatique le long de cette fissure à l’aide d’une agrafeuse chirurgicale (voir Table des matières). Transect le parenchyme par cette fissure à l’aide de tirs séquentiels de l’agrafeuse à l’aide de 60, 45 ou les charges de temps vasculaire de 30 mm.
- Lors de la résection parenchymateuse est terminée, évaluer le foie reste pour assurer l’hémostase suffisante. Contrôle des saignements du parenchyme avec cautérisation ou suture.
- Récupérer la section du foie à l’aide de cautères endoscopiques et un sac de récupération de tissus endoscopique.
- Supprimer les ports et refermer l’incision de port de 12 mm en trois couches avec suture interrompu taille 0 pour le carénage de la ligne médiane, une suture de 2-0 en cours d’exécution pour la couche dermique profond et une suture de 4-0 en cours d’exécution pour la couche sous-cuticulaires. Les ports de 5 mm peuvent être fermés en une seule couche avec 2-0.
- Placer un pansement stérile sur les incisions (voir Table des matières).
- Lorsque les cellules sera prêts en moins de 4 heures, maintenir les animaux sous anesthésie générale après l’opération jusqu’au moment de l’autogreffe.
- Alternativement, si des manipulations de cellules nécessitent de plus longues périodes (par exemple pour permettre la formation de sphéroïdes hépatocytes ou de plus longues périodes de transduction/sélection basées sur des demandes individuelles de cette méthode) permettent à l’animal récupérer de l’anesthésie et répéter le étapes de l’induction anesthésique avant autogreffe quand les cellules sont prêtes.
3. isolement de l’hépatocyte
- Raccorder une pompe péristaltique avec perfusion réglée pour délivrer des solutions chaudes de dispersion (conservées dans le bain d’eau de 43 ° C) des cathéters à placer dans les gros vaisseaux exposés de la section du foie, telle que la température de la solution est de 38 ° C lors de l’introduction au tissu. Tous les tuyaux, l’équipement et des solutions doivent être maintenues stériles pour s’assurer que les cellules ne conviennent pas à la transplantation.
- Amorcez la pompe et la tuyauterie avec par II jusqu'à un robinet placé pour passer par I et par II livraison au tissu. Basculer le robinet vers le rap j’ai positionner et amorcer le reste de la tubulure, remplissant un barboteur en ligne complètement pour éviter que l’introduction de bulles d’air dans le tissu.
- Préparer une propre transversale coupée perpendiculairement à la circulation hépatique pour révéler les coupes des branches de la veine porte et les veines hépatiques au cathétérisme.
- Section les veines apparentes disponibles avec un cathéter ajustés pour éviter les fuites du perfusat. Canule dans au moins 1 portail et 1 veine hépatique pour assurer une perfusion suffisante du tissu.
- Veiller à ce que les catheter(s) est pas apprêtée / d’air avant de placer le cathéter dans une veine.
- Perfuse avec accueil chaleureux Per I à 100 mL/min, passer le tuyau de sortie de veine à veine toutes les 30 secondes à 1 min. de Cycle dans toutes les veines disponibles pendant 15 à 20 min. Pendant Per I infusion, mettre un tube d’évacuation de vider le bac de procédure dans un conteneur de déchets sous vide.
- Basculez vers par II à 100 mL/min, vélo à travers les veines comme avec Per I, pour un total de 30 min. Par seconde, utilisez une pompe de retour à recycler par II vers le réservoir pour la remise en application conserver la préparation de l’enzyme active. Mettre la pompe de retour à moins que la pompe d’écoulement (c.-à-d. 94 mL/min), en veillant à ne pas revenir trop d’air dans la bouteille de la source.
- Si la capsule du foie se casse, ce temps peut être réduit.
- Si le foie n’est pas entièrement digéré (ne reste pas alvéolée par légère pression focale) une perfusion supplémentaire de 5 min peut être effectuée.
- Parfois (environ toutes les 5 minutes) document de température de surface du barboteur et/ou foie pour assurer les hépatocytes ne reçoivent pas froids. Si le foie fait froid (< 35 ° C) augmenter la chaleur de l’eau du bain pour rétablir la température du foie plus près à 38 ° C. Le foie doit blanche à mesure que progresse la perfusion.
- Retirez le foie à plaque stérile ou boîte de Pétri pour le transport à la hotte de la culture cellulaire. Couvrir un champ stérile avec un drap stérile pour maintenir l’intégrité lors du traitement de l’hépatocyte.
- La section du foie de drap stérile et submerge le foie avec les médias de lavage froid hépatocytaire (HWM). Perturber la capsule en faisant glisser les ciseaux sur le dessus. Porter des gants stériles, massez délicatement le foie pour libérer les hépatocytes dans le milieu.
- Filtrer la HWM contenant des hépatocytes à travers une gaze stérile dans des bouteilles de centrifugeuse grand (~ 200 mL). Lavez les hépatocytes par le biais de la procédure suivante en trois exemplaires, combinant le culot cellulaire des bouteilles multiples après la première remise en suspension (le cas échéant) :
- Centrifuger à 50 x g, 5 min, 4 ° C.
- Aspirer et resuspendre dans 150 mL d’HWM.
- Laisser le diabolo dans HWM après le lavage 3rd .
- Compter la concentration cellulaire en utilisant un hémocytomètre ou tout autre dispositif, selon la disponibilité. Ces cellules sont maintenant prêts pour ex vivo manipulation intéressants, notamment la thérapie génique, cellulaire tri ou autre spécialisation avant autogreffe. Un volume final de HWM est réglable pour cibler une concentration spécifique (cellules/mL).
4. hépatocyte Transduction
- Remettre en suspension les hépatocytes dans les médias (milieu d’eagle modifié de Dulbecco [DMEM], 10 % sérum de veau fœtal [BF], pénicilline-streptomycine, 4-(2-hydroxyethyl)-1-piperazineethanesulfonic l’acide [HEPES], dexaméthasone, facteur de croissance épidermique [EGF] et NTBC) à 1 – 2 millions de cellules / mL dans un tube conique sur la glace.
- Décongeler le vecteur lentiviral à température ambiante et ajouter dans un tube conique sur glace à multiplicité 20 cible d’infection (MOI) pour lier les cellules. Faire pivoter les cellules à 4 ° C à 10 tr/min pendant 90 min lier les vecteurs viraux à la surface des cellules.
- Transférer les tubes à 37 ° C pendant 30 à 40 min. inverti de mélanger toutes les 5 minutes pour faciliter le vecteur transduction les cellules liées.
- Centrifuger les cellules à 50 g à 4 ° C pendant 4 min. remettre culot dans une solution saline à la concentration désirée sur la glace. Répétez ce lavage pour garantir l’élimination de tout vecteur non lié de la préparation.
- Si possible, la plaque des aliquotes suffisantes de cellules (par exemple, 500 000 cellules par puits dans un 6 bien plaque de culture cellulaire) pour vérifier la viabilité, l’efficacité de la transduction, adhérence, etc.
Remarque : Il n’est souvent pas possible d’évaluer ces paramètres avant autogreffe, surtout pour les procédures du même jour. Par exemple, la procédure décrite dans les présentes employé un cDNA Fah non balisé sous le contrôle de l’alpha-1 antitrypsine foie spécifiques promoteur, qui n’était pas facilement vérifiable dans les hépatocytes avant la greffe. Cependant, ces cellules plaqués peuvent être dosés à la suite de l’autogreffe comme indicateur de la réussite de la transduction (c.-à-d., par Western Blot) ou un prédicteur de la réussite générale de la procédure.
5. hépatocyte Transplantation
- Identifier la veine porte par ultrasons à l’aide d’un transducteur de 2 à 5 MHz. Diriger un 18 G, 5inch aiguille vers la veine porte principale proximale à sa bifurcation.
- Commencer la perfusion manuelle lente du haut 1 x 109 hépatocytes (environ 10 g) à l’aide d’une seringue. Mesurer des pressions portails au cours de la transplantation à l’aide d’un cathéter de perfusion.
- Si pressions portails une augmentation de plus de 8 mmHg au-dessus de base, faire une pause infusion et laissez la pression revenir à des niveaux de référence.
- Si la pression portale de ne pas retourne au niveau de référence après une pause infusion pendant cinq minutes, interrompre la perfusion.
- Après la transplantation et le retrait du cathéter, utiliser l’échographie pour évaluer la présence d’accidents thrombotiques et transmettre le flux dans la veine porte.
6. maintenance et récupération post-opératoire
- Se déplacer sous réserve d’une zone de récupération adéquate et observer jusqu'à ce que l’animal soit entièrement ambulatoire, monitoring cardiaque, saturation en oxygène et la température corporelle chaque 15 à 30 min. température corporelle maintenir avec couvertures chaudes ou un enveloppement d’air chauffé, selon les besoins.
- Administrer l’omeprazole 1 mg/kg par voie orale tous les jours (jusqu'à la fin de l’étude) afin de réduire les chances de l’ulcère gastrique qui peut se produire avec des épisodes d’inappétence.
- Après l’opération, l’animal est suivie de près par le laboratoire et le personnel vétérinaire et généralement ne nécessite pas d’analgésiques supplémentaires distincts de la dose de buprénorphine préopératoire. Si on observe des signes de détresse/douleur par le personnel qualifié de soins vétérinaires (incision gardiennage, inappétence, léthargie), agents anti-inflammatoires (c.-à-d. Carprofen) peuvent être administrés.
7. recettes
- Voir le tableau 1 pour les recettes utilisées dans le présent protocole.
| Réactif | LIGNE DES HAUTES EAUX | Réactif | Per I (x 10) | Par II (x 10) |
| Williams-E poudre (g/L) | 10,8 | NaCl (g/L) | 83 | 39 |
| NaHCO3 (g/L) | 2.2 | KCl (g/L) | 5 | 5 |
| HEPES (g/L) | 2.6 | HEPES (g/L) | 24 | 240 |
| Stylo/Strep (100 x, mL/L) | 10 | EGTA (g/L) | 9.5 | - |
| Sérum de veau fœtal (mL/L) | 100 | N-acétyl-L-cystéine | 8 | 8 |
| pH | 7.3 | (N-A-C, g/L) | ||
| Nitroglycérine (mL/L) | 5 | 5 | ||
| CaCl2 2 H2O (g/L) | - | 7 | ||
| Collagénase D (mg/mL) | - | 0,2 | ||
| pH | 7.4 | 7.6 |
Tableau 1 : Recettes pour les Solutions utilisées hépatocytes isolés de Sections du foie.
Résultats
La résection du foie et transplantation autologue sont représentés schématiquement à la Figure 1. Dans une cohorte représentative de 5 porcs qui a subi une résection hépatique, la plupart avaient des rendements de > 1 x 109 hépatocytes avec environ 80 % de viabilité (tableau 2), offrant beaucoup de cellules de n’importe quel type de désiré des manipulations, y compris le gène thérapie. Culture subséquente de la portion non transplantés d’hépatocytes disposés dans chacun de ces 5 porcs a montré bonne viabilité et d’adhésion, dont la morphologie typique hépatocyte 46 heures après transduction et ensemencements initiaux (Figure 2). Ces résultats sont représentatifs d’une préparation réussie, alors que des résultats médiocres seraient indiquées avec un faible nombre de cellules, la viabilité ou l’adhérence minimale des cellules dans une monocouche.
Une biopsie hépatique avant le traitement du cochon- / - Fahne montre aucune expression de FAH par immunohistochimie (Figure 3). Première greffe variera selon la quantité de cellules réintroduits au cours de la transplantation. Fréquences de transduction des hépatocytes porcin in vitro à l’aide de lentivirus à un MOI de 10 TU/hépatocyte est généralement de 70 à 100 %. Les cellules implantées élargira par clonage dans le foie de Fah- / - jusqu'à ce que le foie entier est repeuplé par les cellules corrigées. Des biopsies représentatives à 2, 6 et 12 mois démontrent une chronologie de l’expansion cellulaire FAH-positif, qui est généralement complète à 12 mois après la transplantation (Figure 3). Même un faible pourcentage de prise de greffe devrait finalement repeupler le foie, alors que les taux réels greffe initiale ont été n’évalués dans cette expérience.
Les porcs sont soigneusement surveillée après la transplantation pour gain de poids, comme retard staturo-pondéral est un signe que pas assez corrigé les hépatocytes est présent. Dans ce cas les animaux passent sur NTBC au besoin jusqu'à ce que la population de l’hépatocyte corrigée soit suffisante pour permettre un complet de sevrage de la drogue. Évaluation des biomarqueurs en circulation offre un accès facile à suivre la thérapie. Une fois qu’un animal a atteint environ 20 % repopulation des hépatocytes corrigées dans les foie, la tyrosine et succinylacetone niveaux normalisera comparativement aux animaux sauvage (Figure 4 a). En outre, le mal traitée ou non traité Fah- / - porc démontre des changements hépatiques fibreuses semblables vus chez les humains touchés, qui peuvent être suivies par coloration trichrome de Masson de biopsies série8. Des marqueurs indirects d’atteinte hépatique en cours peuvent être évaluées par le dosage des enzymes hépatiques, tels que l’aspartate aminotransférase et phosphatase alcaline en circulation. Alors que les animaux non corrigée montrent une augmentation significative dans les deux paramètres par rapport aux animaux de type sauvage, ex vivo la thérapie génique retourne ces valeurs de sérum à la normale (Figure 4 b et 4C). Enfin, générale Santé métabolique du foie est perturbée chez les non traités Fah- / - porcs, comme il est indiqué par des élévations en ammoniac en circulation. Repeuplement du foie avec cellules corrigées restaure sauvage des concentrations d’ammoniac (Figure 4).

Figure 1 : hépatectomie et autogreffe. (Dans le sens horaire de haut) Une résection hépatique partielle est effectuée sur le sujet pour fournir une source d’hépatocytes et stimuler la régénération du foie. Les hépatocytes sont isolés du foie réséqué (cellules bleues), transduite ex vivo avec le vecteur lentiviral contenant le transgène d’intérêt (cellules brunes), puis les cellules transduits sont transplantés autologously retour à l’animal de la source par l’intermédiaire injection de la veine porte. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : hépatocytes primaires cochon de Sections du foie. Hépatocytes ont été cultivées de résection hépatique de 5 différents porcs, transduites avec un vecteur lentiviral et laissés croître pendant 48 h pour démontrer la morphologie, la viabilité, pureté et adhérence à Pétri. Ces évaluations qualitatives en vitro servent d’indicateurs de substitution pour la probabilité d’une greffe réussie en vivo pour chaque préparation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
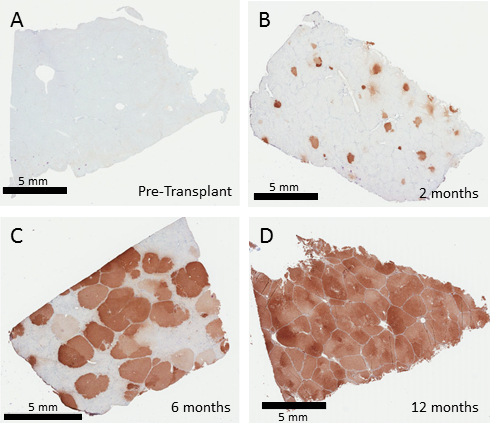
Figure 3 : Corrigés hépatocytes repeuplement le foie de porc- / - Fah. FAH immunohistochimie de mois de biopsies du foie 0, 2, 6 et 12 après la thérapie génique ex vivo des hépatocytes autologues. Non traitée Fah- / - spectacle de porcs aucune cellule FAH-positifs dans le foie (A). Deux mois après la transplantation (B), foyers individuels des hépatocytes positives FAH sont vus, qui subissent alors une expansion en remplacement de 50 à 60 % du foie à 6 mois (C) suivies d’un remplacement complet, vu à 12 mois (D). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
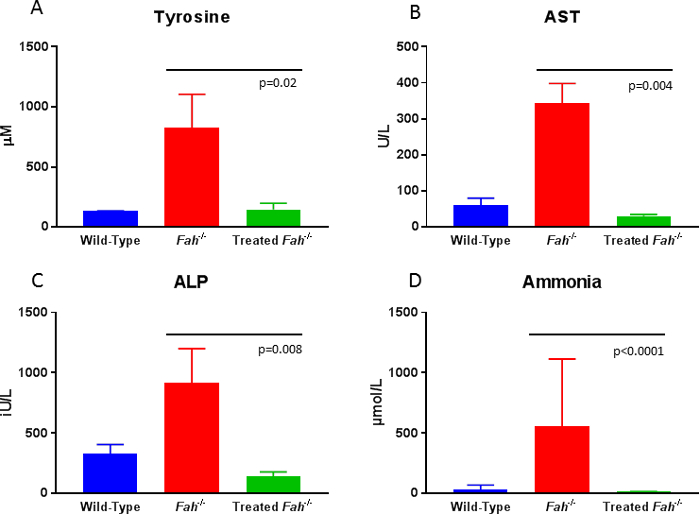
Figure 4 : Biochimie sérique à 10 mois post ex vivo la thérapie génique chez les porcs Fah - / . 10 mois après la thérapie, tyrosine, aspartate aminotransférase14, phosphatase alcaline (ALP) et taux d’ammoniac sont sensiblement inférieurs aux animaux déficients de FAH non traités et sont impossibles à distinguer des niveaux de type sauvage. Données ont été analysées pour signification en utilisant le test U de Mann-Whitney (p valeurs telle que présentée). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Cochon | Total des cellules (x 106) | Cellules en direct (x 106) | Viabilité (%) |
| 1 | 1 381 | 1 160 | 84 |
| 2 | 1 000 | 770 | 77 |
| 3 | 1 213 | 995 | 82 |
| 4 | 789 | 671 | 85 |
| 5 | 1318 | 975 | 74 |
| Moyenne | 1 140 | 914 | 80 |
| St Dev | 244 | 194 | 5 |
Tableau 2 : Hépatocytes représentant résulte d’isolement primaire de 5 porcs.
Discussion
Le présent rapport décrit une approche ex vivo gène autologue thérapie pour guérir un modèle porcin de HT-1. Il s’agit d’une hépatectomie partielle, suivie par ex vivo d’isolement de l’hépatocyte et transduction d’hépatocytes isolés avec lenti virus transportant le transgène correctif. Corrigée des hépatocytes autologues sont alors transplantés vers l’animal déficient FAH par l’intermédiaire de la veine porte8. Bien que la méthode décrite est applicable à tous les grands modèles animaux avec quelques modifications, le cochon de FAH-deficient a l’avantage unique d’un environnement hautement sélectif de cellules corrigées13,15. Cette méthode est un remède efficace pour HT-1, comme le montrent les animaux ayant reçu une dose croissance indépendante NTBC avec normalisation des métabolites mesurés biochimiquement et bio-marqueurs inflammatoires du foie, la prévention de la cirrhose et le HCC et le renversement complet de la fibrose au début vu avec NTBC cyclisme. En outre, une étude plus récente portant sur une vaste analyse histologique n’a démontré aucune des cellules non corrigées détectables, de fibrose, cirrhose ou tumorigénicité 3ans post thérapie (manuscrit en examen). Toutefois, l’utilité de l’arrière-plan de la FAH nulle peut servir d’outil pour permettre l’évaluation d’un large éventail d’interrogatoires dans les hépatocytes des indications de physiologie et de la maladie au-delà de HT-1.
Succès relatif de la procédure peut être évaluée par le nombre de cycles du NTBC requis pour que le sujet peut être totalement sevré de ce médicament protecteur. Dans nombreuses itérations avec ce modèle et autres petits modèles animaux du HT-1, environ 20 % de correction est nécessaire avant NTBC croissance indépendante est réalisée. Vélo plus avec NTBC est révélatrice de la mauvaise prise de greffe/viabilité initiale, avancée une maladie du foie au moment de la greffe initiale, ou expression du transgène pauvres, bien que d’autres facteurs peuvent également jouer un rôle. Les marqueurs biochimiques de la santé du foie (AST, ALT et ammoniac) sont disponibles et donnent un aperçu l’étendue de l’expansion de l’hépatocyte corrigée, mais ultime vérification de cure phénotypique est mieux prouvée par la normalisation de la tyrosine de sérum et succinylacetone et confirmation histologique des hépatocytes exprimant le FAH en l’absence de fibrose. Ceci est réalisé lorsque le foie a été repeuplé par des hépatocytes corrigées.
L’efficacité de la procédure s’appuie plus fortement sur l’intégrité des hépatocytes, qui doit être maintenue stérile et viable pendant tout le processus d’isolement, de transduction et de transplantation d’organes. Réintroduction des hépatocytes non viables ou non corrigées ne sauvera pas le phénotype, et une procédure infructueuse pouvait prendre des mois d’observation de l’objet à vérifier.
Dans ce modèle, bonne transgene expression de l’enzyme fonctionnelle de la FAH est une exigence minimale pour le repeuplement du foie. Lentivirus est seulement une manière de remettre une copie efficace du transgène. Cette méthode permettra la possibilité pour l’utilisation d’autres systèmes de livraison y compris les systèmes non viraux et ceux qui visent à modifier le défaut génomique spécifique. En fin de compte, ce modèle permettra un large éventail de possibilités, y compris la correction d’autres anomalies dans le bioréacteur déficient de FAH. Tant que les cellules transplantées exprime une enzyme fonctionnelle de FAH, toute autre modification du cellules ex vivo serait également être propagée. Cela permettrait des erreurs innées du métabolisme du foie à corriger en arrière-plan- / - FAH. Comme l’expansion des hépatocytes corrigées en bout de ligne remplit à nouveau le foie, les numéros pertinents des hépatocytes pour toute indication de maladie peuvent être atteint, qui souligne la valeur de ce modèle et cette procédure comme une science fondamentale et modèle préclinique de la thérapie.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient Duane Meixner pour expertise dans l’exécution de l’injection de la veine porte, Steve Krage, Joanne Pederson et Lori Hillin soutien pendant les interventions chirurgicales. Ce travail a été soutenu par la Fondation de l’hôpital du Minnesota et la médecine régénérative Minnesota enfants. R.D.H. a été financé par un prix de NIH K01 DK106056 et un centre de clinique de Mayo pour la médecine régénérative Career Development Award.
matériels
| Name | Company | Catalog Number | Comments |
| 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (NTBC) | Yecuris | 20-0027 | |
| 12 mm Trocar | Covidien | B12STS | |
| 5 mm Trocar | Covidien | B5SHF | |
| Endo Surgical Stapler 60 | Covidien | EGIA60AMT | |
| Endo Surgical Stapler 45 | Covidien | EGIA45AVM | |
| Endo Surgical Stapler 30 | Covidien | SIG30AVM | |
| Endo catch bag | Covidien | 173050G | |
| 0 PDS | Ethicon | Z340H | |
| 2-0 Vicryl | Ethicon | J459H | |
| 4-0 Vicryl | Ethicon | J426H | |
| Dermabond | Ethicon | DNX12 | Sterile Dressing |
| Williams’-E Powder | Gibco | ME16060P1 | |
| NaHCO3 | Sigma Aldrich | S8875-1KG | |
| HEPES | Fisher | BP310-1 | |
| Pen/Strep | Gibco | 15140-122 | |
| Fetal Bovine Serum | Corning | 35-011-CV | |
| NaCl (g/L) | Sigma Aldrich | S1679-1KG | |
| KCl (g/L) | Sigma Aldrich | P3911-500G | |
| EGTA (g/L) | Oakwood Chemical | 45172 | |
| N-acetyl-L-cysteine | Oakwood Chemical | 3631 | |
| (N-A-C, g/L) | Sigma Aldrich | A9165-100G | |
| CaCl2 2H2O (g/L) | Sigma Aldrich | 223506-500G | |
| Collagenase D (mg/mL) | Crescent Chemical | 17456.2 | |
| Dulbecco's modified eagle medium (DMEM) | Corning | 15-013-CV | |
| Dexamethasone | Fresenius Kabi | NDC6337 | |
| Epidermal Growth Factor | Gibco | PHG0314 |
Références
- Mak, C. M., Lee, H. C., Chan, A. Y., Lam, C. W. Inborn errors of metabolism and expanded newborn screening: review and update. Critical Reviews in Clinical Laboratory Sciences. 50 (6), 142-162 (2013).
- Hansen, K., Horslen, S. Metabolic liver disease in children. Liver Transplantation. 14 (5), 713-733 (2008).
- Schneller, J. L., Lee, C. M., Bao, G., Venditti, C. P. Genome editing for inborn errors of metabolism: advancing towards the clinic. BMC Medicine. 15 (1), 43(2017).
- Brunetti-Pierri, N. Gene therapy for inborn errors of liver metabolism: progress towards clinical applications. Italian Journal of Pediatrics. 34 (1), 2(2008).
- Carlson, D. F., et al. Efficient TALEN-mediated gene knockout in livestock. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17382-17387 (2012).
- Lindblad, B., Lindstedt, S., Steen, G. On the enzymic defects in hereditary tyrosinemia. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4641-4645 (1977).
- Hickey, R. D., et al. Noninvasive 3-dimensional imaging of liver regeneration in a mouse model of hereditary tyrosinemia type 1 using the sodium iodide symporter gene. Liver Transplantation. 21 (4), 442-453 (2015).
- Hickey, R. D., et al. Curative ex vivo liver-directed gene therapy in a pig model of hereditary tyrosinemia type 1. Science Translational Medicine. 8 (349), (2016).
- Naldini, L., et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272 (5259), 263-267 (1996).
- Bouard, D., Alazard-Dany, D., Cosset, F. L. Viral vectors: from virology to transgene expression. British Journal of Pharmacology. 157 (2), 153-165 (2009).
- Sakuma, T., Barry, M. A., Ikeda, Y. Lentiviral vectors: basic to translational. Biochemical Journal. 443 (3), 603-618 (2012).
- Chowdhury, J. R., et al. Long-term improvement of hypercholesterolemia after ex vivo gene therapy in LDLR-deficient rabbits. Science. 254 (5039), 1802-1805 (1991).
- Elgilani, F., et al. Chronic Phenotype Characterization of a Large-Animal Model of Hereditary Tyrosinemia Type 1. The American Journal of Pathology. 187 (1), 33-41 (2017).
- Patyshakuliyeva, A., et al. Carbohydrate utilization and metabolism is highly differentiated in Agaricus bisporus. BMC Genomics. 14, 663(2013).
- Hickey, R. D., et al. Fumarylacetoacetate hydrolase deficient pigs are a novel large animal model of metabolic liver disease. Stem Cell Research. 13 (1), 144-153 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon