Method Article
Lentivirale Vektor-vermittelte Gentherapie von Hepatozyten Ex Vivo für autologe Transplantation bei Schweinen
In diesem Artikel
Zusammenfassung
Dieses Protokoll soll porcinen Hepatozyten Isolierung und ex-Vivo gen Lieferung um Modelle der metabolischen Krankheiten durch autologe Stammzelltransplantation heilen zu beschreiben. Obwohl dieses Modell einzigartige Vorteile, die erfolgreichen Therapie bevorzugen genießt, ist die Anwendung eine relevante Grundlage um weitere Krankheiten und Indikationen.
Zusammenfassung
Gentherapie ist eine ideale Wahl um viele angeborene Fehler des Stoffwechsels der Leber zu heilen. Ex-Vivo, Lentivirale Vektoren haben erfolgreich eingesetzt bei der Behandlung vieler hämatopoetischer Erkrankungen beim Menschen, da ihre Verwendung bietet stabile Transgene Ausdruck durch den Vektor Fähigkeit in das Wirtsgenom integrieren. Diese Methode demonstriert die Anwendung der ex Vivo Gentherapie von Hepatozyten, ein großes Tier Modell des erblichen Tyrosinemia Typ ich. Dieser Prozess besteht aus 1) Isolierung der primäre Hepatozyten von autologen Empfängerin/Tier, 2) ex Vivo gen Lieferung per Hepatozyten Transduktion Lentivirale Vektor mit 3) autologe Transplantation von korrigierten Hepatozyten-Portal Vene Injektion. Erfolg der Methode im allgemeinen stützt sich auf effiziente und sterile Entfernung der Leber Resektion, sorgfältiger Umgang mit der ausgeschnittenen Probe zur Isolierung von lebensfähigen Hepatozyten für wieder anwachsen, hochprozentigen Transduktion der isolierten Zellen ausreichend und aseptische Eingriffe durchweg um Infektionen zu vermeiden. Technisches Versagen bei jedem dieser Schritte führt zu niedrigen Ertrag von lebensfähigen ausgestrahlt Hepatozyten für autologe Transplantation oder Infektion des Tieres Spender/Empfänger. Das Schwein-Modell des menschlichen Typ 1 erbliche Tyrosinemia (HT-1) für diese Vorgehensweise gewählt ist eindeutig eine solche Methode, zugänglicher, wie auch ein kleiner Prozentsatz der Engraftment korrigierten Zellen zur Wiederbesiedlung der Leber mit gesunden Zellen basierend auf einem leistungsstarken führt selektiven Vorteil gegenüber Native-Kranke Hepatozyten. Obwohl dieses Wachstum-Auswahl nicht wahr für alle Indikationen werden, dieser Ansatz ist eine Grundlage für die Expansion in andere Indikationen und ermöglicht die Manipulation dieser Umgebung zu Adresse zusätzliche Krankheiten, sowohl in der Leber und darüber hinaus, während Steuerung für die Exposition gegenüber viralen Vektoren und Gelegenheit für Ziel-Toxizität und Tumorigenität.
Einleitung
Angeborene Fehler der Stoffwechsel der Leber sind eine Familie von Erbkrankheiten, die gemeinsam so viele wie 1 in 800 Lebendgeburten1betreffen. Viele dieser Krankheiten sind einzelne gen Mängel2 und funktional durch die Einführung einer einzigen korrigierten Kopie des betroffenen Gens in einer ausreichenden Anzahl von Hepatozyten3geheilt werden können. Der tatsächliche Prozentsatz der Hepatozyten, die korrigiert werden muss hängt von der Krankheit4 und ist weitgehend abhängig von der Art des Proteins, die es kodiert, zum Beispiel ausgeschiedenen Proteine gegen cytoplasmatische. In den meisten Fällen ist Wirksamkeit einer Behandlung für metabolische Krankheit leicht durch das Vorhandensein von Biomarkern, die oftmals auch in der Zirkulation untersucht.
HT-1 ist eine angeborene Fehler der Stoffwechsel der Leber, die durch einen Defekt im Fumarylacetoacetate Hydrolase (FAH)5, der letzte enzymatische Schritt in Tyrosin Stoffwechsel6entsteht. FAH-Mangel führt zum Build von toxischen Metaboliten in der Leber, die akutes Leberversagen und Tod verursachen können oder bei der chronischen Form der Erkrankung kann dazu führen, dass Zirrhose und hepatozellulären Karzinom. Die Krankheit wird klinisch durch Gabe von 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (NTBC), ein niedermolekularer Inhibitor eines Enzyms stromaufwärts der FAH in Tyrosin-Stoffwechsel verwaltet. Die Krankheit bietet ein ideales Umfeld, um Gen-Therapie-Methoden zu testen, wie erfolgreiche Korrektur der auch eine kleine Anzahl von Hepatozyten schließlich die Wiederbevölkerung der gesamten Leber mit korrigierten Zellen in kleinen und großen Tiermodellen führt 7 , 8. Dies geschieht, weil korrigiert Zellen haben einen tiefgreifenden Überlebensvorteil gegenüber unkorrigierte Zellen durch die Anhäufung von toxischen Metaboliten in der letzteren. Der Verlust der unkorrigierte Hepatozyten ermöglicht eine selektive Erweiterung korrigierte Hepatozyten entsprechen die Regenerationsfähigkeit der Leber. Behandlung kann leicht verfolgt werden, durch die Messung des Rückgangs der zirkulierenden Tyrosin und Urinspiegel Ebenen nach Transplantation.
Um die invasive Art des Verfahrens, zu rechtfertigen, die eine partielle Hepatektomie enthält, muss das Ziel dieses Ansatzes eine dauerhafte Heilung. Daher werden Replikation inkompetenten Lentivirale Vektoren verwendet, da sie stabil in den Hepatozyten Genom9zu integrieren. Bereitstellung des korrigierten Gens an alle Tochterzellen als die Leber wächst und erweitert um den schnellen Verlust der unkorrigierte Zellen zu ersetzen. Dies ist vorteilhaft über Adeno-verbundene Viren (AAV) Vektoren, bestehen in erster Linie als Episomes, die nur auf eine einzelne Zelle Tochter während der Mitose10 dadurch verlieren jede Wirkung der Therapie in einer Angelegenheit von Wochen übergeben werden können.
Obwohl eine wachsende Zahl von Literatur über die Sicherheit von Lentivirus11, Anliegen unterstützt genotoxische Veranstaltungen gemildert durch die Begrenzung der Transduktion von Wirtszellen zu einer kontrollierten in-vitro- Umgebung. Kostenlose Vektor wird nie systemisch an den Host eingeführt, wenn diese Methode durchgeführt wird, Begrenzung der Exposition gegenüber der Hepatozyten, die mit autologen Transplantation über die Pfortader wieder eingeführt werden.
Dieser Bericht beschreibt die Methode der chirurgischen und ex Vivo Verfahren zum Isolieren von Hepatozyten für Gen-Therapie ex Vivo und anschließende autologe Transplantation12 für die Behandlung des HT-1 Schwein8. Der vollständige Prozess umfasst (1) eine partielle Hepatektomie, das als eine Quelle von Hepatozyten und ein Wachstumsimpulse für die Host Leber, 2) Isolierung der Hepatozyten aus der ausgeschnittenen Leber, gefolgt von ex-Vivo gen Korrektur, und schließlich (3) die Wiedereinführung der dient der korrigierte Hepatozyten zurück in den Host. Das beschriebene Verfahren gilt für alle großen Tiermodellen mit einigen Änderungen, sondern nur die FAH-defizienten Schwein13 haben den Vorteil der selektiven Umweltgutachten korrigierte Hepatozyten.
Protokoll
Alle tierische Verfahren wurden wurden nach institutionellen Richtlinien durchgeführt und überprüft und genehmigt durch die institutionelle Animal Care und Nutzung Committee (IACUC) vor der Durchführung der Studie. Hier beschriebene Verfahren wurden auf männlichen und weiblichen großen weißen Bauernhof Schweine (50 % Landrace/50% Large White genetischen Hintergrund) bis zu 3 Monate alt durchgeführt, die gesund und für Chirurgie geeignet erachtet werden. Die Tiere sind sozial untergebracht, es sei denn, durch institutionelle tierärztliche Versorgung Mitarbeiter als unvereinbar angesehen. Tiere sind angemessene Höhe der Chow zweimal tägliche und beobachteten klinischen Anzeichen von Pflegepersonal mindestens einmal täglich gefüttert.
1. Vorbereitung für die Operation
- Verwaltung von 5 mg/kg Telazol und 2 mg/kg Xylazin intramuskulär, Sedierung zu induzieren. Verwalten von Buprenorphin SR subkutan in einer Dosis von 0,18 mg/kg für postoperative Analgesie (voraussichtlich Analgesie von dieser Dosis werden bis zu 72 h). Manuell überprüfen Sie das Tier zur Beantwortung Sedierung zu überprüfen.
- Einmal sediert, legen Sie einen intravenöse Katheter in eine Vene der peripheren Ohr für pharmakologische Zugang.
- Verwalten Sie 25 mg/kg intravenös Cefazolin und intramuskuläre 5 mg/kg Ceftiofur präoperativ.
- Verwalten Sie normale Kochsalzlösung intravenös um Blutdruck und Herzfrequenz innerhalb der normalen physiologischen Grenzen während des Verfahrens zu halten.
- Statt einem orogastraler Rohr um den Magen zu dekomprimieren. Endotracheale Intubation mit einer entsprechend großen Endotrachealtubus durchzuführen, stellen Sie sicher die richtige Platzierung durch Kompression der Brust manuell um Ausatmung zu erkennen und dann mechanisch lüften das Tier mit 1 – 3 % Isofluran.
- Elektrokardiogramm (EKG) führt, Blutdruckmanschette, Temperaturfühler und Pulsoximeter zu überwachen und aufzeichnen Vitalfunktionen zu platzieren. Legen Sie das Tier in Rückenlage, Bauch vom Brustkorb zum Becken mit Betadine scrub und Drapieren Sie steril.
- Lüften Sie mit 1-3 % Isofluran während des Verfahrens um eine chirurgische Ebene der Narkose aufrechtzuerhalten. Weiterhin Vitalfunktionen auf Änderungen überwachen und Isofluran entsprechend anpassen, um Herzfrequenz auf Pre-Schnitt Ebenen zu erhalten, wenn Blutdruck sinkt dramatisch Isoflurane reduzieren und institutionell zugelassenen Agenten zur Vitalität, wie z. B. Wiederherstellung zu initiieren intravenöse Adrenalin.
- Zeichnen Sie auf, Herzfrequenz, Atemfrequenz, Blutdruck und Körpertemperatur auf einen chirurgischen Eingriff-Datensatz zum Nachverfolgen und Verwalten des Tierschutzes gemäß institutsspezifische zu großen Tierschutzstandards gewährleisten.
(2) laparoskopische partielle Hepatektomie
- Führen Sie erste Einreise Website mit einer offenen Hassen Technik kopfwärts auf den Nabel. Wenn Bauchfell visualisiert wird, stellen Sie sicher eine 12 mm Trokar in die Bauchhöhle. Dieser Port durchlaufen Sie ein 5 mm, 30°, Umfang.
- Insufflieren Sie den Bauch mit CO2 bis 15 MmHg. Legen Sie unter direkter Visualisierung mit der laparoskopischen Kamera zwei zusätzliche 5 mm Anschlüsse auf der linken seitlichen Lappen der Leber Triangulation. Genaue Platzierung der Ports hängt von Größe und Anatomie des Tieres.
- An diesem Punkt setzen Sie das Laparoskop in einem der 5 mm Anschlüsse.
- Identifizieren Sie das linke seitlichen Segment der Leber zum Zeitpunkt der großen Riss der linke Lappen. Diese Fissur trennt die medizinische und linken seitlichen Segmente. Die Portal Strukturen zusammen mit der Lebervene entlang dieser Riss mit einem chirurgischen Hefter zu sichern (siehe Tabelle der Materialien). Das Parenchym durch diesen Riss mit sequentiellen Zündungen von den Hefter mit 60, 45 oder 30 mm lange vaskulären Lasten Transekt.
- Bei parenchymatösen Resektion abgeschlossen ist, bewerten Sie die Überbleibsel Leber dafür ausreichende Blutstillung. Kontrollieren Sie jede Blutung aus dem Parenchym mit Cautery oder Naht.
- Abrufen des Leber Abschnitts mit endoskopischen Graspers und eine endoskopische Gewebe Abruf Tasche.
- Entfernen Sie die Ports und schließen Sie den 12 mm Port Schnitt in drei Schichten mit unterbrochenen Größe 0 Nahtmaterial für die Mittellinie Faszie, eine laufende 2-0 Naht für die tief dermalen Schicht und einer laufenden 4-0 Naht für die Subcuticular Schicht. Die 5 mm-Ports können in einer Schicht mit 2-0 geschlossen werden.
- Legen Sie einen sterilen Verband auf die Einschnitte (siehe Tabelle der Materialien).
- Wenn Zellen in weniger als 4 Stunden fertig sein werden, erhalten Sie die Tiere unter Vollnarkose postoperativ bis zum Zeitpunkt der Autotransplantation.
- Alternativ, wenn Zelle Manipulationen längere Zeit erfordern (z. B. Bildung von Hepatozyten Sphäroide oder längere Transduktion/Auswahl basierend auf einzelne Anwendungen dieser Methode erlauben) erlauben das Tier wieder aus der Narkose und wiederholen Sie die Betäubungsmittel Induktion Schritte vor der Autotransplantation wenn die Zellen bereit sind.
(3) Hepatozyten Isolation
- Verbinden Sie einer peristaltischen Pumpe mit Perfusion auf warmen Streuung Lösungen (im Wasserbad 43 ° C gepflegt) festgelegt mit Katheter in den großen freiliegenden Gefäßen des Abschnitts Leber platziert werden, sodass Lösung Temperatur 38 ° C mit der Einführung des Gewebes ist. Alle Schläuche, Ausrüstung und Lösungen einzuhalten um sicherzustellen, dass die Zellen für die Transplantation geeignet sind steril.
- Prime die Pumpe und Schlauch mit Pro II bis ein Absperrhahn aufgestellt, um zwischen pro I und II pro Lieferung des Gewebes zu wechseln. Wechseln Sie den Absperrhahn in das KGV ich positionieren und prime den Rest der gesetzten Schläuche füllen eine Inline-Blase-Trap komplett um die Einführung zu verhindern Luftblasen in das Gewebe.
- Bereiten Sie eine saubere quer Schnitt senkrecht auf die hepatische Zirkulation, Querschnitte der Pfortader Zweige zu offenbaren und hepatische Adern zur Katheterisierung.
- Katheterisieren Sie verfügbaren freiliegenden Adern mit einem eng anliegenden Katheter austreten von dem Perfusat zu vermeiden. Cannulate mindestens 1 Portal und 1 Lebervene um ausreichende Durchblutung des Gewebes zu gewährleisten.
- Sicherstellen Sie, dass die Catheter(s) grundiert/freie Luft vor der Platzierung des Katheters in eine Vene.
- Durchspülen Sie mit warmen pro ich bei 100 mL/min, bewegt das Auslaufrohr aus Ader, Vene alle 30 Sekunden, 1 min. Zyklus durch alle verfügbaren Adern für 15-20 min. Während pro ich setzen Infusion, eine Evakuierung Rohr, das Verfahren Fach in einen Abfallbehälter unter Vakuum zu leeren.
- 100 mL/min, Radfahren durch die Adern als mit pro ich, für eine Gesamtmenge von 30 min pro II schalten. Pro II Nutzungszeit eine Rückförderpumpe pro II zurück in den Behälter für die Verabreichung, Vorbereitung für das aktive Enzym zu konservieren zu recyceln. Legen Sie die Rückförderpumpe auf weniger als die Abfluss-Pumpe (d. h. 94 mL/min), ohne dabei überschüssige Luft in die Flasche Quelle zurück.
- Wenn die Leber Kapsel bricht, kann dieser Zeit reduziert werden.
- Wenn die Leber nicht vollständig verdaut wird (bleibt nicht mit sanftem Druck fokale Grübchen) eine zusätzliche 5 min der Perfusion durchgeführt werden kann.
- Gelegentlich (ca. alle 5 Minuten) dokumentieren Oberflächentemperatur der Blase Falle und/oder Leber zu gewährleisten, die Hepatozyten sind nicht kalt. Wenn die Leber kalt wird (< 35 ° C) erhöhen die Hitze des Wasserbads zur Wiederherstellung der Leber Temperatur näher bis 38 ° C. Die Leber sollte Blanche im weiteren Verlauf der Perfusion.
- Leber, sterile Platte oder Petrischale für den Transport nach Zelle Kultur Haube zu entfernen. Sterilen Bereich mit einem sterilen Tuch Integrität in die Hepatozyten Verarbeitung weiterhin zu decken.
- Aussetzen des Leber Abschnitts von sterilen Tuch und tauchen die Leber mit kalten Hepatozyten waschen Medien (HWM). Stören Sie die Kapsel durch Schere am oberen Rand ziehen. Mit sterilen Handschuhen, massieren Sie die Leber um die Hepatozyten in das Medium zu lösen.
- Filtern Sie die HWM mit Hepatozyten durch sterile Gaze in großen (ca. 200 mL) Zentrifuge Flaschen. Waschen Sie die Hepatozyten durch das folgende Verfahren in dreifacher Ausfertigung, kombinieren die Zelle Pellet aus mehreren Flaschen nach der ersten Wiederfreisetzung (soweit zutreffend):
- Zentrifuge bei 50 x g, 5 min, 4 ° C.
- Aspirieren und in 150 mL HWM aufzuwirbeln.
- Lassen Sie das Pellet in HWM nach der 3rd -Wäsche.
- Graf Zellkonzentration mit einem Hemocytometer oder einem anderen Gerät als verfügbar. Diese Zellen sind nun bereit für die ex-Vivo Manipulation von Interesse, einschließlich der Gentherapie, Zellsortierung oder andere Spezialisierung vor Autotransplantation. Endvolumen von HWM kann angepasst werden, um gezielt eine bestimmte Konzentration (Zellen/mL).
4. Hepatozyten Transduktion
- Aufschwemmen Hepatozyten in Medien (Dulbeccos modifizierten Eagle Medium [DMEM], 10 % fötalen Rinderserum [FBS], Penicillin-Streptomycin, 4-(2-hydroxyethyl)-1-Piperazineethanesulfonic Säure [HEPES], Dexamethason, epidermalen Wachstumsfaktor [EGF] und NTBC) bei 1 – 2 Million Zellen pro mL in einem konischen Rohr auf Eis.
- Tauen Sie Lentivirale Vektor bei Raumtemperatur auf und verleihen Sie konischem Rohr auf Eis am Ziel 20 Multiplizität der Infektion (MOI), die Zellen zu binden. Drehen Sie die Zellen bei 4 ° C bei 10 u/min für 90 min der viralen Vektoren an der Zelloberfläche binden.
- Übertragen Sie Röhren auf 37 ° C für 30-40 min. invertieren, mischen Sie alle 5 Minuten um den Vektor transducing gebundenen Zellen zu erleichtern.
- Zentrifugieren Sie Zellen bei 50 X g bei 4 ° C für 4 min. Aufschwemmen Zelle Pellet in Kochsalzlösung bei gewünschten Konzentration auf Eis. Wiederholen Sie diese waschen zur Entfernung von jedem ungebundenen Vektor von der Vorbereitung zu gewährleisten.
- Wenn möglich, Platte ausreichend Aliquote von Zellen (z.B. 500.000 Zellen pro Bohrloch in einem 6 Zellen gut Kultur Platte) auf Tragfähigkeit, Adhäsion, Transduktion Effizienz, etc. zu überprüfen
Hinweis: Es ist oft nicht möglich, diese Parameter vor dem Autotransplantation, vor allem für taggleiche Verfahren zu beurteilen. Zum Beispiel beschäftigt das hierin beschriebene Verfahren einen unmarkierten Fah cDNA unter der Kontrolle des Alpha-1 antitrypsin Leber-spezifischen Promotors, die nicht ohne weiteres assayable in den Hepatozyten vor der Transplantation war. Jedoch können diese vergoldeten Zellen im Anschluss an die Autotransplantation als Indikator für den Erfolg der Transduktion (d. h. per Western blotting) oder ein Indikator für den allgemeinen Erfolg des Verfahrens geprüft werden.
5. Hepatozyten Transplantation
- Identifizieren Sie die Pfortader per Ultraschall mit einer 2 bis 5 MHz-Schallkopf. Richten Sie eine 18 G, 5-Zoll-Nadel in Richtung Portal Hauptader proximal zu seiner Gabelung.
- Beginnen Sie langsam manuelle Infusion von bis 1 x 109 Hepatozyten (ca. 10 g) mit einer Spritze. Monitor Portal Druck während der Transplantation mit einer Infusion-Katheter.
- Wenn Portal Druck mehr als 8 MmHg über dem Ausgangswert erhöhen, pause Infusion und ermöglichen den Druck auf den Ausgangswert zurück.
- Wenn Portal Druck nicht zur Grundlinie nach dem Anhalten wieder Infusion für fünf Minuten, die Infusion einzustellen.
- Nach der Transplantation und Katheter entfernen verwenden des Ultraschalls auf das Vorhandensein von thrombotischen Ereignisse zu bewerten und fließen in die Pfortader weiterleiten.
6. postoperative Erholung und Pflege
- Unterliegt eine richtige Recovery-Bereich bewegen Sie und beobachten Sie, bis das Tier vollständig ambulante, Überwachung von Herzfrequenz, Sauerstoffsättigung und Temperatur des Körpers alle 15 – 30 min. Maintain Körpertemperatur mit warme Decken oder eine Luft erwärmt Wrap Bedarf ist.
- Verwalten Sie Omeprazol 1 mg/kg oral täglich (bis zum Ende der Studie) zur Verringerung der Chancen der gastrischen Geschwürbildung, die auftreten können mit Anfällen von Appetitlosigkeit.
- Postoperativ, das Tier ist durch Labor- und Tierärzten überwacht und erfordert in der Regel keine zusätzliche Schmerzmittel getrennt von der präoperativen Buprenorphin-Dosis. Wenn Anzeichen von Stress/Schmerzen durch qualifizierte tierärztliche Versorgung Personal (Einschnitt Bewachung, Appetitlosigkeit, Lethargie) eingehalten werden, können entzündungshemmende Mittel (z.B. Carprofen) verabreicht werden.
7. Rezepte
- In diesem Protokoll verwendeten Rezepte finden Sie unter Tabelle 1 .
| Reagenz | HWM | Reagenz | Pro ich (10 X) | Pro II (10 X) |
| Williams'-E Pulver (g/L) | 10.8 | NaCl (g/L) | 83 | 39 |
| Nahco33 (g/L) | 2.2 | KCl (g/L) | 5 | 5 |
| HEPES (g/L) | 2.6 | HEPES (g/L) | 24 | 240 |
| Pen/Strep (100 X, mL/L) | 10 | EGTA (g/L) | 9.5 | - |
| Fetale Rinderserum (mL/L) | 100 | N-Acetyl-L-Cystein | 8 | 8 |
| pH | 7.3 | (N-A-C, g/L) | ||
| Nitroglycerin (mL/L) | 5 | 5 | ||
| CaCl2 2 H2O (g/L) | - | 7 | ||
| Kollagenase D (mg/mL) | - | 0,2 | ||
| pH | 7.4 | 7.6 |
Tabelle 1: Rezepte für Lösungen in Hepatozyten Isolation von Leber Abschnitte verwendet.
Ergebnisse
Die Leber Resektion und autologe Transplantation sind schematisch in Abbildung 1dargestellt. In einer repräsentativen Gruppe von 5 Schweine, die hepatischen Resektion unterzogen, hatten die meisten Erträge von > 1 x 109 Hepatozyten mit ca. 80 % Lebensfähigkeit (Tabelle 2), bietet viele Zellen für jede Art von gewünschten Manipulationen, einschließlich gen Therapie. Nachfolgende Kultur nicht transplantiert Teil der vorbereiteten Hepatozyten aus jeder dieser 5 Schweine zeigten gute Lebensfähigkeit und Adhäsion, mit typischen Hepatozyten Morphologie 46 Stunden nach Transduktion und erste Beschichtung (Abbildung 2). Diese Ergebnisse sind repräsentativ für eine erfolgreiche Vorbereitung, während schlechte Ergebnisse mit einer niedrigen Anzahl von Zellen, Rentabilität oder minimal Einhaltung von Zellen in einem monomolekularen Film angezeigt werden würde.
Eine Leberbiopsie vor der Behandlung des Fah- / - Schweins zeigt kein Ausdruck der FAH über Immunohistochemistry (Abbildung 3). Anfängliche Engraftment variieren je nach der Anzahl der Zellen während der Transplantation wieder eingeführt. Transduktion Frequenzen von porcinen Hepatozyten in Vitro mit einer MOI von 10 TU/Hepatozyten Lentivirus ist in der Regel 70 – 100 %. Die Zellen eingepflanzt werden klonal in der Fah- / - Leber erweitern, bis die gesamte Leber durch die korrigierten Zellen aufgefüllt ist. Repräsentative Biopsien bei 2, 6 und 12 Monate zeigen eine Chronik der FAH-Positive Zelle Expansion, die in der Regel abgeschlossen nach 12 Monaten nach der Transplantation (Abbildung 3 ist). Noch ein geringer Prozentsatz des Engraftment dürften schließlich neu auffüllen, die Leber, obwohl tatsächliche erste Engraftment Preise in diesem Experiment nicht ausgewertet wurden.
Schweine sind sorgfältig überwachten Posttransplantationsperiode für Gewichtszunahme, Gedeihstörung ist ein Zeichen dafür, dass nicht genug Hepatozyten korrigiert vorhanden sind. In diesem Fall sind Tiere fuhr zurück auf NTBC wie nötig, bis die korrigierte Hepatozyten Bevölkerung zur kompletten Entwöhnung von der Droge ausreicht. Bewertung der zirkulierenden Biomarkern bequem um die Therapie zu folgen. Sobald ein Tier etwa 20 % erreicht hat Wiederbelegung der korrigierten Hepatozyten in der Leber, Tyrosin und Urinspiegel Ebenen normalisieren wird im Vergleich zu Wildtyp Tiere (Abb. 4A). Darüber hinaus zeigt das behandelt oder unbehandelte Fah- / - Schwein ähnliche fibrotische Leber Veränderungen in den betroffenen Menschen, die gefolgt Massons trichrome Färbung des seriellen Biopsien8gesehen. Surrogat-Marker für fortlaufende Schädigung der Leber können durch Prüfung im Umlauf Leberenzymen wie Aspartat-Aminotransferase und alkalische Phosphatase ausgewertet werden. Während unkorrigiert Tiere deutliche Erhöhung in beide Parameter im Vergleich zum Wildtyp Tiere zeigen, kehrt ex Vivo Gentherapie diese Serum-Werte normal (Abbildung 4 b und 4 C). Zu guter Letzt ist allgemeine metabolische Gesundheit der Leber in unbehandelten Fah- / - Schweine, gestört, wie durch Erhebungen in Ammoniak in Umlauf. Wiederbesiedlung der Leber mit korrigierten Zellen stellt Wildtyp Konzentrationen von Ammoniak (Abbildung 4).

Abbildung 1: Hepatektomie und autologe Transplantation. (Im Uhrzeigersinn von oben) Eine partielle Resektion der Leber erfolgt über das Thema zu eine Quelle von Hepatozyten und Leberregeneration zu stimulieren. Hepatozyten sind isoliert aus der resezierten Leber (blaue Zellen), ausgestrahlt ex Vivo mit der Lentivirale Vektor enthält das Transgen von Interesse (braun-Zellen), und dann die transduced Zellen sind autologously zurück zur Quelle Tier über transplantiert Pfortader Injektion. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: primäre Schwein Hepatozyten aus Leber. Hepatozyten wurden von Leber Resektionen von 5 verschiedenen Schweine gezüchtet, mit Lentivirale Vektor ausgestrahlt und für 48 h zu wachsen, um die Morphologie, Rentabilität, Reinheit und Haftung auf Kultur Gerichte zeigen durfte. Diese in-vitro- qualitative Bewertungen dienen als Surrogat Indikatoren für die Wahrscheinlichkeit einer erfolgreichen Engraftment in Vivo für jede Zubereitung. Bitte klicken Sie hier für eine größere Version dieser Figur.
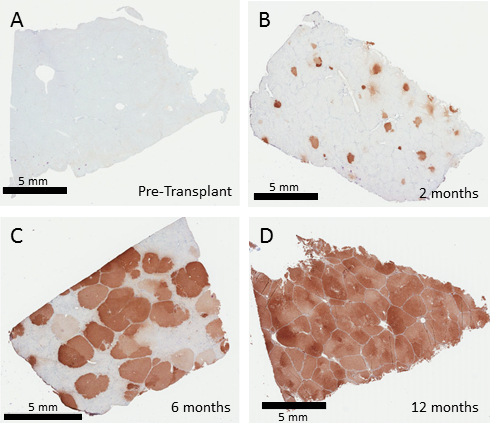
Abbildung 3: Korrigierte Hepatozyten bevölkern die Fah- / - Schwein Leber. FAH Immunohistochemistry Leberbiopsien 0, 2, 6 und 12 Monate nach Ex Vivo Gentherapie von autologen Hepatozyten. Unbehandelten Fah- / - Schweine zeigen keine FAH-positiven Zellen in der Leber (A). Zwei Monate nach der Transplantation (B), sind einzelne Brennpunkte der FAH positive Hepatozyten zu sehen die unterziehen dann Ausbau, 50 – 60 % der Leber nach 6 Monaten (C) gefolgt von vollständiger Ersatz gesehen nach 12 Monaten (D) zu ersetzen. Bitte klicken Sie hier für eine größere Version dieser Figur.
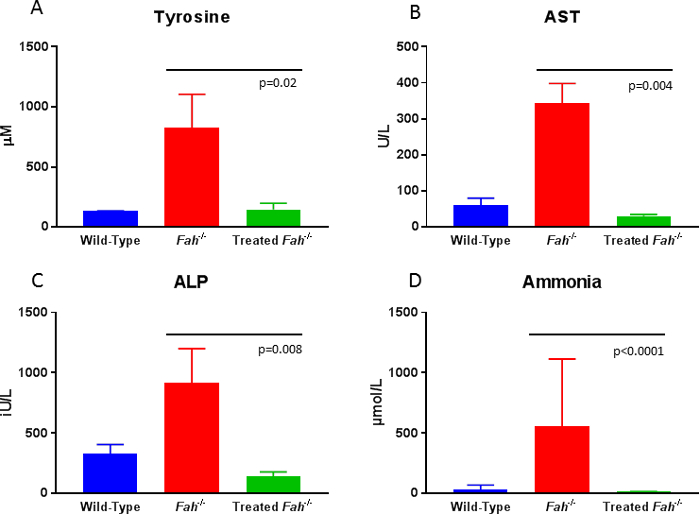
Abbildung 4: Serum Biochemie 10 Monate post ex Vivo Gentherapie bei Fah - / - Schweinen. 10 Monate nach Therapie, Tyrosin, Aspartat-Aminotransferase14, alkalische Phosphatase (ALP) und Ammoniak sind deutlich niedriger als die unbehandelten FAH mangelhaft Tiere und sind von Wildtyp Ebenen zu unterscheiden. Daten wurden für die Bedeutung, die mit dem Mann-Whitney U -Test (p -Werte wie dargestellt) analysiert. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Schwein | Insgesamt Zellen (X 106) | Zellen zu leben (X 106) | Tragfähigkeit (%) |
| 1 | 1.381 | 1.160 | 84 |
| 2 | 1.000 | 770 | 77 |
| 3 | 1.213 | 995 | 82 |
| 4 | 789 | 671 | 85 |
| 5 | 1318 | 975 | 74 |
| Durchschnitt | 1.140 | 914 | 80 |
| St-Dev | 244 | 194 | 5 |
Tabelle 2: Repräsentative Hepatozyten ergibt sich aus primären Isolationen von 5 Schweine.
Diskussion
Dieser Bericht beschreibt eine ex Vivo autologe gen Therapieansatz um ein porcinen Modell HT-1 zu heilen. Es geht um eine partielle Hepatektomie, gefolgt von ex-Vivo Hepatozyten Isolation und Transduktion von isolierten Hepatozyten mit Lenti Virus tragen das korrigierende Transgen. Korrigierte autologe Hepatozyten sind dann zurück zum FAH mangelhaft Tier durch die Pfortader8transplantiert. Obwohl die beschriebenen Verfahren auf alle großen Tiermodellen mit einigen Änderungen anwendbar ist, hat die FAH-defizienten Schwein den einzigartigen Vorteil einer hochselektiven Umgebung für korrigierte Zellen13,15. Diese Methode ist ein wirksames Heilmittel für HT-1, da dosierten Tiere NTBC unabhängiges Wachstum mit Normalisierung der biochemisch gemessenen Stoffwechselprodukte und entzündliche Leber Biomarker, Prävention von Leberzirrhose und HCC und die völlige Umkehrung der frühen Fibrose gesehen zeigen mit NTBC Radfahren. Darüber hinaus eine neuere Studie, die umfangreiche histologische Analyse keine nachweisbaren unkorrigierte Zellen, Fibrose, Zirrhose oder Tumorigenität 3 Jahre bewiesen hat post Therapie (Manuskript im Beitrag). Jedoch kann das Dienstprogramm der FAH-Null Hintergrund als Instrument zur Auswertung von einer Vielzahl von Vernehmungen in Hepatozyten Hinweise über HT-1 Physiologie und Krankheit lassen dienen.
Relative Erfolg des Verfahrens kann durch die Anzahl der Zyklen von NTBC erforderlich, bevor das Thema von diesem schützenden Medikament vollständig entwöhnt werden kann ausgewertet werden. In zahlreichen Iterationen mit diesem Modell und in anderen kleinen Tiermodellen der HT-1 ist ca. 20 % Korrektur erforderlich, bevor NTBC unabhängiges Wachstum erreicht wird. Mehr Radfahren mit NTBC zeugt von schlechten ersten Engraftment/Lebensfähigkeit, fortgeschrittene Lebererkrankung zum Zeitpunkt der ersten Engraftment oder schlechte Transgene Ausdruck, obwohl auch andere Faktoren eine Rolle spielen können. Biochemische Markern der Gesundheit der Leber (AST, ALT und Ammoniak) sind leicht zugänglich und bieten einen Einblick in das Ausmaß der korrigierten Hepatozyten Expansion, aber ultimative Prüfung des phänotypischen Heilung ist am besten durch die Normalisierung der Serum-Tyrosin erwiesen und Urinspiegel und histologische Bestätigung der FAH exprimierenden Hepatozyten bei fehlender Fibrose. Dies wird erreicht, wenn die Leber mit korrigierten Hepatozyten aufgefüllt worden ist.
Die Wirksamkeit des Verfahrens stützt sich am stärksten auf die Integrität der Hepatozyten, die steril und lebensfähigen während des gesamten Prozesses der Isolation, Transduktion und Transplantation einzuhalten sind. Wiedereinführung der nicht lebensfähige oder unkorrigierte Hepatozyten wird den Phänotyp nicht retten konnte, und eine erfolglose Verfahren Monate Thema Beobachtung zu überprüfen.
In diesem Modell ist gut Transgene Ausdruck des funktionalen FAH Enzyms eine Mindestanforderung für Leber Wiederbesiedlung. Lentivirus gibt nur einen Weg, eine effektive Kopie des Transgens zu liefern. Diese Methode erlaubt die Möglichkeit für den Einsatz von anderen Delivery-Systeme, einschließlich nicht-virale Systeme und die Bearbeitung des spezifischen genomischen Defekts abzielen. Schließlich ermöglicht dieses Modell eine Vielzahl von Möglichkeiten, wie z.B. die Korrektur von anderen Defekten in der FAH mangelhaft Bioreaktor. So lange die transplantierten Zellen eine funktionale FAH Enzym ausdrückt, würde jede andere Änderung der Zellen ex Vivo auch propagiert. Dadurch könnten alle angeborenen Fehler der Stoffwechsel der Leber in die FAH- / - Hintergrund korrigiert werden. Wie der Ausbau der korrigierten Hepatozyten letztlich die Leber repopulates, können relevante Zahl der Hepatozyten Anzeichen der Krankheit erreicht werden, was unterstreicht den Wert dieses Modell und Verfahren als Grundlagenwissenschaft und präklinische Therapie Modell.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren danken Duane Meixner für Kompetenz bei der Durchführung der Pfortader Einspritzung, Steve Krage, Joanne Pederson und Lori Hillin für Unterstützung bei chirurgischen Eingriffen. Diese Arbeit wurde durch die Kinder Krankenhaus von Minnesota-Stiftung und Regenerationsmedizin Minnesota unterstützt. R.D.H. wurde durch eine NIH K01 DK106056 Award und eine Mayo-Klinik-Zentrum für Regenerative Medizin Career Development Award finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (NTBC) | Yecuris | 20-0027 | |
| 12 mm Trocar | Covidien | B12STS | |
| 5 mm Trocar | Covidien | B5SHF | |
| Endo Surgical Stapler 60 | Covidien | EGIA60AMT | |
| Endo Surgical Stapler 45 | Covidien | EGIA45AVM | |
| Endo Surgical Stapler 30 | Covidien | SIG30AVM | |
| Endo catch bag | Covidien | 173050G | |
| 0 PDS | Ethicon | Z340H | |
| 2-0 Vicryl | Ethicon | J459H | |
| 4-0 Vicryl | Ethicon | J426H | |
| Dermabond | Ethicon | DNX12 | Sterile Dressing |
| Williams’-E Powder | Gibco | ME16060P1 | |
| NaHCO3 | Sigma Aldrich | S8875-1KG | |
| HEPES | Fisher | BP310-1 | |
| Pen/Strep | Gibco | 15140-122 | |
| Fetal Bovine Serum | Corning | 35-011-CV | |
| NaCl (g/L) | Sigma Aldrich | S1679-1KG | |
| KCl (g/L) | Sigma Aldrich | P3911-500G | |
| EGTA (g/L) | Oakwood Chemical | 45172 | |
| N-acetyl-L-cysteine | Oakwood Chemical | 3631 | |
| (N-A-C, g/L) | Sigma Aldrich | A9165-100G | |
| CaCl2 2H2O (g/L) | Sigma Aldrich | 223506-500G | |
| Collagenase D (mg/mL) | Crescent Chemical | 17456.2 | |
| Dulbecco's modified eagle medium (DMEM) | Corning | 15-013-CV | |
| Dexamethasone | Fresenius Kabi | NDC6337 | |
| Epidermal Growth Factor | Gibco | PHG0314 |
Referenzen
- Mak, C. M., Lee, H. C., Chan, A. Y., Lam, C. W. Inborn errors of metabolism and expanded newborn screening: review and update. Critical Reviews in Clinical Laboratory Sciences. 50 (6), 142-162 (2013).
- Hansen, K., Horslen, S. Metabolic liver disease in children. Liver Transplantation. 14 (5), 713-733 (2008).
- Schneller, J. L., Lee, C. M., Bao, G., Venditti, C. P. Genome editing for inborn errors of metabolism: advancing towards the clinic. BMC Medicine. 15 (1), 43 (2017).
- Brunetti-Pierri, N. Gene therapy for inborn errors of liver metabolism: progress towards clinical applications. Italian Journal of Pediatrics. 34 (1), 2 (2008).
- Carlson, D. F., et al. Efficient TALEN-mediated gene knockout in livestock. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17382-17387 (2012).
- Lindblad, B., Lindstedt, S., Steen, G. On the enzymic defects in hereditary tyrosinemia. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4641-4645 (1977).
- Hickey, R. D., et al. Noninvasive 3-dimensional imaging of liver regeneration in a mouse model of hereditary tyrosinemia type 1 using the sodium iodide symporter gene. Liver Transplantation. 21 (4), 442-453 (2015).
- Hickey, R. D., et al. Curative ex vivo liver-directed gene therapy in a pig model of hereditary tyrosinemia type 1. Science Translational Medicine. 8 (349), (2016).
- Naldini, L., et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272 (5259), 263-267 (1996).
- Bouard, D., Alazard-Dany, D., Cosset, F. L. Viral vectors: from virology to transgene expression. British Journal of Pharmacology. 157 (2), 153-165 (2009).
- Sakuma, T., Barry, M. A., Ikeda, Y. Lentiviral vectors: basic to translational. Biochemical Journal. 443 (3), 603-618 (2012).
- Chowdhury, J. R., et al. Long-term improvement of hypercholesterolemia after ex vivo gene therapy in LDLR-deficient rabbits. Science. 254 (5039), 1802-1805 (1991).
- Elgilani, F., et al. Chronic Phenotype Characterization of a Large-Animal Model of Hereditary Tyrosinemia Type 1. The American Journal of Pathology. 187 (1), 33-41 (2017).
- Patyshakuliyeva, A., et al. Carbohydrate utilization and metabolism is highly differentiated in Agaricus bisporus. BMC Genomics. 14, 663 (2013).
- Hickey, R. D., et al. Fumarylacetoacetate hydrolase deficient pigs are a novel large animal model of metabolic liver disease. Stem Cell Research. 13 (1), 144-153 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten