Method Article
猪自体移植肝细胞外细胞外细胞基因治疗
摘要
本方案旨在描述猪肝细胞分离和体外基因传递, 通过自体细胞移植治疗代谢疾病模型。虽然这种特殊的模式具有独特的优势, 有利于成功的治疗, 但应用是解决其他疾病和适应症的相关基础。
摘要
基因治疗是治疗肝脏代谢许多先天错误的理想选择。在体内, 慢病毒载体已成功地用于治疗人类的许多造血疾病, 因为它们的使用提供了稳定的转基因表达, 因为载体能够融入宿主基因组。该方法表明肝细胞体外基因治疗在 i 型遗传性酪氨酸血症大型动物模型中的应用。这个过程包括 1) 从自体供体受者动物中分离原代肝细胞, 2) 通过肝细胞转导和慢病毒载体进行体内基因传递, 以及 3) 通过门静脉移植矫正肝细胞静脉注射。该方法的成功通常取决于有效和无菌地去除肝切除术, 仔细处理切除标本的存活肝细胞足以重新移植, 分离细胞的高百分比转导,无菌外科手术贯穿始终, 以防止感染。在这些步骤中的任何一个步骤的技术故障都将导致用于自体移植或捐献者受者动物感染的活转染肝细胞的低产量。为这种方法选择的人类1型遗传性酪氨酸血症 (ht-1) 的猪模型是唯一适合这种方法, 因为即使是一小部分矫正细胞的植入将导致肝脏的再繁殖与健康的细胞基于强大的相对于本土病肝细胞的选择性优势。虽然这种生长选择并不适用于所有适应症, 但这种方法是扩展到其他适应症的基础, 并允许操纵这种环境, 以解决肝脏内外的其他疾病, 同时控制接触病毒载体和机会的非目标毒性和致瘤性。
引言
肝脏代谢的先天错误是一个遗传性疾病的家族, 共同影响多达每800例活产 1.其中许多疾病是单一基因缺陷2 , 可以通过将受影响基因的单一纠正副本引入足够数量的肝细胞3来功能治愈。需要纠正的肝细胞的实际百分比因疾病4而异, 在很大程度上取决于其编码的蛋白质的性质, 例如, 排泄蛋白与细胞质的关系。在大多数情况下, 任何代谢疾病治疗的疗效都很容易通过循环中经常存在的生物标志物来检测。
ht-1 是由富马3-1 乙酸水拉酶 (fah)5的缺陷引起的肝脏代谢的先天错误, 是酪氨酸代谢的最后一步。fah 缺乏导致肝脏中有毒代谢物的积累, 可导致急性肝功能衰竭和死亡, 或慢性形式的疾病可导致肝硬化和肝细胞癌。本病通过 2-(2-硝基-4-四氟甲基苯甲酰)-1, 3-环己二酮 (ntbc) 的管理进行临床管理, 这是一种小分子抑制剂的一种酶上游 fah 在酪氨酸代谢。这种疾病为测试基因治疗方法提供了一个理想的环境, 因为即使是少数肝细胞的成功矫正, 最终也会导致整个肝脏的重新繁殖, 在大小动物模型中都有修正的细胞7.,8. 出现这种情况的原因是, 由于毒性代谢物在未纠正的细胞中积累, 经校正的细胞具有深刻的生存优势。未矫正肝细胞的丢失允许与肝脏再生能力一致的修正肝细胞选择性扩张。治疗后, 可以很容易地测量移植后循环酪氨酸和琥珀酰丙酮水平的下降。
为了证明该程序的侵入性, 其中包括部分肝切除术, 这种方法的目标必须是持久的治疗。因此, 复制不称职的慢病毒载体被使用, 因为他们将稳定地融入肝细胞基因组9。确保随着肝脏的生长和扩张, 将修正后的基因传递给所有的子细胞, 以取代未矫正细胞的快速丢失。这是有利的腺病毒相关 (aav) 载体, 主要存在作为会代体, 只能通过一个单一的子细胞在有丝分裂10 , 从而失去任何效果的治疗在几个星期内。
尽管越来越多的文献支持慢病毒11的安全性, 但通过将宿主细胞的转导限制在受控的体外环境中, 缓解了人们对遗传毒性事件的担忧。自由载体从来没有系统地引入到宿主时, 这种方法进行, 限制暴露于肝细胞, 将通过自体移植通过门静脉重新引入。
本报告介绍了用于分离肝细胞的手术和体外程序的方法, 用于体内基因治疗和随后的自体移植 12治疗 ht-1 猪8。整个过程包括: 1) 部分肝切除术, 作为肝细胞的来源和生长刺激宿主的肝脏, 2) 肝细胞从切除的肝脏, 然后进行体外基因校正, 最后 3) 重新引入修正肝细胞回到宿主。所述方法适用于所有具有一定修饰的大型动物模型, 但只有缺乏 fah 的猪13将具有修正肝细胞的选择性环境的优势。
研究方案
所有动物程序都是按照机构准则进行的, 并在研究行为之前得到机构动物护理和使用委员会 (iacuc) 的审查和批准。这里描述的程序是在3个月以下被认为健康和适合手术的男性和女性大型白色农场猪 (50% landrace\ 50% 大白遗传背景) 身上进行的。 除非机构兽医护理人员认为动物不兼容, 否则动物是在社会中居住的。 动物每天吃两次适当水平的食物, 每天至少由护理人员观察一次临床体征。
1. 手术准备
- 肌肉内服用 5 mgkg telazol 和 2 mg/kg 木糖素, 诱导镇静。在 0.18 mgkg 的剂量下, 在 0.18 kg 的剂量下对丁丙诺非 sr 进行治疗 (预计此剂量的镇痛时间将达到 72小时)。手动检查动物的反应, 以验证镇静。
- 一旦镇静剂, 将静脉导管插入外周耳静脉, 以便进行药物治疗。
- 术前静脉注射 25 mgkg 头孢唑啉和肌肉注射 5 mg kg 头孢菌。
- 静脉注射正常盐水, 在整个过程中将血压和心率控制在正常生理范围内。
- 放置一个花胃管, 使胃减压。用适当大小的气管插管, 通过手动按压胸部来检测呼气, 验证适当的位置, 然后用1-3% 异氟醚对动物进行机械通气。
- 放置心电图 (ecg) 引线、血压袖口、温度探头和脉搏血氧仪, 以监测和记录生命体征。将动物置于仰角位置, 用 betadine 擦洗从肋骨笼到骨盆的腹部, 并消毒悬垂。
- 通气对象与1-3% 异氟醚在手术过程中保持麻醉的手术平面。继续监测生命体征的变化, 并相应调整异氟醚, 以保持心率在切口前的水平如果血压大幅下降, 减少异氟烷, 并启动机构批准的药物, 以恢复活力, 如静脉注射肾上腺素。
- 根据机构特有的政策, 在外科手术记录中记录心率、呼吸率、血压和体温, 以跟踪和维护动物福利, 确保遵守大型动物福利标准。
2. 腹腔镜肝部分切除术
- 使用开放的哈森技术头对脐带进行初始港口地点进入。当腹膜被可视化, 安全地引入一个12毫米的小车到腹腔。通过此端口通过5毫米、30°的示波器。
- 用 co2 至15毫米汞柱将腹部入内。在直接可视化的情况下, 使用腹腔镜摄像机, 在肝脏的左侧叶上放置两个额外的5毫米端口三角化。港口的确切位置将取决于动物的大小和解剖结构。
- 此时, 将腹腔镜放置在5毫米端口之一。
- 在左叶的主要裂隙点识别肝脏的左侧段。这种裂隙将医疗和左侧段分开。使用手术订书机 (见材料表), 将门静脉结构与肝静脉沿这口裂隙固定。使用60、45或30毫米长的血管载荷, 使用订书机的顺序发射, 将实质穿过这个裂隙。
- 当实质切除完成后, 评估残肝, 以确保充分的止血。用烧焦或缝合控制实质出血。
- 使用内窥镜掌握和内窥镜组织检索袋进行肝切片的检索。
- 卸下端口并关闭三层中的12毫米端口切口, 中线筋膜的中断尺寸为0缝合, 深真皮层的运行为2-0 缝合线, 近角质层的运行为4-0 缝合线。5毫米端口可以在一层关闭与2-0。
- 将无菌敷料放在切口上 (参见材料表)。
- 当细胞在不到4小时内准备好, 保持动物在全麻醉术后直到自体移植的时间。
- 或者, 如果细胞操作需要更长的时间 (例如允许肝细胞球体的形成或更长的传感器选择期), 允许动物从麻醉中恢复, 并重复当细胞准备好的时候, 自体移植前的麻醉诱导步骤。
3. 肝细胞分离
- 将带灌注装置的蠕动泵连接到导管 (在43°c 的水浴中维护), 将导管放置在肝脏部分的大暴露血管中, 以便在引入组织时, 溶液温度为38°c。所有的导管、设备和溶液都必须保持无菌状态, 以确保细胞适合移植。
- 提供带有每二的泵和油管, 其位置是在每一级和每二输送到组织之间切换。将塞子切换到每一位置, 并将管路的其余部分固定, 完全填充在线气泡陷阱, 以防止在组织中引入气泡。
- 准备一个垂直于肝脏循环的清洁横向切口, 以揭示门静脉分支和肝静脉的横截面, 用于导管插入。
- 将可用的暴露静脉插入一个适合的导管, 以避免香水泄漏。插管至少1个门静脉和1个肝静脉, 以确保组织的充分灌注。
- 在将导管放入静脉之前, 确保导管没有空气。
- 完美使用与温暖的每升在 100 mL/min, 移动出口管从静脉到静脉每30秒到1分钟循环通过所有可用的静脉15-20分钟。在每液输液过程中, 设置一个疏散管, 将手术托盘清空到真空下的废物容器中。
- 切换到每 ii 在 100 ml/min, 骑自行车通过静脉与每单位 i, 共30分钟。在每二期间, 使用返回泵将 per ii 回收回水库进行重新管理, 以保存活性酶的制备。将返回泵设置为小于流出泵 (即94 mL/min), 注意不要将过多的空气返回源瓶。
- 如果肝囊破裂, 这一次可以减少。
- 如果肝脏没有完全消化 (不保持酒窝与温和的焦点压力) 额外的5分钟灌注可以进行。
- 偶尔 (大约每 5分钟) 记录泡沫陷阱和肝脏的表面温度, 以确保肝细胞不会变冷。如果肝脏变冷 (和 lt;35 °c), 增加水浴的热量, 使肝脏温度接近38°c。肝脏应该在灌注过程中出现斑点。
- 取出肝脏到无菌板或培养皿运输到细胞培养罩。用无菌悬垂覆盖无菌场, 以在肝细胞加工过程中保持完整性。
- 从无菌悬垂中暴露肝脏切片, 用冷肝细胞洗涤介质 (hwm) 淹没肝脏。将剪刀拖过顶部, 将胶囊断开。戴无菌手套, 轻轻按摩肝脏, 将肝细胞释放到培养基中。
- 通过无菌纱布将含有肝细胞的 hwm 滤入大型 (~ 200 毫升) 离心机瓶中。在第一次再悬浮后, 将多个瓶子中的细胞颗粒结合起来, 通过以下程序将肝细胞洗一式三份, 如适用):
- 离心速度为 50 x g, 5分钟, 4°c。
- 在150毫升的 hwm 中吸气和重新悬浮。
- 第三次洗完之后, 将颗粒留在 hwm 中。
- 使用血细胞计或其他可用的设备计算细胞浓度。这些细胞现在已经准备好进行感兴趣的体外操作, 包括基因治疗、细胞分类或自体移植前的其他专业化。hwm 的最终体积可以调整为针对特定浓度 (cells/ml)。
4. 肝细胞转导
- 在培养基中再移植肝细胞 (dulbecco 的修饰鹰培养基 [dmem], 10% 胎牛血清 [fbs], 青霉素-链霉素, 4-(2-羟乙基)-1-吡嗪磺酸, 地塞米松, 表皮生长因子 [egf], ntbc) 在1–2在冰上的锥形管中每毫升的百万细胞。
- 在室温下解冻慢病毒载体, 并在目标20的感染 (moi) 上添加到冰上的锥形管, 以结合细胞。在10点9分的4°c 下旋转细胞 90分钟, 将病毒载体与细胞表面结合。
- 将试管转移到 37°c 30-40分钟. 反转每5分钟混合一次, 以方便载体传递结合的细胞。
- 在4°c 下以 50 x g 的速度离心细胞, 在盐水中以所需的浓度在冰上重新移植细胞颗粒。重复此清洗, 以确保从准备中删除任何未绑定的矢量。
- 如有可能, 可在6井细胞培养板中对细胞进行足够的平板检查 (即每口 5, 000 细胞, 以检查其活力、粘附、转导效率等.
注: 在自体移植之前, 通常无法评估这些参数, 尤其是当天的手术。例如, 此处描述的过程采用了一个未标记的fah cdna, 在α-1 抗胰蛋白酶肝特异性启动子的控制下, 在移植前, 这种启动子在肝细胞中不易被检测。然而, 这些镀金细胞可以在自体移植后进行检测, 作为转导成功的指标 (即通过西方印迹) 或程序的一般成功的预测指标。
5. 肝细胞移植
- 使用2至 5 mhz 换能器通过超声波识别门静脉。将 18 g, 5 英寸针指向靠近其分叉的主门静脉。
- 开始使用注射器缓慢地手动注入 1 x10 9 肝细胞 (约10克)。使用输液导管监测移植过程中的门静脉压力。
- 如果门户的压力超过基准量8毫米汞柱, 暂停输液, 并允许压力恢复到基准水平。
- 如果门户静脉压力在暂停输液5分钟后未恢复到基线, 请停止输液。
- 移植和拔管后, 使用超声评估门静脉中是否存在血栓事件和正向流动。
6. 术后恢复和维护
- 移动到适当的恢复区域, 并观察, 直到动物完全流动, 监测心率, 氧气饱和度和体温每 15-30分钟, 保持体温与温暖的毯子或空气加热包装, 根据需要。
- 每天口服 1 mg/kg 奥美拉唑 (通过研究结束), 以减少胃溃疡的机会, 可能发生发作的食欲不振。
- 术后, 动物由实验室和兽医人员密切监测, 通常不需要与术前丁丙诺非剂量分开的额外止痛药物。 如果由合格的兽医护理人员观察到疼痛的迹象 (切口保护、食欲不振、嗜睡), 则可使用消炎药 (即 carprofen)。
7. 食谱
- 有关此协议中使用的配方, 请参阅表 1 。
| 试剂 | hwm | 试剂 | 每 1 (10倍) | 每 2 (10倍) |
| williams ' e 散 (gl) | 10。8 | 氯化钠 (哥林) | 83 | 39 |
| nahco3 (g/l) | 2。2 | kcl (gl) | 5 | 5 |
| hpes (g) | 2。6 | hpes (g) | 24 | 240 |
| pensstrep (100x, mll) | 10 | egta (gl) | 9。8 | - |
| 胎儿牛血清 (mll) | 100元 | n-乙酰-l-半胱氨酸 | 8 | 8 |
| Ph | 7。3 | (n-a-c, g/l) | ||
| 硝酸甘油 (mll) | 5 | 5 | ||
| ccl2 2h 2H(g/2) | - | 7。 | ||
| 胶原酶 d (mg/ml) | - | 0。2 | ||
| Ph | 7。4 | 7。8 |
表 1: 用于肝段肝细胞分离的溶液配方。
结果
肝脏切除和自体移植在图 1中得到了示意图的表达。在5头接受肝切除术的有代表性的猪中, 大多数猪的产量为 gt;1 x10 9个肝细胞, 其生存能力约为 80% (表 2), 为包括基因在内的任何类型的理想操作提供了大量的细胞治疗。随后培养5头猪的未移植部分准备好的肝细胞表现出良好的生存能力和粘附力, 典型的肝细胞形态在转导和初始电镀46小时后 (图 2)。这些结果代表了成功的制备, 而糟糕的结果将表明细胞数量少, 活力, 或最小的细胞在单层。
在治疗 fa-/-猪之前进行肝脏活检, 通过免疫组织化学显示没有 fah 的表达 (图 3)。初始植皮将因移植过程中重新引入的细胞数量而变化。在 10 tu-churgocp 的 moi 中, 利用慢病毒体外培养的猪肝细胞的转导频率通常为70–100%。被移植的细胞将在法/肝中克隆扩张, 直到整个肝脏被矫正的细胞重新填充。在2个月、6个月和12个月时进行的代表性活检显示了 fah 阳性细胞扩张的时间表, 通常在移植后12个月内完成 (图 3)。即使是较低比例的雕刻也有望最终重新填充肝脏, 尽管在本实验中没有评估实际的初始雕刻率。
猪在移植后被仔细监测, 以获得体重, 因为不能茁壮成长是一个迹象, 表明没有足够的纠正肝细胞存在。在这种情况下, 动物根据需要在 ntbc 上循环返回, 直到修正后的肝细胞种群足以使药物完全断奶。对循环生物标志物的评估为遵循治疗提供了便捷的途径。一旦动物在肝脏中实现了约20% 的修正肝细胞再种群, 与野生动物相比, 酪氨酸和琥珀酮水平将正常化 (图 4 a)。此外, 未经治疗或未经治疗的fa-/ -猪表现出类似的纤维化肝脏变化, 在受影响的人身上看到, 其次是马松的三色体染色连续活检8。通过测定循环肝酶, 如天冬氨酸转氨酶和碱性磷酸酶, 可以评价持续肝损伤的代孕标志物。虽然与野生类型动物相比, 未矫正的动物在这两个参数上都显示出显著的升高,但体外基因治疗使这些血清值恢复正常 (图 4b和4B)。最后, 未经治疗的法/猪的肝脏代谢健康受到干扰, 循环氨的升高就表明了这一点。用矫正细胞重新吸收肝脏可以恢复野生类型的氨水平 (图 4d)。

图 1: 肝切除术和自体移植.(从顶部顺时针方向)部分肝切除是在受试者身上进行的, 以提供肝细胞的来源, 并刺激肝脏再生。肝细胞从切除的肝脏 (蓝色细胞) 中分离出来, 用含有感兴趣的转基因的慢病毒载体 (棕色细胞) 在体内外转化, 然后通过门静脉注射。请点击这里查看此图的较大版本.

图 2: 肝切片的原代猪肝细胞.肝细胞从5种不同的猪的肝脏切除中培养出来, 用慢病毒载体转化, 并允许生长 48小时, 以显示其形态、活力、纯度和对培养皿的粘附。这些体外定性评估可作为每种制剂在体内成功移植的可能性的代用指标。请点击这里查看此图的较大版本.
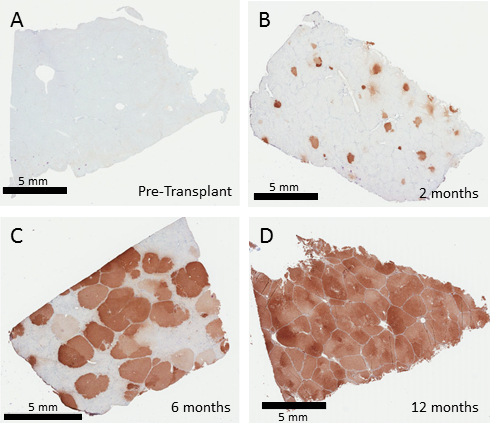
图 3: 修正肝细胞重新定位法-/ -猪肝。自体肝细胞体外基因治疗后0、2、6和12个月肝活检的 fah 免疫组化。未经治疗的法-/猪在肝脏 (a) 中没有 fah 阳性细胞。移植 (b) 后两个月, 会发现 fah 阳性肝细胞的个体病灶, 然后在 6个月 (c) 时进行扩张, 以取代50% 至60% 的肝脏, 然后在 12个月 (d) 时完全替换。请点击这里查看此图的较大版本.
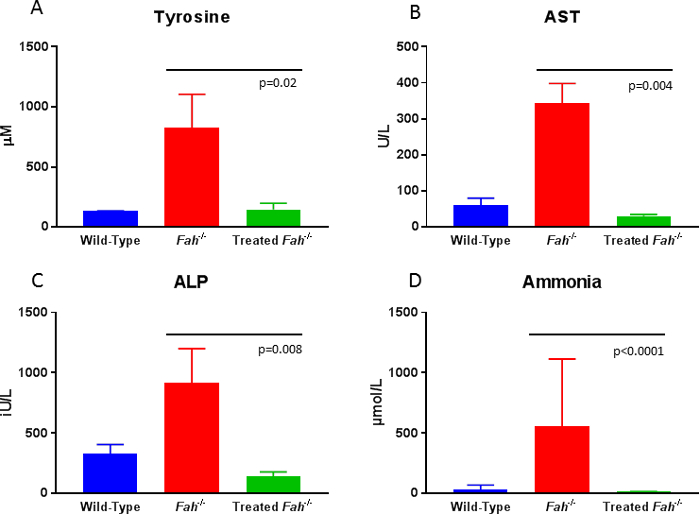
图 4:法/ /猪体内外基因治疗后10个月的血清生物化学。治疗10个月后, 酪氨酸、天冬氨酸转氨酶14、碱性磷酸酶 (alp) 和氨水平明显低于未经治疗的 fah 缺乏的动物, 与野生类型水平无法区分。利用曼恩-惠特尼u测试 (所介绍的p值) 对数据进行了重要分析。请点击这里查看此图的较大版本.
| 猪 | 总单元格 (x10 6) | 活细胞 (x10 6) | 可行性 (%) |
| 1 | 1, 381 | 1, 160 | 84 |
| 2 | 1, 000 | 770 | 77 |
| 3个 | 1, 213 | 995 | 82 |
| 4个 | 789 | 671 | 85 |
| 5 | 1318 | 975 | 74 |
| 平均 | 1, 140 | 914 | 80 |
| 圣德夫 | 244 | 194 | 5 |
表 2: 5 头猪原代分离的代表性肝细胞结果。
讨论
本报告介绍了一种治疗猪 ht-1 模型的体外自体基因治疗方法。它包括部分肝切除术, 其次是体外肝细胞分离和分离肝细胞与伦蒂病毒携带纠正转基因。经修正的自体肝细胞然后通过门静脉8移植回 fah 缺乏的动物。虽然所述方法适用于所有经过一定修改的大型动物模型, 但缺乏 fah 的猪具有对校正细胞13,15具有高度选择性的独特优势。这种方法是一种有效的治疗 ht-1, 因为剂量的动物显示 ntbc 独立生长与生物化学测量的代谢物和炎症性肝脏生物标志物的正常化, 肝硬化和 hcc 的预防和早期纤维化的完全逆转与 ntbc 自行车。此外, 最近一项涉及广泛组织学分析的研究表明, 治疗3年后没有可检测到的未纠正细胞、纤维化、肝硬化或致瘤 (复习手稿)。然而, fah-nnull 背景的效用可以作为一个工具, 可以评估在肝细胞生理学和疾病征兆超过 ht-1 的广泛的审讯。
该程序的相对成功可以通过所需的 ntbc 周期的数量来评估, 然后该主题才能完全摆脱这种保护性药物。在使用此模型的许多迭代和 ht-1 的其他小动物模型中, 在实现 ntbc 独立增长之前, 需要大约20% 的校正。更多的与 ntbc 的循环表明, 早期的雕刻能力差, 在最初的雕刻时的晚期肝病, 或不良的转基因表达, 虽然其他因素也可能发挥作用。肝脏健康的生化标志物 (ast、alt 和氨) 是现成的, 并提供了深入了解肝细胞扩张的程度, 但最终验证表型治疗是最好的证明, 以规范化的血清酪氨酸和在无纤维化的情况下, 琥珀酰丙酮和 fah 表达肝细胞的组织学证实。这是在肝脏被矫正的肝细胞重新填充时实现的。
该程序的有效性在很大程度上取决于肝细胞的完整性, 在整个分离、转导和移植过程中, 肝细胞必须保持无菌和可行。重新引入不可行或未纠正的肝细胞不会挽救表型, 一个不成功的程序可能需要几个月的主题观察来验证。
在该模型中, 良好的 fah 酶的转基因表达是肝脏再繁殖的最低要求。慢病毒只是传递转基因有效副本的一种方式。这种方法将允许使用其他运载系统, 包括非病毒系统和旨在编辑特定基因组缺陷的系统。最终, 该模型将允许大量的可能性, 包括纠正 fah 缺陷生物反应器中的其他缺陷。只要移植的细胞表达了功能性 fah 酶,任何其他对体内细胞的修饰也会被繁殖。这将允许肝脏代谢的任何先天错误在fah/背景中得到纠正。由于修正后的肝细胞的扩张最终会使肝脏重新填充, 任何疾病指征的肝细胞的相关数量都可以实现, 这突出了这种模型和程序作为基础科学和临床治疗前模型的价值。
披露声明
作者没有什么可透露的。
致谢
作者感谢 duane meixner 在执行门静脉静脉注射方面的专业知识, steve krage、joanne pederson 和 lori hillin 在外科手术期间的支持。这项工作得到了明尼苏达州儿童医院基金会和明尼苏达州再生医学的支持。r. d. h. 的资金来自 nih k01 dk106056 奖和梅奥再生医学职业发展中心奖。
材料
| Name | Company | Catalog Number | Comments |
| 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (NTBC) | Yecuris | 20-0027 | |
| 12 mm Trocar | Covidien | B12STS | |
| 5 mm Trocar | Covidien | B5SHF | |
| Endo Surgical Stapler 60 | Covidien | EGIA60AMT | |
| Endo Surgical Stapler 45 | Covidien | EGIA45AVM | |
| Endo Surgical Stapler 30 | Covidien | SIG30AVM | |
| Endo catch bag | Covidien | 173050G | |
| 0 PDS | Ethicon | Z340H | |
| 2-0 Vicryl | Ethicon | J459H | |
| 4-0 Vicryl | Ethicon | J426H | |
| Dermabond | Ethicon | DNX12 | Sterile Dressing |
| Williams’-E Powder | Gibco | ME16060P1 | |
| NaHCO3 | Sigma Aldrich | S8875-1KG | |
| HEPES | Fisher | BP310-1 | |
| Pen/Strep | Gibco | 15140-122 | |
| Fetal Bovine Serum | Corning | 35-011-CV | |
| NaCl (g/L) | Sigma Aldrich | S1679-1KG | |
| KCl (g/L) | Sigma Aldrich | P3911-500G | |
| EGTA (g/L) | Oakwood Chemical | 45172 | |
| N-acetyl-L-cysteine | Oakwood Chemical | 3631 | |
| (N-A-C, g/L) | Sigma Aldrich | A9165-100G | |
| CaCl2 2H2O (g/L) | Sigma Aldrich | 223506-500G | |
| Collagenase D (mg/mL) | Crescent Chemical | 17456.2 | |
| Dulbecco's modified eagle medium (DMEM) | Corning | 15-013-CV | |
| Dexamethasone | Fresenius Kabi | NDC6337 | |
| Epidermal Growth Factor | Gibco | PHG0314 |
参考文献
- Mak, C. M., Lee, H. C., Chan, A. Y., Lam, C. W. Inborn errors of metabolism and expanded newborn screening: review and update. Critical Reviews in Clinical Laboratory Sciences. 50 (6), 142-162 (2013).
- Hansen, K., Horslen, S. Metabolic liver disease in children. Liver Transplantation. 14 (5), 713-733 (2008).
- Schneller, J. L., Lee, C. M., Bao, G., Venditti, C. P. Genome editing for inborn errors of metabolism: advancing towards the clinic. BMC Medicine. 15 (1), 43 (2017).
- Brunetti-Pierri, N. Gene therapy for inborn errors of liver metabolism: progress towards clinical applications. Italian Journal of Pediatrics. 34 (1), 2 (2008).
- Carlson, D. F., et al. Efficient TALEN-mediated gene knockout in livestock. Proceedings of the National Academy of Sciences of the United States of America. 109 (43), 17382-17387 (2012).
- Lindblad, B., Lindstedt, S., Steen, G. On the enzymic defects in hereditary tyrosinemia. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4641-4645 (1977).
- Hickey, R. D., et al. Noninvasive 3-dimensional imaging of liver regeneration in a mouse model of hereditary tyrosinemia type 1 using the sodium iodide symporter gene. Liver Transplantation. 21 (4), 442-453 (2015).
- Hickey, R. D., et al. Curative ex vivo liver-directed gene therapy in a pig model of hereditary tyrosinemia type 1. Science Translational Medicine. 8 (349), (2016).
- Naldini, L., et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272 (5259), 263-267 (1996).
- Bouard, D., Alazard-Dany, D., Cosset, F. L. Viral vectors: from virology to transgene expression. British Journal of Pharmacology. 157 (2), 153-165 (2009).
- Sakuma, T., Barry, M. A., Ikeda, Y. Lentiviral vectors: basic to translational. Biochemical Journal. 443 (3), 603-618 (2012).
- Chowdhury, J. R., et al. Long-term improvement of hypercholesterolemia after ex vivo gene therapy in LDLR-deficient rabbits. Science. 254 (5039), 1802-1805 (1991).
- Elgilani, F., et al. Chronic Phenotype Characterization of a Large-Animal Model of Hereditary Tyrosinemia Type 1. The American Journal of Pathology. 187 (1), 33-41 (2017).
- Patyshakuliyeva, A., et al. Carbohydrate utilization and metabolism is highly differentiated in Agaricus bisporus. BMC Genomics. 14, 663 (2013).
- Hickey, R. D., et al. Fumarylacetoacetate hydrolase deficient pigs are a novel large animal model of metabolic liver disease. Stem Cell Research. 13 (1), 144-153 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。