Method Article
Citometria a flusso di phospho con codici a barre fluorescenti cella per cella singola segnalazione analisi e scoperta del biomarcatore
In questo articolo
Riepilogo
Qui, un protocollo per analisi di medio-alto rendimento degli eventi di fosforilazione della proteina a livello cellulare è presentato. Phospho flusso cytometry è un approccio potente per caratterizzare la segnalazione aberrazioni, identificare e validare biomarcatori e valutare farmacodinamica.
Abstract
Segnalazione delle cellule aberranti svolge un ruolo centrale nello sviluppo del cancro e nella progressione. Più nuove terapie mirate sono infatti diretti alle proteine e le funzioni della proteina, e aberrazioni segnalazione cellulare possono quindi servire come biomarcatori per indicare le opzioni di trattamento personalizzato. Al contrario di analisi del DNA e RNA, cambiamenti nell'attività della proteina in modo più efficiente possono valutare i meccanismi di resistenza e sensibilità ai farmaci. Citometria a flusso di phospho è una tecnica potente che misura gli eventi di fosforilazione della proteina a livello cellulare, una caratteristica importante che distingue questo metodo da altri approcci basati su anticorpi. Il metodo consente l'analisi simultanea di più proteine di segnalazione. In combinazione con codici a barre delle cellule fluorescenti, grandi insiemi di dati medio-alto rendimento possono essere acquisite da citometro standard hardware in breve tempo. Phospho flusso cytometry ha applicazioni sia negli studi di biologia di base e ricerca clinica, tra cui analisi, scoperta del biomarcatore e valutazione della farmacodinamica di segnalazione. Qui, un dettagliato protocollo sperimentale è previsto per fosfo analisi del flusso delle cellule mononucleari del sangue periferico purificata, utilizzando cellule di leucemia linfatica cronica come esempio.
Introduzione
Citometria a flusso di phospho viene utilizzato per analizzare i livelli di fosforilazione della proteina a cella singola risoluzione. L'obiettivo generale del metodo è di mappare i modelli di segnalazione cellulare in determinate condizioni. Sfruttando la capacità multiparametrica di citometria a flusso, parecchie vie di segnalazione possono essere analizzate simultaneamente in diversi sottogruppi di una popolazione cellulare eterogenea come sangue periferico. Queste caratteristiche offrono vantaggi rispetto ad altre tecnologie basate su anticorpi quali immunoistochimica, analisi enzima-collegata dell'immunosorbente (ELISA), matrice di proteine e fase inversa proteina matrice (RPPA)1. Citometria a flusso di phospho combinabile con codici a barre delle cellule fluorescenti (FCB), che significa che campioni di cellule individuali sono etichettati con firme uniche di coloranti fluorescenti in modo che possono essere mescolati tra loro, macchiati e analizzati come un singolo campione2. Questo riduce il consumo di anticorpo, aumenta la robustezza dei dati attraverso la combinazione di controllo e campioni trattati e aumenta la velocità di acquisizione. La popolazione complessiva di FCB possa essere divisi in più piccoli campioni e macchiata con gli anticorpi fosfo-specifici distinti fino a 35, a seconda della quantità di materiale di partenza. Grandi esperimenti profilatura possono, quindi, essere eseguiti con citometro standard hardware. Phospho flusso cytometry è stato applicato al profilo vie nei campioni di segnalazione da parecchi cancri ematologici compresi leucemia linfocitaria cronica (CLL)3,4,5, leucemia mieloide acuta (AML) 6 e non-Hodgkin linfomi7. Citometria a flusso di phospho è dunque un approccio potente per caratterizzare la segnalazione aberrazioni, identificare e validare biomarcatori e valutare farmacodinamica.
Qui, il protocollo ottimizzato per l'analisi di campioni di pazienti di CLL da citometria a flusso di phospho viene fornito (Figura 1A). Vengono illustrati esempi di caratterizzazione segnalazione basale, stimolazione del recettore delle cellule B/anti-IgM e perturbazione di droga. Viene fornita una descrizione dettagliata di una matrice FCB. Il protocollo può essere facilmente adattato ad altri tipi di cella di sospensione.
Protocollo
Campioni di sangue sono stati ricevuti a seguito di consenso informato scritto da tutti i donatori. Lo studio è stato approvato dal Comitato regionale per il medico e salute ricerca etica della Norvegia sud-est e la ricerca su sangue umano è stata condotta in conformità con la dichiarazione di Helsinki8.
Nota: Passaggi 1-3 devono essere eseguiti in condizioni di sterilità in un cappuccio di coltura del tessuto.
1. isolamento di cellule mononucleari del sangue periferico (PBMCs) da campioni di sangue del paziente di CLL
Attenzione: Il sangue umano deve essere maneggiati secondo le normative per il livello 2 di biosicurezza.
- Diluire il sangue 1:1 con tampone fosfato salino (PBS: 136,9 mM NaCl, 2.7 mM KCl, 10,1 mM Na2HPO4 x 2 H2O, 1,8 mM KH2PO4, pH 7.4) e trasferimento in provette da 50 mL (30 mL/tubo).
- Strato con attenzione 10 mL di un mezzo gradiente di densità (ad esempio, Lymphoprep) alla parte inferiore del tubo usando una pipetta da 10 mL.
- Centrifuga a 800 x g per 20 min a 4 ° C. I PBMC sono ora visibili sopra lo strato medio gradiente di densità.
- Utilizzare una pipetta Pasteur per trasferire le cellule in due nuove provette da 50 mL. Lavare due volte con PBS (riempire i tubi).
- Centrifugare a 350 x g per 15 min. scartare il supernatante e risospendere in 3 mL di PBS.
- Contare le celle utilizzando un metodo preferito.
- Centrifugare le cellule a 350 x g per 5 min, scartare il surnatante. Nota: 1.8 a 3.2 passaggi sono facoltativi. È possibile passare direttamente al punto 3.3.
- Risospendere le cellule in siero bovino fetale (FBS) completati con 10% di dimetilsolfossido (DMSO) e congelare giù in aliquote adatte utilizzando tubi di cryo.
Nota: DMSO è tossico per le cellule. Lavoro veloce una volta che le cellule sono mescolate con FBS/DMSO. Le cellule possono essere memorizzati a lungo termine in azoto liquido.
2. lo scongelamento delle cellule
- Scongelare rapidamente le cellule in bagnomaria a 37 ° C.
Nota: DMSO è tossico per le cellule. Lavorare velocemente per limitare l'esposizione a DMSO. - Lavare le cellule una volta con 10 mL di fluido freddo di Roswell Park Memorial Institute (RPMI 1640 con GlutaMAX supplementari, Vedi Tabella materiali).
- Centrifugare a 300 x g per 5 min, scartare il surnatante.
- Risospendere le cellule in RPMI 1640 supplementato con sodio piruvato, MEM non essenziali aminoacidi e penicillina/streptomicina (aggiunti alla diluizione di 1 x secondo le istruzioni) e 10% FBS. Trasferire le cellule in un pallone di cultura di piccole cellule e lasciare in un incubatore a 5% CO2, 37 ° C per 1 ora per permettere alle cellule di calibrare.
3. preparazione delle celle
- Contare le cellule vitali utilizzando un metodo preferito.
- Trasferire le cellule in una provetta 50 mL e centrifugare a 300 x g per 5 min, scartare il surnatante.
- Risospendere le cellule in medium RPMI 1640 (punto 2.2) completate con 1% FBS a non più di 50 x 106 cellule/mL.
- Trasferire la quantità necessaria di sospensione cellulare per pozzetti in una piastra di fondo V ben 96.
Nota: Numero di pozzi corrisponde al numero di condizioni da testare. Campioni per un corso di tempo di stimolazione sono disegnati da un singolo pozzo. Calcolare 50 µ l di campione al punto di tempo + 50 µ l di volume morto. Salvare i campioni per i controlli di compensazione (un campione senza macchia + un campione per tintura di codici a barre). - Trasferire la piastra ben 96 per un bagno di acqua pre-riscaldata 37 ° C. Riposare le cellule per 10 min.
4. la stimolazione e la fissazione delle cellule
Nota: Eseguire i passaggi da 4-8 sul banco di laboratorio (cioè, non sterile).
Attenzione: L'ingrediente principale della difficoltà Buffer I è paraformaldeide, che è tossico (inalazione e contatto). Maneggiare con cura.
- Preparare una piastra di fondo V ben 96 con 60 µ l di tampone di difficoltà che ogni pozzetto per campione. Lasciare a bagno d'acqua di 37 ° C.
Nota: Cellule: Fix buffer deve essere 1:1. Al fine di consentire l'evaporazione a 37 ° C, il buffer di Fix è inizialmente in abbondanza. - Facoltativamente, trattare le cellule con farmaci prima di stimolazione.
- Trasferire un campione di controllo 50 µ l per il piatto di correzione. Mescolare pipettando su e giù.
- Facoltativamente, è possibile iniziare il corso di tempo di stimolazione aggiungendo 10 µ g/mL anti-IgM alle cellule. Mescolare pipettando su e giù.
- Trasferire un 50 µ l di campione alla piastra di correzione in ogni momento. Mescolare pipettando su e giù.
Nota: Anti-IgM indotto segnalazione è iniziato solitamente presto (minuti). - Lasciare la piastra di correzione a 37 ° C per 10 min dopo l'aggiunta dell'ultimo campione.
5. fluorescente cella Barcoding (FCB)
Nota: Per un elenco di codici a barre reagenti, vedere tabella 1 .
- Lavare le cellule fisse 3 x con PBS (riempire i pozzetti).
- Centrifugare a 500 g per 5 min. eliminare il supernatante.
- Preparare una piastra di fondo V ben 96 con codici a barre reagenti. Pipettare 5 µ l di ciascun reagente di codici a barre per pozzetto nel numero di combinazioni necessarie per macchiare tutti i campioni seguendo la matrice di colorazione, per esempio, in Figura 1B. Ogni campione avrà una combinazione unica di codici a barre differenti concentrazioni.
- Risospendere le cellule in 190 µ l di PBS e trasferimento alla piastra di codici a barre. Mescolare accuratamente.
Nota: Macchia un esempio di compensazione con la più alta concentrazione finale utilizzata per ciascun reagente di codici a barre e salvare un campione senza macchia. - Lasciare le cellule per 20 min a temperatura ambiente al buio.
- Lavare le cellule marcate 2 x con flusso lavare (PBS, 1% FBS, 0,09% di sodio azide) (riempire i pozzetti).
- Centrifugare a 500 g per 5 min. eliminare il supernatante.
- Aggiungere 190 µ l di flusso lavare alle cellule e si combinano negli esempi di codice a barre in una provetta da 15 mL. Ogni controllo di compensazione di trasferimento ad un tubo separato 1,7 mL.
- Centrifugare a 500 g per 5 min. eliminare il supernatante.
6. cella permeabilizzazione per antigene intracellulare di colorazione
Attenzione: L'ingrediente principale di Perm Buffer III è metanolo che è tossico (inalazione e contatto) e infiammabili. Maneggiare con cura.
- Trasferire 2 mL di soluzione di Perm III in una provetta da 15 mL. Lasciare a-20 ° C quindi è ghiacciata al momento dell'impiego.
Nota: Il Buffer di Perm può essere lasciato a-20 ° C dall'inizio dell'esperimento. - Aggiungere 1,5 mL di Buffer di Perm ghiacciata per la popolazione delle cellule con codice a barre (in una provetta da 15 mL) e 100 µ l di ogni controllo di compensazione (in tubi di 1,7 mL) drop-wise mentre nel Vortex per evitare che le cellule si aggregano assieme.
- Trasferire le cellule direttamente a-80 ° C. Lasciare agire per un minimo di 30 min.
Nota: È naturale per mettere in pausa l'esperimento a questo punto. Le cellule in Perm Buffer possono essere memorizzati a lungo termine a-80 ° C.
7. anticorpi
Nota: Per un elenco dei segnalati anticorpi fosfo-specifici, vedere Tabella materiali .
- Trasferire le cellule da-80 ° C per una scatola di ghiaccio.
- Lavare 3 volte con flusso lavare.
Nota: È importante aggiungere flusso lavare in eccesso per vedere il pellet cellulare, ad esempio, aggiungere 3 mL di flusso lavare per la popolazione delle cellule con codice a barre e 1 mL per ogni controllo di compensazione. - Centrifugare a 500 g per 5 min a 4 ° C. Scartare il surnatante.
- Risospendere la popolazione delle cellule con codice a barre in un volume di flusso lavare, che permette di 25 µ l di sospensione cellulare a macchia di fosfo-anticorpo. Risospendere i controlli di compensazione in 200 µ l di flusso lavare.
- Preparare gli anticorpi per la colorazione in una piastra di fondo V ben 96. Il volume finale sarà 50 µ l/pozzetto. Ogni pozzetto, aggiungere fosfo-specifici dell'anticorpo diluito nel flusso lavare ad un volume finale di 10 µ l, marcatore di superficie diluito nel flusso lavare ad un volume finale di 15 µ l e 25 µ l di sospensione cellulare.
Nota: Diluizioni di anticorpo devono essere titolata in base prima dell'esperimento. Includono il controllo di isotipo. - Lasciare le cellule per 30 min a temperatura ambiente al buio.
- Lavare le cellule marcate 2 x con flusso lavare (riempire i pozzetti).
- Centrifugare a 500 g per 5 min. eliminare il supernatante.
- Risospendere le cellule in 150 µ l di flusso lavare.
8. preparazione dei controlli di compensazione
- Preparare i controlli di compensazione per l'anticorpo coniugato fluorocromi in parallelo con la macchiatura dell'anticorpo. Utilizzare perle di compensazione secondo le istruzioni del fornitore.
9. analisi di citometria a flusso di
Nota: L'esperimento può essere eseguito su un citometro a flusso con un alto Throughput Sampler (HTS).
- Ottimizzare la tensione di tubo (PMT) fotomoltiplicatore con il controllo senza macchia.
- Eseguire i controlli di compensazione e calcolare la matrice di compensazione.
- Eseguire i campioni. Il tasso di eventi deve essere in conformità con le specifiche dello strumento.
10. gating strategia e analisi dei dati
- Importare i file FCS dall'esperimento di un software di analisi di citometria a flusso come FlowJo o Cytobank (https://cellmass.cytobank.org).
- Strategia di gating
- Selezionare linfociti tracciando SSC-A contro FSC-A in una trama di puntino di densità.
- I linfociti di visualizzare e selezionare le canottiere tracciando SSC-A contro FSC - W.
- Visualizzare le singole cellule e cancello la cella digitare tracciando SSC-A contro la superficie dell'indicatore.
- Visualizzare la popolazione di tipo delle cellule in una trama di SSC-A densità contro Pacific Blue e selezionare le diverse popolazioni di FCB basate su loro Pacific Blue intensità di colorazione (Vedi Figura 1A).
- Tracciare il canale di anticorpi fosfo contro il canale FCB, o come un heatmap (Vedi Figura 1A) per visualizzare gli eventi di fosforilazione.
- Calcolare fosfo-segnali utilizzando il seno iperbolico inverso (arcsinh) di MFI (intensità fluorescente mediana) di fosfo-segnale contro controllo isotype (livelli di fosforilazione basale, Vedi Figura 1), o di stimolata contro popolazioni di cellule non stimolate (Vedi Figura 1E).
Risultati
Le fasi principali del protocollo fosfo flusso cytometry sono illustrate nella Figura 1A. Nell'esempio presentato, cellule di CLL sono state macchiate con il reagente di codici a barre Pacific Blue a quattro diluizioni. Codici a barre tridimensionale può essere eseguita combinando tre coloranti di codici a barre, come illustrato in Figura 1B. I singoli campioni sono poi riconducibili di gating successive su ogni barcoding reagente contro SSC-A (Figura 1). Informazioni dettagliate sui reagenti di codici a barre sono elencati nella tabella 1.
Seguendo la procedura qui descritta, livelli di fosfo-proteine sono stati caratterizzati in cellule di B da pazienti affetti da LLC e comandi normali sotto varie condizioni3. Entrambi i livelli di fosforilazione basale che indotta da stimolazione di 20 molecole a valle del recettore delle cellule B (BCR) sono stati analizzati di segnalazione (Vedi Tabella materiali per un elenco di anticorpi fosfo-specifici segnalati). I livelli basali di fosfo-proteine sono stati mappati in 22 campioni di pazienti di CLL rispetto alla media dei comandi normali. Questa analisi ha mostrato che STAT3 (pY705) è significativamente aumentata in cellule di CLL (Figura 1). L'attivazione costitutiva di STAT3 è stato segnalato in altre neoplasie ematologiche ed è associato con resistenza all'apoptosi9.
Al fine di identificare aberrazioni segnalazione indotte attraverso il pathway BCR, le cellule sono state stimolate con anti-IgM per fino a 30 min. È stato dimostrato che CLL cellule dai pazienti con IgVH unmutated stato (UM-CLL) visualizzazione aumentata sensibilità nei confronti di stimolazione anti-IgM10. Questo infatti è stato osservato per la maggior parte delle proteine analizzate, ma l'effetto era statisticamente significativa soltanto per AKT (pS473) (Figura 1E, UM-CLL versus M-CLL e normale). Per verificare se il segnale aberrante di AKT (pS473) potrebbe essere invertito CLL cellule sono state esposte per la PI3Kδ inibitore idelalisib, che viene utilizzato in clinica per il trattamento di pazienti CLL11. Come illustrato nella Figura 1F, livelli di AKT (pS473) sono stati ridotti significativamente sopra il trattamento di idelalisib in modo concentrazione-dipendente, che dimostrano che gli inibitori della chinasi possono essere applicati per normalizzare la segnalazione aberrante in cellule di CLL.
Questi risultati indicano che fosfo flusso cytometry in combinazione con FCB è un approccio potente per eseguire gli studi di analisi segnalazione, identificare potenziali biomarcatori e valutare farmacodinamica.
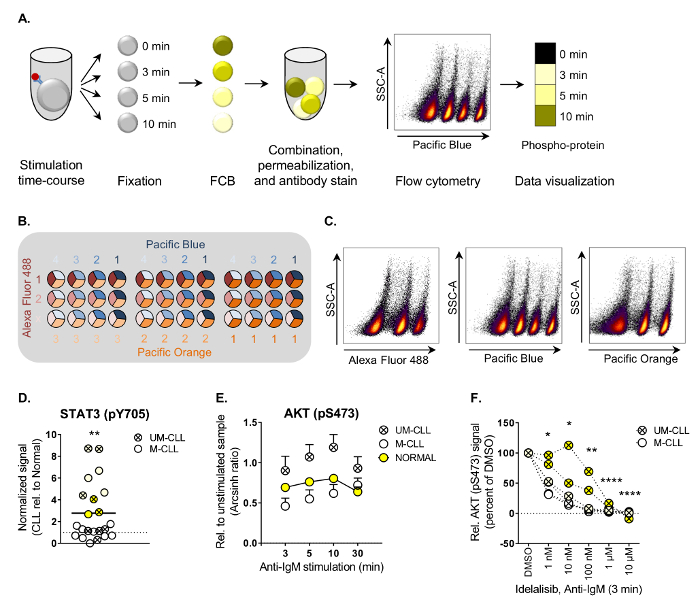
Figura 1. Flusso di lavoro ed esempi di analisi di citometria a flusso di phospho applicata.
(A) i principali passaggi della procedura flusso fosfo è illustrati. Cellule sono prima stimolate, quindi fisso e sottoposta ad un FCB prima possono essere combinati in una provetta per la permeabilizzazione e macchiatura dell'anticorpo successivo. Le cellule vengono eseguite su un citometro a flusso e le popolazioni delle cellule sono riconducibili di gating durante l'analisi dei dati. I risultati possono essere visualizzati come istogrammi o heatmaps, come mostrato. (B) esempio di un tridimensionale FCB macchiatura matrice utilizzando Alexa Fluor 488 (tre diluizioni), Pacific Blue (quattro diluizioni) e Pacific Orange (tre diluizioni). Questa matrice permetterà di combinazione di fino a 36 campioni. (C), la cella FCB popolazione possa essere riconducibili di gating su ogni canale FCB contro SSC-A. Combinazione dei cancelli del software di analisi genera le popolazioni corrette per l'analisi. (D) non stimolate B cellule da donatori sani (n = 25) e pazienti con LLC (n = 22) sono stati sottoposti ad analisi di flusso di phospho seguendo la procedura di (A). I segnali di intensità di fluorescenza basale sono stati calcolati rispetto IgGκ isotipo controllo come arcsinh rapporto. I segnali nelle cellule di CLL B quindi sono stati normalizzati per i segnali nelle cellule B dai comandi normali. p < 0.01, calcolato da un spaiati due campioni t-test. UM-CLL: IgVH unmutated CLL, M-CLL: IgVH mutato CLL. Simboli dello stesso colore rappresentano campioni di pazienti che raggruppate insieme in un gerarchico agglomerativo cluster basato su livelli di 20 fosfoproteine3. (E) B cellule dai comandi normali (n = 10, media + SEM) o pazienti affetti da LLC (n = 11 [M-CLL] e n = 8 [UM-CLL], media + SEM) sono stati stimolati con anti-IgM per il corso di tempo indicato e sottoposto ad analisi di flusso di phospho. I segnali di intensità di fluorescenza sono stati misurati in relazione campioni non stimolati e mostrati come arcsinh rapporto. p < 0.01 (normale vs UM-CLL) e * * *p < 0,001 (M-CLL vs UM-CLL), calcolato dal confronto tra più test con correzione di Holm-Sidak. UM-CLL: IgVH unmutated CLL, M-CLL: IgVH mutato CLL. (F) CLL cellule sono state incubate con DMSO o idelalisib come indicato per 20 min prima di stimolazione anti-IgM per 3 min. Le cellule sono stati poi elaborate seguendo il protocollo di flusso phospho. p < 0,05, * *p < 0.01, * * *p < 0,0001, calcolato dal confronto tra più test con correzione di Holm-Sidak. UM-CLL: IgVH unmutated CLL, M-CLL: IgVH mutato CLL. Per spiegazione di colore del simbolo, vedere (D). (D-F) vengono modificate da3. Clicca qui per visualizzare una versione più grande di questa figura.
| Serie diluita come segue (a partire con la soluzione di riserva) | ||||||
| Reagente di codici a barre | Concentrazione d'archivio | #1 | #2 | #3 | #4 | non macchiate |
| Alexa Fluor 488 | 10 mg/mL | 1: 500 | 1:5 | x | ||
| Pacific Blue | 10 mg/mL | 1: 2500 | 1:4 | 1:4 | 01:10 | |
| Pacifico Orange | 2 mg/mL | 01:50 | 01:12 | 01:24 | ||
Tabella 1. Reagenti di codici a barre.
Discussione
Citometria a flusso di phospho è una tecnica potente per misurare i livelli di fosforilazione della proteina in cellule singole. Poiché il metodo si basa su macchiando con gli anticorpi, citometria a flusso di phospho è limitata dalla disponibilità di anticorpo. Inoltre, al fine di ottenere risultati affidabili, tutti gli anticorpi dovrebbero essere titolati e verificati prima dell'uso. Un protocollo dettagliato per la titolazione di anticorpi fosfo-specifici è stato descritto altrove12. Durante la progettazione del pannello, la considerazione del rapporto segnale-rumore è fondamentale. Nell'esempio presentato, tutti fosfo-gli anticorpi erano coniugati con Alexa Fluor 647. Questo fluoroforo fornisce spesso il differenziale ottimo tra i campioni con bassa contro livelli elevati di fosfo-proteine. Inoltre, utilizzando un solo colore per le fosfoproteine altri canali saranno lasciati liberi per FCB e colorazione di superficie dell'indicatore. Questo design del pannello riduce la ricaduta nel canale di phospho. Avendo tutti i fosfo-anticorpi coniugati al fluoroforo stesso, l'analisi dei dati sarà anche semplificata.
Nel protocollo presentato, tutti gli stainings anticorpo sono stati eseguiti dopo la fissazione e la permeabilizzazione delle cellule. Tuttavia, è importante tenere a mente che la macchiatura di superficie dell'indicatore può risentire negativamente i passaggi di fissazione e permeabilizzazione a causa di denaturazione dell'antigene di superficie o non specifico maggiore macchiatura13. L'utente deve pertanto testare la reattività degli anticorpi su un caso per caso. Risorse su cloni compatibile possono anche essere utile, ad esempio la descrizione delle procedure di fissazione/permeabilizzazione differenti e la loro compatibilità con vari anticorpi alle https://www.cytobank.org/facselect/.
Fosforilazione della proteina o defosforilazione è una modificazione transitoria che si verifica in risposta a stimoli sia estrinseci ed intrinseci. Quando si confrontano modelli di fosforilazione, pertanto è fondamentale che gli esperimenti sono effettuati in condizioni simili. Quando studiare segnalazione in cellule primarie dal sangue, fattori che potrebbero influenzare il risultato includono il tempo trascorso dopo aver disegnato il sangue, le condizioni di conservazione e per quanto tempo le cellule isolate sono riposate prima dell'inizio dell'esperimento. Quando si confrontano modelli di segnalazione in cellule di cryo conservato appena isolate dal sangue, solo molto minori differenze significative potrebbero essere osservate (Skånland, non pubblicato). Tuttavia, è ancora consigliabile usare cryo conservato le cellule normali come un controllo quando si studia biobanked campioni, ad esempio. Le condizioni ottimali per l'esecuzione il phospho flusso cytometry esperimenti e l'impatto di fattori esterni deve essere testato dall'utente individuale.
Qui, un protocollo è presentato per fosfo analisi del flusso di cellule in sospensione. Il protocollo può essere adattato ad altri tipi di cella, ma è un prerequisito che le cellule sono in sospensione come singole cellule per l'analisi di citometria a flusso. La procedura per ottenere questo risultato deve essere delicata per preservare e non influenzare, modelli di fosforilazione. Dove le cellule aderenti sono staccate dal piatto coltura di freddo trypsination12,14, o piuttosto sono coltivate su microsfere15esistono esempi. Quando si tratta di phospho flusso cytometry il tessuto solido, un rapporto esiste su tumori del polmone dove singole cellule sono state ottenute facendo passare le cellule attraverso un tubo con una cella filtro16. Recentemente, fosfo flusso cytometry è stato combinato con un nuovo approccio definito disaggregazione per segnalazione intracellulare in cellule epiteliali singolo da tessuto (DISSEZIONARE) al fine di studiare la fosfo-proteine in tessuti epiteliali17 e cancro colorettale 18.
Il FCB è un passo fondamentale nel protocollo dato deconvoluzione dei campioni alla fine dell'esperimento si basa su popolazioni distinte di FCB. Per ottenere questo, le cellule hanno bisogno di essere colorato in modo omogeneo. Pertanto è importante preparare un piatto di codici a barre che le cellule possono essere aggiunti a. Aggiungendo i reagenti alle cellule si tradurrà in colorazione irregolare e popolazioni miste che non possono essere riconducibili di gating. Si consiglia vivamente di eseguire un test delle diluizioni barcoding prima che l'esperimento è eseguito come l'intensità di colorazione è cellula-tipo dipendente.
Ulteriori tecniche basate su anticorpo come proteina matrice e matrice di proteine di fase inversa (RPPA) possono essere applicati per la quantificazione dei livelli di fosfo-proteine in un mezzo alla maniera di alto-rendimento. Tuttavia, alcune qualità di phospho flusso cytometry distinguere questo metodo dagli altri. Un importante vantaggio di phospho flusso cytometry è che permette per la profilatura di singola cellula. Includendo gli indicatori di superficie per le diverse sottopopolazioni cellulari, può essere rilevata eterogeneità inter-cellulare. Combinazione con FCB consente inoltre per l'analisi delle diverse condizioni nello stesso sperimentale eseguito. Queste caratteristiche rendono fosfo flusso cytometry un interessante metodo per future applicazioni di biomarker discovery e precisione medicina19.
Divulgazioni
L'autore non ha nulla di divulgare.
Riconoscimenti
Questo lavoro è stato condotto nel laboratorio del Professor Kjetil Taskén ed è stato sostenuto dal norvegese Cancer Society e Stiftelsen Kristian Gerhard Jebsen. Johannes Landskron e Marianne Enger sono riconosciuti per la lettura critica del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| RPMI 1640 GlutaMAX | ThermoFisher Scientific | 61870-010 | Cell culture medium |
| Fetal bovine serum | ThermoFisher Scientific | 10270169 | Additive to cell culture medium |
| Sodium pyruvate | ThermoFisher Scientific | 11360-039 | Additive to cell culture medium |
| MEM non-essential amino acids | ThermoFisher Scientific | 11140-035 | Additive to cell culture medium |
| Lymphoprep | Alere Technologies AS | 1114547 | Density gradient medium |
| Anti-IgM | Southern Biotech | 2022-01 | For stimulation of the B cell receptor |
| BD Phosflow Fix Buffer I | BD | 557870 | Fixation buffer |
| BD Phosflow Perm Buffer III | BD | 558050 | Permeabilization buffer |
| Alexa Fluor 488 5-TFP | ThermoFisher Scientific | A30005 | Barcoding reagent |
| Pacific Blue Succinimidyl Ester | ThermoFisher Scientific | P10163 | Barcoding reagent |
| Pacific Orange Succinimidyl Ester, Triethylammonium Salt | ThermoFisher Scientific | P30253 | Barcoding reagent |
| Compensation beads | Defined by user | Correct species reactivity | |
| Falcon tubes | Defined by user | ||
| Eppendorf tubes | Defined by user | ||
| 96 well V-bottom plates | Defined by user | Compatible with the flow cytometer | |
| Centrifuges | Defined by user | For Eppendorf tubes, Falcon tubes and plates | |
| Water bath | Defined by user | Temperature regulated | |
| Flow cytometer | Defined by user | With High Throughput Sampler (HTS) | |
| Name | Company | Catalog Number | Comments |
| Antigen | |||
| AKT (pS473) | Cell Signaling Technologies | 4075 | Clone: D9E Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 |
| ATF-2 (pT71) | Santa Cruz Biotechnology | sc-8398 | Clone: F-1 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| BLNK (pY84) | Beckton Dickinson Pharmingen | 558443 | Clone: J117-1278 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| Btk (pY223)/Itk (pY180) | Beckton Dickinson Pharmingen | 564846 | Clone: N35-86 Reference: Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| Btk (pY551) | Beckton Dickinson Pharmingen | 558129 | Clone: 24a/BTK (Y551) Reference: Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 |
| Btk (pY551)/Itk (pY511) | Beckton Dickinson Pharmingen | 558134 | Clone: 24a/BTK (Y551) Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 |
| CD3ζ (pY142) | Beckton Dickinson Pharmingen | 558489 | Clone: K25-407.69 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| Histone H3 (pS10) | Cell Signaling Technologies | 9716 | Clone: D2C8 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| IκBα | Cell Signaling Technologies | 5743 | Clone: L35A5 Reference: Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| LAT (pY171) | Beckton Dickinson Pharmingen | 558518 | Clone: I58-1169 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| Lck (pY505) | Beckton Dickinson Pharmingen | 558577 | Clone: 4/LCK-Y505 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| MEK1 (pS298) | Beckton Dickinson Pharmingen | 560043 | Clone: J114-64 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| NF-κB p65 (pS529) | Beckton Dickinson Pharmingen | 558422 | Clone: K10-895.12.50 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| NF-κB p65 (pS536) | Cell Signaling Technologies | 4887 | Clone: 93H1 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 |
| p38 MAPK (pT180/Y182) | Cell Signaling Technologies | 4552 | Clone: 28B10 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| p44/42 MAPK (pT202/Y204) | Cell Signaling Technologies | 4375 | Clone: E10 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| p53 (pS15) | Cell Signaling Technologies | NN | Clone: 16G8 Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS20) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS37) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS46) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS392) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| PLCγ2 (pY759) | Beckton Dickinson Pharmingen | 558498 | Clone: K86-689.37 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| Rb (pS807/pS811) | Beckton Dickinson Pharmingen | 558590 | Clone: J112-906 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| S6-Ribos. Prot. (pS235/236) | Cell Signaling Technologies | 4851 | Clone: D57.2.2E Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| SAPK/JNK (pT183/Y185) | Cell Signaling Technologies | 9257 | Clone: G9 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| SLP76 (pY128) | Beckton Dickinson Pharmingen | 558438 | Clone: J141-668.36.58 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| STAT1 (pY701) | Beckton Dickinson Pharmingen | 612597 | Clone: 4a Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| STAT3 (pY705) | Beckton Dickinson Pharmingen | 557815 | Clone: 4/P-STAT3 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| STAT4 (pY693) | Zymed/ThermoFisher Scientific | 71-7900 | Clone: Polyclonal Reference: Uzel et al., 2001, Detection of intracellular phosphorylated STAT-4 by flow cytometry, Clin Immunol, 100(3): 270-6 |
| STAT5 (pY694) | Beckton Dickinson Pharmingen | 612599 | Clone: 47/Stat5(pY694) Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| STAT6 (pY641) | Beckton Dickinson Pharmingen | 612601 | Clone: 18/P-Stat6 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| SYK (pY525/Y526) | Cell Signaling Technologies | 12081 | Clone: C87C1 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 |
| ZAP70/SYK (pY319/Y352) | Beckton Dickinson Pharmingen | 557817 | Clone: 17A/P-ZAP70 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
Riferimenti
- Lu, Y., et al. Using reverse-phase protein arrays as pharmacodynamic assays for functional proteomics, biomarker discovery, and drug development in cancer. Seminars in Oncology. 43 (4), 476-483 (2016).
- Krutzik, P. O., Nolan, G. P. Fluorescent cell barcoding in flow cytometry allows high-throughput drug screening and signaling profiling. Nature Methods. 3 (5), 361-368 (2006).
- Myhrvold, I. K., et al. Single cell profiling of phospho-protein levels in chronic lymphocytic leukemia. Oncotarget. 9 (10), 9273-9284 (2018).
- Parente-Ribes, A., et al. Spleen tyrosine kinase inhibitors reduce CD40L-induced proliferation of chronic lymphocytic leukemia cells but not normal B cells. Haematologica. 101 (2), e59-e62 (2016).
- Blix, E. S., et al. Phospho-specific flow cytometry identifies aberrant signaling in indolent B-cell lymphoma. BMC Cancer. 12, 478 (2012).
- Irish, J. M., et al. Single cell profiling of potentiated phospho-protein networks in cancer cells. Cell. 118 (2), 217-228 (2004).
- Myklebust, J. H., et al. Distinct patterns of B-cell receptor signaling in non-Hodgkin lymphomas identified by single-cell profiling. Blood. 129 (6), 759-770 (2017).
- World Medical Association. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. THE JOURNAL OF THE AMERICAN MEDICAL ASSOCIATION. 310 (20), 2191-2194 (2013).
- Siveen, K. S., et al. Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors. Biochimica et Biophysica Acta. 1845 (2), 136-154 (2014).
- Fabbri, G., Dalla-Favera, R. The molecular pathogenesis of chronic lymphocytic leukaemia. Nature Reviews Cancer. 16 (3), 145-162 (2016).
- Arnason, J. E., Brown, J. R. Targeting B Cell Signaling in Chronic Lymphocytic Leukemia. Current Oncology Reports. 19 (9), 61 (2017).
- Landskron, J., Tasken, K. Phosphoprotein Detection by High-Throughput Flow Cytometry. Methods in Molecular Biology. 1355, 275-290 (2016).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. Journal of Immunology. 175 (4), 2357-2365 (2005).
- Pollheimer, J., et al. Interleukin-33 drives a proinflammatory endothelial activation that selectively targets nonquiescent cells. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (2), e47-e55 (2013).
- Ertsås, H. C., Nolan, G. P., LaBarge, M. A., Lorens, J. B. Microsphere cytometry to interrogate microenvironment-dependent cell signaling. Integrative biology: quantitative biosciences from nano to macro. 9 (2), 123-134 (2017).
- Lin, C. C., et al. Single cell phospho-specific flow cytometry can detect dynamic changes of phospho-Stat1 level in lung cancer cells. Cytometry A. 77 (11), 1008-1019 (2010).
- Simmons, A. J., et al. Cytometry-based single-cell analysis of intact epithelial signaling reveals MAPK activation divergent from TNF-alpha-induced apoptosis in vivo. Molecular Systems Biology. 11 (10), 835 (2015).
- Simmons, A. J., et al. Impaired coordination between signaling pathways is revealed in human colorectal cancer using single-cell mass cytometry of archival tissue blocks. Science Signaling. 9 (449), rs11 (2016).
- Friedman, A. A., Letai, A., Fisher, D. E., Flaherty, K. T. Precision medicine for cancer with next-generation functional diagnostics. Nature Reviews Cancer. 15 (12), 747-756 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon