Method Article
Cytométrie en flux phospho avec cellule fluorescente code-barres pour seule cellule signalisation d’analyse et découverte de Biomarker
Dans cet article
Résumé
Est présenté ici, un protocole d’analyse moyen - à haut-débit des événements de phosphorylation de la protéine au niveau cellulaire. Phospho cytométrie en flux est une approche puissante pour caractériser des aberrations signalisation, identifier et valider des biomarqueurs et évaluer pharmacodynamique.
Résumé
Signalisation cellulaire aberrante joue un rôle central dans le développement du cancer et de la progression. Plus de nouvelles thérapies ciblées visent en effet les protéines et les fonctions des protéines et des aberrations signalisation cellulaire peuvent donc servir de biomarqueurs pour indiquer les options de traitement personnalisé. Par opposition à des analyses d’ADN et d’ARN, changements dans l’activité de la protéine peuvent évaluer plus efficacement les mécanismes qui sous-tendent la résistance et sensibilité aux médicaments. Phospho cytométrie en flux est une technique puissante qui mesure les événements de phosphorylation de la protéine au niveau cellulaire, une caractéristique importante qui distingue cette méthode d’autres approches axées sur les anticorps. La méthode permet l’analyse simultanée de plusieurs protéines de signalisation. En combinaison avec cellule fluorescente barcoding, grands ensembles de données moyen - à haut-débit peuvent être acquis par matériel standard cytomètre en peu de temps. Phospho-cytométrie a des applications aussi bien dans des études de biologie fondamentale et en recherche clinique, y compris l’analyse, découverte de biomarqueurs et l’évaluation de la pharmacodynamique de signalisation. Ici, un plan expérimental détaillé est fourni pour l’analyse de flux de phospho de cellules mononucléaires de sang périphérique purifiée, utilisant des cellules de la leucémie lymphoïde chronique à titre d’exemple.
Introduction
Phospho cytométrie en flux est utilisé pour analyser le taux de phosphorylation de protéines à cellule unique résolution. L’objectif global de la méthode consiste à mapper les modèles de signalisation cellulaires dans des conditions spécifiées. En exploitant la capacité multiparamétrique de cytométrie en flux, plusieurs voies de signalisation peuvent être analysés simultanément dans différents sous-ensembles d’une population de cellules hétérogènes tels que du sang périphérique. Ces traits de caractère offrent des avantages par rapport aux autres technologies axées sur les anticorps comme immunohistochimie, immuno enzymatique (ELISA), alignement de protéine et inversion de phase protéine tableau (RPPA)1. Cytométrie en flux phospho est cumulable avec cellule fluorescente barcoding (FCB), ce qui signifie que les échantillons de cellules individuelles sont étiquetés avec des signatures uniques de colorants fluorescents afin qu’ils peuvent être mélangés entre eux, colorées et analysés comme un seul échantillon2. Cela réduit la consommation d’anticorps, augmente la robustesse des données grâce à la combinaison du contrôle et des échantillons traités et améliore la vitesse d’acquisition. La population combinée de FCB soient divisée en plus petits échantillons et colorée avec jusqu'à 35 anticorps phospho-spécifiques distincts, selon la quantité de matière première. Grandes expériences de profilage peuvent, ainsi, être exécutés avec le matériel standard cytomètre. Phospho écoulement cytometry a été appliqué au profil de signalisation dans les échantillons des patients de plusieurs cancers hématologiques, y compris la leucémie lymphoïde chronique (LLC)3,4,5, leucémie myéloïde aiguë (LMA) de lymphomes non hodgkiniens et 6 7. Phospho cytométrie en flux est donc une approche puissante pour caractériser des aberrations signalisation, identifier et valider des biomarqueurs et évaluer pharmacodynamique.
Ici, le protocole optimisé pour l’analyse des échantillons de patients de CLL par cytométrie en flux phospho est fourni (Figure 1 a). Exemples de caractérisation de signalisation basale, stimulation des récepteurs cellulaires anti-IgM/B et perturbation de la drogue sont indiqués. Une description détaillée d’une matrice FCB est fournie. Le protocole peut facilement être adapté à d’autres types de cellules de suspension.
Protocole
Des échantillons de sang ont été reçues après consentement éclairé de tous les donateurs. L’étude a été approuvée par le Comité régional à usage médical et de santé recherche éthique de la Norvège au sud-est et la recherche sur le sang humain a été effectuée conformément à la déclaration d’Helsinki8.
Remarque : Étapes 1-3 devraient être effectuées dans des conditions stériles sous une hotte de culture de tissus.
1. isolement de cellules mononucléaires du sang périphérique (PBMC) des échantillons de sang de patients de CLL
ATTENTION : Le sang humain doit être manipulé conformément aux règlements de niveau de biosécurité 2.
- Diluer le sang de 1:1 avec une solution saline tamponnée au phosphate (PBS : 136,9 mM NaCl, KCl, 2,7 mM 10,1 mM Na2HPO4 x 2 H2O, 1,8 mM KH2PO4, pH 7,4) et le transfert aux tubes de 50 mL (tube de 30 mL).
- Soigneusement la couche 10 mL d’un milieu de gradient de densité (par exemple, Lymphoprep) au fond du tube à l’aide d’une pipette 10 mL.
- Centrifuger à 800 x g pendant 20 min à 4 ° C. Les PBMC sont maintenant visibles sur le dessus de la couche moyenne gradient de densité.
- Utiliser une pipette Pasteur pour transférer les cellules dans deux nouveaux tubes de 50 mL. Laver deux fois avec du PBS (remplir les tubes).
- Centrifuger à 350 x g pendant 15 min. jeter le surnageant et remettre en suspension dans 3 mL de PBS.
- Compter les cellules à l’aide d’une méthode de choix.
- Centrifuger les cellules à 350 x g pendant 5 min. jeter le surnageant. Remarque : Étapes de 1,8 à 3,2 sont facultatives. Il est possible de passer directement à l’étape 3.3.
- Remettre en suspension les cellules en sérum fœtal (SVF) additionné de 10 % le diméthylsulfoxyde (DMSO) et gèle vers le bas en aliquotes appropriés à l’aide de cryo tubes.
Remarque : DMSO est toxique pour les cellules. Travail rapide une fois que les cellules sont mélangées avec FBS/DMSO. Les cellules peuvent être stockées à long terme dans l’azote liquide.
2. la décongélation des cellules
- Rapidement décongeler les cellules dans un bain-marie à 37 ° C.
Remarque : DMSO est toxique pour les cellules. Travailler vite pour limiter l’exposition au DMSO. - Laver les cellules une fois avec 10 mL de froid milieu de Roswell Park Memorial Institute (RPMI 1640 avec GlutaMAX supplémentaire, voir Table des matières).
- Centrifuger à 300 x g pendant 5 min. éliminer le surnageant.
- Remettre en suspension les cellules dans un milieu RPMI 1640 additionné de pyruvate de sodium, des acides aminés non essentiels MEM et pénicilline/streptomycine (ajouté à une dilution 1 x conformément aux instructions) et 10 % FBS. Transférer les cellules dans un flacon de culture cellulaire petit et laisser dans un incubateur à 5 % CO2, 37 ° C pendant 1 heure pour permettre les cellules à calibrer.
3. préparation des cellules
- Compter les cellules viables à l’aide d’une méthode de choix.
- Transférer les cellules dans un tube de 50 mL et centrifuger à 300 x g pendant 5 min. éliminer le surnageant.
- Remettre en suspension les cellules dans un milieu RPMI 1640 (étape 2.2) additionnés de 1 % FBS à pas plus de 50 x 106 cellules/mL.
- Transférer le montant requis de suspension cellulaire à Herbert George wells dans une plaque de fond V 96 puits.
Remarque : Nombre de puits correspond au nombre des conditions à tester. Échantillons pour un temps de stimulation sont tirés d’un puits unique. Calculer 50 µL d’échantillon par point dans le temps + 50 µL de volume mort. Enregistrer les échantillons pour les contrôles de compensation (un échantillon non coloré + un échantillon par codes à barres colorant). - Transférer la plaque 96 puits dans un bain d’eau préchauffée 37 ° C. Reposer les cellules pendant 10 min.
4. la stimulation et la Fixation des cellules
Remarque : Effectuez les étapes 4-8 sur le banc de laboratoire (c.-à-d., non stérile).
ATTENTION : L’ingrédient principal du tampon Difficulté j’ai est paraformaldéhyde, qui est toxique (contact peau et inhalation). Manipuler avec précaution.
- Préparer une plaque de fond en V puits 96 60 µl de tampon de Difficulté j’ai / puits par échantillon. Laisser dans le bain-marie à 37 ° C.
Remarque : Cellules : Solution tampon devrait être de 1:1. Pour permettre l’évaporation à 37 ° C, le tampon de Fix est initialement dans l’abondance. - Vous pouvez également traiter les cellules avec des médicaments avant la stimulation.
- Transférer un échantillon témoin de 50 µL dans la plaque de fix. La composition de pipetage de haut en bas.
- Éventuellement, commencer la stimulation temporelle en ajoutant 10 µg/mL anti-IgM aux cellules. La composition de pipetage de haut en bas.
- Transférer un 50 µL d’échantillon à la plaque de fix à chaque instant. La composition de pipetage de haut en bas.
Remarque : IgM anti-induite est généralement initié au début de la signalisation (minutes). - Laisser la plaque de fix à 37 ° C pendant 10 min après que le dernier échantillon a été ajouté.
5. fluorescent cellule Barcoding (FCB)
Remarque : Voir le tableau 1 pour une liste de codes à barres réactifs.
- Laver les cellules fixes 3 x avec du PBS (remplir les puits).
- Centrifuger à 500 x g pendant 5 min. éliminer le surnageant.
- Préparer une plaque de fond en V puits 96 avec des réactifs de codes à barres. Pipette 5 µL de chaque réactif de codes à barres / puits dans le nombre de combinaisons pour colorer tous les échantillons après la matrice de coloration, par exemple, dans la Figure 1 b. Chaque échantillon aura une combinaison unique des concentrations de différents codes à barres.
- Remettre en suspension les cellules en 190 µL de PBS et transfert sur la plaque de code à barres. Mélanger soigneusement.
Remarque : Détachant un échantillon de compensation la plus forte concentration finale utilisée pour chaque réactif de codes à barres et enregistrer un échantillon non coloré. - Laissez les cellules pendant 20 min à température ambiante, dans l’obscurité.
- Laver les cellules colorées 2 x avec lavage de flux (PBS, 1 % FBS, 0,09 % d’azide de sodium) (remplir les puits).
- Centrifuger à 500 x g pendant 5 min. éliminer le surnageant.
- Ajouter 190 µL de lavage de flux dans les cellules et combiner les échantillons avec code à barres dans un tube de 15 mL. Transférer chaque commande de compensation dans un tube séparé de 1,7 mL.
- Centrifuger à 500 x g pendant 5 min. éliminer le surnageant.
6. cellule perméabilisation pour la coloration des antigènes intracellulaires
ATTENTION : L’ingrédient principal de Perm tampon III est de méthanol qui est toxique (contact par inhalation et la peau) et inflammable. Manipuler avec précaution.
- Transférer 2 mL de Perm tampon III dans un tube de 15 mL. Laissez à-20 ° C n’est glacée après utilisation.
Remarque : On peut laisser le tampon de Perm à-20 ° C dès le début de l’expérience. - Ajouter 1,5 mL de tampon de Perm glacé à la population de cellules avec code à barres (dans un tube de 15 mL) et 100 µL à chaque commande de compensation (dans des tubes de 1,7 mL) titration en vortex pour éviter que les cellules s’agglutiner ensemble.
- Les cellules de transfert directement à-80 ° C. Laissez pendant au moins 30 min.
Remarque : Il est naturel de mettre en pause l’expérience à ce stade. Les cellules dans un tampon Perm peuvent être stockées à long terme à-80 ° C.
7. anticorps
Remarque : Voir Table des matières pour obtenir une liste des déclarés anticorps phospho-spécifiques.
- Les cellules de transfert de-80 ° C à une boîte de glace.
- Laver 3 x avec lavage de flux.
Remarque : Il est important d’ajouter le flux lavage en excès pour voir le culot cellulaire, par exemple, ajouter 3 mL de lavage de flux à la population de cellules avec code à barres et 1 mL pour chaque commande de compensation. - Centrifuger à 500 x g pendant 5 min à 4 ° C. Jeter le surnageant.
- Resuspendre la population de cellules avec code à barres dans un volume de lavage de flux, qui permet à 25 µL de suspension cellulaire par coloration phospho-anticorps. Resuspendre les commandes de compensation dans 200 µL de lavage de flux.
- Préparer des anticorps pour la coloration dans une plaque de fond V 96 puits. Le volume final sera 50 µL/puits. Par puits, ajoutez l’anticorps phospho-spécifiques dilué dans le débit de lavage pour un volume final de 10 µL, marqueur de surface dilué dans le débit de lavage pour un volume final de 15 µL et 25 µL de suspension cellulaire.
Remarque : Les dilutions anticorps devraient être réglées avant l’expérience. Inclure le contrôle de l’isotype. - Laissez les cellules pendant 30 min à température ambiante, dans l’obscurité.
- Laver les cellules colorées 2 x avec lavage de flux (remplir les puits).
- Centrifuger à 500 x g pendant 5 min. éliminer le surnageant.
- Remettre en suspension les cellules de 150 µL de lavage de flux.
8. préparation des commandes de Compensation
- Préparer les contrôles de compensation pour les anticorps conjugués fluorochromes en parallèle avec la souillure d’anticorps. Utilisez des perles de compensation conformément aux instructions du fournisseur.
9. analyse en cytométrie en flux
Remarque : L’expérience peut être exécutée sur un cytomètre de flux avec un Sampler élevée de débit (HTS).
- Optimiser la tension du tube (PMT) photomultiplicateur avec le contrôle sans coloration.
- Exécuter les contrôles de compensation et de calculer la matrice de compensation.
- Exécuter les exemples. Le taux d’événements devrait être selon les spécifications de l’appareil.
10. blocage stratégie et analyse des données
- Importer les fichiers de FCS de l’expérience d’un logiciel d’analyse de cytométrie en flux comme FlowJo ou Cytobank (https://cellmass.cytobank.org).
- Stratégie de blocage
- Sélectionnez des lymphocytes en traçant SSC-A contre FSC-a dans une parcelle de dot de densité.
- Affichez les lymphocytes et sélectionnez les maillots en traçant SSC-A contre FSC - W.
- Afficher les cellules individuelles et porte de la cellule type de traçage SSC-A contre le marqueur de surface.
- Afficher la population type de cellule dans un bleu Pacifique contre terrain de densité SSC-A, puis sélectionnez les différentes populations de FCB fondées sur leur intensité de coloration de Pacific Blue (voir la Figure 1 a).
- Tracer le canal d’anticorps phospho contre la chaîne FCB, ou comme un heatmap (voir Figure 1 a) pour afficher les événements de phosphorylation.
- Calculer phospho-signaux à l’aide de l’arcsinus hyperbolique (arcsinh) de l’IFM (intensité de fluorescence médiane) de phospho-signal versus isotype contrôle (taux de phosphorylation basale, voir Figure 1), ou de stimulée par rapport populations de cellules non stimulées (voir Figure 1E).
Résultats
Les principales étapes du protocole phospho écoulement cytometry sont illustrées dans la Figure 1 a. Dans l’exemple présenté, cellules CLL ont été colorées avec le réactif de barcoding Pacific Blue à quatre dilutions. Code à barres en trois dimensions peut être effectuée en combinant trois colorants de codes à barres, comme illustré dans la Figure 1 b. Les échantillons individuels sont ensuite déconvolutés par blocage subséquent sur chaque barcoding réactif par rapport aux SSC-A (Figure 1). Des informations détaillées sur les réactifs de codes à barres sont énumérés au tableau 1.
En suivant la procédure décrite ici, niveaux phosphoprotéine ont été caractérisées dans les cellules de patients atteints de LLC et témoins normaux sous diverses conditions3B. Les deux ordres de basale et induites par la stimulation de la phosphorylation de 20 signalisation des molécules en aval du récepteur des cellules B (BCR) ont été analysés (voir Table des matières pour obtenir une liste des déclarés anticorps phospho-spécifiques). Niveaux de phosphoprotéine basale ont été cartographiés dans 22 échantillons de patients de CLL par rapport à la moyenne des témoins normaux. Cette analyse a montré que STAT3 (pY705) est significativement augmentée chez les cellules CLL (Figure 1). Activation constitutive de STAT3 a été signalée chez les autres hémopathies malignes et est associée à la résistance à l’apoptose,9.
Afin d’identifier la signalisation des aberrations induites par la voie de la BCR, les cellules sont stimulées avec IgM anti-jusqu'à 30 min. Il a été démontré que les CLL cellules provenant de patients d’IgVH unmutated État (UM-CLL) augmenté sensibilité vers les IgM anti-stimulation10. Cela a été observé en effet pour la plupart des protéines analysées, mais l’effet n’était significatif que pour AKT (pS473) (Figure 1E, UM-CLL contre M-CLL et Normal). Pour tester si le signal aberrant de AKT (pS473) pourrait être inversé, CLL cellules sont exposées à l’idelalisib d’inhibiteur de la PI3Kδ, qui est utilisé en clinique pour traiter les patients CLL11. Comme sur la Figure 1F, niveaux AKT (pS473) ont été significativement réduits par traitement idelalisib d’une manière dépendante de la concentration, ce qui démontre que les inhibiteurs de la kinase peuvent être appliquées pour normaliser la signalisation aberrant dans les cellules CLL.
Ces résultats montrent que phospho cytométrie en combinaison avec le FCB est une approche puissante pour effectuer des études d’analyse de signalisation, identifier des biomarqueurs potentiels et d’évaluer la pharmacodynamique.
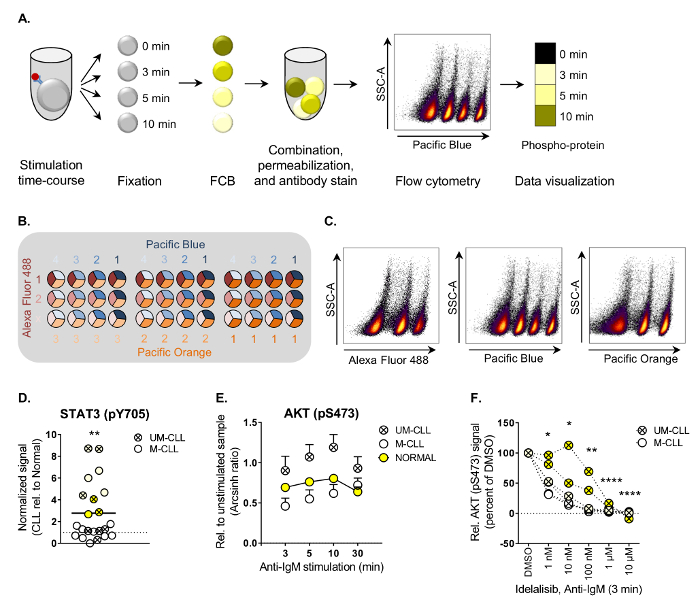
La figure 1. Flux de travail et des exemples d’analyse en cytométrie en flux phospho appliquée.
(A), les principales étapes de la procédure de circulation phospho sont illustrées. Cellules d’abord stimulés, puis fixe et soumis à FCB avant qu’ils peuvent être combinés dans un seul tube pour perméabilisation et anticorps ultérieurs. Les cellules sont exécutés sur un cytomètre en flux et les populations de cellules sont déconvolutées par blocage lors de l’analyse de données. Les résultats peuvent être visualisées en histogrammes ou heatmaps, tel qu’illustré. (B) exemple d’un FCB tridimensionnelle coloration de matrice à l’aide de Alexa Fluor 488 (trois dilutions), Pacific Blue (4 dilutions) et Pacific Orange (trois dilutions). Cette matrice permettra de combinaison de jusqu'à 36 échantillons. (C), la cellule FCB population peut être déconvolutée par blocage sur chaque canal FCB le versus SSC-A. Combinaison des portes dans le logiciel d’analyse génère les populations correctes pour l’analyse. B non stimulées (D) les cellules de donneurs sains (n = 25) et les patients atteints de LLC (n = 22) ont été soumis à l’analyse de flux phospho suivant la procédure décrite dans (A). Les signaux d’intensité de fluorescence basales ont été calculées par rapport au témoin d’isotype IgGκ comme arcsinh ratio. Les signaux dans les cellules CLL B ont été ensuite normalisées aux signaux dans les cellules B des témoins normaux. p < 0,01, calculé par un de deux échantillons appariés t-test. UM-CLL : IgVH unmutated CLL, LLC-M : IgVH muté CLL. Symboles de la même couleur représentent des échantillons de patients qui regroupés dans un cluster de classification ascendante hiérarchique basé sur des niveaux de 20 phospho-protéines3. (E) B cellules des témoins normaux (n = 10, moyenne + SEM) ou de patients atteints de LLC (n = 11 [M-CLL] et n = 8 [UM-CLL], moyenne + SEM) ont été stimulés par des IgM anti-pendant le temps indiqué et soumis à l’analyse des flux phospho. Les signaux d’intensité de fluorescence ont été mesurés par rapport aux échantillons non stimulées et montrés comme arcsinh ratio. p < 0,01 (Normal vs MU-CLL) et ***p < 0,001 (M-CLL vs LLC-UM), calculé en comparant plusieurs tests avec correction de Holm-Sidak. UM-CLL : IgVH unmutated CLL, LLC-M : IgVH muté CLL. (F), CLL cellules ont été incubées avec le DMSO ou idelalisib comme il est indiqué pendant 20 min avant la stimulation anti-IgM pendant 3 min. Puis, les cellules ont été traitées selon le protocole de flux de phospho. p < 0,05, **p < 0,01, ***p < 0,0001, calculés par comparaison de plusieurs tests avec correction de Holm-Sidak. UM-CLL : IgVH unmutated CLL, LLC-M : IgVH muté CLL. Voir (D) pour une description du symbole couleur. (D-F) sont modifiés du3. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Série dilué comme suit (en commençant par la solution-mère) | ||||||
| Réactif de codes à barres | Concentration de stock | #1 | #2 | #3 | #4 | sans coloration |
| Alexa Fluor 488 | 10 mg/mL | 1/500 | 1:5 | x | ||
| Bleu Pacifique | 10 mg/mL | 1:2500 | 1:4 | 1:4 | 01:10 | |
| Orange du Pacifique | 2 mg/mL | 01:50 | 01:12 | 01:24 | ||
Table 1. Réactifs de codes à barres.
Discussion
Phospho cytométrie en flux est une technique puissante pour mesurer le taux de phosphorylation de protéines dans des cellules individuelles. Étant donné que la méthode s’appuie sur la coloration avec des anticorps, phospho cytométrie en flux est limitée par la disponibilité des anticorps. En outre, afin d’obtenir des résultats fiables, les anticorps devraient être titrés et vérifiés avant toute utilisation. Un protocole détaillé pour le titrage d’anticorps phospho-spécifiques ont été décrits ailleurs12. Pendant la conception du panneau, examen du rapport signal-bruit est critique. Dans l’exemple présenté, tous les phospho-anticorps ont été conjugués à Alexa Fluor 647. Ce fluorophore fournit souvent l’écart optimal entre les échantillons avec faible par rapport à des niveaux élevés de phosphoprotéine. En outre, en utilisant qu’une seule couleur pour les phospho-protéines autres canaux est laissés libres pour FCB et des taches de marqueur de surface. Cette conception panneau réduit un empiétement dans le canal de phospho. En ayant tous les phospho-anticorps conjugués à la même molécule, l’analyse des données sera également simplifiée.
Dans le protocole présenté, tous les salissures d’anticorps ont été réalisées après fixation et perméabilisation des cellules. Toutefois, il est important de garder à l’esprit que coloration de marqueur de surface peut être négativement affectée par les étapes de fixation et permeabilization en raison de la dénaturation de l’antigène de surface ou une augmentation non spécifique coloration13. L’utilisateur doit donc tester la réactivité des anticorps sur une base de cas à l’autre. Ressources sur les clones compatibles peuvent également être utiles, telles que la vue d’ensemble des procédures de fixation/perméabilisation différentes et leur compatibilité avec les différents anticorps https://www.cytobank.org/facselect/.
La phosphorylation des protéines ou la phosphorylation est une modification transitoire qui survient en réponse aux signaux extrinsèques et intrinsèques. Lorsque l'on compare les modèles de phosphorylation, il est donc crucial que les expériences sont effectuées dans des conditions similaires. Lorsque étudie la signalisation dans les cellules primaires de sang et de facteurs susceptibles d’influencer le résultat incluent le temps écoulé après avoir dessiné le sang, les conditions de stockage et pour combien de temps les cellules isolées sont reposés avant le démarrage de l’expérience. Lorsque l'on compare les modèles signalisation dans les cellules de cryo préservé et des cellules fraîchement isolées du sang, très mineures pourraient être différence significative (Skånland, non publié). Toutefois, il est toujours conseillé d’utiliser cryo préservé les cellules normales comme témoin lors de l’étude des échantillons de patients fin, par exemple. Les conditions optimales pour l’exécution de la phospho flow cytometry expériences et l’impact des facteurs externes doit être testé par l’utilisateur individuel.
Ici, un protocole est présenté pour l’analyse des flux phospho de cellules en suspension. Le protocole peut être adapté à d’autres types de cellules, mais c’est une condition sine qua non que les cellules sont en suspension dans des cellules individuelles pour l’analyse par cytométrie en flux. La procédure pour y parvenir doit être délicate pour préserver et ne pas affecter, patrons de la phosphorylation. Il existe des exemples où les cellules adhérentes sont détachés de la capsule de culture par trypsination froid12,14, ou poussent plutôt sur des microsphères15. Quand il s’agit de cytométrie en flux phospho sur tissu plein, un seul rapport existe sur les tumeurs du poumon où cellules individuelles ont été obtenues en passant les cellules à travers un tube avec une crépine de cellule16. Récemment, cytométrie en flux phospho a été combinée avec une nouvelle approche appelée ventilation pour signalisation intracellulaire dans les cellules épithéliales simple de tissu (disséquer) afin d’étudier la phospho-protéines dans les tissus épithéliaux17 et cancer colorectal 18.
Le FCB est une étape cruciale dans le protocole car déconvolution des échantillons à la fin de l’expérience repose sur des populations distinctes de FCB. Pour obtenir cela, les cellules doivent être colorés de façon homogène. Il est donc important de préparer une plaque de code à barres qui les cellules peuvent être ajoutés à. Ajouter les réactifs aux cellules se traduira par une coloration inégale et des populations mixtes qui ne peuvent pas être déconvolutées par le blocage. Il est fortement recommandé d’effectuer un test des dilutions barcoding avant que l’expérience est réalisée comme l’intensité de la coloration est de type cellulaire dépendante.
Techniques de base d’anticorps supplémentaires tels que l’alignement de protéine et alignement de protéine de phase inverse (RPPA) peuvent être appliquées pour la quantification des niveaux phosphoprotéine dans un milieu à haut débit manière. Toutefois, certaines qualités de cytométrie en flux phospho distinguent cette méthode des autres. Un avantage important de phospho cytométrie en flux, c’est qu’il permet pour le profilage de cellule unique. En incluant des marqueurs de surface pour différents sous-ensembles cellulaires, hétérogénéité inter cellulaire peut être détectée. Combinaison avec FCB permet en outre pour l’analyse de plusieurs conditions dans la même expérimental exécuter. Ces caractéristiques font de phospho cytométrie une méthode intéressante pour de futures applications dans biomarker discovery et précision médecine19.
Déclarations de divulgation
L’auteur n’a rien à divulguer.
Remerciements
Ce travail a été effectué dans le laboratoire du professeur Kjetil Taskén et a été soutenu par la société norvégienne de Cancer et Stiftelsen Kristian Gerhard Jebsen. Johannes Landskron et Marianne Enger sont reconnus pour une lecture critique du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| RPMI 1640 GlutaMAX | ThermoFisher Scientific | 61870-010 | Cell culture medium |
| Fetal bovine serum | ThermoFisher Scientific | 10270169 | Additive to cell culture medium |
| Sodium pyruvate | ThermoFisher Scientific | 11360-039 | Additive to cell culture medium |
| MEM non-essential amino acids | ThermoFisher Scientific | 11140-035 | Additive to cell culture medium |
| Lymphoprep | Alere Technologies AS | 1114547 | Density gradient medium |
| Anti-IgM | Southern Biotech | 2022-01 | For stimulation of the B cell receptor |
| BD Phosflow Fix Buffer I | BD | 557870 | Fixation buffer |
| BD Phosflow Perm Buffer III | BD | 558050 | Permeabilization buffer |
| Alexa Fluor 488 5-TFP | ThermoFisher Scientific | A30005 | Barcoding reagent |
| Pacific Blue Succinimidyl Ester | ThermoFisher Scientific | P10163 | Barcoding reagent |
| Pacific Orange Succinimidyl Ester, Triethylammonium Salt | ThermoFisher Scientific | P30253 | Barcoding reagent |
| Compensation beads | Defined by user | Correct species reactivity | |
| Falcon tubes | Defined by user | ||
| Eppendorf tubes | Defined by user | ||
| 96 well V-bottom plates | Defined by user | Compatible with the flow cytometer | |
| Centrifuges | Defined by user | For Eppendorf tubes, Falcon tubes and plates | |
| Water bath | Defined by user | Temperature regulated | |
| Flow cytometer | Defined by user | With High Throughput Sampler (HTS) | |
| Name | Company | Catalog Number | Comments |
| Antigen | |||
| AKT (pS473) | Cell Signaling Technologies | 4075 | Clone: D9E Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 |
| ATF-2 (pT71) | Santa Cruz Biotechnology | sc-8398 | Clone: F-1 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| BLNK (pY84) | Beckton Dickinson Pharmingen | 558443 | Clone: J117-1278 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| Btk (pY223)/Itk (pY180) | Beckton Dickinson Pharmingen | 564846 | Clone: N35-86 Reference: Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| Btk (pY551) | Beckton Dickinson Pharmingen | 558129 | Clone: 24a/BTK (Y551) Reference: Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 |
| Btk (pY551)/Itk (pY511) | Beckton Dickinson Pharmingen | 558134 | Clone: 24a/BTK (Y551) Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 |
| CD3ζ (pY142) | Beckton Dickinson Pharmingen | 558489 | Clone: K25-407.69 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| Histone H3 (pS10) | Cell Signaling Technologies | 9716 | Clone: D2C8 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| IκBα | Cell Signaling Technologies | 5743 | Clone: L35A5 Reference: Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| LAT (pY171) | Beckton Dickinson Pharmingen | 558518 | Clone: I58-1169 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| Lck (pY505) | Beckton Dickinson Pharmingen | 558577 | Clone: 4/LCK-Y505 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| MEK1 (pS298) | Beckton Dickinson Pharmingen | 560043 | Clone: J114-64 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| NF-κB p65 (pS529) | Beckton Dickinson Pharmingen | 558422 | Clone: K10-895.12.50 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| NF-κB p65 (pS536) | Cell Signaling Technologies | 4887 | Clone: 93H1 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 |
| p38 MAPK (pT180/Y182) | Cell Signaling Technologies | 4552 | Clone: 28B10 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| p44/42 MAPK (pT202/Y204) | Cell Signaling Technologies | 4375 | Clone: E10 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| p53 (pS15) | Cell Signaling Technologies | NN | Clone: 16G8 Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS20) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS37) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS46) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS392) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| PLCγ2 (pY759) | Beckton Dickinson Pharmingen | 558498 | Clone: K86-689.37 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| Rb (pS807/pS811) | Beckton Dickinson Pharmingen | 558590 | Clone: J112-906 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| S6-Ribos. Prot. (pS235/236) | Cell Signaling Technologies | 4851 | Clone: D57.2.2E Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| SAPK/JNK (pT183/Y185) | Cell Signaling Technologies | 9257 | Clone: G9 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| SLP76 (pY128) | Beckton Dickinson Pharmingen | 558438 | Clone: J141-668.36.58 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| STAT1 (pY701) | Beckton Dickinson Pharmingen | 612597 | Clone: 4a Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| STAT3 (pY705) | Beckton Dickinson Pharmingen | 557815 | Clone: 4/P-STAT3 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| STAT4 (pY693) | Zymed/ThermoFisher Scientific | 71-7900 | Clone: Polyclonal Reference: Uzel et al., 2001, Detection of intracellular phosphorylated STAT-4 by flow cytometry, Clin Immunol, 100(3): 270-6 |
| STAT5 (pY694) | Beckton Dickinson Pharmingen | 612599 | Clone: 47/Stat5(pY694) Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| STAT6 (pY641) | Beckton Dickinson Pharmingen | 612601 | Clone: 18/P-Stat6 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| SYK (pY525/Y526) | Cell Signaling Technologies | 12081 | Clone: C87C1 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 |
| ZAP70/SYK (pY319/Y352) | Beckton Dickinson Pharmingen | 557817 | Clone: 17A/P-ZAP70 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
Références
- Lu, Y., et al. Using reverse-phase protein arrays as pharmacodynamic assays for functional proteomics, biomarker discovery, and drug development in cancer. Seminars in Oncology. 43 (4), 476-483 (2016).
- Krutzik, P. O., Nolan, G. P. Fluorescent cell barcoding in flow cytometry allows high-throughput drug screening and signaling profiling. Nature Methods. 3 (5), 361-368 (2006).
- Myhrvold, I. K., et al. Single cell profiling of phospho-protein levels in chronic lymphocytic leukemia. Oncotarget. 9 (10), 9273-9284 (2018).
- Parente-Ribes, A., et al. Spleen tyrosine kinase inhibitors reduce CD40L-induced proliferation of chronic lymphocytic leukemia cells but not normal B cells. Haematologica. 101 (2), e59-e62 (2016).
- Blix, E. S., et al. Phospho-specific flow cytometry identifies aberrant signaling in indolent B-cell lymphoma. BMC Cancer. 12, 478 (2012).
- Irish, J. M., et al. Single cell profiling of potentiated phospho-protein networks in cancer cells. Cell. 118 (2), 217-228 (2004).
- Myklebust, J. H., et al. Distinct patterns of B-cell receptor signaling in non-Hodgkin lymphomas identified by single-cell profiling. Blood. 129 (6), 759-770 (2017).
- World Medical Association. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. THE JOURNAL OF THE AMERICAN MEDICAL ASSOCIATION. 310 (20), 2191-2194 (2013).
- Siveen, K. S., et al. Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors. Biochimica et Biophysica Acta. 1845 (2), 136-154 (2014).
- Fabbri, G., Dalla-Favera, R. The molecular pathogenesis of chronic lymphocytic leukaemia. Nature Reviews Cancer. 16 (3), 145-162 (2016).
- Arnason, J. E., Brown, J. R. Targeting B Cell Signaling in Chronic Lymphocytic Leukemia. Current Oncology Reports. 19 (9), 61 (2017).
- Landskron, J., Tasken, K. Phosphoprotein Detection by High-Throughput Flow Cytometry. Methods in Molecular Biology. 1355, 275-290 (2016).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. Journal of Immunology. 175 (4), 2357-2365 (2005).
- Pollheimer, J., et al. Interleukin-33 drives a proinflammatory endothelial activation that selectively targets nonquiescent cells. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (2), e47-e55 (2013).
- Ertsås, H. C., Nolan, G. P., LaBarge, M. A., Lorens, J. B. Microsphere cytometry to interrogate microenvironment-dependent cell signaling. Integrative biology: quantitative biosciences from nano to macro. 9 (2), 123-134 (2017).
- Lin, C. C., et al. Single cell phospho-specific flow cytometry can detect dynamic changes of phospho-Stat1 level in lung cancer cells. Cytometry A. 77 (11), 1008-1019 (2010).
- Simmons, A. J., et al. Cytometry-based single-cell analysis of intact epithelial signaling reveals MAPK activation divergent from TNF-alpha-induced apoptosis in vivo. Molecular Systems Biology. 11 (10), 835 (2015).
- Simmons, A. J., et al. Impaired coordination between signaling pathways is revealed in human colorectal cancer using single-cell mass cytometry of archival tissue blocks. Science Signaling. 9 (449), rs11 (2016).
- Friedman, A. A., Letai, A., Fisher, D. E., Flaherty, K. T. Precision medicine for cancer with next-generation functional diagnostics. Nature Reviews Cancer. 15 (12), 747-756 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon