Method Article
Citometría de flujo fosfo con códigos de barra fluorescente de la célula para célula de señalización análisis y descubrimiento de biomarcadores
En este artículo
Resumen
Aquí, se presenta un protocolo para el análisis de mediano a alto rendimiento eventos de fosforilación de proteínas a nivel celular. Citometría de flujo de fosfo es un enfoque potente para caracterizar las aberraciones señalización, identificar y validar biomarcadores y Evaluación farmacodinámica.
Resumen
Señalización celular aberrante desempeña un papel central en el desarrollo del cáncer y la progresión. Terapias dirigidas más nuevas son de hecho dirigidas a proteínas y funciones de la proteína, y aberraciones señalización celular por lo tanto pueden servir como biomarcadores para indicar las opciones de tratamiento personalizado. En contraposición a los análisis de ADN y ARN, cambios en la actividad de la proteína pueden evaluar más eficazmente los mecanismos subyacentes de resistencia y sensibilidad de la droga. Phospho citometría de flujo es una técnica poderosa que mide eventos de fosforilación de proteínas a nivel celular, una característica importante que distingue a este método de otros enfoques basados en anticuerpos. El método permite el análisis simultáneo de múltiples proteínas de señalización. En combinación con códigos de barra fluorescente de la célula, más grande de los conjuntos de datos de mediano a alto rendimiento pueden ser adquiridos por el citómetro estándar hardware en poco tiempo. Citometría de flujo fosfo tiene aplicaciones en estudios de biología básica y en investigación clínica, incluyendo análisis, descubrimiento de biomarcadores y la evaluación de la farmacodinámica de la señalización. Aquí, se proporciona un protocolo experimental detallado para fosfo análisis de flujo de células mononucleares de sangre periférica purificada, usando las células de la leucemia linfocítica crónica por ejemplo.
Introducción
Phospho citometría de flujo se utiliza para analizar los niveles de fosforilación de la proteína unicelular resolución. El objetivo del método es asignar patrones de señalización celulares bajo condiciones especificadas. Aprovechando la capacidad multiparamétrico de citometría de flujo, varias vías de señalización se pueden analizar simultáneamente en diferentes subconjuntos de una población celular heterogénea como la sangre periférica. Estas características ofrecen ventajas sobre otras tecnologías basadas en anticuerpos como inmunohistoquímica, análisis enzima-ligado del inmunosorbente (ELISA), matriz de proteína y fase inversa proteína matriz (RPPA)1. Citometría de flujo fosfo puede combinarse con célula fluorescente código de barras (FCB), que significa que las muestras individuales de la célula están marcadas con firmas únicas de tintes fluorescentes para que pueden ser mezclados, teñidos y analizados como una sola muestra de2. Esto reduce el consumo de anticuerpo aumenta la robustez de los datos a través de la combinación de control y las muestras tratadas y mejora la velocidad de adquisición. La población combinada de FCB puede divide en muestras más pequeñas y manchada con hasta 35 anticuerpos fosfo-específicos distintos, dependiendo de la cantidad de material de partida. Grandes experimentos de generación de perfiles, pueden, ejecutar con hardware estándar citómetro. Phospho citometría de flujo se ha aplicado al perfil señalización vías en muestras de pacientes de varios cánceres hematológicos incluyendo leucemia linfocítica crónica (CLL)3,4,5, leucemia mieloide aguda (AML) 6 y non-Hodgkin ' linfomas7. Citometría de flujo fosfo es un enfoque potente para caracterizar las aberraciones señalización, identificar y validar biomarcadores y Evaluación farmacodinámica.
Aquí, el protocolo optimizado para el análisis de muestras de pacientes de CLL por citometría de flujo fosfo se proporciona (figura 1A). Se muestran ejemplos de caracterización señalización básica, estimulación de receptor de la célula de anti-IgM/B y perturbación de la droga. Se proporciona una descripción detallada de una matriz de FCB. El protocolo fácilmente adaptables a otros tipos de células de suspensión.
Protocolo
Muestras de sangre fueron recibidas tras consentimiento informado por escrito de todos los donantes. El estudio fue aprobado por el Comité Regional de médicos y de salud investigación ética de suroriental Noruega y se llevó a cabo la investigación sobre la sangre humana con arreglo a la declaración de Helsinki8.
Nota: Pasos 1-3 deben realizarse bajo condiciones estériles en una campana de cultivo de tejidos.
1. aislamiento de células mononucleares de sangre periférica (PBMCs) de muestras de sangre de pacientes de CLL
PRECAUCIÓN: Sangre humana debe ser manejada según normas de bioseguridad nivel 2.
- Diluir la sangre 1:1 con solución salina con tampón fosfato (PBS: 136,9 mM NaCl, KCl, de 2.7 mM 10,1 mM Na2HPO4 x 2 H2O, 1,8 mM KH2PO4, pH 7.4) y transferir a tubos de 50 mL (30 mL/tubo).
- Capa con cuidado 10 mL de un medio de gradiente densidad (e.g., Lymphoprep) en la parte inferior del tubo con una pipeta de 10 mL.
- Centrifugar a 800 x g por 20 min a 4 ° C. Las PBMCs ahora son visibles encima de la capa media gradiente de densidad.
- Utilice una pipeta Pasteur transferir las células a dos nuevos tubos de 50 mL. Lavar dos veces con PBS (llenar los tubos).
- Centrifugue a 350 x g por 15 minutos, descartar el sobrenadante y resuspender en 3 mL de PBS.
- Contar las células usando un método preferido.
- Centrifugar las células a 350 x g durante 5 min., descartar el sobrenadante. Nota: Pasos de 1.8 a 3.2 son opcionales. Es posible proceder directamente al paso 3.3.
- Resuspender las células en suero bovino fetal (FBS) suplementado con 10% de dimetilsulfóxido (DMSO) y congelar abajo en alícuotas adecuadas utilizando crio tubos.
Nota: DMSO es tóxico para las células. Trabajo rápido una vez que las células se mezclan con FBS/DMSO. Las células pueden ser almacenadas a largo plazo en nitrógeno líquido.
2. descongelación de las células
- Rápidamente descongelar las células en un baño de agua de 37 ° C.
Nota: DMSO es tóxico para las células. Trabajar rápidamente para limitar la exposición a DMSO. - Lavar las células una vez con 10 mL de medio frío del Roswell Park Memorial Institute (RPMI 1640 con GlutaMAX suplementario, véase Tabla de materiales).
- Centrifugar a 300 x g durante 5 min descartar el sobrenadante.
- Resuspender las células en RPMI 1640 suplementado con piruvato de sodio, MEM no esenciales aminoácidos y penicilina/estreptomicina (agregado en dilución de 1 x según las instrucciones) y 10% FBS. Transferir las células a un matraz de cultivo de células pequeñas y dejar en un incubador al 5% CO2, 37 ° C durante 1 hora para permitir a las células calibrar.
3. preparación de las células
- Contar las células viables usando un método preferido.
- Transferir las células a un tubo de 50 mL y centrifugar a 300 x g durante 5 min descarte el sobrenadante.
- Resuspender las células en Medio RPMI 1640 (paso 2.2) suplidas con 1% FBS a no más de 50 x 106 células/mL.
- Transferir la cantidad necesaria de la suspensión celular a pozos de una placa de V-inferior bien 96.
Nota: Número de pozos se corresponde con el número de condiciones para ser probado. Se toman muestras para un curso de tiempo de estimulación de un solo pozo. Calcular la muestra de 50 μL por punto de tiempo + 50 μl de volumen muerto. Guardar las muestras para los controles de compensación (una muestra sin manchas + una muestra por tinte de código de barras). - Transferencia del 96 bien la placa a un baño de agua precalentada 37 ° C. Resto de las células durante 10 minutos.
4. estimulación y fijación de las células
Nota: Realice los pasos 4-8 en el Banco de laboratorio (es decir, no estéril).
PRECAUCIÓN: El ingrediente principal de fijar es paraformaldehído, que es tóxica (inhalación, contacto de piel). Manéjela con cuidado.
- Prepare una placa de fondo V bien 96 con 60 μL de tampón de arreglar I por pozo por muestra. Deje en el baño de agua de 37 ° C.
Nota: Células: Solución buffer debe ser 1:1. Para permitir la evaporación a 37 ° C, el solución buffer es inicialmente en abundancia. - Opcionalmente, tratar las células con las drogas antes de la estimulación.
- Transferir una muestra de 50 μl de control a la placa de la solución. Mezclar mediante pipeteo arriba y abajo.
- Opcionalmente, inicie el curso del tiempo de estimulación mediante la adición de 10 μg/mL anti-IgM de las células. Mezclar mediante pipeteo arriba y abajo.
- Transferir una muestra de 50 μl a la placa de la solución en cada momento. Mezclar mediante pipeteo arriba y abajo.
Nota: Anti-IgM inducida por señales generalmente se inicia temprano (minutos). - Deje la placa de la solución a 37 ° C durante 10 min después de la última muestra se ha añadido.
5. el código de barras fluorescente de la célula (FCB)
Nota: Vea la tabla 1 para una lista de reactivos de código de barras.
- Lavar las células fijadas 3 x con PBS (llenar los pozos).
- Centrifugar a 500 x g por 5 min descartar el sobrenadante.
- Prepare una placa de fondo V bien 96 con reactivos de código de barras. Pipeta de 5 μl de cada reactivo de código de barras por pozo en el número de combinaciones para teñir las muestras siguiendo la matriz de la tinción, por ejemplo, en la figura 1B. Cada muestra tendrá una combinación única de código de barras diferentes concentraciones.
- Resuspender las células en 190 μl de PBS y la transferencia a la placa de código de barras. Mezclar bien.
Nota: Una muestra de compensación de la mancha con la más alta concentración final utilizada para cada reactivo de código de barras y guardar una muestra sin manchas. - Salir de las células durante 20 min a temperatura ambiente, en la oscuridad.
- Lavar las células 2 x con lavado de flujo (PBS 1% FBS, 0,09% de azida sódica) (llenar los pozos).
- Centrifugar a 500 x g por 5 min descartar el sobrenadante.
- Añadir 190 μl de flujo de lavado a las células y se combinan las muestras con código de barras en un tubo de 15 mL. Transferencia de cada control de compensación a un tubo separado 1,7 mL.
- Centrifugar a 500 x g por 5 min descartar el sobrenadante.
6. permeabilización de la célula para la tinción de antígenos intracelulares
PRECAUCIÓN: El ingrediente principal de Perm Buffer III es el metanol que es tóxica (inhalación, contacto de piel) e inflamable. Manéjela con cuidado.
- Transferir 2 mL de la ondulación permanente Buffer III a un tubo de 15 mL. Salir a-20 ° C por lo que es helada en uso.
Nota: El búfer de la ondulación permanente puede dejarse en-20 ° C desde el comienzo del experimento. - Añadir 1,5 mL de tampón de Perm helada a la población de celular con código de barras (en un tubo de 15 mL) y 100 μl a cada control de compensación (en tubos de 1,7 mL) mediante goteo mientras Vortex para evitar que las células se agrupan juntos.
- Transferir las células directamente a-80 ° C. Licencia por un mínimo de 30 minutos.
Nota: Es natural para hacer una pausa en este punto el experimento. Células en Buffer Perm pueden ser almacenada a largo plazo a-80 ° C.
7. anticuerpos
Nota: Véase Tabla de materiales para obtener una lista de reportados anticuerpos fosfo-específicos.
- Transferencia de las células de-80 ° C a una caja de hielo.
- Lavar 3 x con flujo lavar.
Nota: Es importante añadir lavado de flujo en exceso ver el precipitado de células, por ejemplo, añadir 3 mL de lavado de flujo a la población de celular con código de barras y 1 mL a cada control de compensación. - Centrifugar a 500 x g durante 5 min a 4 ° C. Deseche el sobrenadante.
- Resuspender la población de celular con código de barras en un volumen de lavado de flujo, que permite 25 μl de la suspensión celular por mancha de fosfo-anticuerpos. Resuspender los controles de compensación en 200 μL de lavado de flujo.
- Preparación de anticuerpos para la tinción en un plato de fondo V bien 96. El volumen final será 50 μL/pocillo. Por pozo, añadir anticuerpos fosfo-específicos diluido en flujo de lavado hasta un volumen final de 10 μl, marcador superficial diluido en flujo de lavado hasta un volumen final de 15 μl y 25 μl de la suspensión celular.
Nota: Las diluciones del anticuerpo deben titularse antes del experimento. Incluyen control de isotipo. - Salir de las células durante 30 min a temperatura ambiente, en la oscuridad.
- Lavar las células 2 x con lavado de flujo (llenar los pozos).
- Centrifugar a 500 x g por 5 min descartar el sobrenadante.
- Resuspender las células en 150 μL de lavado de flujo.
8. preparación de controles de compensación
- Preparación de controles de compensación para los fluorocromos conjugados con anticuerpos en paralelo con la tinción de anticuerpos. Utilice cuentas de indemnización según las instrucciones del proveedor.
9. Análisis de citometría de flujo de
Nota: El experimento se puede ejecutar en un citómetro de flujo con un muestreador de alto de rendimiento (HTS).
- Optimizar el voltaje de tubo (PMT) de fotomultiplicador con el control sin manchas.
- Ejecutar controles de compensación y calcular la matriz de compensación.
- Ejecutar ejemplos. La tasa de evento debe ajustarse a las especificaciones del instrumento.
10. estrategia y análisis de los datos que bloquean
- Importar los archivos de la FCS en el experimento a un software de análisis de citometría de flujo como FlowJo o Cytobank (https://cellmass.cytobank.org).
- Estrategia que bloquean
- Seleccionar los linfocitos mediante el trazado de SSC-A frente a FSC-A en una parcela de punto de densidad.
- Mostrar los linfocitos y seleccione los Maillots trazando SSC-A frente a FSC - W.
- Mostrar el células y la puerta de la celda tipo trazando SSC-A comparación con el marcador de superficie.
- Ver la población de tipo celular en el Pacífico azul versus densidad de SSC-A parcela y seleccionar las diferentes poblaciones de FCB basadas en su intensidad de la coloración azul del Pacífico (ver figura 1A).
- Trazar el canal de anticuerpo phospho contra el canal de la FCB, o como un mapa de calor (véase figura 1A) para mostrar los eventos de fosforilación.
- Calcular usando el seno hiperbólico inverso (arcsinh) de la IMF (mediana intensidad fluorescente) de fosfo-señal frente a isotipo control fosfo-señales (niveles de fosforilación basal, ver figura 1), o estimulados frente a poblaciones de la célula sin estimular (véase la Figura 1E).
Resultados
Los pasos principales del Protocolo de citometría de flujo fosfo se ilustran en la figura 1A. En el ejemplo presentado, las células CLL se tiñeron con el reactivo de código de barras Pacífico azul en cuatro diluciones. El código de barras tridimensional se puede realizar mediante la combinación de tres tintes de código de barras, como se ilustra en la figura 1B. Las muestras individuales son entonces deconvoluted por sincronización subsecuente en cada código de barras reactivo versus SSC-A (figura 1). Toda la información sobre los reactivos de código de barras se enumeran en la tabla 1.
Siguiendo el procedimiento descrito aquí, niveles de fosfo-proteína fueron caracterizados en las células B de pacientes CLL y controles normales bajo diversas condiciones3. Ambos niveles de fosforilación basal y la inducida por la estimulación de 20 señalización moléculas corriente abajo del receptor de células B (BCR) fueron analizadas (véase Tabla de materiales para obtener una lista de reportados anticuerpos fosfo-específicos). Los niveles basales fosfo-proteína fueron mapeados en 22 CLL las muestras del paciente en relación con la media de los controles normales. Este análisis mostró que STAT3 (pY705) es significativamente upregulated en las células CLL (figura 1). Activación constitutiva de STAT3 se ha divulgado en otras malignidades hematológicas y se asocia con resistencia a la apoptosis9.
Para identificar aberraciones señalización inducidas a través de la vía de la BCR, las células fueron estimuladas con anti-IgM hasta 30 minutos. Se ha demostrado que CLL de células de pacientes con IgVH unmutated estado (UM-CLL) pantalla aumentó sensibilidad a anti-IgM estimulación10. Este hecho fue observado para la mayoría de las proteínas analizadas, pero el efecto fue estadísticamente significativo sólo para AKT (pS473) (Figura 1E, UM-CLL versus M-CLL y Normal). Para comprobar si podría revertirse la señal aberrante de AKT (pS473) las células CLL fueron expuestas a la idelalisib del inhibidor de la PI3Kδ, que se utiliza en la clínica para el tratamiento de pacientes CLL11. Como se muestra en la Figura 1F, niveles AKT (pS473) se redujeron significativamente sobre el tratamiento de la idelalisib de una manera dependiente de la concentración, demostrando que los inhibidores de la cinasa pueden aplicarse para normalizar la señalización aberrante en las células CLL.
Estos resultados muestran que fosfo citometría de flujo en combinación con el FCB es un enfoque poderoso para realizar estudios de análisis de señales, identificar biomarcadores potenciales y evaluar farmacodinámica.
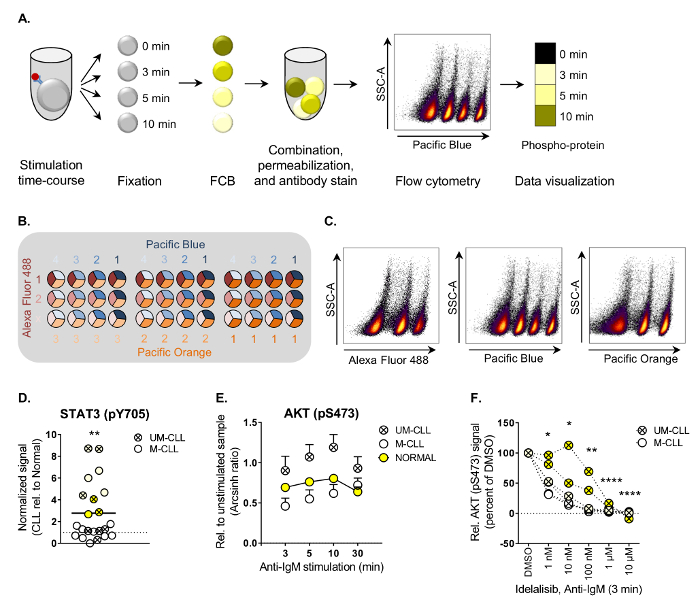
Figura 1. Flujo de trabajo y ejemplos de análisis de citometría de flujo aplicada fosfo.
(A) los principales pasos del procedimiento de flujo de fosfo se ilustran. Las células primero son estimuladas, luego fijo y sometidas a FCB antes de que pueden combinarse en un tubo de permeabilización y anticuerpos posterior. Las células se ejecutan en un citómetro de flujo y las poblaciones celulares son deconvoluted por bloquear durante el análisis de datos. Los resultados pueden ser visualizados como histogramas o heatmaps, como se muestra. (B) ejemplo de un FCB tridimensional tinción matriz usando Alexa Fluor 488 (tres diluciones), Pacífico azul (cuatro diluciones) y Pacífico naranja (tres diluciones). Esta matriz permitirá la combinación de las muestras hasta 36. (C) la célula FCB población puede deconvoluted por compuerta de cada canal la FCB versus SSC-A. Combinación de las puertas en el software de análisis genera las poblaciones correctas para el análisis. B sin estimular (D) las células procedentes de donantes sanos (n = 25) y los pacientes CLL (n = 22) fueron sometidos a análisis mediante flujo de fosfo siguiendo el procedimiento de (A). Las señales de intensidad de fluorescencia basal se calcularon en relación con IgGκ control de isotipo arcsinh relación. Las señales en las células de CLL B luego se normalizaron a las señales en las células de B de controles normales. p < 0.01, calculado por un impar de dos muestras t-test. UM-CLL: IgVH unmutated CLL, M-CLL: IgVH mutado CLL. Símbolos del mismo color representan muestras de pacientes que se agrupan en un cluster aglomerativo jerárquico basado en niveles de 20 fosfo-proteínas3. (E) B las células de controles normales (n = 10, media + SEM) o pacientes CLL (n = 11 [M-CLL] y n = 8 [UM-CLL], media + SEM) fueron estimuladas con anti-IgM para el curso del tiempo indicado y sometidos a análisis de flujo de fosfo. Las señales de intensidad de fluorescencia se mide en relación con las muestras sin estimular y se muestra como relación arcsinh. p < 0.01 (Normal vs UM-CLL) y ***p < 0.001 (M-CLL vs UM-CLL), calculado por comparación múltiple prueba con corrección de Holm-Sidak. UM-CLL: IgVH unmutated CLL, M-CLL: IgVH mutado CLL. (F) CLL las células fueron incubadas con DMSO o idelalisib como se indica por 20 min antes de estimulación anti-IgM durante 3 minutos. Las células entonces se procesaron siguiendo el protocolo de flujo de fosfo. p < 0.05, **p < 0.01, ***p < 0.0001, calculados por comparación múltiple prueba con corrección de Holm-Sidak. UM-CLL: IgVH unmutated CLL, M-CLL: IgVH mutado CLL. Véase explicación de color del símbolo (D). (D-F) se modifican de3. Haga clic aquí para ver una versión más grande de esta figura.
| Serie diluida como sigue (a partir de la solución madre) | ||||||
| Reactivo de código de barras | Concentración stock | #1 | #2 | #3 | #4 | sin mancha |
| Alexa Fluor 488 | 10 mg/mL | 1: 500 | 1:5 | x | ||
| Azul Pacífico | 10 mg/mL | 1:2500 | 1:4 | 1:4 | 1:10 | |
| Naranja Pacífico | 2 mg/mL | 1:50 | 1:12 | 1:24 | ||
Tabla 1. Reactivos de código de barras.
Discusión
Phospho citometría de flujo es una técnica poderosa para medir los niveles de fosforilación de la proteína en las células. Puesto que el método se basa en la coloración con los anticuerpos, fosfo citometría de flujo está limitado por la disponibilidad de anticuerpos. Además, para obtener resultados fiables, todos los anticuerpos deben ser graduados y verificados antes de su uso. Un protocolo detallado para la titulación de anticuerpos fosfo-específicos ha sido descrito en otra parte12. Durante el diseño del panel, consideración de la relación señal a ruido es crítico. En el ejemplo presentado, fosfo-anticuerpos todos fueron conjugados a Alexa Fluor 647. Este fluoróforo a menudo proporciona el óptimo diferencial entre muestras con baja versus niveles altos de fosfo-proteína. Además, mediante el uso de un solo color para las fosfo-proteínas el resto de canales quedará libre para FCB y la coloración superficial del marcador. Este panel de diseño reduce el contagio en el canal de fosfo. Al tener todos fosfo-anticuerpos conjugados fluoróforo mismo, también simplificar el análisis de datos.
En el protocolo presentado, todos los stainings anticuerpo fueron realizados después de la fijación y permeabilización de las células. Sin embargo, es importante tener en cuenta que la coloración superficial del marcador puede verse afectada negativamente por los pasos de fijación y permeabilización debido a la desnaturalización de los antígenos de superficie o inespecífica mayor coloración13. Por lo tanto, el usuario debe probar la reactividad de los anticuerpos en una base de caso a caso. Recursos sobre los clones compatibles también pueden ser útiles, como la descripción de los procedimientos de fijación diferentes/permeabilización y su compatibilidad con los diferentes anticuerpos en https://www.cytobank.org/facselect/.
Fosforilación de la proteína o la fosforilación es una modificación transitoria que se produce en respuesta a señales intrínsecas y extrínsecas. Al comparar los patrones de fosforilación, por lo tanto es crucial que los experimentos se llevan a cabo bajo condiciones similares. Cuando estudio de señalización en células primarias de la sangre, factores que podrían afectar el resultado incluyen el tiempo transcurrido después de dibujar la sangre, las condiciones de almacenamiento y por cuánto tiempo las células aisladas se descansaban antes de la iniciación del experimento. Al comparar los patrones de señalización en células crio preservada y células recién aisladas de sangre, pudieran observar diferencias muy pequeñas (Skånland, inédito). Sin embargo, es aconsejable utilizar crio preservado las células normales como control al estudiar muestras de pacientes biobanked, por ejemplo. Las condiciones óptimas para la realización de la fosfo experimentos de citometría de flujo y el impacto de los factores externos se debe probar por el usuario individual.
Aquí, se presenta un protocolo para fosfo análisis de flujo de las células de suspensión. El protocolo puede ser adaptado a otros tipos celulares, pero es un prerrequisito que son las células en suspensión como las células para el análisis por citometría de flujo. El procedimiento para lograr esto debe ser delicado para preservar y no afectan, los patrones de la fosforilación. Existen ejemplos donde las células adherentes son separadas del plato de cultivo frío trypsination12,14o más bien crecen en microesferas15. Cuando se trata de fosfo citometría de flujo en tejidos sólidos, un informe existe en tumores de pulmón donde se obtuvieron las células al pasar las células a través de un tubo con una célula colador16. Recientemente, citometría de flujo fosfo fue combinado con un nuevo enfoque denominado desglose de señalización intracelular en las células epiteliales del tejido (DISEQUE) para estudiar fosfo-proteínas en los tejidos epiteliales17 y cáncer colorrectal 18.
El FCB es un paso crítico en el protocolo ya deconvolución de las muestras al final del experimento se basa en poblaciones distintas de la FCB. Para conseguir esto, las células necesitan ser teñido homogéneo. Por lo tanto es importante preparar una placa de código de barras que se pueden agregar a las células. Agregar los reactivos a las células dará lugar a la coloración desigual y poblaciones mixtas que no pueden ser deconvoluted por compuerta. Se recomienda realizar una prueba de las diluciones de código de barras antes de realiza el experimento como la intensidad de la tinción es tipo de la célula dependiente.
Técnicas adicionales basados en anticuerpos como proteínas matriz y matriz de proteínas de fase inversa (RPPA) pueden aplicarse para la cuantificación de niveles de fosfo-proteína en un medio a modo de alto rendimiento. Sin embargo, algunas cualidades de citometría de flujo fosfo distinguen este método de los otros. Una ventaja importante de fosfo citometría de flujo es que permite para el perfilado de la célula. Mediante la inclusión de marcadores de superficie para diferentes subconjuntos celulares, puede detectarse heterogeneidad inter-celular. Combinación con FCB permite además el análisis de varias condiciones de la misma experimental ejecutar. Estas características hacen de citometría de flujo de fosfo un método atractivo para futuras aplicaciones en biomarcadores descubiertos y precisión medicina19.
Divulgaciones
El autor no tiene nada que revelar.
Agradecimientos
Este trabajo se llevó a cabo en el laboratorio del profesor Kjetil Taskén y fue apoyado por la sociedad de cáncer de Noruega y Stiftelsen Kristian Gerhard Jebsen. Johannes Landskron y Marianne Enger son reconocidos por la lectura crítica del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| RPMI 1640 GlutaMAX | ThermoFisher Scientific | 61870-010 | Cell culture medium |
| Fetal bovine serum | ThermoFisher Scientific | 10270169 | Additive to cell culture medium |
| Sodium pyruvate | ThermoFisher Scientific | 11360-039 | Additive to cell culture medium |
| MEM non-essential amino acids | ThermoFisher Scientific | 11140-035 | Additive to cell culture medium |
| Lymphoprep | Alere Technologies AS | 1114547 | Density gradient medium |
| Anti-IgM | Southern Biotech | 2022-01 | For stimulation of the B cell receptor |
| BD Phosflow Fix Buffer I | BD | 557870 | Fixation buffer |
| BD Phosflow Perm Buffer III | BD | 558050 | Permeabilization buffer |
| Alexa Fluor 488 5-TFP | ThermoFisher Scientific | A30005 | Barcoding reagent |
| Pacific Blue Succinimidyl Ester | ThermoFisher Scientific | P10163 | Barcoding reagent |
| Pacific Orange Succinimidyl Ester, Triethylammonium Salt | ThermoFisher Scientific | P30253 | Barcoding reagent |
| Compensation beads | Defined by user | Correct species reactivity | |
| Falcon tubes | Defined by user | ||
| Eppendorf tubes | Defined by user | ||
| 96 well V-bottom plates | Defined by user | Compatible with the flow cytometer | |
| Centrifuges | Defined by user | For Eppendorf tubes, Falcon tubes and plates | |
| Water bath | Defined by user | Temperature regulated | |
| Flow cytometer | Defined by user | With High Throughput Sampler (HTS) | |
| Name | Company | Catalog Number | Comments |
| Antigen | |||
| AKT (pS473) | Cell Signaling Technologies | 4075 | Clone: D9E Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 |
| ATF-2 (pT71) | Santa Cruz Biotechnology | sc-8398 | Clone: F-1 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| BLNK (pY84) | Beckton Dickinson Pharmingen | 558443 | Clone: J117-1278 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| Btk (pY223)/Itk (pY180) | Beckton Dickinson Pharmingen | 564846 | Clone: N35-86 Reference: Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| Btk (pY551) | Beckton Dickinson Pharmingen | 558129 | Clone: 24a/BTK (Y551) Reference: Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 |
| Btk (pY551)/Itk (pY511) | Beckton Dickinson Pharmingen | 558134 | Clone: 24a/BTK (Y551) Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 |
| CD3ζ (pY142) | Beckton Dickinson Pharmingen | 558489 | Clone: K25-407.69 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| Histone H3 (pS10) | Cell Signaling Technologies | 9716 | Clone: D2C8 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| IκBα | Cell Signaling Technologies | 5743 | Clone: L35A5 Reference: Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| LAT (pY171) | Beckton Dickinson Pharmingen | 558518 | Clone: I58-1169 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| Lck (pY505) | Beckton Dickinson Pharmingen | 558577 | Clone: 4/LCK-Y505 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| MEK1 (pS298) | Beckton Dickinson Pharmingen | 560043 | Clone: J114-64 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| NF-κB p65 (pS529) | Beckton Dickinson Pharmingen | 558422 | Clone: K10-895.12.50 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| NF-κB p65 (pS536) | Cell Signaling Technologies | 4887 | Clone: 93H1 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 |
| p38 MAPK (pT180/Y182) | Cell Signaling Technologies | 4552 | Clone: 28B10 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| p44/42 MAPK (pT202/Y204) | Cell Signaling Technologies | 4375 | Clone: E10 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| p53 (pS15) | Cell Signaling Technologies | NN | Clone: 16G8 Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS20) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS37) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS46) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| p53 (pS392) | Cell Signaling Technologies | NN | Clone: Polyclonal Reference: Irish et al., 2007, Flt3 Y591 duplication and Bcl-2 overexpression…, Blood, 109(6):2589-96 |
| PLCγ2 (pY759) | Beckton Dickinson Pharmingen | 558498 | Clone: K86-689.37 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| Rb (pS807/pS811) | Beckton Dickinson Pharmingen | 558590 | Clone: J112-906 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| S6-Ribos. Prot. (pS235/236) | Cell Signaling Technologies | 4851 | Clone: D57.2.2E Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| SAPK/JNK (pT183/Y185) | Cell Signaling Technologies | 9257 | Clone: G9 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Pollheimer et al., 2013, Interleukin-33 drives a proinflammatory endothelial…, Arterioscler Thromb Vasc Biol, 33(2):e47-55 |
| SLP76 (pY128) | Beckton Dickinson Pharmingen | 558438 | Clone: J141-668.36.58 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 |
| STAT1 (pY701) | Beckton Dickinson Pharmingen | 612597 | Clone: 4a Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| STAT3 (pY705) | Beckton Dickinson Pharmingen | 557815 | Clone: 4/P-STAT3 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| STAT4 (pY693) | Zymed/ThermoFisher Scientific | 71-7900 | Clone: Polyclonal Reference: Uzel et al., 2001, Detection of intracellular phosphorylated STAT-4 by flow cytometry, Clin Immunol, 100(3): 270-6 |
| STAT5 (pY694) | Beckton Dickinson Pharmingen | 612599 | Clone: 47/Stat5(pY694) Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
| STAT6 (pY641) | Beckton Dickinson Pharmingen | 612601 | Clone: 18/P-Stat6 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 |
| SYK (pY525/Y526) | Cell Signaling Technologies | 12081 | Clone: C87C1 Reference: Myhrvold et al., 2018, Single cell profiling of phospho-protein levels in.., Oncotarget, 9(10):9273-9284 Parente-Ribes et al., 2016, Spleen tyrosine kinase inhibitors reduce…, Haematologica, 101(2):e59-62 |
| ZAP70/SYK (pY319/Y352) | Beckton Dickinson Pharmingen | 557817 | Clone: 17A/P-ZAP70 Reference: Skånland et al., 2014, T-cell co-stimulation through the CD2 and CD28…, Biochem J, 460(3):399-410 Kalland et al., 2012, Modulation of proximal signaling in normal and transformed…, Exp Cell Res, 318(14):1611-9 Myklebust et al., 2017, Distinct patterns of B-cell receptor signaling in…, Blood, 129(6): 759-770 |
Referencias
- Lu, Y., et al. Using reverse-phase protein arrays as pharmacodynamic assays for functional proteomics, biomarker discovery, and drug development in cancer. Seminars in Oncology. 43 (4), 476-483 (2016).
- Krutzik, P. O., Nolan, G. P. Fluorescent cell barcoding in flow cytometry allows high-throughput drug screening and signaling profiling. Nature Methods. 3 (5), 361-368 (2006).
- Myhrvold, I. K., et al. Single cell profiling of phospho-protein levels in chronic lymphocytic leukemia. Oncotarget. 9 (10), 9273-9284 (2018).
- Parente-Ribes, A., et al. Spleen tyrosine kinase inhibitors reduce CD40L-induced proliferation of chronic lymphocytic leukemia cells but not normal B cells. Haematologica. 101 (2), e59-e62 (2016).
- Blix, E. S., et al. Phospho-specific flow cytometry identifies aberrant signaling in indolent B-cell lymphoma. BMC Cancer. 12, 478 (2012).
- Irish, J. M., et al. Single cell profiling of potentiated phospho-protein networks in cancer cells. Cell. 118 (2), 217-228 (2004).
- Myklebust, J. H., et al. Distinct patterns of B-cell receptor signaling in non-Hodgkin lymphomas identified by single-cell profiling. Blood. 129 (6), 759-770 (2017).
- World Medical Association. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. THE JOURNAL OF THE AMERICAN MEDICAL ASSOCIATION. 310 (20), 2191-2194 (2013).
- Siveen, K. S., et al. Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors. Biochimica et Biophysica Acta. 1845 (2), 136-154 (2014).
- Fabbri, G., Dalla-Favera, R. The molecular pathogenesis of chronic lymphocytic leukaemia. Nature Reviews Cancer. 16 (3), 145-162 (2016).
- Arnason, J. E., Brown, J. R. Targeting B Cell Signaling in Chronic Lymphocytic Leukemia. Current Oncology Reports. 19 (9), 61 (2017).
- Landskron, J., Tasken, K. Phosphoprotein Detection by High-Throughput Flow Cytometry. Methods in Molecular Biology. 1355, 275-290 (2016).
- Krutzik, P. O., Clutter, M. R., Nolan, G. P. Coordinate analysis of murine immune cell surface markers and intracellular phosphoproteins by flow cytometry. Journal of Immunology. 175 (4), 2357-2365 (2005).
- Pollheimer, J., et al. Interleukin-33 drives a proinflammatory endothelial activation that selectively targets nonquiescent cells. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (2), e47-e55 (2013).
- Ertsås, H. C., Nolan, G. P., LaBarge, M. A., Lorens, J. B. Microsphere cytometry to interrogate microenvironment-dependent cell signaling. Integrative biology: quantitative biosciences from nano to macro. 9 (2), 123-134 (2017).
- Lin, C. C., et al. Single cell phospho-specific flow cytometry can detect dynamic changes of phospho-Stat1 level in lung cancer cells. Cytometry A. 77 (11), 1008-1019 (2010).
- Simmons, A. J., et al. Cytometry-based single-cell analysis of intact epithelial signaling reveals MAPK activation divergent from TNF-alpha-induced apoptosis in vivo. Molecular Systems Biology. 11 (10), 835 (2015).
- Simmons, A. J., et al. Impaired coordination between signaling pathways is revealed in human colorectal cancer using single-cell mass cytometry of archival tissue blocks. Science Signaling. 9 (449), rs11 (2016).
- Friedman, A. A., Letai, A., Fisher, D. E., Flaherty, K. T. Precision medicine for cancer with next-generation functional diagnostics. Nature Reviews Cancer. 15 (12), 747-756 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados