Method Article
Facendo, test e l'utilizzo di microelettrodi selettivo di ioni potassio in fettine di tessuto del cervello adulto
In questo articolo
Riepilogo
Gli ioni del potassio contribuiscono per il potenziale di membrana di riposo delle cellule e concentrazione extracellulare di K+ è un regolatore fondamentale dell'eccitabilità cellulare. Descriviamo come fare, calibrare e utilizzare monopolare K+-selettivi microelettrodi. Utilizzando tali elettrodi consente la misurazione delle dinamiche di concentrazione K+ elettricamente evocate nelle fette hippocampal adulti.
Abstract
Gli ioni potassio contribuiscono in modo significativo per il potenziale di membrana di riposo delle cellule e, di conseguenza, la concentrazione extracellulare di K+ è un regolatore cruciale dell'eccitabilità delle cellule. Alterato le concentrazioni extracellulari di K+ effetto l'eccitabilità cellulare e potenziali di membrana riposo spostando gli equilibri tra stati chiusi, aperti e inattivati per canali ionici voltaggio-dipendenti che sono alla base di potenziale di azione Iniziazione e conduzione. Quindi, è prezioso per misurare direttamente extracellulare K+ dinamiche in salute e stati malati. Qui, descriviamo come fare, calibrare e utilizzare monopolare K+-selettivi microelettrodi. Li abbiamo distribuito in fette di cervello hippocampal adulto per misurare elettricamente evocate K+ concentrazione dinamica. L'uso giudizioso di tali elettrodi è una parte importante di tool-kit necessari per valutare i meccanismi biofisici e cellulari che controllano le concentrazioni extracellulari di K+ nel sistema nervoso.
Introduzione
Concentrazioni di ioni di potassio sono strettamente regolati nel cervello, e le loro fluttuazioni esercitano una potente influenza sul potenziale di membrana di riposo di tutte le cellule. Alla luce di questi contributi critici, un obiettivo importante di biologia è determinare i meccanismi biofisici e cellulari che vengono utilizzati per regolare strettamente la concentrazione di K+ nello spazio extracellulare in vari organi del corpo1 , 2. un requisito importante in questi studi è la capacità di misurare le concentrazioni di K+ con precisione. Anche se molti componenti che contribuiscono all'omeostasi del potassio nel cervello negli stati sani e malati sono stati identificati3,4,5, ulteriori progressi sono stato rallentato a causa della natura specialistica preparazione di microelettrodi selettiva dello ione per la misura di potassio. Microelettrodo sensori rappresentano il gold standard per la misurazione di K+ le concentrazioni in vitro, in fettine di tessuto e in vivo.
Approcci più recenti per K+ monitoraggio sono in fase di sviluppo mediante sensori ottici, tuttavia questi non rilevano un concentrazioni biologicamente rilevanti gamma di K+ o non siano stati completamente controllati nei sistemi biologici, anche se i risultati iniziali appaiono promettenti6,7,8. Rispetto ai sensori ottici, microelettrodi sono fondamentalmente limitati ad un punto sorgente di ioni, anche se l'array di elettrodi potrebbe migliorare la risoluzione spaziale di9. Questo articolo si concentra sui sensori del microelettrodo singolo-canna per monitoraggio K+ dynamics.
In questo lavoro, segnaliamo procedure dettagliate graduale di rendere K+ microelettrodi selettivi, utilizzando un ionoforo potassio valinomicina-basato che permette altamente selettivo (104 piega alla selettività Na+ K+ ) K+ movimento su membrane10. Un polipeptide natura, valinomicina agisce come un poro permeabile K+ e facilita il flusso di K+ giù di gradiente elettrochimico. Inoltre descriviamo come calibrare gli elettrodi, come memorizzare e utilizzarli e, infine, come distribuirle per misurare K+ concentrazione dinamica in fettine di cervello hippocampal acuta da topi adulti. L'uso di tali elettrodi insieme ai topi geneticamente modificati che non dispongono di canali ionici specifico proposti per regolare extracellulare K+ dinamica dovrebbe rivelare i meccanismi cellulari utilizzati dal sistema nervoso per controllare la concentrazione ambientale di K + nell'ambiente extracellulare.
Protocollo
Tutti gli esperimenti sugli animali sono stati condotti in conformità con l'Istituto nazionale di guida alla salute per la cura e l'uso di animali da laboratorio e sono stati approvati dal comitato di ricerca degli animali del cancelliere presso la University of California, Los Angeles. Tutti i topi sono stati alloggiati con cibo e acqua disponibile ad libitum in un ambiente di luce-buio di 12 h. Tutti gli animali erano sani senza evidenti modifiche comportamentali, non sono stati coinvolti in studi precedenti e sono stati sacrificati durante il ciclo di luce. Dati per gli esperimenti sono stati raccolti da topi adulti (6-8 settimane di vita per tutti gli esperimenti).
1. preparazione di microelettrodi selettivi K+
- Silanizzazione in vetro borosilicato
- Rimuovere sufficiente tubi capillari in vetro da imballaggio e collocare in una provetta conica da 50 mL. Riempire la provetta conica verso l'alto con gli elettrodi di 1 M HCl. lavaggio con agitazione delicata in HCl durante la notte o per un minimo di 6 ore.
- Risciacquare brevemente capillari con etanolo al 70% e poi asciugare completamente a 100-120 ° C per 6-8 ore. Conservare i capillari lavati in contenitori con essiccante solfato di calcio anidro per fino a 4 settimane prima dell'ulteriore uso.
- Prima di silanizzazione, tirare capillari a punta sottile con l'estrattore microelettrodo. I microelettrodi che usiamo sono circa il 2-5 micron di diametro. Maneggiare sempre lavati capillari con i guanti, come oli da pelle possono interferire con la silanizzazione.
- Luogo microelettrodi in un contenitore di vetro in modo che gli elettrodi sono elevati dal basso per prevenire la rottura della punta. Difficoltà microelettrodi al contenitore mediante nastro autoclavabili o nastro adesivo simile.
- Rimuovere circa 0,5 mL di soluzione di silanizzazione 5% dichlorodimethylsilane (DDS) dal relativo contenitore utilizzando il metodo di sostituzione di azoto (Vedi Figura 2). Riempire un palloncino con gas azoto e fissare tubo o una siringa e un ago il palloncino. Inserire l'ago nel contenitore DDS durante l'elaborazione di DDS in una siringa separata tramite un ago più lungo.
- Applicare la soluzione di silanizzazione goccia a goccia per le punte delle pipette e coprire immediatamente. Posizionare il contenitore che tiene i microelettrodi con soluzione di silanizzazione in un forno pre-riscaldato del laboratorio (170-180 ° C) per 10-12 ore o a 200-220 ° C per 30 minuti
- Dopo l'incubazione, spegnere il forno e quindi rimuovere la piastra da forno. Prestare attenzione quando si rimuove la piastra dall'incubatrice, quanto è estremamente caldo. Posizionare la piastra su una panchina a temperatura ambiente per 10-15 minuti consentire la vetreria raffreddare.
- Rimuovere i microelettrodi dalla piastra (usando una lama di rasoio o bisturi per tagliare il nastro) e inserirli in un contenitore ermetico riempito disseccante. Silanizzata microelettrodi prive di umidità possono essere utilizzati per fino a 1 settimana che segue la silanizzazione.
- Gli elettrodi di adescamento
- Preparare una soluzione stock di K+ ionoforo cocktail: valinomicina w/v 5%, 93% v/v 1,2-dimetil-3-nitrobenzene, potassio 2% w/v tetrakis(4-chlorophenyl) borato11. Questa soluzione è un debole colore giallo. Tenere in un contenitore ermetico, opaco a temperatura ambiente. Questa soluzione può durare molti mesi se correttamente conservato.
- Preparare una soluzione stock di 10 mM HEPES tamponata 300 mM NaCl a pH 7,4. Fissare l'elettrodo in un morsetto e recupero con il NaCl tamponato utilizzando una punta di microfil 28G collegata ad una siringa. Osservare che la soluzione salina ha raggiunto l'estremità della punta del microelettrodo. Confermare che il microelettrodo è privo di grandi bolle che potrebbero interferire con il flusso di corrente.
- Rompere la punta dell'elettrodo a circa 10-20 µm di larghezza, utilizzando il lato smussato di un bisturi o lametta.
- Utilizzando una micropipetta, applicare una piccola goccia (~0.1 µ l) dello ionoforo K+ vicino alla punta del microelettrodo. Se l'elettrodo è stato correttamente silanizzata che la goccia sarà assorbita nel punta rotta. Riempimento dell'elettrodo a 1-2 mm con l'ionoforo K+ e rimuovere l'eccesso con carta velina.
2. taratura del microelettrodo selettiva K+
- Preparazione delle soluzioni di taratura
- Preparare soluzioni di varie concentrazioni di KCl in uguale osmolarità del liquido cerebrospinale artificiale (ACSF) sostituendo NaCl con KCl. Abbiamo usato 0.1, 1, 4.5, 10 e 100 mM K+ ACSF, per la calibrazione degli elettrodi. Le ricette per queste soluzioni di calibrazione sono elencate nella tabella 1.
| Prodotto chimico | MW | finale mM | 0,1 mM [K +] | 1 mM [K +] | 4,5 mM [K +] | 10 mM [K +] | 100 mM [K +] |
| (g / mol) | |||||||
| NaCl | 58,44 | varia | 1,51 g | 1,50 g | 1,44 g | 1,4 g | 0,345 g |
| KCl | Stock di 1 M | varia | 20 µ l | 200 µ l | 900 µ l | 2 ml | 20 ml |
| CaCl2 | Stock di 1 M | 2 | 400 µ l | ||||
| MgCl2 | Stock di 1 M | 1 | 200 µ l | ||||
| NaH2PO4 | 119.98 | 1.2 | 0,29 g | ||||
| NaHCO3 | 84.01 | 26 | 0,437 g | ||||
| D-glucosio | 180,16 | 10 | 0,360 g | ||||
| Acqua | q.s. 200 ml | ||||||
Tabella 1. Soluzioni di calibrazione di potassio
- Calibrazione del microelettrodo
- Bubble tutte le soluzioni con 95% O25% CO2 per almeno 20 minuti prima di iniziare l'esperimento. Iniziare che irrora il bagno con 4,5 mM [K+] ACSF ad un tasso di 3 mL al minuto. Inserire l'elettrodo selettivo K+ portaelettrodo attaccato all'headstage elettrodo sul manipolatore. Questo headstage è collegato ad un amplificatore appropriato. Inserire la punta dell'elettrodo nel bagno perfusato.
- Garantire l'elettrodo di terra di Ag/AgCl è bagnata nella stessa soluzione e che il flusso è costante. Applicare soluzioni di calibrazione in un modo graduale e registrare i cambiamenti di potenziali in mV attraverso la punta dell'elettrodo. Attendere che il potenziale presso la punta dell'elettrodo per raggiungere un valore stabile prima di passare alla soluzione successiva
- Misurare la variazione di tensione allo stato stazionario in risposta all'applicazione delle soluzioni di taratura per la punta dell'elettrodo. Confermare che la pendenza della risposta dell'elettrodo è almeno 52 e non superiore a 58 mV a cambio di registro in [K+].
3. preparazione di fettine di cervello Hippocampal acuta
- Preparazione delle soluzioni di fetta
- Preparare il saccarosio 500ml taglio soluzione composta da: saccarosio 194 mM, 30 mM NaCl, 4,5 mM KCl, 10 mM D-glucosio, 1 mM MgCl2, 1,2 mM NaH2PO4e 26 mM NaHCO3, 290-300 mOsm, saturo di 95% O2 e 5% CO2.
- Preparare 1-2 litri di soluzione di registrazione (ACSF) composti da: 124 mM NaCl, 4,5 mM KCl, 1 mM MgCl2, 10 mM D-glucosio, 2mm CaCl2, 1,2 mM NaH2PO4e 26 mM NaHCO3; pH 7.3-7.4 (dopo il bubbling), 290-300 mOsm, saturo di 95% O2 e 5% CO2. Riempire un becher contenente una camera di titolare fetta di cervello con soluzione di registrazione e la tiene a 32-34 ° C. Riempire la camera vibratome con granita di acqua e ghiaccio.
- Preparazione di fetta acuta
- Profondamente anestetizzare un mouse collocandolo in una campana di vetro pre-caricato con 2-3 mL isoflurano. Verifica per reflex di punta pizzico e se non rispondono, rapidamente decapitare utilizzando un paio di forbici taglienti o ghigliottina come richiede il protocollo animale.
- Fare un'incisione di 2-3 cm usando le cesoie dalla porzione caudale del cranio per tagliare il cuoio capelluto lungo la linea mediana. Durante il riavvolgimento manualmente il cuoio capelluto, fare due incisioni orizzontali 1cm dal magnum di orifizio lungo i lati del cranio. Poi, usando le cesoie bene, tagliare un'incisione la lunghezza del cranio, lungo la linea mediana dalla parte posteriore del cranio al naso.
- Utilizzando una pinzetta inserita vicino al midline, ritrarre il cranio inciso in due porzioni. Estrarre il cervello di topo dal cranio e utilizzare una lama per rimuovere il cervelletto e bulbi olfattivi, che si trovano rispettivamente le porzioni rostrale e caudale del cervello. Questi possono essere identificati da grandi fenditure, che li separano dalla corteccia.
- Montare il blocco di cervello sul vassoio vibratome utilizzando colla super. Riempire il vassoio del vibratome con soluzione di taglio di ghiaccio freddo.
- Tagliare le sezioni di tessuto sul piano corona a 300 µm spessore. Di solito possono essere raccolti 6 fette hippocampal coronale.
- Dopo ogni sezione viene tagliato, trasferire immediatamente le fette per la fetta che tiene Becher riscaldato a 32-34° C. Mantenere le sezioni a questa temperatura per 20 minuti prima di rimuovere il becher contenente le sezioni e questo posto a temperatura ambiente per almeno 20-30 minuti prima della registrazione.
4. misurazione delle dinamiche elettricamente evocate K+
- Impostazione per la preparazione di fetta
- Posizionare delicatamente la fetta di cervello nella vasca utilizzando una pipetta di Pasteur e tenerlo delicatamente in posizione con un platino arpa con corde in nylon.
- Garantire le punte dell'elettrodo stimolante bipolare sono parallele tra loro e sono livello con il piano della sezione. Lentamente, nel corso di 6-7 secondi, inserire gli elettrodi in CA3 strato radiato circa 40-50 µm profondità per stimolare collaterali di Schaffer. In sezioni coronali, CA3 può essere identificato circa come la porzione di laterali ippocampo adeguato per lo strato delle cellule del granello al genu hippocampal, con la strato radiato cadendo mediale e ventrale per lo strato delle cellule piramidali.
- Inserire con cautela il K+-elettrodo selettivo in CA1 strato radiato circa 50 µm profonda, abbassando lentamente l'elettrodo sopra circa 3-4 secondi. Consentire il potenziale stabilizzare attraverso l'elettrodo prima di applicare stimoli la fetta: questo di solito richiede 5-10 minuti. Se la fetta esibisce spontanea modifiche in extracellulare K+ scartare e ripetere questo processo con una fetta di nuovo.
- Misurare il rilascio evocato K+
- Applicare i treni di stimolazione elettrica (8 impulsi) premendo manualmente il trigger sullo stimolatore durante la registrazione digitale di risposte. Applicare la stimolazione a 10 Hz e 1 larghezza di impulso di ms, a partire da ampiezza di stimolo 10 µA.
- Applicare le ampiezze di stimolazione crescente di un fattore di 2 fino a quando viene rilevata un'ampiezza massima di risposta K+ . Se non vedete alcuna risposta, è possibile spostare la posizione dell'elettrodo K+ più vicino al sito di stimolazione in 100 µm in passi da
- Determinare l'ampiezza di stimolo che produce la risposta massima mezza. Nella nostra esperienza, questo è tra 40-160 µA, dipendendo la qualità di preparazione, l'età dell'animale e la distanza tra gli elettrodi di stimolazione ed elettrodo selettivo K+ .
- Nella stessa sezione, utilizzando un'ampiezza di stimolo ad un passo inferiore l'ampiezza che produce la risposta massima mezza (ad es. se 80 µA produce una risposta mezzo massima, utilizzare 40 µA) applicare i treni di stimolo di aumento del numero di impulsi. Inizialmente, abbiamo usato i treni di impulsi di 1, 2, 4, 8, 16, 32, 64 e 128.
- Per confermare che K+ segnali sono mediati da infornamento del potenziale d'azione del bagno collaterals Schaffer stimolato elettricamente, applicare 0,5 µM TTX in ACSF per 10 minuti e ripetere il protocollo di stimolazione. Nessun risposte evocate dovrebbero essere osservate.
- Dopo aver terminato l'esperimento di fetta, confermare l'elettrodo ha mantenuto la sua responsività ri-calibrare l'elettrodo nelle soluzioni di calibrazione e garantire la risposta non si è discostato di oltre il 10% dalla taratura iniziale
Risultati
Per la determinazione selettiva di extracellulare K+, abbiamo preparato microelettrodi iono-selettivi, rivestiti con uno strato idrofobico attraverso silanizzazione delle pipette di vetro borosilicato pulito (Figura 1A). Questo rivestimento permette lo ionoforo K+ contenente valinomicina per riposare sulla punta dell'elettrodo e consentire solo K+ di flusso attraverso una stretta apertura presso la punta dell'elettrodo (Figura 1B). Dopo l'innesco degli elettrodi con la soluzione salina riempita e lo ionoforo K+ , gli elettrodi possono essere testati per la loro risposta rapida e lineare graduale cambiamenti nelle concentrazioni di bagno K+ (Figura 3A) e per la loro risposta a bagno K+ cambia sopra il campo di taratura (Figura 3B) in soluzione salina o ACSF in modo predetto dall' equazione del Nernst2. Il cambiamento nello stato di stabilità potenziale può essere tracciato contro la vasca da bagno K+ concentrazione al fine di determinare la pendenza della linea, che dovrebbe essere circa 58,2 mV al registro [K+], secondo l'equazione di Nernst e non meno di 52 mV a accedere [K+] (Figura 3). Inoltre abbiamo testato la capacità di risposta degli elettrodi selettivi K+ e abbiamo trovato che hanno risposto ad un cambiamento di 5,5 mM in K+ con costanti di tempo di ascesa e decadenza di circa 85 ms (Figura 3D,E).
L'impianto di registrazione elettrofisiologica è costituito da un microscopio verticale standard collegato a un display LCD per individuare il posizionamento della stimolante ed elettrodi di registrazione. Ottiche speciali non sono necessari per la collocazione visiva del K+ ed elettrodi di stimolazione; Usiamo un 5x o 10x obiettivo e luce bianca da una lampada alogena, ma un LED bianco potrebbe essere utilizzato invece. L'elettrodo stimolante è collegato all'uscita di un isolatore di stimolo, che batte depolarizzanti corrente tramite la consegna temporizzata di impulsi da uno stimolatore o altri tali dispositivi di temporizzazione. In altre parole, lo stimolatore offre treni di 2 V, 10-20 Hz impulsi di temporizzazione per l'isolatore di stimolo. Alla ricezione di questi impulsi, l'isolatore di stimolo fornisce poi la corrente desiderata per gli elettrodi di stimolazione. L'elettrodo di registrazione è collegato ad un titolare di elettrodo, collegato ad un headstage, amplificatore e scheda A/D, che si interfaccia ad un PC con software di registrazione elettrofisiologica (Figura 4A). Dopo che l'elettrodo è stato calibrato correttamente e le fette acute sono state preparate, la fetta è collocabile nel perfusato ACSF. Per stimolare i collaterali di Schaffer, K+-elettrodo selettivo è collocato all'interno del CA1 strato radiato e l'elettrodo di stimolazione di campo viene inserito all'interno del CA3 (Figura 4B).
Una volta che sono stati collocati gli elettrodi e la registrazione di K+ ha raggiunto una linea di base stabile, quindi impulsi di crescente ampiezza corrente possono essere applicati alla sezione (Figura 5, top). La forma d'onda di questa attività, viene visualizzato come un rapido aumento di K+ con un tasso di decadimento esponenziale, che si è abolito con applicazione di TTX (Figura 5, in basso).

Figura 1 : Schema di reazione di silanizzazione e architettura selettiva microelettrodo K+ . R. rappresentazione schematica della silanizzazione reazione che avviene tra i gruppi di idrossile polare esposta del vetro borosilicato e il dichlorodimethylsilane di reagente di silanizzazione (DDS). Questa reazione rende la superficie del vetro idrofobo, che permette lo ionoforo K+ formare una membrana sottile. B. diagramma del microelettrodo selettiva di K+ . L'elettrodo è riempita con soluzione salina e la soluzione selettiva di K+ è posto in uno strato spesso 1-2 mm sulla punta. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Diagramma di estrazione DDS. Rappresentazione schematica della procedura di sostituzione di azoto per l'estrazione di DDS da un contenitore. DDS è volatile ed infiammabile e può reagire violentemente con gas atmosferici quando è in concentrazioni elevate di conseguenza che è necessario sostituire il DDS rimosso con gas inerte azoto. Un palloncino riempito di azoto è collegato ad un ago tramite una siringa o tubazione appropriata. Questo ago viene inserito attraverso il sigillante sul contenitore permettendo il flusso di gas (N2) di azoto nel contenitore. Separatamente, un ago lungo (3-10 cm) è collegato ad una siringa da 1 mL e inserito nel contenitore. Questa siringa viene quindi utilizzata per estrarre DDS, mentre solo gas di azoto può entrare nel contenitore. Clicca qui per visualizzare una versione più grande di questa figura.
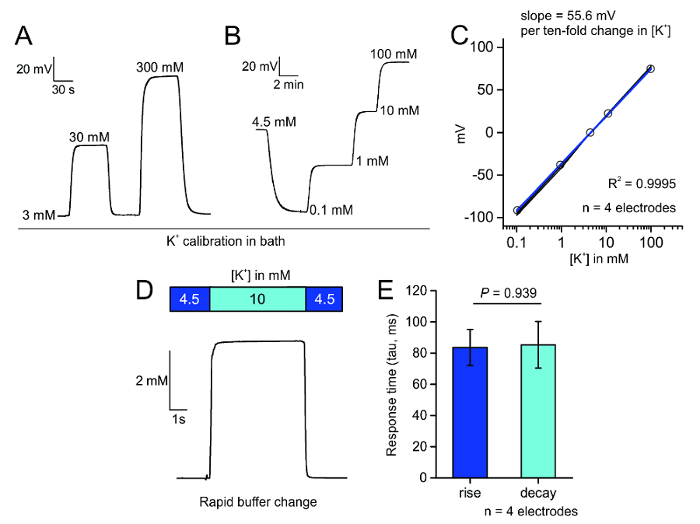
Figura 3 : Taratura di microelettrodi. R. bagno aspersione applicazione delle concentrazioni differenti di K+ in soluzione salina può rapidamente e reversibilmente produrre Nernstian cambiamenti nel potenziale attraverso la punta dell'elettrodo. B. applicazione graduale di K+ in ACSF evoca un cambiamento caratteristico e stabile del potenziale di elettrodo punta. C. trama del cambiamento mV dell'elettrodo selettivo K+ in risposta all'aumento delle concentrazioni di K+ in quattro elettrodi; R2 è 0.9995 per questi quattro elettrodi. D. Perfusione veloce sistema vasca applicazione di 10 mM K+ provoca una risposta di fase in tensione attraverso la punta del elettrodo selettivo di K+ . E. trama della risposta misurata volte (tau in ms); è stata rilevata alcuna differenza tra tempo di ascesa e decadenza (media ± SEM, p = 0.939, due campione t-test). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Apparecchi per la misurazione di K+ extracellulare. R. l'impianto di perforazione di elettrofisiologia è costituito da un microscopio fissato a una tabella di anti-vibrazione con una fotocamera collegata e display LCD per la visualizzazione di fetta. L'elettrodo di K+ è fissato ad un headstage, amplificatore e da analogico a digitale board che emette il segnale di un PC collegato con software di registrazione elettrofisiologica. Gli elettrodi di stimolazione elettrica sono collegati ad un isolatore di stimolo che varia l'ampiezza di stimolazione e uno stimolatore per la consegna di stimolo di temporizzazione. B. diagramma della fetta del preparato e la posizione del posizionamento degli elettrodi vari presso la fetta. CA3 può essere identificato circa come la porzione di laterali ippocampo adeguato per lo strato delle cellule del granello al genu hippocampal, con la strato radiato cadendo rostrale allo strato delle cellule piramidali. Clicca qui per visualizzare una versione più grande di questa figura.
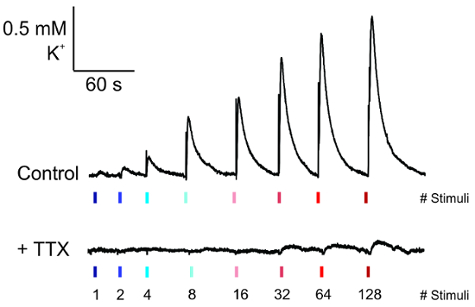
Figura 5 : Misurazione del rilascio elettricamente evocato K+ . Rappresentante tracce di K+ rilasciare dall'elettrodo di registrazione in condizioni basali (in alto) e la loro perdita sull'applicazione della tetrodotossina (0,25 µM) per 5 minuti prima di registrare (in basso). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il metodo che descriviamo qui ci ha permesso di valutare K+ dinamiche in risposta alla stimolazione elettrica dei collaterals Schaffer in fettine ippocampali acute da topi adulti. Il nostro metodo di preparazione K+ microelettrodi selettiva dello ione è simile a precedenti procedure descritte12,13,14,15. Tuttavia, questo metodo presenta vantaggi rispetto alle configurazioni alternative elettrodo in quanto è veloce e semplice da preparare microelettrodi selettivi K+ . Dopo la calibrazione appropriata, questi elettrodi sono stati trovati per misurare robustamente dinamica di K+ a fette durante stimolazione elettrica, e tali risposte sono state bloccate dal TTX. In questi esperimenti, sono stati utilizzati stimolazioni di 80-160 uA a 10 Hz; Tuttavia, ottimizzazione delle condizioni di stimolazione per un particolare esperimento e per un'area del cervello di interesse sarà richiesto. Questi valori sono elencati come una guida.
La pendenza della risposta degli elettrodi deve essere 58,2 mV al registro [K+]. Tale valore è previsto dalle equazioni del Nernst e Nicolsky-Eisenman per una membrana semi-permeabile selettiva K+ ; quest'ultimo rappresenta il meglio per le interazioni tra ioni16. Se l'elettrodo non risponde nel modo previsto, questo potrebbe essere per uno dei due motivi principali. In primo luogo la silanizzazione potrebbe essere insufficiente, provocando la membrana di essere persi o sale ponti a forma. Confermare che la membrana è intatta tramite l'osservazione al microscopio, ci dovrebbe essere una chiara interfaccia tra la membrana e la soluzione di pipetta. Un altro motivo, potrebbe essere la presenza di bolle nella pipetta che ostacolano il flusso di corrente dal filo di cloruro d'argento. Se si osservano bolle, quindi rimuovere la pipetta e flick vigorosamente per rimuoverli. Se queste soluzioni non riescono, ri-fare un altro elettrodo selettivo K+ o ripetere silanizzazione per più o a temperature più elevate. Tuttavia, è importante ripetere questi controlli chiavi ogni volta che una nuova regione del cervello è stata studiata o un nuovo microelettrodo è testato.
Due amplificatori specifici sono stati utilizzati in questi esperimenti, ma altri amplificatori potrebbero essere utilizzati finché l'impedenza dell'input è maggiore o uguale a 500 MΩ. Dopo aver calibrato gli elettrodi con MΩ 500 e 5 impedenze ingresso GΩ, abbiamo trovato non c'era differenza nel versante della risposta tensione con entrambe le impostazioni sopra una gamma di K+ concentrazioni (56,9 ± 0,7 a 56,5 ± 0,9 mV per dieci volte di cambiamento nel [K+ < / C1 >] per 500 MΩ e GΩ 5 input impedenze, rispettivamente; P = 0,759, abbinati a t-prova, n = 4 elettrodi).
Abbiamo anche usato la soluzione veloce interruttori per stimare il tempo di risposta degli elettrodi ad un salto noto in [K+] da 4,5 a 10 mM (Figura 3D). Gli elettrodi ha risposto con tempi di ascesa e decadenza (tau) di 85 ± 12 e 85 ± 15 ms, rispettivamente. A questo proposito, la cinetica del cambio di soluzione per nostro switcher di soluzione personalizzata veloce era 85 ± 27 ms. quindi, gli elettrodi selettivi K+ rispondono con la cinetica veloce come lo switcher di soluzione che abbiamo impiegato e nettamente superiore rispetto la dinamica di K+ in l'ambiente extracellulare a seguito di stimolazione collaterale di Schaffer (Figura 5). Questi dati suggeriscono che elettrodi selettivi K+ possono essere utilizzati per stimare la cinetica di accumulo di K+ e liquidazione nel tessuto cerebrale. Tuttavia, nel futuro lavoro adeguati controlli e tarature saranno necessarie caso per caso. Suggeriamo che vale la pena di dedicare tempo a comprendere la cinetica del cambio di soluzione nella vostra camera di registrazione.
Abbiamo trovato tre criticamente importanti fattori che influenzano la qualità e la robustezza delle misurazioni di K+ a fette. Il primo è la qualità della preparazione, sia la salute dei tessuti e l'età degli animali usati sembrano essere rilevanti. Per questo studio, abbiamo usato i topi C57/Bl6N che sono ~ 12 settimane di età. In rare occasioni, abbiamo trovato fette con fluttuazioni spontanee di K+ pari a ~0.1 mM e dura 5-10 secondi; queste fette sono state scartate. Il secondo è la qualità del microelettrodo registrazione. Il problema principale è il tempo e la temperatura utilizzata per la silanizzazione del vetro tirato capillare. Si consiglia di > 170 ° C per almeno 6 ore (fino a una notte è accettabile) o a 200 ° C per 30 minuti. Riscaldamento insufficiente degli elettrodi con il reagente di silanizzazione può condurre agli elettrodi che non mantengono uno stato costante potenziale a causa della progressiva perdita dello ionoforo K+ . Inoltre, durante la preparazione degli elettrodi, si consiglia di mettere un sottile strato (1-2 mm) dello ionoforo K+ in punta con un diametro di 10-20 µm, vale a dire circa le dimensioni di un corpo cellulare medio (Figura 1B). Non rompere la punta eccessivamente ampia, o la membrana selettiva di K+ perderà l'integrità e l'elettrodo avrà esito negativo. Questo passaggio può richiedere qualche pratica di raggiungere punte di dimensioni corrette. K+ elettrodi selettivi con una punta troppo sottile o troppo spessa di un livello possono avere risposte pigre, rispetto agli elettrodi adeguatamente costruiti. Il terzo fattore è la distanza tra l'elettrodo di stimolazione e l'elettrodo selettivo di K+ . Ci hanno usato una distanza inter-elettrodo di circa 500 µm, tuttavia la distanza ottimale può variare notevolmente con l'area del cervello individuale e sarà necessario considerare con attenzione per il particolare esperimento a portata di mano.
Oltre alla configurazione di canna singola, attualmente esistono diversi metodi per fare K+-selettivi microelettrodi in bipolare e concentrici formati17. Rispetto alle descrizioni pubblicate di questi metodi, monocanale elettrodi hanno due principali svantaggi: 1) un leggermente più grande diametro della punta (~ 10 vs 4 µm), che potrebbe causare una maggiore interruzione dello spazio extracellulare rispetto al bipolare e concentrici elettrodi e 2) incompatibilità con misura simultanea di più specie ioniche come gli elettrodi bipolari. Tuttavia, gli elettrodi di singolo canale offrono diversi vantaggi. In particolare, questi elettrodi possono essere fabbricati in meno di cinque minuti e sono quindi più USA e getta e può essere fatto e calibrato rapidamente prima di esperimenti. Di conseguenza, il rischio di rottura dell'elettrodo durante gli esperimenti di corso è meno di una preoccupazione. Inoltre, poiché l'elettrodo di massa e l'elettrodo di registrazione sono fisicamente separati per il volume del bagno, non c'è nessuna possibilità per la formazione di ponti sale sulla punta dell'elettrodo, che può portare al fallimento dell'elettrodo nel concentrico e bipolare elettrodi. Il tempo di risposta degli elettrodi singolo canale è più veloce di elettrodi bipolari e probabilmente paragonabile a concentrici elettrodi (~ 20 ms), anche se il nostro sistema di perfusione veloce consentito solo una misurazione di tempi di risposta dell'ordine di 80 ms (Figura 3E ). Inoltre, questi elettrodi offrono un rumore inferiore rispetto agli elettrodi bipolari, che hanno una maggiore resistenza di punta e richiedono l'uso di amplificatori con più alta resistenza di ingresso. Infine, questi elettrodi non richiedono l'uso di un micromanipolatore specializzati o headstage come è richiesto per gli elettrodi concentrici. Il saldo, i vantaggi della costruzione e facilità d'uso di elettrodi di singolo canale superano gli svantaggi.
L'approccio che abbiamo usato qui per misurare la dinamica di K+ a fette utilizzabile in molte regioni del cervello per studiare il regolamento di K+ . Anche se questo protocollo viene illustrato l'utilizzo di K+-elettrodi selettivi per le misurazioni delle dinamiche di ioni di potassio elettricamente evocate in tessuti del cervello, questo protocollo può essere ampiamente utilizzato in molti tessuti differenti dove è auspicabile misurare la dinamica di K+ . Tali situazioni possono includere dinamiche spontanee e cambiamenti in risposta a farmacologici, optogenetica, o chemogenetic attivazione cellulare. Questi microelettrodi possono essere fatta con sufficiente qualità e affidabilità tali da consentire la rapida integrazione di questa tecnica in qualsiasi casella degli strumenti di laboratorio. Le analisi dettagliate delle concentrazioni di K+ in salute e stati malati consentirà ulteriori individuazione e la quantificazione di come le varie componenti cellulari e molecolari contribuiscono a riposo K+ le concentrazioni nel cervello3, 18,19.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Il laboratorio di Khakh è stato sostenuto da NIH MH104069. Il laboratorio Mody è stato sostenuto da NIH NS030549. J.C.O. grazie Grant(NS058280) formazione di NIH T32 neurale microcircuiti.
Materiali
| Name | Company | Catalog Number | Comments |
| Vibratome | DSK | Microslicer Zero 1 | |
| Mouse: C57BL/6NTac inbred mice | Taconic | Stock#B6 | |
| Microscope | Olympus | BX51 | |
| Electrode puller | Sutter | P-97 | |
| Ag/AgCl ground pellet | WPI | EP2 | |
| pCLAMP10.3 | Molecular Devices | n/a | |
| Custom microfil 28G tip | World precision instruments | CMF28G | |
| Tungsten Rod | A-M Systems | 716000 | |
| Bipolar stimulating electrodes | FHC | MX21XEW(T01) | |
| Stimulus isolator | World precision instruments | A365 | |
| Grass S88 Stimulator | Grass Instruments Company | S88 | |
| Borosilicate glass pipettes | World precision instruments | 1B150-4 | |
| A to D board | Digidata 1322A | Axon Instruments | |
| Signal Amplifier | Multiclamp 700A or 700B | Axon Instruments | |
| Headstage | CV-7B Cat 1 | Axon Instruments | |
| Patch computer | Dell | n/a | |
| Sodium Chloride | Sigma | S5886 | |
| Potassium Chloride | Sigma | P3911 | |
| HEPES | Sigma | H3375 | |
| Sodium Bicarbonate | Sigma | S5761 | |
| Sodium Phosphate Monobasic | Sigma | S0751 | |
| D-glucose | Sigma | G7528 | |
| Calcium Chloride | Sigma | 21108 | |
| Magnesium Chloride | Sigma | M8266 | |
| valinomycin | Sigma | V0627-10mg | |
| 1,2-dimethyl-3-nitrobenzene | Sigma | 40870-25ml | |
| Potassium tetrakis (4-chlorophenyl)borate | Sigma | 60591-100mg | |
| 5% dimethyldichlorosilane in heptane | Sigma | 85126-5ml | |
| TTX | Cayman Chemical Company | 14964 | |
| Hydrochloric acid | Sigma | H1758-500mL | |
| Sucrose | Sigma | S9378-5kg | |
| Pipette Micromanipulator | Sutter | MP-285 / ROE-200 / MPC-200 | |
| Objective lens | Olympus | PlanAPO 10xW |
Riferimenti
- McDonough, A. A., Youn, J. H. Potassium homeostasis: The knowns, the unknowns, and the health benefits. Physiol Bethesda Md. 32 (2), 100-111 (2017).
- Hille, B. Ion channels of excitable membranes. , Sinauer. Sunderland, MA. 507(2001).
- Kofuji, P., Ceelen, P., Zahs, K. R., Surbeck, L. W., Lester, H. A., Newman, E. A. Genetic inactivation of an inwardly rectifying potassium channel (Kir4.1 subunit) in mice: Phenotypic impact in retina. J Neurosci. 20 (15), 5733-5740 (2000).
- Sibille, J., Dao Duc, K., Holcman, D., Rouach, N. The neuroglial potassium cycle during neurotransmission: role of Kir4.1 channels. PLoS Comput Biol. 11 (3), e1004137(2015).
- Tong, X., et al. Astrocyte Kir4.1 ion channel deficits contribute to neuronal dysfunction in Huntington's disease model mice. Nat Neurosci. 17 (5), 694-703 (2014).
- Datta, D., Sarkar, K., Mukherjee, S., Meshik, X., Stroscio, M. A., Dutta, M. Graphene oxide and DNA aptamer based sub-nanomolar potassium detecting optical nanosensor. Nanotechnology. 28 (32), 325502(2017).
- Bandara, H. M. D., et al. Palladium-Mediated Synthesis of a Near-Infrared Fluorescent K+ Sensor. J Org Chem. 82 (15), 8199-8205 (2017).
- Depauw, A., et al. A highly selective potassium sensor for the detection of potassium in living tissues. Chem Weinh Bergstr Ger. 22 (42), 14902-14911 (2016).
- Machado, R., et al. Biofouling-Resistant Impedimetric Sensor for Array High-Resolution Extracellular Potassium Monitoring in the Brain. Biosensors. 6 (4), (2016).
- Rose, M. C., Henkens, R. W. Stability of sodium and potassium complexes of valinomycin. Biochim Biophys Acta BBA - Gen Subj. 372 (2), 426-435 (1974).
- Ammann, D., Chao, P., Simon, W. Valinomycin-based K+ selective microelectrodes with low electrical membrane resistance. Neurosci Lett. 74 (2), 221-226 (1987).
- Amzica, F., Steriade, M. Neuronal and glial membrane potentials during sleep and paroxysmal oscillations in the neocortex. J Neurosci. 20 (17), 6648-6665 (2000).
- Amzica, F., Steriade, M. The functional significance of K-complexes. Sleep Med Rev. 6 (2), 139-149 (2002).
- MacVicar, B. A., Feighan, D., Brown, A., Ransom, B. Intrinsic optical signals in the rat optic nerve: role for K(+) uptake via NKCC1 and swelling of astrocytes. Glia. 37 (2), 114-123 (2002).
- Chever, O., Djukic, B., McCarthy, K. D., Amzica, F. Implication of Kir4.1 channel in excess potassium clearance: an in vivo study on anesthetized glial-conditional Kir4.1 knock-out mice. J Neurosci. 30 (47), 15769-15777 (2010).
- Hall, D. G. Ion-selective membrane electrodes: A general limiting treatment of interference effects. J Phys Chem. 100 (17), 7230-7236 (1996).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. R. Double-barreled and Concentric Microelectrodes for Measurement of Extracellular Ion Signals in Brain Tissue. J Vis Exp. (103), e53058(2015).
- Larsen, B. R., MacAulay, N. Kir4.1-mediated spatial buffering of K(+): Experimental challenges in determination of its temporal and quantitative contribution to K(+) clearance in the brain. Channels Austin Tex. 8 (6), 544-550 (2014).
- Mei, L., et al. Long-term in vivo recording of circadian rhythms in brains of freely moving mice. Proceedings of the National Academy of Sciences. 115, 4276-4281 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon