Method Article
成人脑组织切片中钾离子选择性电极的制备、检测及应用
摘要
钾离子有助于细胞的静止膜电位, 胞外 K+浓度是细胞兴奋性的重要调节因子。我们描述如何制作, 校准和使用单 K+选择性电极。使用此类电极可以测量成年海马切片中电诱发的 K+浓度动态。
摘要
钾离子对细胞的静止膜电位有显著的促进作用, 因此胞外 K+浓度是细胞兴奋性的重要调节因子。细胞外 K+的浓度改变会影响静止膜电位和细胞兴奋性, 方法是将闭合的、开放的和灭活状态之间的平衡转移到有作用电位的电压依赖离子通道上。启动和传导。因此, 直接测量健康和患病状态下的胞外 K+动态是很有价值的。在这里, 我们描述如何制作, 校准和使用单 K+选择性电极。我们将它们部署在成人海马脑切片中, 以测量电诱发 K+浓度动态。明智地使用此类电极是评估细胞和生物物理机制, 以控制神经系统细胞外 K+浓度所需的工具套件的重要组成部分。
引言
钾离子浓度在大脑中受到严格的调节, 它们的波动对所有细胞的静止膜电位有很大的影响。根据这些重要的贡献, 生物学的一个重要目标是确定细胞和生物物理机制, 用于在身体的不同器官的细胞外空间中严格调节 K+的浓度1,2. 这些研究的一个重要要求是能够准确地测量 K+浓度。虽然在健康和患病状态下, 许多有助于大脑中钾稳态的成分已经被确认为3,45, 由于专业性质的原因, 进一步的进展已经减慢。制备离子选择性电极钾的方法。微电极传感器表示用于测量 K+浓度体外、组织切片和体内中的金标准。
用于 k+监视的更新方法正在使用光学传感器进行开发, 但这些检测不到与生物学相关的 k+浓度范围, 也未在生物系统中进行全面审查, 尽管初步结果显示有希望的6,7,8。与光学传感器相比, 电极从根本上被限制为离子的点源测量, 虽然电极阵列可以改善空间分辨率9。本文重点介绍了用于监测 K+动力学的单桶微电极传感器。
在这项工作中, 我们报告详细的逐步过程, 使 K+选择性电极, 使用基于 valinomycin 的钾载体, 允许高度选择性 (104折叠 k+到 Na+选择性) k+在膜上运动10。valinomycin 是一种自然发生的多肽, 它充当 k+渗透性孔隙, 并使 k+的流量降低到其电化学梯度。我们还描述了如何校准电极, 如何存储和使用它们, 最后如何部署它们来测量成年小鼠海马脑切片中的 K+浓度动态。使用此类电极和基因修饰小鼠缺乏特定的离子通道来调节胞外 K+动力学应该揭示神经系统使用的细胞机制来控制 k 的环境浓度。在胞外环境中的+ 。
研究方案
所有动物实验都是按照美国国家卫生研究院的实验室动物护理和使用指南进行的, 并得到了加州大学洛杉矶分校校长动物研究委员会的批准。所有的老鼠都是在12小时的昏暗环境中使用食物和水的ad 随意。所有动物都是健康的, 没有明显的行为变化, 没有参与以前的研究, 并在光周期中牺牲。实验数据从成年小鼠 (6-8 周大的所有实验) 中采集。
1. K+选择性电极的制备
- 硼硅酸盐玻璃的硅烷化
- 从包装中取出足够的玻璃毛细血管, 放入50毫升锥形管。用1米 hcl 填充锥形管顶部. 在 hcl 中用温和的搅拌方法清洗电极一夜之间或至少6小时。
- 用70% 乙醇简单冲洗毛细血管, 然后在100-120 摄氏度内完全干燥6-8 小时。在使用无水硫酸钙干燥剂的容器中贮存清洗过的毛细血管长达4周。
- 在硅烷化之前, 用微电极拉拔毛细血管到细尖端。我们使用的电极直径约为2-5 微米。总是用手套处理冲洗过的毛细血管, 因为皮肤上的油脂会干扰硅烷化。
- 将电极放入玻璃容器中, 使电极从底部升高以防止尖端破损。使用耐高压胶带或类似胶带将电极固定在容器上。
- 使用氮气替换方法从容器中移除大约0.5 毫升 5% dichlorodimethylsilane (DDS) 硅烷化溶液 (请参见图 2)。用氮气填充气球, 然后将注射器、管子和针头连接到气球上。将该针插入 dds 容器, 同时通过较长的针将 DDS 绘制到单独的注射器中。
- 将硅烷化溶液滴在吸管的尖端, 立即盖上。将容器持有电极与硅烷化溶液放入预热 (170-180 °c) 实验室烤箱10-12 小时或200-220 摄氏度30分钟
- 孵化后, 关闭烤箱, 然后从烤箱中取出盘子。从孵化器中取出盘子时要小心, 因为它非常热。将盘子放在室温下的长凳上10-15 分钟, 让玻璃器皿冷却。
- 从盘子中取出电极 (使用剃刀刀片或手术刀刀片来剪切胶带), 并将其放入干燥剂填充的密闭容器中。硅烷化电极保持水分可用于1周以下硅烷化。
- 启动电极
- 准备 K+载体鸡尾酒的库存解决方案: 5% 瓦特/v valinomycin, 93% 伏/v 12-二甲基3硝基苯, 2% 瓦特/v 钾四 (4-氯苯基) 硼酸盐11。这个解决方案是一个淡黄色的颜色。在室温下保持密闭、不透明的容器。如果正确存储此解决方案可以持续许多个月。
- 准备一个10毫米 HEPES 缓冲300毫米氯化钠在 pH 值7.4 的股票溶液。使用与注射器连接的28G 丙纶尖端, 将电极固定在夹持器和回填用缓冲氯化钠。观察生理盐水溶液已达到微电极尖端的末端。确认微电极没有大气泡, 可能干扰电流的流动。
- 用手术刀或剃刀刀片的钝面将电极的尖端折断到大约10-20 µm 宽。
- 使用微, 在微电极尖端附近应用 K+载体的小水滴 (~ 0.1 µl)。如果电极已正确硅烷化液滴将被吸收到破碎的尖端。用 K+载体将电极填充到1-2 毫米, 并使用纸巾去除多余的部分。
2. K+选择性电极的校准
- 校准解决方案的准备
- 用氯化钾代替氯化钠, 制备等渗透人工脑脊液中不同浓度氯化钾的溶液 (ACSF)。我们使用了0.1、1、4.5、10和100毫米 K+ ACSF, 用于校准电极。这些校准解决方案的食谱列在表 1中。
| 化学 | M w | 最后 mM | 0.1 毫米 [K +] | 1毫米 [K +] | 4.5 毫米 [K +] | 10毫米 [K +] | 100毫米 [K +] |
| (克/摩尔) | |||||||
| Nacl | 58.44 | 不同 | 1.51 克 | 1.50 克 | 1.44 克 | 1.4 克 | 0.345 克 |
| 氯化钾 | 1米库存 | 不同 | 20µl | 200µl | 900µl | 2毫升 | 20毫升 |
| CaCl2 | 1米库存 | 2 | 400µl | ||||
| 氯化镁2 | 1米库存 | 1 | 200µl | ||||
| NaH2PO4 | 119.98 | 1。2 | 0.29 克 | ||||
| NaHCO3 | 84.01 | 26 | 0.437 克 | ||||
| d-葡萄糖 | 180.16 | 10 | 0.360 克 | ||||
| 水 | q.s. 200 毫升 | ||||||
表1。钾校准解决方案
- 微电极校准
- 在开始实验前至少20分钟冒泡所有解决方案, 95% O2/5% CO2 。以每分钟3毫升的速率开始灌注4.5 毫米 [K+] ACSF 的浴缸。将 K+选择性电极放入附着在机械手上电极 headstage 的电极支架上。此 headstage 连接到适当的放大器。将电极尖端插入浴缸灌流液。
- 确保银/AgCl 接地电极沐浴在相同的溶液中, 并且流量是稳定的。以逐步的方式应用校准解决方案, 并记录在 mV 中的电位变化在电极尖端。在切换到下一个解决方案之前, 等待电极尖端的电位达到稳定值
- 测量稳态电压的变化, 以响应对电极尖端的校准解决方案的应用。确认在 [K+] 中, 电极响应的斜率至少为52且不大于 58 mV。
3. 急性海马脑切片的制备
- 切片溶液的制备
- 准备500毫升蔗糖切割液, 由: 194 mM 蔗糖组成, 30 毫米氯化钠, 4.5 毫米氯化钾, 10 毫米 d-葡萄糖, 1 毫米氯化镁2, 1.2 毫米 NaH2PO4和26毫米 NaHCO3, 290-300 mOsm, 饱和与 95% O2和 5% CO2。
- 准备1-2 公升记录解决方案 (ACSF), 包括: 124 毫米氯化钠, 4.5 毫米氯化钾, 1 毫米氯化镁2, 10 毫米 d-葡萄糖, 2 毫米 CaCl2, 1.2 毫米 NaH2PO4, 26 毫米 NaHCO3;pH 值 7.3-7.4 (冒泡后), 290-300 mOsm, 饱和与 95% O2和 5% CO2。用录音溶液填充含有脑切片夹室的烧杯, 并保持在32-34 摄氏度。用冰水来填满 vibratome 室。
- 急性切片制备
- 深麻醉一只老鼠, 把它放在钟罐子 precharged 与2-3 毫升异氟醚。检查脚趾捏反射, 如果不响应, 迅速斩首它使用一对锋利的剪刀或断头台, 因为你的动物协议要求。
- 用剪刀从头骨的尾部部分做一个2-3 厘米的切口, 沿着中线切开头皮。当手动缩回头皮, 使两个1厘米水平切口从孔大口径沿头骨两侧。然后, 使用细剪, 切开切口长度的头骨, 沿中线从头骨后面的鼻子。
- 使用在中线附近插入的细钳, 收回被切开的头骨在两个部分。从头骨中提取小鼠大脑, 用刀片去除小脑和嗅球, 分别位于脑尾部和延髓部分。这些都可以通过大的裂隙来识别, 它们与皮层分离。
- 使用超级胶水将脑块安装到 vibratome 托盘上。用冰冷切削液填充 vibratome 托盘。
- 在冠状面上切开组织切片, 厚度为300µm。通常可以收集6个冠状海马切片。
- 每节切完后, 立即将切片转移到片托烧杯上, 32-34°C。在取下包含该节的烧杯之前, 将这些节保持在20分钟的温度, 在录制前至少20-30 分钟将其放置在室温下。
4. 电诱发 K+动力学的测量
- 设置切片准备
- 用巴斯德吸管轻轻地将大脑切片放在浴缸中, 用带有尼龙弦的铂竖琴轻轻地握住它。
- 确保双极刺激电极的尖端彼此平行, 并与切片的平面保持水平。慢慢地, 在6-7 秒的过程中, 将电极插入 CA3 层 radiatum 大约40-50 µm 深刺激谢弗络。在冠状部分, CA3 可以近似地被辨认作为海马的部分正常侧向颗粒细胞层在海马膝, 与地层 radiatum 下落的内侧和腹侧到锥体细胞层数。
- 小心地将 K+选择性电极插入 CA1 地层 radiatum 约50µm 深, 通过慢慢降低电极约3-4 秒。在对切片施加刺激之前, 允许电位稳定在电极上: 这通常需要5到10分钟。如果切片在胞外 K+中呈现自发的变化, 则用新切片丢弃并重复此过程。
- 测量诱发 K+版本
- 应用电刺激 (8 脉冲) 的列车, 通过在数字记录响应时手动压制刺激器上的触发器。应用刺激在10赫兹和1毫秒脉宽, 从10µA 刺激幅度开始。
- 在检测到最大 K+响应振幅的情况下, 将增加的刺激振幅提高2倍。如果看不到任何响应, 请将 K+电极的位置以100µm 的增量更接近刺激站点。
- 确定产生半最大响应的刺激振幅。根据我们的经验, 这是在40-160 µA 之间, 取决于准备质量, 动物的年龄, 和刺激电极和 K+选择性电极之间的距离。
- 在同一切片中, 使用一个比产生半最大响应的振幅低一步的刺激振幅 (例如, 如果80µA 产生一个半最大响应, 使用40µA) 应用刺激列车的脉冲数量增加。最初, 我们使用了 1, 2, 4, 8, 16, 32, 64 和128脉冲的火车。
- 要确认 K+信号是由电刺激的谢弗络浴的动作电位发射介导的, 请在 ACSF 中应用0.5 µM TTX 10 分钟, 并重复刺激协议。不应观察诱发反应。
- 在完成切片实验后, 确认电极在校准解决方案中重新校准电极以保证其响应, 并确保响应在初始校准时不偏离10% 以上。
结果
对于细胞外 K+的选择性测量, 我们通过硅烷化清洁硼硅酸盐玻璃吸管(图 1A), 制备了具有疏水性层的离子选择性电极。此涂层使包含 valinomycin 的 k+载体在电极尖端上休息, 并且仅允许 k+通量通过在电极尖端的窄开口 (图 1B)。在用回填盐水溶液和 K+载体启动电极后, 可以对电极进行测试, 使其快速、线性地响应浴 K+浓度的逐步变化 (图 3A), 并响应浴 K+以斯特方程2预测的方式在生理盐水或 ACSF 中的校准范围 (图 3B) 上更改。在稳态电位的变化可以绘制对浴 K+浓度, 以确定直线的斜率, 这应该大约是 58.2 mV 每日志 [K+], 根据斯特方程, 并不少于 52 mv 每日志 [K+] (图 3C)。我们还测试了 k+选择性电极的响应性, 发现它们响应了 k+中的5.5 毫米变化, 其上升和衰减时间常数约为85毫秒 (图 3D,E)。
电生理记录钻机由一个标准的直立显微镜连接到 LCD 显示器, 用于识别刺激和记录电极的位置。在视觉上放置 K+和刺激电极不需要特殊的光学;我们使用一个5x 或10x 物镜和白光从卤素灯泡, 但一个白色的 LED 可以代替。刺激电极连接到一个刺激隔离器的输出, 它提供去极化型电流通过定时交付的脉冲从刺激或其他这样的定时装置。换句话说, 刺激器提供2伏, 10-20 赫兹定时脉冲的列车, 以刺激隔离。在接收到这些脉冲后, 刺激隔离器然后将所需电流传递给刺激电极。记录电极连接到一个电极支架上, 连接到 headstage、放大器和 a/d 板, 该主板与带有电生理记录软件的 PC 接口 (图 4A)。在电极已成功校准, 并准备了急性切片后, 切片可以放置在 ACSF 灌流液。为了刺激谢弗络, K+选择电极放置在 CA1 层 radiatum 中, 场刺激电极放在 CA3 内 (图 4B)。
一旦电极被放置并且 K+记录已达到稳定的基线, 则可将增加电流振幅的脉冲应用于切片 (图 5, 顶部)。此活动的波形显示为在 K+中的快速增加, 其指数衰减率为 TTX 应用程序 (图 5, 底部) 而取消。

图 1:硅烷化反应图和K + 选择性微电极体系结构。A.硼硅酸盐玻璃的暴露极性羟基和硅烷化试剂 dichlorodimethylsilane (DDS) 之间发生的硅烷化反应的示意图表示。这种反应呈现玻璃疏水性的表面, 使 K+载体形成薄膜。K+选择性微电极的B.图。电极与盐水溶液回填, K+选择性溶液在尖端的1-2 毫米厚层中放置。请单击此处查看此图的较大版本.

图 2: DDS 提取图.从容器中提取 DDS 的氮气置换过程的示意图表示法。dds 是挥发性的和易燃的, 并且在高浓度时可以与大气气体发生剧烈的反应, 因此有必要用惰性氮气取代 dds。装有氮气的气球通过注射器或适当的导管连接到针头上。此针通过容器上的密封胶插入, 允许氮气 (N2) 流入容器中。另外, 长 (3-10 厘米) 针连接到1毫升注射器, 并插入到容器中。这个注射器被用来提取 DDS, 而只有氮气可以进入容器。请单击此处查看此图的较大版本.
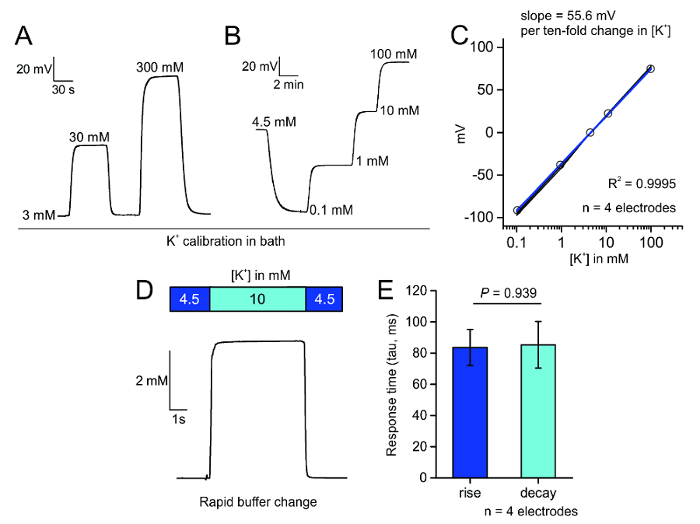
图 3: 校准电极。A.浴灌流应用不同的 K+浓度在生理盐水可以迅速和可逆地产生 Nernstian 变化的潜力, 在电极尖端。B.在 ACSF 中逐步应用 K+唤起了电极尖端电位的特性和稳定变化。C.对 k+选择性电极的 mV 变化进行绘制, 以响应在四电极中增加 k+的浓度;此四电极的 R2为0.9995。D.快速灌注系统浴应用10毫米 k+会导致跨 K+选择性电极尖端的电压步进响应。E.测量的响应时间 (头在 ms 中) 的绘制;没有发现上升和衰变时间之间的差异 (意味着 SEM, p = 0.939, 两个示例t测试)。请单击此处查看此图的较大版本.

图 4: 用于胞外 K+测量的设备。a.电生理学钻机由一台固定在防振动表上的显微镜组成, 并附有摄像头和 LCD 显示屏, 用于切片可视化。K+电极固定在 headstage、放大器和模拟数字板上, 将信号输出到附有电生理记录软件的附加 PC 上。电刺激电极连接到一个刺激的隔离器, 改变刺激幅度和刺激提供定时刺激交付。B.切片制备图和不同电极放置在切片上的位置。CA3 可以近似地被识别为海马膝上颗粒细胞层的适当侧向的部分, 与地层 radiatum 下落延髓到锥体细胞层。请单击此处查看此图的较大版本.
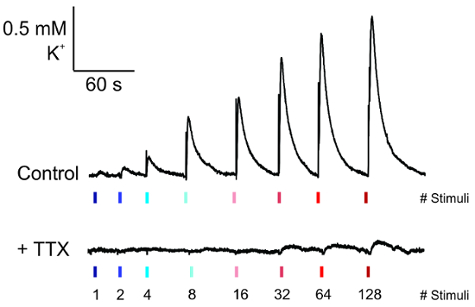
图 5: 测量电诱发 K+释放.有代表性的痕迹, K+释放从记录电极下的基础条件 (顶部) 和他们的损失后, 应用河豚毒素 (0.25 µM) 在5分钟前记录 (底部)。请单击此处查看此图的较大版本.
讨论
我们在这里描述的方法使我们能够评估 K+动力学, 以响应电刺激的谢弗络在急性海马切片的成年小鼠。我们准备 K+离子选择性电极的方法类似于前面描述的过程12,13,14,15。然而, 这种方法优于替代电极配置, 因为它是快速和复杂的准备 K+选择性电极。在适当的校准后, 发现这些电极在电刺激过程中能有力地测量 K+的动力学, 而这种反应被 TTX 阻止。在这些实验中, 使用了10赫兹的 80-160 uA 刺激;然而, 需要对特定实验和脑区感兴趣的刺激条件进行优化。这些值作为指南列出。
电极响应的斜率应为每日志 58.2 mV [K+]。此值由 K+选择性半透膜的斯特和 Nicolsky-埃森曼方程预测;后者更好地解释了离子16之间的相互作用。如果电极没有以预测的方式响应, 这可能是两个主要原因之一。首先硅烷化可能是不足的, 导致膜丢失或盐桥梁形成。通过显微镜观察, 证实膜是完整的, 在吸管溶液和膜之间应该有一个清晰的界面。另一个原因, 可能是在吸管中存在气泡, 阻碍电流从氯化银丝中流动。如果观察到气泡, 则取出吸管并用力轻拍以除去它们。如果这些解决方案失败, 请重新制作另一个 K+选择性电极, 或重复硅烷化以延长或更高的温度。然而, 在每次研究新的大脑区域或测试新的微电极时, 重复这些关键控制是很重要的。
在这些实验中, 使用了两个特定的放大器, 但只要输入阻抗大于或等于 500 MΩ, 就可以使用其他功率放大器。在校准了 500 MΩ和 5 GΩ输入阻抗的电极后, 我们发现电压响应的斜率与设置在 k+浓度范围内 (56.9 @ 0.7 和 56.5 @ 0.9 mV 每十倍的变化) 没有区别 [k+/c1>] 分别为 500 MΩ和 5 GΩ输入阻抗;P = 0.759, 配对的t-测试, n = 4 电极)。
我们还使用快速解决方案开关将电极的响应时间估计为从4.5 到10毫米 (图 3D) 中已知的跳转 (K+)。电极反应的上升和衰变时间 (头) 的 85 12 和 85 @ 15 ms, 分别。与此相关, 我们的自定义快速解决方案切换器的解决方案交换动力学是 85 27 毫秒. 因此, k+选择性电极反应的动力学速度快于我们所使用的解决方案切换器, 远快于 k+的动力学谢弗间接刺激导致的细胞外环境 (图 5)。这些数据表明, k+选择性电极可用于估计在脑组织中 k+积累和清除的动力学。但是, 在今后的工作中, 将需要在个案的基础上进行适当的控制和校准。我们建议花时间理解你的记录室中的解决方案交换动力学是有价值的。
我们发现了三个至关重要的因素, 它们影响了切片中 K+度量的质量和鲁棒性。第一是质量的准备, 无论是组织健康和年龄的动物似乎是相关的。对于这项研究, 我们使用了12周大的 C57/Bl6N 鼠。在罕见的情况下, 我们发现切片与自发 K+的波动, 相当于0.1 毫米和持续5-10 秒;这些切片被丢弃。二是记录微电极的质量。主要的问题是用于硅烷化玻璃毛细管的时间和温度。我们建议 > 170 °c 至少6小时 (最多一夜是可以接受的) 或在200°c 30 分钟。由于 K+载体的逐渐丢失, 电极与硅烷化试剂的加热不足会导致电极无法保持稳定的状态电位。此外, 在准备电极时, 我们建议将 K+载体的薄层 (1-2 毫米) 置于尖端, 直径为10-20 µm, 即大约为平均单元格体大小 (图 1B)。不要将笔尖折断得太宽, 否则 K+选择性膜将失去完整性, 电极将失效。此步骤可能需要一些练习来实现正确大小的提示。与正确构造的电极相比, K+选择性电极具有太细的尖端或太厚的层数可能会产生缓慢的响应。第三个因素是刺激电极与 K+选择性电极之间的距离。我们使用了大约500µm 的电极间距离, 然而最佳的距离可能极大地变化与各自的脑子区域和将需要仔细考虑为具体实验在手边。
除了单桶配置之外, 目前还有几种方法可以在双极和同心格式17中制作 K+选择性电极。与这些方法的公布描述相比, 单通道电极有两个主要的缺点: 1) 一个稍大的尖端直径 (~ 10 vs 4 µm), 这可能会导致更大的破坏细胞外空间 comparted 双极性和同心电极和 2) 不相容的同时测量多离子种类, 如在两极电极。然而, 单通道电极提供了几个优点。具体来说, 这些电极可以在不到五分钟内制造出来, 因此更容易被使用, 并且可以在实验前快速进行校准。因此, 在实验过程中, 电极破损的风险较少引起人们的关注。此外, 由于接地电极和记录电极物理上被浴缸的体积隔开, 在电极尖端没有机会形成盐桥, 这会导致同心和双极性的电极失效。电极。单通道电极的响应时间比双极性电极快, 可能与同心电极 (~ 20 毫秒) 相似, 虽然我们的快速灌注系统只允许测量80毫秒的响应时间 (图 3E).此外, 这些电极提供较低的噪音相比, 双极性电极, 它具有更大的尖端电阻, 并要求使用放大器具有较高的输入电阻。最后, 这些电极不需要使用专门的机器人或 headstage, 因为是同心电极所必需的。在平衡方面, 单通道电极结构的优点和易用性超过了缺点。
我们用来测量切片中 k+动态的方法可以在许多大脑区域用于研究 k+规则。尽管本协议演示了使用 K+选择电极来测量脑组织中电诱发钾离子的动态, 但该协议可以广泛应用于许多不同的组织中, 希望度量 K+动态。这种情况可能包括自发动力学和变化的反应药理, optogenetic, 或 chemogenetic 细胞活化。这些电极可以提供足够的质量和可靠性, 使这一技术迅速集成到任何实验室工具箱。对健康和患病状态中 k+浓度的详细分析将有助于进一步检测和量化各种分子和细胞成分在大脑3中的静止 K+浓度的贡献, 18,19。
披露声明
作者没有什么可透露的。
致谢
Khakh 实验室得到了 NIH MH104069 的支持。这个实验室是由 NIH NS030549 支持的。J.C.O. 感谢 NIH T32 神经集成电路训练补助金 (NS058280)。
材料
| Name | Company | Catalog Number | Comments |
| Vibratome | DSK | Microslicer Zero 1 | |
| Mouse: C57BL/6NTac inbred mice | Taconic | Stock#B6 | |
| Microscope | Olympus | BX51 | |
| Electrode puller | Sutter | P-97 | |
| Ag/AgCl ground pellet | WPI | EP2 | |
| pCLAMP10.3 | Molecular Devices | n/a | |
| Custom microfil 28G tip | World precision instruments | CMF28G | |
| Tungsten Rod | A-M Systems | 716000 | |
| Bipolar stimulating electrodes | FHC | MX21XEW(T01) | |
| Stimulus isolator | World precision instruments | A365 | |
| Grass S88 Stimulator | Grass Instruments Company | S88 | |
| Borosilicate glass pipettes | World precision instruments | 1B150-4 | |
| A to D board | Digidata 1322A | Axon Instruments | |
| Signal Amplifier | Multiclamp 700A or 700B | Axon Instruments | |
| Headstage | CV-7B Cat 1 | Axon Instruments | |
| Patch computer | Dell | n/a | |
| Sodium Chloride | Sigma | S5886 | |
| Potassium Chloride | Sigma | P3911 | |
| HEPES | Sigma | H3375 | |
| Sodium Bicarbonate | Sigma | S5761 | |
| Sodium Phosphate Monobasic | Sigma | S0751 | |
| D-glucose | Sigma | G7528 | |
| Calcium Chloride | Sigma | 21108 | |
| Magnesium Chloride | Sigma | M8266 | |
| valinomycin | Sigma | V0627-10mg | |
| 1,2-dimethyl-3-nitrobenzene | Sigma | 40870-25ml | |
| Potassium tetrakis (4-chlorophenyl)borate | Sigma | 60591-100mg | |
| 5% dimethyldichlorosilane in heptane | Sigma | 85126-5ml | |
| TTX | Cayman Chemical Company | 14964 | |
| Hydrochloric acid | Sigma | H1758-500mL | |
| Sucrose | Sigma | S9378-5kg | |
| Pipette Micromanipulator | Sutter | MP-285 / ROE-200 / MPC-200 | |
| Objective lens | Olympus | PlanAPO 10xW |
参考文献
- McDonough, A. A., Youn, J. H. Potassium homeostasis: The knowns, the unknowns, and the health benefits. Physiol Bethesda Md. 32 (2), 100-111 (2017).
- Hille, B. Ion channels of excitable membranes. , Sinauer. Sunderland, MA. 507(2001).
- Kofuji, P., Ceelen, P., Zahs, K. R., Surbeck, L. W., Lester, H. A., Newman, E. A. Genetic inactivation of an inwardly rectifying potassium channel (Kir4.1 subunit) in mice: Phenotypic impact in retina. J Neurosci. 20 (15), 5733-5740 (2000).
- Sibille, J., Dao Duc, K., Holcman, D., Rouach, N. The neuroglial potassium cycle during neurotransmission: role of Kir4.1 channels. PLoS Comput Biol. 11 (3), e1004137(2015).
- Tong, X., et al. Astrocyte Kir4.1 ion channel deficits contribute to neuronal dysfunction in Huntington's disease model mice. Nat Neurosci. 17 (5), 694-703 (2014).
- Datta, D., Sarkar, K., Mukherjee, S., Meshik, X., Stroscio, M. A., Dutta, M. Graphene oxide and DNA aptamer based sub-nanomolar potassium detecting optical nanosensor. Nanotechnology. 28 (32), 325502(2017).
- Bandara, H. M. D., et al. Palladium-Mediated Synthesis of a Near-Infrared Fluorescent K+ Sensor. J Org Chem. 82 (15), 8199-8205 (2017).
- Depauw, A., et al. A highly selective potassium sensor for the detection of potassium in living tissues. Chem Weinh Bergstr Ger. 22 (42), 14902-14911 (2016).
- Machado, R., et al. Biofouling-Resistant Impedimetric Sensor for Array High-Resolution Extracellular Potassium Monitoring in the Brain. Biosensors. 6 (4), (2016).
- Rose, M. C., Henkens, R. W. Stability of sodium and potassium complexes of valinomycin. Biochim Biophys Acta BBA - Gen Subj. 372 (2), 426-435 (1974).
- Ammann, D., Chao, P., Simon, W. Valinomycin-based K+ selective microelectrodes with low electrical membrane resistance. Neurosci Lett. 74 (2), 221-226 (1987).
- Amzica, F., Steriade, M. Neuronal and glial membrane potentials during sleep and paroxysmal oscillations in the neocortex. J Neurosci. 20 (17), 6648-6665 (2000).
- Amzica, F., Steriade, M. The functional significance of K-complexes. Sleep Med Rev. 6 (2), 139-149 (2002).
- MacVicar, B. A., Feighan, D., Brown, A., Ransom, B. Intrinsic optical signals in the rat optic nerve: role for K(+) uptake via NKCC1 and swelling of astrocytes. Glia. 37 (2), 114-123 (2002).
- Chever, O., Djukic, B., McCarthy, K. D., Amzica, F. Implication of Kir4.1 channel in excess potassium clearance: an in vivo study on anesthetized glial-conditional Kir4.1 knock-out mice. J Neurosci. 30 (47), 15769-15777 (2010).
- Hall, D. G. Ion-selective membrane electrodes: A general limiting treatment of interference effects. J Phys Chem. 100 (17), 7230-7236 (1996).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. R. Double-barreled and Concentric Microelectrodes for Measurement of Extracellular Ion Signals in Brain Tissue. J Vis Exp. (103), e53058(2015).
- Larsen, B. R., MacAulay, N. Kir4.1-mediated spatial buffering of K(+): Experimental challenges in determination of its temporal and quantitative contribution to K(+) clearance in the brain. Channels Austin Tex. 8 (6), 544-550 (2014).
- Mei, L., et al. Long-term in vivo recording of circadian rhythms in brains of freely moving mice. Proceedings of the National Academy of Sciences. 115, 4276-4281 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。