Method Article
Machen, Prüfung und Verwendung von Kalium-Ionen selektive Mikroelektroden im erwachsenen Gehirn Gewebe Scheiben
In diesem Artikel
Zusammenfassung
Kalium-Ionen zur Membran-Ruhepotential der Zellen und extrazellulären K+ -Konzentration ist ein entscheidender Regulator der zellulären Erregbarkeit. Wir beschreiben, wie zu machen, zu kalibrieren und monopolare K+-selektive Mikroelektroden. Mit Hilfe dieser Elektroden ermöglicht die Messung von elektrisch evozierten K+ Konzentration Dynamik in Erwachsene hippocampal Scheiben.
Zusammenfassung
Kalium-Ionen wesentlich dazu beitragen, die Membran-Ruhepotential der Zellen und extrazellulären K+ Konzentration ist daher ein entscheidender Regulator der Erregbarkeit der Zelle. Konzentrationen von extrazellulären K+ beeinflussen die ruhenden Membran potenzielle und zellulären Erregbarkeit durch Verschiebung der Gleichgewichte zwischen geschlossenen, offenen und inaktivierten im Hinblick auf spannungsabhängige Ionenkanäle, die Aktionspotentials zugrunde liegen verändert Initiierung und Leitung. Daher ist es wertvoll, extrazelluläre K+ Dynamik im Gesundheits- und Kranken Staaten direkt zu messen. Hier beschreiben wir, wie zu machen, zu kalibrieren und monopolare K+-selektive Mikroelektroden. Wir ihnen in Erwachsene hippocampal Gehirnscheiben elektrisch evozierten K+ Konzentration Dynamik Messen eingesetzt. Die vernünftige Nutzung von solchen Elektroden ist ein wichtiger Bestandteil der zelluläre und biophysikalische Mechanismen zu bewerten, die extrazelluläre K+ -Konzentrationen im Nervensystem Steuern musste Toolkit.
Einleitung
Kalium-Ionen-Konzentrationen sind fest im Gehirn geregelt, und deren Schwankungen üben einen starken Einfluss auf die Membran-Ruhepotential aller Zellen. Im Hinblick auf diese kritische Beiträge ist ein wichtiges Ziel der Biologie, die zellulären und biophysikalischen Mechanismen zu bestimmen, die verwendet werden, um die Konzentration von K+ fest zu regulieren in den extrazellulären Raum in verschiedenen Organen des Körpers1 , 2. eine wichtige Voraussetzung in diesen Studien ist die Fähigkeit, K+ Konzentrationen genau zu messen. Obwohl viele Komponenten, die zur Kalium Homöostase im Gehirn in gesunden und Kranken Staaten beitragen identifizierten3,4,5, wurden wurde weitere Fortschritte aufgrund der speziellen Art der verlangsamte Messung von Kalium vorbereiten Ionen selektive Mikroelektroden. Mikroelektrode Sensoren sind der Goldstandard für die Messung von K+ -Konzentrationen in Vitro, Gewebe und in Vivo.
Neuere Ansätze zur K+ Überwachung sind in der Entwicklung mit optischen Sensoren, aber diese eine biologisch relevante Bereich von K+ -Konzentrationen nicht erkennen oder nicht wurde komplett in biologischen Systemen, überprüft haben obwohl erste Ergebnisse erscheinen Sie vielversprechend6,7,8. Im Vergleich zu optischen Sensoren, sind Mikroelektroden grundsätzlich beschränkt sich auf eine Punktquelle Messung von Ionen, obwohl Elektroden die räumliche Auflösung9verbessert werden könnte. Dieser Artikel konzentriert sich auf die Einzel-barreled Mikroelektrode Sensoren zur Überwachung der K+ Dynamik.
In dieser Arbeit berichten wir detaillierte schrittweise Verfahren zu K+ selektive Mikroelektroden, mit einer Streptomyceten-basierte Kalium Ionophore, die hochselektiven erlaubt (104 Fach K+ + Na Selektivität) K+ Bewegung über Membranen10. Eine natürlich vorkommende Polypeptid, Streptomyceten fungiert als eine K+ durchlässige Pore und erleichtert den Fluss von K+ hinunter die elektrochemischen Gradienten. Wir beschreiben auch, wie die Elektroden zu kalibrieren wie zu speichern und sie verwenden und schließlich zur Messung der K+ Konzentration Dynamik in akuten hippocampal Hirnschnitten von Erwachsenen Mäusen bereitgestellt. Die Verwendung von solchen Elektroden zusammen mit genetisch veränderten Mäusen, die spezifische Ionenkanäle vorgeschlagen, extrazelluläre K+ Dynamik regulieren fehlt zeigen sollte, die zellulären Mechanismen verwendet durch das Nervensystem, die ambient Konzentration von K zu kontrollieren + in das extrazelluläre Milieu.
Protokoll
Alle Tierversuche wurden durchgeführt in Übereinstimmung mit den nationalen Institut Health Guide für die Pflege und Verwendung von Labortieren und wurden von der Kanzlers Animal Research Committee an der University of California, Los Angeles genehmigt. Alle Mäuse waren mit Futter und Wasser zur Verfügung Ad Libitum in einer 12 h hell-dunkel-Umgebung untergebracht. Alle Tiere waren gesund mit keine offensichtlichen Verhaltensänderungen, nicht in früheren Studien einbezogen wurden und während der lichtzyklus geopfert wurden. Daten für Experimente wurden von Erwachsenen Mäusen (6-8 Wochen alt für alle Experimente) gesammelt.
1. Vorbereitung des selektiven Mikroelektroden K+
- Silanisierung von Borosilikatglas
- Ausreichende Glaskapillaren aus der Verpackung nehmen und in ein 50 mL konische Rohr legen. 1 M HCl. Wash Elektroden mit sanften Agitation in HCl über Nacht oder mindestens 6 Stunden lang konischem Rohr nach oben einfüllen.
- Spülen Sie kurz Kapillaren mit 70 % Ethanol und dann komplett bei 100-120 ° C für 6 bis 8 Stunden trocknen. Gewaschene Kapillaren in Behältern mit wasserfrei Calcium-Sulfat-Trockenmittel für bis zu 4 Wochen vor dem weiteren Gebrauch aufbewahren.
- Ziehen Sie vor der Silanisierung die Kapillaren zu einer feinen Spitze mit einer Mikroelektrode Puller. Die Mikroelektroden, die wir verwenden sind ca. 2 bis 5 Mikrometer im Durchmesser. Handhaben Sie gewaschene Kapillaren mit Handschuhen, als Silanisierung Öle aus der Haut stören können.
- Legen Sie Mikroelektroden in einem Glasbehälter, sodass die Elektroden von der Unterseite zur Spitze Bruch zu verhindern erhöht sind. Befestigen Sie die Mikroelektroden an den Container mit autoklavierbar Band oder ähnliches Klebeband.
- Entfernen Sie etwa 0,5 mL 5 % Dichlorodimethylsilane (DDS) Silanisierung Lösung aus dem Behälter mit der Stickstoff-Ersatz-Methode (siehe Abbildung 2). Füllen Sie einen Ballon mit Stickstoffgas und legen Sie eine Spritze oder Tube und Nadel auf den Ballon. Stechen Sie die Nadel in den DDS-Behälter bei der Erstellung DDS in eine separate Spritze über eine längere Nadel.
- Wenden Sie die Silanisierung Lösung tropfenweise bis in die Spitzen der Pipetten und sofort zu decken. Stellen Sie den Behälter mit Mikroelektroden Silanisierung Lösung in einen vorgewärmten (170-180 ° C) Labor-Ofen für 10-12 Stunden oder bei 200-220 ° C für 30 Minuten
- Nach der Inkubation den Ofen ausschalten und dann die Platte aus dem Ofen nehmen. Seien Sie vorsichtig beim Entfernen der Plattenrandes aus dem Inkubator, da es sehr heiß ist. Legen Sie die Platte auf einer Bank bei Raumtemperatur für 10-15 Minuten die Gläser abkühlen lassen.
- Entfernen Sie die Mikroelektroden aus der Platte (mit einer Rasierklinge oder einem Skalpellklinge Band Abschneiden) und legen Sie sie in einem Trockenmittel gefüllten luftdichten Behälter. Silanisiert Mikroelektroden frei von Feuchtigkeit können bis zu 1 Woche nach der Silanisierung verwendet werden.
- Grundieren die Elektroden
- Bereiten Sie eine Stammlösung K+ Ionophore cocktail: 5 % w/V Streptomyceten, 93 % V/V 1,2-Dimethyl-3-Nitrobenzene, Kalium 2 % w/V tetrakis(4-chlorophenyl) Borat11. Diese Lösung ist eine schwache gelbe Farbe. Unterhalt in einem luftdichten, undurchsichtige Behälter bei Raumtemperatur. Wenn diese Lösung richtig gelagert mehrere Monate dauern kann.
- Bereiten Sie eine Stammlösung von 10 mM HEPES 300 mM NaCl bei pH 7,4 gepuffert. Befestigen Sie die Elektrode in eine Klemme und Abgleich mit der gepufferten NaCl mit einer 28G Microfil Spitze verbunden mit einer Spritze. Beachten Sie, dass die Kochsalzlösung das Ende der Mikroelektrode Spitze erreicht hat. Bestätigen Sie, dass der Mikroelektrode große blasenfrei, die den Stromfluss stören könnten.
- Lösen Sie die Elektrodenspitze mit ca. 10-20 µm breit, mit der stumpfen Seite ein Skalpell oder einer Rasierklinge.
- Tragen Sie mit einer Mikropipette ein kleines Tröpfchen (~0.1 µl) des K+ Ionophore nahe der Spitze der Mikroelektrode. Wenn die Elektrode richtig silanisiert wurde die gebrochene Spitze das Tröpfchen absorbiert. Füllen Sie die Elektrode 1 – 2 mm mit dem K+ Ionophore, und entfernen Sie überschüssiges mittels Tissue-Papier.
2. Kalibrierung des selektiven Mikroelektroden K+
- Vorbereitung der Kalibrierlösungen
- Erarbeiten Sie Lösungen der verschiedenen Konzentrationen von KCl in gleicher Osmolarität künstliche Liquor cerebrospinalis (ACFS) NaCl durch KCl ersetzen. Für die Kalibrierung der Elektroden verwendeten wir 0,1, 1, 10 und 100 mM K+ ACFS, 4.5. Die Rezepte für diese Kalibrierlösungen sind in Tabelle 1aufgeführt.
| Chemische | MW | endgültige mM | 0,1 mM [K +] | 1 mM [K +] | 4,5 mM [K +] | 10 mM [K +] | 100 mM [K +] |
| (g / Mol) | |||||||
| NaCl | 58.44 | variiert | 1,51 g | 1,50 g | 1,44 g | 1,4 g | 0,345 g |
| KCl | 1 M Lager | variiert | 20 µl | 200 µl | 900 µl | 2 ml | 20 ml |
| CaCl2 | 1 M Lager | 2 | 400 µl | ||||
| MgCl2 | 1 M Lager | 1 | 200 µl | ||||
| NaH2PO4 | 119,98 | 1.2 | 0,29 g | ||||
| Nahco33 | 84.01 | 26 | 0,437 g | ||||
| D-Glucose | 180.16 | 10 | 0,360 g | ||||
| Wasser | q.s. 200 ml | ||||||
Tabelle 1. Kalium-Kalibrierlösungen
- Mikroelektrode Kalibrierung
- Bubble-alle Lösungen mit 95 % O25 % CO2 für mindestens 20 Minuten vor Beginn des Experiments. Beginnen, das Bad mit 4,5 mM [K+] Vorrichtung ACFS mit einer Rate von 3 mL pro Minute. Legen Sie die K+ selektivere Elektrode in Elektrodenhalter an der Elektrode Headstage auf dem Manipulator angebracht. Diese Headstage ist an einen entsprechenden Verstärker angeschlossen. Legen Sie die Spitze der Elektrode in Bad Perfusat.
- Sicherstellen der Masseelektrode Ag/AgCl in derselben Lösung getaucht ist und stabil läuft. Gelten Sie Kalibrierlösungen in einer schrittweisen Mode und zeichnen Sie die möglichen Änderungen in mV über die Elektrodenspitze auf. Warten Sie auf das Potential an der Elektrodenspitze, einen stabilen Wert zu erreichen, bevor Sie mit der nächsten Lösung wechseln
- Messen Sie die Steady-State-Spannungsänderung in Reaktion auf die Anwendung der Kalibrierlösungen auf der Elektrodenspitze. Bestätigen Sie, dass die Neigung der Elektrode Antwort mindestens 52 und nicht mehr als 58 mV pro Protokoll Wechsel in [K+].
3. Vorbereitung des akuten Hippocampal Gehirnscheiben
- Vorbereitung der Slice-Lösungen
- Bereiten Sie 500 mL Saccharose schneiden Lösung bestehend aus: 194 mM Saccharose, 30 mM NaCl, 4,5 mM KCl, 10 mM D-Glucose, 1 mM MgCl2, 1,2 mM NaH2PO4, und 26 mM Nahco33, 290-300 mOsm, gesättigt mit 95 % O2 und 5 % CO2.
- Bereiten Sie 1-2 Liter Aufnahmelösung (ACFS) bestehend aus: 124 mM NaCl, 4,5 mM KCl, MgCl21 mM, 10 mM D-Glucose, 2 mM CaCl2, 1,2 mM NaH2PO4und 26 mM Nahco33; pH 7,3-7,4 (nach sprudeln), 290-300 mOsm, gesättigt mit 95 % O2 und 5 % CO2. Füllen Sie einen Becher mit einem Gehirn Scheibe Halter Kammer mit recording-Lösung und halten Sie es bei 32-34 ° C. Füllen Sie die Vibratome Kammer mit Eiswasser Matsch.
- Akuten Slice-Vorbereitung
- Betäuben Sie tief eine Maus indem man es unter einer Glasglocke mit ca. 2-3 mL Isofluran voraufgeladen. Überprüfen Sie Zehe Prise Reflex, und wenn nicht mehr reagiert, schnell enthaupten mit ein paar scharfen Scheren oder Guillotine, da Ihr Tiere Protokoll erfordert.
- Machen Sie einen ca. 2-3 cm Schnitt mit der Schere aus dem kaudalen Teil des Schädels an die Kopfhaut entlang der Mittellinie geschnitten. Während manuell einfahren der Kopfhaut, stellen Sie zwei 1 cm horizontale Einschnitte aus dem Foramen Magnum entlang der Seiten des Schädels. Dann schneiden mit feinen Schere Sie einem Schnitt der Länge des Schädels, entlang der Mittellinie von der Rückseite des Schädels an der Nase.
- Mit feinen Pinzette eingefügt, in der Nähe der Mittellinie, zurückziehen des eingeritzten Schädels in zwei Portionen. Extrahieren Sie das Gehirn der Maus aus dem Schädel zu und verwenden Sie eine Klinge um zu entfernen, das Kleinhirn und der olfaktorischen Lampen, die jeweils an der kaudalen und rostral Teile des Gehirns befinden. Diese können durch die große Risse identifiziert werden, die sie aus dem Kortex trennen.
- Montieren Sie den Gehirn-Block auf der Vibratome Tablett mit super-Klebstoff. Füllen Sie Vibratome Tablett mit eiskalten Cutting-Lösung.
- Schneiden Sie Gewebeschnitte auf der koronalen Ebene bei 300 µm Dicke. In der Regel können 6 koronale hippocampale Scheiben gesammelt werden.
- Nach jedem Schnitt sofort übertragen Sie die Scheiben auf die Scheibe halten Becherglas auf 32-34° c erwärmt Halten Sie die Abschnitte bei dieser Temperatur für 20 min vor dem Entfernen der Becher mit den Abschnitten und stellen Sie diese bei Raumtemperatur mindestens 20-30 Minuten vor der Aufnahme.
4. Messung von elektrisch evozierten K+ Dynamik
- Einrichten der Slice-Vorbereitung
- Legen Sie vorsichtig die Gehirn-Scheibe in der Badewanne mit einer Pasteurpipette und halten Sie ihn sanft mit einem Platin Harfe mit Nylon-Saiten.
- Sicherzustellen, dass die Spitzen der anregenden bipolare Elektrode parallel zueinander und sind mit dem Flugzeug der Scheibe. Langsam, im Laufe von ca. 6-7 Sekunden, legen Sie den Elektroden in CA3 Stratum Radiatum ca. 40-50 µm tief um Schaffer Sicherheiten zu stimulieren. Im koronalen Abschnitte können CA3 etwa als der Teil des Hippocampus richtige Lateral, das Granulat Zellschicht an der hippocampalen Genu mit der Stratum Radiatum fallen mediale und ventralen auf der pyramidalen Zellschicht identifiziert werden.
- Legen Sie die K+-selektiven Elektrode in CA1 Stratum Radiatum ca. 50 µm tief, langsam senken die Elektrode über ca. 3-4 Sekunden. Das Potenzial, über die Elektrode zu stabilisieren, bevor Stimulationen auf die Scheibe zu ermöglichen: Dies dauert in der Regel 5 bis 10 Minuten. Wenn die Scheibe spontane zeigt Veränderungen der extrazellulären K+ dann verwerfen und wiederholen Sie diesen Vorgang mit einer neuen Scheibe.
- Messen Sie evozierten K+ -Freigabe
- Gelten Sie Züge der elektrischen Stimulation (8 Impulse) durch manuell drücken den Auslöser auf der Stimulator während der Aufnahme Digital Antworten. Gelten Sie Stimulation bei 10 Hz und 1 ms Pulsbreite, beginnend bei 10 µA Impuls Amplitude.
- Gelten Sie zunehmende Stimulation Amplituden um einen Faktor von 2, bis eine maximale K+ Antwort Amplitude erkannt wird. Wenn Sie keine Antwort angezeigt werden, verschieben Sie die Position der Elektrode näher K+ Stimulation Standort in Schritten von 100 µm
- Bestimmen Sie die Impuls-Amplitude, die die halbe maximale Reaktion produziert. Nach unserer Erfahrung ist dies zwischen 40-160 µA, je nach Qualität der Vorbereitung, Alter des Tieres und der Abstand zwischen Stimulation Elektroden und selektiven Elektrode K+ .
- In dem gleichen Segment mit einem Impuls-Amplitude am niedriger als die Amplitude, die die halbe maximale Reaktion produziert einen Schritt (z.B. wenn 80 µA eine Hälfte-maximale Reaktion erzeugt, verwenden 40 µA) gelten Reiz Züge der zunehmenden Anzahl von Impulsen. Zunächst haben wir Züge der 1, 2, 4, 8, 16, 32, 64 und 128 Impulse verwendet.
- Um zu bestätigen, dass K+ Signale durch Aktionspotential Abfeuern von elektrisch stimuliert Schaffer Sicherheiten Bad vermittelt werden, gelten Sie 0,5 µM TTX in ACFS für 10 Minuten und wiederholen Sie die Stimulation-Protokoll. Keine evozierten Antworten sollten beachtet werden.
- Nach Beendigung der Slice-Experiment, zu bestätigen, die Elektrode unterhält seine Empfindlichkeit durch neu kalibrieren der Elektrode in die Kalibrierlösungen und Gewährleistung der Reaktion ist nicht um mehr als 10 % von der ersten Kalibrierung abgewichen
Ergebnisse
Für selektive Messung der extrazellulären K+bereiteten wir IONENSELEKTIVE Mikroelektroden beschichtet mit einer hydrophoben Schicht durch Silanisierung sauber Borosilikatglas Pipetten (Abbildung 1A). Diese Beschichtung ermöglicht die K+ -Ionophore mit Streptomyceten zum Ausruhen an der Spitze der Elektrode und erlauben nur K+ Fluss durch eine schmale Öffnung an der Elektrodenspitze (Abbildung 1 b). Nach dem grundieren der Elektroden mit Salzlösung verfüllt und die K+ -Ionophore, werden die Elektroden für ihre schnelle und lineare Reaktion auf schrittweise Änderungen in Bad K+ Konzentrationen (Abbildung 3A) und für ihre Reaktion auf getestet Bad K+ ändert sich im Laufe des Kalibrierung Bereichs (Abb. 3 b) in Kochsalzlösung oder ACFS in gewissem Sinne durch die Nernst-Gleichung2vorhergesagt. Die Änderung in der Steady-State potenzielle kann gegen das Bad K+ Konzentration geplottet werden, um die Steigung der Linie, zu bestimmen, welche ca. 58,2 sein sollte mV pro Protokoll [K+], nach der Nernst-Gleichung und nicht weniger als 52 mV pro Melden Sie sich [K+] (Abbildung 3). Wir zusätzlich die Reaktionsfähigkeit der K+ selektive Elektroden getestet und festgestellt, dass sie zu einer Veränderung 5,5 mM K+ mit Aufstieg und Zerfall Zeitkonstanten von ca. 85 ms (Abbildung 3D,E) reagiert.
Die elektrophysiologische Aufnahme Rigg besteht aus einem standard aufrecht Mikroskop mit einer LCD-Anzeige zur Ermittlung der Platzierung die anregende und Aufnahme Elektroden verbunden. Keine besondere Optik für die visuelle Platzierung der K+ und Stimulation Elektroden erforderlich sind; Wir verwenden ein 5 X oder 10 X-Objektiv und weißes Licht aus einer Halogen-Glühlampe, aber stattdessen eine weiße LED genutzt werden. Die anregende Elektrode ist an den Ausgang eines Isolators Reiz verbunden, depolarisierende über zeitgesteuerte Lieferung von Impulsen aus ein Stimulator oder andere solche Timing-Gerät liefert. Das heißt, liefert der Stimulator Züge von 2 V, 10-20 Hz Timing Impulse zu den Reiz-Isolator. Nach Erhalt dieser Pulse, liefert der Reiz-Isolator dann den gewünschten Strom an die Elektroden Stimulation. Die Aufnahme-Elektrode ist ein Elektrodenhalter, verbunden mit einer Headstage, Verstärker und A/D-Board, die Schnittstelle an einen PC mit elektrophysiologischen Recording-Software (Abb. 4A) verbunden. Nachdem die Elektrode erfolgreich kalibriert, und die akute Scheiben vorbereitet worden, kann die Scheibe in der ACFS Perfusat platziert werden. Förderung der Schaffer Sicherheiten, die K+-selektiven Elektrode befindet sich innerhalb der CA1 Stratum Radiatum und das Feld Stimulationselektrode befindet sich innerhalb der CA3 (Abbildung 4 b).
Sobald die Elektroden und die K+ -Aufnahme eine stabilere Basislinie erreicht hat, dann Impulse aktuelle Amplitude zu erhöhen den Slice angewendet werden können (Abbildung 5, oben). Die Wellenform der diese Aktivität erscheint als ein rasanter Anstieg K+ mit einer exponentiellen Zerfall, die mit TTX Anwendung (Abbildung 5, unten) abgeschafft ist.

Abbildung 1 : Diagramm der Silanisierung Reaktion und K+ selektive Mikroelektrode Architektur. A. schematische Darstellung der Silanisierung Reaktion, die zwischen der exponierten polaren Hydroxyl-Gruppen aus Borosilikat-Glas und der Silanisierung Reagens Dichlorodimethylsilane (DDS) auftritt. Diese Reaktion macht die Glasoberfläche hydrophob, wodurch die K+ -Ionophore, eine dünne Membran zu bilden. B. Darstellung der K+ selektive Mikroelektrode. Die Elektrode ist mit Kochsalzlösung hinterfüllt und die K+ selektive Lösung findet eine 1-2 mm dicke Schicht an der Spitze. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Diagramm der DDS Extraktion. Schematische Darstellung der Stickstoff-Austauschverfahren für DDS-Extraktion aus einem Container. DDS ist flüchtig und brennbaren und kann heftig mit atmosphärischen Gasen reagieren, wenn es in hohen Konzentrationen ist ist es notwendig deshalb, die DDS mit inerte Stickstoff entfernt zu ersetzen. Ein Ballon mit Stickstoff gefüllt ist mit einer Nadel durch eine Spritze oder eine geeignete Schläuche verbunden. Diese Nadel wird durch das Dichtungsmittel auf dem Behältnis, so dass Stickstoff (N2) Gasstrom in den Container eingefügt. Separat, eine Nadel lang (3 bis 10 cm) an eine 1 mL Spritze angeschlossen und in den Container eingefügt. Diese Spritze wird dann verwendet, um DDS, zu extrahieren, während nur Stickstoffgas Container eingeben kann. Bitte klicken Sie hier für eine größere Version dieser Figur.
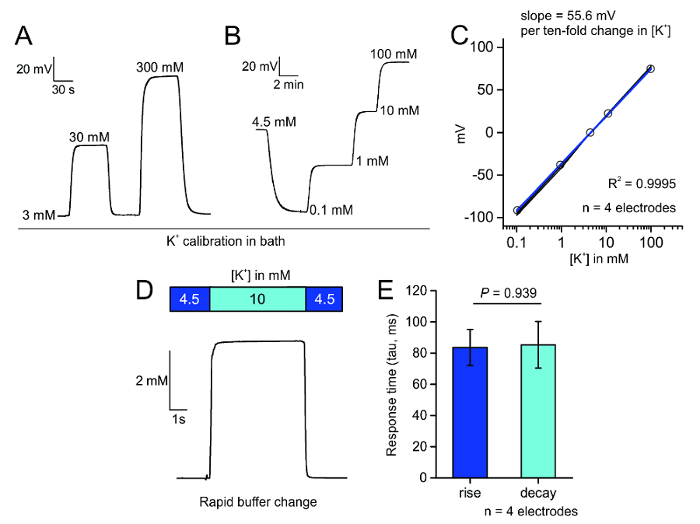
Abbildung 3 : Kalibrierung von Mikroelektroden. A. Bad Perfusion Anwendung der verschiedenen K+ -Konzentrationen in Kochsalzlösung schnell reversibel produzieren und Nernstian Änderungen an das Potenzial über die Elektrodenspitze. B. schrittweise Anwendung von K+ in ACFS evoziert eine charakteristische und stabile Veränderung in der Elektrode Tipp Potenzial. C. Plot der mV Änderung der K+ selektiver Elektrode in Reaktion auf die steigende Konzentrationen von K+ in vier Elektroden; die R-2 ist 0.9995 für diese vier Elektroden. D. Schnell Perfusion System Bad Anwendung von 10 mM K+ bewirkt eine Sprungantwort Spannungsabfall über selektive Elektrodenspitze K+ . E. Plot der gemessenen Reaktion Zeiten (Tau in ms); keinen Unterschied zwischen Aufstieg und Zerfall Zeit erkannt wurde (meine ± SEM, p = 0.939, zwei Probe t-test). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 : Vorrichtung zur extrazellulären K+ -Messung. A. der Elektrophysiologie Rigg besteht aus einem Mikroskop mit eine angeschlossene Kamera und LCD-Display für Slice Visualisierung eine Anti-Vibrationstisch fixiert. Die K+ -Elektrode ist eine Headstage, Verstärker und Analog/digital Board, die auf einem angeschlossenen PC mit elektrophysiologischen Aufnahmesoftware Signalausgänge befestigt. Die Elektrostimulation Elektroden sind an ein Stimulus-Isolator angeschlossen, die Stimulation Amplitude und ein Stimulator für die Zeitmessung Reiz Lieferung variiert. B. Darstellung der Slice-Vorbereitung und den Speicherort der die Platzierung der verschiedenen Elektroden des Segments. CA3 können etwa als der Teil des Hippocampus richtige Lateral, das Granulat Zellschicht an der hippocampalen Genu mit dem Stratum Radiatum fallen auf die pyramidale Zellschicht rostral identifiziert werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
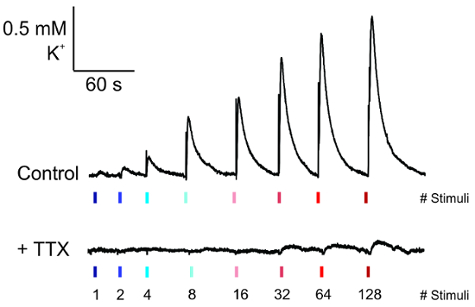
Abbildung 5 : Messung von elektrisch evozierten K+ -Version. Repräsentative Spuren von K+ Entlassung aus der Aufnahme-Elektrode unter basalen Bedingungen (oben) und ihren Verlust auf Antrag des Tetrodotoxin (0,25 µM) für 5 Minuten vor der Aufnahme (unten). Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Die Methode, die wir hier beschreiben konnten wir K+ Dynamik als Reaktion auf die elektrische Stimulation von Schaffer Sicherheiten in akuten hippocampal Scheiben von Erwachsenen Mäusen zu beurteilen. Unsere Methode der Vorbereitung K+ Ion selektiv Mikroelektroden ist ähnlich wie bei den zuvor beschriebenen Verfahren12,13,14,15. Diese Methode hat jedoch Vorteile gegenüber alternativen Elektrode Konfigurationen, dass es sich schnell und unkompliziert, K+ selektive Mikroelektroden vorzubereiten. Nach der entsprechenden Kalibrierung diese Elektroden erwiesen sich als robust K+ Dynamik in Scheiben messen während der elektrischen Stimulation, und solche Reaktionen wurden von TTX blockiert. In diesen Experimenten wurden Stimulationen von 80-160 uA bei 10 Hz verwendet; Optimierung der Stimulation Bedingungen für ein bestimmtes Experiment und ein Bereich des Gehirns von Interesse werden jedoch erforderlich. Diese Werte sind als Leitfaden aufgeführt.
Die Neigung der Antwort der Elektroden sollte 58,2 mV pro Protokoll [K+]. Ein solcher Wert dürfte aus den Nernst und Nicolsky Eisenman Gleichungen für eine selektive semipermeable Membran K+ ; Letzteres macht besser Interaktionen zwischen Ionen16. Wenn die Elektrode nicht in der vorausgesagten Weise reagiert, könnte dies für eine der zwei Hauptgründe. Erstens könnte der Silanisierung unzureichend, wodurch die Membran zu verlorenen oder Salz Brücken zu bilden. Bestätigen Sie, dass die Membran ist durch Beobachtung durch das Mikroskop intakt, es sollte eine klare Schnittstelle zwischen der Pipette-Lösung und die Membran. Ein weiterer Grund könnte Bläschen in die Pipette, die den Stromfluss vom Silberchlorid Draht zu behindern. Wenn Bläschen beobachtet werden, dann entfernen Sie die Pipette und Flick, energisch, um sie zu entfernen. Wenn diese Lösungen nicht, re-make eine andere K+ selektiver Elektrode oder wiederholen Silanisierung für länger oder bei höheren Temperaturen. Es ist jedoch wichtig, diese wichtige Steuerelemente zu wiederholen, jedes Mal, wenn eine neue Gehirnregion studierte oder eine neuen Mikroelektrode getestet.
Zwei spezifische Verstärker wurden in diesen Experimenten verwendet, aber andere Verstärker genutzt werden, solange die Eingangsimpedanz größer oder gleich 500 MΩ ist. Haben kalibriert die Elektroden mit 500 MΩ und 5 GΩ Eingangsimpedanzen, wir fanden, es gab keinen Unterschied in den Hang der Spannung Antwort mit entweder Einstellung über einen Bereich von K+ -Konzentrationen (56,9 ± 0,7 und 56,5 ± 0,9 mV pro Zehnfache Wechsel in [K+ < / C1 >] für 500 MΩ und 5 GΩ Impedanzen, beziehungsweise Eingang; P = 0.759, gepaart t-Test, n = 4 Elektroden).
Wir haben auch schnelle Lösung Schalter, um die Reaktionszeit der Elektroden zu einem bekannten Sprung in [K+] von 4,5 bis 10 mM (Abbildung 3D) zu schätzen. Die Elektroden reagierte mit Anstiegs-und Zerfall (Tau) 85 12 und 85 ± ± 15 ms, beziehungsweise. In diesem Zusammenhang reagieren die Lösung Austausch Kinetik für unsere schnelle Sonderlösung Switcher 85 ± 27 Frau daher war K+ selektive Elektroden mit Kinetik so schnell wie die Lösung-Switcher, die wir angestellt und weit schneller als die Dynamik der K+ Das extrazelluläre Milieu durch Schaffer Sicherheiten Stimulation (Abbildung 5). Diese Daten deuten darauf hin, dass K+ selektive Elektroden verwendet werden können, um die Kinetik der K+ Ansammlung und Freiraum im Gehirngewebe zu schätzen. Jedoch in Zukunft arbeiten entsprechende Kontrollen und Kalibrierungen auf einer Schachtel-durchschachtel Grundlage benötigt werden. Wir vermuten, dass es wertvolle Zeit zu verstehen, die Lösung Austausch Kinetik in Ihrer Aufnahme Kammer zu verbringen.
Wir fanden drei entscheidende Faktoren, die Einfluss auf die Qualität und Robustheit der K+ Messungen in Scheiben. Die erste ist die Qualität der Zubereitung, die Gewebe Gesundheit und das Alter der verwendeten Tiere erscheinen relevant. Für diese Studie haben wir C57/Bl6N Mäuse verwendet, ~ 12 Wochen alt sind. In seltenen Fällen fanden wir Scheiben mit spontanen K+ Fluktuationen in Höhe von ~0.1 mM und 5-10 Sekunden; Diese Scheiben wurden verworfen. Die zweite ist die Qualität der Aufnahme Mikroelektrode. Das primäre Problem ist die Zeit und Temperatur, die für Silanisierung von der Kapillare gezogenem Glas verwendet wird. Wir empfehlen > 170 ° C für mindestens 6 Stunden (bis zu über Nacht akzeptabel ist) oder bei 200 ° C für 30 Minuten. Unzureichende Heizung der Elektroden mit dem Silanisierung Reagenz kann zu Elektroden führen, die keinen Steady-State wegen der allmählichen Verlust der K+ Ionophore potenzielle pflegen. Darüber hinaus Wenn Sie die Elektroden vorbereiten, empfehlen wir eine dünne Schicht (1-2 mm) K+ Ionophore in der Spitze mit einem Durchmesser von 10-20 µm, also in etwa so groß wie eine durchschnittliche Zellkörper (Abbildung 1 b). Brechen nicht übermäßig breit, Tipp oder die K+ selektive Membran Integrität verlieren und die Elektrode schlägt fehl. Dieser Schritt erfordert einige Übung, Tipps für die richtige Größe zu erreichen. K+ selektive Elektroden mit einer zu feinen Spitze oder einer Schicht zu dick können träge Reaktionen, im Vergleich zu ordnungsgemäß angelegten Elektroden haben. Der dritte Faktor ist der Abstand zwischen der Stimulationselektrode und selektiven Elektrode K+ . Wir haben eine Inter Elektrodenabstand von ungefähr 500 µm verwendet, aber den optimalen Abstand kann sehr unterschiedlich mit dem individuellen Hirnareal und müssen sorgfältig geprüft werden, für die besondere Experiment zur hand.
Derzeit gibt es neben der single Barrel-Konfiguration mehrere Methoden zur Herstellung von K+-selektive Mikroelektroden in bipolaren und konzentrische Formate17. Im Vergleich zu den veröffentlichten Beschreibungen dieser Methoden, Einkanal-Elektroden haben zwei wesentliche Nachteile: 1) eine etwas größere Spitzendurchmesser (~ 10 Vs 4 µm), die größere Störung von den Extrazellulärraum bipolar und konzentrischen comparted verursachen könnte Elektroden und 2) Unvereinbarkeit mit gleichzeitige Messung mehrerer ionenspezies wie die bipolaren Elektroden. Die Einkanal-Elektroden bieten jedoch einige Vorteile. Insbesondere diese Elektroden können in weniger als fünf Minuten hergestellt werden und sind daher mehr Einweg gemacht und schnell vor Experimenten kalibriert. Daher ist das Risiko einer Elektrode Bruch während der Kurs-Experimente weniger Anlass zur Sorge. Zusätzlich, da der Masseelektrode und Aufnahme Elektrode durch das Volumen des Bades physisch getrennt sind, gibt es keine Chance für die Bildung von Salz Brücken an der Spitze der Elektrode, die zum Ausfall der Elektrode in konzentrischen und bipolar führen kann Elektroden. Die Reaktionszeit der Elektroden Einkanal ist schneller als bipolare Elektroden und wahrscheinlich vergleichbar mit konzentrischen Elektroden (~ 20 ms), obwohl unser schnelle Perfusion System nur eine Messung der Antwortzeiten in der Größenordnung von 80 ms (Abbildung 3E dürfen ). Darüber hinaus bieten diese Elektroden Geringere Geräuschentwicklung im Vergleich zu bipolaren Elektroden, die Spitze widerstandsfähiger und erfordern den Einsatz von Verstärkern mit höheren Eingangswiderstand. Schließlich erfordern diese Elektroden nicht den Einsatz eines spezialisierten Mikromanipulator oder Headstage wie für konzentrische Elektroden erforderlich ist. Unter dem Strich überwiegen die Vorteile des Baus und Benutzerfreundlichkeit der Elektroden Einkanal die Nachteile.
Der Ansatz, den wir hier verwendet, um K+ Dynamik in Scheiben messen kann in vielen Regionen des Gehirns zur K+ -Verordnung zu studieren. Obwohl dieses Protokoll die Verwendung von K+zeigt-selektive Elektroden für die Messungen der Dynamik von elektrisch evozierten Kalium-Ionen im Gewebe des Gehirns, dieses Protokoll breit einsetzbar in vielen verschiedenen Geweben wo ist es wünschenswert, K+ Dynamik zu messen. Solche Situationen können spontane Dynamik und Veränderungen als Reaktion auf pharmakologische, gehören optogenetische, oder Chemogenetic zelluläre Aktivierung. Diese Mikroelektroden können mit ausreichender Qualität und Zuverlässigkeit, schnelle Integration dieser Technik in jedem Labor Toolbox zulassen erfolgen. Die detaillierten Analysen der K+ -Konzentrationen im Gesundheits- und Kranken Staaten ermöglicht weitere Erkennung und Quantifizierung von wie verschiedenen Molekulare und zelluläre Komponenten zur ruhenden K+ -Konzentrationen im Gehirn3beitragen, 18,19.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Khakh Lab wurde von NIH MH104069 unterstützt. Der Mody Lab wurde von NIH NS030549 unterstützt. J.C.O. Dank der NIH T32 neuronale Mikroschaltungen Training Grant(NS058280).
Materialien
| Name | Company | Catalog Number | Comments |
| Vibratome | DSK | Microslicer Zero 1 | |
| Mouse: C57BL/6NTac inbred mice | Taconic | Stock#B6 | |
| Microscope | Olympus | BX51 | |
| Electrode puller | Sutter | P-97 | |
| Ag/AgCl ground pellet | WPI | EP2 | |
| pCLAMP10.3 | Molecular Devices | n/a | |
| Custom microfil 28G tip | World precision instruments | CMF28G | |
| Tungsten Rod | A-M Systems | 716000 | |
| Bipolar stimulating electrodes | FHC | MX21XEW(T01) | |
| Stimulus isolator | World precision instruments | A365 | |
| Grass S88 Stimulator | Grass Instruments Company | S88 | |
| Borosilicate glass pipettes | World precision instruments | 1B150-4 | |
| A to D board | Digidata 1322A | Axon Instruments | |
| Signal Amplifier | Multiclamp 700A or 700B | Axon Instruments | |
| Headstage | CV-7B Cat 1 | Axon Instruments | |
| Patch computer | Dell | n/a | |
| Sodium Chloride | Sigma | S5886 | |
| Potassium Chloride | Sigma | P3911 | |
| HEPES | Sigma | H3375 | |
| Sodium Bicarbonate | Sigma | S5761 | |
| Sodium Phosphate Monobasic | Sigma | S0751 | |
| D-glucose | Sigma | G7528 | |
| Calcium Chloride | Sigma | 21108 | |
| Magnesium Chloride | Sigma | M8266 | |
| valinomycin | Sigma | V0627-10mg | |
| 1,2-dimethyl-3-nitrobenzene | Sigma | 40870-25ml | |
| Potassium tetrakis (4-chlorophenyl)borate | Sigma | 60591-100mg | |
| 5% dimethyldichlorosilane in heptane | Sigma | 85126-5ml | |
| TTX | Cayman Chemical Company | 14964 | |
| Hydrochloric acid | Sigma | H1758-500mL | |
| Sucrose | Sigma | S9378-5kg | |
| Pipette Micromanipulator | Sutter | MP-285 / ROE-200 / MPC-200 | |
| Objective lens | Olympus | PlanAPO 10xW |
Referenzen
- McDonough, A. A., Youn, J. H. Potassium homeostasis: The knowns, the unknowns, and the health benefits. Physiol Bethesda Md. 32 (2), 100-111 (2017).
- Hille, B. Ion channels of excitable membranes. , Sinauer. Sunderland, MA. 507(2001).
- Kofuji, P., Ceelen, P., Zahs, K. R., Surbeck, L. W., Lester, H. A., Newman, E. A. Genetic inactivation of an inwardly rectifying potassium channel (Kir4.1 subunit) in mice: Phenotypic impact in retina. J Neurosci. 20 (15), 5733-5740 (2000).
- Sibille, J., Dao Duc, K., Holcman, D., Rouach, N. The neuroglial potassium cycle during neurotransmission: role of Kir4.1 channels. PLoS Comput Biol. 11 (3), e1004137(2015).
- Tong, X., et al. Astrocyte Kir4.1 ion channel deficits contribute to neuronal dysfunction in Huntington's disease model mice. Nat Neurosci. 17 (5), 694-703 (2014).
- Datta, D., Sarkar, K., Mukherjee, S., Meshik, X., Stroscio, M. A., Dutta, M. Graphene oxide and DNA aptamer based sub-nanomolar potassium detecting optical nanosensor. Nanotechnology. 28 (32), 325502(2017).
- Bandara, H. M. D., et al. Palladium-Mediated Synthesis of a Near-Infrared Fluorescent K+ Sensor. J Org Chem. 82 (15), 8199-8205 (2017).
- Depauw, A., et al. A highly selective potassium sensor for the detection of potassium in living tissues. Chem Weinh Bergstr Ger. 22 (42), 14902-14911 (2016).
- Machado, R., et al. Biofouling-Resistant Impedimetric Sensor for Array High-Resolution Extracellular Potassium Monitoring in the Brain. Biosensors. 6 (4), (2016).
- Rose, M. C., Henkens, R. W. Stability of sodium and potassium complexes of valinomycin. Biochim Biophys Acta BBA - Gen Subj. 372 (2), 426-435 (1974).
- Ammann, D., Chao, P., Simon, W. Valinomycin-based K+ selective microelectrodes with low electrical membrane resistance. Neurosci Lett. 74 (2), 221-226 (1987).
- Amzica, F., Steriade, M. Neuronal and glial membrane potentials during sleep and paroxysmal oscillations in the neocortex. J Neurosci. 20 (17), 6648-6665 (2000).
- Amzica, F., Steriade, M. The functional significance of K-complexes. Sleep Med Rev. 6 (2), 139-149 (2002).
- MacVicar, B. A., Feighan, D., Brown, A., Ransom, B. Intrinsic optical signals in the rat optic nerve: role for K(+) uptake via NKCC1 and swelling of astrocytes. Glia. 37 (2), 114-123 (2002).
- Chever, O., Djukic, B., McCarthy, K. D., Amzica, F. Implication of Kir4.1 channel in excess potassium clearance: an in vivo study on anesthetized glial-conditional Kir4.1 knock-out mice. J Neurosci. 30 (47), 15769-15777 (2010).
- Hall, D. G. Ion-selective membrane electrodes: A general limiting treatment of interference effects. J Phys Chem. 100 (17), 7230-7236 (1996).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. R. Double-barreled and Concentric Microelectrodes for Measurement of Extracellular Ion Signals in Brain Tissue. J Vis Exp. (103), e53058(2015).
- Larsen, B. R., MacAulay, N. Kir4.1-mediated spatial buffering of K(+): Experimental challenges in determination of its temporal and quantitative contribution to K(+) clearance in the brain. Channels Austin Tex. 8 (6), 544-550 (2014).
- Mei, L., et al. Long-term in vivo recording of circadian rhythms in brains of freely moving mice. Proceedings of the National Academy of Sciences. 115, 4276-4281 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten