Method Article
Fabrication, des essais et à l’aide de microélectrodes sensibles aux ions Potassium dans des tranches de tissu du cerveau adulte
Dans cet article
Résumé
Les ions potassium contribuent au potentiel de repos membranaire des cellules et la concentration extracellulaire de K+ est un régulateur crucial de l’excitabilité cellulaire. Nous décrivons comment faire, calibrer et utiliser monopolaire K+-microélectrodes. L’utilisation de telles électrodes permet la mesure de la dynamique de concentration K+ évoquée électriquement dans des tranches d’hippocampe adultes.
Résumé
Ions potassium considérablement contribuent au potentiel de repos membranaire des cellules et, par conséquent, la concentration extracellulaire de K+ est un régulateur crucial de l’excitabilité cellulaire. Modifié les concentrations extracellulaires K+ affect l’excitabilité de cellulaires et potentiels membranaires au repos en déplaçant les équilibres entre États fermés, ouverts et inactivés pour les canaux ioniques voltage-dépendants qui sous-tendent le potentiel d’action initiation et conduction. Par conséquent, il est utile de mesurer directement extracellulaires K+ dynamique en santé et malades États. Nous décrivons ici, comment faire, calibrer et utiliser monopolaire K+-microélectrodes. Nous avons eux déployé dans des tranches de cerveau hippocampe adulte mesure évoquée électriquement dynamique de concentration K+ . L’utilisation judicieuse de ces électrodes est une partie importante de la trousse d’outils nécessaire à l’évaluation des mécanismes cellulaires et biophysiques qui contrôlent les concentrations extracellulaires de K+ dans le système nerveux.
Introduction
Concentrations d’ions de potassium sont étroitement réglementées dans le cerveau, et leurs fluctuations exercent une influence puissante sur le potentiel membranaire de repos de toutes les cellules. À la lumière de ces contributions critiques, un objectif important de la biologie est de déterminer les mécanismes cellulaires et biophysiques qui servent à bien réguler la concentration de K+ dans l’espace extracellulaire dans les différents organes du corps1 , 2. une exigence importante dans ces études est la possibilité de mesurer avec précision les concentrations de K+ . Bien que de nombreux composants qui contribuent à l’homéostasie de potassium dans le cerveau dans les États sains et malades ont été identifiés3,4,5, encore des progrès a été ralentie en raison de la nature spécialisée du préparation de microélectrodes ion pour la mesure de potassium. Capteurs de la microélectrode représentent l’étalon-or pour la mesure K+ concentrations in vitro, en tranches de tissus et in vivo.
Nouvelles approches pour K+ de surveillance sont en cours d’élaboration à l’aide de capteurs optiques, cependant elles ne détectent pas une concentration de gamme biologiquement pertinente de K+ ou n'ont pas été pleinement vérifiées dans les systèmes biologiques, bien que les premiers résultats semble prometteuse6,7,8. Par rapport aux capteurs optiques, microélectrodes sont fondamentalement limitées à une mesure de source ponctuelle des ions, bien que les rangées d’électrodes susceptibles d’améliorer la résolution spatiale9. Cet article se concentre sur les capteurs de la microélectrode Canon unique pour le suivi dynamique de K+ .
Dans cet ouvrage, les auteurs rapportent des procédures détaillées pas à pas faire K+ microélectrodes, utilisant un ionophore valinomycine-basé de potassium qui permet très sélectif (104 fois K+ à sélectivité Na+ ) K+ mouvement sur membranes10. Un polypeptide d’origine naturelle, valinomycine agit comme un pore de perméabilité K+ et facilite l’écoulement de K+ vers le bas de son gradient électrochimique. On décrit aussi comment calibrer les électrodes, comment stocker et les utiliser et enfin comment déployer afin de mesurer la dynamique de concentration K+ en tranches aiguë hippocampe cerveau de souris adultes. L’utilisation de telles électrodes ainsi que des souris génétiquement modifiées qui n’ont pas les canaux ioniques spécifiques proposés de réglementer extracellulaires K+ dynamique devrait révéler les mécanismes cellulaires utilisés par le système nerveux pour contrôler la concentration ambiante de K + dans le milieu extracellulaire.
Protocole
Toutes les expériences animales ont été effectuées conformément à l’Institut de santé Guide National pour le soin et l’utilisation des animaux de laboratoire et ont été approuvés par le Comité de recherche des animaux du chancelier à l’Université de Californie à Los Angeles. Toutes les souris étaient logés avec la nourriture et l’eau disponible, ad libitum , dans un environnement de lumière-obscurité de 12 h. Tous les animaux étaient en bonne santé sans modification comportementale évidente et n’étaient pas impliqués dans des études antérieures ont été sacrifiés au cours du cycle de lumière. Données pour les expériences ont été prélevées chez la souris adulte (6-8 semaines pour toutes les expériences).
1. préparation des microélectrodes K+
- Silanisation verre borosilicate
- Enlever suffisamment capillaires en verre d’emballage et placer dans un tube conique de 50 mL. Remplir un tube conique à haut avec électrodes lavage HCl 1 M avec agitation modérée dans HCl pendant la nuit ou pendant au moins 6 heures.
- Rincez brièvement capillaires avec l’éthanol à 70 % et puis sécher complètement à 100-120 ° C pendant 6 à 8 heures. Stocker les capillaires lavés dans des récipients avec déshydratant de sulfate de calcium anhydre jusqu'à 4 semaines avant d’utiliser.
- Avant la silanisation, tirez capillaires à une pointe fine à l’aide d’un extracteur de microélectrodes. Des microélectrodes que nous utilisons sont environ de 2 à 5 microns de diamètre. Toujours manipuler les capillaires lavés avec des gants, comme les huiles de la peau peuvent interférer avec la silanisation.
- Placez des microélectrodes dans un récipient en verre pour que les électrodes sont élevés par le bas pour éviter tout bris de pointe. Difficulté des microélectrodes dans le conteneur à l’aide de ruban autoclavable ou similaire de ruban adhésif.
- Retirer environ 0,5 mL de solution de silanisation 5 % dichlorodiméthylsilane (DDS) de son conteneur à l’aide de la méthode de remplacement d’azote (voir Figure 2). Remplir un ballon d’azote gazeux et fixer le tube ou une seringue et une aiguille à l’info-bulle. Insérer l’aiguille dans le conteneur DDS tout en tirant vers le haut de DDS dans une seringue séparée via une aiguille plus longue.
- Appliquer la solution de silanisation goutte à goutte sur le bout des pipettes et couvrir immédiatement. Placer le récipient tenant le microélectrodes avec solution de silanisation dans un four préchauffé de laboratoire (170-180 ° C) pendant 10 à 12 heures, soit à 200-220 ° C pendant 30 minutes
- Après l’incubation, éteindre le four et ensuite retirer la plaque du four. Soyez prudent lorsque vous retirez la plaque de l’incubateur, car il fait très chaud. Placer la plaque sur un banc à température ambiante pendant 10-15 minutes permettre à la verrerie de refroidir.
- Retirer les microélectrodes de la plaque (en utilisant une lame de rasoir ou une lame de bistouri pour couper le ruban) et placez-les dans un contenant hermétique rempli déshydratant. Silanisée microélectrodes exempts d’humidité peuvent être utilisés jusqu'à 1 semaine après silanisation.
- D’amorçage les électrodes
- Préparer une solution de K+ ionophore cocktail : valinomycine de 5 % p/v, 93 % v/v 1, 2-diméthyl-3-nitrobenzène, potassium 2 % w/v tetrakis(4-chlorophenyl) borate11. Cette solution est une couleur jaune pâle. Garder dans un contenant hermétique, opaque à la température ambiante. Si entreposé cette solution peut durer plusieurs mois.
- Préparer une solution de 10 mM HEPES tamponnée 300 mM NaCl à un pH de 7,4. Fixer l’électrode dans une pince et remblayer avec du NaCl dans la mémoire tampon en utilisant un embout de microfil 28G relié à une seringue. Observer que la solution saline a atteint l’extrémité de la microélectrode. Confirmer que la microélectrode est exempte de grosses bulles pouvant gêner la circulation du courant.
- Briser la pointe de l’électrode à environ 10 à 20 µm de largeur, en utilisant le côté émoussé d’un bistouri ou une lame de rasoir.
- À l’aide d’une micropipette, appliquer une petite goutte (~0.1 µl) de l’ionophore K+ près de l’extrémité de la microélectrode. Si l’électrode a été correctement silanisée la goutte est absorbée dans la pointe cassée. Remplissage de l’électrode à 1-2 mm avec l’ionophore K+ et supprimer excès à l’aide de papier de soie.
2. étalonnage des microélectrodes K+
- Préparation des solutions d’étalonnage
- Préparer des solutions de différentes concentrations de KCl dans le liquide céphalorachidien artificiel osmolarité égal (FSCA) en remplaçant le NaCl avec du KCl. Nous avons utilisé 0,1, 1, 4,5, 10 et 100 mM K+ ACSF, pour l’étalonnage des électrodes. Les recettes de ces solutions d’étalonnage sont énumérés au tableau 1.
| Produit chimique | MW | mM final | 0,1 mM [K +] | 1 mM [K +] | 4,5 mM [K +] | 10 mM [K +] | 100 mM [K +] |
| (g / mol) | |||||||
| NaCl | 58.44 | varie | 1,51 g | 1,50 g | 1,44 g | 1.4 g | 0,345 g |
| KCl | Stock de 1 M | varie | 20 µl | 200 µl | 900 µl | 2 ml | 20 ml |
| CaCl2 | Stock de 1 M | 2 | 400 µl | ||||
| MgCl2 | Stock de 1 M | 1 | 200 µl | ||||
| NaH2PO4 | 119.98 | 1.2 | 0,29 g | ||||
| NaHCO3 | 84.01 | 26 | 0,437 g | ||||
| D-Glucose | 180.16 | 10 | g 0,360 | ||||
| Eau | q.s 200 ml | ||||||
Le tableau 1. Solutions d’étalonnage de potassium
- Étalonnage de la microélectrode
- Toutes les solutions avec 95 % O25 % CO2 des bulles pendant au moins 20 minutes avant de commencer l’expérience. Commencer perfusant le bain avec 4,5 mM [K+] FSCA à raison de 3 mL / minute. Placer l’électrode sélective K+ dans porte-électrode, attaché à la tête d’électrode sur le manipulateur. Ce préamplificateur est connecté à un amplificateur approprié. Insérez l’extrémité de l’électrode dans le perfusat de bain.
- S’assurer que l’électrode Ag/AgCl de la terre est baignée dans la même solution et que le flux est constant. Appliquer des solutions d’étalonnage de façon progressive et enregistrer les changements potentiels en mV à travers l’extrémité de l’électrode. Attendez que le potentiel à la pointe de l’électrode atteindre une valeur stable avant de passer à la solution suivante
- Mesurer le changement de tension stabilisées en réponse à la demande des solutions d’étalonnage à la pointe de l’électrode. Confirmer que la pente de la réponse de l’électrode est au moins 52 et ne dépasse pas 58 mV / journal change en [K+].
3. préparation des tranches de cerveau hippocampe aiguë
- Préparation des solutions de tranche
- Préparer le saccharose 500 mL coupe solution composée de : saccharose de 194 mM, 30 mM NaCl, KCl, 10 mM de D-glucose, 1 mM MgCl2à 4,5 mM, 1,2 mM NaH2PO4et 26 mM NaHCO3, 290-300 mOsm, imprégnée de 95 % O2 et de 5 % de CO2.
- Préparer 1 à 2 litres de solution d’enregistrement (FSCA) composés de : 124 mM NaCl, KCl 4,5 mM, 1 mM MgCl2, 10 mM de D-glucose, 2 mM CaCl2, 1,2 mM NaH2PO4et 26 mM NaHCO3; pH 7,3 à 7,4 (après la formation de bulles), 290-300 mOsm, imprégnée de 95 % O2 et de 5 % de CO2. Remplir un bécher contenant une cerveau tranche porte chambre avec la solution d’enregistrement et le maintenir à 32-34 ° C. Remplir la chambre vibratome avec la bouillie de glace-eau.
- Préparation de tranche aiguë
- Profondément anesthésier une souris en le plaçant dans une cloche de verre préchargée avec 2-3 mL isoflurane. Recherchez les réflexe de pincée d’orteil et si non conforme, rapidement décapiter à l’aide d’une paire de ciseaux pointus ou guillotine comme l’exige le protocole de votre animal.
- Faire une incision de 2 à 3 cm à l’aide de ciseaux de la portion caudale du crâne pour couper le cuir chevelu le long de la ligne médiane. Tandis que manuellement rétractant le cuir chevelu, faire deux incisions horizontales 1 cm depuis le trou occipital le long des côtés du crâne. Puis, à l’aide de cisailles fines, coupez une incision la longueur du crâne, le long de la ligne médiane de l’arrière du crâne vers le nez.
- À l’aide de pinces fines insérées près de la ligne médiane, rétracter le crâne incisé en deux tranches. Extraire le cerveau de la souris sur le crâne et utiliser une lame pour enlever le cervelet et les bulbes olfactifs, qui sont respectivement situés dans les parties du cerveau à la caudales et rostrales. Ceux-ci peuvent être identifiés par les grandes fissures, qui les séparent du cortex.
- Montez le bloc de cerveau sur le plateau de vibratome avec de la colle super. Remplissez le plateau vibratome avec solution de découpe glaciale.
- Couper des sections de tissu sur le plan coronal à 300 µm d’épaisseur. Généralement 6 tranches hippocampal coronales peuvent être collectées.
- Après que chaque section est coupée, transférer immédiatement les tranches à la tranche tenant bécher réchauffé à 32-34° C. Conserver les sections à cette température pendant 20 min avant de retirer le bécher contenant les sections et de placer ce à température ambiante pendant au moins 20-30 minutes avant l’enregistrement.
4. mesure de la dynamique évoquées électriquement K+
- Mise en place de la préparation de tranches
- Placez délicatement la tranche de cerveau dans le bain à l’aide d’une pipette Pasteur et maintenez-le enfoncé doucement en place avec une harpe platine avec des cordes en nylon.
- S’assurer que l’extrémité de l’électrode de stimulation bipolaire est parallèles entre eux et est de niveau avec la surface de la tranche. Lentement, au cours des 6-7 secondes, insérez les électrodes CA3 stratum radiatum environ 40-50 µm profonde afin de stimuler les collatérales de Schaffer. Dans les sections coronales, CA3 peut être identifié environ comme la portion du latéral approprié à la couche de cellules de granules à l’hippocampe genu, hippocampe avec stratum radiatum tombant médial et ventrale à la couche de cellules pyramidales.
- Insérez avec précaution le K+-électrode sélective en CA1 stratum radiatum environ 50 µm profonde, en abaissant lentement l’électrode sur environ 3-4 secondes. Laisser la possibilité de se stabiliser dans l’électrode avant d’appliquer les stimulations à la tranche : cela prend habituellement 5 à 10 minutes. Si la tranche présente spontanée changements extracellulaire K+ puis jeter et répétez ce processus pour une nouvelle tranche.
- Mesurer la libération évoquée de K+
- Appliquer les trains de la stimulation électrique (8 impulsions) en appuyant manuellement sur la gâchette sur le stimulateur lors de l’enregistrement numérique des réponses. Appliquer une stimulation à 10 Hz et 1 largeur d’impulsion de ms, commençant à amplitude de stimulation 10 µA.
- Appliquer les amplitudes de stimulation accrue par un facteur de 2 jusqu'à détection d’une amplitude maximale de réponse K+ . Si vous ne voyez pas de réponse, modifie la position de l’électrode K+ plus près du site de stimulation à 100 µm par incréments
- Déterminer l’amplitude de stimulation qui produit la moitié de la réponse maximale. Dans notre expérience, c’est entre 40-160 µA, dépendant de la qualité de la préparation, l’âge de l’animal et la distance entre les électrodes de stimulation et électrode sélective K+ .
- Dans la même tranche, en utilisant une amplitude de stimulation à un peu plus bas que l’amplitude qui produit la moitié de la réponse maximale (par exemple si 80 µA produit une réponse maximale, utilisez 40 µA) s’appliquent à des trains de stimuli de plus en plus nombre d’impulsions. Au départ, nous avons utilisé des trains d’impulsions de 1, 2, 4, 8, 16, 32, 64 et 128.
- Pour confirmer que K+ signaux sont médiés par des tirs de potentiel d’action de la baignoire de collatérales de Schaffer stimulée électriquement, appliquer 0,5 µM TTX dans FSCA pendant 10 minutes et répéter le protocole de stimulation. Aucune réponses évoquées ne doivent être observées.
- Après avoir terminé l’expérience de la tranche, confirmer l’électrode a maintenu sa réceptivité par re-calibrer l’électrode dans les solutions d’étalonnage et d’assurer la réponse n’a pas dévié de plus de 10 % par rapport à l’étalonnage initial
Résultats
Pour la mesure sélective d’extracellulaire K+, nous avons préparé des microélectrodes recouverts d’une couche hydrophobe par silanisation des pipettes de verre borosilicaté propre (Figure 1 a). Ce revêtement permet l’ionophore K+ contenant la valinomycine pour se reposer à l’extrémité de l’électrode et permettent seulement K+ flux à travers une ouverture étroite à la pointe de l’électrode (Figure 1 b). Après amorçage les électrodes avec la solution saline remblayé et l’ionophore K+ , les électrodes peuvent être testés pour leur réaction rapide et linéaire à l’évolution progressive de concentrations K+ de bain (Figure 3 a) et leur réponse au bain K+ change au fil de la gamme d’étalonnage (Figure 3 b) dans une solution saline ou fsca de manière prédites par l' équation de Nernst2. Le changement dans l’état d’équilibre possible peut être tracé contre la baignoire K+ concentration afin de déterminer la pente de la droite, qui devrait être environ de 58,2 mV par log [K+], selon l’équation de Nernst et pas moins de 52 mV par log [K+] (Figure 3). Nous avons en outre testé la réactivité des électrodes sélectives K+ et trouvé qu’ils ont répondu à un changement de 5,5 mM de K+ avec des constantes de temps de montée et de la dégradation d’environ 85 ms (Figure 3D,E As EventArgs).
La plate-forme d’enregistrement électrophysiologique comprend un microscope droit standard connecté à un écran LCD permettant d’identifier l’emplacement de la stimuler et électrodes d’enregistrement. Aucune optique spéciale ne sont nécessaires pour placer des visuels de la K+ et les électrodes de stimulation ; Nous utilisons un 5 x ou 10 x objectif et la lumière blanche d’une ampoule halogène, mais une LED blanche pourrait être utilisée à la place. L’électrode de stimulation est connectée à la sortie d’un isolateur stimulus, qui délivre dépolarisant actuel via la livraison temporisée d’impulsions d’un stimulateur ou autre tel appareil de chronométrage. En d’autres termes, le stimulateur offre des trains de 2 V, 10-20 Hz impulsions à l’isolateur stimulus. Après avoir reçu ces impulsions, l’isolateur stimulus, puis remet le courant désiré pour les électrodes de stimulation. L’électrode d’enregistrement est connecté à un porte-électrode, reliée à un préamplificateur, amplificateur et A/D Conseil d’administration, qui s’interfacent avec un PC avec un logiciel d’enregistrement électrophysiologique (Figure 4 a). Une fois l’électrode a été correctement étalonné et les tranches aiguës ont été préparés, la tranche peut être placée dans le perfusat fsca. Pour stimuler les collatérales de Schaffer, le K+-électrode sélective est placé dans le stratum radiatum CA1 et l’électrode de stimulation de champ est placé dans la région CA3 (Figure 4 b).
Une fois que les électrodes ont été placées et l’enregistrement de K+ a atteint un niveau de référence stable, puis impulsions d’augmenter l’amplitude du courant peuvent être appliquées à la tranche (Figure 5, haut). La forme d’onde de cette activité apparaît comme une augmentation rapide K+ avec un taux de décroissance exponentielle, ce qui est aboli avec application TTX (Figure 5, en bas).

Figure 1 : Diagramme de silanisation réaction et l’architecture de la microélectrode sélective K+ . A. représentation schématique de silanisation réaction qui se produit entre les groupes hydroxyles polaires exposées du verre borosilicate et la silanisation réactif dichlorodiméthylsilane (DDS). Cette réaction rend la surface du verre hydrophobe, permettant l’ionophore K+ former une fine membrane. B. schéma de la microélectrode sélective K+ . L’électrode est remblayé avec du sérum physiologique et la solution sélective K+ est place dans une couche épaisse de 1 à 2 mm à l’extrémité. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Schéma d’extraction DDS. Représentation schématique de la procédure de remplacement d’azote pour l’extraction de DDS dans un conteneur. DDS est volatil et inflammable et peut réagir violemment avec les gaz atmosphériques, lorsqu’il est en concentration élevée donc qu'il est nécessaire de remplacer la DDS enlevée à l’azote inerte. Un ballon rempli d’azote est relié à une aiguille via une seringue ou un tube approprié. Cette aiguille est insérée à travers le mastic sur le conteneur permettant le débit de gaz (N2) d’azote dans le récipient. Séparément, une aiguille longue (3-10 cm) est reliée à une seringue de 1 mL et insérée dans le conteneur. Cette seringue est ensuite utilisée pour extraire les DDS, tandis que seulement l’azote gazeux peut entrer dans le conteneur. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
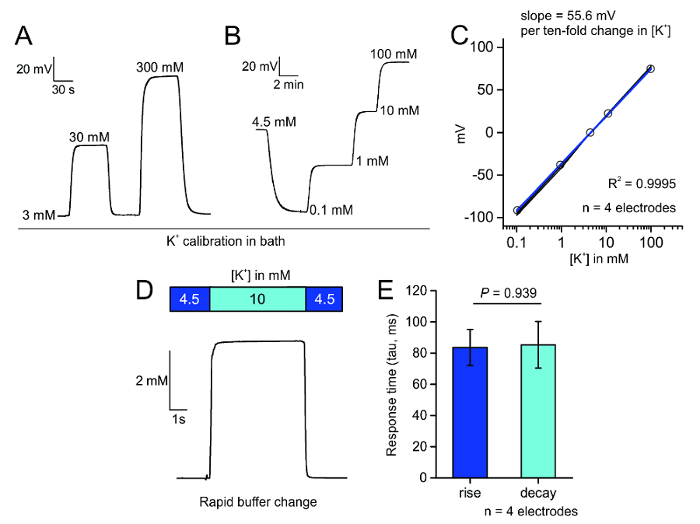
Figure 3 : Étalonnage des microélectrodes. A. demande perfusion bain de différentes concentrations de K+ dans une solution saline peut rapidement et de façon réversible produire nernstienne changements du potentiel à travers l’extrémité de l’électrode. B. application par étapes de K+ dans FSCA évoque un changement caractéristique et stable dans le potentiel de pointe d’électrode. C. terrain de la modification de mV de l’électrode sélective K+ en réponse à l’augmentation des concentrations de K+ quatre électrodes ; le R2 est 0.9995 pour ces quatre électrodes. D. Perfusion rapide système bain application de 10 mM K+ provoque une réponse indicielle de tension à travers l’extrémité d’une électrode sélective K+ . E. le terrain de la réponse mesurée fois (tau en ms) ; aucune différence entre les temps de montée et de la désintégration a été détectée (moyenne ± SEM, p = 0,939, deux sample t-test). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Appareil de mesure de K+ extracellulaire. A. la plate‑forme d’électrophysiologie se compose d’un microscope fixé sur une table antivibratoire avec une caméra attachée et affichage à cristaux liquides pour la visualisation de la tranche. L’électrode K+ est fixé à un préamplificateur et amplificateur analogique/numérique Conseil qui émet le signal à un PC relié avec un logiciel d’enregistrement électrophysiologique. Les électrodes de stimulation électrique sont raccordés à un isolateur stimulus qui varie l’amplitude de stimulation et un stimulateur pour la livraison de stimulus de chronométrage. B. schéma de la préparation de la tranche et la localisation du placement des électrodes diverses à la tranche. Ca3 peut être approximativement identifié comme la partie du latéral approprié à la couche de cellules de granules à l’hippocampe genu, hippocampe avec stratum radiatum tombant rostrale à la couche de cellules pyramidales. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
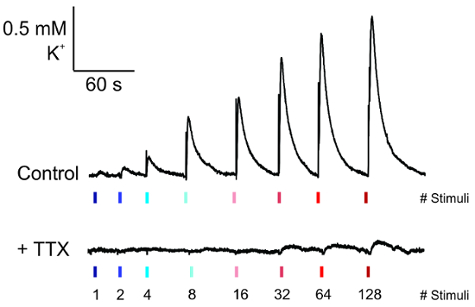
Figure 5 : Mesure de la libération évoquée électriquement de K+ . Des traces représentatives de K+ dégage de l’électrode d’enregistrement dans des conditions basales (haut) ou leur perte à la demande de la tétrodotoxine (0,25 µM) pendant 5 minutes avant l’enregistrement (en bas). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
La méthode que nous décrivons ici nous a permis d’évaluer la dynamique K+ en réponse à une stimulation électrique des collatérales de Schaffer dans des tranches d’hippocampe aiguës de souris adultes. Notre méthode de préparation des microélectrodes ion K+ est semblable au plus tôt des procédures décrites12,13,14,15. Toutefois, cette méthode présente des avantages sur les configurations alternatives électrode car il est rapide et simple à préparer des microélectrodes K+ . Après un étalonnage approprié, ces électrodes se sont avérées pour robuste mesure K+ dynamique en tranches au cours de la stimulation électrique, et de telles réactions ont été bloquées par la TTX. Dans ces expériences, les stimulations de 80-160 uA à 10 Hz ont été utilisées ; Cependant, optimisation des conditions de stimulation pour une expérience particulière et pour une zone du cerveau d’intérêt sera nécessaire. Ces valeurs sont répertoriées comme guide.
La pente de la réponse des électrodes doit être 58,2 mV par log [K+]. Une telle valeur est prédite à partir des équations de Nernst et Nicolsky-Eisenman pour une membrane semi-perméable sélective de K+ ; ce dernier représente mieux les interactions entre les ions16. Si l’électrode ne réagit pas de la manière prévue, cela pourrait être pour l’une des deux raisons principales. Tout d’abord la silanisation pourrait être insuffisante, provoquant la membrane d’être perdus ou sels de ponts pour former. Confirmer que la membrane est intacte par l’observation au microscope, il devrait y avoir une interface claire entre la solution de la pipette et la membrane. Une autre raison, pourrait être la présence de bulles dans la pipette qui entravent la circulation du courant du fil du chlorure d’argent. Si on observe des bulles, puis retirez la pipette et flick vigoureusement pour les supprimer. Si ces solutions ne parviennent pas, refaire une autre électrode sélective K+ ou répéter silanisation pour plus ou à des températures élevées. Cependant, il est important de répéter ces contrôles clés chaque fois qu’une nouvelle région du cerveau est étudiée ou une microélectrode nouveau est mis à l’essai.
Deux amplificateurs spécifiques ont été utilisées dans ces expériences, mais les autres amplificateurs pouvaient être utilisés aussi longtemps que l’impédance d’entrée est supérieure ou égale à 500 MΩ. Après avoir étalonné les électrodes avec MΩ 500 et 5 les impédances d’entrée GΩ, nous avons trouvé il n’y avait aucun différence dans la pente de la réponse de tension avec deux paramètres sur une gamme de K+ des concentrations (56,9 ± 0,7 et 56,5 ± 0,9 mV / change dix fois dans [K+ < / C1 >] pour 500 MΩ et 5 GΩ d’entrée à des impédances, respectivement ; P = 0,759, jumelé t-essai, n = 4 électrodes).
Nous avons aussi utilisé des commutateurs de solution rapide pour estimer le temps de réponse des électrodes à un saut connu dans [K+] de 4,5 à 10 mM (Figure 3D). Les électrodes ont répondu avec des temps de montée et de la décomposition (tau) 85 ± 12 et 85 ± 15 ms, respectivement. A cet égard, la cinétique d’échange solution pour notre sélecteur de solution rapide personnalisée a été 85 Mme ± 27 C’est pourquoi, les électrodes sélectives K+ répondent avec une cinétique aussi vite que le sélecteur de solution, que nous avons utilisé et bien plus rapide que la dynamique de K+ le milieu extracellulaire par suite de la stimulation collatéral de Schaffer (Figure 5). Ces données suggèrent que les électrodes sélectives K+ peuvent être utilisés pour estimer la cinétique d’accumulation de K+ et de dégagement dans le tissu cérébral. Toutefois, à l’avenir travailler les contrôles appropriés et étalonnages seront nécessaires sur une base de cas-par-cas. Nous suggérons qu’il est utile de passer du temps à comprendre la solution exchange cinétiques dans votre chambre d’enregistrement.
Nous avons trouvé trois facteurs d’une importance critique qui influent sur la qualité et la robustesse des mesures K+ en tranches. Le premier est la qualité de la préparation, tant la santé des tissus et l’âge des animaux utilisés semblent pertinentes. Pour cette étude, nous avons utilisé des souris C57/Bl6N qui ont environ 12 semaines. En de rares occasions, nous avons trouvé des tranches avec des fluctuations spontanées K+ s’élevant à ~0.1 mM et d’une durée de 5 à 10 secondes ; ces tranches ont été rejetées. La deuxième est la qualité de la microélectrode d’enregistrement. Le principal problème est le temps et la température qui est utilisée pour la silanisation du verre tiré capillaire. Nous vous recommandons > 170 ° C pendant au moins 6 heures (jusqu'à une nuit est acceptable) ou à 200 ° C pendant 30 minutes. Chauffage insuffisant des électrodes avec le réactif de silanisation peut conduire à des électrodes qui ne maintiennent pas un état d’équilibre possibles à cause de la perte progressive de l’ionophore K+ . En outre, lors de la préparation des électrodes, nous recommandons de placer une fine couche (1-2 mm) de l’ionophore K+ à l’extrémité d’un diamètre de 10 à 20 µm, soit à environ la taille d’un corps de cellule moyenne (Figure 1 b). Ne pas casser la pointe trop large, ou la membrane sélective K+ va perdre l’intégrité et l’électrode échouera. Cette étape peut nécessiter peu de pratique pour obtenir des conseils de la bonne taille. Électrodes sélectives K+ avec une pointe trop fine ou trop épaisse d’une couche peuvent avoir des réponses atone, par rapport aux électrodes correctement construits. Le troisième facteur est la distance entre l’électrode de stimulation et de l’électrode sélective K+ . Nous avons utilisé une distance inter électrode d’environ 500 µm, toutefois la distance optimale peut varier considérablement avec la zone du cerveau individuel et devra être soigneusement examinée pour l’expérience particulière à portée de main.
En plus de la configuration à Canon unique, il y a actuellement plusieurs procédés de fabrication K+-microélectrodes dans bipolaire et concentriques formats17. Par rapport aux descriptions publiées de ces méthodes, monocanal électrodes ont deux principaux inconvénients : 1) un diamètre de pointe légèrement plus grand (~ 10 vs 4 µm), qui pourrait provoquer une plus grande perturbation de l’espace extracellulaire qu’à bipolaire et concentrique électrodes et 2) incompatibilité avec la mesure simultanée de plusieurs espèces ioniques comme les électrodes bipolaires. Toutefois, les électrodes monocanal offrent plusieurs avantages. Plus précisément, ces électrodes peuvent être fabriquées en moins de cinq minutes et sont par conséquent plus jetables et puissent être réalisés et calibré rapidement avant les expériences. Par conséquent, le risque de bris de l’électrode au cours des expériences de cours est moins préoccupants. En outre, parce que l’électrode de masse et les électrodes d’enregistrement sont physiquement séparées par le volume de la baignoire, il n’y a aucune chance pour que la formation de ponts Salins à l’extrémité de l’électrode, ce qui peut conduire à l’échec d’électrode en concentrique et bipolaire électrodes. Le temps de réponse des électrodes monocanal est plus rapide que les électrodes bipolaires et probables comparable à concentriques électrodes (environ 20 ms), bien que notre système de perfusion rapide permise seulement une mesure de temps de réponse sur l’ordre de 80 ms (Figure 3E ). En outre, ces électrodes offrent moins de bruit par rapport aux électrodes bipolaires, qui ont une plus grande résistance à la pointe et nécessitent l’utilisation d’amplificateurs avec une plus grande résistance d’entrée. Enfin, ces électrodes ne nécessitent pas l’utilisation d’un micromanipulateur spécialisé ou un préamplificateur que celle exigée pour les électrodes concentriques. Dans l’ensemble, les avantages de la construction et la facilité d’utilisation d’électrodes monocanal l’emportent sur les inconvénients.
L’approche que nous avons utilisé ici pour mesurer la dynamique K+ en tranches dans de nombreuses régions du cerveau permet d’étudier la régulation K+ . Bien que ce protocole illustre l’utilisation de K+-électrodes sélectives pour les mesures de la dynamique des ions de potassium évoquées électriquement dans les tissus du cerveau, ce protocole peut être largement utilisé dans de nombreux tissus différents où il est souhaitable de mesurer la dynamique K+ . Ces situations peuvent inclure dynamique spontanée et modifications en réponse à pharmacologique, optogenetic, ou chemogenetic activation cellulaire. Ces microélectrodes peuvent être faits avec une qualité et une fiabilité suffisantes de manière à permettre une intégration rapide de cette technique dans toute boîte à outils de laboratoire. Les analyses détaillées des concentrations K+ en santé et malades États permettra encore détection et quantification de la façon dont les différents composants moléculaires et cellulaires contribuent au repos K+ concentrations dans le cerveau de3, 18,19.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Le laboratoire Khakh était soutenu par le NIH MH104069. Le laboratoire Mody était soutenu par le NIH NS030549. J.C.O. Merci le NIH T32 Neural Microcircuits formation Grant(NS058280).
matériels
| Name | Company | Catalog Number | Comments |
| Vibratome | DSK | Microslicer Zero 1 | |
| Mouse: C57BL/6NTac inbred mice | Taconic | Stock#B6 | |
| Microscope | Olympus | BX51 | |
| Electrode puller | Sutter | P-97 | |
| Ag/AgCl ground pellet | WPI | EP2 | |
| pCLAMP10.3 | Molecular Devices | n/a | |
| Custom microfil 28G tip | World precision instruments | CMF28G | |
| Tungsten Rod | A-M Systems | 716000 | |
| Bipolar stimulating electrodes | FHC | MX21XEW(T01) | |
| Stimulus isolator | World precision instruments | A365 | |
| Grass S88 Stimulator | Grass Instruments Company | S88 | |
| Borosilicate glass pipettes | World precision instruments | 1B150-4 | |
| A to D board | Digidata 1322A | Axon Instruments | |
| Signal Amplifier | Multiclamp 700A or 700B | Axon Instruments | |
| Headstage | CV-7B Cat 1 | Axon Instruments | |
| Patch computer | Dell | n/a | |
| Sodium Chloride | Sigma | S5886 | |
| Potassium Chloride | Sigma | P3911 | |
| HEPES | Sigma | H3375 | |
| Sodium Bicarbonate | Sigma | S5761 | |
| Sodium Phosphate Monobasic | Sigma | S0751 | |
| D-glucose | Sigma | G7528 | |
| Calcium Chloride | Sigma | 21108 | |
| Magnesium Chloride | Sigma | M8266 | |
| valinomycin | Sigma | V0627-10mg | |
| 1,2-dimethyl-3-nitrobenzene | Sigma | 40870-25ml | |
| Potassium tetrakis (4-chlorophenyl)borate | Sigma | 60591-100mg | |
| 5% dimethyldichlorosilane in heptane | Sigma | 85126-5ml | |
| TTX | Cayman Chemical Company | 14964 | |
| Hydrochloric acid | Sigma | H1758-500mL | |
| Sucrose | Sigma | S9378-5kg | |
| Pipette Micromanipulator | Sutter | MP-285 / ROE-200 / MPC-200 | |
| Objective lens | Olympus | PlanAPO 10xW |
Références
- McDonough, A. A., Youn, J. H. Potassium homeostasis: The knowns, the unknowns, and the health benefits. Physiol Bethesda Md. 32 (2), 100-111 (2017).
- Hille, B. Ion channels of excitable membranes. , Sinauer. Sunderland, MA. 507(2001).
- Kofuji, P., Ceelen, P., Zahs, K. R., Surbeck, L. W., Lester, H. A., Newman, E. A. Genetic inactivation of an inwardly rectifying potassium channel (Kir4.1 subunit) in mice: Phenotypic impact in retina. J Neurosci. 20 (15), 5733-5740 (2000).
- Sibille, J., Dao Duc, K., Holcman, D., Rouach, N. The neuroglial potassium cycle during neurotransmission: role of Kir4.1 channels. PLoS Comput Biol. 11 (3), e1004137(2015).
- Tong, X., et al. Astrocyte Kir4.1 ion channel deficits contribute to neuronal dysfunction in Huntington's disease model mice. Nat Neurosci. 17 (5), 694-703 (2014).
- Datta, D., Sarkar, K., Mukherjee, S., Meshik, X., Stroscio, M. A., Dutta, M. Graphene oxide and DNA aptamer based sub-nanomolar potassium detecting optical nanosensor. Nanotechnology. 28 (32), 325502(2017).
- Bandara, H. M. D., et al. Palladium-Mediated Synthesis of a Near-Infrared Fluorescent K+ Sensor. J Org Chem. 82 (15), 8199-8205 (2017).
- Depauw, A., et al. A highly selective potassium sensor for the detection of potassium in living tissues. Chem Weinh Bergstr Ger. 22 (42), 14902-14911 (2016).
- Machado, R., et al. Biofouling-Resistant Impedimetric Sensor for Array High-Resolution Extracellular Potassium Monitoring in the Brain. Biosensors. 6 (4), (2016).
- Rose, M. C., Henkens, R. W. Stability of sodium and potassium complexes of valinomycin. Biochim Biophys Acta BBA - Gen Subj. 372 (2), 426-435 (1974).
- Ammann, D., Chao, P., Simon, W. Valinomycin-based K+ selective microelectrodes with low electrical membrane resistance. Neurosci Lett. 74 (2), 221-226 (1987).
- Amzica, F., Steriade, M. Neuronal and glial membrane potentials during sleep and paroxysmal oscillations in the neocortex. J Neurosci. 20 (17), 6648-6665 (2000).
- Amzica, F., Steriade, M. The functional significance of K-complexes. Sleep Med Rev. 6 (2), 139-149 (2002).
- MacVicar, B. A., Feighan, D., Brown, A., Ransom, B. Intrinsic optical signals in the rat optic nerve: role for K(+) uptake via NKCC1 and swelling of astrocytes. Glia. 37 (2), 114-123 (2002).
- Chever, O., Djukic, B., McCarthy, K. D., Amzica, F. Implication of Kir4.1 channel in excess potassium clearance: an in vivo study on anesthetized glial-conditional Kir4.1 knock-out mice. J Neurosci. 30 (47), 15769-15777 (2010).
- Hall, D. G. Ion-selective membrane electrodes: A general limiting treatment of interference effects. J Phys Chem. 100 (17), 7230-7236 (1996).
- Haack, N., Durry, S., Kafitz, K. W., Chesler, M., Rose, C. R. Double-barreled and Concentric Microelectrodes for Measurement of Extracellular Ion Signals in Brain Tissue. J Vis Exp. (103), e53058(2015).
- Larsen, B. R., MacAulay, N. Kir4.1-mediated spatial buffering of K(+): Experimental challenges in determination of its temporal and quantitative contribution to K(+) clearance in the brain. Channels Austin Tex. 8 (6), 544-550 (2014).
- Mei, L., et al. Long-term in vivo recording of circadian rhythms in brains of freely moving mice. Proceedings of the National Academy of Sciences. 115, 4276-4281 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon