Method Article
Formazione di Biofilm indotta da sali biliari in patogeni enterici: tecniche di identificazione e quantificazione
In questo articolo
Riepilogo
Questo protocollo permette al lettore di analizzare la formazione di biofilm indotta da sali biliari in patogeni enterici usando un approccio sfaccettato per catturare la natura dinamica del biofilm batterici valutando l'aderenza, formazione di matrice extracellulare sostanza polimerica, e dispersione.
Abstract
Formazione di biofilm è un processo dinamico, multistadio che avviene nei batteri in condizioni ambientali difficili o periodi di stress. Per gli agenti patogeni enterici, una risposta di stress significativo è indotta durante il transito gastrointestinale e all'esposizione di bile, un normale componente di digestione umana. Per superare gli effetti battericidi di bile, molti agenti patogeni enterici formano un biofilm supposto per consentire la sopravvivenza durante il transito attraverso l'intestino tenue. Qui presentiamo metodologie per definire la formazione di biofilm tramite analisi di fase solida adesione così come rilevamento di matrice extracellulare sostanza polimerica (EPS) e la visualizzazione. Inoltre, valutazione di dispersione di biofilm è presentato per imitare l'analisi degli eventi provoca il rilascio di batteri durante il processo di infezione. Colorazione viola di cristallo viene utilizzato per rilevare batteri aderenti in un'analisi di aderenza ad alta velocità piastra a 96 pozzetti. Valutazione di produzione di EPS è determinato da due saggi, vale a dire la microscopia macchiatura della EPS matrice e analisi semi-quantitativa con una lectina legante il polisaccaride coniugato fluorescente. Infine, dispersione di biofilm è misurata attraverso Colonia conteggi e placcatura. Dati positivi da saggi multipli supportano la caratterizzazione di biofilm e possono essere utilizzati per identificare la formazione di biofilm indotta da sali biliari in altri ceppi batterici.
Introduzione
Formazione di biofilm è una strategia di sopravvivenza batterica importante indotta durante condizioni ambientali difficili. L'esposizione ai composti battericide come antibiotici o cambiamenti di sostanza nutriente o disponibilità di ossigeno induce uno stato sollecitato nei batteri che possono essere alleviati attraverso la formazione di biofilm. Un biofilm è caratterizzato da batterica allegato ad una superficie o altri batteri ed è accompagnato dalla secrezione di una matrice EPS composta principalmente da polisaccaridi1,2,3. Formazione di biofilm è un processo dinamico, in cui una cascata di eventi culmina nella formazione di una comunità batterica aderente matura1,2,3. I batteri producono adesine per facilitare il collegamento iniziale mentre spostando adesina profili di espressione genica per rafforzare allegato durante la maturazione del biofilm. Simultaneamente, produzione di EPS avviene a cappotto della comunità batterica in una matrice a proteggere le cellule dal fattore di sforzo iniziale. I batteri contenuti all'interno del biofilm sono a crescita lenta; e come tale, rende la maggior parte degli antibiotici inefficaci. Inoltre, la lenta crescita conserva l'energia fino a quando le condizioni cambiano per favorire la crescita batterica1,2,3. Dopo aver passato le dure condizioni, batteri disperdono il biofilm e riprendere un stile di vita planctonico1,2,3. Tradizionalmente, i biofilm sono osservati sulle superfici e rappresentano una sfida clinica persistente a causa di serbatoi di infezione presente su cateteri e dispositivi di in-abitazione1,2,3.
Formazione di biofilm recentemente è stato descritto per parecchi agenti patogeni enterici; batteri che infettano il piccolo intestino o del colon4. Per specie Shigella , l'infezione si verifica nel colon umano dopo un transito attraverso la maggior parte del tratto gastrointestinale. Durante il passaggio attraverso l'intestino tenue, Shigella è esposto alla bile; un detergente del lipido-degradanti secernuto nell'intestino per facilitare la digestione dei lipidi mentre simultaneamente uccidendo la maggior parte dei batteri5. Patogeni enterici hanno una capacità unica di resistere agli effetti battericidi di bile6. La nostra analisi recenti utilizzati in vivo-come combinazioni di glucosio e sali biliari per dimostrare la formazione di biofilm robusto in S. flexneri , nonché altre specie di Shigella, patogeni di Escherichia colie Salmonella4. In precedenza, serovar di Salmonella enterica Typhi è stato indicato per formano un biofilm indotta da bile a causa di colonizzazione unico della cistifellea durante l'infezione cronica7,8,9, 10. Inoltre, previa ricerca con Vibrio11e Campylobacter12 ha dimostrato la formazione di biofilm in risposta alla bile. Di conseguenza, le analisi estese le osservazioni di formazione di biofilm bile-indotta di altri agenti patogeni e contribuiscono a stabilire la dimostrazione di una risposta di agente patogeno enterico conservata alla bile. A differenza di biofilm cronico in cui trascrizione genica batterica è limitato e senescenza cellulare può verificarsi1,2,3, proponiamo che il biofilm enterico bile-indotta è più di natura transitorio. Questo transitorio, virulento biofilm è caratterizzato da un rapido smontaggio (come visto nell'analisi della dispersione) e ha migliorato l'espressione di gene di virulenza osservato in biofilm popolazione4,6.
Come formazione di biofilm è un processo dinamico e poliedrico e l'uso dei sali di bile come un fattore d'inizio è stato solo recentemente descritto per patogeni enterici più, gli strumenti e le tecniche utilizzate sono applicazioni uniche e creative dei metodi tradizionali. Così, qui presentati sono gratuite tre strategie per quantificare le diverse caratteristiche importanti della formazione di biofilm indotta da sali biliari, inclusa l'adesione batterica, produzione della matrice EPS e dispersione di batteri vitali dal biofilm. Queste tecniche sono state utilizzate principalmente per la ricerca con Shigella; e pertanto, la valutazione di altri patogeni enterici può richiedere ottimizzazione. Tuttavia, dati positivi da tutti i tre saggi supportano l'identificazione del biofilm e stabilire protocolli riproducibile per la formazione di biofilm indotta da sali biliari.
Protocollo
1. preparazione dei reagenti
- Sali biliari medio: per preparare il brodo di soia triptico (TSB) contenente sali biliari 0,4% (peso/volume), risospendere 200 mg di sali biliari in 50 mL di TSB in autoclave. Filtro sterilizzare usando un filtro da 0,22 µm. Fare fresco medio settimanale.
Note: I sali biliari ordinariamente utilizzati è una miscela di 1:1 di sodio colato e sodio desossicolato isolato dalle cistifellea ovine e bovina. Come dimostrato in precedenza4, la presenza di glucosio è stato richiesta per la formazione di biofilm indotta da sali biliari. TSB ha aggiunto glucosio rispetto al brodo di Luria-Bertani (LB); e quindi, era sufficiente per indurre la formazione di biofilm in Shigella e gli agenti patogeni enterici analizzati. A seconda i batteri per essere analizzati, le concentrazioni differenti di glucosio o zucchero diversi requisiti potrebbero essere necessario. - 0,5 viola di cristallo % p/v in acqua: sciogliere 2,5 g di cristalvioletto in 500 mL di acqua distillata. Filtro sterilizzare usando un filtro da 0,22 µm.
- Concanavalina A (ConA) coniugata con isotiocianato di fluorescina (FITC): ricostituire lo stock in PBS 1X. Diluire il brodo 10 mg concentrato con 400 μL di PBS 1X a una concentrazione finale di 25 µ g/mL e proteggerlo dalla luce.
- PBS + glucosio: Sciogliere 0,2 g di glucosio in 10 mL di PBS 1X (finale del glucosio di 2% w/v). Filtro sterilizzare usando un filtro da 0,22 µm. Fanno fresco il giorno di utilizzo.
- PBS + sali biliari: Sciogliere 40 mg in 10 mL di PBS 1X (0,4% w/v i sali biliari finali). Filtro sterilizzare usando un filtro da 0,22 µm. Fanno fresco il giorno di utilizzo.
- PBS + glucosio e sali biliari: sciogliere sali biliari 40mg e 0,2 g di glucosio in 10 mL di PBS 1X (2% w/v glucosio finale e sali biliari di 0,4% w/v). Filtro sterilizzare usando un filtro da 0,22 µm. Fanno fresco il giorno di utilizzo.
- Preparare piatti agar della libbra.
- Correzione di formaldeide/glutaraldeide: 810 aggiungere µ l formaldeide (soluzione di riserva del 37%, 3% concentrazione finale) e 125 glutaraldeide µ l (soluzione di riserva del 25%, 0,25% concentrazione finale) a 14 mL di PBS 1X. Mescolare accuratamente e conservare a 4 ° C. La correzione dovrebbe essere fredda per un uso corretto.
Attenzione: La correzione è tossica e richiede lo smaltimento di rifiuti pericolosi. - Montante Antifade soluzione: utilizzare il montante antifade soluzione contenente 4,6-diamidino-2-phenylindole (DAPI) macchia per inibizione di photobleaching di campioni immunofluorescente microscopia fluorescente macchiando il DNA dei batteri.
2. preparazione di batteri
- Crescere una notte colture di ceppi batterici per essere testata inoculando 3 mL di TSB con una colonia singola, ben isolata in un tubo di coltura sterile. Incubare a 37 ° C con agitazione a 225 giri/min per incubazione overnight (16-24 h).
Nota: Ceppi dovrebbero essere restreaked dalle scorte congelatore ogni 2 a 4 settimane e mantenuto su piastre non più di 2 settimane di vita.
3. fase solida aderenza Assay
Nota: Questo test quantifica aderenti batteri utilizzando un metodo di piastra a 96 pozzetti. I batteri sono coltivati in modo statico nelle piastre di fondo piatto. Lavaggio viene eseguito per rimuovere i batteri non aderente e batteri aderenti sono macchiati con la viola di cristallo. La macchia viola di cristallo lega peptidoglicano nella parete cellulare batterica e possa essere solubilizzata utilizzando etanolo. Il numero di batteri aderenti è determinato basato sulla conservazione di cristallo viola.
- Impostare due provette da 1,5 mL. Etichetta con TSB o TSB + sali biliari (BS).
- Aggiungere 1 mL di TSB o TSB + BS nelle rispettive provette.
- Inoculare i tubi con 20 µ l della coltura durante la notte (presso un 01:50 diluizione).
- In una piastra a 96 pozzetti sterile, chiara, fondo piatto, coltura del tessuto-trattati, aggiungere 130 µ l/pozzetto di mezzi di controllo non inoculato a tre pozzetti da utilizzare come il controllo in bianco. Impostare tre pozzetti di controllo per ogni tipo di supporto (TSB e TSB + BS) per essere testato.
- Aggiungere 130 µ l/pozzetto di coltura inoculata in tre pozzi e ripetere fino a quando tutte le condizioni sperimentali sono placcate in triplice copia.
- Incubare per 4-24 h a 37 ° C in modo statico.
- Utilizzando un lettore di piastra, registrare il OD600. Impostare i pozzetti di controllo come 'vuoto'. Confermare che il mezzo di controllo è chiaro senza prova di torbidità. Se viene rilevato qualsiasi torbidità, scartare l'esperimento. I valori di600 OD possono essere utilizzati per normalizzare i dati, se ci sono differenze significative nel tasso di crescita tra ceppi batterici.
- Rimuovere il terreno di coltura utilizzando una linea del vuoto delicatamente inclinando la piastra e aspirando lentamente il mezzo al bordo più basso del pozzo. Essere sicuri di raccogliere tutto il terreno di coltura senza interrompere la popolazione batterica aderente situata sulla superficie di plastica. Se la matrice EPS è stato prodotto durante il periodo di incubazione, la matrice verrà visualizzata come un precipitato bianco. Non disturbare la matrice EPS.
- Lavare delicatamente i pozzetti una volta con 200 µ l di PBS sterile. Rimuovere il lavaggio con PBS utilizzando la linea del vuoto.
- Capovolgere la piastra ad asciugare. Consentire un minimo di 20 minuti ad asciugare.
Nota: Poiché i biofilm deve essere completamente asciutto prima della colorazione, il protocollo può essere sospesa a questo punto per un paio d'ore o anche durante la notte. Il tempo di asciugatura aggiunto non modificherà la procedura di colorazione mentre essiccazione incompleta influenzerà la quantificazione dei risultati e riproducibilità. - Aggiungere 150 µ l di cristalvioletto 0,5% per ogni sperimentale e controllo bene.
- Incubare per 5 min a temperatura ambiente (TA).
- Lavare i pozzetti una volta con 400 µ l di acqua distillata. Il volume aggiunto aiuta a rimuovere residui cristalvioletto macchia dai lati dei pozzi. Rimuovere il lavaggio con la linea del vuoto.
- Lavare i pozzetti 5 volte con 200 µ l di acqua distillata. Rimuovere il lavaggio con la linea del vuoto.
Nota: Lavaggio accurato è importante per la quantificazione. Quando i pozzetti del bianco sono chiaro dall'acqua distillata e non contengono alcun residuo cristalvioletto macchia, procedere al passaggio successivo. - Capovolgere la piastra a secco, al riparo dalla luce. Garantire la completa asciugatura della piastra come indicato in precedenza.
- Decolorare i pozzetti con 200 µ l di etanolo al 95%. Incubare la piastra sull'agitatore per 30 min. Per evitare l'evaporazione, specialmente alle più alte temperature, eseguire questo passaggio a 4 ° C.
- Utilizzando un lettore di piastra, registrare il OD540.
Nota: La lunghezza d'onda per assorbanza massima della viola di cristallo è vicino a 590 nm. La letteratura segnala una gamma da OD540 - OD5954,13,14,15,16 per assorbanza viola di cristallo; così scegliere una lunghezza d'onda disponibile basata su lettore della piastra.
4. EPS Matrix Detection
Nota: Questi saggi gratuiti quantificare e visualizzare l'EPS. In entrambi, EPS viene rilevata utilizzando una lectina associare polisaccaridi. La proteina fluorescente coniugati permette di quantificazione (punto 4.1) o visualizzazione (punto 4.2).
- Determinazione semi-quantitativa del EPS
- Impostare due provette da 1,5 mL. Etichetta con TSB o TSB + BS.
- Aggiungere 1 mL di TSB o TSB + BS nelle rispettive provette.
- Inoculare i tubi con 20 µ l della coltura durante la notte (un 01:50 diluizione).
- In una piastra a 96 pozzetti sterile, nera, fondo piatto, coltura del tessuto-trattati, aggiungere 130 µ l/pozzetto di mezzi di controllo non inoculato a tre pozzetti da utilizzare come il controllo in bianco. Impostare tre pozzetti di controllo per ogni tipo di supporto essere testato. Aggiungere 130 µ l/pozzetto di coltura inoculata nei pozzetti e ripetere fino a quando tutte le condizioni sperimentali sono placcate in triplice copia.
- Incubare per 4-24 h a 37 ° C in modo statico.
- Trasferire il terreno di coltura per una piastra a 96 pozzetti chiaro con una pipetta, idealmente una pipetta multicanale. Prestare attenzione a raccogliere tutto il terreno di coltura senza interrompere la popolazione aderente e/o l'EPS si trova sulla superficie di plastica. Mettere da parte.
- Fissare la piastra nera per 15 min a RT utilizzando 200 µ l/pozzetto di formaldeide/glutaraldeide in 1X PBS.
- Mentre la popolazione aderente è fissa, valutare il surnatante dal punto 4.1.6. Utilizzando un lettore di piastra, registrare il OD600. Impostare i pozzetti di controllo come 'vuoto'. Confermare che il mezzo di controllo è chiaro senza prova di torbidità. Se viene rilevato qualsiasi torbidità, scartare l'esperimento.
- In alternativa, il dosaggio intero può essere effettuato in un piatto fondo chiaro nero. Ciò premesso, i valori di600 OD possono essere registrati e il terreno di coltura può essere successivamente scartato prima di procedere al passo 4.1.7. I valori di600 OD possono essere utilizzati per normalizzare i dati nel caso non ci sono differenze significative nel tasso di crescita fra ceppi batterici.
- La correzione di rimuovere e smaltire nei rifiuti pericolosi.
- Lavare delicatamente i pozzetti due volte con 200 µ l/pozzetto di PBS sterile. Rimuovere il lavaggio con PBS utilizzando la linea del vuoto delicatamente inclinando la piastra e aspirando lentamente il lavaggio al bordo più basso del pozzo.
- Aggiungere 150 µ l/pozzetto di 25 µ g/mL ConA-FITC e incubare per 15 minuti a TA.
- Lavare delicatamente due volte con 200 µ l di PBS.
- Aggiungere 150 µ l di PBS in ciascun pozzetto. Registrare la fluorescenza a 488 nm.
- Visualizzazione di microscopia confocale della produzione di EPS e calcolo dello spessore del biofilm
- Impostare due provette da 1,5 mL. Etichetta con TSB o TSB + BS.
- Aggiungere 1 mL di TSB o TSB + BS nelle rispettive provette.
- Inoculare i tubi con 20 µ l della coltura durante la notte (presso un 01:50 diluizione).
- Impostare una piastra a 24 pozzetti sterile con 12 mm sterili round vetrini coprioggetti. Aggiungere 400 µ l/pozzetto di mezzi di controllo non inoculato a tre pozzetti da utilizzare come il controllo in bianco. Impostare tre pozzetti di controllo per ogni tipo di supporto essere testato.
- Aggiungere 400 µ l della coltura inoculata a pozzetti in duplicato e ripetere fino a quando tutte le condizioni sperimentali sono placcate.
- Incubare per 4-24 h a 37 ° C in modo statico.
- Non confermare visivamente crescita nella condizione TSB, crescita ed EPS precipitato (bianco) nel TSB + condizione BS e nessuna crescita e/o precipitato bianco nei pozzetti di controllo sterile. Rimuovere i sovranatante.
- Difficoltà per 15 min a RT utilizzando 200 µ l/pozzetto di soluzione di formaldeide/glutaraldeide in 1X PBS.
- Rimuovere la correzione e lo smaltimento dei rifiuti pericolosi.
- Lavare delicatamente i pozzetti due volte con 200 µ l/pozzetto di PBS sterile. Rimuovere il lavaggio con PBS utilizzando la linea del vuoto.
- Aggiungere 150 µ l/pozzetto di 25 µ g/mL ConA-FITC e incubare per 15 minuti a TA.
- Lavare delicatamente due volte con 200 µ l/pozzetto di PBS.
- Montare con montante antifade soluzione con DAPI.
Nota: La soluzione è una soluzione di montaggio Ready-Made, basati su glicerolo contenenti DAPI per preservare l'etichetta fluorescente mentre simultaneamente macchiando il DNA nelle cellule batteriche per la visualizzazione come un colorante di contrasto. Seguire le indicazioni e le raccomandazioni del kit per tempi di incubazione prima campioni di imaging. La procedura di colorazione DAPI può essere eseguita prima di applicare la soluzione antifade mountant non contenente DAPI. - Valutare mediante microscopia confocale. Su un microscopio confocale, impostare il laser nm/519 eccitazione 495 nm/emissione per visualizzazione FITC. Impostare un secondo laser 360 nm/460 nm eccitazione/emissione di visualizzare DAPI. Individuare il biofilm focalizzando l'attenzione sul canale DAPI. Utilizzare canali DAPI sia FITC per determinare lo spessore completo e impostare superiore e inferiore di imaging confini. Registrare immagini di spessore completo dello stack Z catturando immagini ogni 0,25 µm dopo avere impostato i perimetri di parte superiore e inferiore dello z-stack. Per ulteriori informazioni su microscopia confocal, fare riferimento alle pubblicazioni di Paddock et al. 17 , 18 , 19 , 20
- Ricostruire le immagini 3D in ImageJ (https://imagej.nih.gov/ij/) per visualizzare la formazione di biofilm completo e calcolare lo spessore del biofilm. Lo spessore medio ottenuto per S. flexneri sale biliare indotto biofilm era 14 µm4.
5. la dispersione Assay
Nota: In questa analisi, lo smontaggio del biofilm attraverso dispersione batterica viene rilevato. Qui, i biofilm maturi sono stabiliti e successivamente (solitamente il giorno successivo), i media vengono sostituiti con PBS o completati PBS. Il surnatante componente è poi valutato per quantificare il numero di batteri che hanno dissociato dal biofilm.
- Impostare due provette da 1,5 mL. Etichetta con TSB o TSB + BS.
- Aggiungere 1 mL di TSB o TSB + BS nelle rispettive provette.
- Inoculare i tubi con 20 µ l della coltura durante la notte (presso un 01:50 diluizione).
- In una piastra a 96 pozzetti sterile, chiara, fondo piatto, coltura del tessuto-trattati, aggiungere 130 µ l/pozzetto di mezzi di controllo non inoculato a tre pozzetti da utilizzare come il controllo in bianco. Impostare tre pozzetti di controllo per ogni tipo di supporto per essere testato.
- Aggiungere 130 µ l/pozzetto di coltura inoculata tre pozzi e ripetere fino a quando tutte le condizioni sperimentali sono placcate in triplice copia.
- Incubare la piastra per 4-24 h a 37 ° C in modo statico.
- Prima di continuare, caldo PBS, PBS + glucosio, PBS + sali biliari e PBS + sali biliari + glucosio a 37 ° C. Preparare questi quotidiano fresco di reagenti.
- Utilizzando un lettore di piastra, registrare il OD600. Impostare i pozzetti di controllo come 'vuoto'. Confermare che il mezzo è chiaro senza prova di torbidità. Se viene rilevato qualsiasi torbidità, scartare l'esperimento. I valori di600 OD possono essere utilizzati per normalizzare i dati, se ci sono differenze significative nel tasso di crescita tra ceppi batterici.
- Rimuovere il terreno di coltura utilizzando una linea del vuoto. Essere sicuri di raccogliere tutto il terreno di coltura senza interrompere la popolazione aderente situata sulla superficie di plastica.
- Lavare delicatamente i pozzetti due volte con 200 µ l/pozzetto di PBS sterile. Rimuovere il lavaggio con PBS utilizzando la linea del vuoto.
- Sostituire il lavaggio con 130 µ l/pozzetto di in tre pozzi ogni quanto segue: PBS, PBS + glucosio, PBS + sali biliari e PBS + sali biliari + glucosio. Questi reagenti devono essere pre-riscaldati a 37 ° C.
- Incubare la piastra per 30 min a 37 ° C.
- Rimuovere delicatamente la piastra dall'incubatore 37 ° C. Trasferire i surnatanti di una piastra a 96 pozzetti sterile, fresca.
- Utilizzando un blocco di piastra o diluizione di 96 pozzetti, preparare 10 volte (01:10) diluizioni seriali del surnatante in PBS sterile.
Nota: La serie di diluizione dovrebbero variare da non diluito a 10-6 a seconda del ceppo batterico per essere testato. Esperimenti pilota possono essere eseguiti per determinare l'intervallo di diluizione ottimale. - Posto tavola 5 µ l di ciascuna diluizione su LB agar usando una pipetta multicanale. Incubare a 37 ° C durante la notte. Contare le colonie sul conto per il fattore di diluizione e di giorno successivo quando si determina il recupero unità formanti colonia (UFC). Per calcolare la dispersione percentuale rispetto la 1 x controllo PBS (impostato al 100%), dividere il recupero CFU da ciascuna condizione di trattamento di recupero CFU dal campione di controllo di PBS 1X.
Nota: Piastre di media di Routine per il ceppo batterico di interesse possono anche essere utilizzati. Ad esempio, Shigella può essere placcato sulle piastre di colore rosso di Congo. Assicurarsi che le piastre siano asciutte per tecniche appropriate di posto-placcatura.
Risultati
In Figura 1, formazione del biofilm è indotto nella maggior parte della crescita seguente testata sei patogeni enterici in media che contengono i sali biliari. Un aumento significativo nei batteri aderenti dopo esposizione di sali biliari è osservata in quasi tutti i ceppi testati. L'eccezione è ed Escherichia coli (CEEA); si noti, tuttavia, l'osservazione indotta del Δaaf mutante4. I risultati indicano che meccanismi di adesione aggiuntivi sono indotto tramite l'esposizione di sali biliari in CEEA in assenza di fimbrie aggregative aderenza ho (AAF / ho)21. Per trarre conclusioni da questo set di dati, i valori di540 OD per ogni tipo di sforzo e media di trama testato. Confrontando i valori da ogni sforzo nel controllo media (-BS) rispetto al media contenente sali biliari determinerà se sali biliari inducono significativamente la formazione di biofilm. I confronti tra ceppi batterici e/o mutanti possono essere eseguiti anche per ulteriori analisi di caratterizzazione.
La valutazione di ConA-FITC di EPS è presentata nella Figura 2. Figura 2A rappresenta la valutazione semi-quantitativa della produzione di EPS in cui ConA-FITC è usato per macchiare il biofilm. La ConA si lega ai polisaccaridi nella matrice EPS e l'importo trattenuto viene rilevata da un lettore di piastra fluorescente. Per presentare i dati, le unità di fluorescenza media per ogni condizione di terreno e confrontare le condizioni che inducono biofilm al controllo negativo. Inoltre, confronto tra ceppi batterici o mutanti può essere eseguito. È fondamentale per analizzare un controllo negativo di sola media per determinare la quantità di fluorescenza di ConA-FITC che si verifica per la piastra di fondo. La condizione TSB non era significativamente differente dal controllo media, mentre la fluorescenza letture significativamente aumentato seguente sali biliari l'esposizione. I dati confermano che la produzione di EPS è indicativo della formazione di biofilm e non si verifica in assenza di sali biliari per S. flexneri. Le immagini di biofilm indotta da sali biliari in S. flexneri è rappresentato in Figura 2B. ConA-FITC è usato per macchiare polisaccaridi nella matrice EPS mentre un colorante di contrasto DAPI è usata per prevedere i batteri macchiando il DNA. Per i batteri non esposti a sali biliari (controllo negativo), viene rilevato solo DAPI. In particolare, la densità dei batteri è molto inferiore nella condizione di sali biliari. Uno sfondo chiaro sul canale FITC è ottenuto per indicare la mancanza di produzione di EPS. Come previsto, i dati dimostrano che la produzione di EPS è correlato con sali biliari esposizione seguente biofilm formazione1,2,3 . La ConA - macchiatura controllo nei campioni trattati con sali biliari è fornita per illustrare la specificità della fluorescenza della FITC. Per queste immagini, 1x PBS è stato usato al posto di ConA-FITC e il colorante di contrasto DAPI è stata mantenuta. La formazione immagine può essere eseguita con un microscopio confocale per valutare lo spessore del biofilm con l'EPS-positivi campioni4.
Dispersione batterica da biofilm nella Figura 3 viene rilevata dal biofilm incubazione stabilito in PBS o completati PBS. Fisiologicamente, bile viene riassorbita in circolazione nel piccolo intestino e solo il 5% della bile entra il colon5. Come Shigella invade l'epitelio colico, supponiamo che riassorbimento della bile è un segnale importante per la dispersione di biofilm. In questa figura, la dispersione si verifica nei biofilm esposti a PBS o PBS + glucosio; Tuttavia, la dispersione è inibita in PBS + sali biliari indipendentemente dalla presenza di glucosio. I dati dimostrano che la rimozione di sali biliari è necessaria e sufficiente per indurre la dispersione di S. flexneri da biofilm indotta da sali biliari4. Per tracciare i dati, possono essere tracciata i CFU recuperati dei batteri o la percentuale relativa al controllo (come illustrato di seguito).
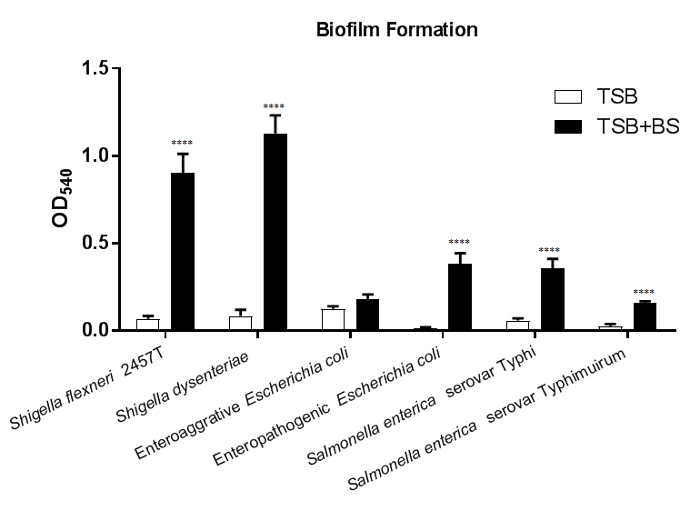
Figura 1: sali biliari indurre la formazione di biofilm in patogeni enterici. 18h biofilm sono stati coltivati in piastre da 96 pozzetti coltura di tessuti trattata in sia TSB o TSB + 0,4% sali biliari media e macchiato con cristalvioletto di 0,5%. I valori quantitativi da solubilizzazione di etanolo della macchia viola di cristallo sono stati determinati mediante spettrofotometria a OD540. Sali biliari esposizione significativamente aumentata formazione di biofilm in Shigella flexneri, S. dysenteriae, enteropatogeni Escherichia coli, Salmonella enterica serovar Typhi e S. enterica sierotipo Typhimurium. Significatività statistica è stata determinata T-test dello studente per ogni ceppo confrontando il trattamento di sali biliari per il controllo di media. L'errore standard della media (SEM) è rappresentato da barre di errore. Tutti i p-valori sono < 0,0001. I dati indicati sono da uno (n = 3) rappresentanza esperimento, con un set completo di dati forniti in una precedente pubblicazione4. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: formazione del biofilm indotta da sali biliari è caratterizzato dalla produzione di una matrice EPS che è rilevata con FITC-labeled concanavalina A. (A) Sterile nero, piastra a 96 pozzetti sono state seminate con S. flexneri ad un 01:50 diluizione in TSB o TSB + sali biliari e cresciuto per 18 h. biofilm sono stati fissati, delicatamente lavato e colorati con ConA-FITC. L'importo di ritenuta Concanavalin-A FITC è stato determinato da un lettore di piastra fluorescente. I valori tracciati dimostrano quantificazione EPS seguendo la crescita di s. flexneri coltivate in TSB o TSB-contenente sali biliari. Importanza è stata determinata da One-way ANOVA e p -valori sono < 0.01. Il SEM è rappresentato da barre di errore. I dati indicati sono da uno (n = 3) rappresentanza esperimento, con un set completo di dati forniti in una precedente pubblicazione4. (B) microscopia immagini da un biofilm di Shigella indotta da sali biliari. Vetrini coprioggetto sterili sono state seminate con S. flexneri ad un 01:50 diluizione in TSB o TSB + sali biliari e coltivati per 18 h. Lamelle sono stati successivamente fissate e macchiate con ConA-FITC e/o il controcolorati con DAPI. ConA-FITC è stato rilevato solo la condizione di sali biliari a causa della presenza della matrice EPS. Un vetrino coprioggetti colorato solo con DAPI nel TSB + trattamento di sali biliari è stato utilizzato per dimostrare la fluorescenza di fondo minimo per l'impostazione di FITC il microscopio confocale. Immagini per ogni canale di lunghezza d'onda e una sovrapposizione di composito sono forniti per tutte le condizioni di trattamento. Barre della scala indicano 10 µm. dati mostrati sono da uno (n = 3) rappresentanza esperimento, con un set completo di dati forniti in una precedente pubblicazione4. Clicca qui per visualizzare una versione più grande di questa figura.
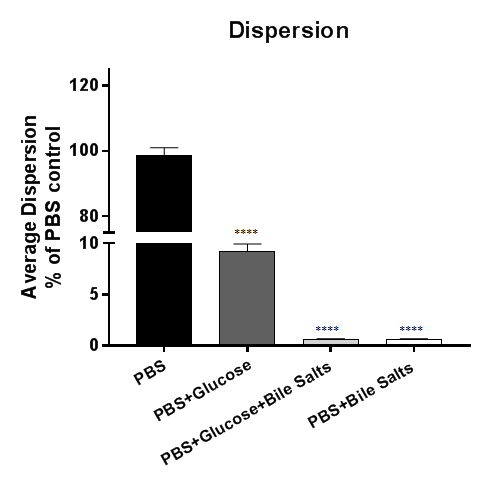
Figura 3: analisi di dispersione batterica da biofilm indotta da sali biliari. 18 h indotta da sali biliari Shigella flexneri biofilm sono stati esposti a PBS o PBS completati con glucosio, sali biliari o una combinazione di glucosio e sali biliari. Il surnatante è stato successivamente in serie diluito e placcato su piastre di agar per enumerare le unità (CFUs) che disperdono il biofilm di formazione di colonie. Il numero di batteri recuperato era tracciato rispetto al controllo di PBS. I batteri dispersero dal biofilm nel PBS o PBS + glucosio condizioni, ma la presenza di sali biliari è stata sufficiente per inibire la dispersione batterica dal biofilm. I dati indicati sono da uno (n = 3) rappresentanza esperimento, con un set completo di dati forniti in una precedente pubblicazione4. Per riferimento, 100 volte più batteri ordinariamente sono stati recuperati dal trattamento di controllo PBS (circa 7 x 107 CFU) rispetto alla PBS + trattamento di sali biliari (circa 7 x 105 CFU). Importanza è stata determinata da One-way ANOVA e p -valori sono < 0,0001. Il SEM è rappresentato da barre di errore.
Discussione
Analisi della formazione di biofilm è impegnativo a causa della natura dinamica del biofilm e la variabilità tra i ceppi, materiali, laboratori e le analisi. Qui, diverse strategie sono presentate per determinare la formazione di biofilm in patogeni enterici dopo esposizione di sali biliari con intuizione sperimentale fornito per promuovere la riproducibilità. Ci sono considerazioni aggiuntive per garantire la riproducibilità. Innanzitutto, si consiglia di eseguire almeno tre indipendenti esperimenti ciascuno con triplici copie tecniche di confermare osservazioni e significatività statistica a causa delle variazioni che possono verificarsi. In secondo luogo, l'uso di controlli positivi e negativi è fondamentale per garantire la riproducibilità del test. Si consiglia di utilizzare il ceppo di tipo selvaggio come controllo positivo durante la valutazione di mutanti per la formazione di biofilm. Inoltre, come sono identificati geni che sono importanti per la formazione di biofilm (Vedi ad esempio Vibrio22, Salmonella7ed e. coli23,24,25), l'uso di mutanti di biofilm come controlli negativi convaliderà la riproducibilità del dosaggio. In terzo luogo, i metodi di cui sopra si basano sulla ricerca mirata con Shigella e S. flexneri, in particolare. Regolazioni dei protocolli possono essere richieste a seconda delle esigenze di crescita di ogni agente patogeno enterico valutati. In quarto luogo, i saggi misurano una risposta di sforzo batterico; e pertanto, è fondamentale per lavorare con i batteri in modo appropriato tenuti dagli stock congelati (-80 ° C) o piastre di deposito conservati in frigorifero (massimo 4 ° C) per non più di due settimane. È importante notare che alcuni batteri, tra cui gli agenti patogeni enterici in genere Yersinia sono psychrotrophs che può crescere a temperature prossime a 0 ° C26. Poiché la conservazione a temperatura refrigerata può alterare la fisiologia batterica e portare eventualmente a genotipica o cambiamenti fenotipici27,28,29, è consigliabile preparare aliquote della colture stock a-80 ° C per routine inoculazione in colture starter. Inoltre, lavorare con gli isolati clinici richiede più frequenti restreaks dalle scorte di-80 ° C come cambiamenti genetici sono rapidamente osservati quando transitioning un ceppo batterico clinicamente derivato il laboratorio impostazione30,31 . Soprattutto lavorando con Shigella isolati, ceppi adattano rapidamente e fenotipo turni si verificano spesso32,33. Si raccomanda di batteri restreak dalle scorte congelatore una volta al mese e restreak lo stock piastra ogni due settimane.
Un altro fattore importante per assicurare la riproducibilità è fresca preparazione dei sali biliari media per limitare la variabilità del dosaggio. Sali biliari media più di 1 settimana influenzato negativamente il robusto fenotipo osservato con preparazione di terreni freschi. Inoltre, secondo l'agente patogeno ed il tipo di esposizione per essere analizzato (piccolo intestino rispetto a due punti), diverse fonti e le miscele di sali biliari possono essere richieste. Ad esempio, singoli sali biliari, coniugato e de-coniugato fonti, o estratti di bile grezza che includono componenti aggiuntivi bile come colesterolo e bilirubina possono essere utilizzati5,6. Analisi di Shigella sono concentrati sull'adattamento batterico all'host durante il transito dell'intestino tenue prima dell'infezione nel colon. Pertanto, l'uso di una miscela colato e desossicolato imita le condizioni del piccolo intestino5,6,34. Anche per quanto riguarda il dosaggio di dispersione (sezione 5), si precisa che i reagenti di PBS-completati sono essere fatto fresco ogni giorno e pre-riscaldato a 37 ° C prima del test. Quando i reagenti più vecchi di un paio di giorni sono stati utilizzati, la riproducibilità del test è stata seriamente compromessa. Anche fosse fondamentale per pre-riscaldare questi reagenti a 37 ° C come dispersione non si prontamente con reagenti a temperatura ambiente. Infine, possono essere utilizzati metodi di dispersione per la valutazione dell'enumerazione titolo completo del biofilm, che comprendono sonicazione35,36 o37di digestione enzimatica. L'approccio per l'analisi di dispersione è stata orientata verso la valutazione dell'effetto di riassorbimento di sali biliari come Shigella transiti dall'ileo terminale e nel colon. L'analisi è basata su ipotesi che la perdita di sali biliari consentirebbe la dispersione del biofilm transitorio e che Shigella deve disperdere il biofilm prima che causano infezione in epitelio colico4,5 . Condizioni quali sonicazione e digestione enzimatica rappresentano il rilascio totale di massa microbica dal biofilm mentre la strategia presentata qui emula l'ileo alla transizione del colon per catturare un fenotipo fisiologico per Shigella. A seconda delle condizioni sperimentali desiderate, metodi aggiuntivi per l'enumerazione di analisi o biofilm di dispersione possono essere richiesti.
I dosaggi sono progettati per essere moderatamente ad alta velocità con l'uso di piastre a 96 pozzetti per abilitare il test di più ceppi batterici e/o condizioni. Per garantire la riproducibilità della formazione di biofilm, fondo piatto, 96 pozzetti piastre che erano la coltura di tessuti trattato sono stati usati. Per motivi tecnici, i lettori di micropiastre non possono misurare accuratamente assorbanza o fluorescenza nelle piastre di fondo tondo. Inoltre, non rivestito di piastre offerti profili variabile aderenza in Shigella, che è un viale di indagine in corso. Le analisi possono essere scalate proporzionalmente a formati ben più grandi, ma richiederanno le alterazioni del protocollo che può ridurre l'efficienza sperimentale. Ad esempio, i terreni di coltura sarà necessario essere trasferito per cuvette per registrare i valori di600 OD con uno spettrofotometro. Inoltre, può essere raschiato il biofilm di cristallo viola-macchiato dopo un'incubazione di 30-60 min in etanolo al 95% decolorare il passaggio e il contenuto può essere trasferito a una cuvetta per letture spettrofotometro a OD540. Cura deve essere presa quando rottamazione il contenuto del biofilm in ciascun pozzetto per evitare gli schizzi, e abbiamo trovato che la rottamazione è più facile dopo un'incubazione di 60 min.
Analisi con Shigella, Salmonella e patogeni di e. coli4 ha dimostrato un'osservazione ripetuta che formazione di biofilm si verifica in una scala di tempo accelerato (entro 24 h) per gli agenti patogeni enterici esposti ai sali biliari. Al contrario di altri batteri che richiedono 48 a 72 h per osservare la formazione di biofilm in condizioni normali, indotta da sali biliari enterici biofilm inizia già a 4 h con la fase di adesione iniziale. Successivamente, EPS matrice formazione è evidente da 6 h, e la maturazione avviene da 24 h. Come tale, il fenotipo di aderenza a 24 h può essere troppo robusto per decifrare il ruolo dei fattori di aderenza differenti nella formazione del biofilm. Effettuando analisi precoce, ad esempio più presto 4 h, consente per l'identificazione dei fattori importante nella formazione di biofilm precoce che altrimenti sarebbe saltato in un secondo tempo. Infine e come accennato in precedenza nei passaggi del protocollo, formazione di biofilm indotta da sali biliari per Shigella non è stata rilevata in assenza di glucosio4. Poiché la matrice EPS è composto principalmente da polisaccaridi ed è un passo fondamentale nella formazione di biofilm per la maggior parte dei batteri38, la presenza di glucosio o altri zuccheri nei media è probabilmente importante per osservare la formazione di biofilm. A seconda dell'agente patogeno batterico analizzato, media base differenti formulazioni possono essere richiesti.
Formazione di biofilm è un processo multilivello che spesso si verifica in un sistema aperto dove nutrienti flusso e movimento fluido facilmente verificarsi1,2,3. I metodi sono limitati dalla cultura chiusa e requisiti di crescita statico; Tuttavia, i metodi di consentono la valutazione della formazione di biofilm nell'impostazione del laboratorio. Al momento l'identificazione del fenotipo biofilm, ulteriori esperimenti utilizzando cellule del liquido o cultura continua strategie39,40,41 può fornire ulteriori informazioni mecanicistiche fisiologiche o cliniche importanza della formazione di biofilm. Per l'identificazione della matrice EPS, i protocolli utilizzano la lectina legante il polisaccaride ConA. ConA associa residui α-D-glucosil o stericamente-strettamente connessi42. Le lectine diverse possono essere richieste a seconda del tipo di EPS prodotta per diversi generi o specie. Una strategia alternativa per identificare la produzione di EPS è la spettrometria di massa, che fornirà sia verifica che l'EPS è prodotto e determinare la composizione dell'EPS matrice43,44. Inoltre, l'uso del colorante di contrasto DAPI può causare notevole luminosità dato il numero di batteri nel biofilm o l'avvenimento di DNA extracellulare che è spesso presente nel EPS matrice45,46.
Ci sono alternative ai metodi sopra descritti nella letteratura. Ad esempio, l'analisi di fase solida obbligatoria è stato segnalato per l'utilizzo in altri agenti patogeni (per esempio, riferimenti4,25,47,48,49). Ci sono modifiche al protocollo tra pubblicazioni; e quindi, le strategie presentate qui sono un formato di facile--replicare. È importante notare che i protocolli di specificano biofilm asciugatura all'aria prima della colorazione (punto 3.10), mentre alcuni gruppi preferiscono risolvere il biofilm. I due diversi approcci possono rappresentare variando patogeno-specifiche strategie. Inoltre, preparando la macchia viola di cristallo in acqua, è stato rilevato un fenotipo di formazione di biofilm coerente. Altri gruppi utilizzano etanolo per solubilizzare viola di cristallo; che per Shigella, ha portato alla destabilizzazione del biofilm e compromessa la riproducibilità. Attualmente stiamo studiando i fattori che possono essere etanolo solubile nel biofilm Shigella . Un altro esempio è la quantificazione della produzione EPS macchiando di ConA. Un metodo di rilevazione fluorescente piastra a 96 pozzetti (punto 4.1) è presentato per determinare valori semi-quantitativi che riflette la quantità di coniugato FITC ConA associazione a biofilm. A nostra conoscenza, il metodo è la prima volta che questa strategia è stata segnalata. Rilevamento di EPS tramite esame microscopico è accettato nella letteratura e consente una strategia diversa, ma gratuita, visualizzare EPS. La rilevazione di fluorescenza semi-quantitativa combinata con la rilevazione microscopica confocal di EPS certamente rafforzato i dati, soprattutto in considerazione le limitazioni della procedura colorante di contrasto DAPI l'analisi di microscopia descritto sopra. In tutto, un significativo punto di forza nel set di analisi descritto qui è che ogni tecnica integra un altro approccio per dar luogo ad una valutazione dinamica della formazione di biofilm indotta da sali biliari in patogeni enterici.
Come sali biliari e virulento biofilm sono incorporati nel paradigma della patogenesi batterica enterica, si prevede che questi metodi utilizzerà per convalidare modelli, identificare i ruoli di specifici geni, identificare i geni della funzione sconosciuta e fornire generale caratterizzazione di ceppi clinici. Questo approccio sfaccettato permette l'identificazione di geni importanti ad un aspetto della formazione del biofilm che può essere perso una volta il biofilm maturo è stabilito, che pertanto consente l'identificazione di funzioni specializzate di ogni componente batterica della biofilm. Inoltre, come è evidente dal fatto che l'adattamento di agente patogeno all'interno dell'intestino umano è un fenomeno rapidamente, il ruolo della formazione del biofilm indotta da sali biliari è un esempio di un fenomeno recentemente apprezzato, conservato e critico che si verifica in Shigella infezione così come ulteriori patogeni enterici.
Divulgazioni
Gli autori non hanno alcuna informazioni integrative.
Riconoscimenti
Ringraziamo Rachael B. Chanin e Alejandro Llanos-Chea per assistenza tecnica. Ringraziamo Anthony T. Maurelli, Bryan P. Hurley, Alessio Fasano, Brett E. Swierczewski e Bobby Cherayil per i ceppi utilizzati in questo studio. Questo lavoro è stato supportato dal National Institute of Allergy e Grant K22AI104755 di malattie infettive (C.S.F). Il contenuto è di esclusiva responsabilità degli autori e non rappresentano necessariamente il punto di vista ufficiale del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Tryptic Soy Broth | Sigma-Aldrich | 22092-500G | |
| Crystal Violet | Sigma | C6158-50 | |
| Concanavalin-A FITC | Sigma | C7642-10mg | |
| Glucose | Sigma | G7021-1KG | |
| Bile Salts | Sigma | B8756-100G | |
| LB Agar | Sigma | L7533-1KG | |
| 14 mL culture tubes, 17 x 100 mm, plastic, sterile | Fisher | 14-959-11B | |
| Vectashield hard-set antifade with DAPI | Vector Laboratories | H-1500 | |
| Formaldehyde | Sigma-Aldrich | F1635-500 | |
| Gluteraldehyde | Sigma-Aldrich | G6257 | |
| Flat-bottomed 96-well plates (clear) | TPP | 92696 | |
| Flat-bottomed 96-well plates (black) | Greiner Bio-One | 655076 | |
| Flat-bottomed 24-well plates (clear) | TPP | 92424 | |
| Glass coverslips 12mm, round | Fisher | 08-774-383 | |
| 96-well plate reader | Spectramax | ||
| Flourescent plate reader | Biotek Synergy 2 | ||
| Confocal or Fluorescent Microscope | Nikon A1 confocal microscope | ||
| 37°C Shaking Incubator | New Brunswick Scientific Excella E25 | ||
| 37°C Plate Incubator | Thermolyne Series 5000 |
Riferimenti
- Joo, H. -. S. S., Otto, M. Molecular basis of in vivo biofilm formation by bacterial pathogens. Chem Biol. 19 (12), 1503-1513 (2012).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm Formation as Microbial Development. Annu Rev Microbiol. 54 (1), 49-79 (2000).
- Donlan, R. M. Biofilm Formation: A Clinically Relevant Microbiological Process. Clin Infect Dis. 33 (8), 1387-1392 (2001).
- Nickerson, K. P., et al. Analysis of Shigella flexneri resistance, biofilm formation, and transcriptional profile in response to bile salts. Infect Immun. 85 (6), (2017).
- Ridlon, J. M., Kang, D. -. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47 (2), 241-259 (2006).
- Sistrunk, J. R., Nickerson, K. P., Chanin, R. B., Rasko, D. A., Faherty, C. S. Survival of the fittest: How bacterial pathogens utilize bile to enhance infection. Clin Microbiol Rev. 29 (4), (2016).
- Prouty, A. M., Schwesinger, W. H., Gunn, J. S. Biofilm formation and interaction with the surfaces of gallstones by Salmonella spp. Infect Immun. 70 (5), 2640-2649 (2002).
- Crawford, R. W., Gibson, D. L., Kay, W. W., Gunn, J. S. Identification of a bile-induced exopolysaccharide required for Salmonella biofilm formation on gallstone surfaces. Infect Immun. 76 (11), 5341-5349 (2008).
- Crawford, R. W., Reeve, K. E., Gunn, J. S. Flagellated but not hyperfimbriated Salmonella enterica serovar Typhimurium attaches to and forms biofilms on cholesterol-coated surfaces. J Bacteriol. 192 (12), 2981-2990 (2010).
- Crawford, R. W., Rosales-Reyes, R., Ramírez-Aguilar, M. d. e. l. a. L., Chapa-Azuela, O., Alpuche-Aranda, C., Gunn, J. S. Gallstones play a significant role in Salmonella spp. gallbladder colonization and carriage. Proc Natl Acad Sci U S A. 107 (9), 4353-4358 (2010).
- Koestler, B. J., Waters, C. M. Bile acids and bicarbonate inversely regulate intracellular cyclic di-GMP in Vibrio cholerae. Infect Immun. 82 (7), 3002-3014 (2014).
- Svensson, S. L., Pryjma, M., Gaynor, E. C. Flagella-mediated adhesion and extracellular DNA release contribute to biofilm formation and stress tolerance of Campylobacter jejuni. PLoS One. 9 (8), e106063 (2014).
- Martinez-Medina, M., et al. Biofilm formation as a novel phenotypic feature of adherent-invasive Escherichia coli (AIEC). BMC Microbiol. 9 (1), 202 (2009).
- Naves, P., et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. J Appl Microbiol. 105 (2), 585-590 (2008).
- Danese, P. N., Pratt, L. A., Dove, S. L., Kolter, R. The outer membrane protein, Antigen 43, mediates cell-to-cell interactions within Escherichia coli biofilms. Mol Microbiol. 37 (2), 424-432 (2000).
- Nickerson, K. P., McDonald, C. Crohn's disease-associated adherent-invasive Escherichia coli adhesion is enhanced by exposure to the ubiquitous dietary polysaccharide maltodextrin. PLoS One. 7 (12), e52132 (2012).
- Paddock, S. W. Confocal laser scanning microscopy. Biotechniques. 27 (5), (1999).
- Paddock, S. W. Principles and practices of laser scanning confocal microscopy. Mol Biotechnol. 16 (2), 127-149 (2000).
- Paddock, S. Over the rainbow: 25 years of confocal imaging. Biotechniques. 44 (5), (2008).
- Paddock, S. W., Eliceiri, K. W. Laser scanning confocal microscopy: history, applications, and related optical sectioning techniques. Methods Mol Biol. 1075, 9-47 (2014).
- Nataro, J. P., Steiner, T., Guerrant, R. L. Enteroaggregative Escherichia coli. Emerg Infect Dis. 4 (2), 251-261 (1998).
- Nesper, J., Lauriano, C. M., Klose, K. E., Kapfhammer, D., Kraiss, A., Reidl, J. Characterization of Vibrio cholerae O1 El tor galU and galE mutants: influence on lipopolysaccharide structure, colonization, and biofilm formation. Infect Immun. 69 (1), 435-445 (2001).
- Hadjifrangiskou, M., et al. Transposon mutagenesis identifies uropathogenic Escherichia coli biofilm factors. J Bacteriol. 194 (22), 6195-6205 (2012).
- Rahimpour, M., et al. GlgS, described previously as a glycogen synthesis control protein, negatively regulates motility and biofilm formation in Escherichia coli. Biochem J. 452 (3), 559-573 (2013).
- Sharma, V. K., Kudva, I. T., Bearson, B. L., Stasko, J. A. Contributions of EspA Filaments and Curli Fimbriae in Cellular Adherence and Biofilm Formation of Enterohemorrhagic Escherichia coli O157:H7. PLoS One. 11 (2), e0149745 (2016).
- Keto-Timonen, R., Hietala, N., Palonen, E., Hakakorpi, A., Lindström, M., Korkeala, H. Cold Shock Proteins: A Minireview with Special Emphasis on Csp-family of Enteropathogenic Yersinia. Front Microbiol. 7, 1151 (2016).
- Pöntinen, A., Markkula, A., Lindström, M., Korkeala, H. Two-Component-System Histidine Kinases Involved in Growth of Listeria monocytogenes EGD-e at Low Temperatures. Appl Environ Microbiol. 81 (12), 3994-4004 (2015).
- Regeard, C., Mérieau, A., Guespin-Michel, J. F. A bioluminescence assay for screening thermoregulated genes in a psychrotrophic bacterium Pseudomonas fluorescens. J Appl Microbiol. 88 (1), 183-189 (2000).
- Markkula, A., Mattila, M., Lindström, M., Korkeala, H. Genes encoding putative DEAD-box RNA helicases in Listeria monocytogenes EGD-e are needed for growth and motility at 3°C. Environ Microbiol. 14 (8), 2223-2232 (2012).
- Fux, C. A., Shirtliff, M., Stoodley, P., Costerton, J. W. Can laboratory reference strains mirror "real-world" pathogenesis?. Trends Microbiol. 13 (2), 58-63 (2005).
- Takai, S., Sekizaki, T., Ozawa, T., Sugawara, T., Watanabe, Y., Tsubaki, S. Association between a large plasmid and 15- to 17-kilodalton antigens in virulent Rhodococcus equi. Infect Immun. 59 (11), 4056-4060 (1991).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Loss of pigmentation in Shigella flexneri 2a is correlated with loss of virulence and virulence-associated plasmid. Infect Immun. 43 (1), 397-401 (1984).
- Kopecko, D. J., Washington, O., Formal, S. B. Genetic and physical evidence for plasmid control of Shigella sonnei form I cell surface antigen. Infect Immun. 29 (1), 207-214 (1980).
- Faherty, C. S., Redman, J. C., Rasko, D. A., Barry, E. M., Nataro, J. P. Shigella flexneri effectors OspE1 and OspE2 mediate induced adherence to the colonic epithelium following bile salts exposure. Mol Microbiol. 85 (1), 107-121 (2012).
- Kobayashi, H., Oethinger, M., Tuohy, M. J., Procop, G. W., Bauer, T. W. Improved detection of biofilm-formative bacteria by vortexing and sonication: a pilot study. Clin Orthop Relat Res. 467 (5), 1360-1364 (2009).
- de Oliveira Ferreira, T., et al. Microbial investigation of biofilms recovered from endotracheal tubes using sonication in intensive care unit pediatric patients. Braz J Infect Dis. 20 (5), 468-475 (2016).
- Petruzzi, B., Briggs, R. E., Swords, W. E., De Castro, C., Molinaro, A., Inzana, T. J. Capsular Polysaccharide Interferes with Biofilm Formation by Pasteurella multocida Serogroup A. MBio. 8 (6), e01843-e01817 (2017).
- Payne, D. E., Boles, B. R. Emerging interactions between matrix components during biofilm development. Curr Genet. 62 (1), 137-141 (2016).
- Huang, R., Li, M., Gregory, R. L. Bacterial interactions in dental biofilm. Virulence. 2 (5), 435-444 (2011).
- Buswell, C. M., Nicholl, H. S., Walker, J. T. Use of continuous culture bioreactors for the study of pathogens such as Campylobacter jejuni and Escherichia coli O157 in biofilms. Methods Enzymol. 337, 70-78 (2001).
- McBain, A. J. Chapter 4 In Vitro Biofilm Models. Adv Appl Microbiol. 69, 99-132 (2009).
- Schiefer, H. G., Krauss, H., Brunner, H., Gerhardt, U. Ultrastructural visualization of surface carbohydrate structures on mycoplasma membranes by concanavalin A. J Bacteriol. 124 (3), 1598-1600 (1975).
- Liener, I. . The Lectins: Properties, Functions and Applications in Biology and Medicine. , (1986).
- Wittmann, V., Pieters, R. J. Bridging lectin binding sites by multivalent carbohydrates. Chem Soc Rev. 42 (10), 4492-4503 (2013).
- Wang, S., et al. The exopolysaccharide Psl-eDNA interaction enables the formation of a biofilm skeleton in Pseudomonas aeruginosa. Environ Microbiol Rep. 7 (2), 330-340 (2015).
- Okshevsky, M., Meyer, R. L. The role of extracellular DNA in the establishment, maintenance and perpetuation of bacterial biofilms. Crit Rev Microbiol. 41 (3), 341-352 (2015).
- Xu, D., Zhang, W., Zhang, B., Liao, C., Shao, Y. Characterization of a biofilm-forming Shigella flexneri phenotype due to deficiency in Hep biosynthesis. PeerJ. 4, e2178 (2016).
- O'Toole, G. A. Microtiter Dish Biofilm Formation Assay. J Vis Exp. (47), (2011).
- Nickerson, K. P., McDonald, C. Crohn's Disease-Associated Adherent-Invasive Escherichia coli Adhesion Is Enhanced by Exposure to the Ubiquitous Dietary Polysaccharide Maltodextrin. PLoS One. 7 (12), (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon