Method Article
La Formation de Biofilm induite sur les sels biliaires chez les agents pathogènes entériques : Techniques d’Identification et de Quantification
Dans cet article
Résumé
Ce protocole permet au lecteur d’analyser la formation de biofilm induite sur les sels biliaires dans les pathogènes entériques à l’aide d’une approche à multiples facettes pour capturer la nature dynamique des biofilms bactériens par évaluation de la conformité, formation de la matrice extracellulaire substance polymérique, et la dispersion.
Résumé
La formation de biofilm est un processus dynamique, à plusieurs étapes qui se produit chez les bactéries sous des conditions environnementales difficiles ou des moments de stress. Pour les pathogènes entériques, une réponse à un stress important est induite pendant le transit gastro-intestinal et à l’exposition de bile, une composante normale de la digestion humaine. Pour surmonter les effets bactéricides de la bile, de nombreux agents pathogènes entériques forment un biofilm l’hypothèse afin de permettre la survie lorsque le transit à travers l’intestin grêle. Nous présentons des méthodes pour définir la formation de biofilms par le biais de tests d’adhérence de la phase solide ainsi que de détection de matrice de substances polymériques extracellulaires (EPS) et de visualisation. En outre, évaluation de dispersion de biofilm est présentée pour imiter l’analyse des événements déclenchant la libération des bactéries durant le processus d’infection. Une coloration violette en cristal est utilisée pour détecter des bactéries adhérentes dans un essai d’adhérence haut débit plaque à 96 puits. Évaluation de production EPS est déterminée par deux essais, à savoir la microscopie de coloration de la matrice de l’EPS et les analyse semi-quantitative avec une lectine liant de polyosidique conjugué fluorescent. Enfin, dispersion de biofilm est mesurée à travers des comptages de colonies et le placage. Résultats positifs de tests multiples soutiennent la caractérisation des biofilms et peuvent être utilisés pour identifier la formation de biofilm induite sur les sels biliaires chez les autres souches bactériennes.
Introduction
La formation de biofilm est une stratégie de survie bactérienne importante induite lors des conditions environnementales difficiles. Exposition à des composés bactéricides comme des antibiotiques ou des modifications des éléments nutritifs ou de disponibilité de l’oxygène induit un état de stress chez les bactéries qui peuvent être soulagées par le biais de la formation de biofilm. Un biofilm est caractérisé par l’attachement des bactéries à une surface ou d’autres bactéries et s’accompagne de la sécrétion d’une matrice d’EPS essentiellement composée de polysaccharides1,2,3. La formation de biofilm est un processus dynamique dans lequel une cascade d’événements aboutit à la formation d’une communauté bactérienne adhérente mature1,2,3. Bactéries peuvent produire des adhésines pour faciliter l’attachement précoce tout en déplaçant les profils d’expression génique adhésine afin de renforcer l’attachement au cours de la maturation du biofilm. Simultanément, la production d’EPS se produit pour bien enrober les communautés bactériennes dans une matrice pour protéger les cellules contre le stress initial. Les bactéries contenues dans le biofilm sont à croissance lente ; et à ce titre, rend la plupart des antibiotiques inefficaces. En outre, la croissance lente conserve l’énergie jusqu'à ce que les conditions changent afin de favoriser la croissance bactérienne1,2,3. Après que les dures conditions se sont écoulées, bactéries dispersent le biofilm et reprendre un mode de vie planctonique1,2,3. Traditionnellement, les biofilms sont observées sur les surfaces et représentent un défi clinique persistant en raison des réservoirs d’infection présentes sur cathéters et en vivant dans les dispositifs1,2,3.
La formation de biofilm a été récemment décrit pour plusieurs pathogènes entériques ; bactéries qui infectent l’intestin grêle ou du côlon4. Pour les espèces de Shigella , , l’infection survient dans le côlon humain après un transit par la majorité du tractus gastro-intestinal. Au cours du passage dans l’intestin grêle, Shigella est exposée à la bile ; un détergent dégradant lipides sécrété dans l’intestin pour faciliter la digestion des lipides, tout en tuant en même temps la plupart bactéries5. Les pathogènes entériques ont une capacité unique à résister aux effets bactéricides de bile6. Notre récente analyse utilisées en vivo-comme des combinaisons de glucose et de sels biliaires pour démontrer la formation de biofilm robuste dans S. flexneri et autres espèces de Shigella, pathogène Escherichia coliet Salmonella4. Auparavant, Salmonella enterica serovar Typhi a été montré pour former un biofilm induite par la bile, en raison de la colonisation unique de la vésicule biliaire au cours de l’infection chronique par le7,8,9, 10. en outre, des recherches antérieures avec Vibrio11et Campylobacter12 a démontré la formation de biofilm en réponse à la bile. Donc, les analyses étendu les observations de la formation de biofilm induite par la bile d’autres agents pathogènes et aident à établir la démonstration d’une réponse de pathogènes entériques conservée à la bile. À la différence des biofilms chroniques dans lequel la transcription de gène bactérien est limitée et la sénescence cellulaire peut se produire de1,2,3, nous proposons que le biofilm entérique induite par la bile est plus transitoire dans la nature. Ce transitoire, biofilm virulent est caractérisent par un démontage rapid (comme vu dans le test de dispersion) et amélioré l’expression de gènes de virulence observée dans le biofilm population4,6.
Comme la formation de biofilm est un processus dynamique, aux multiples facettes et l’utilisation des sels biliaires comme un facteur déclencheur n’a été récemment décrit pour les pathogènes entériques plus, les outils et les techniques utilisées sont des applications uniques et créatives des méthodes traditionnelles. Ainsi, sont présentées ici de trois stratégies complémentaires de quantifier plusieurs caractéristiques importantes de la formation de biofilm induite sur les sels biliaires, dont l’adhérence bactérienne, production de la matrice de l’EPS et la dispersion des bactéries viables de biofilm. Ces techniques ont été utilisées principalement pour la recherche avec Shigella; et donc, évaluation d’autres pathogènes entériques peut-être nécessiter optimisation. Néanmoins, les données positives de tous les trois épreuves soutiennent l’identification des biofilms et établissent des protocoles reproductibles pour la formation de biofilm induite sur les sels biliaires.
Protocole
1. préparation des réactifs
- Moyen de sels biliaires : pour préparer le bouillon trypticase soja (TSB) contenant des sels biliaires de 0,4 % (poids/volume), resuspendre 200 mg de sels biliaires dans 50 mL BST autoclavé. Filtre stériliser à l’aide d’un filtre de 0,22 µm. Faire un milieu frais chaque semaine.
Remarques : Les sels biliaires couramment utilisés est un mélange de 1:1 de cholate de sodium et le désoxycholate de sodium isolées de vésicules biliaires ovines et bovines. Comme démontré précédemment4, la présence de glucose était nécessaire pour la formation de biofilm induite sur les sels biliaires. BST a ajouté glucose par rapport au bouillon Luria-Bertani (LB) ; et par conséquent, était suffisante pour induire la formation de biofilm dans Shigella et les autres pathogènes entériques analysés. Selon les bactéries pour être analysés, les glycémies différentes ou des exigences différentes de sucre pourraient être nécessaires. - 0,5 % p/v cristal violet dans l’eau : dissoudre 2,5 g de cristal violet dans 500 mL d’eau distillée. Filtre stériliser à l’aide d’un filtre de 0,22 µm.
- La concanavaline A (ConA) conjugué à l’isothiocyanate de fluorescéine (FITC) : reconstituer le stock dans du PBS 1 x. Diluer le stock de 10 mg de concentré avec 400 μl de PBS 1 x à une concentration finale de 25 µg/mL et protéger de la lumière.
- PBS + Glucose : Dissoudre 0,2 g de glucose dans 10 mL de PBS 1 x (finale de glucose 2 % p/v). Filtre stériliser à l’aide d’un filtre de 0,22 µm. Faire des frais sur le jour d’utilisation.
- PBS + sels biliaires : Dissoudre 40 mg dans 10 mL de PBS 1 x (sels biliaires 0,4 % w/v finales). Filtre stériliser à l’aide d’un filtre de 0,22 µm. Faire des frais sur le jour d’utilisation.
- CPE + de glucose et de sels biliaires : dissoudre les sels biliaires 40 mg et 0,2 g de glucose dans 10 mL de PBS 1 x (0,4 % w/v les sels biliaires et 2 % w/v glucose final). Filtre stériliser à l’aide d’un filtre de 0,22 µm. Faire des frais sur le jour d’utilisation.
- Préparer des boîtes de gélose LB.
- Solution de formaldéhyde/glutaraldéhyde : 810 ajouter µL formaldéhyde (solution mère de 37 %, 3 % concentration finale) et le 125 glutaraldéhyde µL (solution mère de 25 %, la concentration finale de 0,25 %) à PBS 1 x 14 mL. Bien mélanger et conserver à 4 ° C. Le correctif doit être froid pour une utilisation correcte.
ATTENTION : Le correctif est toxique et nécessite l’élimination des déchets dangereux. - Mountant Antifade solution : utiliser mountant antifade solution contenant 4, 6-diamidino-2-phénylindole (DAPI) tache pour inhiber le photoblanchiment des échantillons de la microscopie par immunofluorescence tandis que fluorescent coloration de l’ADN de la bactérie.
2. préparation de bactéries
- Cultiver des cultures durant la nuit des souches bactériennes à tester en inoculant des 3 mL du BST avec une colonie unique, bien isolée dans un tube à culture stérile. Incuber à 37 ° C sous agitation à 225 tr/min pour une nuit d’incubation (16-24h).
NOTE : Souches devraient être restreaked provenant des stocks du congélateur tous les 2 à 4 semaines et entretenu sur plaques non âgés de plus de 2 semaines.
3. phase solide adhésion Assay
NOTE : Cet essai quantifie les bactéries adhérentes à l’aide d’une méthode de la plaque à 96 puits. Les bactéries sont cultivées statiquement dans les plaques de fond plat. Laver est effectué afin d’éliminer les bactéries non adhérents et adhérentes bactéries sont colorées au violet de gentiane. La tache violette en cristal lie le peptidoglycane de la paroi cellulaire bactérienne et peut être solubilisée à l’éthanol. Le nombre de bactéries adhérentes est déterminé en fonction sur la rétention de violet de gentiane.
- Mis en place deux tubes de 1,5 mL. L’étiquette avec le BST ou TSB + sels biliaires (BS).
- Ajouter 1 mL de TSB ou BST + BS aux tubes respectifs.
- Ensemencer des tubes avec 20 µL de la culture au jour le jour (à une 01:50 dilution).
- Dans une plaque à 96 puits stérile, claire, à fond plat, imprégnées de culture de tissus, ajoutez 130 µL/puits de médias de témoins non inoculées à trois puits pour servir le contrôle à blanc. Mettre en place trois puits de contrôle pour chaque type de média (TSB et BST + BS) à tester.
- Ajouter 130 µL/puits de culture inoculée dans trois puits et répétez jusqu'à ce que toutes les conditions expérimentales sont plaquées en triple exemplaire.
- Incuber à 37 ° C pendant 4-24 heures statiquement.
- À l’aide d’un lecteur, enregistrer l' OD600. Définir les puits de contrôle comme « vide ». Confirmer que le fluide est clair sans aucun signe de turbidité. Si toute turbidité est détectée, jeter l’expérience. Les valeurs de600 OD permet de normaliser les données, s’il y a des différences significatives dans les taux de croissance entre les souches bactériennes.
- Enlever le milieu de culture à l’aide d’une ligne vide en inclinant légèrement la plaque et en aspirant lentement le milieu sur le bord inférieur du puits. N’oubliez pas de collecter tout le milieu de culture sans perturber la population bactérienne adhérente, située sur la surface en plastique. Si la matrice de l’EPS a été développée au cours de la période d’incubation, la matrice va être visualisée comme un précipité blanc. Ne pas déranger la matrice de l’EPS.
- Laver délicatement les puits une fois avec 200 µL de PBS stérile. Retirez le lavage de PBS à l’aide de la ligne du vide.
- Il faut inverser la plaque à sécher. Prévoyez un minimum de 20 minutes pour sécher.
Remarque : Étant donné que le biofilm doit être complètement séché avant la coloration, le protocole peut être suspendue à cette étape pour quelques heures ou même une nuit ou plus. Le temps de séchage supplémentaire ne changera pas la procédure de marquage, tandis que le séchage incomplet affectera la quantification des résultats et reproductibilité. - Ajouter 150 µL de violet de gentiane 0,5 % pour chaque expérimental et contrôle bien.
- Incuber 5 min à température ambiante (RT).
- Laver les puits une fois avec 400 µL d’eau distillée. Le volume supplémentaire est utile pour enlever les tache résiduelle cristal violet sur les côtés des puits. Retirez le lavage avec la conduite d’aspiration.
- Laver les puits cinq fois avec 200 µL d’eau distillée. Retirez le lavage avec la conduite d’aspiration.
Remarque : Le lavage complet est important pour la quantification. Lorsque les blancs sont clairement de l’eau distillée et ne contiennent aucune tache résiduelle cristal violet, passez à l’étape suivante. - Il faut inverser la plaque à sécher, abri de la lumière. Obtenir un séchage complet de la plaque comme indiqué plus haut.
- Décolorer les puits avec 200 µL d’éthanol à 95 %. Incuber les plaques sur l’agitateur pendant 30 min. Pour éviter l’évaporation, en particulier aux températures élevées, effectuez cette étape à 4 ° C.
- À l’aide d’un lecteur, enregistrer l' OD540.
Remarque : La longueur d’onde d’absorbance maximale de violet de gentiane est près de 590 nm. La littérature fait état d’une gamme de OD540 - OD5954,13,14,15,16 d’absorbance de violet de gentiane ; ainsi, choisir une longueur d’onde disponible basé sur le lecteur.
4. détection de matrice EPS
Remarque : Ces tests gratuits quantifier et visualiser l’EPS. Dans les deux, EPS est détecté par une lectine pour lier des polysaccharides. La protéine conjugué fluorescent permet la quantification (étape 4.1) ou visualisation (étape 4.2).
- Détection semi-quantitative d’EPS
- Mis en place deux tubes de 1,5 mL. Étiquette avec le BST ou TSB + BS.
- Ajouter 1 mL de TSB ou BST + BS aux tubes respectifs.
- Ensemencer des tubes avec 20 µL d’une culture (un 01:50 dilution).
- Dans une plaque à 96 puits stérile, noire, à fond plat, imprégnées de culture de tissus, ajoutez 130 µL/puits de médias de témoins non inoculées à trois puits pour servir le contrôle à blanc. Mettre en place trois puits de contrôle pour chaque type de média à tester. Ajouter 130 µL/puits de culture inoculée dans les puits et répétez jusqu'à ce que toutes les conditions expérimentales sont plaquées en triple exemplaire.
- Incuber à 37 ° C pendant 4-24 heures statiquement.
- Transférer le milieu de culture sur une plaque à 96 puits clair avec une pipette, idéalement une pipette multicanaux. Soyez prudent pour recueillir tout le milieu de culture sans perturber la population adhérente et/ou l’EPS situé sur la surface en plastique. Mettre de côté.
- Fixer la plaque noire pendant 15 min à ta en solution 1 PBS x à l’aide de 200 µL/puits de la formaldéhyde/glutaraldéhyde.
- Alors qu’est la fixation de la population adhérente, d’évaluer la fraction surnageante à l’étape 4.1.6. À l’aide d’un lecteur, enregistrer l' OD600. Définir les puits de contrôle comme « vide ». Confirmer que le fluide est clair sans aucun signe de turbidité. Si toute turbidité est détectée, jeter l’expérience.
- Sinon, le test complet peut être effectué dans une plaque de fond transparent noir. Dans ces conditions, les valeurs de600 OD peuvent être enregistrés et le milieu de culture peut être jeté par la suite avant de passer à l’étape 4.1.7. Les valeurs de600 OD peuvent être utilisés pour normaliser les données dans le cas il y a des différences significatives dans les taux de croissance entre les souches bactériennes.
- Supprimer le correctif et éliminer les déchets dangereux.
- Laver délicatement les puits deux fois avec 200 µL/puits de PBS stérile. Retirez le lavage de PBS à l’aide de la ligne du vide en inclinant doucement la plaque et en aspirant doucement le lavage au bord inférieur du puits.
- Ajouter 150 µL/puits de 25 µg/mL ConA-FITC et incuber pendant 15 min à température ambiante.
- Laver délicatement deux fois avec 200 µL de PBS.
- Ajouter 150 µL de PBS dans chaque puits. Enregistrer la fluorescence à 488 nm.
- Visualisation de microscopie confocale de production d’EPS et calcul de l’épaisseur du biofilm
- Mis en place deux tubes de 1,5 mL. Étiquette avec le BST ou TSB + BS.
- Ajouter 1 mL de TSB ou BST + BS aux tubes respectifs.
- Ensemencer des tubes avec 20 µL de la culture au jour le jour (à une 01:50 dilution).
- Mettre en place une plaque 24 puits stérile avec 12 mm stériles round couvre-objet en verre. Ajouter 400 µL/puits de médias de témoins non inoculées à trois puits pour servir le contrôle à blanc. Mettre en place trois puits de contrôle pour chaque type de média à tester.
- Ajouter 400 µL de culture inoculée dans les puits en double exemplaire et répétez jusqu'à ce que toutes les conditions expérimentales sont plaquées.
- Incuber à 37 ° C pendant 4-24 heures statiquement.
- Ne Confirmez visuellement la croissance dans la condition du BST, croissance et condition de BS, + EPS précipité (blanc) dans le BST et aucune croissance et/ou précipité blanc dans les puits de contrôle stérile. Supprimer les surnageants.
- Difficulté à RT à l’aide de 200 µL/puits de la solution de formaldéhyde/glutaraldéhyde dans 1 x PBS pendant 15 minutes.
- Supprimer le correctif et disposer de déchets dangereux.
- Laver délicatement les puits deux fois avec 200 µL/puits de PBS stérile. Retirez le lavage de PBS à l’aide de la ligne du vide.
- Ajouter 150 µL/puits de 25 µg/mL ConA-FITC et incuber pendant 15 min à température ambiante.
- Laver délicatement deux fois avec 200 µL/puits de PBS.
- Monter avec solution antifade mountant au DAPI.
Remarque : La solution est une solution de montage prêtes à l’emploi, axée sur le glycérol contenant DAPI pour préserver les étiquettes fluorescentes tout en simultanément coloration de l’ADN dans des cellules bactériennes pour la visualisation comme contre-colorant. Suivre les instructions et les recommandations du kit pour les temps d’incubation avant l’imagerie des échantillons. Le DAPI souillant le procédé peut être effectué avant d’appliquer la solution mountant antifade qui ne contient-elle pas de DAPI. - Évaluer par microscopie confocale. Sur un microscope confocal, affectez le laser nm/519 495 nm excitation/émission pour la visualisation de la FITC. Définissez un deuxième laser à 360 nm/460 nm excitation/émission de visualiser DAPI. Localiser le biofilm en mettant l’accent sur le canal DAPI. Utiliser des canaux du FITC tant DAPI pour déterminer la pleine épaisseur et définir la partie supérieure et inférieure d’imagerie frontières. Enregistrer des images de pleine épaisseur Z-pile en capturant des images chaque 0,25 µm après avoir réglé les périmètres en haut et en bas de la pile-z. Pour plus d’informations sur la microscopie confocal, veuillez vous reporter aux publications de Paddock et al. 17 , 18 , 19 , 20
- Reconstruire les images 3D dans ImageJ (https://imagej.nih.gov/ij/) pour visualiser la formation de biofilm complet et calculer l’épaisseur du biofilm. L’épaisseur moyenne obtenue pour S. flexneri sels biliaires induits biofilms était 14 µm4.
5. Dispersion Assay
Remarque : Dans cet essai, le démontage du biofilm par dispersion bactérienne est détecté. Ici, biofilms matures sont établies et par la suite (habituellement le lendemain), les médias sont remplacés par PBS ou complétées de PBS. Le composant surnageant est ensuite évalué pour quantifier le nombre de bactéries qui ont dissocié le biofilm.
- Mis en place deux tubes de 1,5 mL. Étiquette avec le BST ou TSB + BS.
- Ajouter 1 mL de TSB ou BST + BS aux tubes respectifs.
- Ensemencer des tubes avec 20 µL de la culture au jour le jour (à une 01:50 dilution).
- Dans une plaque à 96 puits stérile, claire, à fond plat, imprégnées de culture de tissus, ajoutez 130 µL/puits de médias de témoins non inoculées à trois puits pour servir le contrôle à blanc. Mettre en place trois puits de contrôle pour chaque type de média à tester.
- Ajouter 130 µL/puits de culture inoculée à trois puits et répétez jusqu'à ce que toutes les conditions expérimentales sont plaquées en triple exemplaire.
- Incuber les plaques pendant 4 à 24 heures à 37 ° C statiquement.
- Avant de continuer, réchauffer le PBS, PBS + glucose, PBS + sels biliaires et PBS + sels biliaires + glucose à 37 ° C. Préparer ces frais du jour réactifs.
- À l’aide d’un lecteur, enregistrer l' OD600. Définir les puits de contrôle comme « vide ». Confirmer que le milieu est clair sans aucun signe de turbidité. Si toute turbidité est détectée, jeter l’expérience. Les valeurs de600 OD permet de normaliser les données, s’il y a des différences significatives dans les taux de croissance entre les souches bactériennes.
- Enlever le milieu de culture à l’aide d’une ligne vide. N’oubliez pas de collecter tout le milieu de culture sans perturber la population adhérente située sur la surface en plastique.
- Laver délicatement les puits deux fois avec 200 µL/puits de PBS stérile. Retirez le lavage de PBS à l’aide de la ligne du vide.
- Remplacer le lavage avec 130 µL/puits de ce qui suit dans trois puits chaque : PBS, PBS + glucose, PBS + sels biliaires et PBS + sels biliaires + glucose. Ces réactifs doivent être pré chauffées à 37 ° C.
- Incuber la plaque pendant 30 min à 37 ° C.
- Retirer délicatement la plaque de l’incubateur à 37 ° C. Transférer les surnageants dans une plaque à 96 puits fraîche, stérile.
- À l’aide d’un bloc de plaque ou d’une dilution de 96 puits, préparer un facteur 10 (01:10) série de dilutions de surnageant dans PBS stérile.
NOTE : La série de dilution doit varier de non dilué à 10-6 selon les souches bactériennes à tester. Expériences pilotes peuvent être effectuées pour déterminer la plage de la dilution optimale. - Repérer la plaque 5 µL de chaque dilution en gélose LB à l’aide d’une pipette multicanaux. Incuber à 37 ° C pendant la nuit. Dénombrer les colonies sur le lendemain et compte pour le facteur de dilution lors de la détermination de la colonie de récupération formant des unités (UFC). Pour calculer la dispersion pour cent par rapport à la 1 x contrôle de PBS (fixé à 100 %), divisez la récupération UFC dans chaque condition de traitement par la récupération UFC dans l’échantillon de contrôle de PBS 1 x.
NOTE : Plaques de médias de Routine pour la souche bactérienne d’intérêt peuvent également être utilisés. Par exemple, Shigella peuvent être plaqués sur les plaques rouge Congo. S’assurer que les plaques soient sèches pour les techniques de placage à l’endroit appropriés.
Résultats
Dans la Figure 1, la formation de biofilm est induite dans la plupart de la croissance suivante testé six pathogènes entériques dans des milieux contenant des sels biliaires. Une augmentation significative des bactéries adhérentes après que exposition de sels biliaires est observée dans presque toutes les souches testées. L’exception est entéroaggrégatif e. coli (CEEA) ; cependant, note l’observation induite des mutantsaaf Δ4. Les résultats indiquent que les mécanismes de respect des autres sont induites par une exposition de sels biliaires dans CEEA en l’absence des fimbriae adhérence agrégatif j’ai (AAF / I)21. Pour tirer des conclusions de cet ensemble de données, de tracer les valeurs de540 OD pour chaque type de souche et médias testés. En comparant les valeurs de chaque souche dans le contrôle de médias (-BS) par rapport aux médias contenant des sels biliaires déterminera si les sels biliaires induisent significativement la formation de biofilm. Comparaisons entre les souches bactériennes et/ou des mutants peuvent également être effectuées pour approfondir les analyses de caractérisation.
L’évaluation de ConA-FITC d’EPS est présentée à la Figure 2. Figure 2 a représente l’évaluation semi-quantitative de la production d’EPS dans lequel ConA-FITC est utilisé pour colorer les biofilms. La ConA lie les polysaccharides dans la matrice de l’EPS et le montant retenu est détecté par un lecteur de plaque fluorescente. Pour présenter les données, tracer les unités de fluorescence moyenne pour chaque condition et comparer les conditions inductrices de biofilm au témoin négatif. En outre, les comparaisons entre les souches bactériennes ou des mutants peuvent être effectuées. Il est essentiel d’analyser un contrôle médias uniquement, négatif pour déterminer la quantité de fluorescence ConA-FITC qui se produit pour la plaque de fond. La condition du BST n’était pas significativement différente du contrôle des médias, alors que la fluorescence lectures considérablement suivant les sels biliaires exposition accrue. Les données confirment que la production d’EPS est révélateur de la formation de biofilm et ne se produit pas en l’absence de sels biliaires pour S. flexneri. Les images des biofilms induite sur les sels biliaires dans S. flexneri est représenté dans la Figure 2 b. ConA-FITC est utilisé pour colorer les polysaccharides dans la matrice de l’EPS tandis qu’un contre-colorant DAPI sert à visualiser les bactéries par coloration de l’ADN. Pour les bactéries non exposés aux sels biliaires (témoin négatif), DAPI n’est détecté. Notamment, la densité des bactéries est beaucoup plus faible que dans l’état de sels biliaires. Un fond clair sur le canal de la FITC est obtenu pour indiquer l’absence de production d’EPS. Comme prévu, les données montrent que la production d’EPS est en corrélation avec le biofilm formation1,2,3 après l’exposition de sels biliaires. La ConA - coloration de contrôle dans les échantillons traités sels biliaires est fournie pour démontrer la spécificité de la fluorescence de la FITC. Pour ces images, solution 1 PBS x a été utilisé à la place de ConA-FITC et le contre-colorant DAPI a été maintenue. L’imagerie peut être effectuée avec un microscope confocal pour évaluer l’épaisseur des biofilms avec échantillons positifs EPS4.
Dispersion bactérienne de biofilms à la Figure 3 est détectée par des biofilms établis en incubation dans PBS ou PBS complétée. Physiologiquement, bile est réabsorbé dans la circulation dans l’intestin grêle, et le 5 % seulement de la bile entre le côlon5. Comme Shigella envahit l’épithélium colique, nous émettons l’hypothèse que la réabsorption de la bile est un signal important pour la dispersion de biofilm. Dans cette figure, la dispersion se produit dans les biofilms exposés à PBS ou PBS + glucose ; Cependant, dispersion est inhibée en PBS + indépendamment de la présence de glucose, les sels biliaires. Les données démontrent que l’élimination des sels biliaires est nécessaire et suffisante pour induire la dispersion de S. flexneri de biofilms induite sur les sels biliaires4. Pour tracer les données, soit la CFU Récupérée de la bactérie ou le pourcentage relatif à la commande (comme illustré ici) peut être tracé.
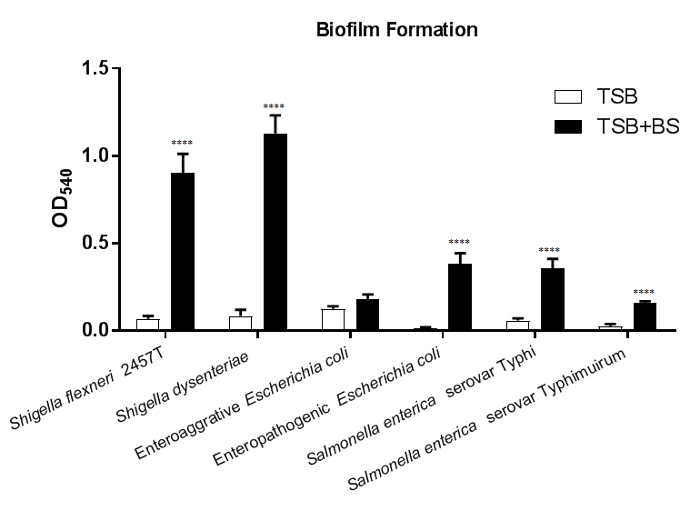
Figure 1 : les sels biliaires induisent la formation de biofilm dans entéropathogènes. 18 h biofilms ont été cultivés sur des plaques de 96 puits de culture de tissus traitée en soit du BST ou BST + 0,4 % sels biliaires médias et colorées par le violet de gentiane 0.5 %. Les valeurs quantitatives de la solubilisation de l’éthanol de la tache violette en cristal ont été déterminées par spectrophotométrie à OD540. Exposition de sels biliaires a augmenté significativement la formation de biofilm à Shigella flexneri, S. dysenteriae, entéropathogène Escherichia coli, Salmonella enterica serovar Typhi et S. enterica serovar Typhimurium. Signification statistique a été déterminée par le test T de l’élève pour chaque souche en comparant le traitement des sels biliaires pour le contrôle des médias. L’erreur-type de la moyenne (SEM) est représenté par les barres d’erreur. Tous les p-valeurs sont < 0,0001. Données présentées sont d’une (n = 3) représentant experiment, avec un ensemble complet des données contenues dans une publication précédente4. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : la formation de biofilm induite sur les sels biliaires se caractérise par la production d’une matrice d’EPS qui est détectée avec marqué FITC concanavaline A. (A) stérile noir, plaque à 96 puits ont été ensemencées avec S. flexneri à un 01:50 dilution dans BST ou TSB + sels biliaires et cultivés pour 18 h. Biofilms ont été résolus, délicatement lavé et coloré avec ConA-FITC. Le montant de la retenue Concanavalin-A FITC a été déterminé par un lecteur de plaque fluorescente. Des valeurs démontrent quantification EPS après une croissance s. flexneri cultivé en sels biliaires BST ou contenant du BST. Signification a été déterminée par ANOVA à et p -values sont < 0,01. Le SEM est représenté par les barres d’erreur. Données présentées sont d’une (n = 3) représentant experiment, avec un ensemble complet des données contenues dans une publication précédente4. (B) microscopie des images d’un biofilm de Shigella induite sur les sels biliaires. Lamelles couvre-objet stérile ont été ensemencées avec S. flexneri à un 01:50 dilution dans BST ou TSB + sels biliaires et cultivées pendant 18 h. Les lamelles ont été par la suite fixés et colorées au ConA-FITC ou Eosine au DAPI. ConA-FITC a été détectée seulement dans l’état de sels biliaires due à la présence de la matrice de l’EPS. Une lamelle colorée uniquement au DAPI dans le BST + traitement des sels biliaires a servi à démontrer la fluorescence de fond minimal pour le paramètre FITC sur la microscopie confocale. Images pour chaque chaîne de longueur d’onde et une superposition de composite sont fournies pour toutes les conditions de traitement. Échelle barres indiquent 10 µm. données présentées sont d’une (n = 3) représentant experiment, avec un ensemble complet des données contenues dans une publication précédente4. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
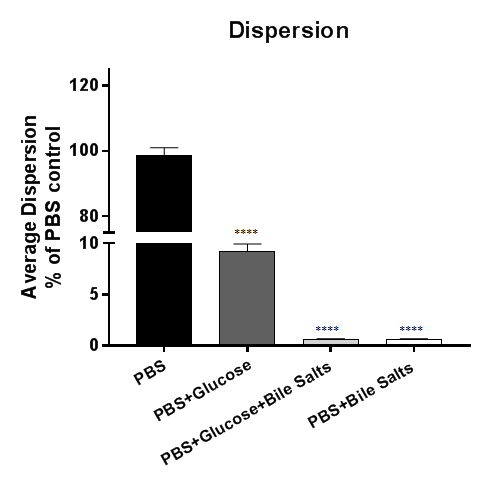
Figure 3 : analyse de la dispersion bactérienne de biofilms induite sur les sels biliaires. 18 h induite sur les sels biliaires Shigella flexneri biofilms exposés à PBS ou PBS additionné de glucose, acides biliaires ou une combinaison de glucose et de sels biliaires. Le surnageant a été par la suite en série dilué et plaqué sur plaques de gélose pour énumérer les unités (CFU) qui a dispersé le biofilm formant des colonies. Le nombre de bactéries récupéré a été tracé par rapport au contrôle de PBS. Bactéries dispersées de biofilm dans du PBS ou de PBS + glucose des conditions, mais la présence de sels biliaires a été suffisante pour inhiber la dispersion bactérienne du biofilm. Données présentées sont d’une (n = 3) représentant experiment, avec un ensemble complet des données contenues dans une publication précédente4. Pour référence, 100 fois plus de bactéries parasitent habituellement le traitement de la commande PBS (environ 7 x 107 UFC) par rapport au PBS + traitement des sels biliaires (environ 7 x 105 UFC). Signification a été déterminée par ANOVA à et p -values sont < 0,0001. Le SEM est représenté par les barres d’erreur.
Discussion
Analyse de la formation de biofilm est difficile en raison de la nature dynamique des biofilms et la variabilité entre les souches, les matériaux, laboratoires et analyses. Ici, plusieurs stratégies sont présentées afin de déterminer la formation de biofilm dans entéropathogènes après exposition de sels biliaires avec perspicacité expérimentale prévue pour promouvoir la reproductibilité. Il y a des considérations supplémentaires pour assurer la reproductibilité. Tout d’abord, nous vous recommandons d’effectuer au moins trois indépendants des expériences chacun avec techniques réanalysés pour confirmer les observations et signification statistique en raison de la variation qui peut se produire. Deuxièmement, l’utilisation de témoins positifs et négatifs est vitale pour assurer la reproductibilité du dosage. Il est fortement recommandé d’utiliser la souche de type sauvage comme un contrôle positif lors de l’évaluation des mutants pour la formation de biofilm. En outre, comme les gènes qui sont importants pour la formation de biofilms sont identifiés (par exemple, voir Vibrio22,7de la Salmonellaet e. coli23,24,25), l’utilisation de des mutants de biofilm comme témoins négatifs validera la reproductibilité du dosage. En troisième lieu, les méthodes ci-dessus sont basées sur la recherche ciblée avec Shigella et S. flexneri, en particulier. Rajustements pour les protocoles peuvent être nécessaires selon les besoins de croissance de chaque entéropathogène évalués. Quatrièmement, les tests mesurent une réaction de stress bactérien ; et, par conséquent, il est essentiel de travailler avec des bactéries convenablement entretenus de stocks congelés (-80 ° C) ou plaques de stockage conservés au réfrigérateur (4 ° C maximum) pour pas plus de deux semaines. Il est important de noter que certaines bactéries y compris les pathogènes entériques dans le genre Yersinia sont psychrotrophes qui peuvent se développer à des températures proches de 0 ° C26. Étant donné que le stockage à température réfrigérée peut modifier la physiologie bactérienne et entraîner éventuellement génotypique ou phénotypiques quarts27,28,29, il est fortement recommandé de préparer des aliquotes de la culture de réserve à-80 ° C pour l’inoculation systématique en ferments lactiques. Par ailleurs, travailler avec des isolats cliniques requiert plus fréquentes restreaks provenant des stocks de-80 ° C comme changements génétiques sont rapidement fait remarquer lorsqu’il passe d’une souche bactérienne dérivés cliniquement dans le laboratoire30,31 . Surtout travailler avec Shigella isole, souches s’adapter rapidement et phénotype déplacements produisent souvent32,33. Il est recommandé de bactéries restreak provenant des stocks du congélateur une fois par mois et restreak le stock plaque toutes les deux semaines.
Un autre facteur important pour assurer la reproductibilité est fraîche préparation des sels biliaires médias pour limiter la variabilité du dosage. Médias de sels biliaires âgés de plus de 1 semaine une incidence négative sur le phénotype solide observé avec la préparation des supports neufs. En outre, selon l’agent pathogène et le type d’exposition à être analysée (intestin grêle ou du côlon), différentes sources et les mélanges de sels biliaires peuvent être nécessaires. Par exemple, des sels biliaires, conjugué et conjugués des sources, ou extraits de bile brut comprenant des éléments de la bile supplémentaires tels que le taux de cholestérol et de la bilirubine peuvent être utilisé5,6. Analyses de Shigella ont mis l’accent sur l’adaptation bactérienne à l’hôte durant le transit de l’intestin grêle avant l’infection du côlon. Par conséquent, l’utilisation d’un mélange de cholate et le désoxycholate imite les conditions de l’intestin grêle,5,6,34. Également en ce qui concerne le test de dispersion (section 5), il est précisé que les réactifs additionné de PBS sont frais du jour et préchauffée à 37 ° C avant le dosage. Lorsqu’ont utilisait des réactifs plus de quelques jours, la reproductibilité du dosage a été gravement compromise. Il était également essentiel de préchauffage ces réactifs à 37 ° C que la dispersion ne bougèrent pas facilement avec les réactifs à température ambiante. Enfin, méthodes de dispersion pour évaluation d’énumération titre complet du biofilm peuvent être utilisées, qui comprennent la sonication35,36 ou37de la digestion enzymatique. L’approche à l’analyse de la dispersion s’est tournée vers l’évaluation de l’effet de la réabsorption des sels biliaires comme Shigella transits de l’iléon terminal et le côlon. L’analyse se fonde sur l’hypothèse que la perte de sels biliaires permettrait de dispersion du biofilm transitoire et que Shigella doit se disperser le biofilm avant de causer une infection dans l’épithélium colique4,5 . Orageux de sonication et digestion enzymatique représente les rejets totaux de masse microbienne de biofilm tandis que la stratégie présentée ici émule l’iléon à la transition du côlon pour capturer un phénotype physiologique pour Shigella. Selon les conditions expérimentales désirées, des méthodes supplémentaires pour l’énumération analyse ou biofilm de dispersion peuvent être nécessaires.
Les dosages sont conçus pour être modérément haut débit avec l’utilisation des plaques de 96 puits pour permettre le test de plusieurs souches bactériennes et/ou des conditions. Pour mieux garantir la reproductibilité de la formation de biofilm, plaques 96 puits à fond plat qui étaient de culture de tissus traitée ont été utilisés. Pour des raisons techniques, lecteurs de plaques ne peut pas mesurer avec précision l’absorbance ou la fluorescence dans les plaques de fond rond. De plus, non revêtus de plaques offert profils d’adhérence variable à Shigella, qui est un moyen d’enquête en cours. Les dosages peuvent être redimensionnées proportionnellement aux formats bien plus grands, mais exigeront des modifications au protocole qui peuvent réduire l’efficacité expérimentale. Par exemple, les milieux de culture devra être transférée à cuvettes pour enregistrer les valeurs de600 OD avec un spectrophotomètre. En outre, le biofilm teinté de violet de gentiane peut être gratté après une incubation de 30 à 60 min dans l’éthanol à 95 % destain étape et le contenu peut être transféré à une cuvette permettant la lecture de spectrophotomètre à OD540. Il faut lorsque vous jetterez le contenu du biofilm dans chaque puits pour éviter les éclaboussures, et nous avons trouvé qu’il est plus facile après une incubation de 60 min de mise au rebut.
Analyse avec la Shigella, Salmonella et pathogène e. coli4 a démontré une observation répétée que la formation de biofilm se produit dans une échelle de temps accéléré (moins de 24 h) pour les pathogènes entériques exposés aux sels biliaires. Contrairement à d’autres bactéries qui ont besoin de 48 à 72 h pour observer la formation de biofilm dans des conditions normales, induite par les sels biliaires entérique biofilm commence dès 4 h avec la phase d’adhésion initiale. Par la suite, formation EPS de la matrice est évidente 6 h, et maturation s’effectue par 24h. Par conséquent, le phénotype de l’adhérence après 24 h peut être trop robuste pour décrypter le rôle des facteurs d’adhésion différent dans la formation de biofilm. Les premières analyses, par exemple dès 4 h, permettant l’identification des facteurs importants dans la formation de biofilm précoce qui serait par ailleurs manquer à un moment ultérieur. Enfin et comme mentionné plus haut dans les étapes du protocole, la formation de biofilm induite sur les sels biliaires pour Shigella n’a pas décelée en l’absence de glucose4. Étant donné que la matrice de l’EPS est composée principalement de polysaccharides et est une étape essentielle dans la formation de biofilm pour la plupart bactéries38, la présence de glucose ou autre sucre dans les médias est probablement importante d’observer la formation de biofilm. Selon la bactérie pathogène analysée, des formulations de différents médias de base peuvent être nécessaires.
La formation de biofilm est un processus multicouche qui se produit souvent dans un système ouvert où des flux de nutriments et des mouvements fluides facilement produisent1,2,3. Les méthodes sont limités par la culture fermée et les exigences de croissance statique ; Cependant, les méthodes permettent l’évaluation de la formation de biofilm en laboratoire. Sur identification du phénotype biofilm, plus expériences utilisant des cellules de fluide ou de la culture continue stratégies39,40,41 peut éclairer supplémentaires mécaniste sur physiologiques et cliniques importance de la formation de biofilm. Pour l’identification de la matrice de l’EPS, les protocoles utilisent la lectine liant le polysaccharide ConA. ConA lie les résidus α-D-glucosyl ou stériquement-étroitement apparentées,42. Lectines différentes peuvent être nécessaires selon le type d’EPS produites pour différents genres ou espèces. Une autre stratégie pour identifier la production d’EPS est la spectrométrie de masse, qui fournira les deux vérification que l’EPS est produit et déterminer la composition de la matrice EPS43,44. En outre, l’utilisation du contre-colorant DAPI peut entraîner de luminosité importante compte tenue du nombre de bactéries présentes dans le biofilm ou la présence d’ADN extracellulaire qui est souvent présent dans les EPS matrice45,46.
Il y a des solutions de rechange aux méthodes ci-dessus décrites dans la littérature. Par exemple, l’analyse de phase solide fixation a été signalé devant servir à d’autres agents pathogènes (par exemple, les références4,25,47,48,49). Il y a des modifications au Protocole entre publications ; et, par conséquent, les stratégies présentées ici sont un format facile à reproduire. Il est important de noter que les protocoles spécifient des biofilms séchage à l’air avant la coloration (étape 3.10), alors que certains groupes préfèrent fixer des biofilms. Les deux approches différentes peuvent représenter différentes stratégies d’agents pathogènes spécifiques. En outre, en préparant la tache violette en cristal dans l’eau, un phénotype de la formation de biofilm conforme a été détecté. Autres groupes utilisent l’éthanol de solubiliser le violet de gentiane ; qui pour les Shigella, déstabilisaient des biofilms et compromis reproductibilité. Nous étudions actuellement les facteurs qui peuvent être éthanol soluble dans le biofilm de Shigella . Un autre exemple est la quantification de la production d’EPS par coloration de ConA. Une méthode de détection par fluorescence plaque à 96 puits (étape 4.1) est présentée pour déterminer les valeurs semi-quantitative qui reflète la quantité de conjugué FITC ConA une liaison avec le biofilm. À notre connaissance, la méthode est la première fois, cette stratégie a été signalée. Détection d’EPS par examen microscopique est acceptée dans la littérature et permet une stratégie différente, mais complémentaires, de visualiser des EPS. La détection de fluorescence semiquantitative combinée avec la détection microscopique confocale d’EPS certainement renforcé les données, en particulier compte tenues des limites de la procédure de contre-colorant DAPI dans l’analyse de microscopie décrit ci-dessus. En tout, une force importante dans l’ensemble des tests décrits ici est que chaque technique complète une autre approche pour donner naissance à une évaluation dynamique de la formation de biofilm induite sur les sels biliaires chez les agents pathogènes entériques.
Les sels biliaires et virulentes biofilms sont reprises dans le paradigme de la pathogénie bactérienne entérique, il est prévu que ces méthodes seront utilisées pour valider les modèles, identifier les rôles des gènes spécifiques, identifier les gènes de fonction inconnue et fournir caractérisation générale des souches cliniques. Cette approche à multiples facettes permet l’identification des gènes importants dans un aspect de la formation de biofilm qui peut-être être perdue une fois les biofilms à maturité est établie, ce qui permet donc l’identification des fonctions spécialisées de chaque composante bactérienne de la biofilm. Par ailleurs, comme en témoigne le fait que l’adaptation des agents pathogènes dans l’intestin humain est un phénomène rapide produit, le rôle de la formation de biofilm induite sur les sels biliaires est un exemple d’un phénomène récemment apprécié, conservé et critique qui se trouve dans Shigella infection, mais aussi les autres entéropathogènes.
Déclarations de divulgation
Les auteurs n’ont aucune divulgation.
Remerciements
Nous remercions Rachael B. Chanin et Alejandro Llanos-Chea pour l’assistance technique. Nous remercions Anthony T. Maurelli, Bryan P. Hurley, Alessio Fasano, Brett E. Swierczewski et Bobby Cherayil pour les souches utilisées dans cette étude. Ce travail a été soutenu par l’Institut National des allergies et K22AI104755 de subvention des maladies infectieuses (L.C.R.). Le contenu est la seule responsabilité des auteurs et ne représente pas nécessairement l’opinion officielle de la National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Tryptic Soy Broth | Sigma-Aldrich | 22092-500G | |
| Crystal Violet | Sigma | C6158-50 | |
| Concanavalin-A FITC | Sigma | C7642-10mg | |
| Glucose | Sigma | G7021-1KG | |
| Bile Salts | Sigma | B8756-100G | |
| LB Agar | Sigma | L7533-1KG | |
| 14 mL culture tubes, 17 x 100 mm, plastic, sterile | Fisher | 14-959-11B | |
| Vectashield hard-set antifade with DAPI | Vector Laboratories | H-1500 | |
| Formaldehyde | Sigma-Aldrich | F1635-500 | |
| Gluteraldehyde | Sigma-Aldrich | G6257 | |
| Flat-bottomed 96-well plates (clear) | TPP | 92696 | |
| Flat-bottomed 96-well plates (black) | Greiner Bio-One | 655076 | |
| Flat-bottomed 24-well plates (clear) | TPP | 92424 | |
| Glass coverslips 12mm, round | Fisher | 08-774-383 | |
| 96-well plate reader | Spectramax | ||
| Flourescent plate reader | Biotek Synergy 2 | ||
| Confocal or Fluorescent Microscope | Nikon A1 confocal microscope | ||
| 37°C Shaking Incubator | New Brunswick Scientific Excella E25 | ||
| 37°C Plate Incubator | Thermolyne Series 5000 |
Références
- Joo, H. -. S. S., Otto, M. Molecular basis of in vivo biofilm formation by bacterial pathogens. Chem Biol. 19 (12), 1503-1513 (2012).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm Formation as Microbial Development. Annu Rev Microbiol. 54 (1), 49-79 (2000).
- Donlan, R. M. Biofilm Formation: A Clinically Relevant Microbiological Process. Clin Infect Dis. 33 (8), 1387-1392 (2001).
- Nickerson, K. P., et al. Analysis of Shigella flexneri resistance, biofilm formation, and transcriptional profile in response to bile salts. Infect Immun. 85 (6), (2017).
- Ridlon, J. M., Kang, D. -. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47 (2), 241-259 (2006).
- Sistrunk, J. R., Nickerson, K. P., Chanin, R. B., Rasko, D. A., Faherty, C. S. Survival of the fittest: How bacterial pathogens utilize bile to enhance infection. Clin Microbiol Rev. 29 (4), (2016).
- Prouty, A. M., Schwesinger, W. H., Gunn, J. S. Biofilm formation and interaction with the surfaces of gallstones by Salmonella spp. Infect Immun. 70 (5), 2640-2649 (2002).
- Crawford, R. W., Gibson, D. L., Kay, W. W., Gunn, J. S. Identification of a bile-induced exopolysaccharide required for Salmonella biofilm formation on gallstone surfaces. Infect Immun. 76 (11), 5341-5349 (2008).
- Crawford, R. W., Reeve, K. E., Gunn, J. S. Flagellated but not hyperfimbriated Salmonella enterica serovar Typhimurium attaches to and forms biofilms on cholesterol-coated surfaces. J Bacteriol. 192 (12), 2981-2990 (2010).
- Crawford, R. W., Rosales-Reyes, R., Ramírez-Aguilar, M. d. e. l. a. L., Chapa-Azuela, O., Alpuche-Aranda, C., Gunn, J. S. Gallstones play a significant role in Salmonella spp. gallbladder colonization and carriage. Proc Natl Acad Sci U S A. 107 (9), 4353-4358 (2010).
- Koestler, B. J., Waters, C. M. Bile acids and bicarbonate inversely regulate intracellular cyclic di-GMP in Vibrio cholerae. Infect Immun. 82 (7), 3002-3014 (2014).
- Svensson, S. L., Pryjma, M., Gaynor, E. C. Flagella-mediated adhesion and extracellular DNA release contribute to biofilm formation and stress tolerance of Campylobacter jejuni. PLoS One. 9 (8), e106063 (2014).
- Martinez-Medina, M., et al. Biofilm formation as a novel phenotypic feature of adherent-invasive Escherichia coli (AIEC). BMC Microbiol. 9 (1), 202 (2009).
- Naves, P., et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. J Appl Microbiol. 105 (2), 585-590 (2008).
- Danese, P. N., Pratt, L. A., Dove, S. L., Kolter, R. The outer membrane protein, Antigen 43, mediates cell-to-cell interactions within Escherichia coli biofilms. Mol Microbiol. 37 (2), 424-432 (2000).
- Nickerson, K. P., McDonald, C. Crohn's disease-associated adherent-invasive Escherichia coli adhesion is enhanced by exposure to the ubiquitous dietary polysaccharide maltodextrin. PLoS One. 7 (12), e52132 (2012).
- Paddock, S. W. Confocal laser scanning microscopy. Biotechniques. 27 (5), (1999).
- Paddock, S. W. Principles and practices of laser scanning confocal microscopy. Mol Biotechnol. 16 (2), 127-149 (2000).
- Paddock, S. Over the rainbow: 25 years of confocal imaging. Biotechniques. 44 (5), (2008).
- Paddock, S. W., Eliceiri, K. W. Laser scanning confocal microscopy: history, applications, and related optical sectioning techniques. Methods Mol Biol. 1075, 9-47 (2014).
- Nataro, J. P., Steiner, T., Guerrant, R. L. Enteroaggregative Escherichia coli. Emerg Infect Dis. 4 (2), 251-261 (1998).
- Nesper, J., Lauriano, C. M., Klose, K. E., Kapfhammer, D., Kraiss, A., Reidl, J. Characterization of Vibrio cholerae O1 El tor galU and galE mutants: influence on lipopolysaccharide structure, colonization, and biofilm formation. Infect Immun. 69 (1), 435-445 (2001).
- Hadjifrangiskou, M., et al. Transposon mutagenesis identifies uropathogenic Escherichia coli biofilm factors. J Bacteriol. 194 (22), 6195-6205 (2012).
- Rahimpour, M., et al. GlgS, described previously as a glycogen synthesis control protein, negatively regulates motility and biofilm formation in Escherichia coli. Biochem J. 452 (3), 559-573 (2013).
- Sharma, V. K., Kudva, I. T., Bearson, B. L., Stasko, J. A. Contributions of EspA Filaments and Curli Fimbriae in Cellular Adherence and Biofilm Formation of Enterohemorrhagic Escherichia coli O157:H7. PLoS One. 11 (2), e0149745 (2016).
- Keto-Timonen, R., Hietala, N., Palonen, E., Hakakorpi, A., Lindström, M., Korkeala, H. Cold Shock Proteins: A Minireview with Special Emphasis on Csp-family of Enteropathogenic Yersinia. Front Microbiol. 7, 1151 (2016).
- Pöntinen, A., Markkula, A., Lindström, M., Korkeala, H. Two-Component-System Histidine Kinases Involved in Growth of Listeria monocytogenes EGD-e at Low Temperatures. Appl Environ Microbiol. 81 (12), 3994-4004 (2015).
- Regeard, C., Mérieau, A., Guespin-Michel, J. F. A bioluminescence assay for screening thermoregulated genes in a psychrotrophic bacterium Pseudomonas fluorescens. J Appl Microbiol. 88 (1), 183-189 (2000).
- Markkula, A., Mattila, M., Lindström, M., Korkeala, H. Genes encoding putative DEAD-box RNA helicases in Listeria monocytogenes EGD-e are needed for growth and motility at 3°C. Environ Microbiol. 14 (8), 2223-2232 (2012).
- Fux, C. A., Shirtliff, M., Stoodley, P., Costerton, J. W. Can laboratory reference strains mirror "real-world" pathogenesis?. Trends Microbiol. 13 (2), 58-63 (2005).
- Takai, S., Sekizaki, T., Ozawa, T., Sugawara, T., Watanabe, Y., Tsubaki, S. Association between a large plasmid and 15- to 17-kilodalton antigens in virulent Rhodococcus equi. Infect Immun. 59 (11), 4056-4060 (1991).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Loss of pigmentation in Shigella flexneri 2a is correlated with loss of virulence and virulence-associated plasmid. Infect Immun. 43 (1), 397-401 (1984).
- Kopecko, D. J., Washington, O., Formal, S. B. Genetic and physical evidence for plasmid control of Shigella sonnei form I cell surface antigen. Infect Immun. 29 (1), 207-214 (1980).
- Faherty, C. S., Redman, J. C., Rasko, D. A., Barry, E. M., Nataro, J. P. Shigella flexneri effectors OspE1 and OspE2 mediate induced adherence to the colonic epithelium following bile salts exposure. Mol Microbiol. 85 (1), 107-121 (2012).
- Kobayashi, H., Oethinger, M., Tuohy, M. J., Procop, G. W., Bauer, T. W. Improved detection of biofilm-formative bacteria by vortexing and sonication: a pilot study. Clin Orthop Relat Res. 467 (5), 1360-1364 (2009).
- de Oliveira Ferreira, T., et al. Microbial investigation of biofilms recovered from endotracheal tubes using sonication in intensive care unit pediatric patients. Braz J Infect Dis. 20 (5), 468-475 (2016).
- Petruzzi, B., Briggs, R. E., Swords, W. E., De Castro, C., Molinaro, A., Inzana, T. J. Capsular Polysaccharide Interferes with Biofilm Formation by Pasteurella multocida Serogroup A. MBio. 8 (6), e01843-e01817 (2017).
- Payne, D. E., Boles, B. R. Emerging interactions between matrix components during biofilm development. Curr Genet. 62 (1), 137-141 (2016).
- Huang, R., Li, M., Gregory, R. L. Bacterial interactions in dental biofilm. Virulence. 2 (5), 435-444 (2011).
- Buswell, C. M., Nicholl, H. S., Walker, J. T. Use of continuous culture bioreactors for the study of pathogens such as Campylobacter jejuni and Escherichia coli O157 in biofilms. Methods Enzymol. 337, 70-78 (2001).
- McBain, A. J. Chapter 4 In Vitro Biofilm Models. Adv Appl Microbiol. 69, 99-132 (2009).
- Schiefer, H. G., Krauss, H., Brunner, H., Gerhardt, U. Ultrastructural visualization of surface carbohydrate structures on mycoplasma membranes by concanavalin A. J Bacteriol. 124 (3), 1598-1600 (1975).
- Liener, I. . The Lectins: Properties, Functions and Applications in Biology and Medicine. , (1986).
- Wittmann, V., Pieters, R. J. Bridging lectin binding sites by multivalent carbohydrates. Chem Soc Rev. 42 (10), 4492-4503 (2013).
- Wang, S., et al. The exopolysaccharide Psl-eDNA interaction enables the formation of a biofilm skeleton in Pseudomonas aeruginosa. Environ Microbiol Rep. 7 (2), 330-340 (2015).
- Okshevsky, M., Meyer, R. L. The role of extracellular DNA in the establishment, maintenance and perpetuation of bacterial biofilms. Crit Rev Microbiol. 41 (3), 341-352 (2015).
- Xu, D., Zhang, W., Zhang, B., Liao, C., Shao, Y. Characterization of a biofilm-forming Shigella flexneri phenotype due to deficiency in Hep biosynthesis. PeerJ. 4, e2178 (2016).
- O'Toole, G. A. Microtiter Dish Biofilm Formation Assay. J Vis Exp. (47), (2011).
- Nickerson, K. P., McDonald, C. Crohn's Disease-Associated Adherent-Invasive Escherichia coli Adhesion Is Enhanced by Exposure to the Ubiquitous Dietary Polysaccharide Maltodextrin. PLoS One. 7 (12), (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon