Method Article
胆汁盐诱导肠道病原菌生物膜形成的鉴别和定量技术
摘要
该协议使读者能够分析胆汁盐诱导的肠道致病菌的生物膜形成, 采用多层面的方法来通过评估附着体、胞外高分子物质基质形成来捕获细菌生物膜的动态特性,和分散。
摘要
生物膜形成是一种动态的、多级的过程, 在恶劣的环境条件下或受压力的时代发生在细菌中。对于肠道病原体, 在胃肠道转运和胆汁暴露过程中, 引起了明显的应力反应, 这是人类消化的正常成分。为了克服胆汁的杀菌作用, 许多肠道病原体形成生物膜假说, 允许在小肠中转时存活。在这里, 我们提出了定义生物膜形成的方法, 通过固相粘附测定, 以及胞外高分子物质 (EPS) 矩阵检测和可视化。此外, 还提出了生物膜色散评估法, 模拟了在感染过程中引发细菌释放的事件的分析。在高通量的96井板粘附试验中, 用结晶紫染色法检测粘附细菌。eps 生产评价由两种方法确定, 即 eps 基质的显微染色和荧光共轭多糖结合凝集素的半定量分析。最后通过菌落计数和电镀来测量生物膜的分散性。来自多种化验的阳性数据支持生物膜的特性, 可用于鉴别其他细菌菌株中的胆汁盐诱导生物膜的形成。
引言
生物膜形成是恶劣环境条件下引起的一种重要的细菌生存策略。暴露在杀菌化合物如抗生素或营养或氧的变化, 导致细菌的压力状态, 可以通过生物膜形成缓解。生物膜的特点是细菌附着于表面或其他细菌, 并伴随着一个 EPS 矩阵的分泌, 主要由多糖1,2,3。生物膜形成是一个动态过程, 其中一连串事件的高潮形成一个成熟的黏附细菌社区1,2,3。细菌产生 adhesins, 以方便早期附着, 而转移黏附基因表达谱, 以加强附着在生物膜成熟。同时, EPS 生产发生在基质中覆盖细菌群落, 以保护细胞不受初始压力源的侵害。生物膜内含有的细菌生长缓慢;因此, 大多数抗生素都是无效的。此外, 缓慢的增长节省能源, 直到条件改变有利于细菌生长1,2,3。在严酷的条件已经过去了, 细菌分散生物膜和恢复浮游生活方式1,2,3。传统上, 生物膜被观察在表面上, 并代表了持续的临床挑战, 因为感染水库存在于导管和居住设备1,2,3。
最近对几种肠道病原体的生物膜形成进行了描述;感染小肠或结肠的细菌4。对于志贺菌物种,感染发生在人类结肠经胃肠道的大部分转运后。在通过小肠的通道中,志贺菌暴露于胆汁中;一种脂质降解的洗涤剂分泌到肠道, 以促进脂肪的消化, 同时杀死大多数细菌5。肠道病原体具有抵御胆汁6杀菌效果的独特能力。我们最近的分析利用了体内类似的葡萄糖和胆汁盐的组合, 以显示在S. 福氏以及其他种类的志贺菌,致病性大肠杆菌, 和 沙门氏菌4。此前,沙门氏菌 enterica钩伤寒被证明形成胆汁诱导生物膜, 由于在慢性感染期间胆囊的独特殖民化7,8,9, 10. 此外, 以前的研究与弧菌11和弯曲的12表明生物膜形成的反应胆汁。因此, 分析将胆汁诱导的生物膜形成观察扩展到其他病原体, 有助于建立一种保守的肠道病原体对胆汁的反应。不同于慢性生物膜, 其中细菌基因转录是有限的, 细胞衰老可能发生1,2,3, 我们建议, 肠道胆汁诱导生物膜是更短暂的性质。这种瞬态, 剧毒生物膜是虚幻快速拆卸 (如在弥散检测中看到) 和增强的毒力基因表达观察在生物膜的人口4,6。
由于生物膜的形成是一个多方面的, 动态的过程和使用胆汁盐作为一个起始因素最近才被描述的大多数肠道病原体, 使用的工具和技术是独特的和创造性的应用传统方法。因此, 这里提出了三免费战略, 以量化的几个重要特征的胆汁盐诱导生物膜形成, 包括细菌黏附, 生产的 EPS 基质, 和分散的活菌从生物膜。这些技术主要用于研究与志贺菌;因此, 评估其他肠道病原体可能需要优化。然而, 来自所有三种化验的阳性数据都支持生物膜的鉴定, 并建立了胆汁盐诱导生物膜形成的可再生的协议。
研究方案
1. 试剂的制备
- 胆汁盐培养基: 制备含有0.4% 胆汁盐 (重量/容积) 的胰蛋白酶大豆汤 (并用重悬), 50 毫升蒸压的200毫克胆汁盐。使用0.22 µm 过滤器进行杀菌消毒。每周制作新鲜媒体。
注: 经常使用的胆汁盐是1:1 混合胆酸钠和脱氧钠, 从绵羊和牛胆囊分离。如前所示的4, 胆汁盐诱导的生物膜形成需要葡萄糖的存在。Luria-Bertani (磅) 汤增加了葡萄糖;因此, 在志贺菌和其他肠道病原体分析中, 足以诱发生物膜的形成。根据要分析的细菌, 可能需要不同的葡萄糖浓度或不同的糖要求。 - 0.5% 瓦特/v 水晶紫在水: 溶化 2.5 g 水晶紫罗兰在500毫升蒸馏水。使用0.22 µm 过滤器进行杀菌消毒。
- 刀豆蛋白 (错那县) 共轭异硫氰酸荧光素 (FITC): 重组 1x PBS 的股票。稀释10毫克集中的股票与 400 ul 1x PBS 的最终浓度25µg/毫升, 并保护免受光。
- pbs + 葡萄糖: 溶解0.2 克葡萄糖在10毫升 1x PBS (2% 瓦特/v 葡萄糖决赛)。使用0.22 µm 过滤器进行杀菌消毒。在使用的当天进行新鲜。
- pbs + 胆汁盐: 溶解40毫克在10毫升 1x PBS (0.4% 瓦特/v 胆汁盐决赛)。使用0.22 µm 过滤器进行杀菌消毒。在使用的当天进行新鲜。
- pbs + 葡萄糖和胆汁盐: 溶出40毫克胆汁盐和0.2 克葡萄糖10毫升 1x PBS (0.4% 瓦特/v 胆汁盐和2% 瓦特/v 葡萄糖决赛)。使用0.22 µm 过滤器进行杀菌消毒。在使用的当天进行新鲜。
- 准备 LB 琼脂盘子。
- 甲醛/戊二醛修复: 添加810µL 甲醛 (37% 库存溶液, 3% 最终浓度) 和125µL 戊二醛 (25% 股票溶液, 0.25% 最终浓度) 到14毫升 1x PBS。彻底混合, 并存储在4摄氏度。修复应该是冷的, 以便正确使用。
注意: 修复是有毒的, 需要危险的废物处理。 - Antifade mountant 解决方案: 使用含有 46-diamidino-2 苯基吲哚 (DAPI) 染色的 Antifade mountant 溶液, 抑制免疫荧光显微镜样品漂白, 同时荧光染色细菌的 DNA。
2. 细菌的制备
- 在不育的试管中, 通过接种3毫升的一只独立的菌落, 在一夜之间培养细菌菌株。孵育在37°c 与震动在 225 rpm 为隔夜孵化 (16-24 h)。
注: 每2至4周, 应从冷冻库存中 restreaked 菌株, 并在盘子上保持不超过2周的时间。
3. 固相粘附试验
注: 本试验采用96井板法对粘附细菌进行量化。细菌在平底板上静态生长。洗涤被执行去除不黏附的细菌和黏附的细菌被染用水晶紫罗兰色。水晶紫染色结合肽在细菌细胞壁和可可溶性使用乙醇。根据晶紫保留量确定粘附细菌的数量。
- 设置两个1.5 毫升管。标签用的是 a 和钠 + 胆汁盐 (BS)。
- 在各自的管子上加1毫升的 a 和 b。
- 接种试管与20µL 的隔夜文化 (在1:50 稀释)。
- 在无菌、清、平底、组织培养处理的96井板上, 添加130µL/井适合控制介质, 以三口井作为空白控制。为每种媒体类型 (所用的) 测试设置三个控制井。
- 添加130µL/井的接种培养成三口井, 并重复, 直到所有实验条件被镀三份。
- 4-24 小时孵育在37摄氏度静态。
- 使用板读取器, 记录 OD600。将控制井设置为 "空"。确认控制介质清晰, 无混浊的迹象。如果检测到浊度, 则丢弃实验。如果细菌菌株之间的生长速率有显著差异, 则可使用 OD600值对数据进行规范化。
- 用真空线去除培养基, 轻轻倾斜板, 慢慢地将井下边缘的介质吸走。一定要收集所有的培养基, 而不会扰乱塑料表面的粘附细菌种群。如果 EPS 矩阵是在孵化时间产生的, 矩阵将被可视化为白色沉淀。请勿干扰 EPS 矩阵。
- 用200µL 消毒 PBS 轻轻冲洗一次水井。使用真空线卸下 PBS 清洗。
- 把盘子倒干。允许至少20分钟的干燥。
注: 由于生物膜必须在染色前彻底干燥, 所以该协议可以在这个步骤上暂停几个小时甚至一夜。添加的干燥时间不会改变染色过程, 而不完全干燥将影响定量的结果和重现性。 - 添加150µL 0.5% 水晶紫对每个实验和控制好。
- 室温下孵育5分钟 (RT)。
- 用400µL 的蒸馏水冲洗一次水井。增加的体积有助于去除残余的晶体紫染色从两侧的水井。用真空线卸下清洗。
- 用200µL 蒸馏水冲洗水井五次。用真空线卸下清洗。
注: 彻底清洗对量化很重要。当从蒸馏水中清除空白井, 不含任何残留的结晶紫染色时, 继续下一步。 - 将盘子倒置, 使其免受光线的侵害。确保完全干燥的板材如上所述。
- 用200µL 乙醇 Destain 井。在振动筛上孵出30分钟的盘子。为了避免蒸发, 特别是在更高的温度下, 执行这个步骤在4摄氏度。
- 使用板读取器, 记录 OD540。
注: 晶体紫最大吸光度的波长接近 590 nm。文献报告一个范围从 od540 -od5954,13,14,15,16为水晶紫吸收;因此, 选择一个波长可利用的板阅读器。
4. EPS 矩阵检测
注: 这些免费化验量化和可视化 EPS。在这两种情况下, EPS 被检测使用凝集素来绑定多糖。荧光共轭蛋白允许量化 (步骤 4.1) 或可视化 (步骤 4.2)。
- EPS 的半定量检测
- 设置两个1.5 毫升管。标签与公司或信托 + BS。
- 在各自的管子上加1毫升的 a 和 b。
- 接种试管与20µL 的隔夜文化 (1:50 稀释)。
- 在无菌、黑色、平底、组织培养处理的96井板上, 添加130µL/井适合控制介质, 以三口井作为空白控制。为要测试的每种介质类型设置三控制井。添加130µL/井的接种培养到水井, 并重复, 直到所有实验条件被镀三份。
- 4-24 小时孵育在37摄氏度静态。
- 用吸管将培养基转化为清晰的96井板, 理想情况下是多通道吸管。小心收集所有的培养基, 而不破坏附着的人口和/或在塑料表面上的 EPS。留。
- 在 1x PBS 中使用甲醛/戊二醛的200µL/井, 在 RT 上固定黑色板15分钟。
- 当黏附的人口是固定的, 评估上清分数从步4.1.6。使用板读取器, 记录 OD600。将控制井设置为 "空"。确认控制介质清晰, 无混浊的迹象。如果检测到浊度, 则丢弃实验。
- 或者, 整个化验可以在一个黑色清晰的底部板进行。在这种情况下, 可以记录 OD600值, 并且在继续执行步骤4.1.7 之前可以丢弃区域性媒体。可以使用 OD600值对数据进行规范化, 在这种情况下, 细菌菌株之间的增长率有显著差异。
- 删除修复和处置危险废物。
- 用200µL 的无菌 PBS 轻轻冲洗两次水井。使用真空线去除 PBS 清洗, 方法是轻轻地倾斜盘子, 慢慢地在井的下边缘吸洗。
- 添加150µL/井25µg/毫升错那县 FITC, 并孵育15分钟在 RT。
- 用200µL 的 PBS 轻轻地洗两次。
- 在每个井中添加150µL 的 PBS。记录荧光在 488 nm。
- EPS 生产的共焦显微可视化及生物膜厚度的计算
- 设置两个1.5 毫升管。标签与公司或信托 + BS。
- 在各自的管子上加1毫升的 a 和 b。
- 接种试管与20µL 的隔夜文化 (在1:50 稀释)。
- 建立一个无菌的24井板与12毫米无菌圆形玻璃盖玻片。添加400µL/井适合控制介质到三井作为空白控制。为要测试的每种介质类型设置三控制井。
- 将接种培养基的400µL, 再重复一次, 直到所有实验条件都被电镀。
- 4-24 小时孵育在37摄氏度静态。
- 可视化地确认在该条件下的生长, 生长和 EPS 沉淀 (白色), 在无菌控制井中没有生长和/或白色沉淀。删除上清液。
- 在 1x PBS 中使用甲醛/戊二醛溶液的200µL/井, 在 RT 上固定15分钟。
- 删除修复和处置危险废物。
- 用200µL 的无菌 PBS 轻轻冲洗两次水井。使用真空线卸下 PBS 清洗。
- 添加150µL/井25µg/毫升错那县 FITC 和孵化15分钟的 RT。
- 轻轻洗两次与200µL/井的 PBS。
- 安装与 DAPI antifade mountant 解决方案。
注意: 该解决方案是一个现成的, 甘油为基础的安装解决方案, 其中含有 DAPI 保存荧光标签, 同时染色的 DNA 在细菌细胞, 以可视化为 counterstain。在成像样品之前, 按照试剂盒的指示和建议进行潜伏期。在应用不含 DAPI 的 antifade mountant 解决方案之前, 可以执行 DAPI 染色过程。 - 用共焦显微镜评价。在共聚焦显微镜下, 将激光器设置为 495 nm/519 nm FITC 可视化的激发/发射。设置第二个激光到 360 nm/460 nm 激发/发射可视化 DAPI。通过聚焦 DAPI 通道找到生物膜。使用 DAPI 和 FITC 通道来确定整个厚度并设置上、下成像边框。在将外围设置为 z 堆栈的顶部和底部后, 每0.25 µm 捕获图像, 记录全厚度的 z 堆栈图像。有关共聚焦显微学的更多信息, 请参阅围场et 等的出版物。17,18,19,20
- 重建 ImageJ (https://imagej.nih.gov/ij/) 中的3D 图像, 以可视化全生物膜形成, 并计算生物膜厚度。为福氏胆汁盐诱导的生物膜获得的平均厚度为14µm4。
5. 色散测定法
注: 在本试验中, 检测到生物膜通过细菌分散而拆卸。在这里, 成熟的生物膜建立和随后 (通常第二天), 媒体被替换为 pbs 或补充 pbs。然后对上清部分进行评估, 以定量与生物膜分离的细菌数量。
- 设置两个1.5 毫升管。标签与公司或信托 + BS。
- 在各自的管子上加1毫升的 a 和 b。
- 接种试管与20µL 的隔夜文化 (在1:50 稀释)。
- 在无菌、清、平底、组织培养处理的96井板上, 添加130µL/井适合控制介质, 以三口井作为空白控制。为要测试的每个介质类型设置三个控制井。
- 添加130µL/井的接种培养到三口井, 并重复, 直到所有实验条件被镀三份。
- 在37摄氏度静态地孵化 4-24 小时的板材。
- 在继续之前, 温暖 pbs, pbs + 葡萄糖, pbs + 胆汁盐和 pbs + 胆汁盐 + 葡萄糖到37°c。每天新鲜地准备这些试剂。
- 使用板读取器, 记录 OD600。将控制井设置为 "空"。确认介质清晰, 无浑浊的迹象。如果检测到浊度, 则丢弃实验。如果细菌菌株之间的生长速率有显著差异, 则可使用 OD600值对数据进行规范化。
- 使用真空线去除培养基。一定要收集所有的培养基, 而不破坏塑料表面的附着填充。
- 用200µL 的无菌 PBS 轻轻冲洗两次水井。使用真空线卸下 PBS 清洗。
- 将以下130µL/井的洗涤更换为三口井: pbs、pbs + 葡萄糖、pbs + 胆汁盐、pbs + 胆汁盐 + 葡萄糖。这些试剂必须预先预热到37摄氏度。
- 在37摄氏度孵育30分钟的盘子。
- 小心地从37°c 的孵化器中取出盘子。把上清液转移到一个新鲜的, 不育的96井板。
- 使用96井板或稀释块, 准备10倍 (1:10) 连续稀释的上清成无菌 PBS。
注: 稀释系列应从未稀释到 10-6不等, 具体取决于要测试的细菌应变。可以进行试验以确定最佳稀释范围。 - 斑点板5µL 每稀释到 LB 琼脂使用多通道吸管。孵化在37°c 过夜。计数殖民地在第二天和解释稀释因素, 当确定恢复殖民地形成单位 (CFU)。要计算相对于 1x pbs 控件的百分比色散 (设置为 100%), 请从 1x pbs 控制示例中的恢复 CFU 划分每个处理条件的恢复 CFU。
注意: 常规培养基板对于细菌性菌株也可以使用。例如,志贺菌可以在刚果红板上电镀。确保板材干燥, 以适当的电镀工艺。
结果
在图 1中, 在含有胆汁盐的培养基的生长过程中, 大多数六种肠道病原体均诱导生物膜形成。在几乎所有的菌株中都能观察到胆汁盐暴露后黏附细菌的显著增加。异常是 enteroaggregative大肠杆菌(EAEC);但是, 请注意对Δ aaf突变4的诱导观察。结果表明, 在没有聚集黏附放线菌菌毛 I (AAF)21 的情况下, EAEC 中胆盐暴露会诱发附加黏附机制。若要从该数据集中得出结论, 请为测试的每个应变和媒体类型绘制 OD540值。比较媒体控制 (BS) 中每个应变的值相对于含胆汁盐的介质, 将决定胆汁盐是否会显著诱发生物膜的形成。对细菌菌株和/或突变体的比较也可以进行进一步的表征分析。
EPS 的错那县 FITC 评估显示在图 2中。图 2A表示对 EPS 生产的半定量评估, 其中错那县 FITC 用于对生物膜进行着色。错那县与 EPS 基质中的多糖结合, 并通过荧光板读取器检测到保留的量。提出数据, 绘制每个条件的平均荧光单元, 并将生物膜诱导条件与负控制进行比较。此外, 可以进行不同菌株或突变体的比较。分析一个仅限媒体、负控制以确定错那县 FITC 荧光的量是非常关键的。在胆汁盐暴露后, 该条件与培养基控制无显著差异, 而荧光读数明显增加。数据证实, EPS 生产表明生物膜形成, 并没有发生在没有胆盐为福氏。福氏中的胆汁盐诱导生物膜的图像在图 2B中表示.错那县-FITC 用于染色 EPS 基质中的多糖, 而 DAPI counterstain 则用于对细菌进行染色, 使其可视化。对于不接触胆汁盐的细菌 (阴性对照), 只检测到 DAPI。值得注意的是, 细菌的密度远低于胆汁盐的情况。FITC 通道的清晰背景表明了 EPS 生产的不足。如预期的那样, 数据表明 EPS 生产与生物膜形成相关,1,2,3后胆盐暴露。本文提供了胆汁盐处理样品中的错那县染色控制, 以证明 FITC 荧光的特异性。对于这些图像, 1x PBS 用于取代错那县-FITC 和 DAPI counterstain 保持。成像可以使用共聚焦显微镜来评估生物膜的厚度与 EPS 阳性样品4。
通过在 pbs 或辅 pbs 中孵化已建立的生物膜, 检测到图 3中生物膜的细菌分散。从生理上来说, 胆汁吸收在小肠内循环, 只有5% 的胆汁进入结肠5。当志贺菌侵入结肠上皮时, 我们推测胆汁的吸收是生物膜弥散的重要信号。在这个数字中, 弥散发生在暴露于 pbs 或 pbs + 葡萄糖的生物膜中;然而, 无论葡萄糖是否存在, PBS + 胆汁盐中的弥散都是被抑制的。数据表明, 胆汁盐的去除是必要的, 足以使S. 福氏从胆汁盐诱导的生物膜中扩散到4。为了绘制数据, 可以绘制细菌的恢复 CFU 或控件的相对百分比 (如下所示)。
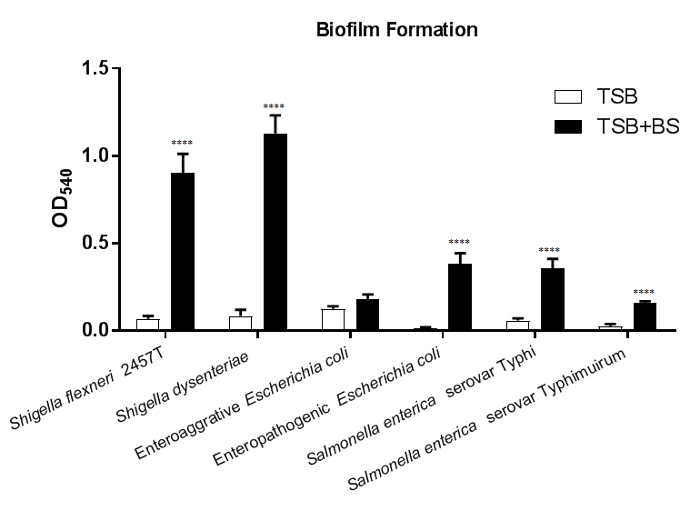
图 1: 胆汁盐导致肠道病原体的生物膜形成.18 h 生物膜生长在组织培养处理96井板, 无论是在一个或0.4% 胆汁盐介质和染色0.5% 水晶紫。用分光光度法测定了结晶紫染色中乙醇溶出量的定量值540。胆汁盐暴露在 志贺菌福氏、 S. 痢疾、致病大肠杆菌、沙门氏菌 enterica钩伤寒和 enterica 钩的沙门氏菌中明显增加生物膜的形成。统计意义是由学生的 T 检验的每个菌株比较胆汁盐治疗与媒体控制。平均值 (SEM) 的标准误差由误差条表示。所有p值均为 < 0.0001。显示的数据来自一个 (n = 3) 具有代表性的实验, 其中提供了以前出版物4中的完整数据集。请单击此处查看此图的较大版本.

图 2: 胆汁盐诱导的生物膜形成的特点是生产的 EPS 矩阵, 检测与 FITC 标记刀豆蛋白a。(A) 无菌黑色, 96 井板被种子与S. 福氏在1:50 稀释成了错那县或 + 胆汁盐并且生长了 18 h. 生物膜被固定, 轻轻冲洗, 并沾上了-FITC。保留刀豆蛋白的数量 FITC 是由荧光板读取器确定的。所绘制的值显示了在福氏的增长后的 EPS 量化, 这些数据是由在美国或包含的胆汁盐中生长的。意义由单向方差分析确定, p值为 < 0.01。SEM 由误差条表示。显示的数据来自一个 (n = 3) 具有代表性的实验, 其中提供了以前出版物4中的完整数据集。(B) 由胆汁盐诱发的志贺氏菌生物膜的显微图像。无菌盖玻片的种子为福氏, 在1:50 的稀释中为18小时。盖玻片随后被固定并沾上错那县-FITC 和/或复染与 DAPI。错那县-FITC 只在胆汁盐条件下检测到, 因为 EPS 基质存在。盖玻片只用 DAPI 的一种染色法 + 胆汁盐处理, 用于演示共焦显微镜下 FITC 设置的最小背景荧光。每个波长通道和复合叠加的图像为所有处理条件提供。刻度条表示10µm. 所显示的数据来自一个 (n = 3) 代表性实验, 并提供了在上一个出版物4中的完整数据集。请单击此处查看此图的较大版本.
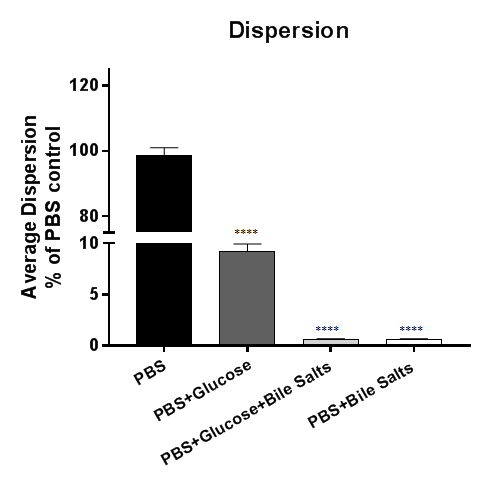
图 3: 从胆汁盐诱导的生物膜中细菌分散的分析.18 h 胆汁盐诱导的志贺氏福氏生物膜被暴露在 pbs 或 pbs 中, 辅以葡萄糖、胆汁盐或葡萄糖和胆汁盐的组合。随后, 上清液被连续稀释和镀在琼脂板块上, 以列举分散生物膜的菌落形成单元 (CFUs)。对恢复的细菌数量进行了相对于 PBS 控制的绘制。细菌在 pbs 或 pbs + 葡萄糖条件下分散于生物膜, 但胆汁盐的存在足以抑制生物膜中的细菌分散。显示的数据来自一个 (n = 3) 具有代表性的实验, 其中提供了以前出版物4中的完整数据集。为参考, 100 倍多的细菌定期从 pbs 控制治疗 (大约 7 x 107 CFU) 与 pbs + 胆盐治疗相比 (大约 7 x 105 CFU)。意义由单向方差分析确定, p值为 < 0.0001。SEM 由误差条表示。
讨论
由于生物膜的动态性质以及菌株、材料、实验室和化验结果之间的变异性, 生物膜形成的分析具有挑战性。本文提出了在胆盐暴露后肠道病原体中生物膜形成的几种策略, 并对其进行了实验研究, 以促进重现性。还有其他的考虑, 以确保重现性。首先, 我们建议执行至少三个独立的实验, 每个与技术 triplicates, 以确认观察和统计意义, 由于可能发生的变化。第二, 使用积极和消极的控制是至关重要的, 以确保化验的重现性。在评价生物膜形成突变体时, 强烈建议将野生型应变作为一种正向控制。此外, 由于对生物膜形成很重要的基因被识别 (例如, 请参阅弧菌22、沙门氏菌7和大肠杆菌23、24、25), 使用生物膜突变体作为阴性对照将验证该检测的重现性。第三, 上述方法的基础是重点研究与志贺菌和S. 福氏,特别是。根据所评估的每个肠道病原体的生长需求, 可能需要对这些协议进行调整。第四、测定细菌应激反应;因此, 在冷冻储存 (-80 °c) 或冷藏 (最高4摄氏度) 的储存盘中, 使用适当维持的细菌不超过两周是至关重要的。值得注意的是, 有些细菌包括耶尔森氏菌属的肠道病原体是耐冷菌, 可在接近 0摄氏度26 的温度下生长。由于冷藏温度下的贮存可以改变细菌生理学, 可能导致基因型或表型转移27,28,29, 强烈建议您准备整除数的存货文化在-80 °c 为常规接种入起始者文化。此外, 与临床分离的工作需要更频繁的 restreaks 从-80 °c 库存, 因为基因转移是迅速观察到, 当转换一个临床上的细菌菌株到实验室设置30,31.特别是与志贺菌分离, 菌株快速适应和表型转移经常发生32,33。建议每月 restreak 一次冷冻储存的细菌, 每两周 restreak 一次。
另一个重要的因素, 以确保重现性是新的准备胆汁盐培养基, 以限制变异的化验。1周以上的胆汁盐介质对新鲜培养基制备的健壮表型有负面影响。此外, 根据所分析的病原体和暴露类型 (小肠与结肠), 可能需要不同的胆汁盐来源和混合物。例如, 个别胆汁盐、共轭和脱共轭源, 或含有额外胆汁成分如胆固醇和胆红素的粗胆汁提取物可使用5,6。志贺菌分析的重点是在结肠感染前小肠转运过程中对宿主的细菌适应。因此, 使用胆酸和脱氧混合的模拟条件的小肠5,6,34。并且关于色散试验 (第5节), 它指定 PBS 补充的试剂将被做新鲜每日和预热到37°c 在化验之前。当使用超过几天的试剂时, 化验的重现性受到严重损害。这也是至关重要的预热这些试剂到37°c, 因为分散不容易发生的室温试剂。最后, 可以使用分散法评估生物膜的完全效价枚举, 其中包括超声波35、36或酶消化37。该方法的目的是评估胆汁盐吸收作为志贺菌从回肠末到结肠的作用。分析的依据是, 胆汁盐的流失会使瞬态生物膜分散, 而志贺菌必须在结肠上皮细胞感染之前分散生物膜4,5.超声波和酶消化等条件代表了生物膜中微生物质量的完全释放, 而此处提出的策略模拟回肠到结肠的过渡, 以捕获志贺菌的生理表型。根据所需的实验条件, 可能需要其他方法进行色散分析或生物膜计数。
该化验的设计是适度高吞吐量的使用96井板, 以使测试多种细菌菌株和/或条件。为进一步保证生物膜形成的重现性, 采用了经组织培养处理的平底、96井板。由于技术上的原因, 平板阅读器无法准确测量圆底板中的吸光度或荧光。另外, 未涂覆的板材在志贺菌,提供可变的黏附物外形, 是当前调查的渠道。测试可以按比例缩放到较大的井格式, 但需要对协议进行修改, 从而降低实验效率。例如, 需要将区域性媒体传输到小试管以分光光度计记录 OD 600 值.此外, 在95% 乙醇 destain 步骤 30-60 分钟的孵化后, 可以刮去水晶紫色生物膜, 并且可以将这些内容转移到试管, 用于在 OD540上进行分光光度计读数。在每井中销毁生物膜的内容时必须小心, 以避免飞溅, 我们发现在60分钟的孵化后, 拆解是容易的。
分析与志贺菌, 沙门氏菌,和致病性大肠杆菌4显示了反复观察, 生物膜形成发生在加速时间尺度 (24 小时内) 的肠道病原体暴露于胆汁盐。与其他需要48到 72 h 的细菌在正常条件下观察生物膜形成相反, 胆汁盐诱导的肠道生物膜早在4小时就开始与初始粘附相结合。随后, EPS 基质形成明显为 6 h, 成熟度为 24 h。因此, 24 小时的粘附表型可能过于健壮, 无法破译不同粘附因子在生物膜形成中的作用。早期的分析, 例如早在4小时内, 可以识别早期生物膜形成中的重要因素, 否则在以后的时间点会被忽略。最后, 如上文所述, 在没有葡萄糖4的情况下, 没有发现胆汁盐诱导的志贺菌生物膜形成。由于 EPS 基质主要由多糖组成, 是大多数细菌的生物膜形成的关键步骤38, 在培养基中存在葡萄糖或其他糖极有可能是观察生物膜形成的重要因素。根据所分析的细菌病原体, 可能需要不同的基质制剂。
生物膜形成是一个多层次的过程, 经常发生在一个开放的系统, 其中养分流量和流体运动容易发生1,2,3。该方法受封闭培养和静态生长要求的限制;然而, 这些方法能够在实验室环境中对生物膜形成进行评估。在识别生物膜表型后, 使用流体细胞或连续培养策略的进一步实验39,40,41可能提供额外的机械洞察到生理或临床生物膜形成的意义。为了识别 EPS 矩阵, 这些协议使用多糖结合凝集素错那县。错那县与葡萄糖或 sterically 密切相关的残滓绑定42。根据不同属或种类的 EPS 类型, 可能需要不同的凝集素。一种用于识别 eps 生产的替代策略是质谱法, 它将提供两种验证, 即 eps 生成并确定 eps 矩阵43,44的组成。另外, 由于生物膜中细菌的数量或胞外 DNA 的发生在 EPS 矩阵45,46中经常出现, DAPI counterstain 的使用可能导致显著的亮度。
在文献中所描述的方法是有选择的。例如, 已报告了用于其他病原体的固相结合试验 (例如, 引用4、25、47、48、49)。在出版物之间有修改协议;因此, 此处介绍的策略是一种易于复制的格式。重要的是要注意, 这些协议指定的空气干燥生物膜染色前 (步骤 3.10), 而一些群体更喜欢修复生物膜。这两种不同的方法可能代表不同病原体的特定策略。另外, 通过制备水中的结晶紫染色, 检测出一致的生物膜形成表型。其他组用乙醇溶解结晶紫;对于志贺氏菌,导致了生物膜的不稳定和重现性的破坏。我们目前正在调查的因素, 可能是乙醇可溶性在志贺菌生物膜。另一个例子是错那县染色对 EPS 生产的量化。提出了一种96井板荧光检测方法 (步骤 4.1), 以确定反映 FITC 共轭错那县与生物膜的结合量的半定量值。据我们所知, 这种方法是第一次报告这种策略。eps 检测通过显微检查被接受的文献, 并允许一个不同的, 但免费的策略, 可视化 EPS。半定量荧光检测与 EPS 共焦显微检测相结合, 肯定加强了数据, 特别是考虑到 DAPI counterstain 程序在上述显微分析中的局限性。总之, 这里所描述的一系列检测方法中的一个显著优势是, 每种技术都补充了另一种途径, 以引起对肠道病原体中胆汁盐诱导的生物膜形成的动态评估。
由于胆汁盐和毒性生物膜被纳入肠道细菌病机的范式, 预计这些方法将用于验证模型, 确定特定基因的作用, 识别未知功能的基因, 并提供临床菌株的一般特征。这种多层面的方法允许鉴定在生物膜形成的一个方面很重要的基因, 一旦成熟的生物膜被建立, 就可能丢失, 因此可以识别生物膜。此外, 由于人类肠道内的病原体适应是一个迅速发生的现象, 因此, 胆汁盐诱导生物膜形成的作用是一个新的被赞赏、保守和关键现象的例子, 发生在志贺菌感染以及其他肠道病原体。
披露声明
作者没有披露。
致谢
我们感谢雷切尔 b. Chanin 和利亚诺斯的技术援助。我们感谢安东尼 t. Maurelli, 布莱恩 p. 赫尔利, 塞科法萨诺, 布雷特 e Swierczewski, 和鲍比 Cherayil 为本研究中使用的菌株。这项工作得到了国家过敏和传染性疾病研究所赠款 K22AI104755 (脑脊液) 的支持。内容完全是作者的责任, 不一定代表国家卫生研究院的官方意见。
材料
| Name | Company | Catalog Number | Comments |
| Tryptic Soy Broth | Sigma-Aldrich | 22092-500G | |
| Crystal Violet | Sigma | C6158-50 | |
| Concanavalin-A FITC | Sigma | C7642-10mg | |
| Glucose | Sigma | G7021-1KG | |
| Bile Salts | Sigma | B8756-100G | |
| LB Agar | Sigma | L7533-1KG | |
| 14 mL culture tubes, 17 x 100 mm, plastic, sterile | Fisher | 14-959-11B | |
| Vectashield hard-set antifade with DAPI | Vector Laboratories | H-1500 | |
| Formaldehyde | Sigma-Aldrich | F1635-500 | |
| Gluteraldehyde | Sigma-Aldrich | G6257 | |
| Flat-bottomed 96-well plates (clear) | TPP | 92696 | |
| Flat-bottomed 96-well plates (black) | Greiner Bio-One | 655076 | |
| Flat-bottomed 24-well plates (clear) | TPP | 92424 | |
| Glass coverslips 12mm, round | Fisher | 08-774-383 | |
| 96-well plate reader | Spectramax | ||
| Flourescent plate reader | Biotek Synergy 2 | ||
| Confocal or Fluorescent Microscope | Nikon A1 confocal microscope | ||
| 37°C Shaking Incubator | New Brunswick Scientific Excella E25 | ||
| 37°C Plate Incubator | Thermolyne Series 5000 |
参考文献
- Joo, H. -. S. S., Otto, M. Molecular basis of in vivo biofilm formation by bacterial pathogens. Chem Biol. 19 (12), 1503-1513 (2012).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm Formation as Microbial Development. Annu Rev Microbiol. 54 (1), 49-79 (2000).
- Donlan, R. M. Biofilm Formation: A Clinically Relevant Microbiological Process. Clin Infect Dis. 33 (8), 1387-1392 (2001).
- Nickerson, K. P., et al. Analysis of Shigella flexneri resistance, biofilm formation, and transcriptional profile in response to bile salts. Infect Immun. 85 (6), (2017).
- Ridlon, J. M., Kang, D. -. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47 (2), 241-259 (2006).
- Sistrunk, J. R., Nickerson, K. P., Chanin, R. B., Rasko, D. A., Faherty, C. S. Survival of the fittest: How bacterial pathogens utilize bile to enhance infection. Clin Microbiol Rev. 29 (4), (2016).
- Prouty, A. M., Schwesinger, W. H., Gunn, J. S. Biofilm formation and interaction with the surfaces of gallstones by Salmonella spp. Infect Immun. 70 (5), 2640-2649 (2002).
- Crawford, R. W., Gibson, D. L., Kay, W. W., Gunn, J. S. Identification of a bile-induced exopolysaccharide required for Salmonella biofilm formation on gallstone surfaces. Infect Immun. 76 (11), 5341-5349 (2008).
- Crawford, R. W., Reeve, K. E., Gunn, J. S. Flagellated but not hyperfimbriated Salmonella enterica serovar Typhimurium attaches to and forms biofilms on cholesterol-coated surfaces. J Bacteriol. 192 (12), 2981-2990 (2010).
- Crawford, R. W., Rosales-Reyes, R., Ramírez-Aguilar, M. d. e. l. a. L., Chapa-Azuela, O., Alpuche-Aranda, C., Gunn, J. S. Gallstones play a significant role in Salmonella spp. gallbladder colonization and carriage. Proc Natl Acad Sci U S A. 107 (9), 4353-4358 (2010).
- Koestler, B. J., Waters, C. M. Bile acids and bicarbonate inversely regulate intracellular cyclic di-GMP in Vibrio cholerae. Infect Immun. 82 (7), 3002-3014 (2014).
- Svensson, S. L., Pryjma, M., Gaynor, E. C. Flagella-mediated adhesion and extracellular DNA release contribute to biofilm formation and stress tolerance of Campylobacter jejuni. PLoS One. 9 (8), e106063 (2014).
- Martinez-Medina, M., et al. Biofilm formation as a novel phenotypic feature of adherent-invasive Escherichia coli (AIEC). BMC Microbiol. 9 (1), 202 (2009).
- Naves, P., et al. Measurement of biofilm formation by clinical isolates of Escherichia coli is method-dependent. J Appl Microbiol. 105 (2), 585-590 (2008).
- Danese, P. N., Pratt, L. A., Dove, S. L., Kolter, R. The outer membrane protein, Antigen 43, mediates cell-to-cell interactions within Escherichia coli biofilms. Mol Microbiol. 37 (2), 424-432 (2000).
- Nickerson, K. P., McDonald, C. Crohn's disease-associated adherent-invasive Escherichia coli adhesion is enhanced by exposure to the ubiquitous dietary polysaccharide maltodextrin. PLoS One. 7 (12), e52132 (2012).
- Paddock, S. W. Confocal laser scanning microscopy. Biotechniques. 27 (5), (1999).
- Paddock, S. W. Principles and practices of laser scanning confocal microscopy. Mol Biotechnol. 16 (2), 127-149 (2000).
- Paddock, S. Over the rainbow: 25 years of confocal imaging. Biotechniques. 44 (5), (2008).
- Paddock, S. W., Eliceiri, K. W. Laser scanning confocal microscopy: history, applications, and related optical sectioning techniques. Methods Mol Biol. 1075, 9-47 (2014).
- Nataro, J. P., Steiner, T., Guerrant, R. L. Enteroaggregative Escherichia coli. Emerg Infect Dis. 4 (2), 251-261 (1998).
- Nesper, J., Lauriano, C. M., Klose, K. E., Kapfhammer, D., Kraiss, A., Reidl, J. Characterization of Vibrio cholerae O1 El tor galU and galE mutants: influence on lipopolysaccharide structure, colonization, and biofilm formation. Infect Immun. 69 (1), 435-445 (2001).
- Hadjifrangiskou, M., et al. Transposon mutagenesis identifies uropathogenic Escherichia coli biofilm factors. J Bacteriol. 194 (22), 6195-6205 (2012).
- Rahimpour, M., et al. GlgS, described previously as a glycogen synthesis control protein, negatively regulates motility and biofilm formation in Escherichia coli. Biochem J. 452 (3), 559-573 (2013).
- Sharma, V. K., Kudva, I. T., Bearson, B. L., Stasko, J. A. Contributions of EspA Filaments and Curli Fimbriae in Cellular Adherence and Biofilm Formation of Enterohemorrhagic Escherichia coli O157:H7. PLoS One. 11 (2), e0149745 (2016).
- Keto-Timonen, R., Hietala, N., Palonen, E., Hakakorpi, A., Lindström, M., Korkeala, H. Cold Shock Proteins: A Minireview with Special Emphasis on Csp-family of Enteropathogenic Yersinia. Front Microbiol. 7, 1151 (2016).
- Pöntinen, A., Markkula, A., Lindström, M., Korkeala, H. Two-Component-System Histidine Kinases Involved in Growth of Listeria monocytogenes EGD-e at Low Temperatures. Appl Environ Microbiol. 81 (12), 3994-4004 (2015).
- Regeard, C., Mérieau, A., Guespin-Michel, J. F. A bioluminescence assay for screening thermoregulated genes in a psychrotrophic bacterium Pseudomonas fluorescens. J Appl Microbiol. 88 (1), 183-189 (2000).
- Markkula, A., Mattila, M., Lindström, M., Korkeala, H. Genes encoding putative DEAD-box RNA helicases in Listeria monocytogenes EGD-e are needed for growth and motility at 3°C. Environ Microbiol. 14 (8), 2223-2232 (2012).
- Fux, C. A., Shirtliff, M., Stoodley, P., Costerton, J. W. Can laboratory reference strains mirror "real-world" pathogenesis?. Trends Microbiol. 13 (2), 58-63 (2005).
- Takai, S., Sekizaki, T., Ozawa, T., Sugawara, T., Watanabe, Y., Tsubaki, S. Association between a large plasmid and 15- to 17-kilodalton antigens in virulent Rhodococcus equi. Infect Immun. 59 (11), 4056-4060 (1991).
- Maurelli, A. T., Blackmon, B., Curtiss, R. Loss of pigmentation in Shigella flexneri 2a is correlated with loss of virulence and virulence-associated plasmid. Infect Immun. 43 (1), 397-401 (1984).
- Kopecko, D. J., Washington, O., Formal, S. B. Genetic and physical evidence for plasmid control of Shigella sonnei form I cell surface antigen. Infect Immun. 29 (1), 207-214 (1980).
- Faherty, C. S., Redman, J. C., Rasko, D. A., Barry, E. M., Nataro, J. P. Shigella flexneri effectors OspE1 and OspE2 mediate induced adherence to the colonic epithelium following bile salts exposure. Mol Microbiol. 85 (1), 107-121 (2012).
- Kobayashi, H., Oethinger, M., Tuohy, M. J., Procop, G. W., Bauer, T. W. Improved detection of biofilm-formative bacteria by vortexing and sonication: a pilot study. Clin Orthop Relat Res. 467 (5), 1360-1364 (2009).
- de Oliveira Ferreira, T., et al. Microbial investigation of biofilms recovered from endotracheal tubes using sonication in intensive care unit pediatric patients. Braz J Infect Dis. 20 (5), 468-475 (2016).
- Petruzzi, B., Briggs, R. E., Swords, W. E., De Castro, C., Molinaro, A., Inzana, T. J. Capsular Polysaccharide Interferes with Biofilm Formation by Pasteurella multocida Serogroup A. MBio. 8 (6), e01843-e01817 (2017).
- Payne, D. E., Boles, B. R. Emerging interactions between matrix components during biofilm development. Curr Genet. 62 (1), 137-141 (2016).
- Huang, R., Li, M., Gregory, R. L. Bacterial interactions in dental biofilm. Virulence. 2 (5), 435-444 (2011).
- Buswell, C. M., Nicholl, H. S., Walker, J. T. Use of continuous culture bioreactors for the study of pathogens such as Campylobacter jejuni and Escherichia coli O157 in biofilms. Methods Enzymol. 337, 70-78 (2001).
- McBain, A. J. Chapter 4 In Vitro Biofilm Models. Adv Appl Microbiol. 69, 99-132 (2009).
- Schiefer, H. G., Krauss, H., Brunner, H., Gerhardt, U. Ultrastructural visualization of surface carbohydrate structures on mycoplasma membranes by concanavalin A. J Bacteriol. 124 (3), 1598-1600 (1975).
- Liener, I. . The Lectins: Properties, Functions and Applications in Biology and Medicine. , (1986).
- Wittmann, V., Pieters, R. J. Bridging lectin binding sites by multivalent carbohydrates. Chem Soc Rev. 42 (10), 4492-4503 (2013).
- Wang, S., et al. The exopolysaccharide Psl-eDNA interaction enables the formation of a biofilm skeleton in Pseudomonas aeruginosa. Environ Microbiol Rep. 7 (2), 330-340 (2015).
- Okshevsky, M., Meyer, R. L. The role of extracellular DNA in the establishment, maintenance and perpetuation of bacterial biofilms. Crit Rev Microbiol. 41 (3), 341-352 (2015).
- Xu, D., Zhang, W., Zhang, B., Liao, C., Shao, Y. Characterization of a biofilm-forming Shigella flexneri phenotype due to deficiency in Hep biosynthesis. PeerJ. 4, e2178 (2016).
- O'Toole, G. A. Microtiter Dish Biofilm Formation Assay. J Vis Exp. (47), (2011).
- Nickerson, K. P., McDonald, C. Crohn's Disease-Associated Adherent-Invasive Escherichia coli Adhesion Is Enhanced by Exposure to the Ubiquitous Dietary Polysaccharide Maltodextrin. PLoS One. 7 (12), (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。