Method Article
Rilevamento della colonizzazione di Escherichia Coli enteroemorragica in murino Host di sistema Non invasivo In Vivo bioluminescenza
In questo articolo
Riepilogo
Un protocollo dettagliato di un modello murino per enteroemorragica e. coli (enteroemorragico EHEC) colonizzazione tramite bioluminescenza-identificati batteri è presentato. La rilevazione di questi batteri bioluminescenti di un non-invasiva in vivo imaging sistema animali vivi può avanzare la nostra comprensione corrente della colonizzazione di EHEC.
Abstract
Enteroemorragica e. coli (enteroemorragico EHEC) O157: H7, che è un agente patogeno portato dagli alimenti che causesdiarrhea, colite emorragica (HS), e la sindrome uremica emolitica (HUS), colonizzare il tratto intestinale degli esseri umani. Per studiare il meccanismo dettagliato della EHEC colonizzazione in vivo, è essenziale disporre di modelli animali per monitorare e quantificare la colonizzazione di EHEC. Dimostriamo qui un modello di colonizzazione del mouse-EHEC trasformando il plasmide di espressione bioluminescente per EHEC per monitorare e quantificare la colonizzazione di EHEC in soggiorno ospiti. Animali inoculati con bioluminescenza-labeled EHEC mostrano segnali bioluminescenti intensi in topi tramite rilevazione con un non-invasiva in vivo imaging sistema. Dopo 1 e 2 giorni dopo l'infezione, bioluminescenti segnali potrebbero essere ancora presente in animali infettati, che suggerisce che EHEC colonizzare in padroni di casa per almeno 2 giorni. Inoltre dimostriamo che questi EHEC bioluminescenti individuare all'intestino del mouse, specificamente nell'intestino cieco e del colon, da immagini di ex vivo . Questo modello di colonizzazione del mouse-EHEC può servire come strumento per far progredire la conoscenza corrente del meccanismo di colonizzazione di EHEC.
Introduzione
EHEC O157: H7 è un patogeno che causa diarrea1, HS2, HUS3e anche insufficienza renale4 attraverso cibo o acqua contaminato. EHEC è un patogeno enterobacterium e colonizza il tratto gastrointestinale di esseri umani1. Quando EHEC prima aderire all'epitelio intestinale host, iniettano i fattori di colonizzazione nelle cellule ospiti attraverso il sistema di secrezione di III tipo (T3SS) che funziona come una siringa molecolare che induce un fissaggio e cancellando (A/E) lesione successivamente per imporre adesione (colonizzazione)5. Questi geni coinvolti nella formazione della lesione A/E codificati per il locus dell'enterocita (LEE) il effacement patogenicità isola5.
Bioluminescenza è una reazione chimica produzione di luce, in cui luciferasi catalizza la luciferina di substrato per generare luce visibile6. Questo processo enzimatico richiede spesso la presenza di ossigeno o l'adenosina trifosfato (ATP)6. Bioluminescenza imaging (BLI) permette ai ricercatori la visualizzazione e la quantizzazione delle interazioni ospite-patogeno in animali vivi7. BLI possono caratterizzare il ciclo di infezione batterica in animali vivi seguendo i batteri bioluminescenti come migrare e invadere i tessuti differenti7; Questo rivela una progressione dinamica dell'infezione. Inoltre, la carica batterica negli animali è relativo al segnale bioluminescenti8; così, è un comodo indicatore per stimare le condizioni patologiche degli animali da esperimento in modo semplice e diretto.
Il plasmide usato qui contenute l'operone luciferasi, luxCDABE, che è il batterio Photorhabdus luminescens che codifica la propria luciferasi substrato7,9. Trasformando questo plasmide esprimendo la luciferasi in batteri, i processi di colonizzazione e l'infezione possono essere monitorati osservando questi batteri bioluminescenti animali vivi. Nel complesso, BLI e bioluminescenza-identificati batteri permettono ai ricercatori di monitorare i numeri batterici e la posizione, la vitalità batterica con antibiotici/terapia trattamento ed espressione genica batterica infezione/colonizzazione6, 7. sono stati segnalati numerosi batteri patogeni che esprimono l'operone luxCDABE per esaminare la loro espressione di ciclo e/o gene di infezione nell'infezione. Questi batteri, tra cui uropathogenic Escherichia coli10, EHEC8,11,12,13, enteropatogeni e. coli (EPEC)8, Citrobacter Rodentium14,15, Salmonella typhimurium16, Listeria monocytogenes17, Yersinia enterocolitica18,19, e Vibrio cholerae20, sono stati documentati.
Parecchi modelli sperimentali sono stati sviluppati per facilitare lo studio di EHEC colonizzazione in vitro e in vivo21,22,23. Tuttavia, c'è una mancanza di adeguati modelli animali per studiare l'EHEC colonizzazione in vivoe quindi una conseguente scarsità di dettagli. Per facilitare lo studio di EHEC colonizzazione meccanismo in vivo, è prezioso per costruire modelli animali per osservare e quantificare la colonizzazione di EHEC animali vivi in un metodo non-invasivo.
Questo manoscritto descrive un modello di colonizzazione del mouse-EHEC che utilizza un sistema di espressione bioluminescente per monitorare la colonizzazione di EHEC nel tempo in soggiorno ospiti. Topi intragastrically vengono inoculati con bioluminescenza-labeled EHEC e viene rilevato il segnale bioluminescente in topi con un non-invasiva in vivo imaging sistema13. I topi infettati con bioluminescenza-labeled EHEC hanno mostrato significativi segnali bioluminescenti in loro intestino dopo 2 giorni dopo l'infezione, che ha suggerito che tali batteri colonizzarono nell'intestino ospite dopo 2 giorni dopo l'infezione. Ex vivo immagine dati hanno mostrato che questa colonizzazione è specificamente nell'intestino cieco e del colon dei topi. Utilizzando questo modello di mouse-EHEC, la colonizzazione di EHEC bioluminescente può essere rilevata nell'ospite vivente da uno in vivo imaging system, per studiare i meccanismi dettagliati della colonizzazione di batteri enterici, che possono promuovere ulteriore comprensione in Cambiamenti fisiologici e patologici indotti da EHEC.
Protocollo
Attenzione: EHEC O157: H7 è un livello di biosicurezza 2 (BSL-2) agente patogeno secondo i Centers for Disease Control and Prevention (CDC) istruzioni di sicurezza biologica (https://www.cdc.gov/). Di conseguenza, tutte le procedure sperimentali che coinvolgono EHEC devono essere effettuate in una struttura di BSL-2. Indossare guanti e camici da laboratorio quando si effettua l'esperimento. Lavorare in una certificato di biosicurezza (BSC). Disinfettare il banco sperimentale prima e dopo la procedura sperimentale con etanolo al 70%. Tutti gli strumenti o attrezzature che EHEC contatto (o potenzialmente contatto) deve essere disinfettata con etanolo al 70% o candeggina. Rifiuti contaminati (o potenzialmente contaminati) dovrebbero essere accuratamente sigillati e sterilizzati in autoclave. Indossare una maschera, occhiali protettivi, guanti doppio o una tuta, se necessario. I topi femminili C57BL/6 di 6-settimana-vecchio sono stati acquistati e mantenuti presso il laboratorio animale Center del National Cheng Kung University (NCKU). Esperimenti sugli animali sono stati approvati dal istituzionale Animal Care e uso Comitato di NCKU (numero di omologazione 104-039).
1. generazione di batteri EHEC Bioluciferase-etichettato
- Mix 50 ng dell'acido deossiribonucleico (DNA), 1 μL ogni 10 μm avanti e indietro primer, 2 μL 2,5 mM deossinucleotidi (dNTP), 2 μL 10 x buffer, 0,2 μL DNA polimerasi e acqua bidistillata sterile (ddH2O) ad un volume finale di 20 μL per amplificare il Cassetta anti-kanamicina, nptII gene24. Il modello di DNA è da pBSL18024, che è stato acquistato da progetto nazionale di BioResource (NBRP). Le condizioni PCR sono elencate nella tabella 1 e sequenza del primer è disponibile nella tabella 2.
- Legare i prodotti di PCR in un vettore di clonazione commerciale seguendo il kit protocollo (Vedi Tabella materiali).
- Asportare il frammento del gene nptII dal vettore di clonazione da NsiI e SmaI e clonare in pBBR1MCS4, che viene digerito dal NsiI e ScaI da pAKlux29 per creare il plasmide resistente kanamicina, pWF27813.
- Asportare l'operone luxCDABE , dalla luciferasi esprimendo plasmide9, pAKlux2, di SpeI-HF e ScaI e clone SpeI-HF e SmaI digerito pWF278 per generare kanamicina resistente e luciferasi esprimendo plasmide, pWF27913.
Nota: Per le estrazioni di plasmide e le purificazioni di frammento asportato, utilizzare l'estrazione commerciale plasmide e il kit di estrazione del gel, rispettivamente. Per digestione degli enzimi, mescolare 100 ng DNA, 1 μL 10 x buffer, 1 μL di ogni selezionato degli enzimi di limitazione e sterile ddH2O ad un volume totale di 10 μL e incubare a 37 ° C per 2,5-3 ore. - Trasformare il plasmide pWF279 in cellule competenti di Escherichia coli O157: H7 EDL933 mediante elettroporazione con 2.500 V per 4 ms.
- Incubare le cellule di batteri trasformati in 1 mL di terreno di Luria-Bertani (LB) a 37 ° C per 1 h.
- Piastra i batteri su una piastra di agar LB completati con 50 µ g/mL di kanamicina a 37 ° C per 16-18 h.
- Controllare il segnale bioluminescente della piastra da uno in vivo imaging macchina il giorno successivo. Scegli una singola Colonia dalla piastra e cultura esso in 3 mL di LB completati con 50 kanamicina µ g/mL a 37 ° C per 16-18 h.
- Preparare il supporto di stock batterico diluendo 100% glicerolo sterile ddH2O per rendere la soluzione di glicerolo di 30%.
- La kanamicina resistente al gelo e. coli O157: H7 EDL933 batteri che harboring il plasmide luciferasi come azione batterica in un tappo a vite cryovial come un rapporto di 1:1 di soluzione di glicerolo cultura e 30% di batteri a-80 ° C. La concentrazione finale del glicerolo è del 15%.
2. preparazione di batteri EHEC bioluminescenti per inoculazione orale
Nota: Il diagramma di flusso di timeline delle procedure sperimentali per la preparazione di EHEC e sonda gastrica orale del mouse è presentato nella Figura 1 per aiutare nella preparazione sperimentale.
- Striscia e. coli O157: H7 EDL933 batteri che harboring plasmide luciferasi su una piastra di agar LB con 50 kanamicina µ g/mL a magazzino di-80 ° C. Crescere i batteri per 16-18 h a 37 ° C.
- Scegliere una singola Colonia dalla piastra durante la notte e la cultura in 3 mL LB medium con 50 kanamicina µ g/mL per 16-18 h in un incubatore a 37 ° C a 220 giri/min.
- Sottocultura i batteri (diluizione 1: 100) in kanamicina (50 µ g/mL) contenenti brodo LB per 2.5-3 h in un incubatore a 37 ° C a 200 giri/min. (Per esempio, aggiungere 2 mL coltivato durante la notte i batteri per mL 200 LB supplementato con kanamicina (50 µ g/mL)).
- Incubare i batteri per 2.5-3 h e misurare il valore di densità ottica a 600 nm (OD600) fino a quando il valore è compreso tra 0,9 a 1. Il numero di cellule batteriche è una densità di8 di circa 10 con unità formanti colonie (CFU) / mL.
- Centrifugare i batteri ri-colti a 8.000 x g per 30 min, 4 ° C.
- Scartare il supernatante senza agitare il pellet di batteri e lavare la pallina con 100 mL 0,9% normale soluzione salina sterile di movimentazione delicata.
- Ripetere i passaggi da 2.5 e 2.6 una volta.
- Dopo il lavaggio, centrifugare la coltura batterica a 8.000 x g per 30 min, 4 ° C e scartare il surnatante delicatamente.
- Condensa il pellet a 100 volte con soluzione salina sterile 0,9%. Per esempio, se sono centrifugati batteri 200 mL, aggiungere 2 mL di normale soluzione salina per sospendere il pellet.
- Confermare i batteri CFU (dovrebbe essere circa 109 CFU/100 μL dopo condensazione in salino normale) i batteri concentrati attraverso una diluizione seriale 10 volte25di placcatura.
3. Mouse Gavage orale di EHEC
- Trattare 6-settimana-vecchi topi C57BL/6 femminili con acqua di streptomicina (5 g/L) per 24 h.
- Dopo 24 h, passare alla normale acqua potabile per un altro 24 h prima sonda gastrica. Dopo il trattamento con acqua normale per 24 h, i topi sono pronti per sonda gastrica orale di EHEC.
- Riempire la siringa con 100 batteri EHEC di μL tirando indietro lo stantuffo. Assicurarsi che non siano bolle d'aria nella siringa. Rimuovere le bolle schioccando la siringa con le dita.
- Sollevare delicatamente l'animale e posizionarlo sulla parte superiore gabbia con cura.
- Afferrare il mouse per la coda con attenzione, e l'animale verrà presa nella parte superiore della gabbia e tentare di allontanare.
- Frenare dolcemente il mouse afferrando la pelle flaccida del collo e sul retro l'animale con pollice e indice per impedire che la testa del mouse in movimento.
- Tenere premuto il mouse in posizione verticale per inserire l'ago sonda gastrica e garantire che la testa del mouse è immobilizzato e verticale.
- Inserire l'ago sonda gastrica in bocca del mouse seguendo il tetto della bocca e spostare verso il basso nell'esofago e verso lo stomaco.
- Quando l'ago inserito è metà o due terzi lunghezza nel topo, iniettare 100 batteri EHEC μL, che contengono circa 10 celle di9 CFU.
4. visualizzazione
- Dopo l'alimentazione mediante sonda gastrica orale, rilevare i segnali bioluminescenti nei giorni 1 e 2.
- Prima di esaminare i segnali bioluminescenti di animali, li anestetizzare inserendole in una camera di 2,5% isoflurane con 1,5 L/min di ossigeno.
- Attendere 2-5 min fino a quando tutti i topi diventano inconscio e si fermano. Gli animali sono pronti per la rilevazione in vivo della bioluminescenza.
- Rilevare e immagine bioluminescenti segnali di animali da uno in vivo imaging system. Vedi sezione 5 "Acquisizione dati" per il funzionamento del software. Durante il processo di imaging, tutti gli animali sono sotto una fornitura continua di 2,5% isoflurane con 1,5 L/min di ossigeno.
- Fare clic su file > dal vivo e manualmente si concentrerà sul mouse.
- Selezionare l'intensità di laser e tempo di esposizione.
- Fare clic su acquisire > catturare.
- Per l'ex vivo imaging, eutanasia i topi di dislocazione cervicale e rimuovere l'intero intestino dei topi infettati. Posizionare l'intestino in una capsula di Petri e immagine a 9 cm dal in vivo imaging sistema. L'impostazione è la stessa come l'in vivo imaging tranne il campo di vista è impostato come A/B. Per dettagli, vedere sezione 5 "Acquisizione dati".
Nota: Il metodo per dislocazione cervicale: frenare i topi sulla parte superiore gabbia afferrando la coda con una mano in modo che gli animali afferrare la gabbia. Posizionare un pennarello o il pollice e l'indice di altra mano contro la parte posteriore del collo alla base del cranio. Spingere in avanti con la mano o un oggetto mentre tratteneva la testa e tirare all'indietro con la mano che tiene la coda rapidamente.
Controllare molto attentamente per confermare l'arresto respiratorio e nessun battito cardiaco.
5. acquisizione dati
Nota: Il software utilizzato per l'acquisizione dati è elencato nella Tabella materiali.
- Per acquisizione di immagini, aprire il pannello di controllo di acquisizione del software (Figura 2).
- Selezionare "Luminescente", "fotografare" e "Overlay".
- Impostare il tempo di esposizione come "Auto". Impostare Binning come "Medio".
- Impostare ƒ/stop come 1 per luminescenti e 8 per fotografia. Ƒ/stop controlli la quantità di luce ricevuta dal sensore CCD.
- Impostare il campo visivo basato sul campo delle immagini che sono di interesse per l'acquisizione. Opzione "D" può montare cinque 6-settimana-vecchi topi e loro immagine tutto in un momento. "C" potete immagine tre 6-settimana-vecchi topi in un campo.
- Una volta che i topi/campioni sono pronti per l'imaging, fare clic su "Acquire" per acquisizione di immagini.
- Aprire i dati di immagine che è stati acquistati.
- Aprire il pannello tavolozza degli strumenti (Figura 3).
- Selezionare strumenti di ROI. Si consiglia il cerchio (quello più a sinistra) alla gamma della zona bioluminescente sulle immagini (Figura 4).
- Fare clic su "Misura ROIs" (icona di matita) per misurare l'intensità bioluminescente superficie (Figura 3). Il pannello di ROI misurazioni e i valori di quantificazione appaiono (Figura 5).
- Utilizzare la misurazione configurare nell'angolo sinistro del pannello misure ROI per selezionare i valori/informazioni necessarie (Figura 6), in caso contrario fare clic su "Esporta" per esportare questa tabella di dati e salvare come file CSV (Figura 5).
- Utilizzare i valori della colonna "Flusso totale (p/s)" come la quantificazione bioluminescenti intensità nel file CSV.
Risultati
Abbiamo amministrato la bioluminescenza-labeled EHEC (~ 109 cellule batteriche) ai topi C57BL/6 femminili 6 - settimana-vecchi mediante sonda gastrica orale. Dopo la somministrazione orale di EHEC ai topi all'interno di 1h, gli animali sono stati esaminati per segnale bioluminescenti secondo il sistema di imaging in vivo come mostrato nella Figura 7. I risultati hanno mostrato un forte segnale bioluminescente in topi di sonda gastrica con bioluminescenza-labeled EHEC. Abbiamo esaminato i segnali su 2 giorni post infezione. Come mostrato in Figura 8A, i topi inoculati con bioluminescenza-labeled selvaggio-tipo EHEC EDL933 ha mostrato segnali bioluminescenti intensi anche dopo 2 giorni dopo l'infezione, che ha suggerito che EHEC colonizzato in padroni di casa da 2 giorni. Abbiamo infettato anche intragastrically bioluminescenza-labeled EDL933ΔrfaD (ΔrfaD) ai topi (Figura 8A). Questo mutante, disertato in lipopolysaccharide (LPS), è stato indicato per ridurre la colonizzazione nell'ospite nel nostro studio precedente. Come mostrato in Figura 8A, non c'è nessun segnale bioluminescente rilevato in ΔrfaD-topi infetti, che suggerisce che non ci sono nessun o meno batteri cellule colonizzarono nei topi. Quantificazione del segnale fluorescente è mostrato in Figura 8B. Successivamente, è stata determinata la posizione di questi batteri bioluminescenza-etichettati. I topi infetti sono stati sacrificati umanamente e loro intero intestino rimosso. Intestini di topi 2 giorni post infezione sono stati posizionati su 9cm di Petri ed imaged ex vivo (Figura 9A). I tessuti intestinali di bioluminescenza-labeled EDL933 infettati topi hanno rivelato un aumento significativo nei segnali bioluminescenti nell'intestino cieco e del colon, che suggeriscono che questi EHEC bioluminescenti colonizzato l'intestino cieco e colon dei topi infettati per 2 giorni al meno. Al contrario, i topi infettati con bioluminescenza-etichetta ΔrfaD (Figura 9A), ha rivelato in diminuzione bioluminescenti segnale nel loro tessuto intestinale, che è coerenza con l'immagine in vivo (Figura 8A ). Quantificazione del segnale fluorescente è mostrato in figura 9B.

Figura 1 : Timeline del diagramma di flusso preparazione sperimentale.
Panoramica dei tempi necessari per preparare batteri bioluminescenti EHEC e pretrattare topi con streptomicina. Preparazione di (A) EHEC. (B) preparazione di topi. Clicca qui per visualizzare una versione più grande di questa figura.
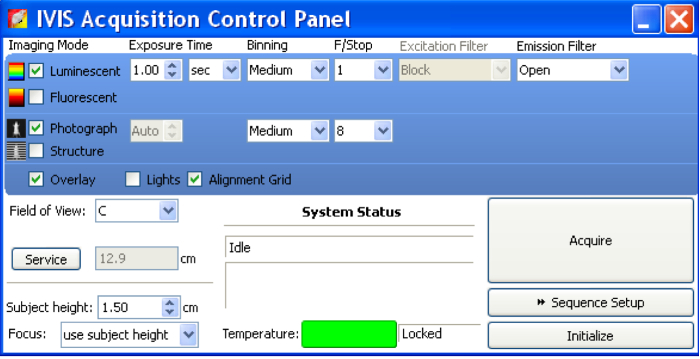
Figura 2 : In vivo Pannello di controllo di acquisizione sistema di imaging.
Prima dell'imaging di campioni, aprire Pannello di controllo di IVIS acquisizione. Selezionare "Luminescente", "fotografare" e "Overlay". Impostare il tempo di esposizione come "Auto". Impostare Binning come "Medio". Impostare ƒ/stop come 1 per luminescenti e 8 per fotografia. Ƒ/stop controlli la quantità di luce ricevuta dal sensore CCD. Una volta che i campioni sono pronti per l'imaging, fare clic su "Acquire" per acquisire immagini. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 : Pannello tavolozza.
Dopo l'immagine di acquisizione, è possibile utilizzare il pannello tavolozza per quantificare l'intensità bioluminescenti. Aprire il pannello tavolozza degli strumenti e i dati di immagine. Scegli uno degli strumenti di ROI per variare i segnali bioluminescenti sulle immagini. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Segnale bioluminescenti da campione per quantificazione.
Area di bioluminescenti segnale sulle immagini circondato dagli strumenti di ROI. Tutti i segnali bioluminescenti mostrati qui sono nel cerchio rosso. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 : Misure di ROI.
Dopo la circonduzione bioluminescenti segnali e cliccando "Misura ROIs" sul pannello tavolozza, i valori sono presentati come mostrato. I valori della colonna flusso totale (p/s) vengono utilizzati per la quantificazione dell'intensità bioluminescenti. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6 : Aggiungere informazioni diverse quantificazione.
Facendo clic su configurare misurazione all'angolo sinistro del pannello di ROI misurazioni, è possibile selezionare altri valori/informazioni di quantificazione desiderata. Clicca qui per visualizzare una versione più grande di questa figura.
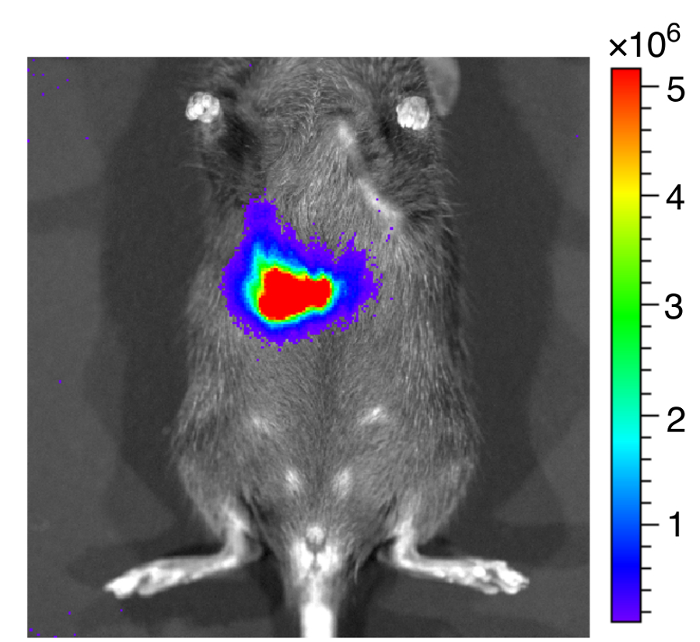
Figura 7 : Immagine rappresentativa dei topi dopo inoculati con bioluminescenti EHEC.
Immagine rappresentativa dei topi inoculati con bioluminescenti EHEC mediante sonda gastrica orale entro 1 h. La scala dei colori rappresenta la radianza (/sr p/s/cm2). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8 : Immagini di topi inoculati con bioluminescenza-labeled EHEC dopo 2 giorni.
(A) immagine rappresentano dei topi inoculati con selvaggio-tipo bioluminescente EDL933 EHEC ed EDL933:ΔrfaD mediante sonda gastrica orale dopo 2 giorni dopo l'infezione. (B) quantificazione dell'intensità di bioluminescenza dei topi infettati con EHEC. Barre di errore indicano le deviazioni standard. Immagini rappresentative sono mostrati. Tutti gli esperimenti sono stati condotti in modo indipendente tre volte con 2-3 animali ogni volta, e le barre di errore indicano le deviazioni standard. P-valori indicano i risultati dell'analisi statistica mediante t-test. La scala dei colori rappresenta la radianza (/sr p/s/cm2). Clicca qui per visualizzare una versione più grande di questa figura.
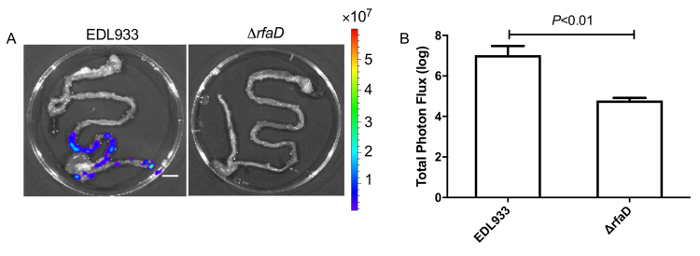
Figura 9 : Immagini di tessuti intestinali dei topi infettati con bioluminescenza-labeled EHEC.
(A) 2 giorni dopo l'inoculazione con bioluminescenza-etichettato EHEC, i topi sono stati eutanasizzati e tessuti intero intestinali sono stati rimossi ed imaged ex vivo. Immagini rappresentative sono mostrati. (B) quantificazione dell'intensità di bioluminescenza dei tessuti intestinali da topi infettati con EHEC. Tutti gli esperimenti sono stati condotti in modo indipendente tre volte con 2-3 animali ogni volta, e le barre di errore indicano le deviazioni standard. P-valori indicano i risultati dell'analisi statistica mediante t-test. La scala dei colori rappresenta la radianza (/sr p/s/cm2). Barra della scala rappresenta 1 cm. per favore clicca qui per visualizzare una versione più grande di questa figura.
| Passaggi | Temperatura | Tempo | Numero di cicli |
| Denaturazione iniziale | 95 ° C | 10 min | 1 |
| Denaturazione | 95 ° C | 30 sec | 35 |
| Ricottura | 58,4 ° C | 30 sec | |
| Estensione | 72 ° C | 1,5 min | |
| Estensione finale | 72 ° C | 10 min | 1 |
| Tenere premuto | 4 ° C | ∞ | 1 |
Tabella 1: Condizioni di polimerasi reazione a catena (PCR)
| Nome di primer | Sequenza |
| nptII F | 5' CCTATGCATAATAATTCCGCTAGCTTCACG3' |
| nptII R | 5' GCTCCACCGATAATATTCCTGAGTCATACT3' |
Tabella 2: sequenze Primer utilizzati per amplificare nptII
Discussione
È stato segnalato che EHEC trasformati con il plasmide luciferasi è stato utilizzato per esaminare la localizzazione nel host o espressione genica in vivo8,11,12. Il modello murino dimostrato qui è stato segnalato anche per rilevare i tempi di EHEC colonizzato e localizzazione in host murino8. Tuttavia, forniamo il protocollo di dettaglio di come amministrare l'inoculazione di EHEC ai topi intragastrically e come prepararsi accuratamente i batteri bioluminescenti per sonda gastrica orale. In particolare, per la sonda gastrica orale del mouse di EHEC (punto 3.7), la posizione della testa del mouse è critica quando viene inserito l'ago sonda gastrica. Se la posizione non è verticale, sarà difficile passare l'ago, e possibilmente potrebbe ferire il mouse. Al punto 3.8, quando l'ago sonda gastrica è all'interno della bocca del mouse, la lingua si pone fuori la bocca leggermente. Se si incontra resistenza quando si passa l'ago sonda gastrica all'esofago, smettere di andare avanti l'ago e ritirarlo immediatamente. Modificare la posizione dell'ago per assicurarsi che l'ago penetri l'esofago. L'ago potrebbe entrare in trachea Quando si verifica di resistenza, che condurrebbe ad iniettare i batteri nei polmoni invece lo stomaco.
Applicazione della proteina fluorescente verde (GFP) come un biosensore è comune negli esperimenti biologici. Tuttavia, usando GFP come reporter per osservare che l'agente patogeno infezione/colonizzazione animali vivi da in vivo imaging non è raccomandata, perché la capacità di assorbimento di acqua, proteine e dell'emoglobina sono alte fra 200-650 nm26, che si sovrappone con GFP (eccitazione 480 nm, emissione 510 nm)27. Pertanto, usando GFP segnale come reporter per l'imaging in vivo possono essere interrotta da emoglobina, proteine e acqua in animali26. La fluorescenza di vicino infrarosso (NIR) è ideale per in vivo imaging perché la sua finestra di assorbanza è intorno a 650-900 nm28, che è una regione del più basso coefficiente di assorbimento dell'emoglobina (< 650 nm) e acqua (> 900 nm)26 ,28 . Inoltre, quando il tessuto assorbe la luce, c'è la possibilità di indurre autofluorescenza. Quando le lunghezze d'onda di eccitazione e di emissione gamma nella finestra GFP, induce autofluorescenza molto più oltre NIR29. Utilizzo di NIR può migliorare il rapporto segnale-priorità bassa rispetto a quella di GFP eliminando l'autofluorescenza sfondo29. Bioluminescenza non richiede eccitazione energia per generare luce visibile. Dipende la reazione a catalizzare luciferina di substrato di suo enzima luciferasi e generare la luce. Poiché la bioluminescenza non richiede la luce direttamente su un campione, il segnale di fondo da un campione è molto basso. Pertanto, utilizzare della bioluminescenza come un reporter è più generale e più facile per l'imaging in vivo . Al contrario, fluorescenza richiede luce eccitazione per indurre il segnale luminoso. Quando tessuti assorbono la luce, c'è una possibilità che la luce fluorescente è emesso e indurre autofluorescence affinché loro segnale-rumore è più elevato rispetto a quello di bioluminescenza.
Considerando EHEC è naturalmente meno colonizzato in topi dall'infezione orale2,22, agente patogeno della mucosa naturale dei topi, chiamato Citrobacter rodentium, è stato utilizzato per studiare il meccanismo di colonizzazione a murino host come un batterio22,30di surrogati. EHEC e c. rodentium colonizzare la mucosa intestinale e indurre la formazione di lesioni A/E in host22,30. Essi contengono anche l'isola di patogenicità di LEE, che codifica per un T3SS e parecchie proteine effettrici che ha indotto A/E lesione22,30. Pertanto, l'uso della luciferasi esprimendo plasmide come un reporter in c. rodentium per rilevare la patologia di colonizzazione e di studiare il meccanismo di colonizzazione tramite un sistema di imaging in vivo è stato anche segnalato14, 15. Tuttavia, mentre c. rodentium infezione dei topi è un modello utile per studiare la funzione di T3SS e il meccanismo di lesione A/E, c. rodentium non contiene Shiga tossina (Stx)30, che è un dominante fattore di virulenza che causa insufficienza renale nel EHEC, in particolare sierotipo O157: H73. Anche se un ceppo di Stx-esprimendo rodentium c. è stato costruito recentemente31, che è più realistico di infezione da EHEC, non include altri potenziali fattori di virulenza EHEC che sono cruciali per la colonizzazione e/o infezione. Inoltre, c. rodentium condivide il 67% dei suoi geni con EHEC32, che suggerisce che l'EHEC possono utilizzare una virulenza distinta da c. rodentium durante la colonizzazione e/o infezione.
La luciferasi esprimendo plasmide usato qui, pWF27913, è stato modificato dal pAKlux29 cui spina dorsale è pBBR1MCS433. Anche se pBBR1MCS4 sono stati testati e replicati in vari batteri33, è fondamentale garantire l'origine di replicazione (ORI) di questo plasmide è adatto per l'host batterica prima di utilizzare questo sistema basato su plasmide luciferasi per l'esperimento e confermando che questo luciferasi esprimendo plasmide possono replicare nell'ospite batterico. Usiamo lo stress antibiotico per mantenere la stabilità del plasmide nei batteri. Quando i batteri entrare animali in assenza di antibiotici, è stato rilevato il segnale bioluminescente di selvaggio-tipo EHEC per almeno 2 giorni. Tuttavia, non abbiamo fatto a seguito di infezione per più di 2 giorni perché avevamo già visto una differenza significativa nell'intensità luminescente tra EHEC WT ed EHEC rfaD (che codifica un gene necessario per EHEC sintetizzando intatto LPS) mutante ai 2 giorni. Per mantenere il plasmide stabilmente nei batteri in assenza di antibiotici, un plasmide pCM1710,34 può essere utilizzato per questo scopo. pCM17 codifica per un sistema di ripartizione del due-plasmide e un meccanismo di uccisione post-segregational per garantire il mantenimento del plasmide nei batteri in assenza di antibiotici10,34. La pCM17 plasmide contenente l'operone luxCDABE guidato dal promotore OmpC può essere rilevato da segnale bioluminescenti per almeno 7 giorni8. Un metodo alternativo per ottenere una continua espressione bioluminescente di batteri in assenza di antibiotici è quello di inserire luxABCDE gene del cromosoma batterico35. Trasposone et al utilizzato Francis inserito la cassetta di operone e antibiotici luxABCDE casualmente inserita nel cromosoma dello Streptococcus pneumoniae per ottenere la bioluminescenza ceppo stabile35.
Nel nostro precedente studio13, abbiamo utilizzato questo sistema modello per colonizzazione di EHEC in un host di esaminare e confrontare la differenza di capacità di colonizzazione fra l'EHEC wild type (WT) e mutante13. Quando i topi sono stati amministrati il mutante di rfaD EHEC bioluminescente, i segnali bioluminescenti diminuiti drasticamente rispetto a che di EHEC WT dopo 2 giorni post infezione. Fornisce la prova che questo modello murino può analizzare l'effetto di mutazione della colonizzazione di EHEC nell'ospite. Inoltre, trattamenti terapeutici per ridurre la colonizzazione di EHEC è una soluzione, considerata il potenziale di infezione da EHEC poiché l'uso di antibiotici è controindicato5,36. Pertanto, vale la pena di test se questo sistema modello può essere utilizzato per esaminare l'efficacia di anti-colonizzazione droga/trattamenti contro la colonizzazione di enterobatteri nell'ospite. Noi crediamo che usando questo sistema di modello, è possibile esaminare i tempi e la posizione di non solo EHEC, ma anche altri enterobatteri colonizzazione in vivo. Utilizzando questo modello animale, il processo di colonizzazione di EHEC in topi può essere monitorato e l'onere di colonizzazione nell'ospite può essere quantificata per determinare la colonizzazione spaziale e temporale di EHEC in animali vivi. La visualizzazione e la quantificazione della colonizzazione di enterobatteri utilizzando questo modello lo rende un ottimo strumento per indagare e analizzare i meccanismi fini di colonizzazione enterobacterial così compensare la carenza di ricerca di colonizzazione e migliorare la conoscenza corrente.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Riconosciamo Chi-Chung Chen dal dipartimento di ricerca medica, Chi Mei Medical Center (Tainan, Taiwan) per l'aiuto nel topo di infezione e il supporto dal centro laboratorio animale della National Cheng Kung University. Questo lavoro è sostenuto dal Ministro della scienza e tecnologia (MOST) concede (più 104-2321-B-006-019, 105-2321-B-006-011,-005 and106-2321-B-006) a CC.
Materiali
| Name | Company | Catalog Number | Comments |
| Shaker incubator | YIH DER | LM-570R | bacteria incubation |
| Orbital shaking incubator | FIRSTEK | S300 | bacteria incubation |
| pBSL180 | source of nptII gene | ||
| pAKlux2 | source of luxCDABE operon | ||
| T&A Cloning Kit | Yeastern Biotech | FYC001-20P | use for TA cloning |
| Nsi I | NEB | R0127S | use for plasmid cloning |
| Sca I | NEB | R0122S | use for plasmid cloning |
| Spe I-HF | NEB | R0133S | use for plasmid cloning |
| Sma I | NEB | R0141S | use for plasmid cloning |
| T4 ligase | NEB | M0202S | use for plasmid cloning |
| Ex Taq | TaKaRa | RR001A | use for PCR amplification |
| 10X Ex Taq Buffer | TaKaRa | RR001A | use for PCR amplification |
| dNTP Mixture | TaKaRa | RR001A | use for PCR amplification |
| PCR machine | applied Biosystem | 2720 thermal cycler | for PCR amplification |
| Glycerol | SIGMA | G5516-1L | use for bacteria stocking solution |
| NaCl | Sigma | 31434-5KG-R | chemical for making LB medium, 10 g/L |
| Tryptone | CONDA pronadisa | Cat 1612.00 | chemical for making LB medium, 10 g/L |
| Yeast Extract powder | Affymetrix | 23547-1 KG | chemical for making LB medium, 5 g/L |
| Agar | CONDA pronadisa | Cat 1802.00 | chemical for making LB agar |
| kanamycin | Sigma | K4000-5G | antibiotics, use for seleciton |
| streptomycin | Sigma | S6501-100G | antibiotics, eliminate the microbiota in mice |
| EDL933 competent cell | Homemade | method is on supplemental document | |
| Electroporator | MicroPulser | for electroporation | |
| Electroporation Cuvettes | Gene Pulser/MicroPulser | 1652086 | for electroporation |
| High-speed centrifuge | Beckman Coulter | Avanti, J-26S XP | use for centrifuging bacteria |
| Fixed-Angle Rotor | Beckman Coulter | JA25.5 | use for centrifuging bacteria |
| Fixed-Angle Rotor | Beckman Coulter | JLA10.5 | use for centrifuging bacteria |
| centrifuge bottles | Beckman Coulter | REF357003 | use for centrifuging bacteria |
| centrifuge bottles | Thermo Fisher scientific | 3141-0500 | use for centrifuging bacteria |
| eppendorf biophotometer plus | eppendorf | AG 22331 hamburg | for measuring the OD600 value of bacteria |
| C57BL/6 mice | Laboratory Animal Center of NCKU | ||
| lab coat, gloves | for personnel protection | ||
| isoflurane | Panion & BF Biotech Inc. | G-8669 | for mice anesthesia, pharmaceutical grade |
| 1ml syringe | use for oral gavage of mice | ||
| Reusable 22 G ball-tipped feeding needle | φ0.9 mm X L 50 mm | use for oral gavage of mice | |
| surgical scissors | use for mice experiment | ||
| Xenogen IVIS 200 imaging system | Perkin Elmer | IVIS spectrum | use for bioluminescent image capture |
| Living Image Software | Perkin Elmer | version 4.1 | use for quantifying the image data |
Riferimenti
- Pennington, H. Escherichia coli O157. Lancet. 376 (9750), 1428-1435 (2010).
- Mayer, C. L., Leibowitz, C. S., Kurosawa, S., Stearns-Kurosawa, D. J. Shiga toxins and the pathophysiology of hemolytic uremic syndrome in humans and animals. Toxins (Basel). 4 (11), 1261-1287 (2012).
- Tarr, P. I., Gordon, C. A., Chandler, W. L. Shiga-toxin-producing Escherichia coli and haemolytic uraemic syndrome. Lancet. 365 (9464), 1073-1086 (2005).
- Obrig, T. G. Escherichia coli Shiga Toxin Mechanisms of Action in Renal Disease. Toxins (Basel). 2 (12), 2769-2794 (2010).
- Nguyen, Y., Sperandio, V. Enterohemorrhagic E. coli (EHEC) pathogenesis. Front Cell Infect Microbiol. 2, 90 (2012).
- Wiles, S., Robertson, B. D., Frankel, G., Kerton, A. Bioluminescent monitoring of in vivo colonization and clearance dynamics by light-emitting bacteria. Methods Mol Biol. 574, 137-153 (2009).
- Hutchens, M., Luker, G. D. Applications of bioluminescence imaging to the study of infectious diseases. Cell Microbiol. 9 (10), 2315-2322 (2007).
- Rhee, K. J., et al. Determination of spatial and temporal colonization of enteropathogenic E. coli and enterohemorrhagic E. coli in mice using bioluminescent in vivo imaging. Gut Microbes. 2 (1), 34-41 (2011).
- Karsi, A., Lawrence, M. L. Broad host range fluorescence and bioluminescence expression vectors for Gram-negative bacteria. Plasmid. 57 (3), 286-295 (2007).
- Lane, M. C., Alteri, C. J. S., Smith, S. N., Mobley, L. H. Expression of flagella is coincident with uropathogenic Escherichia coli ascension to the upper urinary tract. Proc Natl Acad Sci U S A. 104 (42), 16669-16674 (2007).
- Roxas, J. L., et al. Enterohemorrhagic E. coli alters murine intestinal epithelial tight junction protein expression and barrier function in a Shiga toxin independent manner. Lab Invest. 90 (8), 1152-1168 (2010).
- Siragusa, G. R., Nawotka, K., Spilman, S. D., Contag, P. R., Contag, C. H. . Real-Time Monitoring of Escherichia coli O157:H7 Adherence to Beef Carcass Surface Tissues with a Bioluminescent Reporter. , (1999).
- Kuo, C. J., et al. Mutation of the Enterohemorrhagic Escherichia coli Core LPS Biosynthesis Enzyme RfaD Confers Hypersusceptibility to Host Intestinal Innate Immunity In vivo. Front Cell Infect Microbiol. 6, 82 (2016).
- Wiles, S., et al. Organ specificity, colonization and clearance dynamics in vivo following oral challenges with the murine pathogen Citrobacter rodentium. Cell Microbiol. 6 (10), 963-972 (2004).
- Wiles, S., Pickard, K. M., Peng, K., MacDonald, T. T., Frankel, G. In vivo bioluminescence imaging of the murine pathogen Citrobacter rodentium. Infect Immun. 74 (9), 5391-5396 (2006).
- Contag, C. H., Contag, P. R., Mullins, J. I., Spillman, S. D., Stevenson, D. K., Benaron, D. A. Photonic detection of bacterial pathogens in living hosts. Mol Microbiol. 18 (4), 593-603 (1995).
- Hardy, J., Francis, K. P., DeBoer, M., Chu, P., Gibbs, K., Contag, C. H. Extracellular replication of Listeria monocytogenes in the murine gall bladder. Science. 303 (5659), 851-853 (2004).
- Kaniga, K., Sory, M. P., Delor, I., Saegerman, C., Limet, J. N., Cornelis, G. R. Monitoring of Yersinia enterocolitica in Murine and Bovine Feces on the Basis of the Chromosomally Integrated luxAB Marker Gene. Appl Environ Microbiol. 58 (3), 1024-1026 (1992).
- Trcek, J., Fuchs, T. M., Trulzsch, K. Analysis of Yersinia enterocolitica invasin expression in vitro and in vivo using a novel luxCDABE reporter system. Microbiology. 156 (Pt 9), 2734-2745 (2010).
- Morin, C. E., Kaper, J. B. Use of stabilized luciferase-expressing plasmids to examine in vivo-induced promoters in the Vibrio cholerae vaccine strain CVD 103-HgR. FEMS Immunol Med Microbiol. 57 (1), 69-79 (2009).
- Law, R. J., Gur-Arie, L., Rosenshine, I., Finlay, B. B. In vitro and in vivo model systems for studying enteropathogenic Escherichia coli infections. Cold Spring Harb Perspect Med. 3 (3), a009977 (2013).
- Ritchie, J. M. Animal Models of Enterohemorrhagic Escherichia coli Infection. Microbiol Spectr. 2 (4), EHEC-0022-2013 (2014).
- Chou, T. C., et al. Enterohaemorrhagic Escherichia coli O157:H7 Shiga-like toxin 1 is required for full pathogenicity and activation of the p38 mitogen-activated protein kinase pathway in Caenorhabditis elegans. Cell Microbiol. 15 (1), 82-97 (2013).
- Alexeyev, M. F., Shokolenko, I. N. Mini-Tnl 0 transposon derivatives for insertion mutagenesis and gene delivery into the chromosome of Gram-negative bacteria. Gene. 160 (1), 59-62 (1995).
- Wiegand, I., Hilpert, K., Hancock, R. E. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nat Protoc. 3 (2), 163-175 (2008).
- Pansare, V., Hejazi, S., Faenza, W., Prud'homme, R. K. Review of Long-Wavelength Optical and NIR Imaging Materials: Contrast Agents, Fluorophores and Multifunctional Nano Carriers. Chem Mater. 24 (5), 812-827 (2012).
- Heim, R., Cubitt, A. B., Tsien, R. Y. Improved green fluorescence. Nature. 373 (6516), 663-664 (1995).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19 (4), 316-317 (2001).
- Frangioni, J. In vivo near-infrared fluorescence imaging. Current Opinion in Chemical Biology. 7 (5), 626-634 (2003).
- Collins, J. W., et al. Citrobacter rodentium: infection, inflammation and the microbiota. Nat Rev Microbiol. 12 (9), 612-623 (2014).
- Mallick, E. M., et al. A novel murine infection model for Shiga toxin-producing Escherichia coli. J Clin Invest. 122 (11), 4012-4024 (2012).
- Petty, N. K., et al. The Citrobacter rodentium genome sequence reveals convergent evolution with human pathogenic Escherichia coli. J Bacteriol. 192 (2), 525-538 (2010).
- Kovach, M. E., Elzer, P. H., Hill, D. S., Robertson , G. T., Farris, M. A., Roop, R. M., Peterson, K. M. Four new derivatives of the broad-host-range cloning vector pBBR1MCS, carrying different antibiotic-resistance cassettes. Gene. 166 (1), 175-176 (1995).
- Galen, J. E., Nair, J., Wang , J. Y., Wasserman, S. S., Tanner, M. K., Sztein , M. B., Levine, M. M. Optimization of Plasmid Maintenance in the Attenuated Live Vector Vaccine Strain Salmonella typhiCVD 908-htrA. Infect Immun. 67 (12), 6424-6433 (1999).
- Francis, K. P., et al. Visualizing pneumococcal infections in the lungs of live mice using bioluminescent Streptococcus pneumoniae transformed with a novel gram-positive lux transposon. Infect Immun. 69 (5), 3350-3358 (2001).
- Goldwater, P. N., Bettelheim, K. A. Treatment of enterohemorrhagic Escherichia coli (EHEC) infection and hemolytic uremic syndrome (HUS). BMC Med. 10, (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon