Method Article
Détection de la colonisation de Escherichia Coli entéro-hémorragique en hôte murin par système de Bioluminescence Non invasif In Vivo
Dans cet article
Résumé
Un protocole détaillé d’un modèle de souris pour entérohémorragique Escherichia coli (EHEC) colonisation en utilisant des bactéries marquées bioluminescence est présenté. La détection de ces bactéries bioluminescentes par un non invasif in vivo d’imagerie système animaux vivants peut avancer notre compréhension actuelle de la colonisation de l’ECEH.
Résumé
Entérohémorragique Escherichia coli (EHEC) O157 : H7, qui est un agent pathogène d’origine alimentaire de cette causesdiarrhea, la colite hémorragique (HS), et de syndrome hémolytique et urémique (SHU), coloniser pour le tractus intestinal de l’homme. Pour étudier le mécanisme détaillé de EHEC colonisation in vivo, il est essentiel d’avoir des modèles animaux de surveiller et de quantifier la colonisation ECEH. Nous montrons ici un modèle de colonisation souris-ECEH en transformant le plasmide exprimant bioluminescent à EHEC de surveiller et de quantifier la colonisation ECEH chez les hôtes de la vie. Animaux inoculés avec marqué bioluminescence EHEC affichent des signaux bioluminescentes intenses chez les souris par détection avec un non invasif en vivo système d’imagerie. Après que 1 à 2 jours après l’infection, signaux bioluminescentes pourraient toujours être détectés chez les animaux infectés, ce qui suggère que les EHEC colonisent en hôtes pendant au moins 2 jours. Nous démontrons également que ces EHEC bioluminescentes localiser à l’intestin de souris, plus précisément dans le caecum et le côlon, des images ex vivo . Ce modèle de colonisation souris-EHEC peut servir d’outil pour faire avancer les connaissances actuelles sur le mécanisme de colonisation ECEH.
Introduction
EHEC O157 : H7 est un pathogène qui provoque la diarrhée1, HS2, HUS3et une insuffisance rénale aiguë même4 par contamination de l’eau ou de nourriture. EHEC est un enterobacterium pathogène et colonise dans le tube digestif de l’homme1. Lorsque EHEC a tout d’abord adhérer à l’épithélium intestinal hôte, ils injectent les facteurs de colonisation dans les cellules de l’hôte à travers le système de sécrétion type III (T3SS) qui fonctionne comme une seringue moléculaire induisant une fixation et effacement (A/E) lésion suite à appliquer adhérence (colonisation)5. Ces gènes impliqués dans la formation de lésions A/E sont codés par le locus de l’entérocyte effacement (LEE) pathogénicité île5.
Bioluminescence est une réaction chimique produisant de la lumière, dans laquelle luciférase catalyse la luciférine de substrat pour générer de la lumière visible6. Ce processus enzymatique nécessite souvent la présence d’oxygène ou de l’adénosine triphosphate (ATP)6. Bioluminescence imaging (BLI) permet aux chercheurs de la visualisation et la quantification des interactions hôte-pathogène dans les animaux vivants7. BLI peut caractériser le cycle d’infection bactérienne chez les animaux vivants en suivant les bactéries bioluminescentes comme ils migrent vers et envahissent les différents tissus7; Cela révèle une progression dynamique de l’infection. En outre, la charge bactérienne chez les animaux est liée à la bioluminescence signal8; Il est donc un indicateur commode pour estimer les conditions pathologiques des animaux d’expérimentation d’une manière simple et directe.
Le plasmide utilisé ici contenait l’opéron luciférase, luxCDABE, qui est de la bactérie Photorhabdus luminescens qui encode ses propres luciférase substrat7,9. En transformant ce plasmide exprimant luciférase en bactéries, les processus de colonisation et l’infection peuvent être surveillés en observant ces bactéries bioluminescentes animaux vivants. Dans l’ensemble, BLI et bactéries marquées bioluminescence permettent aux chercheurs de suivre le nombre de bactéries et de l’emplacement, la viabilité bactérienne avec des antibiotiques/thérapie de traitement et l’expression de gène bactérien infection/colonisation6, 7. on a signalé des nombreuses bactéries pathogènes qui expriment l’opéron luxCDABE d’examiner leur expression de cycle ou de gène d’infection dans l’infection. Ces bactéries, y compris des uropathogènes e. coli10à EHEC8,11,12,13, entéropathogène e. coli (EPEC)8, Citrobacter rodentium14,15, Salmonella typhimurium16, Listeria monocytogenes17, Yersinia enterocolitica18,19, et Vibrio cholerae20, ont été documentés.
Plusieurs modèles expérimentaux ont été développés pour faciliter l’étude des EHEC colonisation in vitro et in vivo21,22,23. Cependant, il y a un manque de modèles animaux appropriés pour étudier l’ECEH colonisation in vivoet ainsi une pénurie résultante de détails. Pour faciliter l’étude du EHEC colonisation mécanisme in vivo, il est utile de construire des modèles animaux pour observer et quantifier la colonisation d’ECEH dans les animaux vivants dans une méthode non invasive.
Ce manuscrit décrit un modèle de colonisation de souris-ECEH qui utilise un système exprimant bioluminescent pour surveiller la colonisation EHEC au fil du temps chez les hôtes vivants. Souris sont inoculées par voie intragastrique avec marqué bioluminescence EHEC et le signal de bioluminescent est détecté chez les souris avec un non invasif in vivo d’imagerie système13. Souris infectées avec marqué bioluminescence ECEH ont montré des signaux bioluminescentes significatives dans leur intestin après que 2 jours après l’infection, ce qui suggère que ces bactéries ont colonisé dans l’intestin de l’hôte après que 2 jours après l’infection. Données d’image ex vivo ont montré que cette colonisation est spécifiquement dans le caecum et le côlon des souris. En utilisant ce modèle de souris-ECEH, la colonisation de EHEC bioluminescente peut être détectée dans l’accueil de la vie par une in vivo d’imagerie système, afin d’étudier les mécanismes détaillés de la colonisation des bactéries entériques, qui peut favoriser une meilleure compréhension dans Changements physiologiques et pathologiques induits par ECEH.
Protocole
ATTENTION : EHEC O157 : H7 est un niveau de biosécurité 2 (BSL-2) pathogène selon les Centers for Disease Control and Prevention (CDC) instruction de biosécurité (https://www.cdc.gov/). Par conséquent, toutes les procédures expérimentales impliquant ECEH doivent être effectuées dans un établissement de BSL-2. Porter des gants et blouses tout en exécutant l’expérience. Travailler dans une cabinet de biosécurité certifiée (BSC). Désinfecter le banc expérimental avant et après la procédure expérimentale avec l’éthanol à 70 %. Tous les instruments ou matériel que EHEC contact (ou potentiellement contact) doit être désinfecté avec l’éthanol à 70 % ou l’eau de Javel. Les déchets contaminés (ou potentiellement contaminés) devraient être soigneusement scellé et stérilisés à l’autoclave. Portez un masque, des lunettes de protection, double gants ou une combinaison, si nécessaire. Les souris femelles C57BL/6 de 6 semaines ont été achetés et maintenues à la laboratoire Animal Center de la National Cheng Kung University (NCKU). Les expérimentations animales ont été approuvées par le Comité emploi de NCKU (numéro d’agrément 104-039) et d’institutionnels animalier.
1. génération de bactéries ECEH marqués au Bioluciferase
- Mélanger 50 ng d’acide désoxyribonucléique (ADN), 1 μL de 10 μM avant et marche arrière amorces, désoxynucléotides de 2,5 mM 2 μL (dNTPs), 2 μl 10 x tampon, 0,2 μL ADN polymérase et eau bidistillée stérile (ddH2O) pour un volume final de 20 μL d’amplifier le anti-kanamycine cassette, de gène nptII 24. La matrice d’ADN est du pBSL18024, qui est acheté depuis le projet National de BioResource (PRBN). Les conditions de la PCR sont répertoriées dans le tableau 1 et la séquence d’amorçage est disponible dans le tableau 2.
- Ligaturer les produits PCR à un vecteur de clonage commercial suivant le kit du protocole (voir Table des matières).
- Le fragment de gène nptII depuis le vecteur de clonage par NsiI et SmaI l’accise et de cloner dans pBBR1MCS4, qui est digéré par la NsiI et ScaI du pAKlux29 pour créer le plasmide résistant à la kanamycine, pWF27813.
- L’opéron luxCDABE , de la luciférase exprimant le plasmide9, pAKlux2, par SpeI-HF et ScaI et clone de l’accise à SpeI-HF et SmaI digéré pWF278 pour générer la kanamycine résistant et luciférase exprimant le plasmide, pWF27913.
Remarque : Pour les extractions de plasmide et les fragment excisé des purifications, utilisez l’extraction de plasmide commerciale et le kit d’extraction de gel, respectivement. Pour la digestion enzymatique, mélanger 100 ng ADN, 1 tampon de x 10 μL, 1 μL de chaque enzyme de restriction sélectionné et ddH stérile2O pour un volume total de 10 μL et incuber à 37 ° C pendant 2,5 à 3 h. - Transformer le plasmide pWF279 cellules compétentes d’Escherichia coli O157 : H7 EDL933 par électroporation avec 2 500 V pour 4 ms.
- Incuber les cellules bactéries transformées en milieu Luria-Bertani (LB) 1 mL à 37 ° C pendant 1 h.
- Plaque de la bactérie sur une gélose LB additionné de 50 µg/mL de kanamycine à 37 ° C pendant 16-18 h.
- Vérifier le signal de bioluminescent de la plaque par un in vivo d’imagerie machine le lendemain. Prélever une colonie unique sur la plaque et il culture dans 3 mL LB additionné de 50 kanamycine µg/mL à 37 ° C pendant 16-18 h.
- Préparer bactérienne stock moyen en diluant 100 % glycérol stérile ddH2O faire la solution de glycérol de 30 %.
- Congeler le résistant à la kanamycine e. coli O157 : H7 EDL933 bactéries porteuses de plasmide luciférase comme un stock bactérien dans un bouchon à vis cryovial comme un ratio de 1:1 de solution de glycérol bactéries culture et 30 % à-80 ° C. La concentration finale de glycérol est de 15 %.
2. préparation de bactéries ECEH bioluminescente pour l’Inoculation par voie orale
NOTE : L’organigramme de la chronologie des procédures expérimentales pour la préparation de l’ECEH et gavage oral de souris est présentée dans la Figure 1 pour aider à la préparation expérimentale.
- Bactéries strie e. coli O157 : H7 EDL933 hébergeant des plasmides de luciférase sur une gélose LB avec 50 kanamycine µg/mL de stock de-80 ° C. Cultiver les bactéries pendant 16-18 h à 37 ° C.
- Prélever une colonie unique sur la plaque pendant la nuit et de la culture dans un milieu 3 mL LB avec 50 kanamycine µg/mL pendant 16 à 18 h dans un incubateur à 37 ° C à 220 tr/mn.
- Repiquer les bactéries (dilution 1 : 100) en kanamycine (50 µg/mL) contenant le bouillon LB pour 2,5 à 3 h dans un incubateur à 37 ° C à 200 tr/min. (Par exemple, ajouter 2 mL cultivées pendant la nuit à 200 mL LB additionné à la kanamycine (50 µg/mL), les bactéries).
- Incuber les bactéries pour 2,5 à 3 h et mesurer la valeur de la densité optique à 600 nm (OD600) jusqu'à ce que la valeur est de 0,9 à 1. Le nombre de cellules bactériennes a atteint une densité d’environ 108 d’unités formant colonies (UFC) / mL.
- Centrifuger les bactéries re-cultivées à 8 000 x g pendant 30 min, 4 ° C.
- Éliminer le liquide surnageant sans agiter le culot de bactéries et laver le culot avec 100 mL de solution saline 0,9 % stérile normale par agitation douce.
- Répétez une fois les étapes 2.5 et 2.6.
- Après le lavage, centrifuger la culture bactérienne à 8 000 x g pendant 30 min, 4 ° C et éliminer le surnageant doucement.
- Le culot de condensat à 100 fois avec du sérum physiologique 0,9 %. Par exemple, si les bactéries de 200 mL sont centrifugés, ajouter physiologique de 2 mL pour suspendre le culot.
- Confirmer les bactéries UFC (il faut environ 109 UFC/100 μL après la condensation dans une solution saline normale) en ensemençant les bactéries concentrées à travers une dilution en série 10 fois25.
3. souris Gavage Oral d’ECEH
- Traiter les souris C57BL/6 femelles de 6 semaines avec de l’eau streptomycine (5 g/L) pendant 24 h.
- Après 24 h, passer à l’eau potable ordinaire pour un autre 24h avant le gavage. Après le traitement de l’eau ordinaire pendant 24 h, les souris sont prêts pour gavage oral d’ECEH.
- Remplir la seringue de 100 bactéries ECEH de μL en tirant sur le piston. N’assurer aucune bulle d’air dans la seringue. Enlever les bulles à faire claquer la seringue avec les doigts.
- Soulever l’animal doucement et placez-le sur le dessus de la cage avec soin.
- Saisir la souris par la queue avec soin, et l’animal sera prise au sommet de la cage et tenter de s’éloigner.
- Freiner doucement la souris en saisissant la peau du cou et le dos de l’animal avec le pouce et l’index pour empêcher le mouvement de la tête de la souris.
- Maintenez le pointeur de la souris en position verticale pour insérer l’aiguille de gavage et s’assurer que la tête de la souris est bien immobile et verticale.
- Insérer l’aiguille de gavage dans la bouche de la souris après le toit de la bouche et descendre dans le œsophage et vers l’estomac.
- Quand l’aiguille insérée est la moitié ou les deux-tiers longueur chez la souris, injecter 100 bactéries ECEH μL, qui contiennent environ 109 UFC cellules.
4. visualisation
- Après le gavage oral, détecter les signaux bioluminescents sur 1 à 2 jours.
- Avant d’examiner les signaux bioluminescentes des animaux, anesthésier les en les plaçant dans une chambre de 2,5 % isoflurane avec 1,5 L/min d’oxygène.
- Attendez 2 à 5 min jusqu'à ce que toutes les souris deviennent inconscient et le déplacement de l’arrêt. Les animaux sont prêts pour la détection in vivo de la bioluminescence.
- Détecter et image bioluminescentes signaux d’animaux par un in vivo système d’imagerie. Veuillez voir la Section 5 « D’Acquisition de données » pour le fonctionnement du logiciel. Au cours du processus d’imagerie, tous les animaux subissent un approvisionnement continu de 2,5 % isoflurane avec 1,5 L/min d’oxygène.
- Cliquez sur fichier > direct et manuellement, se concentrer sur la souris.
- Sélectionner l’intensité de l’exposition temps et laser.
- Cliquez sur acquérir > capturer.
- Pour l’imagerie ex vivo , euthanasier les souris par dislocation cervicale et retirez l’intestin entier des souris infectées. Placer les intestins dans une image et une boîte de Pétri à 9 cm in vivo système d’imagerie. Le réglage est le même que le in vivo l’imagerie sauf que le champ de vision est réglé comme A/B. Veuillez voir la Section 5 « D’Acquisition de données » pour plus de détails.
Remarque : Méthode pour la dislocation cervicale : maîtriser les souris sur le dessus de la cage en saisissant la queue d’une main pour que les animaux saisir la cage. Placer un marqueur ou le pouce et l’index de l’autre main contre l’arrière du cou à la base du crâne. Poussez vers l’avant avec la main ou un objet tout en retenant la tête et tirer vers l’arrière avec la main qui tient la queue rapidement.
Examinez pour confirmer un arrêt respiratoire et aucun battement de cœur.
5. Acquisition de données
Remarque : Le logiciel utilisé pour l’acquisition de données est répertorié dans la Table des matières.
- Pour l’acquisition de l’image, ouvrez le panneau de contrôle d’Acquisition du logiciel (Figure 2).
- « Luminescents », sélectionnez « photographie » et « Overlay ».
- Temps d’exposition défini comme « Auto ». La valeur Binning comme « Moyenne ».
- Néc ƒ/stop 1 luminescentes et 8 pour la photographie. Ƒ/stop contrôles de la quantité de lumière reçue par le détecteur de CCD.
- Définissez le champ de vision basée sur le champ des images qui présentent un intérêt à acquérir. Option « D » peut tenir cinq souris âgés de 6 semaines et leur image tout à la fois. « C » peut l’image trois souris âgés de 6 semaines dans un champ.
- Une fois que les souris/échantillons sont prêts pour l’imagerie, cliquez sur « Acquérir » pour l’acquisition d’images.
- Ouvrir les données d’image qui a été acquis.
- Ouvrez le panneau de la Palette d’outils (Figure 3).
- Sélectionnez Outils ROI. Nous vous recommandons le cercle (celui le plus à gauche) dans la plage de la région de bioluminescente sur images (Figure 4).
- Cliquez sur « Mesure ROIs » (icône représentant un crayon) pour mesurer l’intensité bioluminescente surface (Figure 3). Le panneau de retour sur investissement des mesures et les valeurs de quantification apparaissent (Figure 5).
- Utiliser la mesure de la configurer sur le coin gauche du panneau mesures de ROI pour sélectionner les valeurs/informations nécessaires (Figure 6), sinon cliquez sur « Exporter » pour exporter ce tableau de données et l’enregistrer comme fichier .csv (Figure 5).
- Utilisez les valeurs de la colonne « Flux Total (p/s) » comme la quantification bioluminescentes intensité dans le fichier .csv.
Résultats
Que nous administrons marqué bioluminescence EHEC (~ 109 cellules bactériennes) à des souris C57BL/6 femelles 6 - anciennes semaine par gavage. Après l’inoculation par voie orale d’ECEH chez la souris à 1 h, les animaux ont été examinés pour signal de bioluminescence par le système d’imagerie in vivo comme illustré à la Figure 7. Les résultats ont montré un signal fort de bioluminescent chez des souris de gavage avec marqué bioluminescence EHEC. Nous avons examiné les signaux sur 2 jours après l’infection. Tel qu’illustré en Figure 8 a, les souris inoculées avec marqué bioluminescence sauvage EHEC EDL933 ont montré des signaux bioluminescentes intenses même après que 2 jours après l’infection, ce qui suggère le QU'ECEH colonisé hôtes par 2 jours. Nous avons également par voie intragastrique infecté marqué bioluminescence EDL933ΔrfaD (ΔrfaD) à des souris (Figure 8 a). Ce mutant, fit défection en lipopolysaccharide (LPS), a été montré pour réduire la colonisation de l’hôte dans notre étude précédente. Tel qu’illustré en Figure 8 a, aucun signal n’est bioluminescente détecté dans ΔrfaD-souris infectées, ce qui suggère qu’il y a des bactéries pas ou moins colonisés de cellules chez les souris. Quantification du signal fluorescent est illustrée à la Figure 8 b. Ensuite, l’emplacement de ces bactéries marquées bioluminescence a été déterminé. Les souris infectés ont été sacrifiés humainement et leur intestin tout enlevé. L’intestin des souris 2 jours après l’infection était positionnés sur les plats de Pétri de 9 cm et imagées ex vivo (Figure 9 a). Les tissus intestinaux de bioluminescence marqué EDL933 infectés souris ont révélé une augmentation significative des signaux bioluminescents dans le caecum et le côlon, qui donnent à penser que ces EHEC bioluminescentes colonisé dans le caecum et le côlon de souris infectées pendant 2 jours à moins. En revanche, les souris infectées par bioluminescence marqué ΔrfaD (Figure 9 a), a révélé diminué bioluminescente signal dans leur tissu intestinal, ce qui est conforme à l’image en vivo (Figure 8 a ). Quantification du signal fluorescent est illustrée à la Figure 9 b.

Figure 1 : Chronologie de l’organigramme de préparation expérimentale.
Aperçu de la synchronisation nécessaire pour préparer les bactéries ECEH bioluminescentes et Prétraiter les souris dotées de streptomycine. (A), EHEC préparation. (B) préparation de la souris. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
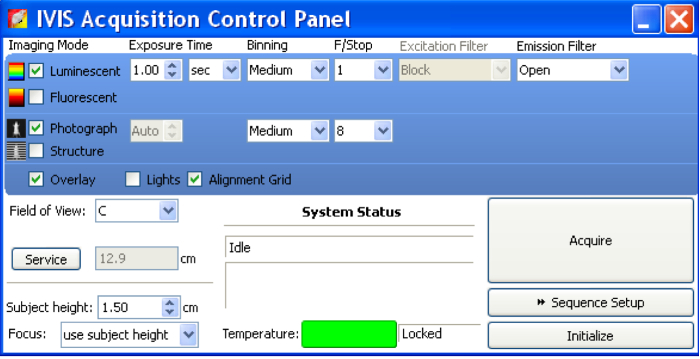
Figure 2 : In vivo panneau acquisition de système d’imagerie.
Avant d’imagerie échantillons, ouvrez le panneau de configuration pour le Acquisition IVIS. « Luminescents », sélectionnez « photographie » et « Overlay ». Temps d’exposition défini comme « Auto ». La valeur Binning comme « Moyenne ». Néc ƒ/stop 1 luminescentes et 8 pour la photographie. Ƒ/stop contrôles de la quantité de lumière reçue par le détecteur de CCD. Une fois que les échantillons sont prêts pour l’imagerie, cliquez sur « Acquérir » pour acquérir des images. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Panneau de la Palette d’outils.
Après image acquisition, utilisez le panneau de la Palette d’outils pour quantifier l’intensité bioluminescente. Ouvrez le panneau de la Palette d’outils et les données d’image. Choisissez l’un des outils de ROI à varier les signaux bioluminescents sur images. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Signal bioluminescente d’échantillon pour la quantification.
Zone de signal bioluminescent sur images encerclés par des outils de ROI. Tous les signaux bioluminescentes montrés ici sont dans le cercle rouge. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Mesures de ROI.
Après encerclant les signaux bioluminescentes et en cliquant sur « Mesure ROIs » sur le panneau de la Palette d’outils, les valeurs sont présentées comme indiqué. Les valeurs de la colonne Flux Total (p/s) sont utilisées pour la quantification d’intensité bioluminescent. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : Ajouter des informations de différents quantification.
En cliquant sur Configurer mesure sur le coin gauche du panneau mesures de ROI, vous pouvez sélectionner autre valeurs/information de quantification souhaitées. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
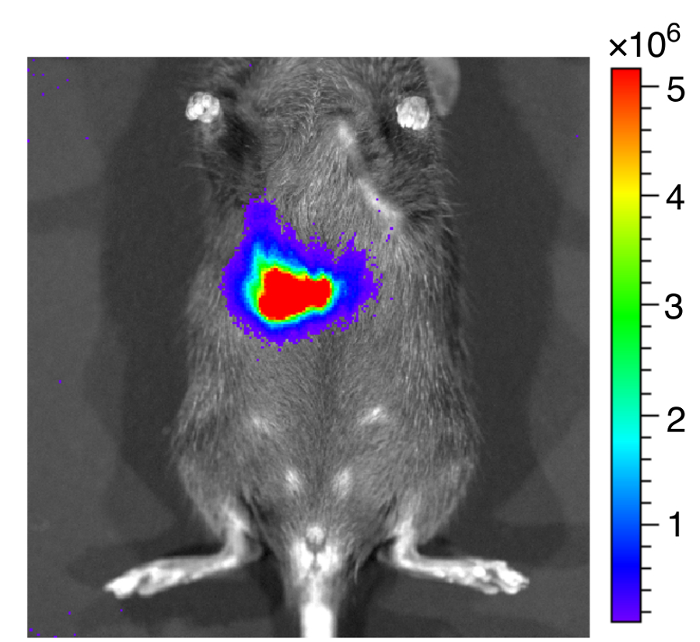
Figure 7 : Une image représentative des souris après avoir inoculé EHEC bioluminescente.
Une image représentative des souris inoculées avec ECEH bioluminescente par gavage à 1 h. L’échelle de couleurs représente le rayonnement (p/s/cm2/sr). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 8 : Images des souris inoculées avec ECEH bioluminescence marqués après 2 jours.
(A) image représentent des souris inoculées avec sauvage bioluminescente EHEC EDL933 et EDL933 :ΔrfaD par gavage après 2 jours après l’infection. (B) la Quantification de l’intensité de la bioluminescence des souris infectées par ECEH. Barres d’erreur indiquent les écarts-types. Images représentatives sont indiqués. Toutes les expériences ont été menées séparément trois fois avec 2-3 animaux chaque fois, et les barres d’erreur indiquent les écarts-types. P-valeurs indiquent les résultats de l’analyse statistique de test t. L’échelle de couleurs représente le rayonnement (p/s/cm2/sr). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
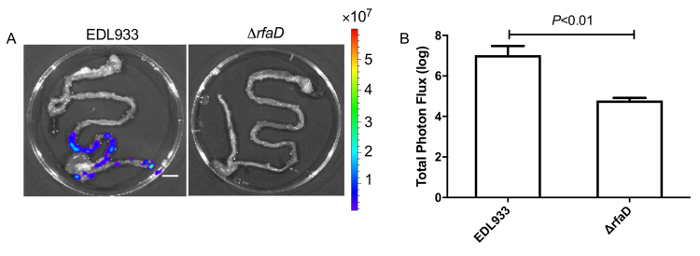
Figure 9 : Images de tissus intestinaux de souris infectées avec marqué bioluminescence EHEC.
(A) 2 jours après l’inoculation avec marqué bioluminescence ECEH, les souris ont été euthanasiés et tissus intestinaux entiers ont été enlevées et imagées ex vivo. Images représentatives sont indiqués. (B) la Quantification de l’intensité de la bioluminescence des tissus intestinaux de souris infectées par ECEH. Toutes les expériences ont été menées séparément trois fois avec 2-3 animaux chaque fois, et les barres d’erreur indiquent les écarts-types. P-valeurs indiquent les résultats de l’analyse statistique de test t. L’échelle de couleurs représente le rayonnement (p/s/cm2/sr). Barre d’échelle représente 1 cm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Mesures | Température | Temps | Nombre de cycles |
| Dénaturation initiale | 95 ° C | 10 min | 1 |
| Dénaturation | 95 ° C | 30sec | 35 |
| Recuit | 58,4 ° C | 30sec | |
| Extension | 72 ° C | 1,5 min | |
| Extension finale | 72 ° C | 10 min | 1 |
| Maintenez | 4 ° C | ∞ | 1 |
Tableau 1 : Conditions de Polymerase chain reaction (PCR)
| Nom d’amorces | Séquence |
| nptII F | 5' CCTATGCATAATAATTCCGCTAGCTTCACG3' |
| nptII R | 5' GCTCCACCGATAATATTCCTGAGTCATACT3' |
Tableau 2 : séquences d’amorces utilisées pour amplifier nptII
Discussion
Il a été signalé que EHEC transformé avec plasmide de la luciférase a été utilisé pour examiner sa localisation en hôtes ou gene expression in vivo8,11,12. Le modèle murin démontré ici a aussi signalé pour détecter le moment de EHEC colonisé et la localisation dans hôte murine8. Néanmoins, nous fournissons le protocole en détail comment administrer l’inoculation à des souris ECEH par voie intragastrique et comment préparer soigneusement les bactéries bioluminescentes gavage oral. Notamment, pour le gavage oral de souris d’ECEH (étape 3.7), la position de la tête de la souris est cruciale lorsque l’aiguille de gavage est insérée. Si la position n’est pas verticale, il sera difficile de passer l’aiguille, et il pourrait éventuellement blesser la souris. À l’étape 3.8, lorsque l’aiguille de gavage se trouve à l’intérieur de la bouche de la souris, la langue jettera à l’extérieur de la bouche légèrement. Cas de résistance lors du passage de l’aiguille de gavage à le œsophage, arrêter de bouger l’aiguille vers l’avant et retirer immédiatement. Modifier la position de l’aiguille pour s’assurer que l’aiguille ne pénètre dans le œsophage. L’aiguille pourrait pénétrer dans la trachée en cas de résistance, qui conduirait à l’injection de bactéries dans les poumons au lieu de l’estomac.
Application de la protéine fluorescente verte (GFP) comme un biocapteur est fréquente chez les expériences biologiques. Toutefois, l’utilisation de GFP comme reporter pour observer que la pathogène infection/colonisation des animaux vivants de l’imagerie in vivo n’est pas recommandée, car l’absorption par l’hémoglobine, de protéines et d’eau sont élevés entre 200-650 nm26, qui se confond avec GFP (excitation 480 nm, émission 510 nm)27. Par conséquent, à l’aide de GFP signal comme reporter pour l’imagerie in vivo peut être interrompu par l’hémoglobine, les protéines et l’eau en animaux26. Fluorescence proche infrarouge (NIR) est idéal pour in vivo d’imagerie parce que sa fenêtre d’absorbance est d’environ 650-900 nm28, qui est la région le plus bas coefficient d’absorption de l’hémoglobine (< 650 nm) et de l’eau (> 900 nm)26 ,,28 . En outre, lorsque le tissu absorbe la lumière, il y a une chance pour induire l’autofluorescence. Lorsque les longueurs d’onde d’excitation et d’émission varient dans la fenêtre de la GFP, il induit beaucoup plus autofluorescence que NIR29. Utilisation du NIR peut améliorer le rapport signal sur arrière-plan par rapport à celle de la GFP en éliminant l’autofluorescence fond29. Bioluminescence n’exige pas l’excitation d’énergie pour produire de la lumière visible. Cela dépend de la réaction pour catalyser la luciférine de substrat de la luciférase enzyme et générer lumière. Puisque bioluminescence n’exige pas la lumière directement sur un échantillon, le signal de fond auprès d’un échantillon est très faible. Par conséquent, utiliser de la bioluminescence comme un reporter est plus générale et plus facile pour l’imagerie in vivo . En revanche, la fluorescence requiert une excitation lumineuse pour induire le signal lumineux. Lorsque les tissus absorbent la lumière, il y a une chance que la lumière fluorescente retentit et induire l’autofluorescence afin que leur signal sur bruit est plus élevé comparé à celui de la bioluminescence.
Vu EHEC est naturellement moins colonisés chez les souris par infection orale2,22, un pathogène muqueux naturel des souris, appelée Citrobacter rodentium, a été utilisé pour étudier le mécanisme de la colonisation à murine hôte comme un remplacement des bactérie22,30. Deux EHEC et c. rodentium colonisent la muqueuse intestinale et provoquent la formation de lésions A/E en hôte22,30. Ils contiennent également de l’île de pathogénicité de LEE, qui encode un T3SS et plusieurs protéines effectrices qui induit des lésions A/E22,30. Par conséquent, l’utilisation de la luciférase exprimant le plasmide comme journaliste à c. rodentium de détecter la pathologie de colonisation et d’étudier le mécanisme de colonisation via un système d’imagerie in vivo a été également signalé14, 15. Néanmoins, tandis que c. rodentium infection de souris est un modèle utile pour étudier la fonction de T3SS et le mécanisme de la lésion A/E, c. rodentium ne contient pas de Shiga toxine (Stx)30, qui est une position dominante facteur de virulence qui provoque une insuffisance rénale à EHEC, particulièrement le sérotype O157 : H7,3. Bien qu’une souche de Stx exprimant c. rodentium a été construite récemment,31, qui est plus réaliste de l’infection à ECEH, il ne comprend pas autres facteurs de virulence potentiels ECEH qui sont cruciaux pour la colonisation et/ou infection. En outre, c. rodentium partage 67 % de ses gènes avec ECEH32, ce qui suggère que les EHEC peut utiliser une virulence distincte de c. rodentium durant la colonisation et/ou infection.
La luciférase exprimant le plasmide utilisé ici, pWF27913, modification du pAKlux29 dont le squelette est pBBR1MCS433. Bien que les pBBR1MCS4 ont été testées et répliquées dans diverses bactéries33, il est crucial de s’assurer de l’origine de réplication (ORI) de ce plasmide est adapté pour l’hôte bactérien avant d’utiliser ce système de luciférase axée sur le plasmide pour l’expérience et ce qui confirme que cette luciférase exprimant le plasmide peut reproduire dans l’hôte bactérien. Stress aux antibiotiques nous permet de maintenir la stabilité des plasmides dans les bactéries. Lorsque les bactéries pénètrent dans les animaux en l’absence d’antibiotiques, le signal de bioluminescent d’ECEH sauvage a été détecté au moins 2 jours. Cependant, nous n’avons pas suite à une infection pendant plus de 2 jours car nous avions déjà vu une différence significative dans l’intensité luminescente entre EHEC WT et EHEC rfaD (qui encode un gène nécessaire à EHEC synthèse intactes LPS) mutant à 2 jours. Pour conserver le plasmide stablement dans les bactéries sous l’absence d’antibiotiques, un plasmide pCM1710,34 peut être utilisé à cet effet. pCM17 code pour un système de cloisonnement de deux-plasmide et un mécanisme de mise à mort post-segregational pour assurer le maintien du plasmide dans les bactéries en l’absence d’antibiotiques10,,34. Le plasmide pCM17 contenant l’opéron luxCDABE conduit par le promoteur OmpC peut être détectée par signal bioluminescente au moins 7 jours8. Une autre méthode pour obtenir une bactérie expression bioluminescentes continue en l’absence d’antibiotiques est d’insérer luxABCDE gène dans le chromosome bactérien35. Francis et coll. utilisé transposon inséré la cassette d’opéron et antibiotiques luxABCDE insérée au hasard dans le chromosome de Streptococcus pneumoniae pour obtenir la bioluminescence souche stable35.
Dans notre précédente étude13, nous avons utilisé ce système modèle pour examiner la colonisation ECEH chez un hôte et comparer la différence de capacité de colonisation entre les EHEC sauvage (WT) et un mutant13. Quand les souris ont reçu le mutant de rfaD EHEC bioluminescent, les signaux bioluminescentes a diminué considérablement par rapport à que d’ECEH WT après 2 jours après l’infection. Il fournit une preuve que ce modèle murin peut analyser l’effet de la mutation de la colonisation d’ECEH chez l’hôte. En outre, des traitements thérapeutiques pour réduire la colonisation d’ECEH est une solution réfléchie, potentielle d’infections à ECEH puisque l’utilisation d’antibiotiques est contre-indiquée5,36. Par conséquent, il convient tester si ce système de modèle peut être utilisé pour examiner l’efficacité de la lutte contre la colonisation médicaments/traitements contre la colonisation des entérobactéries chez l’hôte. Nous croyons qu’en utilisant ce système de modèle, il est possible d’examiner le calendrier et la localisation des EHEC ne consiste pas seulement, mais aussi des autres entérobactéries colonisation in vivo. En utilisant ce modèle animal, le processus de colonisation d’ECEH chez la souris peut être surveillé et le fardeau de la colonisation de l’hôte peut être quantifié afin de déterminer la colonisation spatiale et temporelle des EHEC animaux vivants. La visualisation et la quantification de la colonisation des entérobactéries en utilisant ce modèle rend un excellent outil pour étudier et analyser les mécanismes fines de colonisation entérobactérie et ainsi compenser l’insuffisance de la recherche de la colonisation et améliorer les connaissances actuelles.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous reconnaissons Chi-Chung Chen de la Department of Medical Research, Chi Mei Medical Center (Tainan, Taïwan) à l’aide de la souris, maladies infectieuses et le soutien du centre animaux Laboratoire National Cheng Kung University. Ce travail est soutenu par le ministre de la Science et la technologie (MOST) accorde (plus 104-2321-B-006-019, 105-2321-B-006-011,-005 and106-2321-B-006) aux CC.
matériels
| Name | Company | Catalog Number | Comments |
| Shaker incubator | YIH DER | LM-570R | bacteria incubation |
| Orbital shaking incubator | FIRSTEK | S300 | bacteria incubation |
| pBSL180 | source of nptII gene | ||
| pAKlux2 | source of luxCDABE operon | ||
| T&A Cloning Kit | Yeastern Biotech | FYC001-20P | use for TA cloning |
| Nsi I | NEB | R0127S | use for plasmid cloning |
| Sca I | NEB | R0122S | use for plasmid cloning |
| Spe I-HF | NEB | R0133S | use for plasmid cloning |
| Sma I | NEB | R0141S | use for plasmid cloning |
| T4 ligase | NEB | M0202S | use for plasmid cloning |
| Ex Taq | TaKaRa | RR001A | use for PCR amplification |
| 10X Ex Taq Buffer | TaKaRa | RR001A | use for PCR amplification |
| dNTP Mixture | TaKaRa | RR001A | use for PCR amplification |
| PCR machine | applied Biosystem | 2720 thermal cycler | for PCR amplification |
| Glycerol | SIGMA | G5516-1L | use for bacteria stocking solution |
| NaCl | Sigma | 31434-5KG-R | chemical for making LB medium, 10 g/L |
| Tryptone | CONDA pronadisa | Cat 1612.00 | chemical for making LB medium, 10 g/L |
| Yeast Extract powder | Affymetrix | 23547-1 KG | chemical for making LB medium, 5 g/L |
| Agar | CONDA pronadisa | Cat 1802.00 | chemical for making LB agar |
| kanamycin | Sigma | K4000-5G | antibiotics, use for seleciton |
| streptomycin | Sigma | S6501-100G | antibiotics, eliminate the microbiota in mice |
| EDL933 competent cell | Homemade | method is on supplemental document | |
| Electroporator | MicroPulser | for electroporation | |
| Electroporation Cuvettes | Gene Pulser/MicroPulser | 1652086 | for electroporation |
| High-speed centrifuge | Beckman Coulter | Avanti, J-26S XP | use for centrifuging bacteria |
| Fixed-Angle Rotor | Beckman Coulter | JA25.5 | use for centrifuging bacteria |
| Fixed-Angle Rotor | Beckman Coulter | JLA10.5 | use for centrifuging bacteria |
| centrifuge bottles | Beckman Coulter | REF357003 | use for centrifuging bacteria |
| centrifuge bottles | Thermo Fisher scientific | 3141-0500 | use for centrifuging bacteria |
| eppendorf biophotometer plus | eppendorf | AG 22331 hamburg | for measuring the OD600 value of bacteria |
| C57BL/6 mice | Laboratory Animal Center of NCKU | ||
| lab coat, gloves | for personnel protection | ||
| isoflurane | Panion & BF Biotech Inc. | G-8669 | for mice anesthesia, pharmaceutical grade |
| 1ml syringe | use for oral gavage of mice | ||
| Reusable 22 G ball-tipped feeding needle | φ0.9 mm X L 50 mm | use for oral gavage of mice | |
| surgical scissors | use for mice experiment | ||
| Xenogen IVIS 200 imaging system | Perkin Elmer | IVIS spectrum | use for bioluminescent image capture |
| Living Image Software | Perkin Elmer | version 4.1 | use for quantifying the image data |
Références
- Pennington, H. Escherichia coli O157. Lancet. 376 (9750), 1428-1435 (2010).
- Mayer, C. L., Leibowitz, C. S., Kurosawa, S., Stearns-Kurosawa, D. J. Shiga toxins and the pathophysiology of hemolytic uremic syndrome in humans and animals. Toxins (Basel). 4 (11), 1261-1287 (2012).
- Tarr, P. I., Gordon, C. A., Chandler, W. L. Shiga-toxin-producing Escherichia coli and haemolytic uraemic syndrome. Lancet. 365 (9464), 1073-1086 (2005).
- Obrig, T. G. Escherichia coli Shiga Toxin Mechanisms of Action in Renal Disease. Toxins (Basel). 2 (12), 2769-2794 (2010).
- Nguyen, Y., Sperandio, V. Enterohemorrhagic E. coli (EHEC) pathogenesis. Front Cell Infect Microbiol. 2, 90 (2012).
- Wiles, S., Robertson, B. D., Frankel, G., Kerton, A. Bioluminescent monitoring of in vivo colonization and clearance dynamics by light-emitting bacteria. Methods Mol Biol. 574, 137-153 (2009).
- Hutchens, M., Luker, G. D. Applications of bioluminescence imaging to the study of infectious diseases. Cell Microbiol. 9 (10), 2315-2322 (2007).
- Rhee, K. J., et al. Determination of spatial and temporal colonization of enteropathogenic E. coli and enterohemorrhagic E. coli in mice using bioluminescent in vivo imaging. Gut Microbes. 2 (1), 34-41 (2011).
- Karsi, A., Lawrence, M. L. Broad host range fluorescence and bioluminescence expression vectors for Gram-negative bacteria. Plasmid. 57 (3), 286-295 (2007).
- Lane, M. C., Alteri, C. J. S., Smith, S. N., Mobley, L. H. Expression of flagella is coincident with uropathogenic Escherichia coli ascension to the upper urinary tract. Proc Natl Acad Sci U S A. 104 (42), 16669-16674 (2007).
- Roxas, J. L., et al. Enterohemorrhagic E. coli alters murine intestinal epithelial tight junction protein expression and barrier function in a Shiga toxin independent manner. Lab Invest. 90 (8), 1152-1168 (2010).
- Siragusa, G. R., Nawotka, K., Spilman, S. D., Contag, P. R., Contag, C. H. . Real-Time Monitoring of Escherichia coli O157:H7 Adherence to Beef Carcass Surface Tissues with a Bioluminescent Reporter. , (1999).
- Kuo, C. J., et al. Mutation of the Enterohemorrhagic Escherichia coli Core LPS Biosynthesis Enzyme RfaD Confers Hypersusceptibility to Host Intestinal Innate Immunity In vivo. Front Cell Infect Microbiol. 6, 82 (2016).
- Wiles, S., et al. Organ specificity, colonization and clearance dynamics in vivo following oral challenges with the murine pathogen Citrobacter rodentium. Cell Microbiol. 6 (10), 963-972 (2004).
- Wiles, S., Pickard, K. M., Peng, K., MacDonald, T. T., Frankel, G. In vivo bioluminescence imaging of the murine pathogen Citrobacter rodentium. Infect Immun. 74 (9), 5391-5396 (2006).
- Contag, C. H., Contag, P. R., Mullins, J. I., Spillman, S. D., Stevenson, D. K., Benaron, D. A. Photonic detection of bacterial pathogens in living hosts. Mol Microbiol. 18 (4), 593-603 (1995).
- Hardy, J., Francis, K. P., DeBoer, M., Chu, P., Gibbs, K., Contag, C. H. Extracellular replication of Listeria monocytogenes in the murine gall bladder. Science. 303 (5659), 851-853 (2004).
- Kaniga, K., Sory, M. P., Delor, I., Saegerman, C., Limet, J. N., Cornelis, G. R. Monitoring of Yersinia enterocolitica in Murine and Bovine Feces on the Basis of the Chromosomally Integrated luxAB Marker Gene. Appl Environ Microbiol. 58 (3), 1024-1026 (1992).
- Trcek, J., Fuchs, T. M., Trulzsch, K. Analysis of Yersinia enterocolitica invasin expression in vitro and in vivo using a novel luxCDABE reporter system. Microbiology. 156 (Pt 9), 2734-2745 (2010).
- Morin, C. E., Kaper, J. B. Use of stabilized luciferase-expressing plasmids to examine in vivo-induced promoters in the Vibrio cholerae vaccine strain CVD 103-HgR. FEMS Immunol Med Microbiol. 57 (1), 69-79 (2009).
- Law, R. J., Gur-Arie, L., Rosenshine, I., Finlay, B. B. In vitro and in vivo model systems for studying enteropathogenic Escherichia coli infections. Cold Spring Harb Perspect Med. 3 (3), a009977 (2013).
- Ritchie, J. M. Animal Models of Enterohemorrhagic Escherichia coli Infection. Microbiol Spectr. 2 (4), EHEC-0022-2013 (2014).
- Chou, T. C., et al. Enterohaemorrhagic Escherichia coli O157:H7 Shiga-like toxin 1 is required for full pathogenicity and activation of the p38 mitogen-activated protein kinase pathway in Caenorhabditis elegans. Cell Microbiol. 15 (1), 82-97 (2013).
- Alexeyev, M. F., Shokolenko, I. N. Mini-Tnl 0 transposon derivatives for insertion mutagenesis and gene delivery into the chromosome of Gram-negative bacteria. Gene. 160 (1), 59-62 (1995).
- Wiegand, I., Hilpert, K., Hancock, R. E. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nat Protoc. 3 (2), 163-175 (2008).
- Pansare, V., Hejazi, S., Faenza, W., Prud'homme, R. K. Review of Long-Wavelength Optical and NIR Imaging Materials: Contrast Agents, Fluorophores and Multifunctional Nano Carriers. Chem Mater. 24 (5), 812-827 (2012).
- Heim, R., Cubitt, A. B., Tsien, R. Y. Improved green fluorescence. Nature. 373 (6516), 663-664 (1995).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19 (4), 316-317 (2001).
- Frangioni, J. In vivo near-infrared fluorescence imaging. Current Opinion in Chemical Biology. 7 (5), 626-634 (2003).
- Collins, J. W., et al. Citrobacter rodentium: infection, inflammation and the microbiota. Nat Rev Microbiol. 12 (9), 612-623 (2014).
- Mallick, E. M., et al. A novel murine infection model for Shiga toxin-producing Escherichia coli. J Clin Invest. 122 (11), 4012-4024 (2012).
- Petty, N. K., et al. The Citrobacter rodentium genome sequence reveals convergent evolution with human pathogenic Escherichia coli. J Bacteriol. 192 (2), 525-538 (2010).
- Kovach, M. E., Elzer, P. H., Hill, D. S., Robertson , G. T., Farris, M. A., Roop, R. M., Peterson, K. M. Four new derivatives of the broad-host-range cloning vector pBBR1MCS, carrying different antibiotic-resistance cassettes. Gene. 166 (1), 175-176 (1995).
- Galen, J. E., Nair, J., Wang , J. Y., Wasserman, S. S., Tanner, M. K., Sztein , M. B., Levine, M. M. Optimization of Plasmid Maintenance in the Attenuated Live Vector Vaccine Strain Salmonella typhiCVD 908-htrA. Infect Immun. 67 (12), 6424-6433 (1999).
- Francis, K. P., et al. Visualizing pneumococcal infections in the lungs of live mice using bioluminescent Streptococcus pneumoniae transformed with a novel gram-positive lux transposon. Infect Immun. 69 (5), 3350-3358 (2001).
- Goldwater, P. N., Bettelheim, K. A. Treatment of enterohemorrhagic Escherichia coli (EHEC) infection and hemolytic uremic syndrome (HUS). BMC Med. 10, (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon