Method Article
In Situ MHC-tetramero macchiatura e analisi quantitativa per determinare la posizione, l'abbondanza e fenotipo di cellule T antigene-specifiche CD8 nei tessuti
In questo articolo
Riepilogo
Qui, descriviamo un metodo che unisce in situ MHC-tetramero colorazione immunoistochimica per determinare la localizzazione, fenotipo e la quantità di cellule T antigene-specifiche nei tessuti. Questo protocollo viene utilizzato per determinare le caratteristiche spaziali e fenotipiche delle cellule CD8 T antigene-specifiche rispetto a strutture in tessuti e altro tipo di cellula.
Abstract
Le cellule T sono fondamentali per molti processi immunologici, compreso rilevazione ed eliminando le cellule infettate da virus, impedendo l'autoimmunità, assistendo nella produzione delle cellule di B e delle cellule di plasma di anticorpi e rilevare ed eliminare le cellule tumorali. Lo sviluppo di MHC-tetramero macchiatura delle cellule T antigene-specifiche analizzate tramite flusso cytometry ha rivoluzionato la nostra capacità di studiare e comprendere l'immunobiologia delle cellule T. Mentre estremamente utile per determinare la quantità e il fenotipo delle cellule T antigene-specifiche, citometria a flusso non può determinare la localizzazione spaziale delle cellule T antigene-specifiche ad altre cellule e strutture nei tessuti e le attuali tecniche di disaggregazione per estrarre le T cellule necessarie per citometria a flusso hanno un'efficacia limitata in tessuti non linfoidi. In situ MHC-tetramero macchiatura (IST) è una tecnica per visualizzare le cellule T che sono specifiche per gli antigeni di interesse nei tessuti. In combinazione con immunohistochemistry (IHC), IST può determinare l'abbondanza, la posizione e il fenotipo delle cellule CD8 e CD4 T antigene-specifiche nei tessuti. Qui, descriviamo un protocollo per macchiare ed enumerare le cellule CD8 T antigene-specifiche, con specifici fenotipi che si trova all'interno di compartimenti tissutali specifici. Queste procedure sono le stesse che abbiamo usato nella nostra recente pubblicazione da Li et al., intitolato "cellule producenti su Virus dell'immunodeficienza delle scimmie in follicoli sono parzialmente soppresso da CD8+ cellule In Vivo." I metodi descritti sono ampiamente applicabili perché può essere utilizzati per localizzare, fenotipo e quantificare essenzialmente qualsiasi cella di CD8 T antigene-specifiche per cui i tetrameri MHC sono disponibili, in tutto il tessuto.
Introduzione
Le cellule T sono fondamentali per molti processi immunologici, compreso rilevazione ed eliminando le cellule infettate da virus, impedendo l'autoimmunità, assistendo nella produzione delle cellule di B e delle cellule di plasma di anticorpi e rilevare ed eliminare le cellule tumorali. Lo sviluppo del peptide/MHC di classe I tetramero macchiatura di antigene-specifiche le cellule CD8 T1 e il più recente sviluppo di MHC classe II tetramero macchiatura delle cellule di T CD42 tramite flusso cytometry ha rivoluzionato la nostra capacità di studiare e comprendere la immunobiologia delle cellule T. Mentre estremamente utile per determinare la quantità e il fenotipo delle cellule T antigene-specifiche, citometria a flusso non consente la rilevazione della localizzazione spaziale delle cellule T antigene-specifiche ad altre cellule e strutture nei tessuti e corrente tecniche di disaggregazione per estrarre le cellule T necessari per citometria a flusso hanno limitato l'efficacia in tessuti non linfoidi3.
Noi ed altri abbiamo sviluppato metodi utilizzando peptide-caricato MHC di classe I e classe II tetramer o multimer reagenti per macchiare le cellule CD8 e CD4 T antigene-specifiche in tessuti4,5,6,7, 8 , 9 , 10 , 11 , 12 , 13. IST questi metodi consentono la determinazione della posizione, abbondanza e fenotipo di cellule CD8 e CD4 T antigene-specifiche nei tessuti e forniscono un mezzo per rilevare di queste celle relative altre cellule e strutture nei tessuti. Il nostro gruppo ha utilizzato estesamente MHC-ho tetramero macchiatura per studiare il virus di immunodeficenza umana (HIV) - e virus dell'immunodeficienza delle scimmie (SIV) - cellule di T di CD8 specifiche nei tessuti linfoidi, genitale e rettale per acquisire una comprensione di HIV e SIV immunopatogenesi e per identificare correlazioni di vaccinazione successo strategie14,15,16,17. Inoltre, abbiamo anche sviluppato una tecnica che combina IST con ibridazione in situ (ISH) di localizzare e quantificare le cellule T CD8 specifici virus e cellule infettate da virus nei tessuti e di determinare i livelli di effettore--obiettivo in vivo 18 , 19.
Qui, descriviamo un protocollo utilizzando peptide-caricato MHC-I tetrameri per macchiare le cellule CD8 T antigene-specifiche nelle sezioni di tessuto fresco, a tessuti controcolorazione con IHC e quantificare le cellule con fenotipi specifici nei compartimenti tissutali specifici. Queste procedure sono le stesse sono state usate nella nostra recente pubblicazione da Li et al., in cui abbiamo determinato la posizione, l'abbondanza e fenotipo delle cellule di T di SIV-specific in tessuto linfoide durante l'infezione cronica di SIV in macachi20.
Per questa procedura, tessuti freschi sono sezionate e incubate durante la notte con caricamento del peptide di MHC-I tetrameri coniugati a molecole di tiocianato di fluorescina (FITC). Quindi sono fissati in paraformaldeide. Dopo aver sistemato il tessuto, il segnale dai tetrameri MHC viene amplificato usando gli anticorpi di coniglio anti-FITC e incubate con anticorpi di IgG di anti-coniglio fluorescente contrassegnati, che amplificano ulteriormente il segnale dai tetrameri associati. IHC è utilizzato in combinazione con IST per caratterizzare le cellule T antigene-specifiche e le cellule circostanti. Gli anticorpi che riconoscono epitopi sulla superficie delle cellule o nello spazio extracellulare sono inclusi in incubazione primaria con i tetrameri. Gli anticorpi che riconoscono epitopi intracellulari richiedono permeazione della parete della cellula prima della colorazione. Le sezioni di tessuto macchiato sono Imaging utilizzando un microscopio confocale e analizzati utilizzando software confocale. Cellule con etichettate vengono quantificate utilizzando software di microscopia confocale o ImageJ. Il protocollo descritto può essere utilizzato a macchiare essenzialmente qualsiasi cellule CD8 T antigene-specifiche in qualsiasi tessuto per cui MHC-I tetrameri sono disponibili.
Protocollo
1. giorno 1: taglio di tessuto fresco e incubazione primaria
- uso un bisturi per tagliare il tessuto fresco in pezzi piccoli (circa 0,5 cm di larghezza di 0,5 cm di altezza). Separatamente ogni tessuto per un pistone per colla e incorporarli con 3-5 mL dell'agarosi di basso-fusione di 4% in PBS. Etichettare il pistone con le informazioni di tessuto usando un adesivo. Metterlo in un supporto refrigerato in un secchio di ghiaccio per solidificare.
- Accendere il microtomo e impostare lo spessore delle sezioni a 200 µm. installa una lama di rasoio sulle microtomo e inserire lo stantuffo montato con il tessuto nel bagno microtomo.
- Preparare il tampone fosfato salino con eparina (PBS-H) aggiungendo 100 µ g/mL o 18,7 eparina U/mL di PBS per preservare il RNA e per consentire applicazioni ISH potenziali a valle. Riempire la vasca di microtomo, che copre il tessuto incorporato, con 100-120 mL di PBS-h refrigerati, sterile. Aggiungere cubetti di ghiaccio di PBS-H per il bagno per mantenere la temperatura a 0 - 2 ° C. Start il microtomo e tagliare il tessuto in 200 µm sezioni.
Nota: È importante mantenere i tessuti refrigerati sul ghiaccio per ridurre al minimo l'attività cellulare all'interno dei tessuti e perché tessuto fresco è più facile sezione quando è freddo. PBS da solo può essere utilizzato se non ci sono piani per ISH a valle. - In alternativa, per i tessuti che non tagliano bene con un microtomo (ad es., intestino e polmone), utilizzare un bisturi o una lama di rasoio per tagliare il tessuto in strisce sottili come vicino possibile a 200 µm.
- Etichetta il coperchio di piastre di coltura del tessuto 24 pozzetti con le informazioni del campione sperimentale e posizionare gli alloggiamenti di tessuto nei pozzetti corrispondenti. Refrigerati utilizza un pennello per trasferire le sezioni a una camera di tessuto insieme nel pozzetto di una piastra di coltura del tessuto 24 pozzetti contenente 1 mL di PBS-H.
Nota: Tessuto riutilizzabile camere dovrebbero essere fatto prima di iniziare la colorazione. Alloggiamenti del tessuto possono essere fatto utilizzando una provetta di snap con tappo rotondo-fondo in polipropilene 14 mL e rete metallica. Utilizzare una lama di rasoio affilata per tagliare sul fondo di una provetta di-salvapercussore rotondo-fondo in polipropilene 14 mL. Tagliare la rete metallica in cerchio per essere inserito nel foro nella parte inferiore del tubo. Calore il cerchio di maglia di filo con un becco Bunsen fino a quando è rovente. Impostare il cerchio di maglia di filo molto rapidamente e spingere il tubo sulla mesh. Verificare che la rete metallica è saldamente fissato alla parte inferiore del tubo e poi accuratamente tagliato fuori dalla parte superiore del tubo presso il marchio di 3 mL utilizzando una lama di rasoio affilata. Inserire fino a 3 sezioni di tessuto in ogni camera di tessuto, o fino a 1 cm 2 di tessuto per pozzetto. Mantenere almeno un pozzo vuoto tra pozzetti con combinazioni di diversi anticorpi per evitare la contaminazione incrociata. - Procedere al primario tetramero e anticorpo che macchia immediatamente dopo aver terminato il trasferimento di tutte le sezioni di taglio negli alloggiamenti del tessuti. Mantenere le sezioni sommerso e refrigerati in 1 mL di PBS-H a tutte le ore.
- Incubare le sezioni di tessuto durante la notte con 0,5 µ g/mL di coniugato FITC, peptide-caricato MHC-I tetrameri diluiti in PBS-H con 2% di siero di capra normale (NGS). Includono mouse o altri non-coniglio anticorpi direzionati alle epitopi extracellulari di interesse in questa incubazione (per esempio, gli anticorpi di anti-CD8 ratto diluito 1: 500 in PBS-H con 2% NGS). Posizionare 1 mL di anticorpi diluiti in ciascun pozzetto.
Nota: Occorre prestare attenzione quando si selezionano gli anticorpi CD8, come alcuni possono migliorare e alcuni in grado di inibire i tetrameri MHC vincolante a cellula T recettori 4 , 21. L'anticorpo di CD8 anti-umano di ratto descritto qui è instabile e a volte risulta in colorazione un po' debole. È usato qui per etichettatura triple perché è l'unico non-coniglio e CD8 non-anticorpo testato che le cellule T CD8 di macaco rhesus macchiato. - Utilizzare 1 mL di soluzione ogni pozzetto per l'anticorpo primario e tutti i successivi incubazioni ed eseguire questo e tutti i successivi dopo incubazione a 4 ° C, con le piastre su una piattaforma a dondolo.
Nota: Tessuti devono galleggiare liberamente nella camera.
2. Giorno 2: Fissazione e incubazione secondario
- dopo l'incubazione primaria, lavare le sezioni due volte con 1 mL di PBS-H refrigerati per 20 min ogni lavaggio. Fare questo trasferendo gli alloggiamenti del tessuto ad una piastra di coltura di tessuti diversi 24 pozzetti contenente 1 mL di PBS-H refrigerati nei pozzetti corrispondenti.
Nota: Fare attenzione a non gocciolare contenuto da un campione sperimentale in un altro, quando si spostano tra camere di tessuto. Per tutte le successive incubazioni e lavaggi, allo stesso modo trasferire camera del tessuto per un piatto pulito contenente la soluzione appropriata. Assicuratevi di controllare le sezioni negli alloggiamenti del tessuto durante la procedura per assicurarsi che le sezioni non si blocca ai lati delle sezioni del tessuto. Se essi, spingere indietro nella soluzione. - Fissare le sezioni con 1 mL di fresco paraformaldeide 4% tamponata con PBS per 2 h a temperatura ambiente (non sopra-difficoltà). Lavare con PBS freddo-H due volte per 5 min.
Attenzione: Paraformaldeide è tossico; indossare adeguati dispositivi di protezione personale.
Nota: Se il ricupero dell'antigene e permeabilizzazione è necessario per rilevare gli epitopi intracellulari, antigeni possono essere recuperati facendo bollire le sezioni nell'urea di 0.01 mol dopo la fissazione del paraformaldeide. - Trasferire le sezioni in piastre di coltura 24 pozzetti contenenti 0,01 mol urea e collocare questi piatti nel forno a microonde. Bollire le sezioni tre volte per circa 10 s ciascuno, per un totale di 30 s.
Nota: State molto attenti, come bollire la soluzione possibile forzare le sezioni dalle fonti. Se questo accade, è possibile utilizzare un pennello a riportare le sezioni dai lati della camera del tessuto o dal coperchio della piastra nella parte inferiore della camera del tessuto appropriato. - Prima per l'incubazione di anticorpo secondario, permeabilize e bloccare le sezioni di tessuto di incubarle in blocco soluzione contenente PBS-H, 0,3% detergente (PBS-H-T) e 2% NGS su un rocker per 1 h a 4 ° C. eseguire successive le incubazioni dell'anticorpo con NGS PBS-H-T/2%.
- Per l'incubazione secondaria, trasferire le sezioni negli alloggiamenti del tessuto a pozzetti contenenti coniglio anti-FITC anticorpo diluito 1: 10.000 in PBS-H-T/2% NGS. Incubare per una notte.
- Eseguire una colorazione di contrasto utilizzando anti-CD20 anticorpo diluito 1: 200 in PBS-H-T/2% NGS. Per questa opzione, recuperare gli epitopi se necessario, permeano le cellule e bloccare prima del termine dell'incubazione, come descritto in precedenza.
3. Giorno 3: Terziario incubazione
- dopo la seconda incubazione, lavare le sezioni tre volte in PBS-H a 4 ° C per almeno 20 min.
- Eseguire un'incubazione finale con l'appropriato con l'etichetta fluorescente anticorpi (ad es., capra anti-coniglio coniugato giallo-verdastro, colorante lontano rosso coniugati di capra anti-ratto e capra anti-topo coniugata colorante verde anticorpi diluito 1:5, 000, 1:5, 000 e 1:2, 000, rispettivamente, in PBS-H-T/2% NGS). Incubare per una notte.
Nota: A questo punto, l'incubazione può essere estesa fino a tre giorni se necessario. Mantenere le sezioni protette dalla luce avvolgendo le piastre in carta stagnola durante questo incupassaggio di Angela e, successivamente, come luce disseta fluorofori.
4. Giorno 4: Montaggio delle sezioni
- lavare le sezioni tre volte in PBS-H per almeno 20 min.
Nota: Se la pianificazione per downstream ISH 19, fissare le sezioni in paraformaldeide al 4% per 1 h per garantire i tetrameri e anticorpi in luogo e poi lavare le sezioni due volte con PBS-H per 5 minuti ciascuno.
Attenzione: Paraformaldeide è tossico; indossare adeguati dispositivi di protezione personale. - Utilizzare un pennello per trasferire le sezioni su un vetrino da microscopio. Fare attenzione a non colpire il tessuto troppo. Spalmate ogni sezione glicerolo/gelatina contenente 4 mg/mL n-propyl gallate o un altro mezzo di montaggio contenente un fluoroforo conservante. Coprire con un vetrino coprioggetti.
- Conservare i vetrini in un contenitore protetto da luce diapositiva a -20 ° C. lavare le piastre di coltura del tessuto e rimuovere le etichette sui coperchi utilizzando alcool.
Nota: Le piastre possono essere riutilizzate.
5. Acquisizione di immagini al microscopio confocale
- cattura immagini ad alta risoluzione con un microscopio confocale, utilizzando il laser appropriato e filtri per ogni fluoroforo ( Figura 1A e B).
Nota: In questo esempio, (Vedi la Tabella materiali) è stato utilizzato un microscopio confocale. Immagini sono state raccolte utilizzando il 561 nm laser al 20% di energia per le cellule di T antigene-specifiche con etichetta giallo verdastre, il laser di 488 nm a potenza del 10% per le cellule di B che esprimono CD20 con etichetta verde e il laser di 640 nm a 15% di potenza per le cellule di T di CD8 lontano rosso-etichettati. Sono stati utilizzati il 20X obiettivo e un'apertura numerica di 0.8. - Raccogliere in sequenza di intervalli di z-serie a 3 µm (o altro) nei tre canali in più campi di 800 x 800 pixel. Costruire un montaggio dei campi raccolti ( Figura 1 -E). Nome di ogni immagine di montaggio sulla base delle informazioni della diapositiva corrispondente e salvare per l'analisi.
- Eseguire analisi quantitativa delle immagini utilizzando il software di analisi e quantificazione del rispettivo microscopio confocale o ImageJ.
6. Analisi quantitativa delle immagini
Nota: analisi quantitativa delle immagini possono essere realizzato utilizzando software di analisi e quantificazione del microscopio confocale o utilizzando il software ImageJ. Qui, ImageJ è stata usata come esempio.
- Open al confocale montage trascinandolo nella finestra di ImageJ ( Figura 2A).
Nota: ImageJ può aprire direttamente raccolti da molti microscopi confocali diversi montaggi. Se il montaggio non può essere aperto direttamente da ImageJ, esportare il z-scan selezionato come file TIFF per aprire it. - Duplicare la z-scan selezionato per l'analisi (" immagine "-> " duplicare ") ( Figura 2B).
- Dividere i diversi canali (" immagine "-> " colore "-> " canali Split ") ( Figura 2).
- Disegnare il ROI per l'analisi quantitativa nel canale corrispondente per essere obiettivo e aggiungerlo al gestore di ROI premendo " T " sulla tastiera. Misurare l'area.
Nota: Il gestore di ROI di ImageJ Mostra l'area in µm 2 ( Figura 2D). - Regolare la fluorescenza luminosità e contrasto del canale da analizzare (" immagine "-> " regolare "-> " luminosità/contrasto ") ( Figura 2E).
- Appiattire il ROI sull'immagine (" manager ROI "-> " Flatten ") ( Figura 2F).
- Quantificare le cellule positive nell'immagine utilizzando il " multi-punto " strumento ( Figura 2).
Risultati
Figura 1 Mostra come raccogliere immagini confocal utilizzando un microscopio confocale. Nella figura 2 viene illustrata l'analisi quantitativa immagine usando ImageJ. Figure 3 e 4 indicano rappresentante immagini dei tessuti di linfonodo da un SIV infettati macaco rhesus macchiato con tetrameri MHC, CD8 anticorpi e anticorpi CD20 e servono a dimostrare la specificità della MHC-tetramero colorazione. Figura 3 confronta MHC di classe I tetrameri caricato con un peptide da SIV rispetto alle sezioni dallo stesso tessuto macchiato con MHC di classe I tetrameri caricato con un peptide irrilevante. La figura 4 Mostra che le cellule colorate con il tetramero SIV/MHC-peptide sono co-macchiate con gli anticorpi CD8, ma non gli anticorpi di CD20, che macchia le cellule B. Figura 5 Mostra un esempio di un fotomontaggio creato da più campi di confocal z-serie usati per la quantificazione del tetramero macchiato le cellule con fenotipi specifici in diversi compartimenti anatomici il linfonodo. L'ingrandimento mostra un'area di linfonodo con un follicolo di cellule B delineato dalla macchiatura di CD20 e la circostante zona di cellula T, in cui possono essere rilevate cellule MHC-tetramero-macchiate, alcuni dei quali co-esprimono Ki67 che è un marker di attivazione delle cellule T e la proliferazione. Questa combinazione di colorazione permette la determinazione del fenotipo di cellule T CD8 SIV-specifici all'interno e all'esterno di follicoli di cellule B, in relazione alle cellule T CD8 SIV-specifici e ad altre cellule esprimenti Ki67 e le cellule B.

Figura 1: Rappresentante Screenshots mostrare come raccogliere immagini Confocal utilizzando un microscopio confocale. (A) acquisizione modalità utilizzata per raccogliere immagini confocal. (B) canali utilizzati per la raccolta di immagini. (C) 20 X obiettivo e 800 x 800 pixel campi sono stati utilizzati nella raccolta di immagini. (D) una sequenziale z-stack è stato raccolto a intervalli di 3 µm. (E) piastrelle sono state adottate per delineare e raccogliere immagini in più campi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Screenshots rappresentante dimostrando quantitativa Image Analysis Using ImageJ. (A) Apri un montaggio confocale trascinandolo nella finestra di ImageJ. (B) duplicato il z-scan selezionato per l'analisi. (C) dividere i diversi canali. (D) disegnare il ROI per l'analisi quantitativa nel canale corrispondente per essere obiettivo e aggiungerlo al gestore di ROI premendo "t". (E) regolare la luminosità di fluorescenza e contrasto del canale per essere analizzati. Flatten (F) il ROI sull'immagine. (G) conteggio positivo cellule nell'immagine. Clicca qui per visualizzare una versione più grande di questa figura.
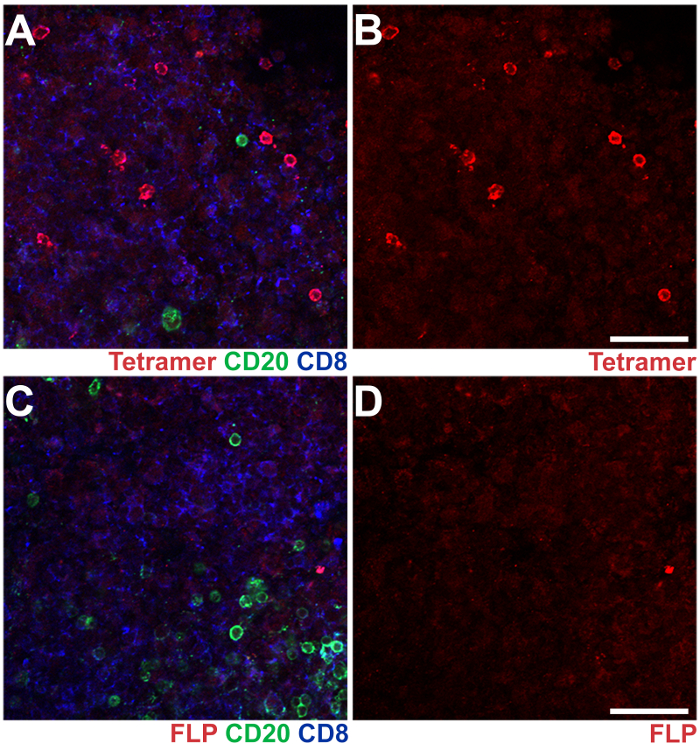
Figura 3 : IST combinato con IHC nelle sezioni di linfonodo ascellare da un macaco Rhesus SIV-infettati. Motta - A * 02 tetrameri caricati con SIV Nef YY9 peptidi sono stati utilizzati per macchiare le cellule CD8 T antigene-specifiche e simili tetrameri caricati con un peptide FLP irrilevante da virus dell'epatite B sono stati usati come controllo negativo (rosso). Anticorpi anti-CD20 mouse sono stati utilizzati per macchiare CD20+ B cellule (verde), e gli anticorpi anti-CD8 di ratto sono stati utilizzati per macchiare CD8+ T cellule (blu). (A), A immagine rappresentativa da una sezione di linfonodo ascellare macchiato con CD8, CD20 e tetrameri YY9 anticorpi. (B) la stessa immagine pannello un mostrando il tetramero YY9 macchia da solo. (C) immagine rappresentativa di una sezione dal stesso linfonodo ascellare, macchiato con gli anticorpi di CD20 e CD8 e tetrameri FLP. (D), la stessa immagine pannello C con il tetramero FLP macchia da solo. Scala bar = 100 µm. Clicca qui per visualizzare una versione più grande di questa figura.
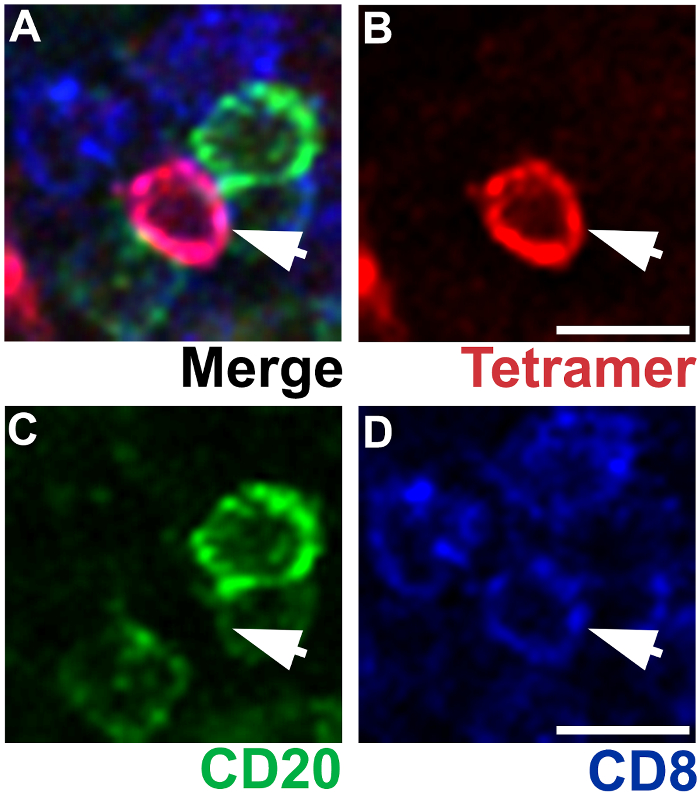
Figura 4 : IST combinato con IHC mostrando la specificità di macchiatura MHC-tetramero. Rappresentante di linfonodo ascellare sezione macchiato con tetrameri di Mamu - A * 02 caricati con peptidi Nef YY9 a cellule T CD8 SIV-specifiche di etichetta (rosse), anticorpi anti-CD20 del mouse alle cellule di B di etichetta (verde) e gli anticorpi anti-CD8 ratto alle cellule di T di CD8 etichetta (blue) (A ). Una cellula di T di CD8 SIV-specifici è tetramero + (B), CD20– (C) e CD8+ (D). Barre di scala = 10 µm. Clicca qui per visualizzare una versione più grande di questa figura.
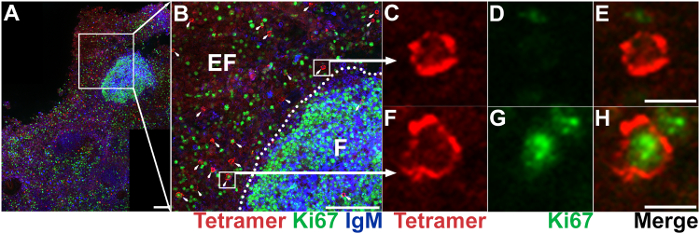
Figura 5: IST combinato con IHC per mostrare la posizione, l'abbondanza e fenotipo di cellule T antigene-specifiche CD8. (A) sezione di linfonodo ascellare rappresentante colorati con tetrameri di Mamu - A * 02 caricati con Nef YY9 peptidi per etichettare le cellule T CD8 SIV-specifici (rosse), Ki67 anticorpi per marcare le cellule proliferanti (verde) e IgM anticorpi alle cellule etichetta B (blu). Barra della scala = 100 µm. (B) l'allargamento di una regione selezionata nel pannello A. IgM colorazione definisce l'area follicolare, che è contrassegnato come "F"; l'area extrafollicular è contrassegnata come "EF". Le cellule tetramero+ sono indicate con le frecce. Barra della scala = 100 µm. rappresentante tetramero+ Ki67 cell– (C, D, E) e tetramero+ Ki67+ cellulare (F, G, H). Barra della scala = 10 µm. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
IST combinato con IHC fornisce uno strumento essenziale per rilevare, caratterizzare e quantificare le cellule CD8 T antigene-specifiche in ambienti nativi con il contesto di altre cellule e strutture del tessuto. Qui, abbiamo descritto le procedure dettagliate per IST combinato con IHC, seguita da analisi dell'immagine quantitativa, per determinare la posizione, l'abbondanza e fenotipo di cellule T CD8 antigene-specifiche nei linfonodi da macachi rhesus. Macchiatura simile può essere applicata all'essere umano, del mouse, o altri tessuti di specie per cui MHC-I tetrameri sono disponibili. Inoltre, peptide tetramero di MHC classe II o dextramer colorazione può essere eseguita utilizzando metodologie relativamente simili per marcare le cellule T CD4 + antigene-specifica in tessuti4,5,6,,7, 8 , 9 , 10 , 11 , 12 , 13. IST possono anche essere combinati con ISH per determinare, ad esempio, in vivo cellule effettrici-target livelli18,19. In futuro, sarà interessante trasportare IST/IHC ulteriormente combinando IST/IHC con avanzate in situ del DNA e RNA rilevamento metodologie. Gli avanzamenti recenti nelle analisi di ibridazione in situ includono lo sviluppo di RNAscope e DNAscope24. Queste tecniche consentono la rilevazione di DNA e RNA bersaglio nei tessuti. Sarà emozionante combinare queste metodologie con IST e IHC per rilevare contemporaneamente le cellule di T di CD8-virus-specifici, RNA virale, DNA virale e antigene anticorpo marcato di interesse.
Mentre abbiamo originariamente descritto metodi IST con tessuti freschi, tessuti che sono stati corretti per una breve durata e tessuti congelati4, negli ultimi anni, abbiamo utilizzato esclusivamente le sezioni di tessuto fresco, come producono costantemente le macchie di altissima qualità e consentire l'esame delle cellule in sezioni di tessuto spesso. Come un'alternativa ai procedimenti presentati qui, uno può applicare tetrameri ai tessuti, incubare per una notte, difficoltà, incorporare e crioconservare nel Congelamento medio (ad es., OCT), produrre sezioni sottili congelate ed eseguire IHC successive22. Allo stesso modo, abbiamo regolarmente macchia da solo un sottoinsieme delle sezioni del tessuto con tetrameri e poi congelare le sezioni di personalizzazione di Office per consentire in futuro ulteriori combinazioni di colorazione di contrasto. Inoltre, dei multimeri Qdot 655-coniugati peptide-MHC possono essere utilizzati per visualizzare direttamente le cellule T antigene-specifiche in tessuto crioconservati sezioni13.
Abbiamo descritto qui indiretta tetramero macchiatura. Colorazione diretta utilizzando tetrameri APC - o PE-coniugato ha anche dimostrato di funzionare4,22. In questo caso, la concentrazione del tetramero di MHC richiesto è superiore a quello utilizzato nella macchiatura indiretta tetramero. Nelle nostre mani, una concentrazione di 20 µ g/mL di APC-labeled tetramero era efficace nel rilevare le cellule antigene-specifiche. Tuttavia, l'intensità di macchiatura era molto inferiore a quella ottenuta con etichettatura indiretta, che comprende amplificazione con gli anticorpi anti-FITC.
Abbiamo trovato che l'uso di un microtomo basate sulla compressione (Vedi la Tabella materiali) per taglio di tessuto fresco ha facilitato il processo di taglio di sezioni di tessuto fresco come rispetto all'utilizzo di un microtomo vibrante23. Tuttavia, in casi dove un microtomo basate sulla compressione non è disponibile, un vibrante microtomo o bisturi possono essere utilizzato per il taglio di tessuto fresco.
Una limitazione principale di questa tecnica è l'uso di tessuti freschi. Utilizzando tessuti freschi è molto più difficile di tessuti fissi o congelati perché richiedono l'elaborazione e l'attenzione immediata. Abbiamo spedito con successo tessuti freschi durante la notte il ghiaccio in mezzo di coltura tissulare o PBS-H. Tuttavia, ci sono stati problemi occasionali con la spedizione; per esempio, tempeste di neve hanno ritardato la spedizione dei tessuti per 48 ore o più. In questi casi, abbiamo trovato che tessuti freschi sezionati e quelli macchiato dell'alberino-estrazione 48h generalmente mostrano una colorazione specifica, con segni di qualche degradazione del tessuto; tessuti macchiati post-estrazione 72 h sono troppo degradati per la colorazione. Inoltre abbiamo trovato che la spedizione dei tessuti freschi con blocchi di ghiaccio che sono troppo freddo o troppo vicino a che tessuti possono congelare i tessuti durante il trasporto; Questo congelamento generalmente distrugge il tessuto per la colorazione. Pertanto, è estremamente importante per spedire tessuti freschi, refrigerati, ma non congelato e per avviare IST macchiatura entro 24 h. tessuto fresco elaborazione anche richiede una grande quantità di studenti e personale del tempo, come tessuti da più animali o partecipanti allo studio non possono essere raccolti e macchiato insieme in una data successiva. Nonostante queste difficoltà, troviamo che le sezioni di tessuto fresco sono la scelta migliore per bella, specifici IST/IHC che macchia.
Un'altra limitazione del metodo IST/IHC descritto qui è l'approccio di macchiatura indiretta. A causa delle limitazioni sul numero di specie distinte di animali disponibili per generare combinazioni di anticorpo secondario, siamo limitati dall'anticorpo indiretto metodi all'anticorpo fluorescente solo tre o quattro combinazioni di colorazione in un momento di colorazione. Questo limita la quantità di informazioni che possono essere raccolti su una lastra di tessuto. Colorazione diretta di IHC supera questa limitazione e possibile espandere le funzionalità, rilevando otto o più antigeni anticorpo-tag contemporaneamente, anche se con ogni anticorpo producendo un segnale fluorescente molto più debole rispetto ai metodi indiretti. Così, IHC indiretta potrebbe essere utilizzato come alternativa all'IHC indiretta per colorazione di contrasto IST-tinto tessuti, permettendo per la rilevazione dei numeri aumentati degli antigeni cellulari quando combinato con la rilevazione di IST di cellule CD8 T antigene-specifiche.
In alcuni casi, sostanza autofluorescenza e/o legami aspecifici tetramero o anticorpo possono verificarsi con IST/ISH. Per questo motivo, buoni controlli positivi e negativi sono necessari per discernere le macchie specifiche da sfondo e autofluorescent macchiatura. Controllo delle buon negativo per MHC I tetrameri includono tessuti di controllo negativo (per esempio, i tessuti non infetti; tessuti macchiati con MHC I tetrameri caricato con peptidi irrilevanti o irrilevanti tetrameri MHC; o, in un pizzico, tessuti colorati con no tetrameri ma con amplificando anticorpi).
In sintesi, MHC I IST combinato con IHC è un valido strumento per determinare la posizione, l'abbondanza e fenotipo di cellule CD8 T antigene-specifiche nei tessuti. Questa metodologia consente il rilevamento di cellule CD8 T antigene-specifiche in ambienti nativi, con la localizzazione relativa ad altri tipi di cellule e strutture di tessuto mantenuti. Questo metodo è ampiamente applicabile perché può essere utilizzato per localizzare, fenotipo e quantificare essenzialmente qualsiasi cella di CD8 T antigene-specifiche per cui MHC tetrameri sono disponibili, in tutto il tessuto.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal servizio di sanità pubblica concede dal National Institutes of Health (T32 DA007097, R01AI096966, andUM1AI26617).
Materiali
| Name | Company | Catalog Number | Comments |
| MHC-I monomer | NIH tetramer core facility | Materials for MHC-tetramer preparation | |
| ExtrAvidin-FITC | Sigma-Aldrich | E2716 | Materials for MHC-tetramer preparation |
| Normal goat serum | Jackson Immunoresearch | 005-000-121 | |
| Low melt agarose | Promega | V3121 | |
| Heparin | Sigma-Aldrich | SLBL6391V | |
| Triton X-100 | Sigma-Aldrich | T-6878 | |
| Urea | J.T.Baker | 4204-05 | |
| Glycerol gelatin | Sigma-Aldrich | SLBH2672V | |
| n-propyl gallate | Sigma-Aldrich | P3130 | |
| rat-a-h-CD8 (1:500) | Acris | 0714 | Antibody unstable, use single use frozen aliquot |
| m-a-h-CD20 (1:500) | NOVOCASTRA | 6026819 | |
| m-a-h-Ki67 (1:500) | Vector | 6022201 | |
| goat-a-m-A488 (1:2,000) | Jackson Immunoresearch | 124083 | |
| goat-a-rb-Cy3 (1:5,000) | Jackson Immunoresearch | 106232 | |
| goat-a-rat-Cy5 (1:5,000) | Jackson Immunoresearch | 118088 | |
| goat-a-h-IgM-Dylight649 (1:5,000) | Jackson Immunoresearch | 86579 | |
| Compresstome: VF-300 Microtome | Precisionary Instruments, LLC | 1079 | |
| Quick Set Instant Adhesive | Loctite | 46551 | |
| 24-well flat bottomed tissue culture plates | Falcon | 353226 | |
| Microscope slide | Globe scienfitic Inc. | #1321 | |
| Razor blade | Ted Pella, Inc | 121-6 | |
| Feather Disposable Scalpel | FEATHER SAFETY RAZOR CO. LTD. | No. 21 | |
| Round paintbrush #2 | PRINCETON ART & BRUSH CO. | 4350R | Can trim as needed with razor |
| Confocal Microscope | Olympus | FV1000 | |
| FV10-ASW_Viewer4.0 | Olympus |
Riferimenti
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Novak, E. J., Liu, A. W., Nepom, G. T., Kwok, W. W. MHC Class II tetramers identify peptide-specific human CD4(+) T cells proliferating in response to influenza A antigen. J Clin Invest. 104, R63-R67 (1999).
- Steinert, E. M., et al. Quantifying memory CD8 T cells reveals regionalization of immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Skinner, P. J., Daniels, M. A., Schmidt, C. S., Jameson, S. C., Haase, A. T. Cutting edge: In situ tetramer staining of antigen-specific T cells in tissues. J Immunol. 165 (2), 613-617 (2000).
- Haanen, J. B., et al. In situ detection of virus- and tumor-specific T-cell immunity. Nat Med. 6 (9), 1056-1060 (2000).
- Skinner, P. J., Haase, A. T. In situ tetramer staining using MHC class I tetramers. J Immunol Methods. 268 (1), 29-34 (2002).
- Skinner, P. J., Haase, A. T. In situ staining using MHC class I tetramers. Curr Protoc Immunol. 17, 4.1-4.9 (2004).
- Li, Y., et al. Use of HLA-DR*08032/E7 and HLA-DR*0818/E7 tetramers in tracking of epitope-specific CD4+ T cells in active and convalescent tuberculosis patients compared with control donors. Immunobiology. 216, 947-960 (2011).
- Bischof, F., et al. Analysis of autoreactive CD4 T cells in experimental autoimmune encephalomyelitis after primary and secondary challenge using MHC class II tetramers. J Immunol. 172, 2878-2884 (2004).
- Massilamany, C., et al. Direct staining with major histocompatibility complex class II dextramers permits detection of antigen-specific, autoreactive CD4 T cells in situ. PLoS ONE. 9, e87519(2014).
- Massilamany, C., et al. In situ detection of autoreactive CD4 T cells in brain and heart using major histocompatibility complex class II dextramers. J Vis Exp. (90), e51679(2014).
- Dileepan, T., Kim, H. O., Cleary, P. P., Skinner, P. J. In Situ Peptide-MHC-II Tetramer Staining of Antigen-Specific CD4+ T Cells in Tissues. PLoS ONE. 10 (6), e0128862(2015).
- Tjernlund, A., et al. In situ detection of Gag-specific CD8+ cells in the GI tract of SIV infected Rhesus macaques. Retrovirology. 7, 7-12 (2010).
- Connick, E., et al. CTL fail to accumulate at sites of HIV-1 replication in lymphoid tissue. J Immunol. 178, 6975-6983 (2007).
- Hong, J. J., et al. Localized Populations of CD8low/− MHC Class I Tetramer+ SIV-Specific T Cells in Lymphoid Follicles and Genital Epithelium. PLoS ONE. 4 (1), e4131(2009).
- Sasikala-Appukuttan, A. K., et al. Location and dynamics of the immunodominant CD8 T cell response to SIVΔnef immunization and SIVmac251 vaginal challenge. PLoS ONE. 8 (12), e81623(2013).
- Connick, E., et al. Compartmentalization of simian immunodeficiency virus replication within secondary lymphoid tissues of rhesus macaques is linked to disease stage and inversely related to localization of virus-specific CTL. J Immunol. 193, 5613-5625 (2014).
- Li, Q., et al. Visualizing antigen-specific and infected cells in situ predicts outcomes in early viral infection. Science. 323, 1726-1729 (2009).
- Li, Q., Skinner, P. J., Duan, L., Haase, A. T. A technique to simultaneously visualize virus-specific CD8+ T cells and virus-infected cells in situ. J Vis Exp. (30), e1561(2009).
- Li, S., et al. Simian immunodeficiency virus-producing cells in follicles are partially suppressed by CD8+ cells in vivo. J Virol. 90, 11168-11180 (2016).
- Daniels, M. A., Jameson, S. C. Critical role for CD8 in T cell receptor binding and activation by peptide/major histocompatibility complex multimers. J Exp Med. 191, 335-346 (2000).
- Lee, Y. J., Wang, H., Starrett, G. J., Phuong, V., Jameson, S. C., Hogquist, K. A. Tissue specific distribution of iNKT cells impacts their cytokine response. Immunity. 43 (3), 566-578 (2015).
- Abdelaal, H. M., Kim, H. O., Wagstaff, R., Sawahata, R., Southern, P. J., Skinner, P. J. Comparison of Vibratome and Compresstome sectioning of fresh primate lymphoid and genital tissues for in situ MHC-tetramer and immunofluorescence staining. Biol Proced Online. 17, (2015).
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. J Mol Diagn. 14 (1), 22-29 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon