Method Article
In Situ La tinción de tetrámero de MHC y análisis cuantitativo para determinar la localización, abundancia y fenotipo de células de T CD8 específica de antígeno en los tejidos
En este artículo
Resumen
Aquí, describimos un método que combina en situ MHC tetramer tinción con inmunohistoquímica para determinar localización, fenotipo y cantidad de antígenos específicos de células T en los tejidos. Este protocolo se utiliza para determinar las características espaciales y fenotípicas de las células de T CD8 específica de antígeno con respecto a otro tipo de célula y las estructuras de los tejidos.
Resumen
Las células T son esenciales para muchos procesos inmunológicos, incluyendo la detección y eliminación de células infectadas por virus, previniendo autoinmunidad, ayudando en la producción de células B y células plasmáticas de anticuerpos y detectar y eliminar las células cancerosas. El desarrollo de la tinción de tetrámero de MHC de las células antígeno específicas analizadas por citometría de flujo ha revolucionado nuestra capacidad para estudiar y comprender la Inmunobiología de las células. Mientras que extremadamente es útil para determinar la cantidad y el fenotipo de las células T específicas de antígeno, citometría de flujo no puede determinar la localización espacial de las células a otras células y estructuras de los tejidos y las técnicas actuales de desagregación específica de antígeno para extraer la T las células necesitan para citometría de flujo han limitado eficacia en tejidos no linfoides. In situ Tinción de MHC-tetrámero (IST) es una técnica para visualizar las células T que son específicas para antígenos de interés en los tejidos. En combinación con inmunohistoquímica (IHQ), IST puede determinar la abundancia, la ubicación y el fenotipo de las células CD8 y CD4 T específica de antígeno en los tejidos. Aquí, describimos un protocolo para manchar y para enumerar las células de T CD8 específica de antígeno, con fenotipos específicos ubicados dentro de compartimientos de tejido específico. Estos procedimientos son los mismos que utilizamos en nuestra reciente publicación por Li et al., titulado "las células productoras de Virus Simian de la inmunodeficiencia en los folículos se suprimen parcialmente por CD8 células+ en Vivo." Los métodos descritos son ampliamente aplicables ya que se pueden utilizar para localizar, fenotipo y cuantificar esencialmente cualquier célula T CD8 específica de antígeno para el cual tetrámeros de MHC están disponibles, en cualquier tejido.
Introducción
Las células T son esenciales para muchos procesos inmunológicos, incluyendo la detección y eliminación de células infectadas por virus, previniendo autoinmunidad, ayudando en la producción de células B y células plasmáticas de anticuerpos y detectar y eliminar las células cancerosas. El desarrollo del péptido/MHC clase I tetrámero tinción de antígenos específicos de las células T CD81 y el más reciente desarrollo de MHC clase II la tinción de tetrámero de T CD4 células2 por citometría de flujo revolucionó nuestra capacidad para estudiar y comprender la Inmunobiología de las células. Mientras que extremadamente es útil para determinar la cantidad y el fenotipo de las células T específicas de antígeno, citometría de flujo no permite la detección de la localización espacial de las células antígeno específicas a otras células y estructuras en los tejidos y actual técnicas de desagregación para extraer las células T necesitan para citometría de flujo han limitado eficacia en tejidos no linfoides3.
Nosotros y otros hemos desarrollado métodos cargados de péptido MHC de clase I y clase tetrámero II multimer reactivos o para teñir las células CD8 y CD4 T específica de antígeno en los tejidos4,5,6,7, 8 , 9 , 10 , 11 , 12 , 13. IST estos métodos permiten la determinación de la localización, abundancia y fenotipo de las células CD8 y CD4 T específica de antígeno en los tejidos y proporcionar un medio para la detección de estas células en comparación con otras células y estructuras en los tejidos. Nuestro grupo ha utilizado extensivamente la MHC-I tetrámero tinción para estudio de virus de inmunodeficiencia humana (VIH) - y virus de la inmunodeficiencia símica (VIS) - células T CD8 específicas en tejidos linfoides, genitales y rectales para obtener un entendimiento de la inmunopatogénesis del VIH y SIV e identificar correlatos de vacunación exitoso estrategias14,15,16,17. Además, también desarrollamos una técnica que combina IST con hibridación en situ (ISH) para localizar y cuantificar virus específicos de células T CD8 y células infectadas por virus en los tejidos y para determinar los niveles de efector a destino en vivo 18 , 19.
Aquí, describimos un protocolo usando cargado de péptido MHC-I tetrámeros para teñir las células de T CD8 específica de antígeno en secciones de tejido fresco, hasta tejidos de contratinción con IHC y cuantificar las células con fenotipos específicos en compartimientos de tejido específico. Estos procedimientos son los mismos que fueron utilizados en nuestra reciente publicación por Li et al., en el que se determinaron la localización, abundancia y fenotipo de células T específicas de la SIV en tejido linfoide durante la infección crónica de vis en macacos20.
Para este procedimiento, los tejidos frescos son seccionados y se incubó toda la noche con carga de péptido MHC-I tetrámeros conjugan con moléculas de tiocianato de fluoresceína (FITC). Luego están fijados en paraformaldehido. Después de fijar el tejido, la señal de los tetrámeros de MHC se amplifica usando conejo anti-FITC anticuerpos y se incubaron con fluorescente etiquetados anticuerpos de IgG de Anti-conejos que más amplifican la señal de los tetrámeros encuadernados. IHC se usa junto con IST para caracterizar antígenos específicos de células T y las células circundantes. En la incubación primaria con los tetrámeros se incluyen anticuerpos que reconocen epítopos en la superficie de las células o en el espacio extracelular. Anticuerpos que reconocen epítopos intracelulares requieren permeabilidad de la pared celular antes de la tinción. Las secciones de tejidos teñidos son imágenes con un microscopio confocal y analizan usando el software confocal. Las células marcadas se cuantifican mediante microscopía confocal software o ImageJ. El protocolo descrito se puede utilizar para manchar esencialmente cualquier célula T CD8 específica de antígeno en los tejidos para que MHC-I tetrámeros están disponibles.
Protocolo
1. día 1: secciones de tejido fresco e incubación primaria
- uso de un bisturí para cortar tejido fresco en trozos pequeños (aproximadamente 0,5 cm de ancho por 0,5 cm de altura). Por separado cada tejido de un émbolo del pegamento e incrustarlos con 3-5 mL de agarosa de baja fusión de 4% en PBS. El émbolo de la etiqueta con la información de tejido con una pegatina. Poner en un porta frío en un cubo de hielo para solidificar.
- Encienda el micrótomo y el espesor de las secciones a 200 μm. Instale una cuchilla de afeitar en el micrótomo e Inserte el émbolo montado con el tejido en el baño de micrótomo.
- Preparación de solución salina con tampón fosfato con heparina (PBS-H) mediante la adición de 100 μg/mL o 18.7 de U/mL heparina para PBS para preservar el RNA y permitir aplicaciones de ISH potenciales aguas abajo. Llene la bañera de micrótomo, cubriendo el tejido embebido, con 100-120 mL de PBS estéril, refrigerado-H. Añadir cubitos de hielo de PBS-H al baño para mantener la temperatura a 0 - 2 ° C. arranque el microtomo y cortar el tejido en 200 secciones μm.
Nota: Es importante mantener los tejidos refrigerados en hielo para minimizar la actividad celular dentro de los tejidos y porque el tejido fresco es más fácil a la sección cuando se enfría. PBS solo puede usarse si no hay planes para ISH abajo. - , Tejidos que no corte bien con un micrótomo (p. ej., intestino y pulmón), usar un bisturí o navaja para cortar el tejido en tiras finas como cerca posible de 200 μm.
- Etiqueta de la tapa de las placas de cultivo de tejidos de 24 pocillos con la información de la muestra experimental y las cámaras de tejido en los pocillos correspondientes. Refrigerados de uso un pincel para transferir las secciones a una cámara de tejido situado en el pozo de una placa de cultivo de tejidos de 24 pocillos que contienen 1 mL de PBS-H.
Nota: Cámaras de tejido reutilizable deben hacerse antes de iniciar la coloración. Cámaras de tejido pueden ser hechas usando un tubo de snap-cap 14 mL polipropileno fondo redondo y malla de alambre. Utilice una cuchilla de afeitar para cortar la parte inferior de un tubo de snap-cap 14 mL polipropileno fondo redondo. Cortar la malla de alambre en un círculo para el agujero en la parte inferior del tubo. El círculo de malla de alambre con un mechero de Bunsen hasta que esté al rojo vivo de calor. Establecido muy rápidamente el círculo de malla de alambre y empuje el tubo dentro de la malla. Compruebe que el acoplamiento de alambre está fijado firmemente a la parte inferior del tubo y luego con cuidado cortar la parte superior del tubo en la marca de 3 mL con una cuchilla de afeitar. Puesto hasta 3 secciones de tejido en cada cámara de tejido, o hasta 1 cm 2 de tejido por pozo. Mantener al menos un pozo vacío entre pozos con combinaciones de anticuerpos diferentes para evitar la contaminación cruzada.
Tetrámero de - proceder a la primaria y el anticuerpo tinción inmediatamente después de terminar a la transferencia de todas las secciones de corte en los compartimientos de los tejidos. Mantener las secciones sumergidas y enfría en 1 mL de PBS-H en todo momento.
- Incubar las secciones de tejido durante la noche con 0,5 μg/mL de conjugado de FITC, cargado de péptido MHC-I tetrámeros diluidos en PBS-H con 2% de suero de cabra normal (NGS). Incluyen mouse u otros no conejo anticuerpos dirigidos a epítopes extracelulares de interés en la incubación (por ejemplo, los anticuerpos anti-CD8 rata diluyeron 1: 500 en PBS-H con el 2% NGS). Ponga 1 mL de anticuerpos diluidos en cada pocillo.
Nota: Debe tenerse cuidado al seleccionar anticuerpos CD8, y algunos pueden mejorar algunos pueden inhibir tetrámeros de MHC binding a receptores de células T 4 , 21. El rata anti-CD8 anticuerpo descrito aquí es inestable y a veces resulta algo débil de la tinción. Se utiliza para el etiquetado triple porque es el único no-conejo y CD8 anticuerpos de ratón no probaron eso células de T CD8 de macaco rhesus manchada. - 1 mL de solución por pozo para el anticuerpo primario e incubaciones posteriores y realizar esto y todas las incubaciones posteriores a 4 ° C, con las placas en una plataforma oscilante.
Nota: Los tejidos deben flotar libremente en la cámara de.
2. Día 2: Fijación e incubación secundario
- después de la incubación primaria, lavar las secciones dos veces con 1 mL de PBS-H refrigerado por 20 min cada colada. Ello mediante la transferencia de las cámaras de tejido a una placa de cultivo de tejidos de diferentes 24 pocillos que contienen 1 mL de PBS-H refrigerado en los pozos correspondientes.
Nota: Tenga cuidado de no gotear el contenido desde una muestra experimental en otro cuando se mueve entre compartimientos de tejido. Para todas las incubaciones posteriores y lavados, igualmente la transferencia de la cámara de tejido a un plato limpio con la solución adecuada. Asegúrese de supervisar las secciones de las cámaras de tejido durante el procedimiento para asegurarse de que las secciones no se atascan a los lados de las cámaras de tejido. Si ellos, empuje hacia dentro la solución. - Fijar las secciones con 1 mL de fresco con tampón PBS paraformaldehído al 4% durante 2 h a temperatura ambiente (no demasiado fix). Lavado con PBS-H frío dos veces por 5 min
PRECAUCIÓN: Paraformaldehido es tóxica; usar equipo de protección personal.
Nota: Si se necesita recuperación de antígeno y permeabilización para detectar epítopos intracelulares, antígenos pueden recuperar hirviendo las secciones en 0.01 urea mol después de la fijación de paraformaldehido. - Transferencia de las secciones en placas de 24 pocillos de cultivo que contiene 0,01 mol urea y colocar estas placas en un horno de microondas. Hervir las secciones tres veces para unos 10 s cada uno, para un total de 30 s.
Nota: Tenga mucho cuidado, como punto de ebullición la solución puede forzar las secciones de las fuentes. Si esto ocurre, utilice un pincel para rechazar las secciones de los lados de la cámara de tejido o de la tapa de la placa en la parte inferior de la cámara de tejido adecuada. - Previo a la incubación del anticuerpo secundario, permeabilizar y bloquear las secciones de tejido por incubación en solución de bloqueo que contiene PBS-H, 0,3% detergente (PBS-H-T) y 2% NGS en un eje de balancín por 1 h a 4 ° C. realizar anticuerpos posterior las incubaciones con PBS-H-T/2% NGS.
- Para la incubación secundaria, la transferencia de las secciones en las cámaras de tejido para pozos con conejo anti-FITC anticuerpos diluidos 1: 10,000 en PBS-H-T/2% NGS. Incubar durante una noche. Anticuerpo anti-CD20 de
- realizar counterstaining usando ratón diluido 1: 200 en PBS-H-T/2% NGS. Para esta opción, recuperar los epitopos si es necesario, impregnan las células y bloquear antes de la incubación, como se describe arriba.
3. Día 3: Incubación terciario
- después de la segunda incubación, lavar las secciones tres veces en PBS-H a 4 ° C durante al menos 20 min
- Realizar una incubación final con la correspondiente etiqueta fluorescente anticuerpos (por ejemplo, cabra anti-conejo conjugado amarillo verdoso, conjugados mucho rojo tinte de cabra anti-rata y cabra anti-ratón conjugado colorante verde anticuerpos diluido 1:5, 000, 1:5, 000 y 1:2, 000, respectivamente, en PBS-H-T/2% NGS). Incubar durante una noche.
Nota: en este punto, la incubación puede prolongarse hasta tres días si es necesario. Mantener las secciones protegidas de la luz envolviendo las placas en papel de aluminio durante este incupaso de bation y después de eso, como la luz apaga fluoróforos.
4. Día 4: Montaje de las secciones
- lavado las secciones tres veces en PBS-H por al menos 20 min
Nota: Si se planifica abajo ISH 19, fije las secciones en paraformaldehído al 4% durante 1 hora para asegurar los tetrámeros y anticuerpos en el lugar y luego lavar las secciones dos veces con PBS-H por 5 min.
PRECAUCIÓN: Paraformaldehido es tóxica; usar equipo de protección personal. - Utilizar un pincel para transferir las secciones en un portaobjetos de microscopio. Tenga cuidado de no meter demasiado el tejido. Cubra cada sección con glicerol/gelatina que contenga 4 mg/mL n-propil galato u otro medio de montaje que contiene un conservante fluoróforo. Cubrir con un cubreobjetos.
- Guardar las diapositivas en un recipiente de deslizamiento protegido de la luz-20 º C. lavar las placas de cultivo de tejidos y eliminar las etiquetas de las tapas con alcohol.
Nota: Las placas se pueden reutilizar.
5. Adquisición de imágenes de Microscopio Confocal
- captura imágenes de alta resolución con un microscopio confocal, utilizando el láser adecuado y filtros para cada fluoróforo ( figura 1A y B).
Nota: En este ejemplo (véase la Tabla de materiales) utilizaron un microscopio confocal. Se obtuvieron imágenes utilizando el láser 561 al 20% de potencia para el verdoso amarillo marcado antígeno específicos de células T, el láser de 488 nm en el 10% de energía para las células B expresan CD20 marcado con verde y el láser de 640 nm en 15% de energía para las células T CD8 ahora marcado con rojo. Se utilizaron 20 X objetivo y una apertura numérica de 0.8. - Recoger secuencialmente intervalos de la serie z a 3 μm (u otro) en los tres canales en los múltiples campos de 800 x 800 píxeles. Construir un montaje de los campos recogidos ( figura 1 -E). Nombre de cada imagen de montaje basado en la información de la diapositiva correspondiente y guardar para análisis.
- Realizar análisis cuantitativo de imagen utilizando el software de análisis y cuantificación de microscopio confocal respectivos o ImageJ.
6. Análisis de imagen cuantitativo
Nota: Análisis de imagen cuantitativo pueden lograrse usando software de análisis y cuantificación de microscopio confocal o usando el software ImageJ. Aquí, ImageJ fue utilizado como ejemplo.
Montaje- abierto un confocal arrastrándolo a la ventana de ImageJ ( figura 2A).
Nota: ImageJ puede abrir directamente montajes recopilados por muchos diferentes microscopios confocales. Si el montaje no puede ser abierto directamente por ImageJ, exportar el z-scan seleccionado como un archivo TIFF para abrir it - Duplicar el seleccionado z-scan para el análisis (" imagen "-> " duplicados ") ( figura 2B).
- Divide los diferentes canales (" imagen "-> " Color "-> " Split canales ") ( figura 2).
- Dibujar el ROI para el análisis cuantitativo en el canal correspondiente para ser objetivo y añadir al Gerente de ROI pulsando " T " en el teclado. Medir el área de.
Nota: El administrador de ROI de ImageJ muestra el área en el μm 2 ( Figura 2D). - Ajustar el brillo de la fluorescencia y contraste del canal a ser analizados (" imagen "-> " ajuste "-> " brillo/contraste ") ( Figura 2E).
- Aplanar el ROI en la imagen (" manager de ROI "-> " aplane ") ( figura 2F).
- Cuantificar las células positivas en la imagen usando el " multipunto " herramienta ( figura 2).
Resultados
La figura 1 muestra cómo recopilar imágenes confocales utilizando un microscopio confocal. Figura 2 muestra el análisis de imagen cuantitativo con ImageJ. Figuras 3 y 4 muestran a representante imágenes de tejidos del nodo de linfa de un SIV infectaron macaque del macaco de manchados de tetrámeros de MHC, CD8 anticuerpos y anticuerpos CD20 y sirven para demostrar la especificidad de la tinción de tetrámero de MHC. Figura 3 compara MHC clase I tetrámeros cargados con un péptido de SIV en comparación con las secciones del mismo tejido manchado con MHC de clase I tetrámeros cargados con un péptido irrelevante. La figura 4 muestra que las células teñidas con el tetrámero SIV/MHC-péptido son co teñidas con anticuerpos CD8, pero no los anticuerpos CD20, que manchan las células de B. La figura 5 muestra un ejemplo de un montaje creado a partir de múltiples campos de serie z confocal utilizados para la cuantificación de tetrámero teñido de células con fenotipos específicos en diferentes compartimentos anatómicos en el nodo de linfa. La ampliación muestra un área de ganglio linfático con un folículo de la célula de B delineado por tinción CD20 y célula de T zona circundante, en el que pueden detectarse células con tinción tetrámero MHC, co algunos de los cuales expresan Ki67 que es un marcador de activación de células T y proliferación. Esta combinación de tinción permite la determinación del fenotipo de células de linfocitos T CD8 específicas de SIV dentro y fuera de los folículos de células B, en relación a linfocitos t CD8 específicas de la SIV y a otras células expresión de Ki67 y B.

Figura 1: Representante de imágenes mostrando cómo recoger utilizando un microscopio Confocal de imágenes confocales. Adquisición de (A) el modo utilizado para recoger imágenes confocales. (B) canales utilizados para la colección de imágenes. (C) 20 X 800 x 800 píxeles y objetivo campos fueron utilizados en la colección de imágenes. (D) A z-pila secuencial recogió 3 μm a intervalos. (E) azulejos fueron adoptados para delinear y recoger imágenes en múltiples campos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Representante imágenes demostrando cuantitativa imagen análisis con ImageJ. (A) abrir un montaje confocal arrastrándolo a la ventana de ImageJ. (B) duplicado el z-scan seleccionado para el análisis. (C) divide los diferentes canales. (D) dibujar el ROI para el análisis cuantitativo en el canal correspondiente para ser objetivo y añadir al Gerente de ROI pulsando "T." (E) ajuste el brillo de la fluorescencia y contraste del canal a ser analizados. (F) aplane el ROI en la imagen. (G) contar lo positivo de las células en la imagen. Haga clic aquí para ver una versión más grande de esta figura.
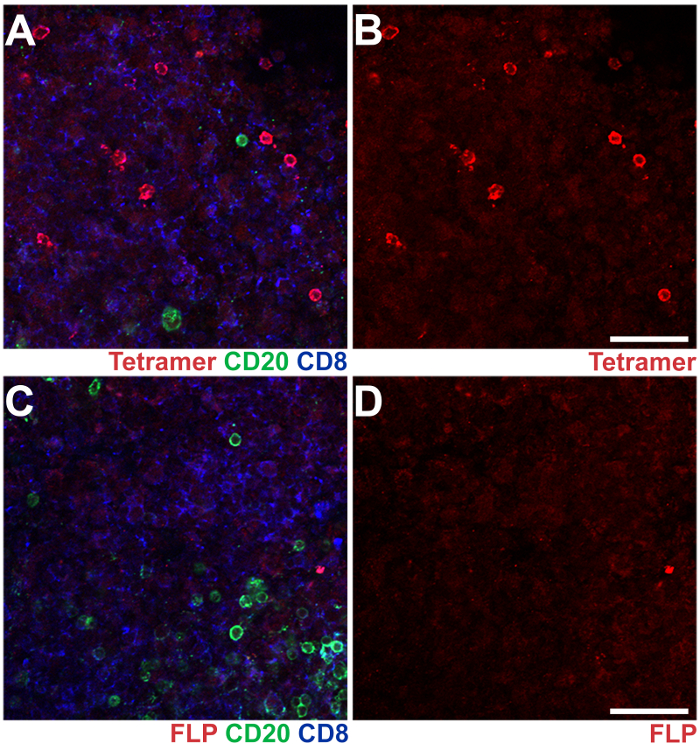
Figura 3 : IST combinado con IHC en secciones de ganglio linfático axilar de un macaco Rhesus infectados con SIV. Mamu - A * 02 tetrámeros cargados con SIV Nef YY9 péptidos fueron utilizados para teñir las células de T CD8 específica de antígeno, y tetrámeros similares cargados con un péptido FLP irrelevante del virus de la hepatitis B fueron utilizados como control negativo (rojo). Anticuerpos anti-CD20 de ratón se utilizaron para tinción CD20+ B células (verde), y anticuerpos anti-CD8 de rata fueron utilizados para teñir CD8+ T las células (azul). (A) A imagen representativa de la sección de un ganglio linfático teñido con YY9 tetrámeros, CD20 y CD8 anticuerpos. (B) la misma imagen en el panel que muestra el tetrámero YY9 mancha sola. (C) imagen representativa de un tramo de la misma ganglionar axilar, teñidas con anticuerpos CD20 y CD8 y tetrámeros FLP. C (D) la misma imagen en el panel con el tetrámero FLP mancha sola. Barras de escala = 100 μm. haga clic aquí para ver una versión más grande de esta figura.
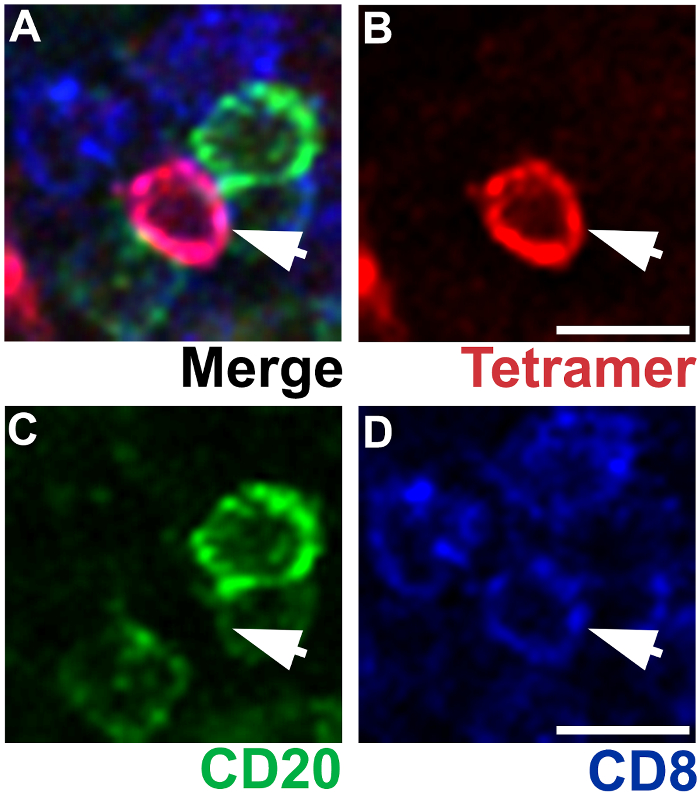
Figura 4 : IST combinado con IHC que muestra la especificidad de la tinción de tetrámero MHC. Sección representativa del nodo de linfa axilar con Mamu - A * 02 tetrámeros cargados con Nef YY9 péptidos a células de linfocitos T CD8 específicas de SIV de etiqueta (rojo), anticuerpos de ratón anti-CD20 de las células de etiqueta B (verde) y anticuerpos anti-CD8 rata etiqueta CD8 T las células (azul) (A ). Una célula de linfocitos T CD8 específicas de la SIV es tetrámero + (B), CD20– (C) y CD8+ (D). Barras de la escala = 10 μm. haga clic aquí para ver una versión más grande de esta figura.
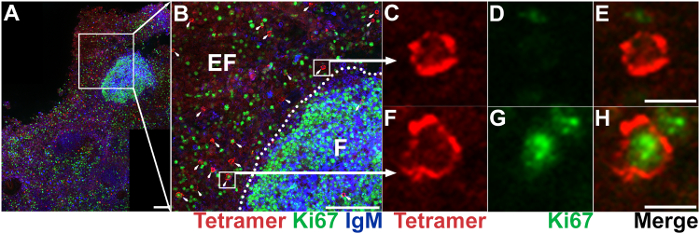
Figura 5: IST combinado con IHC para demostrar la localización, abundancia y fenotipo de las células T específicas de antígeno CD8. (A) representante del nodo de linfa axilar corte teñido con Mamu - A * 02 tetrámeros cargados con péptidos de Nef YY9 etiquetar SIV-específica linfocitos T CD8 células (rojo), Ki67 anticuerpos a células de la proliferación de etiquetas (verde) y IgM anticuerpos a células de etiqueta B (azul). Barra de escala = 100 μm. (B) Ampliación de una región seleccionada en la tinción de IgM panel A. define el área folicular, que está marcado como "F"; el área extrafollicular está marcado como "EF". Las células tetrámero+ se indican con flechas. Barra de escala = 100 μm. tetrámero representante+ Ki67– celular (C, D, E) y tetrámero+ Ki67+ celular (F, G, H). Barra de escala = 10 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
IST combinado con IHC proporciona una herramienta esencial para detectar, caracterizar y cuantificar las células de T CD8 específica de antígeno en ambientes nativos con el contexto de otras células y estructuras del tejido. Aquí, describimos los procedimientos detallados para IST combinado con IHC, seguido por análisis de imagen cuantitativo, para determinar la localización, abundancia y fenotipo de las células de T CD8 específica de antígeno en nodos de linfa de macaques del macaco de la India. Coloración similar puede ser aplicado al ser humano, ratón u otros tejidos de especies para que MHC-I tetrámeros están disponibles. Además, péptido tetrámero de MHC clase II o dextramer de tinción puede realizarse utilizando metodologías relativamente similares a las células de T CD4 específica de antígeno en los tejidos4,5,6,7, de la etiqueta 8 , 9 , 10 , 11 , 12 , 13. IST puede combinarse también con ISH para determinar, por ejemplo, en vivo la célula efectora a destino niveles18,19. En el futuro, sería interesante llevar IST/IHC más combinando IST/IHC con avanzada en situ RNA y DNA detección metodologías. Los últimos avances en ensayos de hibridación en situ incluyen el desarrollo de RNAscope y DNAscope24. Estas técnicas permiten la detección de objetivo RNA y DNA en los tejidos. Será emocionante combinar estas metodologías con IST y IHC simultáneamente detectar virus-específica-CD8 células de T, ARN viral, ADN viral y antígenos marcados con anticuerpos de interés.
Mientras que originalmente describió métodos IST con tejidos frescos, tejidos que se fijaron para una corta duración y de los tejidos congelados4, en los últimos años, hemos utilizado exclusivamente secciones de tejido fresco, ya que constantemente producen las manchas de la más alta calidad y permitir el examen de las células en secciones de tejido grueso. Como una alternativa a los procedimientos presentados aquí, uno puede aplicar tetrámeros a tejidos, incubar durante una noche, fijar, incrustar y criopreservar en medio de congelación (p. ej., OCT), producir secciones finas congeladas y realizar IHQ más adelante22. Del mismo modo, que rutinariamente la mancha solo un subconjunto de las secciones de tejido con tetrámeros y luego congele las secciones en OCT para permitir combinaciones counterstaining adicionales en el futuro. Además, Multímeros Qdot 655 conjugados péptido-MHC pueden utilizarse para visualizar directamente antígenos específicos de células T en secciones de tejidos criopreservados13.
Hemos descrito aquí indirecta tetrámero de tinción. Tinción directa usando tetrámeros conjugado con APC o PE también ha demostrado trabajar4,22. En este caso, la concentración de tetrámero de MHC requerido es mayor que el utilizado en la tinción de tetrámero indirecta. En nuestras manos, una concentración de 20 μg/mL de APC-labeled tetrámero fue eficaz en la detección de antígenos específicos de células. Sin embargo, la intensidad de la tinción fue mucho menor que la obtenida con el etiquetado indirecta, que incluye amplificación con anti-FITC anticuerpos.
Encontramos que el uso de un micrótomo de compresión (véase Tabla de materiales) para corte de tejido fresco facilitó el proceso de corte de secciones de tejido fresco como en comparación con usando un vibrante micrótomo23. Sin embargo, en casos donde un micrótomo de compresión no está disponible, un microtomo vibratorio o un bisturí puede utilizarse para seccionamiento de tejido fresco.
Una limitación importante de esta técnica es el uso de tejidos frescos. Utilizando tejidos frescos es mucho más difícil que los tejidos fijos o congelados ya que requieren procesamiento y atención inmediata. Hemos enviado con éxito tejidos frescos durante la noche en el hielo en medio de cultivo de tejidos o PBS-H. Sin embargo, ha habido problemas ocasionales con el envío; por ejemplo, tormentas de nieve han demorado el envío de los tejidos durante 48 h o más. En estos casos, encontramos que frescos tejidos seccionados y los manchados post extracción 48 h generalmente muestran coloración específica, con signos de alguna degradación de tejido; tejidos manchados post extracción 72 h también son degradados para la tinción. También encontramos que el envío de tejidos frescos con bloques de hielo que están demasiado fríos o demasiado cerca que los tejidos pueden congelar los tejidos durante el transporte; Esta congelación generalmente destruye el tejido para la tinción. Por lo tanto, es muy importante enviar los tejidos frescos refrigeradas pero no congeladas e iniciar IST tinción en 24 h. procesamiento de tejido fresco también requiere una gran cantidad de estudiantes y personal del tiempo, como los tejidos de animales múltiples o los participantes del estudio no pueden ser recogidos y manchado juntos en una fecha posterior. A pesar de estas dificultades, nos encontramos con que las secciones de tejido fresco son la mejor opción para la tinción de IST/IHC hermoso, específicos.
Otra limitación del método IST/IHC descrito aquí es el método de tinción indirecto. Debido a limitaciones en el número de especies distintas de animales disponibles para generar combinaciones de anticuerpo secundario, estamos limitados por métodos para anticuerpos fluorescentes solamente tres o cuatro combinaciones de tinción en un momento la coloración indirecta de anticuerpos. Esto limita la cantidad de información que puede recogerse en una losa de tejido. Tinción directa de IHC supera esta limitación y puede ampliar las capacidades, detección de antígenos anticuerpos etiquetados ocho o más simultáneamente, aunque con cada anticuerpo produciendo una señal fluorescente mucho más débil en comparación con métodos indirectos. Por lo tanto, IHC indirecta podría utilizarse como alternativa a IHC indirecta para contratinción tejidos teñidos de IST, lo que permite la detección de un mayor número de antígenos celulares cuando se combina con el IST de detección de antígenos específicos de células T CD8.
En algunos casos, autofluorescencia substancial o atascamiento de tetrámero o anticuerpos no específicos puede ocurrir con IST/ISH. Debido a esto, buenos controles positivos y negativos son necesarios para distinguir las manchas específicas de fondo y autofluorescent tinción. Negativa buena controla para MHC tetrámeros incluyen tejidos de control negativo (por ejemplo, los tejidos no-infectados, tejidos teñidos con MHC I tetrámeros cargados con péptidos irrelevantes o tetrámeros de MHC irrelevantes; o, en un apuro, tejidos teñidos con no tetrámeros con amplificación de anticuerpos).
En Resumen, MHC I IST combinado con IHC es una herramienta valiosa para determinar la localización, abundancia y fenotipo de las células de T CD8 específica de antígeno en los tejidos. Esta metodología permite la detección de antígeno específicos de células T CD8 en ambientes nativos, con la localización relativa a otros tipos de células y estructuras del tejido mantenidas. Este método es ampliamente aplicable, ya que puede ser utilizado para localizar, fenotipo y cuantificar esencialmente cualquier célula T CD8 específica de antígeno para que MHC tetrámeros están disponibles, en cualquier tejido.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por becas de servicio de salud pública de los institutos nacionales de salud (T32 DA007097, R01AI096966, andUM1AI26617).
Materiales
| Name | Company | Catalog Number | Comments |
| MHC-I monomer | NIH tetramer core facility | Materials for MHC-tetramer preparation | |
| ExtrAvidin-FITC | Sigma-Aldrich | E2716 | Materials for MHC-tetramer preparation |
| Normal goat serum | Jackson Immunoresearch | 005-000-121 | |
| Low melt agarose | Promega | V3121 | |
| Heparin | Sigma-Aldrich | SLBL6391V | |
| Triton X-100 | Sigma-Aldrich | T-6878 | |
| Urea | J.T.Baker | 4204-05 | |
| Glycerol gelatin | Sigma-Aldrich | SLBH2672V | |
| n-propyl gallate | Sigma-Aldrich | P3130 | |
| rat-a-h-CD8 (1:500) | Acris | 0714 | Antibody unstable, use single use frozen aliquot |
| m-a-h-CD20 (1:500) | NOVOCASTRA | 6026819 | |
| m-a-h-Ki67 (1:500) | Vector | 6022201 | |
| goat-a-m-A488 (1:2,000) | Jackson Immunoresearch | 124083 | |
| goat-a-rb-Cy3 (1:5,000) | Jackson Immunoresearch | 106232 | |
| goat-a-rat-Cy5 (1:5,000) | Jackson Immunoresearch | 118088 | |
| goat-a-h-IgM-Dylight649 (1:5,000) | Jackson Immunoresearch | 86579 | |
| Compresstome: VF-300 Microtome | Precisionary Instruments, LLC | 1079 | |
| Quick Set Instant Adhesive | Loctite | 46551 | |
| 24-well flat bottomed tissue culture plates | Falcon | 353226 | |
| Microscope slide | Globe scienfitic Inc. | #1321 | |
| Razor blade | Ted Pella, Inc | 121-6 | |
| Feather Disposable Scalpel | FEATHER SAFETY RAZOR CO. LTD. | No. 21 | |
| Round paintbrush #2 | PRINCETON ART & BRUSH CO. | 4350R | Can trim as needed with razor |
| Confocal Microscope | Olympus | FV1000 | |
| FV10-ASW_Viewer4.0 | Olympus |
Referencias
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Novak, E. J., Liu, A. W., Nepom, G. T., Kwok, W. W. MHC Class II tetramers identify peptide-specific human CD4(+) T cells proliferating in response to influenza A antigen. J Clin Invest. 104, R63-R67 (1999).
- Steinert, E. M., et al. Quantifying memory CD8 T cells reveals regionalization of immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Skinner, P. J., Daniels, M. A., Schmidt, C. S., Jameson, S. C., Haase, A. T. Cutting edge: In situ tetramer staining of antigen-specific T cells in tissues. J Immunol. 165 (2), 613-617 (2000).
- Haanen, J. B., et al. In situ detection of virus- and tumor-specific T-cell immunity. Nat Med. 6 (9), 1056-1060 (2000).
- Skinner, P. J., Haase, A. T. In situ tetramer staining using MHC class I tetramers. J Immunol Methods. 268 (1), 29-34 (2002).
- Skinner, P. J., Haase, A. T. In situ staining using MHC class I tetramers. Curr Protoc Immunol. 17, 4.1-4.9 (2004).
- Li, Y., et al. Use of HLA-DR*08032/E7 and HLA-DR*0818/E7 tetramers in tracking of epitope-specific CD4+ T cells in active and convalescent tuberculosis patients compared with control donors. Immunobiology. 216, 947-960 (2011).
- Bischof, F., et al. Analysis of autoreactive CD4 T cells in experimental autoimmune encephalomyelitis after primary and secondary challenge using MHC class II tetramers. J Immunol. 172, 2878-2884 (2004).
- Massilamany, C., et al. Direct staining with major histocompatibility complex class II dextramers permits detection of antigen-specific, autoreactive CD4 T cells in situ. PLoS ONE. 9, e87519(2014).
- Massilamany, C., et al. In situ detection of autoreactive CD4 T cells in brain and heart using major histocompatibility complex class II dextramers. J Vis Exp. (90), e51679(2014).
- Dileepan, T., Kim, H. O., Cleary, P. P., Skinner, P. J. In Situ Peptide-MHC-II Tetramer Staining of Antigen-Specific CD4+ T Cells in Tissues. PLoS ONE. 10 (6), e0128862(2015).
- Tjernlund, A., et al. In situ detection of Gag-specific CD8+ cells in the GI tract of SIV infected Rhesus macaques. Retrovirology. 7, 7-12 (2010).
- Connick, E., et al. CTL fail to accumulate at sites of HIV-1 replication in lymphoid tissue. J Immunol. 178, 6975-6983 (2007).
- Hong, J. J., et al. Localized Populations of CD8low/− MHC Class I Tetramer+ SIV-Specific T Cells in Lymphoid Follicles and Genital Epithelium. PLoS ONE. 4 (1), e4131(2009).
- Sasikala-Appukuttan, A. K., et al. Location and dynamics of the immunodominant CD8 T cell response to SIVΔnef immunization and SIVmac251 vaginal challenge. PLoS ONE. 8 (12), e81623(2013).
- Connick, E., et al. Compartmentalization of simian immunodeficiency virus replication within secondary lymphoid tissues of rhesus macaques is linked to disease stage and inversely related to localization of virus-specific CTL. J Immunol. 193, 5613-5625 (2014).
- Li, Q., et al. Visualizing antigen-specific and infected cells in situ predicts outcomes in early viral infection. Science. 323, 1726-1729 (2009).
- Li, Q., Skinner, P. J., Duan, L., Haase, A. T. A technique to simultaneously visualize virus-specific CD8+ T cells and virus-infected cells in situ. J Vis Exp. (30), e1561(2009).
- Li, S., et al. Simian immunodeficiency virus-producing cells in follicles are partially suppressed by CD8+ cells in vivo. J Virol. 90, 11168-11180 (2016).
- Daniels, M. A., Jameson, S. C. Critical role for CD8 in T cell receptor binding and activation by peptide/major histocompatibility complex multimers. J Exp Med. 191, 335-346 (2000).
- Lee, Y. J., Wang, H., Starrett, G. J., Phuong, V., Jameson, S. C., Hogquist, K. A. Tissue specific distribution of iNKT cells impacts their cytokine response. Immunity. 43 (3), 566-578 (2015).
- Abdelaal, H. M., Kim, H. O., Wagstaff, R., Sawahata, R., Southern, P. J., Skinner, P. J. Comparison of Vibratome and Compresstome sectioning of fresh primate lymphoid and genital tissues for in situ MHC-tetramer and immunofluorescence staining. Biol Proced Online. 17, (2015).
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. J Mol Diagn. 14 (1), 22-29 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados