Method Article
בחיי עיר MHC-tetramer מכתים וניתוח כמותי כדי לקבוע את מיקום שפע, ותפקיד של אנטיגן ספציפי CD8 T תאים ברקמות
In This Article
Summary
כאן, אנו מתארים שיטה המשלבת בחיי עיר MHC-tetramer מכתים עם אימונוהיסטוכימיה כדי לקבוע לוקליזציה, פנוטיפ וכמות תאי T אנטיגן ספציפי ברקמות. פרוטוקול זה משמש כדי לקבוע את המאפיינים המרחבי, פנוטיפי של אנטיגן ספציפי בתאי CD8 T ביחס אחרים סוג התא ומבני ברקמות.
Abstract
תאי T הם קריטיים לתהליכים אימונולוגי רבים, לרבות גילוי ו חיסול תאים הנגועים בנגיף, מניעת מחלת חיסון עצמי, סיוע בייצור תאי B ו פלזמה-cell של נוגדנים, איתור של חיסול תאים סרטניים. הפיתוח של MHC-tetramer מכתים של תאי T אנטיגן ספציפי נותחו על ידי cytometry זרימה יש מהפכה היכולת שלנו ללמוד ולהבין את immunobiology של תאי T. בזמן מאוד שימושי לקביעת כמות של פנוטיפ של תאי T אנטיגן ספציפי, cytometry זרימה אין אפשרות לקבוע את ההתאמה המרחבית של אנטיגן ספציפי בתאי T תאים אחרים, מבנים רקמות וטכניקות disaggregation הנוכחי כדי לחלץ את ה-T תאים הדרושים עבור cytometry זרימה מוגבלת ברקמות שאינן הלימפה. בחיי עיר MHC-tetramer מכתים (IST) היא טכניקה להמחיש T תאים ספציפיים עבור אנטיגנים עניין ברקמות. בשילוב עם אימונוהיסטוכימיה (IHC), IST ניתן לקבוע את השפע, מה מיקומם ואילו פנוטיפ של אנטיגן ספציפי תאי CD8 ו- CD4 T ברקמות. כאן, אנו מתארים את פרוטוקול כדי להכתים ולספור תאי CD8 T אנטיגן ספציפי, עם פנוטיפים ספציפי ממוקם בתוך תאי רקמות ספציפיות. הליכים אלה זהים פעם בפרסום האחרונה שלנו מאת Li. et al., שכותרתו "תאים מייצרי בנגיף זקיקים מדוכאים באופן חלקי על ידי CD8+ תאים Vivo ב." בשיטות המתוארות חלים באופן כללי כי הם יכולים לשמש כדי להתאים לשפה, פנוטיפ, ולכמת למעשה כל אנטיגן ספציפי CD8 תא T שעבורו MHC tetramers זמינים, כל רקמה.
Introduction
תאי T הם קריטיים לתהליכים אימונולוגי רבים, לרבות גילוי ו חיסול תאים הנגועים בנגיף, מניעת מחלת חיסון עצמי, סיוע בייצור תאי B ו פלזמה-cell של נוגדנים, איתור של חיסול תאים סרטניים. הפיתוח של פפטיד/MHC מחלקה אני tetramer מכתים של אנטיגן ספציפי CD8 T תאים1 , התפתחות עדכנית יותר של MHC class II tetramer מכתימה של תאי CD4 T2 מאת cytometry זרימה מהפכה היכולת שלנו ללמוד ולהבין immunobiology של תאי T. בזמן מאוד שימושי לקביעת כמות של פנוטיפ של תאי T אנטיגן ספציפי, cytometry זרימה אינו מאפשר איתור לוקליזציה המרחבי של אנטיגן ספציפי בתאי T כדי תאים ומבנים אחרים ברקמות, ועדכניים disaggregation טכניקות כדי לחלץ את תאי T הדרושים עבור cytometry זרימה מוגבלת רקמות הלימפה3.
אנחנו ואחרים פיתחו שיטות שימוש טעון-פפטיד MHC class אני ו class II tetramer או multimer ריאגנטים כתם תאי CD8 ו- CD4 T אנטיגן ספציפי רקמות4,5,6,7, 8 , 9 , 10 , 11 , 12 , 13. שיטות אלה IST לאפשר הקביעה של מיקום, שפע, ותפקיד של CD8 אנטיגן ספציפי ותאי CD4 T ברקמות ולספק אמצעי לגילוי של תאים אלה ביחס תאים ומבנים אחרים ברקמות. הקבוצה שלנו השתמשה בהרחבה MHC-אני tetramer מכתים ללמוד וירוס הכשל החיסוני האנושי (HIV) - וגם הקופי הכשל החיסוני (SIV) - תאי CD8 T ספציפיים ברקמות הלימפה, איברי המין, פי הטבעת כדי להשיג הבנה של השיגה SIV ו- HIV כדי לזהות בקורלציה של חיסון מוצלחת אסטרטגיות14,15,16,17. בנוסף, אנו גם פיתחו טכניקה שמשלב IST בבאתרו הכלאה (איש) כדי להתאים לשפה ולכמת בתאי CD8 T וירוס ספציפיים, תאים הנגועים בנגיף ברקמות וכדי לקבוע את רמות אפקטור-כדי-יעד ויוו 18 , 19.
כאן, אנו מתארים את פרוטוקול באמצעות טעון-פפטיד MHC-אני tetramers כתם אנטיגן ספציפי בתאי CD8 T בסעיפים רקמות טריים, עד counterstain רקמות באמצעות IHC ולאחר לכמת תאים עם פנוטיפים ספציפי בתאים רקמות ספציפיות. הליכים אלה הם בדיוק כמו Li. et al., שבו קבענו את מיקום שפע, ותפקיד של תאי T ספציפי SIV ברקמת הלימפה במהלך זיהום כרוני SIV קופי מקוק20שימש בפרסום האחרונה שלנו.
עבור הליך זה, רקמות טריים למחלקה, מודגרות בין לילה עם טעון-פפטיד MHC-אני tetramers מצומדת כדי מולקולות thiocyanate fluorescein (FITC). ואז הם קבועים ב- paraformaldehyde. לאחר תיקון הרקמה, האיתות tetramers MHC מוגבר באמצעות נוגדנים anti-FITC הארנב, מודגרות עם מתויגות fluorescently הארנב אנטי איג נוגדנים, נוסף להיקלט. מ tetramers מאוגד. IHC משמש בשילוב עם IST לאפיין אנטיגן ספציפי T תאים, התאים שמסביב. נוגדנים מזהה epitopes על פני השטח של תאים או בחלל חוץ-תאית כלולים הדגירה העיקרי עם tetramers. נוגדנים מזהה תאיים epitopes דורשים הסתננות של דופן התא לפני צביעת. הסעיפים רקמות מוכתמים הם צילמו באמצעות מיקרוסקופ קונפוקלי וניתח באמצעות תוכנה קונפוקלי. תאים עם תוויות הם לכמת באמצעות תוכנה מיקרוסקופיה קונפוקלית או ImageJ. הפרוטוקול המתואר יכול לשמש כדי להכתים בעיקרו אנטיגן ספציפי CD8 T תא כלשהו ברקמה כלשהי עבור אילו MHC-אני tetramers הינם זמינים.
Protocol
1. יום 1: חלוקתה רקמות טריים, הדגירה העיקרי
- שימוש באזמל כדי טריים רקמות לחתוך לחתיכות קטנות (כ 0.5 ס מ בגובה 0.5 ס מ). בנפרד דבק כל רקמה פומפה, להטביע אותם עם 3-5 מ של agarose נמוך-להמיס 4% ב- PBS. תווית על הבוכנה עם המידע רקמות באמצעות מדבקה. תכניס אותו בעל צונן בתוך דלי קרח שבמהלכו.
- להפעיל את מיקרוטום ואת ערכת העובי של הסעיפים ל- 200 מיקרומטר. התקנה תער על מיקרוטום, הוספה הבוכנה רכוב עם רקמת באמבטיה מיקרוטום.
- להכין באגירה פוספט תמיסת מלח עם הפרין (PBS-H) על-ידי הוספת µg 100/mL או הפארין U/mL 18.7 PBS כדי לשמר את הרנ א ולא להתיר יישומים פוטנציאליים איש במורד הזרם. למלא את האמבטיה מיקרוטום, כיסוי הרקמה מוטבע, עם 100-120 מ של PBS-ה צוננת, סטרילי להוסיף קוביות קרח PBS-H לאמבטיה כדי לשמור על הטמפרטורה ב 0 - 2 ° C. התחל האזמל הקטן, חיתוך לרקמת למקטעים מיקרומטר 200.
הערה: חשוב לשמור על הרקמות מקורר על קרח כדי למזער את פעילות תאית בתוך הרקמות בגלל רקמת טריים שזה היה בסעיף זה הוא מקורר. PBS לבד יכול לשמש אם קיימות תוכניות עבור איש הזרם. - לחילופין, ברקמות לא לחתוך עם מיקרוטום (למשל, בטן, ריאות), להשתמש באזמל או גילוח לחתוך את הרקמה לרצועות דק כמו קרוב ככל האפשר מיקרומטר 200.
- לתייג את המכסה של תרביות רקמה. ובכן 24 צלחות עם המידע מדגם ניסיוני ולמקם את תאי רקמת הבארות המתאימים. להשתמש במכחול כדי להעביר את המקטעים תא רקמת להגדיר בתוך הבאר של צלחת 24-ובכן תרביות רקמה המכיל 1 מ"ל של צונן PBS-ה
הערה: תאי רקמות לשימוש חוזר צריכה להיעשות לפני ייזום מכתים. רקמת תאי יכולים להתבצע באמצעות צינור snap-קאפ 14 mL סיבוב המדרגה פוליפרופילן, חוט רשת שינוי. השתמש סכין גילוח חדה לחתוך את החלק התחתון של צינור snap-קאפ 14 mL סיבוב המדרגה פוליפרופילן. חותכים רשת התיל במעגל כדי להתאים את החור בתחתית הצינורית. חום המעגל תיל רשת שינוי באמצעות מבער בונזן עד שזה לוהט. תניח את המעגל עם רשת שינוי חוט מהר מאוד ודחף את הצינורית על גבי רשת השינוי. בדוק כי רשת התיל הוא מחובר היטב לתחתית הצינור ואז בזהירות לחתוך את החלק העליון של הצינור-סימן 3 מ"ל באמצעות סכין גילוח חד. לשים עד 3 מקטעי רקמת לתא בכל רקמה, או עד 1 ס מ 2 של רקמות לכל טוב. לשמור היטב ריק אחד לפחות בין וולס עם שילובים נוגדנים שונים כדי למנוע זיהום צולב.
Tetramer - להמשיך למטרה העיקרית, נוגדן מכתים מיד לאחר שסיים את ההעברה של כל המקטעים לחתוך לתוך התאים ברקמות. לשמור על הסעיפים שקוע ולא מקורר ב 1 מ"ל של PBS-H כל הזמן.
- דגירה הסעיפים רקמות בין לילה עם 0.5 µg/mL FITC מצומדת, טעון-פפטיד MHC-אני tetramers מדולל ב- PBS-H עם 2% עז נורמלית בסרום (הגדרות). כוללות העכבר או נוגדנים אחרים-ארנב מכוונת epitopes חוץ-תאי של עניין זה דגירה (למשל, נוגדנים anti-CD8 עכברוש מדולל שבערך ב- PBS-H עם 2% המיתרים). מקום 1 מ"ל של נוגדנים מדולל היטב לכל.
הערה: כדאי לשים לב בעת בחירת CD8 נוגדנים, וגם כמה יכול לשפר כמה יכול לעכב MHC tetramers מחייב את T-cell קולטנים 4 , 21. הנוגדן CD8 נגד עכברוש המתוארים כאן אינו יציב, לפעמים התוצאות מכתים חלש במקצת. הוא משמש כאן עבור תיוג משולש כי היא היחידה שאינה-הארנב-עכבר CD8 נוגדן נבדק זה תאי CD8 T מקוק רזוס מוכתם. - לנפש 1 מ"ל של פתרון טוב עבור נוגדן ראשוני ו incubations כל הסגירות העוקבות ולבצע זה ואת כל הבאים incubations ב 4 ° C, עם הצלחות על פלטפורמה נדנדה.
הערה: רקמות צריך מרחפים בחופשיות בחדר.
2. יום 2: קיבוע של דגירה משני
- לאחר הדגירה העיקרי, לשטוף המקטעים פעמיים עם 1 מ"ל PBS-H בקירור למשך 20 דקות כל כביסה. עושים זאת על ידי העברת רקמות התאים צלחת תרביות רקמה 24-ובכן שונים המכיל 1 מ"ל של PBS צוננת-H בהבארות המתאים.
הערה: יש להיזהר לא לטפטף התוכן מהדגימה ניסיוני אחת אחרת כשעוברים בין תאי רקמות. עבור כל incubations עוקבות, שוטף, בדומה להעביר תא רקמת צלחת נקי המכיל את הפתרון המתאים. הקפד לעקוב אחר בסעיפים רקמות התאים במהלך ההליך כדי לוודא כי הסעיפים לא להיתקע לצדדים של רקמות התאים. אם הם עושים, לדחוף אותם בחזרה לתוך הפתרון. - לתקן את הסעיפים 1 מ"ל של טרי באגירה PBS 4% paraformaldehyde עבור 2 h בטמפרטורת החדר (לא יותר מדי לתקן). תשטוף עם PBS קר-H פעמיים במשך 5 דק
התראה: Paraformaldehyde הוא רעיל; ללבוש ציוד מגן אישי המתאים.
הערה: אם אחזור אנטיגן, permeabilization נחוצה כדי לזהות epitopes תאיים, אנטיגנים ניתן לאחזר הרתחה בסעיפים 0.01 מול אוריאה לאחר הקיבעון paraformaldehyde. - להעביר את המקטעים לתוך תרבות. ובכן 24 צלחות המכיל mol 0.01 אוריאה ולמקם את הצלחות האלה בתנור מיקרוגל. מרתיחים את המקטעים שלוש פעמים במשך כ 10 s עבור סכום כולל של 30 ס'
הערה: להיות זהיר מאוד, כמו רותחים הפתרון יכול להכריח את המקטעים החוצה הבארות. אם זה קורה, להשתמש במברשת לדחוף הסעיפים צידי החדר רקמות או את המכסה של הצלחת בחזרה לתוך החלק התחתון של תא הרקמה המתאימה. - מראש כדי הדגירה נוגדנים משניים, permeabilize וחסום את הסעיפים רקמות על ידי המקננת בהם בפתרון חסימה המכיל PBS-H, 0.3% דטרגנט (PBS-H-T) ו- 2% המיתרים על כיסא נדנדה עבור h 1-4 מעלות צלזיוס, בצע עוקבות נוגדן incubations עם הגדרות PBS-H-T/2%.
- עבור הדגירה המשני, להעביר הסעיפים בתאי רקמת וולס המכיל ארנב anti-FITC 1:10,000 נוגדנים מדולל ב PBS-H-T/2% המיתרים. דגירה בין לילה. נוגדן אנטי-CD20 העכבר
- באמצעות counterstaining בצע מדולל 1:200 ב PBS-H-T/2% המיתרים. עבור אפשרות זו, לאחזר את epitopes אם יש צורך, לחדור לתאים, לחסום לפני זה דגירה, כפי שתואר לעיל.
3. יום 3: הדגירה שלישוני
- לאחר הדגירה השני, לשטוף את הסעיפים 3 פעמים ב- PBS-H-4 מעלות צלזיוס במשך לפחות 20 דקות
- לבצע דגירה הסופי עם המתאים fluorescently שכותרתו נוגדנים (למשל, ארנב נגד עז מצומדת צהוב ירקרק, צבע אדום רחוק מצומדת אנטי חולדה עז, עז אנטי-העכבר צבע ירוק מצומדת נוגדנים מדולל 1:5, 000, 1:5, 000, 1:2, 000, בהתאמה, בעוד PBS-H-T/2% המיתרים). דגירה בין לילה.
הערה: בשלב זה, הדגירה ניתן להרחיב עד שלושה ימים במידת הצורך. לשמור על הסעיפים מוגן מפני אור על ידי ליפוף הצלחות באלומיניום במהלך הזה incuשלב bation לאחר מכן, כמו אור המרווה fluorophores.
4. יום 4: הרכבה הסעיפים
- שטיפת הסעיפים שלוש פעמים ב- PBS-H לפחות 20 דקות
הערה: אם תכנון עבור איש הזרם 19, לתקן בסעיפים 4% paraformaldehyde לשעה כדי לאבטח את tetramers ואת נוגדנים במקום ולאחר מכן לשטוף את המקטעים פעמיים עם PBS-H למשך 5 דקות לכל.
התראה: Paraformaldehyde הוא רעיל; ללבוש ציוד מגן אישי המתאים. - להשתמש במכחול כדי להעביר את המקטעים לשקופית מיקרוסקופ. יש להיזהר לא לדחוף את הרקמה מדי. מעיל כל מקטע עם גליצרול/הג'לטין המכיל מספר n-propyl 4 מ"ג/מ"ל או באמצעי הרכבה אחר המכיל את fluorophore של שימור. לכסות עם coverslip.
- לאחסן את השקופיות במיכל המוגן על-ידי אור שקופיות ב-20 מעלות צלזיוס. לשטוף את הצלחות תרביות רקמה ולהסיר את התוויות על עפעפיו באמצעות אלכוהול.
הערה: הלוחות ניתן להשתמש בהם.
5. רכישת תמונות מיקרוסקופ קונפוקלי
- לכידת תמונות ברזולוציה גבוהה עם מיקרוסקופ קונפוקלי, באמצעות לייזרים המתאים מסננים עבור כל fluorophore ( איור 1 א' ו ב').
הערה: בדוגמה זו, מיקרוסקופ קונפוקלי (ראה את הטבלה של חומרים) שימש. תמונות נאספו באמצעות הלייזר nm 561 ב 20% כוח של ירקרק התווית על-ידי צהוב אנטיגן ספציפי בתאי T, הלייזר 488-nm ב 10% כוח עבור התווית על-ידי ירוק לבטא CD20 B תאים של הלייזר 640-nm ב 15% כוח עבור תאי CD8 T מתויג אדום רחוק. 20 X אובייקטיבית, מפתח נומרי של 0.8 שימשו. - ברצף לאסוף z-סדרה 3 מיקרומטר (או השני) מרווחי בערוצים שלושה שדות מרובים 800 x 800 פיקסלים. לבנות מצרף של השדות שנאספו ( איור 1C -E). שם כל תמונה מונטאז בהתבסס על המידע של השקופית המתאימה ולשמור אותה לניתוח.
- לבצע ניתוח התמונה כמותית באמצעות מיקרוסקופ קונפוקלי בהתאמה ניתוח, כימות התוכנה או באמצעות ImageJ.
6. כמותיים וניתוח תמונות
הערה: ניתוח כמותי תמונות יכול להתבצע באמצעות ניתוח מיקרוסקופ קונפוקלי ותוכנות כימות או באמצעות תוכנת ImageJ. כאן, ImageJ שימש כדוגמה.
- פתח קונאפוקלית מונטאז על-ידי גרירתה לחלון ImageJ ( איור 2 א).
הערה: ImageJ יכול לפתוח ישירות montages שנאספו על ידי מיקרוסקופ קונפוקלי שונים רבים. אם מונטאז לא ניתן לפתוח ישירות על-ידי ImageJ, לייצא את z-הסריקה שנבחרו כקובץ TIFF כדי לפתוח את זה - לשכפל את הסריקה-z שנבחרו לניתוח (" התמונה "-> " לשכפל ") ( איור 2B).
- לפצל את הערוצים השונים (" התמונה "-> " צבע "-> " פצל ערוצים ") ( איור 2C).
- לצייר את רועי לניתוח כמותי בערוץ המתאים כדי להיות אובייקטיבי ולהוסיף אותו למנהל רועי על ידי לחיצה על " T " בלוח המקשים. למדוד את השטח.
הערה: מנהל רועי ImageJ מציג את האזור מיקרומטר 2 ( איור דו-ממדי). - להתאים את קרינה פלואורסצנטית הבהירות והחדות של הערוץ כדי להיות מנותח (" התמונה "-> " התאם "-> " בהירות/ניגוד ") ( איור 2E).
- לשטח את ההחזר על התמונה (" רועי מנהל "-> " לשטח ") ( איור 2F).
- לכמת התאים חיובית התמונה באמצעות " multi-point " כלי ( איור 2G).
תוצאות
איור 1 מראה כיצד לאסוף תמונות קונאפוקלית באמצעות מיקרוסקופ קונפוקלי. איור 2 מדגים ניתוח התמונה כמותית באמצעות ImageJ. דמויות 3 ו- 4 הצג נציג תמונות של רקמות הלימפה סיב נגוע מקוק רזוס צבעונית עם MHC tetramers, נוגדנים CD8 נוגדנים CD20, ומגישים להפגין יחודיות של ההכתמה MHC-tetramer. איור 3 משווה MHC מחלקה אני tetramers טעון עם פפטיד של סיב לעומת קטעים מתוך הרקמה אותו מוכתם מחלקה MHC tetramers עמוסה פפטיד לא רלוונטי. איור 4 מראה כי תאים מוכתם tetramer MHC/סיב-פפטיד הם מוכתמים במשותף עם נוגדנים CD8, אבל לא CD20 נוגדנים, כתם בתאי B. איור 5 מראה דוגמה במצרף שנוצרו משדות מרובים קונאפוקלית מסדרת z, המשמש עבור כימות של tetramer צבעונית תאים עם פנוטיפים ספציפי בתאים אנטומי שונה על הצומת לימפה. ההרחבה מציגה שטח של הצומת לימפה עם זקיק תא B המותווית על ידי CD20 מכתים ואזור שמסביב תא T, שבו ניתן להבחין תאים MHC-tetramer-צבעונית, אשר חלקם במשותף אקספרס Ki67 אשר מהווה סמן של תא T הפעלה והתפשטות. שילוב מכתימים זה מאפשר קביעת פנוטיפ של תאי T CD8 SIV ספציפיים בתוך ומחוץ זקיקי תא B, בקשר לתאי T CD8 ספציפיים SIV ו לתאים לביטוי אחרים Ki67, ותאי B.

איור 1: נציג צילומי מסך מראה כיצד לאסוף תמונות קונאפוקלית באמצעות מיקרוסקופ קונפוקלי. רכישה (A) במצב נהג לאסוף תמונות קונפוקלי. ערוצי (B) המשמש עבור אוסף תמונה. (ג) 20 X אובייקטיבית, 800 x 800 פיקסלים שדות שימשו באוסף תמונות. (ד) A z רציף-מחסנית נאסף במרווחים 3 מיקרומטר. (E) אריחים אומצו ניסחו ולאסוף תמונות בשדות מרובים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2 : נציג צילומי מסך הוכחת כמותיים תמונה ניתוח באמצעות ImageJ. (א) פתח במצרף קונאפוקלית על-ידי גרירתה לחלון ImageJ. (B) כפול z-הסריקה שנבחרו לניתוח. (ג) לפצל את ערוצים שונים. (ד) צייר רועי לניתוח כמותי בערוץ המתאים כדי להיות אובייקטיבי ולהוסיף אותו למנהל רועי על ידי לחיצה על "ט" (E) כוונון הבהירות פלורסצנטיות והחדות של הערוץ כדי להיות מנותח. (F) לשטח רועי על התמונה. (G) ספירת החיובי תאים בתמונה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
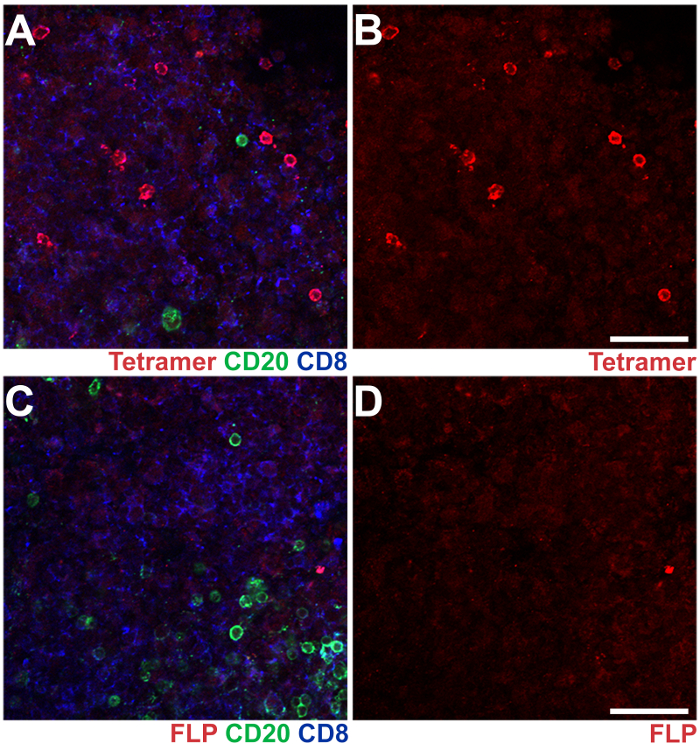
איור 3 : IST בשילוב IHC בסעיפים לנתיחה הלימפה בבית השחי הצומת של מקוק רזוס הנגועים סיב. Tetramers Mamu - A * 02 נטען עם פפטידים SIV Nef YY9 שימשו כתם תאי CD8 T אנטיגן ספציפי, דומה tetramers עמוסה של פפטיד FLP לא רלוונטיים מן הנגיף הפטיטיס B שימשו פקד שלילי (אדום). נוגדנים אנטי-CD20 העכבר שימשו כתם CD20+ B תאים (ירוק), נוגדנים anti-CD8 חולדה שימשו כתם CD8+ T תאים (כחול). (א) א התמונה נציג מ מקטע לנתיחה הלימפה בבית השחי הצומת צבעונית עם tetramers YY9, CD20 ו CD8 נוגדנים. (B) אותה תמונה כמו לוח מציג את tetramer YY9 כתם לבד. (ג) תמונת הנציגה של קטע מן הצומת לימפה באותו בית השחי, מוכתם עם FLP tetramers, נוגדנים CD20 ו CD8. (ד) אותה תמונה כמו לוח C עם tetramer FLP כתם לבד. גודל ברים = 100 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
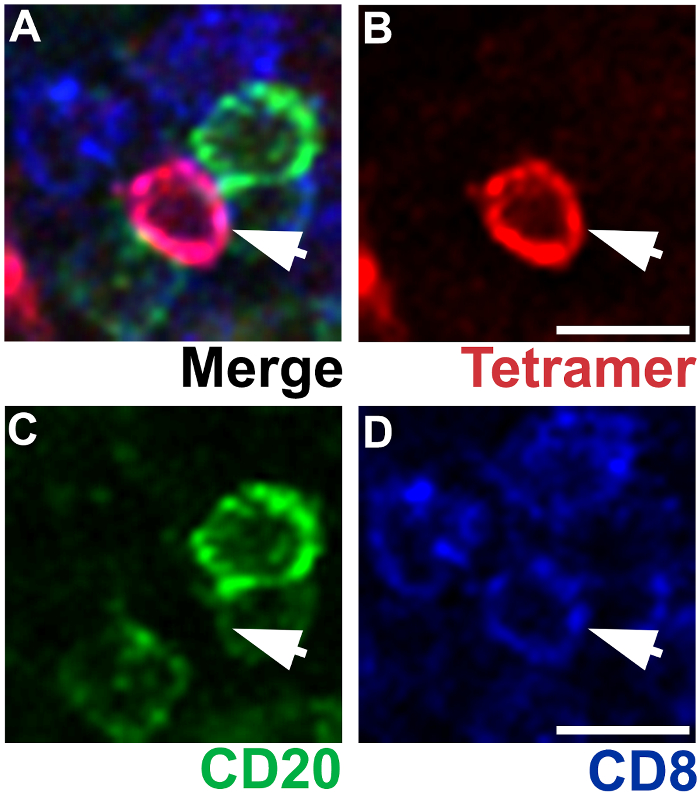
איור 4 : IST בשילוב IHC מציג יחודיות של צביעת MHC-tetramer. נציג צומת בית השחי הלימפה סעיף מוכתם Mamu - A * 02 tetramers טעון עם פפטידים Nef YY9 תאי T CD8 SIV ספציפיים תווית (אדום), העכבר נוגדנים anti-CD20 לתאי B תווית (ירוק) של עכברוש נוגדנים anti-CD8 לתאים תווית CD8 T (כחול) (A ). תא T CD8 SIV ספציפי הוא tetramer + (B), CD20– (ג), ו CD8+ (D). גודל ברים = 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
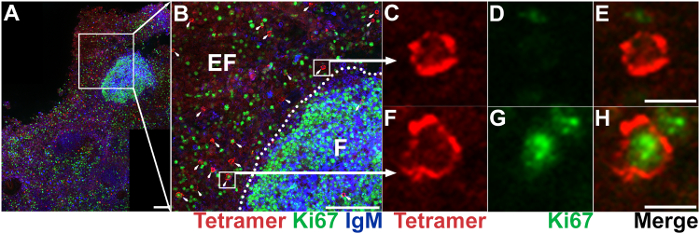
איור 5: IST בשילוב IHC להראות את מיקום שפע, ותפקיד של תאי T CD8 אנטיגן ספציפי. (א) סעיף נציג צומת בית השחי הלימפה מוכתם Mamu - A * 02 tetramers טעון עם פפטידים Nef YY9 לתייג בתאי T CD8 SIV ספציפיים (אדום), נוגדנים Ki67 לסמן תאים מתרבים (ירוק) ו- IgM נוגדנים לתאי תווית B (כחול). סרגל קנה מידה = 100 מיקרומטר. (B) הגדלה של אזור שנבחר בלוח א IgM מכתים מגדיר את האזור הזקיקים, אשר מסומן "F"; אזור extrafollicular מסומן "EF." Tetramer+ תאים מסומנים עם החצים. סרגל קנה מידה = 100 מיקרומטר. נציג tetramer+ Ki67 תא– (C, D, E), tetramer+ Ki67+ תא (F, G, H). סרגל קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
IST בשילוב עם IHC מספק כלי חיוני עבור זיהוי, אפיון לכימות אנטיגן ספציפי בתאי CD8 T בסביבות מקורית עם ההקשר של תאים ומבנים רקמות אחרות. כאן, אנו המתואר הליכים מפורטים עבור IST בשילוב עם IHC, ואחריו ניתוח תמונה כמותית, כדי לקבוע את מיקום שפע, ותפקיד של אנטיגן ספציפי בתאי CD8 T בבלוטות הלימפה של קופי מקוק רזוס. צביעת דומה יכול להיות עכבר יישומית האנושי, או רקמות אחרות מינים עבור אילו MHC-אני tetramers הינם זמינים. בנוסף, פפטיד MHC Class II tetramer או dextramer מכתים יכול להתבצע באמצעות מתודולוגיות דומה יחסית לתייג אנטיגן ספציפי בתאי CD4 T רקמות4,5,6,7, 8 , 9 , 10 , 11 , 12 , 13. IST יכול גם להיות משולב עם איש כדי לקבוע, למשל, אין ויוו אפקטור-כדי-יעד תא רמות18,19. בעתיד, זה יהיה מעניין לשאת IST/IHC עוד יותר על ידי שילוב IST/IHC עם מתקדם בחיי עיר RNA ו- DNA זיהוי מתודולוגיות. הפיתוחים האחרונים בתחום בחיי עיר הכלאה מבחני כוללים הפיתוח של RNAscope ו- DNAscope24. שיטות אלה מאפשרות איתור יעד RNA ו- DNA ברקמות. זה יהיה מרגש לשלב שיטות אלה עם IST IHC כדי לזהות בו זמנית בתאי T וירוס-ספציפי-CD8, RNA נגיפי, ה-DNA הנגיפי ואת התווית על-ידי נוגדנים אנטיגנים של עניין.
בעוד אנחנו במקור תיאר IST שיטות עם רקמות טריים, רקמות ועיניו שננעצו עבור משך זמן קצר ורקמות קפוא4, בשנים האחרונות, באופן בלעדי השתמשנו מקטעי רקמת טריים, כפי שהם מייצרים באופן עקבי את הכתמים האיכותי לאפשר הבחינה של תאים בסעיפים רקמות עבות. כמו אלטרנטיבה הנהלים שהוצגו כאן, אחד יכול להחיל את tetramers על רקמות דגירה בין לילה, לתקן, להטמיע, cryopreserve קפואים בינוני (למשל, OCT), לייצר סעיפים רזה קפוא ולבצע IHC מאוחר יותר22. בדומה לכך, אנו באופן שגרתי כתם תת-קבוצה של רקמות מקטעים עם tetramers לבד, ואז להקפיא את הסעיפים ב- OCT כדי לאפשר counterstaining שילובים נוספים בעתיד. בנוסף, ניתן להשתמש multimers מצומדת Qdot 655 פפטיד-MHC ישירות להמחיש T אנטיגן ספציפי בתאי רקמת cryopreserved סעיפים13.
שתיארנו כאן עקיפה tetramer מכתים. ישיר מכתים באמצעות tetramers מצומדת APC או PE גם הוכח לעבוד4,22. במקרה זה, הריכוז של MHC tetramer הנדרש הוא גבוה יותר מאשר בשימוש עקיף tetramer מכתים. בידיים שלנו, ריכוז של µg/mL 20 של התווית על-ידי APC tetramer היה יעיל על איתור תאים אנטיגן ספציפי. לעומת זאת, עוצמת מכתימים היה נמוך בהרבה מזה שהושג עם תיוג עקיף, הכולל הגברה עם נוגדנים אנטי-FITC.
מצאנו כי השימוש מיקרוטום מבוססי דחיסה (ראה את הטבלה של חומרים) עבור חיתוך רקמה טריים, הקלו את התהליך של חיתוך מקטעי רקמת טריים כמו לעומת שימוש מיקרוטום רוטטת23. עם זאת, במקרים שבו מיקרוטום מבוססי דחיסה אינה זמינה, מיקרוטום רוטטת או אזמל יכול לשמש בשביל לרקמות טריים חלוקתה.
מגבלה עיקרית של שיטה זו הוא השימוש של רקמות טריים. שימוש ברקמות טריים הוא הרבה יותר קשה מאשר רקמות קבוע או קפוא כי הם דורשים תשומת לב מיידית ועיבוד. לנו יש שנשלחו בהצלחה רקמות טריים למשך הלילה על קרח בינוני תרביות רקמה או ה-PBS עם זאת, היו פה ושם בעיות עם משלוח; לדוגמה, סופות שלגים דחו את המשלוח של רקמות במשך 48 שעות או יותר. במקרים אלה, מצאנו כי רקמות טריים למחלקה ואלה צבעונית 48 שעות לאחר מיצוי כלל להראות מכתים ספציפי, עם סימנים של השפלה רקמות מסוימות; רקמות צבעונית החילוץ שלאחר 72 h מושפלים מדי עבור מכתים. מצאנו את זה גם את המשלוח של רקמות טריים עם גושי קרח, כי הם יותר מדי קר מדי או קרוב אליו שהרקמות ניתן להקפיא את הרקמות במהלך המשלוח; הקפאה זו בדרך כלל הורסת רקמת עבור צביעת. לכן חשוב מאוד לשלוח רקמות טריים מקורר, אבל לא קפוא, ליזום IST מכתים בתוך ה 24 רקמות טריים עיבוד גם מצריכה מידה רבה של תלמיד ו צוות זמן, כמו רקמות חיות מרובים או משתתפי המחקר לא יכול להיות שנאספו, מיטה ביחד על תאריך מאוחר יותר. למרות קשיים אלה, אנו מוצאים כי מקטעי רקמת טריים הם הבחירה הטובה ביותר עבור יפה, ספציפית IST/IHC מכתים.
מגבלה נוספת של השיטה IST/IHC המתוארים כאן הוא הגישה מכתימים עקיף. בשל מגבלות על מספר מינים שונים של בעלי חיים זמין כדי ליצור שילובים נוגדנים משניים, אנחנו מוגבלים על ידי נוגדנים עקיף מכתים שיטות נוגדן פלורסנט רק שלוש או ארבע מכתים שילובים בכל פעם. זה מגביל את כמות המידע הניתנים לאיסוף על לוח רקמה אחת. צביעת IHC ישירה מתגבר על מגבלה זו, באפשרותך להרחיב את היכולות, זיהוי מתויג נוגדנים אנטיגנים 8 או יותר בו זמנית, אם כי עם כל נוגדן בהפקת אות ניאון הרבה יותר חלשה לעומת שיטות עקיפות. לפיכך, IHC עקיף עשוי לשמש כחלופה IHC עקיף עבור counterstaining שהוכתמו IST רקמות, המאפשר איתור מספר רב יותר של אנטיגנים הסלולר בשילוב עם גילוי IST של תאי CD8 T אנטיגן ספציפי.
במקרים מסוימים, autofluorescence ניכר ו/או איגוד tetramer או נוגדן שאינם ספציפיים עלולה להתרחש עם IST/איש. מסיבה זו, פקדים חיוביים ושליליים טוב נחוצים להבחין כתמים מסוימים מרקע, מכתים autofluorescent. שלילי טוב שולט על MHC אני tetramers כוללות רקמות בקרה שלילית (למשל, רקמות לבריא; רקמות מוכתם MHC tetramers טעון עם פפטידים לא רלוונטי או לא רלוונטי MHC tetramers; או, קמצוץ, רקמות מוכתם. לא tetramers אבל עם הגברה נוגדנים).
לסיכום, MHC I IST בשילוב עם IHC הוא כלי חשוב כדי לקבוע את מיקום שפע, ותפקיד של אנטיגן ספציפי בתאי CD8 T ברקמות. מתודולוגיה זו מאפשרת זיהוי אנטיגן ספציפי בתאי CD8 T בסביבות מקורי, עם ההתאמה היחסית אל שאר סוגי תאים ומבנים רקמות מתוחזק. שיטה זו ישימה באופן כללי כי זה יכול לשמש כדי להתאים לשפה, פנוטיפ, ולכמת למעשה כל אנטיגן ספציפי CD8 תא T עבור אילו MHC tetramers זמינים, בכל רקמה.
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי שירותי הבריאות הציבוריים מעניקה מ מכוני הבריאות הלאומיים (T32 DA007097, R01AI096966, andUM1AI26617).
Materials
| Name | Company | Catalog Number | Comments |
| MHC-I monomer | NIH tetramer core facility | Materials for MHC-tetramer preparation | |
| ExtrAvidin-FITC | Sigma-Aldrich | E2716 | Materials for MHC-tetramer preparation |
| Normal goat serum | Jackson Immunoresearch | 005-000-121 | |
| Low melt agarose | Promega | V3121 | |
| Heparin | Sigma-Aldrich | SLBL6391V | |
| Triton X-100 | Sigma-Aldrich | T-6878 | |
| Urea | J.T.Baker | 4204-05 | |
| Glycerol gelatin | Sigma-Aldrich | SLBH2672V | |
| n-propyl gallate | Sigma-Aldrich | P3130 | |
| rat-a-h-CD8 (1:500) | Acris | 0714 | Antibody unstable, use single use frozen aliquot |
| m-a-h-CD20 (1:500) | NOVOCASTRA | 6026819 | |
| m-a-h-Ki67 (1:500) | Vector | 6022201 | |
| goat-a-m-A488 (1:2,000) | Jackson Immunoresearch | 124083 | |
| goat-a-rb-Cy3 (1:5,000) | Jackson Immunoresearch | 106232 | |
| goat-a-rat-Cy5 (1:5,000) | Jackson Immunoresearch | 118088 | |
| goat-a-h-IgM-Dylight649 (1:5,000) | Jackson Immunoresearch | 86579 | |
| Compresstome: VF-300 Microtome | Precisionary Instruments, LLC | 1079 | |
| Quick Set Instant Adhesive | Loctite | 46551 | |
| 24-well flat bottomed tissue culture plates | Falcon | 353226 | |
| Microscope slide | Globe scienfitic Inc. | #1321 | |
| Razor blade | Ted Pella, Inc | 121-6 | |
| Feather Disposable Scalpel | FEATHER SAFETY RAZOR CO. LTD. | No. 21 | |
| Round paintbrush #2 | PRINCETON ART & BRUSH CO. | 4350R | Can trim as needed with razor |
| Confocal Microscope | Olympus | FV1000 | |
| FV10-ASW_Viewer4.0 | Olympus |
References
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Novak, E. J., Liu, A. W., Nepom, G. T., Kwok, W. W. MHC Class II tetramers identify peptide-specific human CD4(+) T cells proliferating in response to influenza A antigen. J Clin Invest. 104, R63-R67 (1999).
- Steinert, E. M., et al. Quantifying memory CD8 T cells reveals regionalization of immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Skinner, P. J., Daniels, M. A., Schmidt, C. S., Jameson, S. C., Haase, A. T. Cutting edge: In situ tetramer staining of antigen-specific T cells in tissues. J Immunol. 165 (2), 613-617 (2000).
- Haanen, J. B., et al. In situ detection of virus- and tumor-specific T-cell immunity. Nat Med. 6 (9), 1056-1060 (2000).
- Skinner, P. J., Haase, A. T. In situ tetramer staining using MHC class I tetramers. J Immunol Methods. 268 (1), 29-34 (2002).
- Skinner, P. J., Haase, A. T. In situ staining using MHC class I tetramers. Curr Protoc Immunol. 17, 4.1-4.9 (2004).
- Li, Y., et al. Use of HLA-DR*08032/E7 and HLA-DR*0818/E7 tetramers in tracking of epitope-specific CD4+ T cells in active and convalescent tuberculosis patients compared with control donors. Immunobiology. 216, 947-960 (2011).
- Bischof, F., et al. Analysis of autoreactive CD4 T cells in experimental autoimmune encephalomyelitis after primary and secondary challenge using MHC class II tetramers. J Immunol. 172, 2878-2884 (2004).
- Massilamany, C., et al. Direct staining with major histocompatibility complex class II dextramers permits detection of antigen-specific, autoreactive CD4 T cells in situ. PLoS ONE. 9, e87519(2014).
- Massilamany, C., et al. In situ detection of autoreactive CD4 T cells in brain and heart using major histocompatibility complex class II dextramers. J Vis Exp. (90), e51679(2014).
- Dileepan, T., Kim, H. O., Cleary, P. P., Skinner, P. J. In Situ Peptide-MHC-II Tetramer Staining of Antigen-Specific CD4+ T Cells in Tissues. PLoS ONE. 10 (6), e0128862(2015).
- Tjernlund, A., et al. In situ detection of Gag-specific CD8+ cells in the GI tract of SIV infected Rhesus macaques. Retrovirology. 7, 7-12 (2010).
- Connick, E., et al. CTL fail to accumulate at sites of HIV-1 replication in lymphoid tissue. J Immunol. 178, 6975-6983 (2007).
- Hong, J. J., et al. Localized Populations of CD8low/− MHC Class I Tetramer+ SIV-Specific T Cells in Lymphoid Follicles and Genital Epithelium. PLoS ONE. 4 (1), e4131(2009).
- Sasikala-Appukuttan, A. K., et al. Location and dynamics of the immunodominant CD8 T cell response to SIVΔnef immunization and SIVmac251 vaginal challenge. PLoS ONE. 8 (12), e81623(2013).
- Connick, E., et al. Compartmentalization of simian immunodeficiency virus replication within secondary lymphoid tissues of rhesus macaques is linked to disease stage and inversely related to localization of virus-specific CTL. J Immunol. 193, 5613-5625 (2014).
- Li, Q., et al. Visualizing antigen-specific and infected cells in situ predicts outcomes in early viral infection. Science. 323, 1726-1729 (2009).
- Li, Q., Skinner, P. J., Duan, L., Haase, A. T. A technique to simultaneously visualize virus-specific CD8+ T cells and virus-infected cells in situ. J Vis Exp. (30), e1561(2009).
- Li, S., et al. Simian immunodeficiency virus-producing cells in follicles are partially suppressed by CD8+ cells in vivo. J Virol. 90, 11168-11180 (2016).
- Daniels, M. A., Jameson, S. C. Critical role for CD8 in T cell receptor binding and activation by peptide/major histocompatibility complex multimers. J Exp Med. 191, 335-346 (2000).
- Lee, Y. J., Wang, H., Starrett, G. J., Phuong, V., Jameson, S. C., Hogquist, K. A. Tissue specific distribution of iNKT cells impacts their cytokine response. Immunity. 43 (3), 566-578 (2015).
- Abdelaal, H. M., Kim, H. O., Wagstaff, R., Sawahata, R., Southern, P. J., Skinner, P. J. Comparison of Vibratome and Compresstome sectioning of fresh primate lymphoid and genital tissues for in situ MHC-tetramer and immunofluorescence staining. Biol Proced Online. 17, (2015).
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. J Mol Diagn. 14 (1), 22-29 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved