Method Article
In Situ MHC-Tetramer Färbung und Quantitative Analyse zur Bestimmung der Lage, Fülle und Phänotyp der Antigen-spezifische CD8-T-Zellen in den Geweben
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Methode, die kombiniert in Situ MHC-Tetramer Färbung mit Immunohistochemistry, Lokalisierung, Phänotyp und Menge an Antigen-spezifische T-Zellen im Gewebe zu bestimmen. Dieses Protokoll wird verwendet, um die räumliche und phänotypischen Merkmale der Antigen-spezifische CD8 T-Zellen im Vergleich zu anderen Zelltyp und Strukturen im Gewebe zu bestimmen.
Zusammenfassung
T-Zellen sind entscheidend für viele immunologische Prozesse, einschließlich der Erkennung und Beseitigung von Virus-infizierten Zellen, verhindert Autoimmunität, Unterstützung bei der B-Zellen und Plasma-Zelle Produktion von Antikörpern und Aufspüren und eliminieren von Krebszellen. Die Entwicklung der MHC-Tetramer Färbung von antigenspezifischen T-Zellen durch Durchflusszytometrie analysiert revolutioniert unsere Fähigkeit zu untersuchen und verstehen die Immunbiologie der T-Zellen. Während äußerst nützlich für die Bestimmung der Menge und der Phänotyp der antigenspezifischen T-Zellen, bestimmen nicht Durchflusszytometrie die räumliche Lokalisation der antigenspezifischen T-Zellen auf andere Zellen und Strukturen im Gewebe und aktuellen Disaggregation Techniken. zum Extrahieren der T benötigt Zellen für Durchflusszytometrie Wirksamkeit in nicht-lymphatischen Geweben eingeschränkt haben. In situ MHC-Tetramer Färbung (IST) ist eine Technik, T-Zellen zu visualisieren, die spezifisch für Antigene von Interesse im Gewebe sind. In Kombination mit Immunhistochemie (IHC) bestimmen IST die Fülle, Standort und Phänotyp der Antigen-spezifische CD8 und CD4-T-Zellen in den Geweben. Hier beschreiben wir ein Protokoll, um Flecken und Antigen-spezifischen CD8 T-Zellen, mit bestimmten Phänotypen befindet sich in bestimmte Gewebe Fächer aufzählen. Diese Verfahren sind die gleichen, die wir in unserem kürzlich erschienenen Publikation von Li Et Al., unter dem Titel verwendet "Simian Immunodeficiency Virus-produzierenden Zellen im Follikel werden teilweise unterdrückt durch CD8 Zellen+ In Vivo." Die beschriebenen Methoden sind breit anwendbar, weil sie verwendet werden, können um zu lokalisieren, Phänotyp, und im wesentlichen Antigen-spezifischen CD8 T Zelle für die MHC-Tetramers in jedem Gewebe vorliegen, zu quantifizieren.
Einleitung
T-Zellen sind entscheidend für viele immunologische Prozesse, einschließlich der Erkennung und Beseitigung von Virus-infizierten Zellen, verhindert Autoimmunität, Unterstützung bei der B-Zellen und Plasma-Zelle Produktion von Antikörpern und Aufspüren und eliminieren von Krebszellen. Die Entwicklung von Peptid/MHC Klasse I Tetramer Färbung des Antigen-spezifische CD8 T-Zellen1 und die neuere Entwicklung der MHC Klasse II Tetramer Färbung von CD4-T-Zellen-2 durch Durchflusszytometrie revolutioniert unsere Fähigkeit zu studieren und zu verstehen, die Immunbiologie der T-Zellen. Während äußerst nützlich für die Bestimmung der Menge und der Phänotyp der antigenspezifischen T-Zellen, lässt die Durchflusszytometrie nicht für den Nachweis von räumliche Lokalisation der antigenspezifischen T-Zellen auf andere Zellen und Strukturen in den Geweben, und aktuelle Disaggregation Techniken, die T-Zellen zu extrahieren benötigt für Durchflusszytometrie Wirksamkeit in nicht-lymphatischen Gewebe3begrenzt haben.
Wir und andere entwickelten Methoden mit Peptid beladenen MHC Klasse I und Klasse II Tetramer oder Multimer Reagenzien, Antigen-spezifische CD8 und CD4-T-Zellen im Gewebe4,5,6,7, beflecken 8 , 9 , 10 , 11 , 12 , 13. these IST Methoden ermöglichen die Bestimmung der Lage, die Fülle und den Phänotyp der Antigen-spezifische CD8 und CD4-T-Zellen in den Geweben und bieten eine Möglichkeit, diese Zellen im Vergleich zu anderen Zellen und Strukturen im Gewebe zu erkennen. Unsere Fraktion wird intensiv genutzt, MHC-ich Tetramer beflecken, zum studieren Human Immunodeficiency Virus (HIV)- und simian Immunodeficiencyvirus (SIV) - spezifischen CD8 T-Zellen im lymphatischen, genitalen und rektalen Gewebe um ein Verständnis von HIV und SIV Immunpathogenese und Korrelate des erfolgreichen Impfung Strategien14,15,16,17zu identifizieren. Darüber hinaus entwickelten wir auch eine Technik, die kombiniert IST mit in Situ Hybridisierung (ISH) zu lokalisieren und zu quantifizieren, Virus-spezifischen CD8 T-Zellen und Virus-infizierten Zellen in Geweben und zu bestimmen, die in Vivo -Effektor-zu-Zielwerte 18 , 19.
Hier beschreiben wir ein Protokoll mit Peptid beladenen MHC-ich Tetramers Antigen-spezifische CD8 T-Zellen in frischen Gewebeschnitten zu Gegenfärbung Gewebe mit IHC beflecken und Zellen mit bestimmten Phänotypen in bestimmte Gewebe Fächer zu quantifizieren. Diese Verfahren sind die gleichen wie in unseren kürzlich erschienenen Publikation von Li Et Al., verwendet wurden, in denen wir die Lage, der Fülle und der Phänotyp der SIV-spezifische T-Zellen im lymphatischen Gewebe während chronische SIV-Infektion bei Makaken20bestimmt.
Für dieses Verfahren sind frische Gewebe geschnitten und über Nacht inkubiert mit Peptid beladenen MHC-ich Tetramers konjugiert zu Fluorescein Thiocyanat Moleküle (FITC). Sie sind dann in Paraformaldehyd fixiert. Nach der Fixierung des Gewebes, ist das Signal von der MHC-Tetramers verstärkt mit Kaninchen Anti-FITC Antikörper und inkubiert mit Gewebekulturen tagged Anti-Kaninchen-IgG-Antikörper, die das Signal von der gebundenen Tetramers weiter zu verstärken. IHC dient in Verbindung mit IST Antigen-spezifische T-Zellen und umgebenden Zellen zu charakterisieren. Antikörper, die Epitope auf der Oberfläche von Zellen oder in den Extrazellulärraum zu erkennen sind in der primären Inkubation mit dem Tetramers enthalten. Antikörper, die intrazellulären Epitope erkennen erfordern Durchdringung der Zellwand vor dem beflecken. Die gefärbten Gewebeschnitten sind abgebildet mit einem konfokalen Mikroskop und mittels konfokale Software analysiert. Markierte Zellen werden mit der konfokalen Mikroskopie Software oder ImageJ quantifiziert. Das beschriebene Protokoll kann verwendet werden, um im wesentlichen Antigen-spezifische CD8 T-Zellen in jedem Gewebe für die MHC färben-ich Tetramers stehen zur Verfügung.
Protokoll
1. 1. Tag: frisches Gewebe schneiden und primäre Inkubation
- Verwendung eines Skalpells frische Gewebe in kleine (ca. 0,5 cm breit von 0,5 cm groß) Stücke schneiden. Separat kleben Sie jedes Gewebe, einem Kolben und eingebettet in PBS mit 3-5 mL 4 % Low-Melt Agarose. Kennzeichnen Sie den Kolben mit der Gewebe-Informationen mit einem Aufkleber. Legen Sie es in ein gekühltes Halter in einem Eiskübel zu festigen.
- Schalten Sie das Mikrotom und setzen die Dicke der Querschnitte 200 µm. Installation einer Rasierklinge auf dem Mikrotom und legen Sie den Kolben mit Gewebe in der Badewanne Mikrotom montiert.
- Bereiten Phosphat-gepufferte Kochsalzlösung mit Heparin (PBS-H) durch Zugabe von 100 µg/mL oder 18,7 U/mL Heparin, PBS, die RNA zu bewahren und ISH Anwendungsmöglichkeiten stromabwärts zu ermöglichen. Füllen Sie das Mikrotom-Bad, für das eingebettete Gewebe mit 100-120 mL gekühlten, sterile PBS-H. PBS-H Eiswürfel hinzufügen, um das Bad, die Temperatur bei 0 - 2 ° C. Start Mikrotom und Schneiden des Gewebes in 200 µm Abschnitte.
Hinweis: Es ist wichtig, dass das Gewebe gekühlt auf Eis, zelluläre Aktivität im Gewebe zu minimieren und da frische Gewebe ist leichter zu Abschnitt, wenn sie gekühlt wird. PBS allein kann verwendet werden, wenn es keine Pläne für nachgeschaltete ISH. - Alternativ für Gewebe, die nicht gut mit einem Mikrotom (z.B., Darm und Lunge), Schneiden verwenden ein Skalpell oder einer Rasierklinge, schneiden Sie das Gewebe in dünne Streifen als möglichst nahe an 200 µm.
- Beschriften Sie den Deckel des 24-Well-Zellkultur-Platten mit den experimentellen Probeninformationen und legen Sie die Gewebe-Kammern in den entsprechenden Vertiefungen. Verwenden ein Pinsel in den Abschnitten zu einer Gewebe-Kammer übertragen in den Brunnen einer Gewebekultur 24-Well-Platte mit 1 mL PBS-H. gekühlt
Hinweis: Wiederverwendbaren Kammern sollten vor Einleitung Färbung vorgenommen werden. Gewebe-Kammern können erfolgen mit einem 14 mL Polypropylen Rundboden Snap-Cap Rohr und Drahtgeflecht. Verwenden Sie eine scharfe Rasierklinge ein 14 mL Polypropylen Rundboden Snap-Cap Rohr unten abgeschnitten. Schneiden Sie das Drahtgeflecht in einem Kreis um das Loch an der Unterseite des Rohres zu passen. Hitze der Wire Mesh Kreis mit dem Bunsenbrenner, bis es glühend ist. Setzen Sie Wire Mesh Kreis sehr schnell ab und schieben Sie den Schlauch auf das Netz. Überprüfen Sie, dass das Drahtgeflecht ist sicher an der Unterseite des Rohres befestigt und dann vorsichtig die Spitze des Rohres an der 3 mL-Marke mit einer scharfen Rasierklinge abgeschnitten. Legen Sie bis zu 3 Gewebeschnitte in jedes Gewebe Patronenlager oder bis zu 1 cm 2 des Gewebes pro Bohrloch. Halten Sie mindestens einen leeren Brunnen zwischen Brunnen mit verschiedenen Antikörper Kombinationen, um Kreuzkontaminationen zu vermeiden. - Gehen Sie zu den primären Tetramer und Antikörper Färbung unmittelbar nach Abschluss der Übertragung alle Zuschnitte in die Gewebe-Kammern. Halten Sie die Abschnitte unter Wasser und in 1 mL PBS-H stets gekühlt.
- Brüten die Gewebeschnitte Übernachtung mit 0,5 µg/mL FITC konjugiert, Peptid beladenen MHC-ich Tetramers im PBS-H mit 2 % normalem Ziegenserum (NGS) verdünnt. Maus oder andere-Kaninchen-Antikörper gegen extrazelluläre Epitope des Interesses an dieser Inkubation enthalten (z. B. Ratte Anti-CD8 Antikörper verdünnt 1: 500 im PBS-H mit 2 % NGS). Legen Sie 1 mL der verdünnten Antikörper in jede Vertiefung.
Hinweis: Vorsicht bei der Auswahl der CD8-Antikörper, wie einige verbessern können und einige MHC Tetramers Bindung an T-Zell-Rezeptoren 4 , 21 hemmen können. Die Ratte Anti-Human CD8 Antikörper hier beschriebenen ist instabil und manchmal etwas schwache Färbung ergibt. Es dient hier zur dreifachen bezeichnen, denn es das einzige nicht-Kaninchen ist und -Maus-CD8-Antikörper, dass gefärbten Rhesus Makake CD8 T-Zellen getestet. - 1 mL der Lösung pro Bohrloch für Primärantikörper und alle nachfolgenden Inkubationen verwenden, und führen Sie diese und alle nachfolgenden Inkubationen bei 4 ° C, mit den Platten auf einem schaukelnden Plattform.
Hinweis: Gewebe sollte frei im Raum schweben.
2. Tag 2: Fixierung und sekundäre Inkubation
- Abschnitt zweimal mit 1 mL gekühlten PBS-H 20 min waschen nach der primären Inkubation jedem Waschgang. Tun Sie dies durch die Übertragung der Gewebe-Kammern zu einer verschiedenen 24-Well-Zellkultur-Platte mit 1 mL gekühlten PBS-H in den entsprechenden Vertiefungen.
Hinweis: Achten Sie darauf, Inhalte aus einem experimentellen Probe in ein anderes tropft beim Wechsel zwischen Gewebe Kammern. Für alle nachfolgenden Inkubationen und Waschungen ähnlich übertragen Sie die Gewebe-Kammer auf einen sauberen Teller mit der entsprechenden Lösung. Achten Sie darauf, die Abschnitte in den Gewebe-Kammern zu überwachen, während des Verfahrens um sicherzustellen, dass die Abschnitte nicht zu den Seiten der Gewebe Kammern stecken zu tun. Wenn sie sie zurück in die Lösung, drücken wollen,. - Befestigen Sie die Abschnitte mit 1 mL frisch PBS-gepufferte 4 % Paraformaldehyd für 2 h bei Raumtemperatur (nicht über fix). Waschen mit kaltem PBS-H zweimal für 5 min.
Achtung: Paraformaldehyd ist giftig; Tragen geeigneten persönlichen Schutzausrüstung.
Hinweis: Ggf. Antigen-Retrieval und Permeabilisierung ist intrazellulären Epitope erkennen Antigene können abgerufen werden durch Kochen in den Abschnitten in 0,01 Mol Harnstoff nach der Fixierung von Paraformaldehyd. - In den Abschnitten in Kultur 24-Well-Platten mit 0,01 Mol Harnstoff und diese Platten in einem Mikrowellenherd. Kochen Sie in den Abschnitten drei Mal für ca. 10 s jeweils für insgesamt 30 s.
Hinweis: Seien Sie sehr vorsichtig, wie kochendes kann die Lösung erzwingen, dass die Abschnitte aus dem Brunnen. In diesem Fall verwenden Sie einen Pinsel in den Abschnitten von den Seiten der Kammer Gewebe oder aus dem Deckel der Platte in den Boden der Kammer entsprechende Gewebe zurückzudrängen. - Vor, die Sekundärantikörper Inkubation, permeabilize und blockieren die Gewebeschnitte von brüten sie in blockierende Lösung mit PBS-H, 0,3 % Waschmittel (PBS-H-T) und 2 % NGS auf einer Wippe für 1 h bei 4 ° c führen nachfolgende Antikörper Inkubationen mit PBS-H-T/2% NGS.
- Für die sekundäre Inkubation, die Abschnitte in den Gewebe-Kammern an Brunnen mit Kaninchen Anti-FITC Antikörper verdünnt 1: 10.000 in PBS-H-T/2% NGS übertragen. Über Nacht inkubieren.
- Perform Gegenfärbung mit Maus Anti-CD20-Antikörper verdünnt 1: 200 in PBS-H-T/2% NGS. Für diese Option Abrufen der Epitope bei Bedarf, die Zellen zu durchdringen und vor diese Inkubation zu blockieren, wie oben beschrieben.
3. 3. Tag: Tertiäre Inkubation
- nach der zweiten Inkubation, waschen Sie die Abschnitte dreimal in PBS-H bei 4 ° C für mindestens 20 min.
- Durchführen eine endgültigen Inkubation mit dem entsprechenden Eindringmittel beschriftet Antikörper (z. B. Ziege Anti-Kaninchen konjugiert grüngelb, Ziege Anti-Ratte konjugierten viel roten Farbstoff und Ziege Anti-Maus konjugierten grünen Farbstoff Antikörper verdünnt 1:5 000, 1:5, 000 und 1:2, 000, bzw. in PBS-H-T/2% NGS). Über Nacht inkubieren.
Hinweis: an dieser Stelle kann die Inkubationszeit bis zu drei Tage lang bei Bedarf erweitert werden. Halten Sie die Abschnitte vor Licht geschützt werden, indem man die Platten in Alufolie während dieser incuBallungsraum Schritt und danach jeweils Licht Fluorophore stillt.
4. Tag 4: Montage der Abschnitte
- waschen in den Abschnitten drei Mal im PBS-H für mindestens 20 min.
Hinweis: Wenn nachgeschaltete ISH 19 planen, befestigen Sie die Abschnitte in 4 % Paraformaldehyd für 1 h Tetramers und Antikörpern im Ort zu sichern und dann waschen Sie die Abschnitte zweimal mit PBS-H 5 min.
Achtung: Paraformaldehyd ist giftig; Tragen geeigneten persönlichen Schutzausrüstung. - Verwenden Sie einen Pinsel in den Abschnitten auf einen Objektträger übertragen. Achten Sie darauf, dass Sie nicht zu viel Gewebe zu stecken. Bestreichen Sie jeden Abschnitt mit Glycerol/Gelatine, 4 mg/mL n-Propyl Gallat oder ein anderes Eindeckmittel mit einem Fluorophor Konservierungsmittel enthalten. Decken Sie mit einem Deckgläschen.
- Speichern die Folien in einem lichtgeschützt Folie Behälter bei-20 ° c spülen die Gewebekultur-Platten und entfernen Sie die Etiketten auf den Deckeln mit Alkohol.
Hinweis: Die Platten können wiederverwendet werden.
5. Erwerb von Confocal Mikroskop-Bilder
- Capture hochauflösende Bilder mit einem konfokalen Mikroskop, mit dem entsprechenden Laser und Filter für jede Fluorophor ( Abbildung 1A und B).
Hinweis: In diesem Beispiel ein confocal Mikroskop (siehe die Tabelle der Materialien) diente. Bilder wurden gesammelt mit dem 561 nm Laser bei 20 % Leistung für die grünlichen gelb beschriftet antigenspezifischen T-Zellen, der 488 nm Laser bei 10 % Leistung für Grün beschriftet B CD20 exprimierenden Zellen und 640 nm-Laser bei 15 % Leistung für CD8 T-Zellen weit rot gekennzeichnet. 20 X Objektiv und einer numerischen Apertur von 0,8 dienten. - Sammeln sequenziell Z-Serie auf 3 µm (oder andere) Abständen in den drei Kanälen in mehreren Feldern 800 x 800 Pixel. Erstellen Sie eine Montage aus den erfassten Bereichen ( Abbildung 1 -E). Jede Montage Bild basierend auf den Informationen der entsprechenden Folie benennen und speichern Sie für die Analyse.
- Führen quantitative Bildanalyse mithilfe der jeweiligen confocal Mikroskop Analyse und Quantifizierung Software oder ImageJ.
6. Quantitative Bildanalyse
Hinweis: Quantitative Bildanalyse mit confocal Mikroskop Analyse und Quantifizierung Software erreicht werden kann oder mittels ImageJ-Software. Hier, ImageJ diente als Beispiel.
- Open a konfokale Montage durch Ziehen an den ImageJ-Fenster ( Abbildung 2A).
Hinweis: ImageJ kann direkt öffnen, Montagen von vielen verschiedenen konfokalen Mikroskopen gesammelt. Wenn die Montage von ImageJ direkt geöffnet werden kann, exportieren die ausgewählten Z-Scan als TIFF-Datei zu öffnen Sie it. - Den ausgewählten Z-Scan für die Analyse zu duplizieren (" Bild "-> " doppelte ") ( Abb. 2 b).
- Die verschiedenen Kanäle aufgeteilt (" Bild "-> " Farbe "-> " Kanäle teilen ") ( Abbildung 2).
- Zeichnen den ROI für die Quantitative Analyse in der entsprechende Kanal sein Ziel und Hinzufügen des ROI-Managers durch Drücken " T " auf der Tastatur. Messen Sie den Bereich.
Hinweis: Die ROI-Manager von ImageJ zeigt das Gebiet in µm 2 ( Abb. 2D). - Fluoreszenz Helligkeit und Kontrast des Kanals zu analysierenden anpassen (" Bild "-> " Adjust "-> " Helligkeit/Kontrast ") ( Abb. 2E).
- Glätten den ROI auf das Bild (" ROI-Manager "-> " Flatten ") ( Abb. 2F).
- Quantifizieren die positive Zellen in das Bild mit der " multi-Point " Tool ( Abbildung 2).
Ergebnisse
Abbildung 1 veranschaulicht die konfokale Bilder mit einem konfokalen Mikroskop zu sammeln. Abbildung 2 veranschaulicht quantitative Bildanalyse mit ImageJ. Abbildungen 3 und 4 zeigen Vertreter, dass Bilder von Lymphknoten Gewebe aus einem SIV Rhesus-Makaken gebeizt mit MHC Tetramers, CD8-Antikörper und CD20-Antikörper infiziert, und dienen dazu, die Spezifität der MHC-Tetramer Färbung zeigen. Abbildung 3 vergleicht MHC Klasse I Tetramers geladen mit einem Peptid von SIV im Vergleich zu Abschnitten aus dem gleichen Gewebe gebeizt mit MHC-Klasse ich Tetramers mit einem irrelevant Peptid geladen. Abbildung 4 zeigt, dass Zellen befleckt mit SIV/MHC-Peptid-Tetramer Co gebeizt mit CD8 Antikörper, aber nicht CD20-Antikörper, die B-Zellen zu beflecken. Abbildung 5 zeigt ein Beispiel für eine Montage aus mehreren konfokale Z-Serie-Feldern, die zur Quantifizierung der gefärbten Zellen mit bestimmten Phänotypen in verschiedenen anatomischen Kompartimente auf den Lymphknoten Tetramer erstellt. Die Erweiterung zeigt eine Fläche von Lymphknoten mit ein B-Zell-Follikel abgegrenzt von CD20 Färbung und umliegenden T-Zell-Zone, MHC-Tetramer-gefärbten Zellen erkannt werden können, von denen einige Ki67 Co express ist ein Marker für T-Zell-Aktivierung und Proliferation. Diese Färbung Kombination erlaubt die Bestimmung des Phänotyps von SIV-spezifische CD8 T-Zellen innerhalb und außerhalb von B-Zell-Follikel, in Beziehung zu SIV-spezifische CD8 T-Zellen und anderen Ki67 mit dem Ausdruck ihrer Zellen und B-Zellen.

Abbildung 1: Vertreter Screenshots zeigen, wie konfokale Bilder mit einem konfokalen Mikroskop sammeln. (A) Erwerb Modus verwendet, um die konfokale Bilder zu sammeln. (B) Kanäle für Bildsammlung verwendet. (C) 20 X Objektiv und 800 x 800 Pixel, die Felder in Bildsammlung verwendet wurden. (D) eine sequenzielle Z-Stack wurde in 3 µm Intervallen gesammelt. (E) Fliesen wurden angenommen, um abzugrenzen und Bilder in mehreren Bereichen zu sammeln. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Vertreter Screenshots zeigen Quantitative Bildanalyse mit ImageJ. (A) eine konfokale Montage durch Ziehen an den ImageJ-Fenster geöffnet. (B) Duplikat der ausgewählten Z-Scan für die Analyse. (C) unterteilt die verschiedenen Kanäle. (D) zeichnen den ROI für die Quantitative Analyse in der entsprechende Kanal sein Ziel und Hinzufügen des ROI-Managers durch Drücken der Taste "t". (E) passen Sie die Fluoreszenz-Helligkeit und Kontrast des Kanals analysiert werden. (F) Abflachen der ROI auf das Bild. (G) die Anzahl die positiven in das Bild Zellen. Bitte klicken Sie hier für eine größere Version dieser Figur.
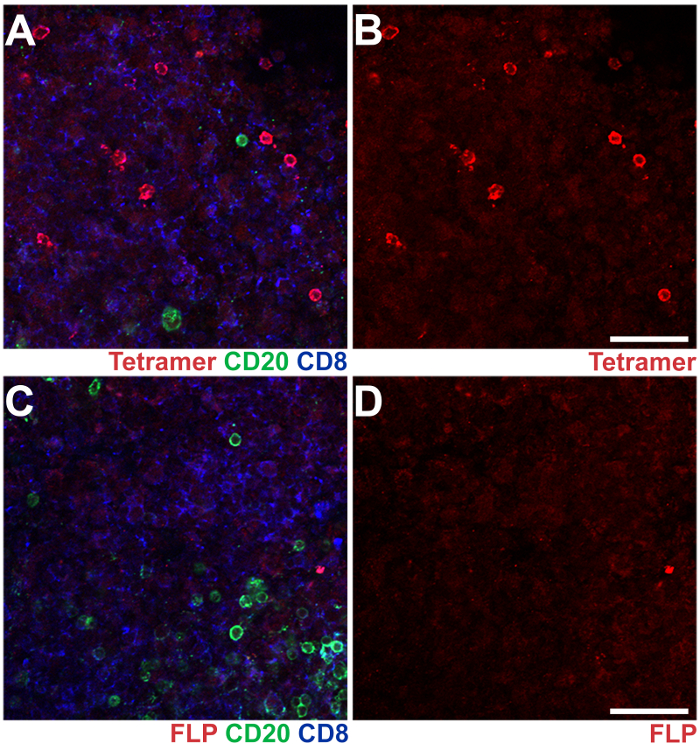
Abbildung 3 : IST in Kombination mit IHC in axillären Lymphknoten Abschnitte aus einem SIV-infizierten Rhesus-Makaken. Mamu - A * 02 Tetramers geladen mit SIV Nef YY9 Peptide wurden verwendet, um die Antigen-spezifische CD8 T-Zellen zu beflecken, und ähnliche Tetramers geladen mit einer irrelevant FLP-Peptid aus dem Hepatitis B-Virus dienten als Negativkontrolle (rot). Maus Anti-CD20-Antikörper wurden verwendet, um CD20 Fleck+ B-Zellen (grün) und Ratte Anti-CD8 Antikörper wurden verwendet, um CD8 Fleck+ T-Zellen (blau). (A) A repräsentatives Bild aus axillären Lymphknoten gebeizt mit YY9 Tetramers CD20 und CD8 Antikörper. (B) das gleiche Bild wie auf Tafel eine zeigt die YY9 Tetramer alleine färben. (C) repräsentatives Bild eines Abschnitts aus der gleichen axillären Lymphknoten, befleckt mit FLP Tetramers und CD8-CD20-Antikörper. (D) das gleiche Bild wie in Feld C mit dem FLP-Tetramer Fleck alleine. Skalieren von Balken = 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
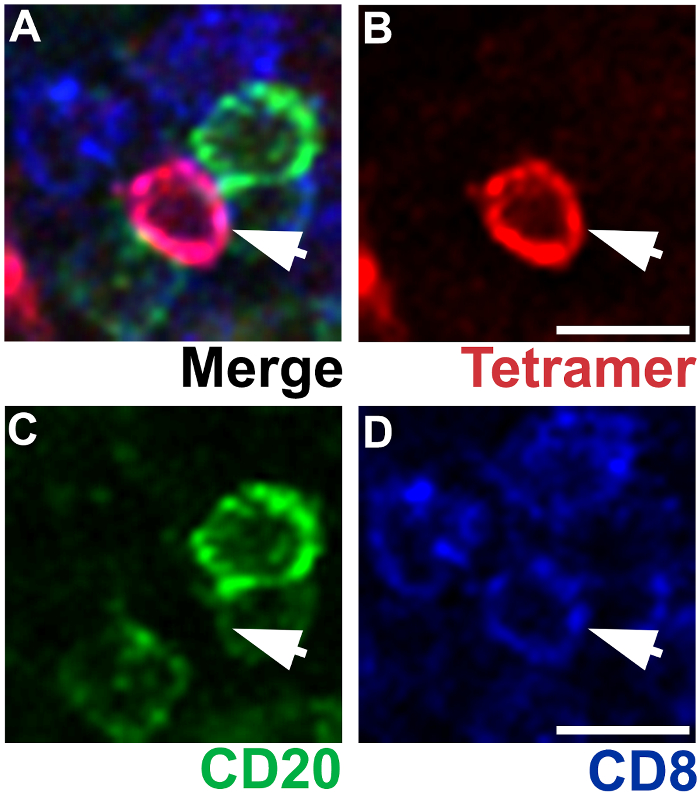
Abbildung 4 : IST in Kombination mit IHC zeigt die Besonderheit des MHC-Tetramer beflecken. Repräsentative axillären Lymphknoten Abschnitt gebeizt mit Mamu - A * 02 Tetramers geladen mit Nef YY9 Peptide, Ratte Anti-CD8 Antikörper gegen Label CD8 T-Zellen (blau) (A Label SIV-spezifische CD8 T-Zellen (rot) und Maus Anti-CD20-Antikörper zur Bezeichnung B-Zellen (grün) ). Eine SIV-spezifische CD8 T-Zellen ist Tetramer + (B), CD20– (C) und CD8+ (D). Skalieren von Balken = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
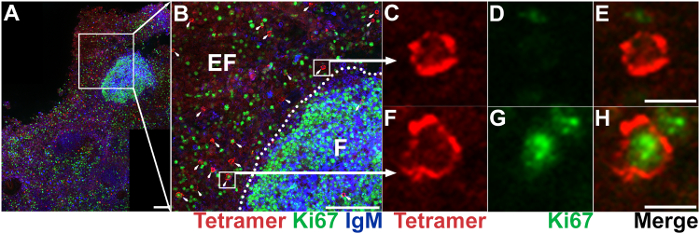
Abbildung 5: IST in Kombination mit IHC, die Lage, die Fülle und den Phänotyp der Antigen-spezifische CD8-T-Zellen zeigen. (A) repräsentative axillären Lymphknoten Abschnitt gebeizt mit Mamu - A * 02 Tetramers geladen mit Nef YY9 Peptide, SIV-spezifische CD8 T-Zellen (rot), Ki67 Antikörper gegen wuchernde Zellen (grün) beschriften und IgM-Antikörper auf Label B-Zellen (blau) zu kennzeichnen. Maßstabsleiste = 100 µm. (B) Erweiterung eines ausgewählten Bereichs in Panel A. IgM Färbung legt die follikulären, gekennzeichnet als "F"; der extrafollicular Bereich ist gekennzeichnet als "EF." Tetramer+ Zellen sind mit Pfeilen gekennzeichnet. Maßstabsleiste = 100 µm. repräsentative Tetramer+ Ki67– Zelle (C, D, E) und Tetramer+ Ki67+ Zelle (F, G, H). Maßstabsleiste = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
IST in Kombination mit IHC stellt ein wesentliches Instrument für die Erkennung, Charakterisierung und Quantifizierung der Antigen-spezifische CD8 T-Zellen in nativen Umgebungen mit dem Kontext von anderen Zellen und Gewebestrukturen. Hier beschrieben wir detaillierte Verfahren für IST kombiniert mit IHC, gefolgt von quantitativen Bildanalyse zu bestimmen, die Lage, die Fülle und den Phänotyp der Antigen-spezifische CD8 T-Zellen in den Lymphknoten von Rhesus-Makaken. Ähnliche Färbung kann für Mensch, Maus oder andere Arten Gewebe für die MHC-ich Tetramers stehen zur Verfügung. Darüber hinaus kann Peptid-MHC-Klasse-II-Tetramer oder Dextramer Färbung durchgeführt werden mit relativ ähnlichen Methoden um zu beschriften Sie Antigen-spezifischen CD4-T-Zellen im Gewebe4,5,6,7, 8 , 9 , 10 , 11 , 12 , 13. IST auch kombinierbar mit ISH zu bestimmen, z. B. in-Vivo -Effektor-Ziel-Zelle Ebenen18,19. In Zukunft wird es interessant IST/IHC weiter durchzuführen, durch die Kombination von IST/IHC mit fortgeschrittenen in Situ RNA und DNA-Nachweis Methoden sein. Jüngste Fortschritte in der in Situ Hybridisierung Tests umfassen die Entwicklung von RNAscope und DNAscope24. Diese Techniken ermöglichen die Erkennung der Ziel-RNA und DNA im Gewebe. Es wird spannend, diese Methoden kombinieren mit IST und IHC gleichzeitig erkennen Virus-spezifische CD8-T-Zellen, virale RNA, virale DNA und mit der Bezeichnung der Antikörper Antigene von Interesse sein.
Während wir ursprünglich IST Methoden mit frischem Gewebe, Gewebe beschrieben, die für eine kurze Dauer und gefrorenes Gewebe4, in den letzten Jahren behoben wurden haben wir ausschließlich frische Gewebeschnitte verwendet, da sie konsequent die qualitativ hochwertigsten Flecken produzieren und ermöglichen die Untersuchung der Zellen in dicken Gewebeschnitten. Als Alternative zu den Verfahren hier vorgestellt, eine kann Gewebe Tetramers zuweisen, Inkubation über Nacht zu beheben, einbetten und Tiefgefrieren in eisigen Medium (z. B. OCT), dünne Gefrierschnitte zu produzieren, und führen Sie IHC später22. Ebenso wir routinemäßig Fleck eine Teilmenge der Gewebeschnitte mit Tetramers allein und dann einfrieren in den Abschnitten im OAT, um zusätzliche Gegenfärbung Kombinationen in der Zukunft zu ermöglichen. Darüber hinaus kann Qdot 655 konjugiert Peptid-MHC-Multimere zur antigenspezifischen T-Zellen in kryokonservierten Gewebe Abschnitte13direkt sichtbar zu machen.
Wir haben hier beschriebenen indirekten Tetramer Färbung. Direkte Färbung mit APC oder PE-konjugiert Tetramers auch nachweislich,4,22zu arbeiten. In diesem Fall ist die Konzentration des MHC Tetramer erforderlich höher wie in der indirekten Tetramer Färbung. In unseren Händen wurde eine Konzentration von 20 µg/mL mit der Bezeichnung von APC Tetramer effektiv bei der Erkennung von Antigen-spezifischen Zellen. Allerdings war die Intensität der Färbung viel niedriger als der indirekte Etikettierung, die Verstärkung mit Anti-FITC Antikörper enthält.
Wir fanden, dass die Verwendung von ein Kompressions-basierte Mikrotom (siehe die Tabelle der Materialien) für frische Gewebe Schneiden erleichtert den Prozess des Schneidens frische Gewebeschnitte als im Vergleich zur Verwendung einer vibrierenden Mikrotom-23. Jedoch kann in Fällen, in denen ein Kompressions-basierte Mikrotom nicht verfügbar ist, eine vibrierende Mikrotom oder Skalpell für frische Gewebe Schneiden verwendet werden.
Eine große Einschränkung dieser Technik ist die Verwendung von frischen Geweben. Mit frischem Gewebe ist viel schwieriger als feste oder gefrorenes Gewebe, weil sie sofortige Aufmerksamkeit und Verarbeitung erfordern. Wir haben erfolgreich versendet, frisches Gewebe über Nacht auf dem Eis in Gewebekultur Mittel "oder" PBS-H. Jedoch gab es gelegentlich Probleme mit Versand; Schneestürme haben z. B. die Lieferung von Geweben für 48 h oder mehr verzögert. In diesen Fällen fanden wir, dass frische Gewebe geschnitten und die in der Regel 48 h nach Extraktion gebeizt zeigen spezifische Färbung mit Anzeichen für eine Verschlechterung der Gewebe; Gewebe gebeizt 72 h nach Extraktion sind auch zum Färben geschädigt. Wir fanden, dass auch die Lieferung von frischem Gewebe mit Eisblöcke, die zu kalt oder zu nah an, dass das Gewebe während des Transports der Gewebe einfrieren können; dieses Einfrieren zerstört in der Regel das Gewebe zum Färben. Daher ist es äußerst wichtig, frisches Gewebe gekühlt, aber nicht gefroren zu versenden und zu initiieren IST innerhalb von 24 h frische Gewebe Verarbeitung auch Färbung erfordert ein hohes Maß der Schüler und Mitarbeiter Zeit, als Gewebe aus mehreren Tieren oder Studienteilnehmer lässt sich nicht gesammelt und zusammen zu einem späteren Zeitpunkt gefärbt. Trotz dieser Schwierigkeiten finden wir, dass frische Gewebeschnitte die beste Wahl für schöne, spezielle IST/IHC beflecken sind.
Eine weitere Einschränkung der hier beschriebene IST/IHC-Methode ist die indirekte Färbung Ansatz. Aufgrund von Einschränkungen für die Anzahl der unterschiedlichen Tierarten zur Sekundärantikörper Kombinationen erzeugen sind wir durch indirekte Antikörper Färbung Methoden, um nur drei oder vier fluoreszierende Antikörper Färbung Kombinationen zu einem Zeitpunkt begrenzt. Dies schränkt die Menge der Informationen, die auf eine Gewebe-Tafel gesammelt werden kann. Direkte IHC beflecken überwindet diese Einschränkung und kann erweitern die Fähigkeiten, Erkennung von acht oder mehr Antigene Antikörper markiert gleichzeitig, wenn auch mit jeder Antikörper-produzierenden eine viel schwächere Fluoreszenzsignal im Vergleich zur indirekten Methoden. Dadurch könnte indirekte IHC als Alternative zur indirekten IHC einsetzbar für Gegenfärbung IST gefärbten Geweben ermöglicht den Nachweis einer erhöhten Zahl von zellulären Antigene in Kombination mit den IST-Nachweis von Antigen-spezifischen CD8 T-Zellen.
In einigen Fällen kann erhebliche Autofluoreszenz und/oder unspezifischen Tetramer oder Antikörper-Bindung mit IST/ISH auftreten. Aus diesem Grund sind gute positive und negative Kontrollen notwendig, um bestimmte Flecken von Hintergrund und Autofluorescent Färbung zu erkennen. Gute negativ steuert für MHC Tetramers gehören Negativkontrolle Gewebe (z. B. nicht infizierten Gewebe, Gewebe gebeizt mit MHC ich Tetramers geladen mit irrelevanten Peptide oder irrelevant MHC-Tetramers; oder im Notfall Gewebe befleckt mit Nein Tetramers aber mit Verstärkung Antikörper).
Zusammenfassend lässt sich sagen ist MHC I IST in Kombination mit IHC ein wertvolles Instrument zur Bestimmung der Lage, Fülle und Phänotyp der Antigen-spezifische CD8 T-Zellen in den Geweben. Diese Methodik ermöglicht für den Nachweis von Antigen-spezifischen CD8 T-Zellen in nativen Umgebungen, mit der relativen Lokalisierung zu anderen Zelltypen und Gewebestrukturen beibehalten. Diese Methode ist breit anwendbar, da es verwendet werden kann, zu lokalisieren, Phänotyp, und im wesentlichen Antigen-spezifische CD8 T-Zellen für welche MHC Tetramers in jedem Gewebe vorliegen, zu quantifizieren.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde unterstützt von Public Health Service Zuschüsse aus dem National Institutes of Health (T32 DA007097, R01AI096966, andUM1AI26617).
Materialien
| Name | Company | Catalog Number | Comments |
| MHC-I monomer | NIH tetramer core facility | Materials for MHC-tetramer preparation | |
| ExtrAvidin-FITC | Sigma-Aldrich | E2716 | Materials for MHC-tetramer preparation |
| Normal goat serum | Jackson Immunoresearch | 005-000-121 | |
| Low melt agarose | Promega | V3121 | |
| Heparin | Sigma-Aldrich | SLBL6391V | |
| Triton X-100 | Sigma-Aldrich | T-6878 | |
| Urea | J.T.Baker | 4204-05 | |
| Glycerol gelatin | Sigma-Aldrich | SLBH2672V | |
| n-propyl gallate | Sigma-Aldrich | P3130 | |
| rat-a-h-CD8 (1:500) | Acris | 0714 | Antibody unstable, use single use frozen aliquot |
| m-a-h-CD20 (1:500) | NOVOCASTRA | 6026819 | |
| m-a-h-Ki67 (1:500) | Vector | 6022201 | |
| goat-a-m-A488 (1:2,000) | Jackson Immunoresearch | 124083 | |
| goat-a-rb-Cy3 (1:5,000) | Jackson Immunoresearch | 106232 | |
| goat-a-rat-Cy5 (1:5,000) | Jackson Immunoresearch | 118088 | |
| goat-a-h-IgM-Dylight649 (1:5,000) | Jackson Immunoresearch | 86579 | |
| Compresstome: VF-300 Microtome | Precisionary Instruments, LLC | 1079 | |
| Quick Set Instant Adhesive | Loctite | 46551 | |
| 24-well flat bottomed tissue culture plates | Falcon | 353226 | |
| Microscope slide | Globe scienfitic Inc. | #1321 | |
| Razor blade | Ted Pella, Inc | 121-6 | |
| Feather Disposable Scalpel | FEATHER SAFETY RAZOR CO. LTD. | No. 21 | |
| Round paintbrush #2 | PRINCETON ART & BRUSH CO. | 4350R | Can trim as needed with razor |
| Confocal Microscope | Olympus | FV1000 | |
| FV10-ASW_Viewer4.0 | Olympus |
Referenzen
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Novak, E. J., Liu, A. W., Nepom, G. T., Kwok, W. W. MHC Class II tetramers identify peptide-specific human CD4(+) T cells proliferating in response to influenza A antigen. J Clin Invest. 104, R63-R67 (1999).
- Steinert, E. M., et al. Quantifying memory CD8 T cells reveals regionalization of immunosurveillance. Cell. 161 (4), 737-749 (2015).
- Skinner, P. J., Daniels, M. A., Schmidt, C. S., Jameson, S. C., Haase, A. T. Cutting edge: In situ tetramer staining of antigen-specific T cells in tissues. J Immunol. 165 (2), 613-617 (2000).
- Haanen, J. B., et al. In situ detection of virus- and tumor-specific T-cell immunity. Nat Med. 6 (9), 1056-1060 (2000).
- Skinner, P. J., Haase, A. T. In situ tetramer staining using MHC class I tetramers. J Immunol Methods. 268 (1), 29-34 (2002).
- Skinner, P. J., Haase, A. T. In situ staining using MHC class I tetramers. Curr Protoc Immunol. 17, 4.1-4.9 (2004).
- Li, Y., et al. Use of HLA-DR*08032/E7 and HLA-DR*0818/E7 tetramers in tracking of epitope-specific CD4+ T cells in active and convalescent tuberculosis patients compared with control donors. Immunobiology. 216, 947-960 (2011).
- Bischof, F., et al. Analysis of autoreactive CD4 T cells in experimental autoimmune encephalomyelitis after primary and secondary challenge using MHC class II tetramers. J Immunol. 172, 2878-2884 (2004).
- Massilamany, C., et al. Direct staining with major histocompatibility complex class II dextramers permits detection of antigen-specific, autoreactive CD4 T cells in situ. PLoS ONE. 9, e87519(2014).
- Massilamany, C., et al. In situ detection of autoreactive CD4 T cells in brain and heart using major histocompatibility complex class II dextramers. J Vis Exp. (90), e51679(2014).
- Dileepan, T., Kim, H. O., Cleary, P. P., Skinner, P. J. In Situ Peptide-MHC-II Tetramer Staining of Antigen-Specific CD4+ T Cells in Tissues. PLoS ONE. 10 (6), e0128862(2015).
- Tjernlund, A., et al. In situ detection of Gag-specific CD8+ cells in the GI tract of SIV infected Rhesus macaques. Retrovirology. 7, 7-12 (2010).
- Connick, E., et al. CTL fail to accumulate at sites of HIV-1 replication in lymphoid tissue. J Immunol. 178, 6975-6983 (2007).
- Hong, J. J., et al. Localized Populations of CD8low/− MHC Class I Tetramer+ SIV-Specific T Cells in Lymphoid Follicles and Genital Epithelium. PLoS ONE. 4 (1), e4131(2009).
- Sasikala-Appukuttan, A. K., et al. Location and dynamics of the immunodominant CD8 T cell response to SIVΔnef immunization and SIVmac251 vaginal challenge. PLoS ONE. 8 (12), e81623(2013).
- Connick, E., et al. Compartmentalization of simian immunodeficiency virus replication within secondary lymphoid tissues of rhesus macaques is linked to disease stage and inversely related to localization of virus-specific CTL. J Immunol. 193, 5613-5625 (2014).
- Li, Q., et al. Visualizing antigen-specific and infected cells in situ predicts outcomes in early viral infection. Science. 323, 1726-1729 (2009).
- Li, Q., Skinner, P. J., Duan, L., Haase, A. T. A technique to simultaneously visualize virus-specific CD8+ T cells and virus-infected cells in situ. J Vis Exp. (30), e1561(2009).
- Li, S., et al. Simian immunodeficiency virus-producing cells in follicles are partially suppressed by CD8+ cells in vivo. J Virol. 90, 11168-11180 (2016).
- Daniels, M. A., Jameson, S. C. Critical role for CD8 in T cell receptor binding and activation by peptide/major histocompatibility complex multimers. J Exp Med. 191, 335-346 (2000).
- Lee, Y. J., Wang, H., Starrett, G. J., Phuong, V., Jameson, S. C., Hogquist, K. A. Tissue specific distribution of iNKT cells impacts their cytokine response. Immunity. 43 (3), 566-578 (2015).
- Abdelaal, H. M., Kim, H. O., Wagstaff, R., Sawahata, R., Southern, P. J., Skinner, P. J. Comparison of Vibratome and Compresstome sectioning of fresh primate lymphoid and genital tissues for in situ MHC-tetramer and immunofluorescence staining. Biol Proced Online. 17, (2015).
- Wang, F., et al. RNAscope: a novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. J Mol Diagn. 14 (1), 22-29 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten