Method Article
Destrano migliora l'efficienza di trasduzione lentivirale di cellule NK primarie Murine ed umane
In questo articolo
Riepilogo
L'obiettivo di questo studio era quello di formulare le tecnologie che permettono per la trasduzione del gene successo in primarie cellule natural killer (NK). La trasduzione lentivirale destrano-mediata di umani o risultati primari di cellule NK del mouse in una maggiore efficienza di espressione genica. Questo metodo di trasduzione del gene migliorerà notevolmente la manipolazione genetica delle cellule NK.
Abstract
La trasduzione efficiente di specifici geni in cellule natural killer (NK) è stata una sfida importante. Trasduzioni successo sono fondamentali per definire il ruolo del gene di interesse per lo sviluppo, la differenziazione e la funzione delle cellule NK. Gli avanzamenti recenti legati ai recettori chimerici antigene (automobili) nell'immunoterapia del cancro accentuano la necessità di un metodo efficiente trasportare geni esogeni di linfociti effettori. Le efficienze di trasduzioni lentivirali-mediata del gene in primari umani o cellule NK del mouse rimangano significativamente basse, che è un importante fattore limitante. Gli avanzamenti recenti utilizzando polimeri cationici, quali polybrene, mostrano un'efficienza di trasduzione migliorata gene in cellule di T. Tuttavia, questi prodotti non è riuscito a migliorare l'efficienza di trasduzione delle cellule NK. Questo lavoro mostra che destrano, un polisaccaride ramificato glucano, migliora notevolmente l'efficienza di trasduzione dell'essere umano e cellule NK primarie del topo. Questa metodologia di trasduzione altamente riproducibili fornisce uno strumento competente per trasdurre umano primarie cellule NK, che possono migliorare notevolmente le applicazioni cliniche gene consegna e così immunoterapia dei tumori basati su cellule NK.
Introduzione
Cellule natural killer (NK) sono la popolazione linfocitaria principale del sistema immunitario innato1. Le cellule NK funzionano come i difensori di prima linea della risposta immunitaria contro i tumori e infezioni2,3,4. Le cellule NK svolgono un ruolo centrale nello sviluppo di tolleranza attraverso la secrezione di potenti citochine e chemochine5. Grazie alla loro potente capacità di mirare ed eliminare le cellule tumorali, test clinici multipli vengono condotte per valutare donatore-derivati di cellule NK umane come un'immunoterapia adottiva per cancro6,7. Contrariamente alle cellule di T, la biologia dello sviluppo delle cellule di NK ha ancora essere ben caratterizzati8. Questa mancanza di conoscenza è parzialmente dovuto alla mancanza di tecniche efficienti che consegnare i geni di interesse al mouse o cellule NK primarie. Per questi motivi, la maggior parte delle cellule NK studi condotti in linee cellulari, piuttosto che in cellule primarie. Pertanto, la necessità di un protocollo affidabile ed efficiente di trasdurre primarie cellule NK con geni di interesse è fondamentale.
L'obiettivo generale di questo studio era di formulare un metodo coerente e affidabile con cui le cellule NK umane o murine primarie potrebbero essere trasdotte con lenti - o retrovirus.
Sono stati effettuati studi precedenti che hanno tentato di risolvere questo problema, in gran parte utilizzando la trasformazione transitoria primarie delle cellule di NK. Questo include il plasmide transfezione9,10, Virus di Epstein - Barr (EBV) / ibrido retroviral vector11, vaccinia virus file vettoriale12,13e Ad5/F35 vettori adenovirali chimerico14. Nonostante la modesta efficienza di queste tecniche, la natura transitoria della trasduzione li rende inadatti per l'utilizzo a lungo termine delle cellule NK geneticamente modificate. Alcuni studi recenti hanno utilizzato vettori retrovirali trasduce le cellule NK, che richiedono più cicli di infezione per raggiungere un livello accettabile di espressione genica11,15. In contrasto con vettori retrovirali, vettori lentivirali possono utilizzare macchinari di importazione nucleare cellula ospite per il complesso di pre-integrazione virale di traslocano nel nucleo. Si tratta di un importante fattore limitante nella replicazione del virus nelle cellule di divisione, che comprendono le cellule NK primarie.
Interazioni tra diversi recettori della superficie cellulare e particelle virali consentono l'assorbimento virale nella cellula. L'iniziali impegni fra le proteine dell'envelope virale ed i loro ricevitori cognate host potrebbero essere limitati a causa del potenziale cariche negative esistenti tra questi due. La spiegazione razionale dietro molte tecniche di trasduzione è che l'aggiunta di polimeri cationici, quali polybrene (Pb), solfato di protamina (PS) o destrano, potrebbe dare una carica positiva per i recettori della superficie cellulare e quindi aumentare l'associazione dell'envelope virale proteine. Ciò aumenterà l'efficienza di fusione e l'assorbimento delle particelle virali dai cellule16. Anche se è stato segnalato che Pb o PS può migliorare il trasferimento genico in cellule T17, loro applicazione non ha alcun effetto dell'efficienza di trasduzione delle cellule NK primarie. Inoltre, non è stata eseguita un'analisi comparativa tra questi reagenti utilizzando cellule NK primarie. In questo studio, sono state confrontate le efficienze di trasduzione dei tre polimeri cationici. I risultati mostrano che, tra questi tre polimeri cationici, solo destrano migliora significativamente efficiente trasduzione virale in cellule NK primarie sia il mouse.
Protocollo
Tutti i protocolli degli animali ha seguito il trattamento umano ed etico degli animali e sono stati approvati dal istituzionale Animal Care e uso Committee (IACUC) all'interno di centro di ricerca biomedica (BRC) del Medical College of Wisconsin (MCW), Milwaukee, WI. L'uso delle cellule mononucleari del sangue periferico umano (PBMC) è stato approvato da istituzionale Review Board (IRB) dell'Istituto di ricerca sangue sangue centro di Wisconsin, Milwaukee, WI.
1. topi, linee cellulari e vettori
- Ottenere topi C57BL/6 dai fornitori commerciali. Mantenere le colonie del mouse in condizioni esenti da patogeni e utilizzare topi femminili e maschi fra le età di 6 e 12 settimane. Ottenere PBMCs umano de-identificata da fonti approvato IRB.
- Anestetizzare gli animali con una miscela di 20-30% v/v isoflurane in propilene glicole (1, 2-propandiolo, grado di USP) per anestetizzare i topi. Applicare unguento veterinario agli occhi per prevenire la secchezza mentre i topi sono sotto anestesia.
- Per l'eutanasia degli animali, eseguire dislocazione cervicale dopo l'induzione dell'anestesia.
- Trattenga i topi afferrando saldamente la base della coda con una mano. Posizionare una robusto bastone-tipo penna o il pollice e l'indice di altra mano contro la parte posteriore del collo, alla base del cranio.
- Per produrre la dislocazione, spingere la mano trattenente la testa dell'animale in avanti e spinta verso il basso mentre si tira indietro con la mano che tiene la coda base. Verificare l'efficacia della dislocazione di sensibilità per una separazione del tessuto cervicale.
- Tenere gli animali in camera/gabbia per almeno 5 min e rimuoverli solo quando l'attività respiratoria è assente o quando c'è una mancanza di un battito rilevabile.
- Ottenere cellule K562 e YAC-1 dai fornitori commerciali e mantenerli in RPMI1640 mezzo contenente 10% FBS inattivati al calore. Prova queste linee cellulari periodicamente per escludere la possibilità di contaminazione del micoplasma.
2. preparazione e titolazione di vettori lentivirali
- 5 × 106 293T cellule durante la notte in una boccetta di2 cm T75 contenente una soluzione di 20 mL di terreno di RPMI1640 con 10% FBS, 100 U/mL di penicillina, 100 µ g/mL di streptomicina, piruvato di sodio di 1 mM, 5% di soluzione di bicarbonato di sodio 7,5% e 0,001% Β-mercaptoetanolo. Collocare la beuta in un incubatore a 37 ° C infuso con 5,2% CO2.
- Raccogliere le cellule 293T usando tripsina (0.025%)/EDTA (1 mM) in tampone fosfato salino (PBS). Aggiungere 5 mL di tripsina/EDTA in PBS e incubare le beute per 10 min in un 37 ° C un'incubatrice per consentire il distacco delle cellule 293T dai palloni T75 cm2 .
- Raccogliere le cellule indipendenti e lavare due volte in PBS per rimuovere eventuali tracce di tripsina ed EDTA. Contare le celle con un emocitometro e regolare il numero di cellulare per 1 milione di cellule per mL.
- Transfect 293T cellule18 con 3.95 µ g di psPAX2, 1,32 µ g di pMD2G e 5,26 µ g di pLEP-GFP-Puro (generato internamente in BRI clonando promotore di EF1alpha da pWPI al posto di un promotore di CMV in pLenti CMV-GFP-Puro)19.
- Preparare 1 mL di NaCl 150 mM con 63 µ l di 0,6 mg/mL polyethylenimine (PEI; 25.000 kD, lineare). Mescolare bene e poi aggiungere i plasmidi e mescolare. Incubare per 20 minuti a temperatura ambiente e poi aggiungerlo alle cellule.
- Post-transfezione 16 h, sostituire il mezzo di transfezione con medium fresco più butirrato di sodio 4,5 mM. Raccogliere il supernatante contenente virus 48h post-di transfezione e concentrato mediante centrifugazione durante la notte a 5.000 × g. Vedere la tabella materiali.
- Determinare i titoli virali utilizzando cellule 293T effettuando diluizioni seriali e di analisi di flusso cytometry 72 h post-traduzionali20. Utilizzare l'espressione della proteina fluorescente verde (GFP) come misura per quantificare i titoli virali.
3. purificazione e l'espansione delle cellule NK primarie murine
- Purificare murino primario di cellule NK21. Passare brevemente, sospensioni unicellulari milza attraverso colonne di lana di nylon per vuotare le popolazioni aderenti costituito da macrofagi e linfociti B.
- Cultura le popolazioni non-aderenti eluite dalla colonna di lana di nylon che contiene cellule murine di NK con 1.000 U/mL interleuchina (IL) -2 nel mezzo di RPMI1640 con 10% FBS, 100 U/mL di penicillina, 100 µ g/mL di streptomicina, piruvato di sodio di 1 mM, 5% 7,5% di bicarbonato di sodio soluzione e 0,001% β-mercaptoetanolo (RPMI1640 completa medio).
- Modificare il mezzo dai palloni il giorno 4 di questa cultura per rimuovere l'antiaderente T e le cellule NKT; le cellule che restano rispettate le beute sono in gran parte delle cellule NK. Aggiungere 20 mL di terreno completo di nuovo RPMI1640 e 1.000 U/mL IL-2 per ricostituire le beute.
- Verificare la purezza delle colture cellulari NK murine il giorno 7 di citometria a flusso con NK marcatori di cellula-specifico20 utilizzando preparazioni con oltre il 95% di CD3–NK1.1+ popolazione.
4. purificazione e l'espansione umane primarie delle cellule di NK
- Isolare PBMCs mediante gradiente di densità dai cappotti buffy di volontari umani sani. Brevemente, attentamente il livello 35 mL di diluito a metà (con HBSS) cellule oltre 15 mL del gradiente di densità in un tubo canonico 50 mL. Centrifugare a 400 × g per 30 min a 20 ° C in un rotore oscillante senza freno.
- Utilizzare i kit commerciali basati su anticorpi negativi selezione per purificare cellule NK umane primarie secondo il protocollo del produttore.
- In seguito l'isolamento, è necessario determinare la purezza delle preparazioni delle cellule NK dalle analisi di immunofluorescenza. Macchia le cellule preparazioni di cellule NK con 2 µ g/mL anti-CD3 e gli anticorpi anti-CD56 a 2 µ g/mL a 4 ° C per 20 min. lavare due volte con popolazioni di cellule NK PBS determinate dall'assenza di CD3 e la presenza di CD56 sulla superficie delle cellule.
- Incubare le preparazioni di cellule con anticorpi per 20 min a 4 ° C, lavate con PBS e analizzare in un citometro a flusso. Utilizzare preparazioni di cellule NK con più di 85% di purezza per la trasduzione del gene analisi20.
5. trasduzione delle cellule NK primarie murine ed umane con lentivirus
- Sospendere il mouse o cellule NK umane primarie in una piastra a 24 pozzetti in 0,5 × 105/ml di medium in presenza dei lentivirus GFP surnatante a 5, 10 e 20 molteplicità di infezione (MOI) e in presenza di Pb (8 µ g/mL), PS (8 µ g/mL) o destrano (8 µ g/mL).
- Centrifugare le piastre a 1.000 × g per 60 min.
- Senza decantare il supernatante, coltura le cellule durante la notte (16-18 h) in un incubatore a 37 ° C infuso con 5,2% CO2.
- Lavare con 10 mL di PBS e risospendere in 2 mL di terreno di coltura RPMI1640 completo in presenza di IL-2 (300 U/mL).
- Prova l'essere umano e del mouse primaria Citotossicità cellulo-mediata di NK contro K562 e YAC-1, rispettivamente eseguendo 51cromo (Cr)-saggi di rilascio al vario rapporti effettrici delle cellule bersaglio22.
- Brevemente, dare 1 milione bersaglio cellule 50 µ ci di radioattivo sodio cromato 51Cr. Durante il periodo di incubazione di 4-h, l'assorbimento del 51Cr in proteine cellulari. Al termine dell'incubazione, lavare le cellule per rimuovere qualsiasi etichetta non incorporata.
- Lisi delle cellule tumorali specifici per calcolare la quantità di rilascio assoluto, spontanea e sperimentale di 51Cr da cellule bersaglio.
Nota: Il calcolo della percentuale di lisi specifiche da esperimenti di pentaplicate è stato fatto usando la seguente equazione: Lisi specifiche % = ((51Cr significa emissione sperimentale - rilascio spontaneo media di 51Cr) / (51Cr significa massimo rilascio - 51Cr dire rilascio spontaneo)) х 100, dove "51media rilascio spontaneo Cr" è il 51Cr rilasciato da cellule bersaglio in assenza di cellule NK e "51rilascio massima media di Cr" è il 51Cr Pubblicato da cellule bersaglio su lisi di N 2 l'acido cloridrico (HCl).
- Raccogliere le cellule NK trasdotte il giorno 7 toccando delicatamente le beute.
- Per attivare le cellule prelevate con concentrazioni titolate di mAb associato a piastra anti-NKG2D (A10), rivestimento lastre di polistirene 96 pozzetti, altamente proteico-assorbente con concentrazioni di 2,5 µ g/mL di mAb anti-NKG2D durante la notte.
- Lavare ogni bene con 100 µ l di PBS tre volte prima dell'aggiunta delle cellule NK primarie.
- Raccogliere i surnatanti utilizzando una pipetta multicanale tra 16 e 18 h post-attivazione di quantificare citochine quali IFN-γ. Generare le curve standard utilizzando le citochine ricombinanti fornite con i kit di analisi (ELISA) enzima-collegata dell'immunosorbente.
- Verificare l'attuabilità delle cellule NK utilizzando Annessina-V/7-amino-actinomicina D (7-AAD) colorazione23 e determinare la percentuale di cellule necrotiche fra le cellule NK trasformate utilizzando un citometro a flusso.
- Per eseguire questo test, raccolta cellule NK murine ed umane quattro giorni dopo la trasduzione, lavare due volte con 10 mL di PBS freddo a 500 × g per 5 minuti ciascuno e incubare con un Annessina-V (PE) / kit 7-AAD.
- Utilizzare software di citometria a flusso appropriato per analizzare i dati. Selezionare la popolazione di cellule vive e analizzare l'espressione della GFP (canale FITC) come misura di trasduzione virale24.
Risultati
Destrano induce il trasferimento del gene efficiente del vettore lentivirale in cellule NK primarie umane e murine
Cellule NK umane erano isolate e purificate da PBMC (con una purezza superiore al 85%) e incubate durante la notte con rIL-2 300 U/mL. Queste cellule NK primarie erano quindi trasdotte con lentivirus GFP a variegata molteplicità di infezione (MOI; 3, 10 e 20 UI per cella) in piastre da 24 pozzetti in presenza di 8 µ g/mL Pb, PS o destrano. Le cellule sono state centrifugate a 1.000 × g per 60 min e coltivate (in presenza di virus) una notte a 37 ° C in un incubatore a CO2 . Le cellule erano lavate e risospesi in fresco RPMI1640 complete medium con rIL-2 300 U/mL per sette giorni. L'efficienza di trasduzione è stata valutata da citometria a flusso per l'espressione della GFP sette giorni dopo la trasduzione. Risultati mostrano che il dextrano migliora l'efficienza di trasduzione lentivirale in cellule NK umane e aumenta il titolo virale, che può anche migliorare la percentuale di cellule NK trasdotte (Figura 1).
Cellule NK murine sono sono isolate e coltivate come descritto nella sezione precedente. Il protocollo di cui sopra è stato utilizzato per analizzare e confrontare l'efficienza di trasduzione di Pb, Ps e destrano. Risultati nella Figura 2 mostrano che destrano può aumentare l'efficienza di vettori lentivirali rispetto al Pb o PS.
Trasduzione di cellule NK con destrano non influisce la loro capacità di mediare funzioni effettrici
La capacità citotossica delle cellule NK trasdotte umane e murine è stata esaminata dalle analisi di 51Cr-rilascio contro K562 e YAC-1 come cellule bersaglio. Presentato in Figura 3a e b i risultati rivelano che la trasduzione delle cellule NK di destrano non altera negativamente le potenzialità di uccisione delle cellule NK trasformate rispetto alle cellule NK non trasdotte. Inoltre, è stata analizzata la produzione di citochina dalle cellule NK primarie trasdotte. Generazione di IFN-γ è stata misurata usando un ELISA. Cellule NK umane trasdotte primarie erano co-coltivate con K562 per 24 h, e i surnatanti sono stati raccolti su misura IFN-γ. Risultati presentati nella Figura 4a rivelano che destrano non ha alcun impatto sulla capacità delle cellule NK trasdotte di produrre citochine. Come una convalida indipendente, cellule NK trasdotte sono state attivate con le concentrazioni titolate di mAb associato a piastra anti-NKG2D (A10) per i surnatanti di 18 h. sono stati raccolti, e generazione di IFN-γ è stato misurato da ELISA. Risultati mostrati in Figura 4b rivelano che la trasduzione delle cellule NK murine con destrano non ha alcun effetto sulla loro capacità di produrre citochine.
Trasduzione di cellule NK con destrano non influisce la loro attuabilità delle cellule
L'influenza di Pb, PS o destrano sull'attuabilità delle cellule NK trasdotte è stata valutata usando un dosaggio di propidio ioduro (PI) e le analisi di flusso successivo. Risultati in Figura 5a e b dimostrano che, anche se transducing primari umani e cellule NK del topo con virus può indurre necrosi in circa il 20% delle cellule di NK, l'aggiunta di destrano non ha fatto aumentare questa necrosi rispetto al Pb o PS.
Analisi statistiche sono state effettuate con un due code spaiato di test t di Student. P -valori ≤ 0,05 sono stati considerati significativi.

Figura 1: Destrano ha una maggiore efficienza di trasduzione di cellule NK primarie.
Cellule NK umane primarie sono state trasformate con MOI di 3, 10 o 20 IU/cella e sono state coltivate per sette giorni in presenza di Pb (8 µ g/mL), PS (8 µ g/mL), o destrano (8 µ g/mL). Percentuali delle cellule di NK GFP-positivi sono state determinate mediante citometria a flusso il giorno sette seguendo la trasduzione. Uno dei tre esperimenti indipendenti è mostrato. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Destrano ha una maggiore efficienza di trasduzione in cellule murine di NK.
Cellule NK murine primarie sono state trasformate con un MOI di 30 IU/cella e sono state coltivate per sette giorni in presenza di Pb (8 µ g/mL), PS (8 µ g/mL), o destrano (8 µ g/mL). Percentuali di cellule che esprimono GFP sono state determinate mediante citometria a flusso alle sette giorni successivi la trasduzione. Uno dei tre esperimenti indipendenti è mostrato. Clicca qui per visualizzare una versione più grande di questa figura.
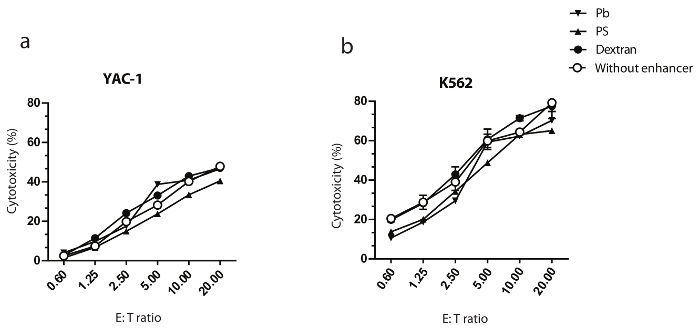
Figura 3: Destrano non modifica l'attività citotossica di NK cellulo-mediata delle cellule trasformate.
Cellule NK primarie sono state trasformate con un MOI di 10 IU/cella e sono state coltivate per sette giorni. YAC-1 e K562 sono stati utilizzati come cellule bersaglio per determinare il potenziale citotossico murine (a) e umane (b) delle cellule di NK, rispettivamente. I dati mostrati sono i rappresentanti di due esperimenti indipendenti. I dati riportati sono medie con SEM. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Destrano non altera la produzione di IFN-γ primarie delle cellule di NK.
) cellule NK murine erano trasdotte con un MOI 30 u.i./cella e coltivate per sette giorni. Le cellule NK sono state stimolate con 2,5 µ g/mL di anticorpo associato a piastra anti-NKG2D per 18 h e IFN-γ è stato quantificato in surnatanti utilizzando un test ELISA. b) trasdotte cellule NK umane sono state coltivate con cellule K562 per 24 h, e la produzione di IFN-γ è stata misurata in surnatanti della cultura. I dati presentati sono rappresentativi di tre esperimenti indipendenti. I dati riportati sono medie con SEM. Clicca qui per visualizzare una versione più grande di questa figura.
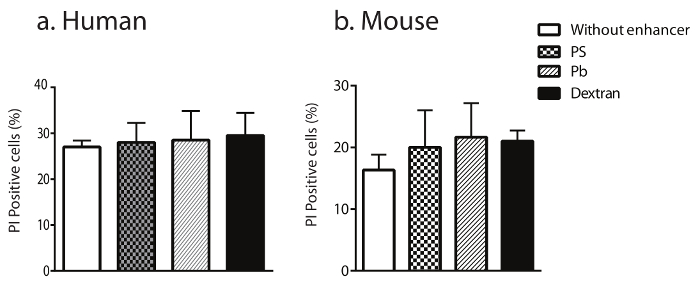
Figura 5: Trasduzione delle cellule NK con destrano non altera la loro attuabilità delle cellule.
La vitalità di umani trasformati (a) e cellule NK (b) del topo è stata quantificata dopo la macchiatura per annessina-V (PE) / cellule positive 7-AAD. I dati riportati sono medie con SEM. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo studio dimostra che l'uso di destrano come un agente di polimero cationico migliora l'efficienza di trasduzione lentivirale sia murine ed umane primarie delle cellule di NK. Inoltre, altri agenti cationici, quali Pb o PS, non avere alcun effetto visibile sulla fornitura di vettori virali in cellule NK primarie. In precedenza, è stato dimostrato che il Pb può aumentare trasduzione del gene umano di cellule T17. Questi risultati, tuttavia, indicano che Pb né PS hanno una simile efficienza sulle cellule NK umane primarie. In questo studio, Pb migliorato l'efficacia di trasduzione solo modestamente in cellule murine di NK. Esso ha dimostrato che l'inibizione dei meccanismi di difesa antivirale intracellulare utilizzando BX795, un inibitore di TBK1/IKKɛ e PS come un enhancer può aumentare l' efficienza di trasduzione lentivirale25. Tuttavia, i risultati hanno mostrato che questo inibitore non ha alcun effetto sull'efficacia di trasduzione in cellule di NK murine o umane primarie (dati non mostrati).
I risultati dimostrano che destrano può indurre la trasduzione efficiente di primari umani e cellule NK del topo, mentre PS e Pb non hanno alcun effetto. I risultati mostrano anche che il dextrano non altera le funzioni effettrici delle cellule NK, quali citotossicità antitumorale e la produzione di citochine pro-infiammatorie. Così, questi risultati dimostrano che la redditività di queste cellule NK primarie non è stata alterata dall'uso di destrano.
Gli studi multipli analizzato e confrontato l'efficienza di trasduzione di vettori retrovirali utilizzando diversi polimeri cationici, con esiti vario26,27,28. Uno studio precedente ha confrontato l'efficacia di trasduzione di questi polimeri utilizzando vettori lentivirali; Tuttavia, questo è stato testato in CD4 cellule+ T16. In uno di questi studi, ha dimostrato che Pb ha una migliore capacità di trasduzione su cellule trasformate di B e le cellule dendritiche rispetto al destrano26. In un altro studio, risulta che destrano facilita una maggiore efficienza di trasduzione rispetto altri rinforzatori in linfociti B umani e cellule di T16. Lo studio corrente è il primo del suo genere, a nostra conoscenza, che ha analizzato e confrontato la capacità di trasduzione di diversi polimeri in cellule NK primarie sia umane e murine.
Trasduzioni basati su destrano gene possono richiedere un minimo di due turni di trasduzioni. Questi risultati indicano che un round di trasduzione è sufficiente raggiungere fino al 40% delle cellule trasdotte positivamente, che è aumentato fino a 100% segue due turni di trasduzione (dati non mostrati). Una delle sfide principali nella trasduzione di cellule NK è la capacità di queste cellule per preservare l'espressione del gene trasdotte. I risultati attuali dimostrano che la trasduzione delle cellule NK primarie con destrano è stabile e che le cellule NK che sono coltivate in presenza di IL-2 possono mantenere il vettore e mantenere l'espressione del transgene per quattro settimane (dati non mostrati). Gli esperimenti supplementari sono necessari per analizzare l'efficienza di trasduzione e per esaminare l'espressione simultanea di transgeni multipli.
L'efficacia clinica delle terapie del cancro basati su cellule immuni è convalidato da istituzioni multiple. Cellule di T auto-trasdotte forniscono rinnovata promessa per il recupero di malattia e di ricaduta-libera dei malati di cancro rispetto alle terapie convenzionali. Come parte della risposta immunitaria innata, le cellule NK non richiedono sensibilizzazione anteriore per mediare le loro funzioni effettrici, compreso citotossicità antitumorale. A causa della loro rapida risposta, le cellule NK sono un sottoinsieme del linfocita effettore ideale per mediare un'immunoterapia efficienti basati su cellule tumorali. Nonostante loro attributi positivi nel riconoscimento del tumore e l'eliminazione, gli ostacoli tecnici per quanto riguarda la manipolazione genetica di consegnare transgeni limitano la massima utilizzazione clinica delle cellule NK.
Elettroporazione del mRNA per l'espressione genica esogeno è altamente efficiente e ha risultati migliori. Tuttavia, l'utilità di mRNA è limitato, come consentono solo l'espressione transitoria di geni di interesse e quindi non sono adatti per applicazioni cliniche. La trasduzione retrovirale di cellule NK è meno efficiente in quanto richiede più cicli di trasduzione; Inoltre, non possono transduce i vettori retrovirali in cellule di divisione. L'unico approccio promettente per la consegna del transgene stabile è l'uso di vettori lentivirali.
Complessivamente, questo studio fornisce un metodo efficiente per consegnare transgeni nelle cellule NK primarie, senza compromettere le loro funzioni effettrici. Questo protocollo rende l'immunoterapia del cancro basati su cellule NK altamente efficiente e applicabile ai test clinici emergenti. Per convalidare l'efficacia di questo metodo in immunoterapie cancro basati su cellule NK sono necessari esperimenti futuri.
Divulgazioni
Gli autori non sostengono nessun conflitto di interessi finanziario.
Riconoscimenti
Ringraziamo Lucia Sammarco e sua Lulu limonata Stand per ispirazione, motivazione e supporto. Questo lavoro è stato sostenuto in parte da NIH R01 AI102893 e NCI R01 CA179363 (S.M.); NHLBI-HL087951 (S.R.); NIH-CA151893-K08 (M.J.R.); NCI 1R01CA164225 (L.W); l'Alex Lemonade Stand della Fondazione (S.M.); il programma HRHM del fondo MACC (S.M.; S.R.; MANGIAGLI); la Fondazione di famiglia Nicholas (S.M.); la famiglia Gardetto (S.M.); gli studiosi di Hyundai programmare (M.S.T); Hyundai speranza su ruote (S.R.); il fondo MACC (M.S.T e S.M.); Istituto di ricerca dei bambini, MCW (S.R.); e il premio di Kathy Duffey Fogerty (M.J.R.).
Materiali
| Name | Company | Catalog Number | Comments |
| Dextran | Sigma-Aldrich | 90-64-91-9 | |
| polybrene (Pb) | Sigma-Aldrich | TR-1003 | |
| protamine sulfate (PS) | Sigma-Aldrich | p3369 | |
| Trypsin | Corning | 25-052-CI | |
| RPMI1640 | Corning | 10-040-CV | |
| Fetal Bovine Serum | ATALANTA | S11150 | |
| Penicillin | Corning | 30-001-CI | |
| B-mercaptoethanol | SIGMA | M3148 | |
| sodium pyruvate | Corning | MT25000CI | |
| Interferon gamma (IFN-γ ) | eBioscience | 14-7311-85 | |
| Propidium lodding staining solution | BD | 51-66211E | |
| Lipofectamine 3000 | Thermo Fisher | L3000015 | |
| Isoflurane | PHOENIX | NDC 57319-559-05 | |
| NK cell negative selection kit | Stem Cell | 19855 | |
| Yac-1 | ATCC | TIB-160 | |
| K562 | ATCC | CCL-243 | |
| Mice | Jakson | 664 | |
| 293T cells | ATCC | CRL-3216 | |
| T75 flasks | Cornnig | 430641U | |
| antibody-based negative selection kits | Stem Cell | 19055 | |
| 51Chromium (Cr)-release assays | perkin elmer's | NEZ030 | |
| ELISA kits | Ebioscience | 00-4201-56 | |
| Sodium Butyrate | Sigma | 5887-5G | |
| Linear polyethylenimine | polysciences | 23966-2 | |
| Ficoll | GE Life Science | 17-1440-03 | |
| HBSS | Corning | 21-022-CV |
Riferimenti
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nat. Immunol. 9, 503-510 (2008).
- Zitvogel, L., Tesniere, A., Kroemer, G. Cancer despite immunosurveillance: immunoselection and immunosubversion. Nat. Rev. Immunol. 6, 715-727 (2006).
- Arina, A., et al. Cellular liaisons of natural killer lymphocytes in immunology and immunotherapy of cancer. Expert. Opin. Biol. Ther. 7, 599-615 (2007).
- Manilay, J. O., Sykes, M. Natural killer cells and their role in graft rejection. Curr. Opin. Immunol. 10, 532-538 (1998).
- Raulet, D. H., Vance, R. E. Self-tolerance of natural killer cells. Nat. Rev. Immunol. 6, 520-531 (2006).
- Chouaib, S., et al. Improving the outcome of leukemia by natural killer cell-based immunotherapeutic strategies. Front Immunol. 5, 95 (2014).
- Dulphy, N., et al. Underground Adaptation to a Hostile Environment: Acute Myeloid Leukemia vs. Natural Killer Cells. Front Immunol. 7, 94 (2016).
- Tran, J., Kung, S. K. Lentiviral vectors mediate stable and efficient gene delivery into primary murine natural killer cells. Mol. Ther. 15, 1331-1339 (2007).
- Maasho, K., Marusina, A., Reynolds, N. M., Coligan, J. E., Borrego, F. Efficient gene transfer into the human natural killer cell line, NKL, using the Amaxa nucleofection system. J. Immunol. Methods. 284, 133-140 (2004).
- Trompeter, H. I., Weinhold, S., Thiel, C., Wernet, P., Uhrberg, M. Rapid and highly efficient gene transfer into natural killer cells by nucleofection. J. Immunol. Methods. 274, 245-256 (2003).
- Becknell, B., et al. Efficient infection of human natural killer cells with an EBV/retroviral hybrid vector. J. Immunol. Methods. 296, 115-123 (2005).
- Jiang, K., et al. Syk regulation of phosphoinositide 3-kinase-dependent NK cell function. J. Immunol. 168, 3155-3164 (2002).
- Burshtyn, D. N., et al. Conserved residues amino-terminal of cytoplasmic tyrosines contribute to the SHP-1-mediated inhibitory function of killer cell Ig-like receptors. J. Immunol. 162, 897-902 (1999).
- Schroers, R., et al. Gene transfer into human T lymphocytes and natural killer cells by Ad5/F35 chimeric adenoviral vectors. Exp. Hematol. 32, 536-546 (2004).
- Imai, C., Iwamoto, S., Campana, D. Genetic modification of primary natural killer cells overcomes inhibitory signals and induces specific killing of leukemic cells. Blood. 106, 376-383 (2005).
- Denning, W., et al. Optimization of the transductional efficiency of lentiviral vectors: effect of sera and polycations. Mol. Biotechnol. 53, 308-314 (2013).
- Lamers, C. H., Willemsen, R. A., Luider, B. A., Debets, R., Bolhuis, R. L. Protocol for gene transduction and expansion of human T lymphocytes for clinical immunogene therapy of cancer. Cancer Gene Ther. 9, 613-623 (2002).
- Campeau, E., et al. A versatile viral system for expression and depletion of proteins in mammalian cells. PLoS. ONE. 4, e6529 (2009).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Rajasekaran, K., et al. Signaling by Fyn-ADAP via the Carma1-Bcl-10-MAP3K7 signalosome exclusively regulates inflammatory cytokine production in NK cells. Nat. Immunol. 14, 1127-1136 (2013).
- Regunathan, J., Chen, Y., Wang, D., Malarkannan, S. NKG2D receptor-mediated NK cell function is regulated by inhibitory Ly49 receptors. Blood. 105, 233-240 (2005).
- Awasthi, A., et al. Rap1b facilitates NK cell functions via IQGAP1-mediated signalosomes. J. Exp. Med. 207, 1923-1938 (2010).
- Rajasekaran, K., et al. Transforming Growth Factor-{beta}-activated Kinase 1 Regulates Natural Killer Cell-mediated Cytotoxicity and Cytokine Production. J Biol. Chem. 286, 31213-31224 (2011).
- Wolkowicz, R., Nolan, G. P., Curran, M. A. Lentiviral vectors for the delivery of DNA into mammalian cells. Methods Mol. Biol. 246, 391-411 (2004).
- Sutlu, T., et al. Inhibition of intracellular antiviral defense mechanisms augments lentiviral transduction of human natural killer cells: implications for gene therapy. Hum. Gene Ther. 23, 1090-1100 (2012).
- Cornetta, K., Anderson, W. F. Protamine sulfate as an effective alternative to polybrene in retroviral-mediated gene-transfer: implications for human gene therapy. J. Virol. Methods. 23, 187-194 (1989).
- Toyoshima, K., Vogt, P. K. Enhancement and inhibition of avian sarcoma viruses by polycations and polyanions. Virology. 38, 414-426 (1969).
- Jensen, M., et al. The bi-specific CD3 x NCAM antibody: a model to preactivate T cells prior to tumour cell lysis. Clin. Exp. Immunol. 134, 253-263 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon