Method Article
Dextran erhöht die Effizienz der Lentivirale Transduktion von murinen und menschliche primäre NK-Zellen
In diesem Artikel
Zusammenfassung
Das Ziel dieser Studie war es, Technologien zu formulieren, die für erfolgreiche gen Transduktion in primären natürlichen killer (NK) Zellen ermöglichen. Die Dextran-vermittelten Lentivirale Transduktion von Mensch oder Maus primären NK Zellen führt zu höheren Wirkungsgraden der gen-Expression. Diese Methode des Gens Transduktion wird NK Zelle genetischen Manipulation erheblich verbessern.
Zusammenfassung
Die effizienteste Transduktion bestimmter Gene in natürlichen killer (NK)-Zellen ist eine große Herausforderung gewesen. Erfolgreiche Transductions sind entscheidend für die Bestimmung der Rolle des Gens von Interesse in der Entwicklung, Differenzierung und Funktion von NK-Zellen. Die jüngsten Fortschritte im Zusammenhang mit Chimären Antigen-Rezeptoren (Autos) im Krebsimmuntherapie betonen die Notwendigkeit für eine effiziente Methode zu exogenen Gene Effektor Lymphozyten liefern. Die Wirkungsgrade von Lentivirale vermittelte gen Transductions in primären Mensch oder Maus-NK-Zellen bleiben deutlich niedriger, was ein wichtiger begrenzender Faktor. Die jüngsten Fortschritte mit kationischen polymeren, z. B. Polybrene, zeigen eine verbesserte gen Transduktion Effizienz in T-Zellen. Doch scheiterte dieser Produkte, die Transduktion Wirkungsgrade von NK-Zellen zu verbessern. Diese Arbeit zeigt, dass Dextran, verzweigte Glucan Polysaccharid, verbessert erheblich die Transduktion Effizienz von Mensch und Maus primären NK-Zellen. Dieser hoch reproduzierbare Transduktion Methodik bietet ein kompetenter Werkzeug für transducing menschliche primäre NK-Zellen, die klinischen gen Lieferung Anwendungen und somit NK-Zell-basierte Krebs-Immuntherapie. erheblich verbessern können
Einleitung
Natürliche killer (NK)-Zellen sind die großen lymphatischer Bevölkerung des angeborenen Immunsystems1. NK-Zellen fungieren als Erstlinien Verteidiger der Host Immunantwort gegen Tumoren und Infektionen2,3,4. NK-Zellen spielen auch eine zentrale Rolle bei der Entwicklung der Toleranz durch die Sekretion von potenten Zytokine und Chemokine5. Aufgrund ihrer starken Fähigkeit, gezielt zu beseitigen Tumorzellen werden mehrere klinische Studien durchgeführt, um Spender-abgeleitete menschliche NK-Zellen als eine Adoptive Immuntherapie bei Krebs6,7zu bewerten. Im Gegensatz zu T-Zellen muss der Entwicklungsbiologie von NK-Zellen noch gut charakterisierten8. Diese Unkenntnis ist teilweise wegen fehlender effizienter Techniken, die Gene von Interesse an Maus oder menschliche primäre NK-Zellen zu liefern. Aus diesen Gründen haben die meisten NK-Zell in Zell-Linien, anstatt in Primärzellen Studien. Daher ist die Notwendigkeit für ein zuverlässiges und effizientes Protokoll zum primären NK-Zellen mit Genen von Interesse transduzieren entscheidend.
Das übergeordnete Ziel dieser Studie war es, eine konsistente und zuverlässige Methode zu formulieren, mit der primären menschlichen oder murine NK-Zellen mit Lenti oder Retroviren ausgestrahlt werden könnte.
Frühere Studien, die versuchten, dieses Problem zu beheben wurden durchgeführt, weitgehend über die vorübergehende Umwandlung von primären NK-Zellen. Dazu gehören Plasmid Transfektion9,10, Epstein - Barr-Virus (EBV) / retrovirale Hybrid Vektor11, "Vaccinia" Vektoren12,13und Ad5/F35 Chimären adenovirale Vektoren14. Trotz der bescheidenen Wirkungsgrad dieser Techniken macht die vergängliche Natur der Transduktion sie ungeeignet für die langfristige Nutzung von gentechnisch veränderten NK-Zellen. Einige neuere Studien haben retrovirale Vektoren verwendet, um transduzieren NK-Zellen, erfordern mehrere Zyklen der Infektion auf ein akzeptables Niveau der gen-Expression-11,-15zu erreichen. Im Gegensatz zur retroviralen Vektoren können Lentivirale Vektoren Wirtszelle nuclear Import Maschinen die virale Vorintegration Komplex translozieren in den Zellkern. Dies ist ein großer limitierender Faktor bei der Replikation des Virus in nicht-teilenden Zellen, die primäre NK-Zellen enthalten.
Wechselwirkungen zwischen verschiedenen Rezeptoren der Zelloberfläche und virale Partikel erlauben virale Aufnahme in die Zelle. Die ersten Kämpfe zwischen der Virushülle Proteine und ihre Verwandten Host-Rezeptoren könnte wegen der potenziellen negativen Ladungen zwischen diesen beiden bestehenden beschränkt werden. Das Grundprinzip hinter vielen Transduktion Techniken ist, dass die Zugabe von kationischen polymeren, z. B. Polybrene (Pb), Protamin Sulfat (PS) oder Dextran, könnte eine positive Ladung an die Rezeptoren der Zelloberfläche und damit die Bindung der Virushülle ergänzen Proteine. Dies erhöht die Fusion-Effizienz und die Aufnahme der viralen Partikel von den Zellen16. Obwohl es berichtet wurde, dass Pb oder PS Gentransfer in T Zellen17verbessern kann, ihre Anwendung nicht in die Transduktion Effizienz der primären NK-Zellen auswirken. Darüber hinaus wurde eine vergleichende Analyse zwischen dieser Reagenzien mit primären NK-Zellen nicht durchgeführt. In dieser Studie wurden die Transduktion Wirkungsgrade der drei kationische Polymere verglichen. Die Ergebnisse zeigen, dass unter diesen drei kationischen polymeren nur Dextran effiziente virale Transduktion in Maus und menschliche primäre NK-Zellen deutlich erhöht.
Protokoll
Alle tierischen Protokolle folgten die humane und ethische Behandlung der Tiere und durch die institutionelle Animal Care und Nutzung Committee (IACUC) in Biomedical Research Center (BRC) des Medical College of Wisconsin (MCW), Milwaukee, WI angenommen wurden. Die Verwendung von menschlichen peripheren mononukleären Blutzellen (PBMCs) wurde durch die institutionelle Review Board (IRB) des Blut-Forschungsinstituts der Blut von Wisconsin, Milwaukee, WI genehmigt.
(1) Mäuse, Zell-Linien und Vektoren
- Kommerzielle Anbieter C57BL/6 Mäusen einzuholen. Warten Sie die Maus-Kolonien in Pathogen-freies Bedingungen und verwenden Sie weibliche und männliche Mäuse im Alter von 6 bis 12 Wochen. Anonymisierte menschlichen PBMCs von IRB genehmigten Quellen erhalten.
- Betäuben Sie die Tiere mit einer Mischung aus 20-30 % V/V Isofluran in Propylenglykol (1, 2-Propandiol, USP Klasse) um die Mäuse zu betäuben. Gelten Sie Tierarzt Salbe für die Augen, um Trockenheit zu verhindern, während sich die Mäuse unter Narkose.
- Um die Tiere einschläfern, führen Sie durch zervikale Dislokation nach Induktion der Anästhesie.
- Zurückhalten Sie, die Mäuse durch das Fest der Schwanzwurzel mit einer Hand greifen. Legen Sie einen stabilen Stock-Typ Stift oder Daumen und Zeigefinger der anderen Hand gegen die Rückseite des Halses, an der Basis des Schädels.
- Um die Versetzung zu erzeugen, drücken Sie die Hand Ruhigstellung, die der Kopf des Tieres nach vorne und drücken nach unten und ziehen Sie mit der Hand die Rute Basis rückwärts. Überprüfung der Effektivität der Luxation durch Abtasten eine Trennung der zervikalen Gewebe.
- Halten Sie die Tiere in der Kammer/Käfig mindestens 5 min lang und entfernen Sie sie nur, wenn Atmungsaktivität nicht vorhanden ist oder wenn es ein Mangel nachweisbar Herzschlag.
- K562 und YAC-1 Zellen von kommerziellen Anbietern erhalten und pflegen sie in RPMI1640 Medium mit 10 % Hitze-inaktivierten FBS. Testen Sie diese Zell-Linien in regelmäßigen Abständen zu Mykoplasmen Kontamination auszuschließen.
2. Vorbereitung und Titration der Lentivirale Vektoren
- Zellkulturen 5 × 106 293T über Nacht in einem T75 cm2 Kolben mit einer Lösung von 20 mL RPMI1640 Medium mit 10 % FBS, 100 U/mL Penicillin, 100 µg/mL Streptomycin, 1 mM Natrium Pyruvat, 5 % 7,5 % Natriumbicarbonat Lösung und 0,001 % Β-Mercaptoethanol. Legen Sie die Flasche in einem 37 ° C Inkubator mit 5,2 % CO2infundiert.
- Ernte der 293T Zellen mittels Trypsin (0.025%)/EDTA (1 mM) in Phosphat-gepufferte Kochsalzlösung (PBS). Fügen Sie 5 mL Trypsin/EDTA in PBS und inkubieren Sie die Flaschen für 10 min in einem 37 ° C Inkubator auf die Ablösung der 293T Zellen aus den T75 cm2 Kolben ermöglichen.
- Sammeln Sie die freistehenden Zellen zu, und waschen Sie sie zweimal in PBS, entfernen alle Spuren von Trypsin und EDTA. Zählen Sie die Zellen mit einem Hemocytometer und passen Sie die Anzahl von Zellen auf 1 Million Zellen pro mL.
- Die 293T Zellen18 mit 3,95 µg psPAX2, 1,32 µg pMD2G und 5,26 µg pLEP-GFP-Puro (generiert intern bei BRI durch Klonen EF1alpha Veranstalter von pWPI anstelle von einem CMV-Promotor in pLenti CMV-GFP-Puro) transfizieren19.
- Bereiten Sie 1 mL 150 mM NaCl plus 63 µL 0,6 mg/mL Polyethylenimine (PEI; 25.000 kD, linear). Gut verrühren und dann die Plasmiden hinzufügen und mischen. 20 min bei Raumtemperatur inkubieren Sie und fügen Sie ihn zu den Zellen.
- 16 h nach Transfektion, ersetzen die Transfektion Medium mit frischem Medium plus 4,5 mM Natrium Butyrat. Ernten Sie Virus 48 h nach Transfektion mit Überstand zu und zu konzentrieren Sie, indem über Nacht Zentrifugation bei 5.000 × g. Siehe Tabelle der Materialien.
- Bestimmen Sie die virale Titer mit 293T Zellen durch Ausführen von Verdünnungsreihen und assay Flow Cytometry 72 h nach Transduktion20. Verwenden Sie den Ausdruck des grün fluoreszierenden Proteins (GFP) als eine Maßnahme, um die virale Titer zu quantifizieren.
3. Reinigung und Ausbau der murinen primäre NK-Zellen
- Murine primäre NK Zellen21zu reinigen. Kurz gesagt, pass einzellige Milz Suspensionen durch Nylon Wolle Spalten, die anhaftende Bevölkerung bestehend aus B-Zellen und Makrophagen zum Abbau.
- Kultur-anhaftende Populationen aus Nylon Wolle Spalte eluiert, das murine NK-Zellen mit 1.000 U/mL Interleukin (IL)-2 in RPMI1640 Medium mit 10 % FBS, 100 U/mL Penicillin, 100 µg/mL Streptomycin, 1 mM Natrium Pyruvat, 5 % 7,5 % Natriumbicarbonat enthält Lösung und 0,001 % β-Mercaptoethanol (RPMI1640 komplette Medium).
- Ändern Sie das Medium aus den Kolben am 4. Tag dieser Kultur, die nicht-anhaftende T und NKT-Zellen zu entfernen; Zellen, die den Kolben eingehalten bleiben sind weitgehend NK-Zellen. Fügen Sie 20 mL frisches RPMI1640 komplette Medium und 1.000 U/mL IL-2, die Flaschen wieder aufzufüllen.
- Überprüfen Sie die Reinheit der murinen NK-Zellkulturen am 7. Tag von Durchflusszytometrie mit NK zellspezifische Marker20 mehr als 95 % der CD3 Vorbereitungen mit–NK1.1+ Bevölkerung.
4. Reinigung und Erweiterung der menschlichen primäre NK-Zellen
- Isolieren Sie PBMCs von Dichtegradienten von buffy Coats von gesunden Freiwilligen. Kurz, sorgfältig Schicht 35 mL Hälfte verdünnt (mit HBSS) Zellen über 15 mL Dichtegradient in eine kanonische 50-mL-Tube. Zentrifugieren Sie bei 400 × g für 30 min bei 20 ° C in einem schwingenden Eimer Rotor ohne Bremse.
- Verwenden Sie die kommerzielle Antikörper-basierten negative Auslese-Kits menschliche primäre NK-Zellen nach Protokoll des Herstellers zu reinigen.
- Im Anschluss an die Isolation bestimmen Sie die Reinheit der NK-Zelle-Vorbereitungen durch Immunfluoreszenz Analysen. Färben Sie NK Zelle Vorbereitungen mit 2 µg/mL Anti-CD3 und 2 µg/mL Anti-CD56-Antikörper bei 4 ° C für 20 min. Waschen der Zellen zweimal mit PBS NK-Zell-Populationen durch das Fehlen von CD3 und das Vorhandensein von CD56 auf der Zelloberfläche bestimmt.
- Die Zelle Vorbereitungen mit Antikörpern für 20 min bei 4 ° C inkubieren, waschen mit PBS, und in einem Durchflusszytometer analysiert. NK Zelle Präparate mit mehr als 85 % Reinheit für die gen-Transduktion20Proben.
(5) Transduktion von murinen und menschliche primäre NK-Zellen mit lentivirus
- Maus oder menschliche primäre NK-Zellen in einer 24-Well-Platte bei 0,5 × 105/mL des Mediums im Beisein von GFP Lentivirus Überstand auf 5, 10 und 20 Multiplizität der Infektion (MOI) und in Anwesenheit von Pb aussetzen (8 µg/mL), PS (8 µg/mL) oder Dextran (8 µg/mL).
- Zentrifugieren Sie die Platten bei 1000 × g 60 min.
- Ohne Umfüllen des Überstands, Kultur der Zellen über Nacht (16-18 h) in einem 37 ° C Inkubator infundiert mit 5,2 % CO2.
- Mit 10 mL PBS waschen und in 2 mL des kompletten RPMI1640 Kulturmedium in Anwesenheit von IL-2 Aufschwemmen (300 U/mL).
- Testen der Mensch und Maus primären NK zellvermittelte Zytotoxizität gegenüber K562 und YAC-1, bzw. durch Ausführen von 51Chrom (Cr)-Release Assays auf abwechslungsreiche Effektor-Zielzelle Verhältnisse22.
- Kurz gesagt, geben Sie 1 Million Ziel Zellen 50 µCi radioaktiven Natrium Chromat 51Cr. Während der Inkubationszeit von 4-h sie Aufnahme 51Cr in zelluläre Proteine. Am Ende der Inkubation Waschen der Zellen, um eine nicht rechtsfähige Etikett zu entfernen.
- Berechnen Sie spezifische Tumor Zelle lyse durch die Menge der absolute, spontan und experimentelle Freisetzung von 51Cr aus den Zielzellen.
Hinweis: Die Berechnung des Prozentsatzes der spezifische lyse von Pentaplicate Experimente erfolgte unter Verwendung der folgenden Gleichung: % spezifische lyse = ((51Cr meine Freisetzungsversuch - 51Cr bedeuten spontane Freisetzung) / (51meine Cr maximale Freigabe - 51Cr meine spontane Freisetzung)) х 100, wo "51Cr bedeuten spontane Freisetzung" 51Cr von Zielzellen in Ermangelung von NK-Zellen befreit und "51Cr mittlere maximale Freigabe" ist die 51Cr veröffentlicht von Zielzellen nach lyse von 2 N Salzsäure (HCl).
- Ernten Sie die transduced NK-Zellen am 7. Tag durch leichtes Klopfen die Kolben.
- Aktivieren Sie die geernteten Zellen mit einer betitelten Platte gebundene Anti-NKG2D (A10) mAb durch die Beschichtung 96-Well, Protein Hochabsorbierendes Polystyrol-Platten mit 2,5 µg/mL-Konzentrationen des Anti-NKG2D mAb über Nacht.
- Waschen Sie jeweils gut mit 100 µL PBS dreimal vor der Zugabe von primären NK-Zellen.
- Sammeln Sie Kultur Überstände mit einer Multi-Kanal-Pipette zwischen 16 und 18 h nach Aktivierung, Zytokinen wie IFN-γ zu quantifizieren. Generieren Sie Standardkurven mit der rekombinanten Zytokine mit Enzym-linked Immunosorbentprobe Assay (ELISA) Kits zur Verfügung gestellt.
- Testen Sie der NK Zellviabilität mit annexin-V/7-amino-Actinomycin D (7-AAD) Färbung23 und bestimmen Sie den Prozentsatz der nekrotischen Zellen unter den transformierten NK-Zellen mit einem Durchflusszytometer.
- Um diesen Test durchzuführen, Ernte der murine und menschlichen NK Zellen vier Tage nach Transduktion, zwei Mal mit 10 mL kaltem PBS 500 × g für 5 min waschen und inkubieren Sie es mit einem Annexin V (PE) / 7-AAD Kit.
- Verwenden Sie geeignete Flow Cytometry Software zum Analysieren der Daten. Wählen Sie die live-Zell-Population und analysieren Sie den Ausdruck der GLP (FITC Kanal) als Maß für die virale Transduktion24zu.
Ergebnisse
Dextran induziert die effiziente Gentransfer Lentivirale Vektor in primären menschlichen und murinen NK-Zellen
Menschlichen NK-Zellen wurden isoliert und gereinigt von PBMC (mit einer Reinheit von mehr als 85 %) und über Nacht mit rIL-2 300 U/mL inkubiert. Diese primäre NK-Zellen wurden dann mit GFP Lentivirus am abwechslungsreichen Mannigfaltigkeiten der Infektion ausgestrahlt (MOI; 3, 10 und 20 IU pro Zelle) in 24-Well-Platten im Beisein von 8 µg/mL Pb, PS oder Dextran. Zellen wurden 1.000 × g für 60 min zentrifugiert und kultiviert (in Anwesenheit von Virus) über Nacht bei 37 ° C in einem CO-2 -Inkubator. Zellen wurden gewaschen und Nukleinsäuretablette an frischen RPMI1640 komplette Medium mit rIL-2 300 U/mL für sieben Tage. Die Transduktion Effizienz wurde sieben Tage nach Transduktion von Durchflusszytometrie für die GFP Expression bewertet. Ergebnisse zeigen, dass Dextran steigert die Effizienz der Lentivirale Transduktion in menschlichen NK-Zellen und erhöht die virale Titer, die wodurch auch den Anteil der ausgestrahlt NK-Zellen (Abbildung 1) verbessert werden kann.
Murine NK-Zellen wurden isoliert und kultiviert wie im vorigen Abschnitt beschrieben. Das obige Protokoll wurde verwendet, zu analysieren und vergleichen die Transduktion Effizienz von Pb, Ps und Dextran. Ergebnisse in Abbildung 2 zeigen, dass Dextran kann die Effizienz der Lentivirale Vektoren im Vergleich zu Pb ergänzen oder PS.
Transduktion von NK-Zellen mit Dextran hat keinen Einfluss auf ihre Fähigkeit, Effektor-Funktionen zu vermitteln
Die zytotoxische Kapazität ausgestrahlt menschlichen und murinen-NK-Zellen wurde als die Zielzellen von 51Cr-Release Assays gegen K562 und YAC-1 geprüft. In Abbildung 3a und b dargestellten Ergebnisse zeigen, dass die Transduktion von NK-Zellen von Dextran nicht negativ das töten Potenzial der transformierten NK-Zellen im Vergleich zu nicht ausgestrahlt NK-Zellen ändert. Darüber hinaus wurde die Produktion von Zytokinen aus primären NK-Zellen ausgestrahlt analysiert. IFN-γ-Generation wurde mit einem ELISA gemessen. Ausgestrahlt menschliche primäre NK-Zellen wurden mit K562 für 24 h Co kultiviert wurden, und die Überstände nach Maß IFN-γ. In Abbildung 4a dargestellten Ergebnisse zeigen, dass Dextran hat keine Auswirkungen auf die Fähigkeit von NK-Zellen ausgestrahlt, Zytokine produzieren. Als eine unabhängige Validierung wurden ausgestrahlt NK-Zellen mit einer betitelten Platte gebundene Anti-NKG2D (A10) mAb aktiviert, für 18 h. Kultur Überstände wurden gesammelt, und IFN-γ-Generation wurde von ELISA gemessen. In Abbildung 4 b dargestellten Ergebnisse zeigen, dass die Transduktion von murinen NK-Zellen mit Dextran keine Auswirkung auf ihre Fähigkeit hat, Zytokine produzieren.
Transduktion von NK-Zellen mit Dextran hat keinen Einfluss auf ihre Zellviabilität
Der Einfluss von Pb, PS oder Dextran auf die Lebensfähigkeit der NK-Zellen ausgestrahlt wurde über ein Propidium Jodid (PI) Assay und anschließenden Fluss Analysen ausgewertet. Ergebnisse in Abb. 5a und b zeigen, dass obwohl transducing primäre Mensch und Maus-NK-Zellen mit Viren Nekrose in etwa 20 % der NK-Zellen induzieren kann, die Zugabe von Dextran nicht diese Nekrose im Vergleich zu Pb ergänzen oder PS.
Statistische Analysen wurden mit einem zweiseitigen ungepaarte Student t-Test durchgeführt. P -Werte ≤ 0,05 wurden als bedeutende.

Abbildung 1: Dextran hat eine höhere Effizienz der Transduktion menschlicher primäre NK-Zellen.
Primären menschlichen NK-Zellen wurden mit MOI von 3, 10 oder 20 IU/Zelle umgewandelt und wurden gezüchtet für sieben Tage im Beisein von Pb (8 µg/mL), PS (8 µg/mL) oder Dextran (8 µg/mL). Prozentsätze der GFP-positiven NK-Zellen wurden am Tag nach der Transduktion sieben Durchflusszytometrie bestimmt. Eine der drei unabhängigen Experimenten wird angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Dextran hat eine höhere Effizienz der Transduktion in murinen NK-Zellen.
Primären murine NK-Zellen wurden mit einer MOI 30 IU/Zelle umgewandelt und wurden gezüchtet für sieben Tage im Beisein von Pb (8 µg/mL), PS (8 µg/mL) oder Dextran (8 µg/mL). Prozentsätze der GFP exprimierenden Zellen wurden sieben Tage nach der Transduktion Durchflusszytometrie bestimmt. Eine der drei unabhängigen Experimenten wird angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
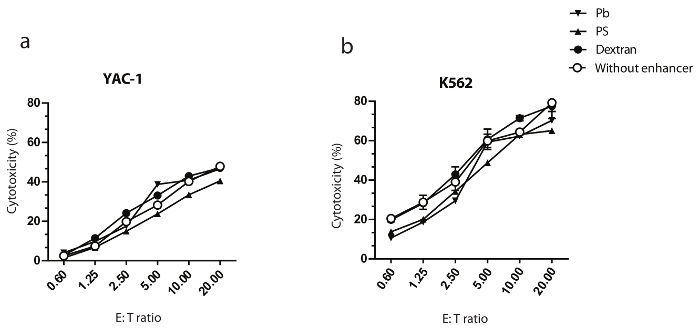
Abbildung 3: Dextran ändert nicht die NK Zell-vermittelten zytotoxische Aktivität der transformierten Zellen.
Primäre NK-Zellen wurden mit einer MOI von 10 IU/Zelle transformiert und waren für sieben Tage kultiviert. YAC-1 und K562 als Zielzellen dienten um die zytotoxischen Potenziale der murinen (a) und Menschen (b) NK-Zellen, bzw. zu ermitteln. Die angezeigten Daten sind Vertreter von zwei unabhängigen Experimenten. Die angezeigten Daten sind Durchschnittswerte mit SEM Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 4: Dextran ändert nicht die IFN-γ Produktion von primären NK-Zellen.
(a) murine NK-Zellen wurden mit einer MOI von 30 IU ausgestrahlt/Zelle und für sieben Tage kultiviert. NK-Zellen wurden mit 2,5 µg/mL für 18 h Platte gebundene Anti-NKG2D Antikörper stimuliert, und IFN-γ wurde in Kultur Überstände mit einem ELISA quantifiziert. (b) menschlichen NK-Zellen ausgestrahlt wurden mit K562 Zellen 24 Stunden kultiviert, und IFN-γ Produktion wurde in Kultur Überstände gemessen. Die vorgelegten Daten sind repräsentativ für drei unabhängigen Experimenten. Die angezeigten Daten sind Durchschnittswerte mit SEM Klicken Sie bitte hier, um eine größere Version dieser Figur.
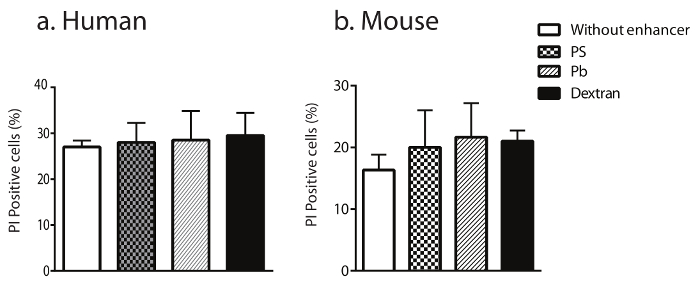
Abbildung 5: Transduktion von NK-Zellen mit Dextran ändert nicht ihre Zellviabilität.
Die Lebensfähigkeit der transformierten Menschen (a) und Maus (b) NK-Zellen wurde nach der Färbung für Annexin V (PE) quantifiziert / 7-AAD positive Zellen. Die angezeigten Daten sind Durchschnittswerte mit SEM Klicken Sie bitte hier, um eine größere Version dieser Figur.
Diskussion
Diese Studie zeigt, dass die Verwendung von Dextran als ein kationisches Polymer-Agent die Lentivirale Transduktion Effizienz der murinen und menschliche primäre NK-Zellen verbessert. Darüber hinaus haben andere kationische Mittel, wie Pb oder PS, keinen erkennbaren Einfluss auf die Lieferung von viralen Vektoren in menschliche primäre NK-Zellen. Zuvor wurde nachgewiesen, dass Pb gen Transduktion in menschlichen T-Zellen-17ergänzen kann. Diese Ergebnisse zeigen jedoch, dass weder Pb noch PS eine ähnliche Effizienz auf menschliche primäre NK-Zellen. In dieser Studie Pb verbessert die Transduktion Wirksamkeit nur in bescheidenem Maße in murinen NK-Zellen. Es hat sich gezeigt, dass die Hemmung der intrazellulären antivirale Abwehrmechanismen mit BX795, ein Inhibitor der TBK1/IKKɛ und PS als Verstärker der Lentivirale Transduktion Effizienz25erhöhen kann. Dennoch zeigten die Ergebnisse, dass dieser Hemmstoff keinen Einfluss auf die Wirksamkeit der Transduktion in murinen oder menschliche primäre NK-Zellen (Daten nicht gezeigt hat).
Die Ergebnisse zeigen, dass das Dextran effizienteste Transduktion von primären Mensch und Maus-NK-Zellen, induzieren kann, während PS und Pb wirkungslos. Die Ergebnisse zeigen auch, dass das Dextran die Effektor-Funktionen von NK-Zellen, wie Anti-Tumor-Zytotoxizität und die Produktion von Pro-inflammatorischen Zytokinen nicht verändert wird. So, diese Ergebnisse beweisen, dass die Lebensfähigkeit dieser primären NK-Zellen nicht durch den Einsatz von Dextran geändert wurde.
Mehrere Studien analysiert und verglichen die Transduktion Effizienz der retroviralen Vektoren mit verschiedenen kationischen polymeren mit vielfältigen Ergebnisse26,27,28. Eine frühere Studie verglich die Transduktion Wirksamkeit dieser Polymere mit Lentivirale Vektoren; jedoch wurde dies in CD4 getestet+ T Zellen16. In einer dieser Studien hat sich gezeigt, dass Pb eine bessere Kapazität von Transduktion auf entartete B-Zellen und dendritischen Zellen im Vergleich zu Dextran26 hat. In einer weiteren Studie hat gezeigt, dass Dextran einen höheren Wirkungsgrad der Transduktion als andere Geschmacksverstärker in humanen B-Zellen ermöglicht und T-16 Zellen. Die aktuelle Studie ist das erste seiner Art, unseres Wissens, die analysiert und verglichen die Transduktion Kapazität verschiedener Polymere in menschlichen und murinen primäre NK-Zellen.
Dextran-basierte gen Transductions erfordern ein Minimum von zwei Runden des Transductions. Diese Ergebnisse zeigen, dass eine Runde Transduktion ist genug um zu erreichen bis zu 40 % der Zellen positiv ausgestrahlt, die bis zu 100 % im folgenden erhöht ist zwei Runden der Transduktion (Daten nicht gezeigt). Eine der großen Herausforderungen in der transducing NK-Zellen ist die Fähigkeit dieser Zellen, die Expression des Gens transduced zu bewahren. Die aktuellen Ergebnisse zeigen, dass die Transduktion von primären NK-Zellen mit Dextran stabil ist und die NK-Zellen, die in Gegenwart von IL-2 kultiviert werden können den Vektor zu behalten und Transgene Ausdruck für vier Wochen (Daten nicht gezeigt pflegen). Weitere Experimente sind erforderlich, um die Transduktion Effizienz analysieren und untersuchen Sie den gleichzeitigen Ausdruck mehrere transgene.
Die klinische Wirksamkeit von immun-zellbasierte Therapien wird von mehreren Institutionen validiert wird. Auto-ausgestrahlt-T-Zellen bieten erneuerte Verheißung für die Krankheit und Rückfall-freie Verwertung von Krebs-Patienten im Vergleich zu konventionellen Therapien. Im Rahmen der angeborenen Immunantwort erfordern NK-Zellen keine vorherige Sensibilisierung ihrer Effektor-Funktionen, einschließlich Anti-Tumor-Zytotoxizität zu vermitteln. Durch ihre schnelle Reaktion sind NK-Zellen eine ideale Effektor Lymphozyten Teilmenge eine effiziente zellbasierte Krebsimmuntherapie zu vermitteln. Trotz ihrer positiven Eigenschaften in Tumor-Erkennung und Beseitigung begrenzen die technischen Hürden bezüglich der genetischen Manipulation, transgene liefern die vollste klinische Verwendung von NK-Zellen.
Elektroporation von mRNA für exogene Genexpression ist hocheffizient und hat bessere Ergebnisse. MRNA-Dienstprogramm ist jedoch begrenzt, da sie nur die transiente Expression von Genen von Interesse erlauben und somit eignen sich nicht für klinische Anwendungen. Die retrovirale Transduktion von NK-Zellen ist weniger effizient, da es mehrere Runden der Transduktion erfordert; Darüber hinaus können nicht retrovirale Vektoren in nicht-teilenden Zellen transduzieren. Die einzige vielversprechende Ansatz für stabile Transgen Lieferung ist die Verwendung von Lentivirale Vektoren.
Insgesamt bietet diese Studie eine effiziente Methode, um transgene in primären NK-Zellen zu liefern, ohne Beeinträchtigung ihrer Effektor-Funktionen. Dieses Protokoll macht NK-Zell-basierte Krebs-Immuntherapie, hocheffizient und auf neue klinische Studien anwendbar. Zukünftige Experimente sind erforderlich, um die Wirksamkeit dieser Methode in NK-Zell-basierte Krebsimmuntherapien zu validieren.
Offenlegungen
Die Autoren behaupten keine finanziellen Interessenkonflikt.
Danksagungen
Wir danken Lucia Sammarco und ihr Lulus Lemonade Stand für Inspiration, Motivation und Unterstützung. Diese Arbeit wurde zum Teil durch NIH R01 AI102893 und NCI R01 CA179363 (S.M) unterstützt; NHLBI-HL087951 (S.R.); NIH-CA151893-K08 (M.J.R.); NCI-1R01CA164225 (L.W); der Alex Lemonade Stand Foundation (S.M.); Das HRHM-Programm des MACC Fonds (S.M.; S.R.; M.S.T); die Nikolaus-Familienstiftung (S.M.); Gardetto Familie (S.M.); die Hyundai-Gelehrten Programm (M.S.T.); Hyundai Hoffnung auf Rädern (S.R.); die MACC-Fonds (M.S.T. und S.M.); die Kinder-Forschungsinstitut, MCW (S.R.); und Kathy Duffey Fogerty Award (M.J.R.).
Materialien
| Name | Company | Catalog Number | Comments |
| Dextran | Sigma-Aldrich | 90-64-91-9 | |
| polybrene (Pb) | Sigma-Aldrich | TR-1003 | |
| protamine sulfate (PS) | Sigma-Aldrich | p3369 | |
| Trypsin | Corning | 25-052-CI | |
| RPMI1640 | Corning | 10-040-CV | |
| Fetal Bovine Serum | ATALANTA | S11150 | |
| Penicillin | Corning | 30-001-CI | |
| B-mercaptoethanol | SIGMA | M3148 | |
| sodium pyruvate | Corning | MT25000CI | |
| Interferon gamma (IFN-γ ) | eBioscience | 14-7311-85 | |
| Propidium lodding staining solution | BD | 51-66211E | |
| Lipofectamine 3000 | Thermo Fisher | L3000015 | |
| Isoflurane | PHOENIX | NDC 57319-559-05 | |
| NK cell negative selection kit | Stem Cell | 19855 | |
| Yac-1 | ATCC | TIB-160 | |
| K562 | ATCC | CCL-243 | |
| Mice | Jakson | 664 | |
| 293T cells | ATCC | CRL-3216 | |
| T75 flasks | Cornnig | 430641U | |
| antibody-based negative selection kits | Stem Cell | 19055 | |
| 51Chromium (Cr)-release assays | perkin elmer's | NEZ030 | |
| ELISA kits | Ebioscience | 00-4201-56 | |
| Sodium Butyrate | Sigma | 5887-5G | |
| Linear polyethylenimine | polysciences | 23966-2 | |
| Ficoll | GE Life Science | 17-1440-03 | |
| HBSS | Corning | 21-022-CV |
Referenzen
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., Ugolini, S. Functions of natural killer cells. Nat. Immunol. 9, 503-510 (2008).
- Zitvogel, L., Tesniere, A., Kroemer, G. Cancer despite immunosurveillance: immunoselection and immunosubversion. Nat. Rev. Immunol. 6, 715-727 (2006).
- Arina, A., et al. Cellular liaisons of natural killer lymphocytes in immunology and immunotherapy of cancer. Expert. Opin. Biol. Ther. 7, 599-615 (2007).
- Manilay, J. O., Sykes, M. Natural killer cells and their role in graft rejection. Curr. Opin. Immunol. 10, 532-538 (1998).
- Raulet, D. H., Vance, R. E. Self-tolerance of natural killer cells. Nat. Rev. Immunol. 6, 520-531 (2006).
- Chouaib, S., et al. Improving the outcome of leukemia by natural killer cell-based immunotherapeutic strategies. Front Immunol. 5, 95(2014).
- Dulphy, N., et al. Underground Adaptation to a Hostile Environment: Acute Myeloid Leukemia vs. Natural Killer Cells. Front Immunol. 7, 94(2016).
- Tran, J., Kung, S. K. Lentiviral vectors mediate stable and efficient gene delivery into primary murine natural killer cells. Mol. Ther. 15, 1331-1339 (2007).
- Maasho, K., Marusina, A., Reynolds, N. M., Coligan, J. E., Borrego, F. Efficient gene transfer into the human natural killer cell line, NKL, using the Amaxa nucleofection system. J. Immunol. Methods. 284, 133-140 (2004).
- Trompeter, H. I., Weinhold, S., Thiel, C., Wernet, P., Uhrberg, M. Rapid and highly efficient gene transfer into natural killer cells by nucleofection. J. Immunol. Methods. 274, 245-256 (2003).
- Becknell, B., et al. Efficient infection of human natural killer cells with an EBV/retroviral hybrid vector. J. Immunol. Methods. 296, 115-123 (2005).
- Jiang, K., et al. Syk regulation of phosphoinositide 3-kinase-dependent NK cell function. J. Immunol. 168, 3155-3164 (2002).
- Burshtyn, D. N., et al. Conserved residues amino-terminal of cytoplasmic tyrosines contribute to the SHP-1-mediated inhibitory function of killer cell Ig-like receptors. J. Immunol. 162, 897-902 (1999).
- Schroers, R., et al. Gene transfer into human T lymphocytes and natural killer cells by Ad5/F35 chimeric adenoviral vectors. Exp. Hematol. 32, 536-546 (2004).
- Imai, C., Iwamoto, S., Campana, D. Genetic modification of primary natural killer cells overcomes inhibitory signals and induces specific killing of leukemic cells. Blood. 106, 376-383 (2005).
- Denning, W., et al. Optimization of the transductional efficiency of lentiviral vectors: effect of sera and polycations. Mol. Biotechnol. 53, 308-314 (2013).
- Lamers, C. H., Willemsen, R. A., Luider, B. A., Debets, R., Bolhuis, R. L. Protocol for gene transduction and expansion of human T lymphocytes for clinical immunogene therapy of cancer. Cancer Gene Ther. 9, 613-623 (2002).
- Campeau, E., et al. A versatile viral system for expression and depletion of proteins in mammalian cells. PLoS. ONE. 4, e6529(2009).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Rajasekaran, K., et al. Signaling by Fyn-ADAP via the Carma1-Bcl-10-MAP3K7 signalosome exclusively regulates inflammatory cytokine production in NK cells. Nat. Immunol. 14, 1127-1136 (2013).
- Regunathan, J., Chen, Y., Wang, D., Malarkannan, S. NKG2D receptor-mediated NK cell function is regulated by inhibitory Ly49 receptors. Blood. 105, 233-240 (2005).
- Awasthi, A., et al. Rap1b facilitates NK cell functions via IQGAP1-mediated signalosomes. J. Exp. Med. 207, 1923-1938 (2010).
- Rajasekaran, K., et al. Transforming Growth Factor-{beta}-activated Kinase 1 Regulates Natural Killer Cell-mediated Cytotoxicity and Cytokine Production. J Biol. Chem. 286, 31213-31224 (2011).
- Wolkowicz, R., Nolan, G. P., Curran, M. A. Lentiviral vectors for the delivery of DNA into mammalian cells. Methods Mol. Biol. 246, 391-411 (2004).
- Sutlu, T., et al. Inhibition of intracellular antiviral defense mechanisms augments lentiviral transduction of human natural killer cells: implications for gene therapy. Hum. Gene Ther. 23, 1090-1100 (2012).
- Cornetta, K., Anderson, W. F. Protamine sulfate as an effective alternative to polybrene in retroviral-mediated gene-transfer: implications for human gene therapy. J. Virol. Methods. 23, 187-194 (1989).
- Toyoshima, K., Vogt, P. K. Enhancement and inhibition of avian sarcoma viruses by polycations and polyanions. Virology. 38, 414-426 (1969).
- Jensen, M., et al. The bi-specific CD3 x NCAM antibody: a model to preactivate T cells prior to tumour cell lysis. Clin. Exp. Immunol. 134, 253-263 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten