Method Article
Derivazione delle Culture leptomeningi Explant da Postmortem cervello umano donatori
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il protocollo cultura leptomeningi espianto dal post-mortem cervello umano è un modo tecnicamente robusto e semplice da ricavare fibroblasti meningei fibronectina-positivo entro 6-8 settimane e crioconservazione circa 20-30 milioni di cellule.
Abstract
Anche se è stato fatto grandi progressi nella caratterizzazione clinica della malattia di Parkinson, diversi studi riportano che la diagnosi della malattia di Parkinson non è patologicamente confermato fino al 25% della malattia diagnosi clinica di Parkinson. Pertanto, tessuti raccolti da pazienti clinicamente diagnosticata la malattia di Parkinson idiopatica può avere un alto tasso di diagnosi errate; da qui in studi in vitro da tali tessuti per studiare il morbo di Parkinson in un modello preclinico può diventare inutile.
Raccogliendo leptomeningi umani post-mortem con una diagnosi neuropatologica confermata di malattia di Parkinson e caratterizzata da perdita di cellule nigrostriatale e inclusioni proteiche intracellulari chiamati corpi di Lewy, si può essere certi che parkinsonismo clinicamente osservata non è causata da un altro processo patologico di base (ad esempio tumori, arteriosclerosi).
Questo protocollo presents la dissezione e la preparazione di leptomeningi umani post mortem per la derivazione di una cultura di fibroblasti meningea. Questa procedura è robusto e ha un alto tasso di successo. La sfida della cultura è la sterilità come l'approvvigionamento del cervello non è generalmente effettuata in condizioni di sterilità. Pertanto, è importante integrare mezzi di coltura con un cocktail di penicillina, streptomicina, e amfotericina B.
La derivazione dei fibroblasti meningei dai casi autopsia confermati con la malattia di Parkinson fornisce le basi per la modellazione in vitro di malattia di Parkinson. fibroblasti meningei compaiono 3-9 giorni dopo la preparazione del campione e circa 20-30 milioni di cellule possono essere crioconservati in 6-8 settimane. La cultura fibroblasti meningeo omogeneo e le cellule esprimono fibronectina, un marker comunemente usato per identificare meningi.
Introduzione
Meningi costituiti da tre membrane che proteggono il cervello: dura madre madre, aracnoide e pia. Più recentemente, è stato riconosciuto che meningi svolgono un ruolo importante nello sviluppo del cervello e del cervello omeostasi 1. Meningi sono derivati da mesenchimali e le cellule derivati dalla cresta neurale ed è interessante notare, è stato dimostrato che le cellule progenitrici residenti nel meningi possono dare origine a neuroni in vitro e dopo il trapianto in vivo 2, 3, 4. Culture meningi sono stati utilizzati con successo anche come strati di alimentazione, in quanto in possesso di cellule derivate da attività Indurre stromale per la differenziazione delle cellule staminali embrionali in neuroni dopaminergici 5. Inoltre, leptomeningi hanno il potenziale di differenziarsi direttamente in neuroni, astrociti, oligodendrociti e in condizioni ischemiche 6.
Per questo protocollo, meningi post-mortem umani campioni sono raccolti presso l'aracnoide e pia, chiamati collettivamente le leptomeningi, e sono acquistati come parte di una donazione cervello umano per scopi di ricerca. La dissezione del cervello viene eseguita entro 24 ore di morte e il campione leptomeningi è collocato in terreni di crescita a freddo per l'ulteriore elaborazione entro il prossimo 6-8 h, come illustrato qui in questo protocollo.
Questo protocollo descrive la dissezione e preparazione dei campioni meningi umani per lo sviluppo della coltura cellulare leptomeningi primarie paziente. Il tessuto viene tagliato in 25-30 pezzi di circa 3 mm x 3 mm quadrati. Tre pezzi sono collocati in ogni 6 pozzetti di gelatina rivestite bene e tenuto premuto con coprioggetto di vetro rotondo. La dissezione meningi dura circa 25-35 minuti. La sfida principale con questa cultura è la sterilità come l'approvvigionamento del cervello, dei trasporti, e la dissezione non sono generalmente eseguite in condizioni sterili. Therefore, è importante integrare mezzi di coltura con un cocktail di penicillina, streptomicina, e amfotericina B e utilizzare piatti multi-pozzetto per separatamente pezzi di tessuto di coltura.
Conseguenza di fibroblasti meningei si verifica di solito entro la prima settimana. Media viene cambiata ogni due o tre giorni fino a quando le cellule sono confluenti e le cellule sono enzimaticamente diversi passaggi. I fibroblasti meningei sono crioconservati a 1 milione di cellule per mL / flacone in mezzi crioconservazione. Con questo protocollo, 20-30 milioni di fibroblasti meningei possono essere derivate in 6-8 settimane per la crioconservazione. applicazioni a valle di questi fibroblasti meningei sono colture primarie per la ricerca sulle malattie, la differenziazione neuronale diretta o derivazione di cellule staminali pluripotenti indotte dalle leptomeningi per la comprensione dei meccanismi della malattia e per lo sviluppo di farmaci.
Protocollo
La registrazione donazione del cervello include la documentazione dal dichiarante della loro intenzione di donare. Il permesso autopsia per il recupero dei tessuti è fornito dal parente più prossimo di quanto consentito dalla legge. Gli studi di ricerca che utilizzano i campioni autoptici raccolti sono esaminati dal comitato di revisione istituzionale (IRB) per garantire il rispetto Health Insurance Portability e Accountability Act regolamenti (HIPAA).
NOTA: i campioni leptomeningi vengono raccolti dal dissector cerebrale o neuropathologist durante una dissezione del cervello e sono memorizzati in 50 provette coniche ml contenente 25-30 ml meningi terreni di coltura. Il campione viene conservato a 4 ° C fino preparazione del campione. Il trattamento deve essere eseguita appena possibile la vitalità delle cellule diminuisce con il tempo post mortem.
1. Set-up prima di iniziare la leptomeningi Dissection
NOTA: i passaggi 1,1-1,3 sono da eseguire all'interno di un armadio biosicurezza.
- Preparare mezzi di crescita meningi combinando 375 mL di Dulbecco Modified Eagle Media, 100 mL di siero fetale bovino, 5 mL 10 mM aminoacidi non essenziali, 5 mL 200 mM di L-alanil-L-glutammina, 5 mL 100 mM di sodio piruvato, 5 ml 10.000 U / mL di penicillina / streptomicina e 5 ml 250 mg / ml amfotericina B in 500 unità filtro mL. Filtrare e mescolare. Utilizzare supporti fino a quattro settimane.
- Mettere tutti i materiali nell'armadio biosicurezza prima di iniziare la dissezione: piatti 4x Petri, 2x 6 pozzetti, 2x bisturi, 15-20 sterilizzati coprioggetto 15 mm, tampone fosfato salino (PBS), pipette sierologiche, aspirando pipette.
- Aggiungere 1 mL di soluzione sterile autoclavato gelatina 0,1% a ciascun pozzetto di una piastra da 6 pozzetti. Impostare la piastra da parte per 30-60 min. Preparare 2x 6 pozzetti.
2. Preparazione del campione leptomeningi
NOTA: i passaggi 2,1-2,3 sono da eseguire all'interno di un armadio biosicurezza.
- Aggiungere circa 10 ml di soluzione salina insterile 10-cm piatto di coltura tissutale e posizionare il campione meningi nel piatto. Utilizzando pinze, lavare delicatamente leptomeningi con PBS per rimuovere il sangue.
- Trasferire le meningi in un nuovo 10-cm piatto di coltura tissutale contenente 10 ml di PBS fresco e continuare lavaggio. Ripetere se necessario rimuovere tutto il sangue possibile.
- Utilizzando due bisturi, tagliate leptomeningi tessuto in un circa 6 cm x 6 cm grosso pezzo.
- Mettere il coperchio su un piatto di coltura e trasferimento ad un microscopio da dissezione in una cappa a flusso laminare orizzontale.
3. La dissezione di leptomeningi Tissue
NOTA: passi 3.1 - 3.3 devono essere eseguite all'interno di una cappa a flusso laminare orizzontale utilizzando un microscopio da dissezione.
- Rimuovere vasi sanguigni da una regione sul pezzo leptomeningi (passo 2.3) sufficiente per creare almeno 20-25 3 parti mm x 3 mm. Tenere le leptomeningi in posizione con una bisturi e con l'altra, usare un dolce e poco profondo mo raschiandozione per separare i vasi.
- Tagliare piccoli quadrati di tessuto dalla zona preparata. Tagliare in un processo graduale facendo prima pezzi più grandi e quindi affettare quelli in sezioni più piccole.
- Utilizzare uno scalpello per tenere il tessuto in luogo e un altro bisturi per tagliare il tessuto con un movimento rotatorio. La consistenza del tessuto, è difficile far scorrere i bisturi contro l'altro. Questo sarà strappare solo il tessuto a parte e si traduce in bordi frastagliati.
- Continuare a tagliare i pezzi a metà fino a quando ci sono circa 20-25 pezzi 3 mm x 3 mm.
4. Trasferimento di Dissected meningi Pezzi su piastre di coltura tissutale
NOTA: Passo 4 deve essere eseguito all'interno di un armadio biosicurezza.
- Aspirare la gelatina da 6 pozzetti (dal punto 1.3). Aggiungere 1 ml di terreni di crescita meningi in ciascun pozzetto. Utilizzando pinze sterili, posizionare 3-4 pezzi di biopsia in tutti i pozzetti.
5. collocamento di Slips copertura sopra Meninges Pezzi
NOTA: I passaggi 5.1 - 5.2 sono essere eseguite all'interno di una cappa a flusso laminare orizzontale utilizzando un microscopio da dissezione.
- Coprire i pezzi con 1-2 15 mm vetrini circolari sterili per bene.
- Premere saldamente con una pinza per garantire i pezzi tocchino il fondo della piastra. Questo permette il collegamento dei pezzi di tessuto al fondo del pozzo.
- Posizionare il 6 pozzetti in un 37 ° C, 5% CO 2 incubatore.
6. colture cellulari Manutenzione
NOTA: i passaggi 6,1-6,3 sono da eseguire all'interno di un armadio biosicurezza. Maneggiare piatti della cultura con cura, come vetrini non dovrebbero muovere e rimuovere i pezzi meningi.
- Dopo 2 giorni di coltura, aggiungere un ulteriore 1 ml di terreni di crescita meningi fresco in ogni pozzetto.
- A 7 giorni, aspirare accuratamente i media e aggiungere 2 ml di mezzi freschi in ciascun pozzetto.
- Dopo 9 ° giorno, continuerà a cambiare i media di crescita ognialtro giorno fino a quando la cultura diventa confluenti.
7. Passaging
NOTA: Tutte le fasi devono essere eseguite all'interno di un armadio biosicurezza. Una volta che i fibroblasti meningei sono migrati fuori dei pezzi di tessuto meningea e iniziare a crescere verso i bordi del recipiente di coltura, espandere fibroblasti meningei nella più grande capsula di Petri.
- Prima di iniziare la passaging, cappotto piatto cultura con l'1% di gelatina per 15-30 min.
- supporti Aspirare da 6-ben piatto e lavare le cellule con 2 ml di PBS.
- Aggiungere 1 ml di tripsina / EDTA a ciascun pozzetto e incubare a 37 ° C per 5-10 min. Non è necessario rimuovere i vetrini coprioggetto o il tessuto meningeo per questo passo.
- Quando le cellule sono arrotondate e si cominciano a staccare, aggiungere 2 ml di terreni di coltura.
- cellule Pipetta su e giù per distruggere completamente tutti i grumi e trasferire la soluzione cella più grande piatto di coltura.
- Utilizzare un rapporto di 1: 3 a 1: 4 a combinare le cellule da tre piatti 6 pozzetti ina un piatto della cultura T75.
- Una volta che le cellule fibroblasti meningee sono confluenti in T75 fiasche di coltura, le cellule trypsinize, e crioconservazione nei mezzi di crioconservazione a 1x10 6 cellule / ml per fiala. Un T75 pallone di coltura con fibroblasti meningei confluenti contiene circa 5-7 milioni di cellule.
8. Caratterizzazione dei fibroblasti meningei mediante immunocolorazione
NOTA: Prima di iniziare la procedura, preparare una soluzione di paraformaldeide al 4%, 5% di siero normale di capra in PBS (tampone bloccante), 0,3% Triton X-100 in PBS (tampone di permeabilizzazione), soluzioni di anticorpi primari e secondari, e 1 mg / mL di Hoechst 33342 diluito in PBS da 10 mg / ml magazzino.
- Seed 15.000 a 30.000 fibroblasti meningei a 8-ben scorrevole camera rivestite con 0,1% di gelatina.
- Dopo 24 ore quando sono attaccate le cellule, fissare le cellule in 100 microlitri 4% paraformaldeide per pozzetto per 10 min a temperatura ambiente. Lavare i pozzetti 3 volte con PBS 1x.
- Permeabilize le cellule con 150 ml di 0,3% Triton X-100 per 5 min a temperatura ambiente. Lavare i pozzetti 3 volte con PBS 1x.
- Aggiungere 200 microlitri soluzione bloccante (PBS + 5% siero di capra normale) per 1 ha temperatura ambiente.
- Aspirare la soluzione di saturazione, e aggiungere 150 ml di anticorpi primari desiderati diluiti in soluzione bloccante. Per doppia colorazione, preparare diluizioni di lavoro di anticorpi primari in provette da centrifuga separati su ghiaccio come segue:
- Preparare 1: 300 diluizione anti-fibronectina + 1: 200 diluizione anti-nestina in soluzione bloccante. Preparare 1: 250 diluizione anti-SERPINH1 + 1: 1000 diluizione anti-TUJ1 in soluzione bloccante. Preparare 1: 250 diluizione anti-SERPINH1 + diluizione 1: 100 di anticorpi anti-SOX2 in soluzione bloccante
- Incubare a 4 ° C durante la notte.
- Lavare i pozzetti 3 volte con PBS 1x.
- Preparare un lavoro 1: 400 diluizione fluorescente anticorpi secondari di capra anti-coniglio (verde; Ex / Em 2 495/519 nm) e di capra anti-topo (rosso; Ex / Em 2 590/617 nm) in soluzione di bloccaggio e aggiungere 100 microlitri di ogni bene. Incubare per 1 ora, al buio, a temperatura ambiente. Quindi lavare i pozzetti una volta con PBS 1x.
- Aggiungere 100 ml di 1 mg / ml Hoechst 33342 (blu; Ex / Em 2 358/461 nm) soluzione ad ogni pozzetto ed incubare al buio per 3 min. Lavare pozzetti 3 volte con PBS 1x, lasciando in finale di lavaggio PBS 1x nel pozzo, e coprire il vetrino con foglio di alluminio.
- Analizzare le cellule al microscopio a fluorescenza.
Risultati
Quando il protocollo di trasformazione leptomeningi ha avuto successo, conseguenza di fibroblasti meningei prima si osserva tre a nove giorni dopo la dissezione, anche se questo può dipendere dalla lunghezza dell'intervallo post-mortem per il cervello. La figura 1 mostra colture di fibroblasti meningei di quattro diversi donatori. La figura 1A mostra un pezzo leptomeningi tenuto premuto da una scivolata copertura in vetro (linea diagonale scuro) e fibroblasti escrescenza intorno al tessuto quattro giorni dopo l'elaborazione da un 88-year-old donatore con 10 h 20 min intervallo post-mortem. Figura 1B mostra scarsa fibroblasti conseguenza sette giorni dopo l'elaborazione da un donatore di 70 anni e 11 h 45 min intervallo post-mortem. La figura 1C mostra fibroblasti escrescenza 13 giorni dopo la dissezione da un 88-year-old donatore e 24 ore intervallo post-mortem. Figura 1D mostra una cultura confluenti che è stato diversi passaggi in una Vess T75el e cellule possono essere crioconservati in questa fase.
Fibroblasti meningei sono bipolare o multipolare e hanno allungato o forme irregolari (Figura 2). Essi sono caratterizzati dall'espressione di glicoproteina fibronectina e marcatore fibroblasti SERPINH che si localizza al reticolo endoplasmatico (figure 2A-2C). Fibroblasti meningei non sono immuno-reattivi al fattore di trascrizione SRY (Sex Determinazione Regione Y) -Box 2 (SOX2), che è un marker per le cellule staminali indifferenziate (Figura 2A). Tuttavia, un sottoinsieme dei fibroblasti leptomeningee è positivo per tipo VI filamento intermedio nestina, un marcatore di cellule staminali neurali (Figura 2B), e la classe specifica dei neuroni III beta-tubulina (TUJ1) (Figura 2C).

Figura 1.Esempi di conseguenza di fibroblasti meningei provenienti da quattro diversi donatori. A) pezzo di tessuto leptomeningi viene tenuto premuto da un vetrino di vetro (linea diagonale scuro) e fibroblasti conseguenza tutto il tessuto è stato osservato quattro giorni dopo l'elaborazione da un 88-year-old donatore con 10 h 20 min intervallo post-mortem. B) Sparse fibroblasti escrescenza sette giorni post-elaborazione da un donatore di 70 anni e 11 h 45 min intervallo post-mortem. C) meningea fibroblasti escrescenza 13 giorni dopo la dissezione da un 88-year-old donatore e 24 ore intervallo post-mortem. D) confluenti cultura meningea fibroblasti diversi passaggi in un recipiente T75. Clicca qui per vedere una versione più grande di questa figura.
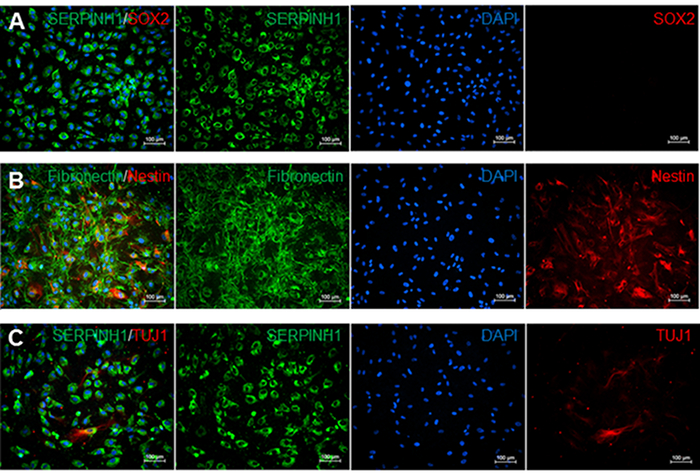
Figura 2. Immunost aining per meningi, cellule staminali, cellule staminali neurali, e marcatori neuronali. A) colorazione immunofluorescenza per i marcatori di fibroblasti SERPINH1 (verde) e staminali marker delle cellule SOX2 (rosso). SERPINH1 era espresso in tutti i nuclei delle cellule contate. Staminali marcatore della cella SOX2 non è stato rilevato in questi cultura leptomeningi. B) colorazione immunofluorescenza per specifici-meningi marcatore fibronectina (verde) e marker delle cellule staminali neurali Nestin (rosso). 52,1% dei nuclei cellulari contati sono stati positivi sia per nestina e fibronectina. C) colorazione immunofluorescenza per SERPINH1 (verde) e TUJ1 marcatore neuronale (rosso). 6,9% dei nuclei contati era positivo per SERPINH1 e TUJ1. dati di conteggio delle cellule sono stati determinati utilizzando il manuale cellulare Contro Multi-Select strumento su ImageJ. immagini macchiate singole sono state valutate contando il numero di cellule DAPI-positive rispetto al numero di cellule positive per ciascun marcatore percentuali.lank "> Clicca qui per vedere una versione più grande di questa figura.
| Giorno | Risultati aspettati | |||||
| 3-9 | Conseguenza del primo fibroblasti meningei. | |||||
| 7-18 | fibroblasti meningei si espandono, e la cultura diventa più densa. Cambio media di 2 ml a giorni alterni. | |||||
| 18-25 | 6 pozzetti diventa confluenti, una volta fibroblasti meningee sono confluenti combinare tre pozzi in un pallone di coltura T75 (passaggio a 1: 3 a 1: 4). | |||||
| 26-45 | Un confluenti risultati pallone di coltura T75 in 5-7 milioni di cellule. Cryopreserve fibroblasti meningei a 1 milione di cellule / flacone. | |||||
linguettaLe 1: Timeline di escrescenza cellulare.
Discussione
Questo protocollo descrive un protocollo semplice e robusto per derivare una coltura di fibroblasti meningeo da leptomeningi post-mortem umani raccolti in combinazione con una donazione cervello. Ci sono pochissime le descrizioni di protocolli per ricavare colture di cellule dal materiale umano post-mortem. Due studi descrivono la pelle derivati da colture di fibroblasti 7, 8, 9, uno studio descrive campioni Dura 10, e un altro descrive non crioconservati campioni Dura congelato 11.
Prepariamo due 6 pozzetti con 2-3 pezzi di tessuto (circa 3 mm x 3 mm) in ciascun pozzetto per garantire escrescenza sufficiente e di espansione prima di crioconservazione. E 'fondamentale che i pezzi meningi sono attaccati al piatto cultura, pressatura soffice uno sterile vetrino di vetro sui pezzi di tessuto per tenerli in luogo. Senza un vetrino, le meningi pezzi non sarannot allegare al fondo del piatto cultura. escrescenza successo si osserva solo quando i pezzi di tessuto sono a diretto contatto con il fondo in plastica. Se i pezzi di tessuto galleggiano in terreni di coltura, non si osserva alcuna conseguenza delle cellule dal tessuto. Questo dovrebbe essere eseguita con circa 500 ml di crescita media per non seccare i campioni e poi aggiungere fino a 1 ml di terreni di crescita alla nave. Non è necessario utilizzare ulteriormente silicone per tenere le coprioggetto in posizione.
Se i pezzi sono più piccole di 3 mm x 3 mm, la conseguenza è più lento e in alcuni casi non culture confluenti può essere stabilita. E 'fondamentale per non far crescere le cellule troppo scarsa e si consiglia un rapporto di divisione di 1: 3 a 1: 4. I singoli piccoli pozzi consentono una migliore gestione possibile contaminazione. Wells possono essere alimentati singolarmente e pipette devono essere modificati tra i pozzi.
Abbiamo derivato con successo fibroblasti meningei da 9 campioni post-mortem con un po 'stmortem intervallo tra 10-24 h. I donatori sono stati tra i 70 ei 88 anni di età e hanno una durata di malattia di malattia di Parkinson tra 8-31 anni. Notiamo che i tessuti con un intervallo post mortem più richiedono più tempo prima che le prime cellule crescono (fino a 9 giorni). In campioni con più breve intervallo post mortem, osserviamo conseguenza, non appena 3 giorni dopo la preparazione. Non abbiamo notato una differenza nella crescita in base all'età del donatore, ma abbiamo avuto solo i donatori> 70 anni.
L'importanza del metodo è la derivazione di una coltura cellulare primaria per una malattia neurodegenerativa sporadica come il morbo di Parkinson, che può solo attualmente essere confermata all'autopsia 12, 13, 14 poiché non ci sono pienamente alla definizione delle caratteristiche cliniche, tecniche di imaging o biomarcatori che possono fornire una diagnosi definitiva durante la vita 15. Abbiamo già svipato un protocollo per la derivazione di fibroblasti da biopsie cutanee soprattutto per i casi geneticamente confermati della malattia di Parkinson 16 che ci hanno permesso di generare cellule staminali pluripotenti indotte e studiare meccanismi di malattia 17, 18, ma questo nuovo protocollo sarà cruciale per confrontare direttamente i cambiamenti neuropatologici con i risultati in vitro per la malattia di Parkinson sporadica. A nostra conoscenza, questo è il primo protocollo derivante fibroblasti meningei da leptomeningi umani post mortem.
Colture di fibroblasti meningei possono essere direttamente utilizzati per lo studio dei meccanismi molecolari per la malattia o lesioni o come fonte per la riprogrammazione nucleare in cellule staminali pluripotenti indotte o conversione diretta in colture neuronali come modelli preclinici avanzati per la malattia di Parkinson sporadica o altre patologie neurodegenerative 19. questi humodelli derivati da pazienti man forniscono le basi e accelerare i progressi nel campo della medicina personalizzata e rigenerativa.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Development of this protocol was funded by private donations directed to the Parkinson's Institute Brain Donation Program.
Materiali
| Name | Company | Catalog Number | Comments |
| Corning Petri dishes | Fisher Scientific | 351029 | |
| Nunc 6-well plate | Fisher Scientific | 14-832-11 | |
| 15-mm cover slips | Fisher Scientific | 12-545-83 15CIR-1D | |
| Scalpels, sterile blade, No. 15 | Miltex | 4-415 | |
| Curved precision tip forceps | Fisher Scientific | 16-100-122 | |
| Serological pipettes | Fisher Scientific | 13-678-11E | |
| Pasteur pipettes | Fisher Scientific | 22-230490 | |
| Gelatin | Sigma | G1890-100G | |
| Phosphate Buffer Saline | Fisher Scientific | SH30264.02 | |
| Corning 500 mL filter unit | Fisher Scientific | 430770 | Combine media components and filter. |
| Nunc Cell Culture Treated Flasks with Filter Caps, T175 cm2 | Thermo Scientific | 178883 | |
| Name | Company | Catalog Number | Comments |
| Growth Media | |||
| Hyclone DMEM | Fisher Scientific | SH30081.02 | |
| Hyclone FBS | Fisher Scientific | SH30910.03 | |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher | 11140-050 | |
| GlutaMAX Supplement (100x) | Thermo Fisher | 35050-061 | |
| Sodium Pyruvate (100 mM) | Thermo Fisher | 11360-070 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher | 15140-122 | |
| Amphotericin B (Yellow Solution/250 µg/mL) | Fisher Scientific | BP264520 | |
| Bambanker Freeze 120 mL | Fisher Scientific | NC9582225 | |
| Name | Company | Catalog Number | Comments |
| Fibronectin Staining | |||
| 8 well chamber slides | Fisher Scientific | 1256518 | |
| 20% paraformaldehyde | Electron Microscopy Sciences | 15713 | |
| Triton X-100 | Sigma | T8787 | |
| 100% Glycerol | BioRad | 9455 | |
| 100% normal goat serum | Fisher Scientific | 101098-382 | |
| Anti-Fibronectin antibody [F1] | Abcam | ab32419 | 1:300 dilution in blocking solution |
| Anti-SERPINH1 | Sigma | S5950-200ul | 1:250 dilution in blocking solution |
| Anti-SOX2 | Millipore | MAB4343 | 1:100 dilution in blocking solution |
| Anti-Nestin | Millipore | MAB5326 | 1:200 dilution in blocking solution |
| Anti-TUJ1 | Covance | MMS-435P | 1:1,000 dilution in blocking solution |
| Alexa Fluor 488 anti-rabbit | Thermo Fisher | A11029 | 1:400 dilution in blocking solution; (green channel; Ex/Em2 495/519 nm) |
| Alexa Fluor 555 anti-mouse | Thermo Fisher | A21424 | 1:400 dilution in blocking solution; (red channel; Ex/Em2 590/617 nm) |
| Hoechst 33342 stain | Thermo Fisher | H3570 | dilute to a final concentration of 1.0 μg/mL; (blue channel; Ex/Em2 358/461 nm) |
| Suppliers are suggestions, similar products from alternative vendors can be used as well. | |||
Riferimenti
- Decimo, I., Fumagalli, G., Berton, V., Krampera, M., Bifari, F. Meninges: from protective membrane to stem cell niche. Am J Stem Cells. 1 (2), 92-105 (2012).
- Bifari, F., et al. Novel stem/progenitor cells with neuronal differentiation potential reside in the leptomeningeal niche. J Cell Mol Med. 13 (9B), 3195-3208 (2009).
- Bifari, F., et al. Meninges harbor cells expressing neural precursor markers during development and adulthood. Front Cell Neurosci. 9, 383(2015).
- Decimo, I., Bifari, F., Krampera, M., Fumagalli, G. Neural stem cell niches in health and diseases. Curr Pharm Des. 18 (13), 1755-1783 (2012).
- Hayashi, H., et al. Meningeal cells induce dopaminergic neurons from embryonic stem cells. Eur J Neurosci. 27 (2), 261-268 (2008).
- Nakagomi, T., et al. Leptomeningeal-derived doublecortin-expressing cells in poststroke brain. Stem Cells Dev. 21 (13), 2350-2354 (2012).
- Hjelm, B. E., et al. Induction of pluripotent stem cells from autopsy donor-derived somatic cells. Neurosci Lett. 502 (3), 219-224 (2011).
- Hjelm, B. E., et al. In vitro-differentiated neural cell cultures progress towards donor-identical brain tissue. Hum Mol Genet. 22 (17), 3534-3546 (2013).
- Meske, V., Albert, F., Wehser, R., Ohm, T. G. Culture of autopsy-derived fibroblasts as a tool to study systemic alterations in human neurodegenerative disorders such as Alzheimer's disease--methodological investigations. J Neural Transm (Vienna). 106 (5-6), 537-548 (1999).
- Bliss, L. A., et al. Use of postmortem human dura mater and scalp for deriving human fibroblast cultures. PLoS One. 7 (9), e45282(2012).
- Sproul, A. A., et al. Generation of iPSC lines from archived non-cryoprotected biobanked dura mater. Acta Neuropathol Commun. 2, 4(2014).
- Adler, C. H., et al. Low clinical diagnostic accuracy of early vs advanced Parkinson disease: clinicopathologic study. Neurology. 83 (5), 406-412 (2014).
- Hughes, A. J., Daniel, S. E., Kilford, L., Lees, A. J. Accuracy of clinical diagnosis of idiopathic Parkinson's disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry. 55 (3), 181-184 (1992).
- Hughes, A. J., Daniel, S. E., Lees, A. J. Improved accuracy of clinical diagnosis of Lewy body Parkinson's disease. Neurology. 57 (8), 1497-1499 (2001).
- Langston, J. W., Schüle, B., Rees, L., Nichols, R. J., Barlow, C. Multisystem Lewy body disease and the other parkinsonian disorders. Nature Genetics. 47 (12), 1378-1384 (2015).
- Vangipuram, M., Ting, D., Kim, S., Diaz, R., Schüle, B. Skin punch biopsy explant culture for derivation of primary human fibroblasts. J Vis Exp. (77), e3779(2013).
- Byers, B., et al. SNCA triplication Parkinson's patient's iPSC-derived DA neurons accumulate alpha-synuclein and are susceptible to oxidative stress. PLoS One. 6 (11), e26159(2011).
- Sanders, L. H., et al. LRRK2 mutations cause mitochondrial DNA damage in iPSC-derived neural cells from Parkinson's disease patients: reversal by gene correction. Neurobiol Dis. 62, 381-386 (2014).
- Beevers, J. E., Caffrey, T. M., Wade-Martins, R. Induced pluripotent stem cell (iPSC)-derived dopaminergic models of Parkinson's disease. Biochem Soc Trans. 41 (6), 1503-1508 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon