Method Article
Derivación de las leptomeninges de explantes de culturas postmortem Humanos Los donantes de cerebro
* Estos autores han contribuido por igual
En este artículo
Resumen
El protocolo de cultivo de explante de leptomeninges cerebral postmortem humana es una forma técnicamente robusto y sencillo para derivar los fibroblastos meníngeos fibronectina positiva dentro de 6-8 semanas y criopreservar aproximadamente 20-30 millones de células.
Resumen
A pesar de que se han hecho grandes avances en la caracterización clínica de la enfermedad de Parkinson, varios estudios indican que el diagnóstico de la enfermedad de Parkinson no está confirmado patológicamente en hasta el 25% de las enfermedades clínicamente diagnosticados de Parkinson. Por lo tanto, el tejido recogido de pacientes con diagnóstico clínico de enfermedad de Parkinson idiopática pueden tener una alta tasa de diagnóstico erróneo; por lo tanto, en estudios in vitro a partir de tales tejidos para estudiar la enfermedad de Parkinson como un modelo preclínico puede llegar a ser inútil.
Mediante la recopilación de las leptomeninges humanos postmortem con un diagnóstico neuropatológico confirmado de la enfermedad de Parkinson y que se caracteriza por la pérdida de células nigroestriatal y las inclusiones de proteínas intracelulares llamadas cuerpos de Lewy, uno puede estar seguro de que el parkinsonismo clínicamente observada no es causada por otra enfermedad subyacente (por ejemplo, tumores, arteriosclerosis).
Este protocolo presents la disección y preparación de las leptomeninges de cadáver utilizadas para derivación de un cultivo de fibroblastos meníngea. Este procedimiento es robusto y tiene una alta tasa de éxito. El reto de la cultura es la esterilidad como la adquisición cerebro generalmente no se lleva a cabo en condiciones estériles. Por lo tanto, es importante para complementar los medios de cultivo con un cóctel de penicilina, estreptomicina y anfotericina B.
La derivación de los fibroblastos meníngeos de casos confirmados de la autopsia con la enfermedad de Parkinson proporciona la base para el modelado in vitro de la enfermedad de Parkinson. fibroblastos meníngeos aparecen 3-9 días después de la preparación de la muestra y cerca de 20-30 millones de células pueden ser criopreservados en 6-8 semanas. El cultivo de fibroblastos meníngea es homogénea y las células expresan la fibronectina, un marcador utilizado comúnmente para identificar meninges.
Introducción
Meninges consisten en tres membranas que protegen el cerebro: la duramadre, la aracnoides y la piamadre. Más recientemente, se ha reconocido que meninges también juegan un papel importante en el desarrollo del cerebro y el cerebro homeostasis 1. Meninges se derivan de mesenquimales y células derivadas de la cresta neural y de manera interesante, se ha demostrado que las células progenitoras que residen en meninges puede dar lugar a neuronas in vitro y después del trasplante in vivo 2, 3, 4. Culturas Meninges han sido también utilizado con éxito como capas de alimentación, ya que poseen actividad inductora de derivado de células del estroma para la diferenciación de células madre embrionarias en neuronas dopaminérgicas 5. Por otra parte, leptomeninges tienen el potencial de diferenciarse directamente en neuronas, astrocitos y oligodendrocitos en condiciones isquémicas 6.
Para este protocolo, humanos muestras postmortem meninges se recogen de la aracnoides y la piamadre, llamados colectivamente las leptomeninges, y se adquieren como parte de una donación de cerebro humano con fines de investigación. La disección del cerebro se lleva a cabo dentro de las 24 h de la muerte y la muestra leptomeninges se coloca en medio de cultivo frío para su posterior procesamiento en el próximo 6-8 h como se ilustra aquí en este protocolo.
Este protocolo describe la disección y preparación de muestras meninges humanos para el desarrollo de cultivo de células primarias leptomeninges paciente. El tejido se corta en piezas de aproximadamente 25-30 3 mm x 3 mm cuadrados. Tres piezas se colocan en cada uno de 6 pocillos recubiertos de gelatina bien y se mantiene presionada con cubreobjetos de vidrio redondos. La disección de las meninges toma alrededor de 25-35 minutos. El principal reto con esta cultura es la esterilidad como la adquisición del cerebro, el transporte, y la disección generalmente no se llevan a cabo en condiciones estériles. Tor lo tanto, es importante para complementar los medios de cultivo con un cóctel de penicilina, estreptomicina y anfotericina B y el uso de platos de múltiples pocillos de cultivo de tejidos por separado piezas.
Consecuencia de fibroblastos meníngeos ocurre generalmente dentro de la primera semana. Medios se cambia cada dos o tres días hasta que las células son confluentes y las células se pasan enzimáticamente. Los fibroblastos meníngeos son criopreservados en 1 millón de células por ml / vial en los medios de crioconservación. Con este protocolo, 20-30 millones de fibroblastos meníngeos se pueden derivar en 6-8 semanas para la criopreservación. aplicaciones posteriores de estos fibroblastos meníngeos son cultivos primarios para la investigación de enfermedades, la diferenciación neuronal directa o derivación de células madre pluripotentes inducidas a partir de las leptomeninges para la comprensión de los mecanismos de la enfermedad y para el desarrollo de fármacos.
Protocolo
El registro de la donación de cerebro incluye documentación por el solicitante de registro de su intención de donar. El permiso de la autopsia para la recuperación de los tejidos es proporcionada por los familiares de lo permitido por la ley. Los estudios de investigación utilizando muestras de autopsia recogidos son revisados por la Junta de Revisión Institucional (IRB) para garantizar el cumplimiento de portabilidad del seguro médico y reglamentos de la Ley de Responsabilidades (HIPAA).
Nota: Las muestras leptomeninges son recogidos por el disector de cerebro o neuropathologist durante una disección cerebro y se almacenan en tubos cónicos de 50 ml que contenían 25-30 ml meninges medio de crecimiento. La muestra se almacena a 4 ° C hasta que la preparación de muestras. El tratamiento debe realizarse lo más pronto posible ya que la viabilidad de las células disminuye con el tiempo de post mortem.
1. Puesta en marcha antes de iniciar la disección leptomeninges
NOTA: Los pasos 1.1 a 1.3 se va a realizar dentro de una cabina de bioseguridad.
- Preparar medio de crecimiento meninges combinando 375 ml de Dulbecco modificado de Eagle Media, 100 ml de suero bovino fetal, 5 ml 10 mM de aminoácidos no esenciales, 5 ml 200 mM L-alanil-L-glutamina, 5 ml de piruvato sódico 100 mM, 5 ml 10000 U / ml de penicilina / estreptomicina y 5 ml 250 mg / ml de anfotericina B en 500 ml unidad de filtro. Filtrar y mezclar. Utilizar los medios de comunicación para un máximo de cuatro semanas.
- Coloque todos los materiales en la cabina de bioseguridad antes de comenzar la disección: platos de Petri 4x, 2x placas de 6 pocillos, 2x escalpelos, 15-20 esterilizados cubreobjetos de 15 mm, tampón fosfato salino (PBS), pipetas serológicas, aspirando pipetas.
- Añadir 1 ml de solución estéril en autoclave gelatina 0,1% a cada pocillo de una placa de 6 pocillos. Ajuste el plato a un lado durante 30-60 minutos. Preparar 2x placas de 6 pocillos.
2. Preparación de la muestra leptomeninges
NOTA: Los pasos 2.1 a 2.3 se va a realizar dentro de una cabina de bioseguridad.
- Añadir aproximadamente 10 ml de PBS paraa 10 cm placa de cultivo tisular estéril y coloque la muestra meninges en el plato. Con unas pinzas, lavar suavemente leptomeninges con PBS para eliminar la sangre.
- La transferencia de las meninges en un nuevo 10-cm placa de cultivo de tejido que contenía 10 ml de PBS fresco y seguir lavando. Repetir si es necesario para eliminar la mayor cantidad de sangre posible.
- El uso de dos escalpelos, cortados leptomeninges tejido en un aproximado de 6 cm x 6 cm pedazo grande.
- Coloque la tapa sobre una placa de cultivo y la transferencia a un microscopio de disección en una campana de flujo laminar horizontal.
3. La disección de tejidos de leptomeninges
NOTA: Los pasos 03.01 a 03.03 se va a realizar dentro de una campana de flujo laminar horizontal usando un microscopio de disección.
- Eliminar los vasos sanguíneos de una región en la pieza leptomeninges (paso 2.3) lo suficientemente grande como para crear al menos 20-25 3 piezas mm x 3 mm. Mantenga las leptomeninges en su lugar con una bisturí y con la otra, utilizar un mo raspado suave y poco profundación para separar los vasos.
- Cortar pequeños cuadrados de tejido de la región preparados. Cortar en un proceso por etapas primero haciendo pedazos más grandes y luego cortar los en secciones más pequeñas.
- Utilice uno bisturí para mantener el tejido en su lugar y otro bisturí para cortar el tejido con un movimiento de balanceo. Debido a la consistencia del tejido, es difícil deslizar los escalpelos uno contra el otro. Esto sólo se rasgará el tejido aparte y los resultados en los bordes desiguales.
- Continuar el corte de las piezas por la mitad hasta que hay alrededor de 20-25 piezas de 3 mm x 3 mm.
4. Transferencia de disecado meninges piezas en tejido Placas de Cultivo
NOTA: El paso 4 se va a realizar dentro de una cabina de bioseguridad.
- Aspirar la gelatina de la placa de 6 pocillos (del paso 1.3). Añadir 1 ml de medio de crecimiento de las meninges a cada pocillo. El uso de pinzas estériles, coloque 3-4 piezas de biopsia en cada pocillo.
5. Colocación de la cubierta se desliza sobre MPiezas eninges
NOTA: Los pasos 5.1 a 5.2 se va a realizar dentro de una campana de flujo laminar horizontal usando un microscopio de disección.
- Cubrir las piezas con 1-2 de 15 mm cubreobjetos circulares estériles por pocillo.
- Presione hacia abajo firmemente con unas pinzas para asegurar las piezas estén en contacto con la parte inferior de la placa. Esto permite la unión de piezas de tejido a la parte inferior del pozo.
- Coloque la placa de 6 pocillos en un 37 ° C, 5% de CO2.
6. Mantenimiento de Cultivos Celulares
NOTA: Los pasos 6.1 a 6.3 se va a realizar dentro de una cabina de bioseguridad. Manejar con cuidado las placas de cultivo como cubreobjetos no deben mover y desplazar las piezas meninges.
- Después de 2 días de cultivo, añadir 1 ml adicionales de medio de cultivo fresco meninges a cada pocillo.
- En el día 7, aspirar con cuidado los medios de comunicación y añadir 2 ml de medio fresco a cada pocillo.
- Después Día 9, seguirá cambiando cada medio de crecimientodos días hasta que se convierte en la cultura confluente.
7. pases
NOTA: Todos los pasos deben ser realizados dentro de una cabina de bioseguridad. Una vez que los fibroblastos meníngeos han emigrado fuera de las piezas de tejido meníngeas y empezar a crecer hacia los bordes del recipiente de cultivo, ampliar fibroblastos meníngeos en placa de cultivo más grande.
- Antes de iniciar el passaging, capa la placa de cultivo con 1% de gelatina durante 15-30 min.
- Aspirar los medios de placa de 6 pocillos y lavar las células con 2 ml de PBS.
- Añadir 1 ml de tripsina / EDTA a cada pocillo y se incuba a 37 ° C durante 5 a 10 min. No es necesario retirar los cubreobjetos o el tejido meníngeo para este paso.
- Cuando las células se redondean y se empiezan a separar, añadir 2 ml de medio de cultivo.
- Las células de la pipeta hacia arriba y abajo para interrumpir por completo todos los grumos y transferir la solución de células de placa de cultivo más grande.
- Utilice una relación de 1: 3 a 1: 4 para combinar las células de los tres platos de 6 pocillos ena una placa de cultivo T75.
- Una vez que las células fibroblastos meníngeos son confluentes en matraces de cultivo T75, trypsinize las células, y criopreservar en los medios de crioconservación en 1x10 6 células / ml por vial. Un matraz de cultivo T75 con meníngea fibroblastos confluentes contiene alrededor de 5-7 millones de células.
8. Caracterización de los fibroblastos meníngeos por inmunotinción
NOTA: Antes de comenzar el procedimiento, preparar la solución de paraformaldehído al 4%, suero de cabra normal al 5% en PBS (tampón de bloqueo), 0,3% de Triton X-100 en PBS (tampón de permeabilización), soluciones de anticuerpos primarios y secundarios, y 1 mg / ml de Hoechst 33342 diluido en PBS a partir de 10 mg / mL de stock.
- Semilla de 15.000 a 30.000 fibroblastos meníngeos en 8 pocillos recubiertos con cámara de diapositivas 0,1% de gelatina.
- Después de 24 h cuando se unen las células, fijar las células en 100 l 4% de paraformaldehído por pocillo durante 10 min a temperatura ambiente. Lavar los pocillos 3 veces con PBS 1x.
- Permeabilizar las células con 150 l de 0,3% de Triton X-100 para 5 min a temperatura ambiente. Lavar los pocillos 3 veces con PBS 1x.
- Añadir 200 l de solución de bloqueo (PBS + 5% de suero normal de cabra) durante 1 h a temperatura ambiente.
- Aspirar la solución de bloqueo, y añadir 150 l de anticuerpos primarios deseados diluido en solución de bloqueo. Por doble tinción, preparar diluciones de trabajo de los anticuerpos primarios en tubos de centrífuga separados en el hielo de la siguiente manera:
- Preparar una dilución 1: 300 de anti-fibronectina + dilución 1: 200 de anti-nestina en solución de bloqueo. Preparar una dilución 1: 250 de anti-SERPINH1 + 1: 1000 dilución de anti-Tuj1 en solución de bloqueo. Preparar 1: 250 dilución de anti-SERPINH1 + 1: 100 dilución de anti-SOX2 en solución de bloqueo
- Se incuba a 4 ° C durante la noche.
- Lavar los pocillos 3 veces con PBS 1x.
- Preparar un trabajo dilución 1: 400 de la etiqueta fluorescente secundaria de anticuerpos de cabra anti-conejo (verde; Ex / Em 2 495/519 nm) y de cabra anti-ratón (rojo; Ex / Em 2 590/617 nm) en solución de bloqueo y añadir 100 l a cada pocillo. Incubar durante 1 h, en la oscuridad, a temperatura ambiente. Luego se lavan los pocillos una vez con PBS 1x.
- Añadir 100 l de 1 mg / ml de Hoechst 33342 (azul; Ex / Em 2 358/461 nm) solución a cada pocillo y se incuba en la oscuridad durante 3 min. Lavar los pocillos 3 veces con PBS 1x, dejando en la final de lavado 1x PBS en el pozo, y cubrir el portaobjetos con papel de aluminio.
- Analizar las células bajo el microscopio de fluorescencia.
Resultados
Cuando el protocolo de procesamiento leptomeninges ha tenido éxito, primero se observa consecuencia de fibroblastos meníngeos tres a nueve días después de la disección, aunque esto puede depender de la duración del intervalo post-mortem para el cerebro. La Figura 1 muestra los cultivos de fibroblastos meníngeas de cuatro donantes diferentes. La figura 1A muestra una pieza leptomeninges sujetado por un cubreobjetos de vidrio (línea diagonal oscura) y el crecimiento de los fibroblastos del tejido alrededor de los cuatro días después de la transformación de una de 88 años de edad del donante con 10 h 20 min intervalo post mortem. La Figura 1B muestra escasa consecuencia de fibroblastos de post-procesamiento de siete días a partir de un donante de 70 años de edad y 11 h 45 min intervalo post mortem. La figura 1C muestra fibroblastos excrecencia de 13 días después de la disección de un 88 años de edad de los donantes y 24 h intervalo post mortem. La figura 1D muestra un cultivo confluente que se pasó en un Vess T75EL y las células pueden ser criopreservadas en esta etapa.
Fibroblastos meníngeos son bipolar o multipolar y han alargado o formas irregulares (Figura 2). Se caracterizan por la expresión de la glicoproteína de fibronectina y el marcador de fibroblastos SERPINH que se localiza en el retículo endoplásmico (Figuras 2A-2C). Fibroblastos meníngeos no son inmuno-reactiva a SRY factor de transcripción (región determinante del sexo Y) -Box 2 (SOX2) que es un marcador para las células madre no diferenciadas (Figura 2A). Sin embargo, un subconjunto de los fibroblastos leptomeníngeo es positivo para el tipo VI nestin filamentos intermedios, un marcador de células madre neurales (Figura 2B), y la clase específica de neuronas III beta-tubulina (Tuj1) (Figura 2C).

Figura 1.Ejemplos de derivación de fibroblastos meníngeas de cuatro donantes diferentes. A) pieza de tejido leptomeninges se mantiene presionado por un cubre de vidrio (línea diagonal oscura) y el crecimiento de fibroblastos alrededor del tejido se observó cuatro días después de la transformación de una de 88 años de edad del donante con 10 h 20 min intervalo post mortem. B) fibroblastos Escaso excrecencia de siete días post-procesamiento de un donante de 70 años de edad y 11 h 45 min intervalo post mortem. C) meníngea consecuencia de fibroblastos 13 días después de la disección de un 88 años de edad de los donantes y 24 h intervalo post mortem. D) confluentes cultivo de fibroblastos meníngea a pases en un recipiente T75. Haga clic aquí para ver una versión más grande de esta figura.
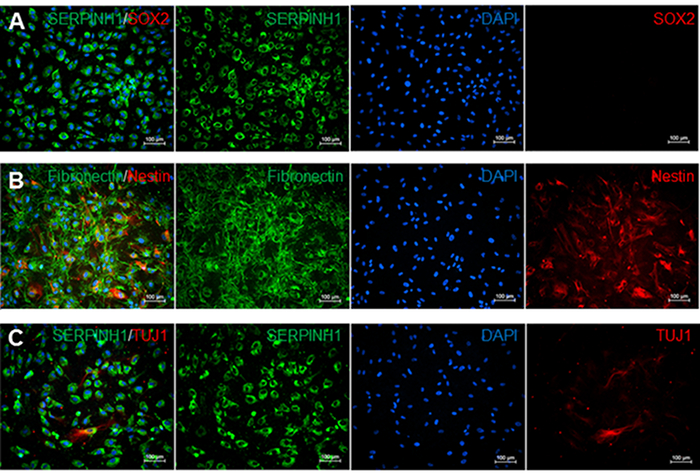
Figura 2. Immunost aining de las meninges, celular, de células madre neurales, y los marcadores de las neuronas del tallo. A) La tinción de inmunofluorescencia para los marcadores de fibroblastos SERPINH1 (verde) y el vástago SOX2 marcador de células (rojo). SERPINH1 se expresó en todos los núcleos de las células contadas. Stem SOX2 marcador de células no se detectó en estos leptomeninges cultura. B) La tinción de inmunofluorescencia para fibronectina meninges específicas de marcador (verde) y el marcador de células madre neurales nestina (rojo). 52,1% de los núcleos de las células contadas fueron positivos tanto para la nestina y fibronectina. C) La tinción de inmunofluorescencia para SERPINH1 (verde) y Tuj1 marcador neuronal (rojo). 6,9% de núcleos contados fueron positivos para SERPINH1 y Tuj1. datos de recuento de células se determinaron utilizando el manual de células Contador Multi-Select herramienta en ImageJ. imágenes teñidas individuales se evaluaron mediante el recuento del número de células DAPI-positivas en comparación con el número de células positivas para cada marcador en porcentajes.lacio "> Haga clic aquí para ver una versión más grande de esta figura.
| Día | Resultados previstos | |||||
| 3-9 | Consecuencia de primeros fibroblastos meníngeos. | |||||
| 7-18 | meníngea fibroblastos se expanden, y la cultura se vuelve más densa. Cambio de medio de 2 ml cada dos días. | |||||
| 18-25 | placa de 6 pocillos se vuelve confluente, una vez que los fibroblastos meníngeos son confluentes se combinan tres pozos en un matraz de cultivo T75 (paso a 1: 3 a 1: 4). | |||||
| 26-45 | Una confluentes resultados matraz de cultivo T75 en 5-7 millones de células. Criopreservar fibroblastos meníngeos en 1 millón de células / vial. | |||||
LengüetaLe 1: Cronología de la excrecencia celular.
Discusión
Este protocolo describe un protocolo simple y robusto para derivar un cultivo de fibroblastos de meníngea leptomeninges postmortem humanos recogidos en conjunción con una donación cerebro. Hay muy pocas descripciones de los protocolos para derivar los cultivos celulares a partir de material humano postmortem. Dos estudios describen cultivos de fibroblastos 7, 8, de la piel derivado de 9, un estudio describe muestras Dura 10, y otro describe no criopreservados muestras Dura congelado 11.
Preparamos dos placas de 6 pocillos con 2-3 piezas de tejido (aproximadamente 3 mm x 3 mm) en cada pocillo para asegurar la suficiente extensión y expansión antes de ser congelados. Es fundamental que las piezas meninges están unidos a la placa de cultivo por prensado suave una hoja de cubierta de vidrio estéril sobre las piezas de tejido para mantenerlos en su lugar. Sin un cubreobjetos, las meninges piezas será sint se adhieren a la parte inferior de la placa de cultivo. excrecencia éxito sólo se observa cuando las piezas de tejido están en contacto directo con la parte inferior de plástico. Si las piezas de tejido flotan en el medio de cultivo, no se observa crecimiento externo de células del tejido. Esto debe realizarse con unos 500 l de crecimiento de los medios para no secar las muestras y luego añadir hasta 1 ml de medio de crecimiento a la vasija. No es necesario el uso de más de silicona para mantener la cubierta se desliza en su lugar.
Si las piezas son más pequeñas que 3 mm x 3 mm, la consecuencia es más lento y, en algunos casos no se puede establecer cultivos confluentes. Es fundamental no crecen las células demasiado escasa y se recomienda una relación de división de 1: 3 a 1: 4. pequeños pozos individuales permiten la contaminación potencial una mejor gestión. Wells se pueden alimentar de forma individual y pipetas deben cambiarse entre los pozos.
Hemos derivado éxito meníngea fibroblastos de 9 muestras postmortem con un postmortem intervalo entre 10-24 h. Los donantes fueron entre 70 y 88 años de edad y tienen duraciones de las enfermedades de la enfermedad de Parkinson entre 8-31 años. Nos damos cuenta de que los tejidos con un intervalo post mortem ya llevan más tiempo antes de que las primeras células crecen fuera (hasta 9 días). En las muestras con intervalo post mortem más corto, observamos consecuencia, tan pronto como 3 días después de la preparación. No hemos notado una diferencia en el crecimiento basado en la edad del donante, pero sólo tuvimos donantes> 70 años.
La importancia del método es la obtención de un cultivo celular primario para una enfermedad neurodegenerativa esporádica como la enfermedad de Parkinson, que actualmente sólo puede ser confirmado en la autopsia 12, 13, 14 ya que están definiendo ningún plenamente las características clínicas, las técnicas de imagen o biomarcadores que pueden proporcionar un diagnóstico seguro durante la vida 15. Tenemos anteriormente devellado un protocolo para la derivación de los fibroblastos de biopsias de piel principalmente para los casos confirmados genéticamente de la enfermedad de Parkinson 16 que nos han permitido generar células madre pluripotentes inducidas y estudiar mecanismos de la enfermedad 17, 18, pero este nuevo protocolo será crucial para comparar directamente los cambios neuropatológicos con los hallazgos in vitro para la enfermedad de Parkinson esporádica. Para nuestro conocimiento, este es el primer protocolo derivado de fibroblastos meníngeos leptomeninges humanos post mortem.
Cultivos de fibroblastos meníngeos directamente se pueden utilizar para el estudio de los mecanismos moleculares respecto a la enfermedad o lesión, o como una fuente para la reprogramación nuclear en células madre pluripotentes inducidas o conversión directa en cultivos neuronales como modelos preclínicos avanzados para la enfermedad de Parkinson esporádica u otros trastornos neurodegenerativos 19. estos humodelos derivados del paciente por el hombre son la base y acelerar los avances en la medicina personalizada y regenerativa.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Development of this protocol was funded by private donations directed to the Parkinson's Institute Brain Donation Program.
Materiales
| Name | Company | Catalog Number | Comments |
| Corning Petri dishes | Fisher Scientific | 351029 | |
| Nunc 6-well plate | Fisher Scientific | 14-832-11 | |
| 15-mm cover slips | Fisher Scientific | 12-545-83 15CIR-1D | |
| Scalpels, sterile blade, No. 15 | Miltex | 4-415 | |
| Curved precision tip forceps | Fisher Scientific | 16-100-122 | |
| Serological pipettes | Fisher Scientific | 13-678-11E | |
| Pasteur pipettes | Fisher Scientific | 22-230490 | |
| Gelatin | Sigma | G1890-100G | |
| Phosphate Buffer Saline | Fisher Scientific | SH30264.02 | |
| Corning 500 mL filter unit | Fisher Scientific | 430770 | Combine media components and filter. |
| Nunc Cell Culture Treated Flasks with Filter Caps, T175 cm2 | Thermo Scientific | 178883 | |
| Name | Company | Catalog Number | Comments |
| Growth Media | |||
| Hyclone DMEM | Fisher Scientific | SH30081.02 | |
| Hyclone FBS | Fisher Scientific | SH30910.03 | |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher | 11140-050 | |
| GlutaMAX Supplement (100x) | Thermo Fisher | 35050-061 | |
| Sodium Pyruvate (100 mM) | Thermo Fisher | 11360-070 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher | 15140-122 | |
| Amphotericin B (Yellow Solution/250 µg/mL) | Fisher Scientific | BP264520 | |
| Bambanker Freeze 120 mL | Fisher Scientific | NC9582225 | |
| Name | Company | Catalog Number | Comments |
| Fibronectin Staining | |||
| 8 well chamber slides | Fisher Scientific | 1256518 | |
| 20% paraformaldehyde | Electron Microscopy Sciences | 15713 | |
| Triton X-100 | Sigma | T8787 | |
| 100% Glycerol | BioRad | 9455 | |
| 100% normal goat serum | Fisher Scientific | 101098-382 | |
| Anti-Fibronectin antibody [F1] | Abcam | ab32419 | 1:300 dilution in blocking solution |
| Anti-SERPINH1 | Sigma | S5950-200ul | 1:250 dilution in blocking solution |
| Anti-SOX2 | Millipore | MAB4343 | 1:100 dilution in blocking solution |
| Anti-Nestin | Millipore | MAB5326 | 1:200 dilution in blocking solution |
| Anti-TUJ1 | Covance | MMS-435P | 1:1,000 dilution in blocking solution |
| Alexa Fluor 488 anti-rabbit | Thermo Fisher | A11029 | 1:400 dilution in blocking solution; (green channel; Ex/Em2 495/519 nm) |
| Alexa Fluor 555 anti-mouse | Thermo Fisher | A21424 | 1:400 dilution in blocking solution; (red channel; Ex/Em2 590/617 nm) |
| Hoechst 33342 stain | Thermo Fisher | H3570 | dilute to a final concentration of 1.0 μg/mL; (blue channel; Ex/Em2 358/461 nm) |
| Suppliers are suggestions, similar products from alternative vendors can be used as well. | |||
Referencias
- Decimo, I., Fumagalli, G., Berton, V., Krampera, M., Bifari, F. Meninges: from protective membrane to stem cell niche. Am J Stem Cells. 1 (2), 92-105 (2012).
- Bifari, F., et al. Novel stem/progenitor cells with neuronal differentiation potential reside in the leptomeningeal niche. J Cell Mol Med. 13 (9B), 3195-3208 (2009).
- Bifari, F., et al. Meninges harbor cells expressing neural precursor markers during development and adulthood. Front Cell Neurosci. 9, 383(2015).
- Decimo, I., Bifari, F., Krampera, M., Fumagalli, G. Neural stem cell niches in health and diseases. Curr Pharm Des. 18 (13), 1755-1783 (2012).
- Hayashi, H., et al. Meningeal cells induce dopaminergic neurons from embryonic stem cells. Eur J Neurosci. 27 (2), 261-268 (2008).
- Nakagomi, T., et al. Leptomeningeal-derived doublecortin-expressing cells in poststroke brain. Stem Cells Dev. 21 (13), 2350-2354 (2012).
- Hjelm, B. E., et al. Induction of pluripotent stem cells from autopsy donor-derived somatic cells. Neurosci Lett. 502 (3), 219-224 (2011).
- Hjelm, B. E., et al. In vitro-differentiated neural cell cultures progress towards donor-identical brain tissue. Hum Mol Genet. 22 (17), 3534-3546 (2013).
- Meske, V., Albert, F., Wehser, R., Ohm, T. G. Culture of autopsy-derived fibroblasts as a tool to study systemic alterations in human neurodegenerative disorders such as Alzheimer's disease--methodological investigations. J Neural Transm (Vienna). 106 (5-6), 537-548 (1999).
- Bliss, L. A., et al. Use of postmortem human dura mater and scalp for deriving human fibroblast cultures. PLoS One. 7 (9), e45282(2012).
- Sproul, A. A., et al. Generation of iPSC lines from archived non-cryoprotected biobanked dura mater. Acta Neuropathol Commun. 2, 4(2014).
- Adler, C. H., et al. Low clinical diagnostic accuracy of early vs advanced Parkinson disease: clinicopathologic study. Neurology. 83 (5), 406-412 (2014).
- Hughes, A. J., Daniel, S. E., Kilford, L., Lees, A. J. Accuracy of clinical diagnosis of idiopathic Parkinson's disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry. 55 (3), 181-184 (1992).
- Hughes, A. J., Daniel, S. E., Lees, A. J. Improved accuracy of clinical diagnosis of Lewy body Parkinson's disease. Neurology. 57 (8), 1497-1499 (2001).
- Langston, J. W., Schüle, B., Rees, L., Nichols, R. J., Barlow, C. Multisystem Lewy body disease and the other parkinsonian disorders. Nature Genetics. 47 (12), 1378-1384 (2015).
- Vangipuram, M., Ting, D., Kim, S., Diaz, R., Schüle, B. Skin punch biopsy explant culture for derivation of primary human fibroblasts. J Vis Exp. (77), e3779(2013).
- Byers, B., et al. SNCA triplication Parkinson's patient's iPSC-derived DA neurons accumulate alpha-synuclein and are susceptible to oxidative stress. PLoS One. 6 (11), e26159(2011).
- Sanders, L. H., et al. LRRK2 mutations cause mitochondrial DNA damage in iPSC-derived neural cells from Parkinson's disease patients: reversal by gene correction. Neurobiol Dis. 62, 381-386 (2014).
- Beevers, J. E., Caffrey, T. M., Wade-Martins, R. Induced pluripotent stem cell (iPSC)-derived dopaminergic models of Parkinson's disease. Biochem Soc Trans. 41 (6), 1503-1508 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados