Method Article
Repetitive stimolazione magnetica transcranica al unilaterale emisfero del cervello di ratto
In questo articolo
Riepilogo
We applied repetitive transcranial magnetic stimulation (rTMS) to the unilateral hemisphere of rat brain, by placing a 25-mm figure-8 coil 1 cm lateral to the vertex on the biauricular line and angulating the coil by 45°. An in-house water cooling system was used for rTMS for more than 20 min.
Abstract
Previous rodent models of repetitive transcranial magnetic stimulation (rTMS) adopted whole-brain stimulation instead of unilateral hemispheric rTMS, which is unlike the protocols used for human subjects. We report a successful application of rTMS to the unilateral hemisphere of rat brain. The rTMS was delivered with a low-frequency (1 Hz), high-frequency (20 Hz), or sham stimulation protocol to one side of the brain by using a small 25-mm figure-8 coil. We placed the center of the coil 1 cm lateral to the vertex on the biauricular line and angulated the coil 45° to the ground to minimize a potential direct effect of rTMS on the contralateral cortex. We also used an in-house water cooling system to enable repetitive magnetic stimulation for more than 20 min, even at a 20-Hz stimulation frequency. Increases in the transcriptions of immediate early genes (Arc, Junb, and Egr2) were greater after rTMS than after sham stimulation. After 5 consecutive days of 20-min 1-Hz rTMS, bdnf mRNA expression was significantly higher in stimulated cortex than in contralateral side. The model presented herein will elucidate the molecular mechanisms of rTMS by allowing analysis of the inter-hemispheric difference in its effect.
Introduzione
Repetitive stimolazione magnetica transcranica (TMS), uno strumento per la stimolazione cerebrale non invasiva e neuromodulazione, è stato applicato nel trattamento di varie condizioni come il dolore centrale 1,2, depressione 3, l'emicrania 4, e anche ictus 5-7. Rapido cambiamento di corrente elettrica attraverso le bobine sulla testa induce un campo elettrico sulla corteccia cerebrale e una attivazione neuronale risultante. L'eccitabilità della corteccia cerebrale può essere modulata da TMS, che possono durare per più di 30 minuti dopo la stimolazione è terminata.
Meccanismi suggeriti dei rTMS dopo-effetto includono potenziamento a lungo termine / depressione-come effetto 8, spostamento transitorio in equilibrio ionico 9, e metaboliche cambia 10. Inoltre, Di Lazzaro et al. suggeriscono che la stimolazione intermittente theta-burst colpisce gli ingressi sinaptici eccitatori al piramidale neuroni del tratto, sia nel stimolatae l'emisfero controlaterale 11.
significative limitazioni, tuttavia, hanno ostacolato i ricercatori da tradurre prove su banco a situazioni cliniche. In primo luogo, in studi su animali precedenti, rTMS è stato utilizzato per la stimolazione tutto il cervello 12. Stimolazione tutto il cervello è molto diverso dai protocolli utilizzati negli studi sull'uomo 9. L'altro problema è correlato con la durata stimolazione. Questo è almeno in parte attribuibile al fatto che un efficace sistema di raffreddamento è stato disponibile per piccole bobine in passato.
Negli ultimi anni, articoli seminali sono stati pubblicati suggerendo modi per superare queste difficoltà nell'esperimento rTMS sul cervello piccolo animale. Con questi modelli animali, è stato rivelato che il cervello di ratto mostra anche simili cambiamenti eccitabilità corticale come nella umana in risposta a rTMS a bassa frequenza 13. Ancora più importante, i meccanismi cellulari e molecolari della rTMS sono sempre più being studiata utilizzando modelli animali di rTMS. Un esempio calzante è che un tipo distinto di interneurone inibitorio è noto per essere più sensibili al intermittente theta stimolazione scoppio 14. modelli di roditori di rTMS, in tal modo, offrono nuove opportunità per esplorare questioni molto ricercato sulle basi molecolari di cambiamenti rTMS-indotti. Se i piccoli modelli animali di rTMS possono essere utilizzati in più laboratori, può notevolmente accelerare e rafforzare la ricerca in questo settore.
Descriviamo ora come applicare rTMS per l'emisfero unilaterale di cervello di ratto, un prolungamento del lavoro precedente 15. modifiche stimolazione indotta sono stati valutati utilizzando micro-tomografia ad emissione di positroni (PET) e microarray mRNA per studiare i cambiamenti rTMS-indotti nella corteccia cerebrale stimolata.
Protocollo
Tutte le procedure che utilizzano gli animali sono stati esaminati e approvati dal Comitato Cura e uso istituzionale degli animali di Seoul National University Hospital.
1. apparato sperimentale
- preparazione degli animali
- Consentire ratti maschi Sprague-Dawley 1 settimana a adattarsi al loro nuovo ambiente prima di iniziare l'esperimento.
NOTA: Sebbene 8 settimane ratti sono stati utilizzati nel presente studio, un sviluppo o cervello adulto può essere scelto secondo le ipotesi di ricerca.
- Consentire ratti maschi Sprague-Dawley 1 settimana a adattarsi al loro nuovo ambiente prima di iniziare l'esperimento.
- l'anestesia per inalazione per l'induzione
- Indurre e mantenere l'anestesia con il 5% e il 2% di isoflurano disciolto in 40% / 60% e il 25% / 75% di ossigeno / azoto tramite un cono camera ed il naso, rispettivamente. Regolare la profondità dell'anestesia al livello di abolire il riflesso pedale ritiro a pizzico punta a confermare il corretto anestesia.
NOTA: L'uso di animali risvegliati può essere una scelta migliore in termini traslazionali, ma ci sono difficoltà per trattenere durante rTMS e they sono inclini a stress eccessivo. - Monitorare la temperatura corporea con una sonda rettale e mantenerla a 37 ° C utilizzando una coperta omeotermi. Monitorare profondità dell'anestesia tramite pedale ritiro reflex, temperatura, frequenza respiratoria e della frequenza cardiaca.
- Indurre e mantenere l'anestesia con il 5% e il 2% di isoflurano disciolto in 40% / 60% e il 25% / 75% di ossigeno / azoto tramite un cono camera ed il naso, rispettivamente. Regolare la profondità dell'anestesia al livello di abolire il riflesso pedale ritiro a pizzico punta a confermare il corretto anestesia.
- Switch-over per l'anestesia per via endovenosa per la manutenzione
- Preparare la coda con un tampone imbevuto di alcool. Cateterizzare una vena della coda laterale con un catetere venoso 24-gauge per il passaggio in IV anestesia (Figura 1A). Carico propofol per via endovenosa (1 mg / kg [· min] oltre 10 min, utilizzando 10 mg / ml di emulsione) agli animali. Interrompere isoflurano 5 minuti dopo l'inizio del propofol carico.
- Mantenere propofol sedazione ad una velocità di infusione di 500 - 700 pg / (kg · min) durante l'esperimento, come in un precedente studio 16. Supplemento ossigeno a 0,8 L / min tramite un cono di naso.
NOTA: anestesia con propofol è quello di ridurre il potenziale soppressione di eccitabilità corticale dal inspagente zione 17-19. Tuttavia, l'anestesia non è obbligatorio in esperimenti rTMS, e gli animali risvegliato può anche essere usato. metodi di anestesia deve essere stabilito in considerazione delle ipotesi di ricerca. - Usare pomata veterinario occhi per prevenire la secchezza mentre sotto anestesia.
- Applicare la stimolazione magnetica (vedi Sezione 2) 10 min dopo la completa transizione al IV anestesia.
- le condizioni di recupero
- Monitorare i segni vitali durante la fase di recupero. Non lasciare l'animale incustodito fino a quando non ha ripreso conoscenza sufficiente a mantenere decubito sternale. Se un animale è stato sottoposto a un intervento chirurgico, non restituirlo alla compagnia di altri animali fino alla completa guarigione.
NOTA: Se si esegue un intervento chirurgico per un modello di malattia, la gestione del dolore post-chirurgico è necessario. Tuttavia, la gestione del dolore non è necessario per questo esperimento rTMS.
- Monitorare i segni vitali durante la fase di recupero. Non lasciare l'animale incustodito fino a quando non ha ripreso conoscenza sufficiente a mantenere decubito sternale. Se un animale è stato sottoposto a un intervento chirurgico, non restituirlo alla compagnia di altri animali fino alla completa guarigione.
2. ripetitiva Stimolazione Magnetica Transcranica
- Stimolatore e la bobina
- Applicare la stimolazione utilizzando uno stimolatore ripetitivo che offre stimoli bifasici tramite 25 mm Figura 8-coil. Localizzare il centro della bobina 0,5 cm lateralmente al vertice sulla linea biauricular e angulate la bobina 45 ° a terra.
NOTA: L'intensità del campo magnetico massimo della bobina è 4,0 T. La bobina magnetica è montato saldamente su un supporto incorporato.
- Applicare la stimolazione utilizzando uno stimolatore ripetitivo che offre stimoli bifasici tramite 25 mm Figura 8-coil. Localizzare il centro della bobina 0,5 cm lateralmente al vertice sulla linea biauricular e angulate la bobina 45 ° a terra.
- soglia motoria
- Determinare la soglia motoria (MT) al punto caldo, con il centro della bobina posizionata 0,5 cm lateralmente al vertice sulla linea biauricular e con la superficie piana sul calvaria. Questa è la stessa metodologia utilizzata in uno studio precedente 20.
NOTA: Definire MT come l'intensità minima di stimolo evocando 5 o più palpabile contrazioni sulla zampa anteriore controlaterale di 10 stimoli consecutivi. Verificare se la stimolazione è principalmente causando controlaterale contrazione muscolare per garantire la stimolazione unilaterale.
- Determinare la soglia motoria (MT) al punto caldo, con il centro della bobina posizionata 0,5 cm lateralmente al vertice sulla linea biauricular e con la superficie piana sul calvaria. Questa è la stessa metodologia utilizzata in uno studio precedente 20.
- L'applicazione di rTMS
- Applicare rTMS 10 minuti dopo la stabilizzazione di anestesia profonda. Posizionare il centro della bobina al sito rTMS bersaglio, scelto tra i cortecce cerebrali seconda domande di ricerca. Quindi, inclinare la bobina per assicurare il contatto diretto tra il centro della bobina e la superficie del cranio nel punto di stimolazione.
NOTA: Per esempio, angulate la bobina 45 ° a terra per minimizzare un potenziale effetto diretto della rTMS sulla corteccia controlaterale (Figura 1B e 1C). - Sottoporre gli animali ad una sessione di 20 min rTMS dell'emisfero unilaterale. Utilizzando la console software, fornire rTMS con una bassa frequenza (1 Hz), ad alta frequenza (20 Hz), o protocollo di stimolazione simulata, e impostare l'intensità della stimolazione a 100-110% della MT.
- Eseguire 1 Hz stimolazione senza riposo. Utilizzando la console di input software "1.200" colpi di "20" min). Per 20 Hz stimolazione, condurre 2 sec di stimolazione seguita da 28sec di riposo. Utilizzando la console di input software "1.600" colpi per minuto "20".
- Per la stimolazione sham, inclinare la bobina perpendicolare (rotazione di 90 °) per calvaria e posizionare il bordo della bobina 2 cm di distanza dalla superficie della testa (Figura 1D). Fissare il supporto della bobina saldamente al dispositivo principale; non vi è alcuna necessità di tenere la bobina a mano durante l'esperimento.
NOTA: Per compensare gli effetti non specifici acustici e altri, protocolli sham distinte devono essere utilizzati per i protocolli di stimolazione distinti. Ad esempio, la stimolazione sham 1-Hz può essere usato per 1 Hz rTMS esperimenti.
- Applicare rTMS 10 minuti dopo la stabilizzazione di anestesia profonda. Posizionare il centro della bobina al sito rTMS bersaglio, scelto tra i cortecce cerebrali seconda domande di ricerca. Quindi, inclinare la bobina per assicurare il contatto diretto tra il centro della bobina e la superficie del cranio nel punto di stimolazione.
- Raffreddamento della bobina
- Utilizzare un sistema di raffreddamento ad acqua per consentire stimolazione magnetica ripetitiva per più di 20 minuti a 1 e da 20 Hz frequenze di stimolazione (Figura 2). Circolare acqua ghiacciata circonda tutta la lunghezza della bobina durante l'esperimento per evitare il surriscaldamento, anche se la temperatura della batteria o stimolatore non viene monitorato.
NOTA: disponibili in commercio bobine ratto raffreddate possono anche essere utilizzati. - Se possibile, controllare la temperatura della batteria osservando l'indicatore di riscaldamento della macchina rTMS. NOTA: Non ci sono state conseguenze negative legate alla stimolazione rTMS. Vi è, tuttavia, un potenziale rischio ustione se tag di identificazione metallo orecchie vengono utilizzati in prossimità della bobina stimolante.
- Utilizzare un sistema di raffreddamento ad acqua per consentire stimolazione magnetica ripetitiva per più di 20 minuti a 1 e da 20 Hz frequenze di stimolazione (Figura 2). Circolare acqua ghiacciata circonda tutta la lunghezza della bobina durante l'esperimento per evitare il surriscaldamento, anche se la temperatura della batteria o stimolatore non viene monitorato.
3. Micro Positron Emission Tomography
- preparazione degli animali
- Condurre anestesia per inalazione per l'induzione e IV anestesia per la manutenzione (vedi punto 1.2.1 e 1.3.1). Applicare 1 Hz rTMS ad un animale per 10 minuti ad una intensità di stimolazione del 100-110% della MT.
- Cinque minuti dopo aver terminato la stimolazione rTMS, iniettare 1 mCi di 2- [F-18] fluoro-desossiglucosio (18 FDG) sciolti in 0,5 ml di soluzione fisiologica per via endovenosa utilizzando un catetere vena della coda. Lasciare 30 minuti per 18 FDG. NOTA: Posizionare il topo sotto anestesia durante l'intero micro-PEesperimento T.
- analisi delle immagini
- Utilizzare uno scanner PET per l'imaging del cervello per riaffermare l'unilateralità della stimolazione. Ricostruire le immagini con un 3-D algoritmo iterativo. Per valutare i cambiamenti nel metabolismo indotti da TMS, identificare le regioni di interesse (ROI) nelle immagini delle sezioni di cervello trasversali 21.
- Eutanasia
- Dopo aver eseguito l'imaging micro-PET, eutanasia i topi in una camera di pre-riempite con anidride carbonica mentre i ratti sono in anestesia profonda.
4. mRNA microarray
- Eutanasia
- Indurre e mantenere l'anestesia con il 5% e il 2% di isoflurano disciolto in 40% / 60% e il 25% / 75% di ossigeno / azoto tramite un cono camera ed il naso, rispettivamente. Anestetizzare profondamente al livello di abolire il riflesso pedale ritiro a pizzico punta prima di essere decapitato.
- Decapitare i ratti di eutanasia 5 minuti dopo 1 seduta di 1-Hz rTMS.
- raccolta dei tessuti
- Disporre i materiali e gli strumenti chirurgici in ordine di utilizzo, tra cui asciugamani piegati di carta, un rongeur osso, microscissors, forbici chirurgiche più grandi, un microforcep, una lama di bisturi n ° 10 o 11, un coperchio 10 cm piatto di vetro Petri riempite con ghiaccio , e tubi da 1,5 ml. Preparare un sacchetto di plastica per lo smaltimento delle carcasse.
- Effettuare una incisione cutanea mediana nel anterioposteriorly cranio. Senza mezzi termini sezionare i tessuti molli e muscoli circostanti con le forbici chirurgiche, e togliere il pezzo di osso del cranio con un rongeur osso. sezionare rapidamente il cervello fresco con cura dal cranio. Poi, si trovava sul ghiaccio utilizzando i microforceps e microscissors. Sciacquare il tessuto cerebrale in ghiacciata soluzione fisiologica.
- Trasferire il cervello di ghiaccio secco immediatamente, e successivamente conservarlo a -80 ° C in un tubo fino al procedimento.
- Scongelare il tessuto cerebrale prima della raccolta.
- Posizionare dorsale del cervello rivolta verso l'alto, e raccogliere il tessuto cerebrale dalla stimulated corteccia cerebrale (intorno al punto caldo nella corteccia motoria primaria) su ghiaccio utilizzando i microforceps e microscissors. Mettere il tessuto raccolto nel tubo da 1,5 ml.
- preparazione RNA
- Estratto RNA totale da omogenati di tessuti utilizzando la lisi dei reagenti 22. Processo con DNasi digestione e procedure di clean-up. Quantificare i campioni di RNA e le aliquote e conservare a -80 ° C fino al momento dell'uso.
- Per controllo di qualità, valutare RNA purezza e integrità denaturazione elettroforesi su gel, con un rapporto di OD 260: 280, e analizzarli su un analizzatore disponibile in commercio.
- Etichettatura e purificazione
- Amplificare e purificare RNA totale utilizzando un kit di RNA di amplificazione disponibile in commercio a cedere cRNA biotinilato. Brevemente, reverse-trascrivere 550 ng di RNA totale di cDNA usando un primer T7 oligo (dT). Sintetizzare e in vitro trascrivere il secondo filamento cDNA e poi etichettarlo con biotina-NTP.
- dopo purification, quantificare cDNA utilizzando uno spettrofotometro.
- Ibridazione e esportazione di dati 23
- Utilizzare il beadchip espressione per l'analisi di espressione dell'mRNA. Ibridare le etichettati 750-NG campioni di cDNA per ogni ratto-12 espressione di matrice tallone per 16 - 18 ore a 58 ° C. Effettuare il rilevamento dei segnali gamma utilizzando streptavidina-Cy3.
- array di scansione con uno scanner confocale. Eseguire l'elaborazione esportazione dei dati di array e analisi utilizzando un software disponibile in commercio.
Risultati
Quindici 8 settimane di età ratti maschi Sprague-Dawley sono stati utilizzati per un separato inter-rater analisi di affidabilità della determinazione MT. Utilizzando la palpazione di contrazioni muscolari, le MTS erano ottenibili in tutti i ratti e calcolate in 33,00 ± 4,21% di uscita massima stimolatore (% MSO) e 33.93 ± 0,88% MSO, rispettivamente, da due ricercatori indipendenti. bias di Bland-Altman era -0.93, e limiti al 95% di accordo erano -9,13 a 7,26%.
Nell'esperimento micro-PET su sei di 8 settimane ratti (n = 4 nei rTMS 1 Hz, e n = 2 nel gruppo rTMS sham), l'assorbimento di 18 F-FDG nella ROI è stato calcolato come la media nCi / cc dopo la calibrazione di entrambe le cortecce cerebrali ipsilaterale e controlaterale nelle stesse immagini. La radioattività nella zona controlaterale è stata usata come riferimento per normalizzare i dati ottenuti nella zona omolaterale, e il rapporto differenziale assorbimento (DUR) è stata calcolata.I durs medi ottenuti da tre immagini consecutive trasversali sono stati mediati per ottenere la durs per i topi. Questa è la stessa metodologia utilizzata in uno studio precedente 21. 18 immagini FDG-PET hanno mostrato un aumento focale nel metabolismo del glucosio nella zona corticale sinistro stimolato nel gruppo 1-Hz, sostenendo l'unilateralità delle rTMS (Figura 3).
Nello studio microarray mRNA, la qualità di ibridazione e chip di prestazioni complessive sono stati monitorati mediante ispezione visiva di entrambi i controlli di qualità interni e dati scansionati grezzi. dati di matrice sono stati filtrati in base ad un valore di rilevamento p <0,05 (simile al rapporto segnale-rumore) in% campioni almeno 50 (un valore di segnale superiore è stata necessaria per ottenere un valore di rilevamento p <0,05). Il valore del segnale gene selezionato è stato trasformato da logaritmo e normalizzato utilizzando un metodo quantile. La significatività statistica dell'espressione data è stata determinata utilizzando il test di Mann-Whitney U e ripiegare il cambiamento, in cui l'ipotesi nulla è che non esiste alcuna differenza tra l'1-Hz rTMS (n = 4) e gruppi sham (n = 4). Il tasso di scoperta falsa è stata controllata regolando il valore p utilizzando l'algoritmo Benjamini-Hochberg. Dopo la normalizzazione e filtraggio, mRNA mostrando significative espressioni differenziali (| fold change | 1.2, p <0,05) sono stati selezionati. Di conseguenza, i livelli di espressione dei geni precoci immediati erano significativamente più alti nel gruppo rTMS rispetto al gruppo sham, con le espressioni del Arc, JunB, e geni EGR2 upregulated (figura 4a).
Inoltre, abbiamo misurato BDNF espressioni mRNA nella corteccia stimolato e controlaterale dopo 5 giorni consecutivi di 20-min rTMS (n = 5 ogni del 1 Hz e 20 Hz-gruppi). Dopo la stimolazione 1-Hz, espressione di mRNA BDNF era significativamente higher nella corteccia stimolato che in quello controlaterale (Figura 4B). Questo ha rivelato differenziali rTMS-indotto cambiamenti nelle cortecce cerebrali stimolate e controlaterale.

Figura 1. Impostazioni sperimentali. (A) Un catetere endovenoso viene inserito in una vena della coda laterale (freccia), ed un cono viene utilizzato per l'anestesia con isoflurano nonché di supplemento ossigeno dopo un passaggio alla propofol endovenosa. (B ) dorsale vista antero-laterale durante rTMS. (C) dorsale vista posteriore. La superficie di una bobina figure-of-8 angolata a 45 ° rispetto al terreno per minimizzare il potenziale di stimolazione diretta della corteccia controlaterale. (D) Una illustrazione schematica di rTMS fittizi. La bobina è posizionato 2 cm di distanza da e inclinato perpendicolare (rotazione di 90 °)al calvaria. Clicca qui per vedere una versione più grande di questa figura.
Figura 2. Il sistema di raffreddamento utilizza una pompa di circolazione d'acqua con senza motore. Imballaggio ghiaccio sui fili della bobina di rame, come il sistema di raffreddamento avvolge il cavo della bobina è sufficiente a raffreddare il calore prodotto ai fili di rame. La superficie della bobina non è in contatto diretto con l'acqua ghiacciata. Il sistema di raffreddamento è attivo durante sedute di stimolazione.
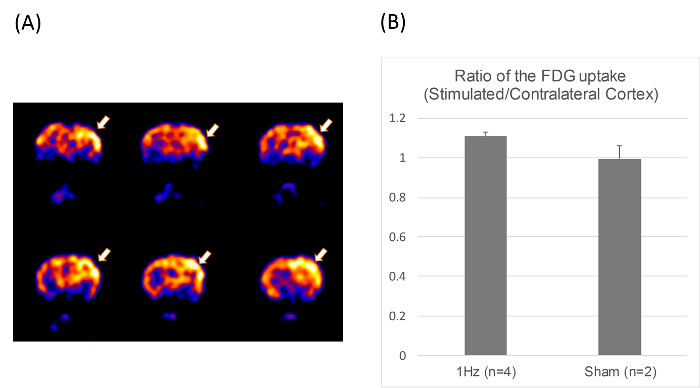
Figura 3. Positron Emission Tomography (PET) immagine. (A) Le sezioni coronali di immagini micro-PETun ratto ottenuto usando 2- [F-18] fluoro-desossiglucosio, mostra un aumento del metabolismo del glucosio locale nella corteccia stimolato dopo 1-Hz rTMS per 10 min a 100% dei MT (frecce). (b) il rapporto di FDG in stimolato / corteccia controlaterale nel 1-Hz (n = 4) e sham gruppo rTMS (n = 2). Si prega di cliccare qui per vedere una versione più grande di questa figura.
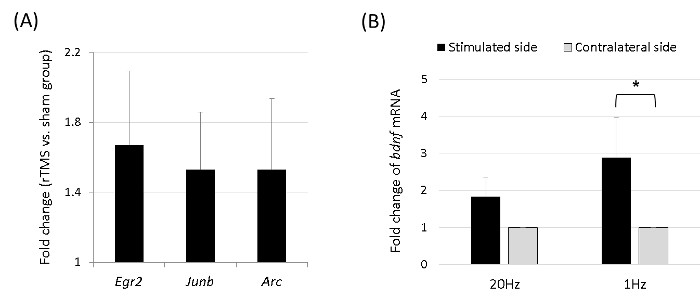
Figura 4. L'mRNA microarray dei geni immediata primi e BDNF. (A) Arco, JunB, e EGR2 sono stati espressi in modo differenziale, che sono stati identificati sul microarray ottenuti 5 minuti dopo 1 seduta di 1-Hz rTMS, ordinata dal cambiamento volte. I livelli di espressione dei geni erano significativamente più alti nel gruppo TMS (n = 4) than nel gruppo sham (n = 4) (p <0.05 con Mann-Whitney test U), con le espressioni dei geni Arc, JunB e EGR2 upregulated. (B) Dopo 5 giorni consecutivi di 20 min 1-Hz rTMS, espressione di mRNA BDNF era significativamente più alto nella corteccia stimolata rispetto al lato controlaterale (* p <0,05, Wilcoxon test di ranghi). clicca qui per vedere una versione più grande di questa figura.
Discussione
Lo scopo principale di questo studio è stato quello di introdurre un modello animale di rTMS unilaterali. Sebbene stimolazione unilaterale è una delle caratteristiche fondamentali della ricerca rTMS umani, molti studi non hanno adottata nei piccoli animali. Tuttavia, Rotenberg et al. 15 registrate deputati controlaterali con stimolazione del 100% MT utilizzando una bobina figura-8 con diametro lobo esterno di 20 mm, mentre la stimolazione con 112,5% e 133,3% MT prodotta omolaterale nonché deputati controlaterale. Questo potrebbe essere perché il grande campo elettrico indotto può influenzare l'emisfero controlaterale. Così, il nostro studio è un estensione di questo lavoro precedente 15,24, spostando la bobina più laterale e inclinandolo di accentuare la stimolazione unilaterale. Lo scopo primario di questo studio è stato raggiunto perché abbiamo confermato che micro-PET ha rivelato un aumento locale del metabolismo del glucosio nella corteccia cerebrale stimolata dopo TMS (Figura 3).
jove_content "> posizione e l'angolazione della bobina sono passaggi critici in questo esperimento. stimolazione unilaterale è possibile, sistemando il centro delle rTMS bobina 1 cm lateralmente al vertice sulla linea biauricular e angolare i la bobina 45 ° a terra. La stimolazione sito può essere differente dalla corteccia motoria primaria (M1), a seconda della condizione che gli investigatori vogliono bersaglio con rTMS. ad esempio, inteso a migliorare la depressione, la corteccia dorsolaterale prefrontale (DLPFC) è stimolato con rTMS, ma la soglia motore, che viene misurato anche in M1, determina l'intensità di stimolazione anche per DLPFC rTMS Analogamente, l'hotspot -. 0,5 cm lateralmente al vertice sulla linea biauricular - è stato utilizzato per determinare la soglia motoria nel presente studio la corteccia più laterale -. 1 cm lateralmente al vertice - è stato intenzionalmente selezionato per garantire la unilateralità di stimolo e di indagare i cambiamenti molecolari rTMS-indotta. ve_content "> Per quanto riguarda l'intensità del campo magnetico all'interno del tessuto, in un precedente studio elementi finiti in campo elettrico indotto nel cervello di topo, il campo elettrico indotto da 70 mm Figura-8 coil al 75% MSO raggiunto circa 150 V / m sulla superficie del cervello e nella corteccia. l'intensità del campo elettrico è sceso drasticamente la distanza aumentata, mostrando la profondità massima con maggiore di 100 V / m forza era all'1,9 mm per 70 mm figura-8 bobina 25. in un'altra rat studio, in profondità 10 millimetri del campo elettrico indotto ridotta a 25% di quella sulla superficie del cervello 26. è interessante notare che la regione metà potenza (HPR) è stato il più ampio ~ 7 x 7 mm (0,51 cm 2) anche quando a 25 mm figura-8 bobina è stato usato 25. Sebbene numeri concreti non sono stati forniti per la figura-8 bobina 70 mm, Salvador e Miranda commentato che il HPR per la bobina 70 millimetri era più grande di quello della spirale 25 mm. Poiché volevamo evitare che la HPR di coprire ilemisfero controlaterale, abbiamo selezionato una macchia 1 cm lateralmente alla linea mediana. Inclinazione era inevitabile per assicurare il contatto diretto tra il centro della bobina e la superficie del cranio nel punto di stimolazione.L'anestesia può potenzialmente deprimere l'eccitabilità neuronale, il metabolismo del glucosio, e l'espressione genica. Haghighi et al. ha rivelato che isoflurano a concentrazione di 0,5% significativamente depressi deputati transcranica elettrici registrati dai ratti 17. D'altra parte, i deputati sono stati conservati durante infusione di propofol alto come 40 mg / [kg · hr], con ampiezze rimanendo grande nei ratti 18. In uno studio umano, non sono stati rilevati potenziali d'azione muscolare composto (CMAP) durante l'anestesia isoflurano. Tuttavia, 333 Hz, quattro impulsi di stimolazione magnetica evocata CMAP nel muscolo hypothenar nel 75% dei pazienti, e nel muscolo tibiale anteriore nel 65% dei pazienti, durante propofol 19. L'uso di animali risvegliati può essere una scelta migliore nei Physaspetti iological, ma non sono facili da trattenere durante rTMS e sono soggetti a condizioni di stress.
Come la risoluzione dei problemi, un semplice dispositivo di raffreddamento che utilizza una pompa di circolazione dell'acqua ci ha permesso di estendere la durata stimolo per più di 20 minuti, anche ad una frequenza di stimolazione 20 Hz. Questo è importante perché permette altrettanti stimoli come in protocolli rTMS per soggetti umani. Raffreddamento della bobina figura-8 con solo un sacchetto di acqua ghiacciata palmare non è sufficiente a garantire la stimolazione di oltre 20 min. Lunga durata rTMS nei piccoli animali sarà l'occasione per un'indagine approfondita dei meccanismi molecolari di rTMS. Disponibili in commercio bobine di ratto raffreddate saranno alternative ragionevoli.
Ci sono stati diversi limiti in questo esperimento. Innanzitutto, solo un impulso bifasico era disponibile, che era una limitazione della macchina rTMS abbiamo usato. Saranno necessari ulteriori studi che studiano l'effetto di vari legumi e forme d'onda.In secondo luogo, abbiamo adottato un approccio pragmatico per determinare la soglia del motore con la palpazione. Anche se questo metodo può essere inferiore a tecniche EMG in termini di precisione, è facilmente riproducibili e applicabile a molti ipotesi di ricerca. Ad esempio, se lo scopo primario di un ricercatore dovesse indagare le differenze tra la corteccia motoria primaria e subcortices adiacenti gene rTMS indotta o l'espressione di proteine, più precisa determinazione della soglia motoria sarebbe necessario. Se un ricercatore, tuttavia, voluto analizzare rTMS indotta profili di espressione genica nel tessuto corticale prefrontale dorsolaterale, il presente approccio pragmatico può essere sufficiente, perché la distanza e l'angolo tra il tessuto bersaglio e la bobina può variare leggermente durante il movimento della bobina dalla M1 all'area DLPFC. In terzo luogo, anche se abbiamo applicato con successo rTMS sull'emisfero unilaterale del cervello di ratto, ancora la stimolazione non è così focale rTMS nella ricerca umana. La forte fi elettrica indottacampo di ~ 0.5 cm 2 con meno di 10 cm 2 di superficie cervello di ratto sembra relativamente più diffusa di quella sulla superficie emisferica umana di ~ 2500 centimetri 2 27. Riteniamo, tuttavia, che il modello presentato qui può essere utilizzato per chiarire i meccanismi molecolari di rTMS consentendo analisi della differenza inter-emisferico nel suo effetto.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported by the Korea Research Foundation Grant funded by the Korean Government (KRF-2008-313-E00458). The authors thank Jin-Joo Lee for the technical assistance.
Materiali
| Name | Company | Catalog Number | Comments |
| Homeothermic blanket with a rectal probe | Harvard apparatus | 507222F | |
| Isoflurane (Forane sol.) | Choongwae | ||
| Propofol (Provive Inj. 1% 20 ml) | Claris Lifesciences | ||
| Repetitive magnetic stimulator (Magstim Rapid2) | Magstim Company Ltd | ||
| 25 mm figure-of-8 coil | Magstim Company Ltd | 1165-00 | |
| PET-CT | GE Healthcare | ||
| QIAzol Lysis Reagent | Qiagen | (US Patent No. 5,346,994) | |
| RNeasy Lipid Tissue Mini Kit | Qiagen | 74804 | |
| RNeasy Mini Spin Columns | Qiagen | (Mat No. 1011708) | |
| Agilent 2100 Bioanalyzer | Agilent Technologies | ||
| Ambion Illumina RNA amplification kit | Ambion | ||
| Nanodrop Spectrophotometer | NanoDrop | ND-1000 | |
| Illumina RatRef-12 Expression BeadChip | Illumina, Inc. | ||
| Amersham fluorolink streptavidin-Cy3 | GE Healthcare Bio-Sciences |
Riferimenti
- Lefaucheur, J. P., et al. Neurogenic pain relief by repetitive transcranial magnetic cortical stimulation depends on the origin and the site of pain. J Neurol Neurosurg Psychiatry. 75 (4), 612-616 (2004).
- Hirayama, A., et al. Reduction of intractable deafferentation pain by navigation-guided repetitive transcranial magnetic stimulation of the primary motor cortex. Pain. 122 (1-2), 22-27 (2006).
- O'Reardon, J. P., et al. Efficacy and safety of transcranial magnetic stimulation in the acute treatment of major depression: a multisite randomized controlled trial. Biol Psychiatry. 62 (11), 1208-1216 (2007).
- Brighina, F., et al. Facilitatory effects of 1 Hz rTMS in motor cortex of patients affected by migraine with aura. Exp Brain Res. 161 (1), 34-38 (2005).
- Lefaucheur, J. P. Stroke recovery can be enhanced by using repetitive transcranial magnetic stimulation (rTMS). Neurophysiol Clin. 36 (3), 105-115 (2006).
- Khedr, E. M., Ahmed, M. A., Fathy, N., Rothwell, J. C. Therapeutic trial of repetitive transcranial magnetic stimulation after acute ischemic stroke. Neurology. 65 (3), 466-468 (2005).
- Fregni, F., et al. A sham-controlled trial of a 5-day course of repetitive transcranial magnetic stimulation of the unaffected hemisphere in stroke patients. Stroke. 37 (8), 2115-2122 (2006).
- Pascual-Leone, A., Valls-Sole, J., Wassermann, E. M., Hallett, M. Responses to rapid-rate transcranial magnetic stimulation of the human motor cortex. Brain. 117 (4), 847-858 (1994).
- Ridding, M. C., Rothwell, J. C. Is there a future for therapeutic use of transcranial magnetic stimulation). Nat Rev Neurosci. 8 (7), 559-567 (2007).
- Valero-Cabre, A., Payne, B. R., Pascual-Leone, A. Opposite impact on 14C-2-deoxyglucose brain metabolism following patterns of high and low frequency repetitive transcranial magnetic stimulation in the posterior parietal cortex. Exp Brain Res. 176 (4), 603-615 (2007).
- Di Lazzaro, V., et al. The physiological basis of the effects of intermittent theta burst stimulation of the human motor cortex. J Physiol. 586 (16), 3871-3879 (2008).
- Post, A., Keck, M. E. Transcranial magnetic stimulation as a therapeutic tool in psychiatry: what do we know about the neurobiological mechanisms. J Psychiatr Res. 35 (4), 193-215 (2001).
- Muller, P. A., Dhamne, S. C., Vahabzadeh-Hagh, A. M., Pascual-Leone, A., Jensen, F. E., Rotenberg, A. Suppression of motor cortical excitability in anesthetized rats by low frequency repetitive transcranial magnetic stimulation. PLoS One. 9 (3), 91065(2014).
- Funke, K., Benali, A. Modulation of cortical inhibition by rTMS - findings obtained from animal models. J Physiol. 589 (18), 4423-4435 (2011).
- Rotenberg, A., et al. Lateralization of forelimb motor evoked potentials by transcranial magnetic stimulation in rats. Clin Neurophysiol. 121 (1), 104-108 (2010).
- Beom, J., Kim, W., Han, T. R., Seo, K. S., Oh, B. M. Concurrent use of granulocyte-colony stimulating factor with repetitive transcranial magnetic stimulation did not enhance recovery of function in the early subacute stroke in rats. Neurol Sci. 36 (5), 771-777 (2015).
- Haghighi, S. S., Green, K. D., Oro, J. J., Drake, R. K., Kracke, G. R. Depressive effect of isoflurane anesthesia on motor evoked potentials. Neurosurgery. 26, 993-997 (1990).
- Fishback, A. S., Shields, C. B., Linden, R. D., Zhang, Y. P., Burke, D. The effects of propofol on rat transcranial magnetic motor evoked potentials. Neurosurgery. 37 (5), 969-974 (1995).
- Rohde, V., Krombach, G. A., Baumert, J. H., Kreitschmann-Andermahr, I., Weinzierl, M., Gilsbach, J. M. Measurement of motor evoked potentials following repetitive magnetic motor cortex stimulation during isoflurane or propofol anaesthesia. Br J Anaesth. 91 (4), 487-492 (2003).
- Lee, S. A., Oh, B. M., Kim, S. J., Paik, N. J. The molecular evidence of neural plasticity induced by cerebellar repetitive transcranial magnetic stimulation in the rat brain: a preliminary report. Neurosci Lett. 575, 47-52 (2014).
- Fu, Y. K., et al. Imaging of regional metabolic activity by (18)F-FDG/PET in rats with transient cerebral ischemia. Appl Radiat Isot. 67 (18), 1743-1747 (2009).
- Silveyra, P., Catalano, P. N., Lux-Lantos, V., Libertun, C. Impact of proestrous milieu on expression of orexin receptors and prepro-orexin in rat hypothalamus and hypophysis: actions of Cetrorelix and Nembutal. Am J Physiol Endocrinol Metab. 292 (3), 820-828 (2007).
- Zidek, N., Hellmann, J., Kramer, P. J., Hewitt, P. G. Acute hepatotoxicity: a predictive model based on focused illumina microarrays. Toxicol Sci. 99 (1), 289-302 (2007).
- Hsieh, T. H., Dhamne, S. C., Chen, J. J., Pascual-Leone, A., Jensen, F. E., Rotenberg, A. A new measure of cortical inhibition by mechanomyography and paired-pulse transcranial magnetic stimulation in unanesthetized rats. J Neurophysiol. 107 (3), 966-972 (2012).
- Salvador, R., Miranda, P. C. Transcranial magnetic stimulation of small animals: a modeling study of the influence of coil geometry, size and orientation. Conf Proc IEEE Eng Med Biol Soc. 2009, 674-677 (2009).
- Parthoens, J., Verhaeghe, J., Servaes, S., Miranda, A., Stroobants, S., Staelens, S. Performance Characterization of an Actively Cooled Repetitive Transcranial Magnetic Stimulation Coil for the Rat. Neuromodulation. , (2016).
- Toro, R., et al. Brain size and folding of the human cerebral cortex. Cereb Cortex. 18 (10), 2352-2357 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon