Method Article
Repetitive transkranielle Magnetstimulation auf die Einseitige Hemisphäre von Rattenhirn
In diesem Artikel
Zusammenfassung
We applied repetitive transcranial magnetic stimulation (rTMS) to the unilateral hemisphere of rat brain, by placing a 25-mm figure-8 coil 1 cm lateral to the vertex on the biauricular line and angulating the coil by 45°. An in-house water cooling system was used for rTMS for more than 20 min.
Zusammenfassung
Previous rodent models of repetitive transcranial magnetic stimulation (rTMS) adopted whole-brain stimulation instead of unilateral hemispheric rTMS, which is unlike the protocols used for human subjects. We report a successful application of rTMS to the unilateral hemisphere of rat brain. The rTMS was delivered with a low-frequency (1 Hz), high-frequency (20 Hz), or sham stimulation protocol to one side of the brain by using a small 25-mm figure-8 coil. We placed the center of the coil 1 cm lateral to the vertex on the biauricular line and angulated the coil 45° to the ground to minimize a potential direct effect of rTMS on the contralateral cortex. We also used an in-house water cooling system to enable repetitive magnetic stimulation for more than 20 min, even at a 20-Hz stimulation frequency. Increases in the transcriptions of immediate early genes (Arc, Junb, and Egr2) were greater after rTMS than after sham stimulation. After 5 consecutive days of 20-min 1-Hz rTMS, bdnf mRNA expression was significantly higher in stimulated cortex than in contralateral side. The model presented herein will elucidate the molecular mechanisms of rTMS by allowing analysis of the inter-hemispheric difference in its effect.
Einleitung
Repetitive transkranielle Magnetstimulation (rTMS), ein Werkzeug für die nicht-invasive Hirnstimulation und Neuromodulation, wurde bei der Behandlung von verschiedenen Bedingungen, wie die zentrale Schmerz 1,2, Depression 3, Migräne 4 und sogar Schlaganfall 5-7 angewendet. Schnell ändernden elektrischen Stroms durch die Spulen auf dem Kopf eines elektrischen Feldes auf der Hirnrinde und einer resultierenden neuronale Aktivierung induziert. Die Erregbarkeit der Großhirnrinde durch rTMS moduliert werden, die für mehr als 30 min dauern kann nach der Stimulation beendet.
Vorgeschlagene Mechanismen der rTMS Nachwirkung sind Langzeit - Potenzierung / depressionsähnlichen Effekt 8, vorübergehende Verschiebung der Ionenbilanz 9 und metabolischen Veränderungen 10. Darüber hinaus al Di Lazzaro et. legen nahe, dass eine intermittierende Theta-Burst-Stimulation der exzitatorischen synaptischen Eingaben beeinflußt Neuronen Trakt pyramidal, sowohl in der stimuliertenund der kontralateralen Hemisphäre 11.
Wesentliche Einschränkungen haben jedoch behindert Forscher aus der Umrechnung auf Bank Beweise zu klinischen Situationen. Zuerst in früheren Tierstudien wurde rTMS für Whole-Brain - Stimulation 12 verwendet. Whole-Hirnstimulation ist ziemlich verschieden von den Protokollen in Humanstudien verwendeten 9. Das andere Problem ist mit der Stimulationsdauer zusammen. Dies ist zumindest teilweise der Tatsache zuzuschreiben, dass ein wirksames Kühlsystem für kleine Spulen in der Vergangenheit nicht verfügbar war.
In den letzten Jahren haben Samen Artikel veröffentlicht worden Möglichkeiten zur Überwindung dieser Schwierigkeiten in der rTMS Experiment auf der Kleintierhirn hindeutet. Durch diesen Tiermodellen wurde gezeigt , dass die Rattenhirn auch ähnlich kortikalen Erregbarkeit Veränderungen wie in humanen in Reaktion auf niederfrequente rTMS 13 zeigt. Noch wichtiger ist, sind zellulären und molekularen Mechanismen der rTMS bei zunehmendng untersuchten Tiermodellen von rTMS verwenden. Ein Beispiel dafür ist , dass eine unterschiedliche Art von hemmenden Interneuron ist bekannt , am empfindlichsten auf intermittierenden Theta - Burst Stimulation 14 zu sein. Nagetier-Modelle von rTMS somit bieten neue Möglichkeiten für die Erkundung vielgesuchte Fragen über die molekularen Grundlagen der rTMS-induzierte Veränderungen. Wenn kleine Tiermodelle von rTMS können in mehr Laboratorien verwendet werden, kann es erheblich beschleunigen und die Forschung in diesem Bereich zu stärken.
Wir beschreiben nun , wie rTMS zur einseitigen Hemisphäre Rattenhirns anzuwenden, eine Erweiterung der früheren Arbeit 15. Stimulation induzierten Änderungen wurden ausgewertet durch Mikro Positronen-Emissions-Tomographie (PET) und mRNA unter Verwendung von Mikroarrays rTMS-induzierte Veränderungen in der stimulierten Großhirnrinde zu studieren.
Protokoll
Alle Verfahren wurden die Tiere überprüft und genehmigt von der Institutional Animal Care und Use Committee von Seoul National University Hospital mit.
1. Experimenteller Aufbau
- Tiervorbereitung
- Lassen Sie männliche Sprague-Dawley-Ratten 1 Woche an ihre neue Umgebung anzupassen, bevor das Experiment beginnt.
Hinweis: Obwohl 8 Wochen alten Ratten in der vorliegenden Studie verwendet wurden, kann ein Entwicklungs- oder erwachsenen Gehirn nach den Forschungshypothesen gewählt werden.
- Lassen Sie männliche Sprague-Dawley-Ratten 1 Woche an ihre neue Umgebung anzupassen, bevor das Experiment beginnt.
- Inhalationsanästhesie für Induktion
- Einleitung und Aufrechterhaltung einer Narkose mit 5% und 2% Isofluran , gelöst in 40% / 60% und 25% / 75% Sauerstoff / Stickstoff über eine Kammer und Nasenkonus, respectively. Passen Anästhesie Tiefe auf das Niveau der Abschaffung des Pedals Rückzugsreflex bis Fuß Prise richtige anesthetization zu bestätigen.
HINWEIS: aufgeweckt Tiere verwenden, können eine bessere Wahl in der translationalen Begriffe sein, aber es gibt Schwierigkeiten bei der rTMS und t zu beschränkenhey sind anfällig für übermäßige Belastung. - Überwachung der Körpertemperatur mit einer rektalen Sonde und halten sie bei 37 ° C durch eine homeothermic Decke verwendet wird. Überwachung der Narkosetiefe mit Pedalrückzugsreflex, Temperatur, Atemfrequenz und Herzfrequenz.
- Einleitung und Aufrechterhaltung einer Narkose mit 5% und 2% Isofluran , gelöst in 40% / 60% und 25% / 75% Sauerstoff / Stickstoff über eine Kammer und Nasenkonus, respectively. Passen Anästhesie Tiefe auf das Niveau der Abschaffung des Pedals Rückzugsreflex bis Fuß Prise richtige anesthetization zu bestätigen.
- Die Umschaltung auf die intravenöse Anästhesie für die Wartung
- Bereiten Sie den Schwanz mit einem Alkoholtupfer. Katheterisieren eine seitliche Schwanzvene mit 24-Gauge - Katheter für den Übergang zur IV Anästhesie (1A). Last Propofol intravenös (1 mg / [kg · min] über 10 min unter Verwendung von 10 mg / ml Emulsion) an die Tiere. Unterbrechen Sie Isofluran 5 min nach der Propofol-Laden beginnen.
- Aufrechterhaltung Propofolsedierung mit einer Infusionsrate von 500 bis 700 & mgr; g / (kg · min) während des gesamten Experiments, wie es in einer früheren Studie 16. Nachtrag Sauerstoff bei 0,8 l / min über einen Nasenkegel.
HINWEIS: mit Propofol ist es, mögliche Unterdrückung der kortikalen Erregbarkeit durch die inhal zu reduzierenation Mittel 17-19. Jedoch ist Anästhesie in rTMS Experimenten nicht obligatorisch, und awoken Tiere können ebenfalls verwendet werden. Anesthesia Methoden sollten unter Berücksichtigung der Forschungshypothesen entschieden werden. - Verwenden Veterinär Salbe auf die Augen Trockenheit während der Narkose zu verhindern.
- Bewerben Magnetstimulation (siehe Abschnitt 2 ) 10 Minuten nach der vollständigen Umstellung auf iv Anästhesie.
- Wiederherstellungsbedingungen
- Überwachen der Vital während Erholungsphase. Nicht das Tier unbeaufsichtigt lassen, bis es genügend Bewusstsein zu halten Brustlage wiedergewonnen hat. Wenn ein Tier-Operation unterzogen, nicht zurück an die Gesellschaft anderer Tiere, bis sie vollständig erholt.
HINWEIS: Wenn eine Operation für ein Krankheitsmodell durchgeführt wird, postoperative Schmerzbehandlung notwendig ist. Allerdings ist der Schmerzbehandlung für dieses rTMS Experiment benötigt.
- Überwachen der Vital während Erholungsphase. Nicht das Tier unbeaufsichtigt lassen, bis es genügend Bewusstsein zu halten Brustlage wiedergewonnen hat. Wenn ein Tier-Operation unterzogen, nicht zurück an die Gesellschaft anderer Tiere, bis sie vollständig erholt.
2. Repetitive transkranielle Magnetstimulation
- Stimulator und Spule
- Tragen Sie die Stimulation durch eine sich wiederholende Stimulator , die zweiphasige Impulse über eine 25 mm Figur-8 - Spule liefert. Die Mitte der Spule 0,5 cm auf den Scheitelpunkt auf der Linie biauricular lateral und Angulate die Spule 45 ° zum Boden.
HINWEIS: Die maximale magnetische Feldstärke der Spule ist 4,0 T. Die Magnetspule fest an einem Einbau-Halter montiert ist.
- Tragen Sie die Stimulation durch eine sich wiederholende Stimulator , die zweiphasige Impulse über eine 25 mm Figur-8 - Spule liefert. Die Mitte der Spule 0,5 cm auf den Scheitelpunkt auf der Linie biauricular lateral und Angulate die Spule 45 ° zum Boden.
- Motor Schwelle
- Bestimmung der Motorschwelle (MT) an dem Hot Spot, mit dem Zentrum der Spule positioniert 0,5 cm zu dem Scheitelpunkt auf der Linie biauricular seitlich und mit der Oberfläche flach auf die Calvaria. Dies ist die gleiche Methodik in einer früheren Studie verwendet 20.
HINWEIS: Definieren MT wie die Intensität Mindest Stimulus evoziert 5 oder mehr tastbar Kontraktionen auf der Gegen forepaw von 10 aufeinander folgenden Stimuli. Überprüfen Sie, ob die Stimulation kontralateralen Muskelkontraktion in erster Linie, um sicherzustellen, einseitige Stimulation verursacht.
- Bestimmung der Motorschwelle (MT) an dem Hot Spot, mit dem Zentrum der Spule positioniert 0,5 cm zu dem Scheitelpunkt auf der Linie biauricular seitlich und mit der Oberfläche flach auf die Calvaria. Dies ist die gleiche Methodik in einer früheren Studie verwendet 20.
- Die Anwendung von rTMS
- Bewerben rTMS 10 min nach der Stabilisierung der tiefen Narkose. Legen Sie die Mitte der Spule an der Ziel rTMS Ort, von den zerebralen Kortex ausgewählt je nach Forschungsfragen. Dann kippen Sie die Spule direkten Kontakt zwischen dem Spulenzentrum und der Oberfläche des Schädels an der Stimulationsstelle zu gewährleisten.
HINWEIS: Zum Beispiel angulate die Spule 45 ° zum Boden eine potentielle direkte Wirkung von rTMS auf der kontralateralen Kortex (1B und 1C) zu minimieren. - Durch die die Tiere zu einer Sitzung von 20 min rTMS der einseitigen Hemisphäre. Mit der Software-Konsole liefern rTMS mit einer Niederfrequenz (1 Hz), Hochfrequenz (20 Hz), oder Schein-Stimulationsprotokoll und stellen Sie die Stimulationsintensität bei 100-110% der MT.
- Führen 1 Hz Stimulation ohne Rest. Mit der Software-Konsole Eingang "1200" Aufnahmen für "20" min). Für 20 Hz-Stimulation führen 2 sec der Stimulation um 28 gefolgtsec Ruhe. Mit der Software-Konsole Eingang "1600" Aufnahmen für "20" min.
- Für Scheinstimulation, kippen Sie die Spule senkrecht (90 ° -Drehung) an die Schädelkalotte und legen Sie die Spulenkante 2 cm von Kopfoberfläche (Abbildung 1D). Befestigen Sie den Spulenhalter fest mit dem Hauptgerät; es besteht keine Notwendigkeit, die Spule mit der Hand während des Experiments zu halten.
HINWEIS: Um für akustische und andere unspezifische Effekte, verschiedene Schein Protokolle kompensieren sollten für verschiedene Stimulationsprotokolle verwendet werden. So kann beispielsweise 1-Hz-Schein-Stimulation für 1-Hz rTMS Experimente verwendet werden.
- Bewerben rTMS 10 min nach der Stabilisierung der tiefen Narkose. Legen Sie die Mitte der Spule an der Ziel rTMS Ort, von den zerebralen Kortex ausgewählt je nach Forschungsfragen. Dann kippen Sie die Spule direkten Kontakt zwischen dem Spulenzentrum und der Oberfläche des Schädels an der Stimulationsstelle zu gewährleisten.
- Die Kühlung der Spule
- Verwenden Sie System eine Wasserkühlung repetitiven Magnetstimulation für mehr als 20 Minuten bei 1- und 20-Hz Stimulationsfrequenzen (Abbildung 2) zu ermöglichen. Umlaufen eiskaltes Wasser über die gesamte Länge der Spule während des Experiments umgebenden Überhitzen zu verhindern, auch wenn die Temperatur der Spule oder Stimulator nicht überwacht wird.
HINWEIS: Im Handel erhältliche gekühlt Ratte Spulen auch verwendet werden können. - Wenn möglich, zu überwachen, indem Sie die Heizung Messer der rTMS Maschine der Spulentemperatur. HINWEIS: Es gibt keine negativen Folgen auf die rTMS Stimulation verbunden waren. Es gibt jedoch eine potentielle Brandgefahr, wenn Metall Ohr-Identifikationsetiketten in der Nähe der anregenden Spule verwendet werden.
- Verwenden Sie System eine Wasserkühlung repetitiven Magnetstimulation für mehr als 20 Minuten bei 1- und 20-Hz Stimulationsfrequenzen (Abbildung 2) zu ermöglichen. Umlaufen eiskaltes Wasser über die gesamte Länge der Spule während des Experiments umgebenden Überhitzen zu verhindern, auch wenn die Temperatur der Spule oder Stimulator nicht überwacht wird.
3. Micro Positron-Emissions-Tomographie
- Tiervorbereitung
- Führen Inhalationsanästhesie für die Induktion und iv Anästhesie für die Wartung (siehe Schritt 1.2.1 und 1.3.1). Anwenden 1-Hz rTMS an ein Tier für 10 min bei einer Stimulationsintensität von 100-110% der MT.
- Fünf Minuten nach der Stimulation rTMS Beendigung injizieren 1 mCi von 2- [F-18] fluoro-Desoxyglucose (18 FDG) , gelöst in 0,5 ml physiologischer Kochsalzlösung intravenös durch eine Schwanzvenenkatheter. Lassen Sie 30 Minuten für 18 FDG - Aufnahme. HINWEIS: Legen Sie die Ratte unter Narkose während der gesamten Mikro-PET Experiment.
- Die Bildanalyse
- Verwenden Sie einen PET-Scanner für Bildgebung des Gehirns, die Einseitigkeit der Stimulation zu bekräftigen. Rekonstruieren von Bildern mit einem 3-D iterative Algorithmus. Um die Veränderungen im Stoffwechsel von rTMS induziert beurteilen zu können , identifizieren Bereiche von Interesse (ROIs) in den Bildern der Quergehirnabschnitte 21.
- Euthanasie
- Mikro-PET-Bildgebung, euthanize die Ratten in einer Kammer mit Kohlendioxid vorgefüllt, während die Ratten in tiefer Narkose nach der Durchführung.
4. mRNA Microarray
- Euthanasie
- Einleitung und Aufrechterhaltung einer Narkose mit 5% und 2% Isofluran , gelöst in 40% / 60% und 25% / 75% Sauerstoff / Stickstoff über eine Kammer und Nasenkonus, respectively. Anesthetize tief auf das Niveau vor dem Pedal Rückzugsreflex bis Fuß Prise Abschaffung enthauptet.
- Enthaupten die Ratten für Euthanasie 5 min nach 1 Sitzung von 1-Hz rTMS.
- Gewebeernte
- Legen Sie Materialien und chirurgische Instrumente in der Reihenfolge der Verwendung, einschließlich gefaltete Papiertücher, einen Knochen Rongeur, Mikroscheren, größere chirurgische Scheren, einem microforcep, ein Nr 10 oder 11 Skalpellklinge, einem Deckel versehenen 10-cm Petrischale aus Glas mit Eis gefüllt und 1,5-ml-Röhrchen. Bereiten Sie einen Plastikbeutel für die Entsorgung von Karkasse.
- Machen Sie eine Mittellinie Hautschnitt im Schädel anterioposteriorly. Unverblümt sezieren das weiche Gewebe und die umliegenden Muskeln mit chirurgischen Scheren, und entfernen Sie den Schädelknochen Stück einen Knochen Rongeur verwenden. Schnell die frische Gehirn sezieren vorsichtig aus dem Schädel. Dann legen Sie es auf Eis durch die microforceps und Mikroscheren verwenden. Spülen Sie das Hirngewebe in eiskalter physiologischer Kochsalzlösung.
- Übertragen Sie das Gehirn auf Trockeneis sofort und anschließend lagern bei -80 ° C in einem Rohr bis zur weiteren Verarbeitung.
- Tauen Sie das Hirngewebe vor der Ernte.
- Legen Sie das Gehirn dorsalen Seite nach oben, und ernten das Hirngewebe aus dem stHirnrinde (rund um die Hot-Spot im primären motorischen Kortex) auf Eis imulated durch die microforceps und Mikroscheren verwenden. Legen Sie das gewonnene Gewebe in der 1,5-ml-Tube.
- RNA-Präparation
- Extrahieren Sie Gesamt - RNA aus Gewebehomogenisate mit Lysereagenz 22. Prozess mit DNase Verdauung und Clean-up-Verfahren. Quantifizierung der RNA-Proben und Aliquots und lagern Sie sie bei -80 ° C bis zur Verwendung.
- Für die Qualitätskontrolle, RNA Reinheit und Integrität zu bewerten durch Gelelektrophorese Denaturierung bei einem OD-Verhältnis von 260: 280, und analysieren sie auf einem im Handel erhältlichen Analysator.
- Labeling und Reinigung
- Amplifizieren und die Gesamt-RNA zu reinigen, indem eine kommerziell erhältliche RNA Amplification Kit unter Verwendung von biotinylierten cRNA zu ergeben. Kurz gesagt, revers transkribieren 550 ng Gesamt-RNA in cDNA durch eine T7-Oligo (dT) -Primer verwendet wird. Synthetisieren und in vitro transkribieren den zweiten Strang der cDNA und beschriften Sie es dann mit Biotin-NTP.
- Nach purifizierung, quantifizieren cDNA durch Verwendung eines Spektrophotometers.
- Die Hybridisierung und Datenexport 23
- Verwenden Sie den Ausdruck BeadChip für die mRNA-Expressionsanalyse. Hybridisierung der markierten 750-ng cDNA Proben jeder Ratte-12-Expression bead array für 16 bis 18 Stunden bei 58 ° C. Führen Sie die Erkennung von Array-Signal durch Streptavidin-Cy3 verwendet wird.
- Scan-Arrays mit einem konfokalen Scanner. Führen Sie Array-Daten-Export Verarbeitung und Analyse durch einen im Handel erhältlichen Software.
Ergebnisse
Fünfzehn 8 Wochen alte männliche Sprague-Dawley-Ratten wurden für eine separate Interraterreliabilität Analyse von MT Bestimmung verwendet. Mit Palpation von Muskelzuckungen, waren die MTs erhältlich in allen Ratten und gemessen als 33,00 ± 4,21% der maximalen Stimulator Ausgang (% MSO) und 33,93 ± 0,88% MSO, die jeweils von zwei unabhängigen Forschern. Bland-Altman-Bias war -0,93, und die 95% Grenzen der Vereinbarung waren -9,13 bis 7,26%.
In der Mikro-PET - Experiment auf sechs 8-Wochen alten Ratten (n = 4 in 1-Hz rTMS und n = 2 in der Schein - rTMS - Gruppe) wurde die Aufnahme von 18 F-FDG in den ROIs als gemittelt berechnet nCi / cc nach der Kalibrierung sowohl ipsi- und kontralateralen zerebralen Kortex in den gleichen Bildern. Die Radioaktivität in der kontralateralen Bereich wurde als Referenz verwendet, um Daten in der ipsilateralen Bereich und die differentielle Aufnahmeverhältnis (DUR) berechnet wurde erhalten, zu normalisieren.Die mittleren DURS von drei aufeinanderfolgenden Quer Bilder erhalten wurden gemittelt, um die DURS für die Ratten zu erhalten. Dies ist die gleiche Methodik in einer früheren Studie verwendet 21. 18 FDG-PET - Bilder zeigten eine Brenn Anstieg in den Glukosestoffwechsel in der stimulierten linken kortikalen Bereich in der 1-Hz - Gruppe, die Unterstützung der Einseitigkeit der rTMS (Abbildung 3).
In der mRNA Microarray-Studie wurden die Qualität der Hybridisierung und der Gesamtchipleistung durch visuelle Inspektion überwacht sowohl die interne Qualitätskontrolle und rohen gescannten Daten. Arraydaten wurden gemäß einem Detektionswert p gefilterten von <0,05 (ähnlich dem Signal-zu-Rausch-Verhältnis) in mindestens 50% Proben (ein höherer Signalwert wurde benötigt, um ein Detektions p-Wert von <0,05 zu erhalten). Das ausgewählte Gen Signalwert wurde durch Logarithmus transformiert und normalisiert durch ein Quantil-Methode. Die statistische Signifikanz des Ausdrucks data wurde unter Verwendung des Mann-Whitney U-Test und falten Änderung bestimmt, in der die Nullhypothese, dass kein Unterschied zwischen der 1-Hz rTMS vorhanden (n = 4) und sham-Gruppen (n = 4). Die falsche Entdeckung Rate wurde durch Einstellen der p-Wert gesteuert, indem die Benjamini-Hochberg-Algorithmus. Nach der Normalisierung und Filterung, mRNAs zeigt signifikante Differentialausdrücke (| fache Veränderung | 1,2, p <0,05) wurden ausgewählt. Als Ergebnis waren die Expressionsniveaus der unmittelbaren frühen Gene signifikant höher in der Gruppe rTMS als in der Sham - Gruppe, mit den Ausdrücken des Arc, Junb und EGR2 Gene hochreguliert (4A).
Zusätzlich maßen wir BDNF mRNA Ausdrücke in der stimulierten und kontralateralen Kortex nach 5 aufeinanderfolgenden Tagen 20 min rTMS (n = 5 jeweils in der 1-Hz und 20 Hz-Gruppen). Nach 1-Hz - Stimulation war BDNF - mRNA - Expression signifikant higher in der stimulierten Kortex als in der kontralateralen eine (4B). Dabei zeigte sich Differential rTMS-induzierte Veränderungen in den stimulierten und kontralateralen zerebralen Kortex.

Abbildung 1. Experimentelle Settings. (A) ein intravenöser Katheter an einer lateralen Schwanzvene eingeführt wird (Pfeil), und eine Nasenkegel für Anästhesie mit Isofluran sowie für Sauerstoffergänzung nach einer Umschaltung auf intravenösem Propofol verwendet. (B ) Dorsal anterolateraler Ansicht während rTMS. (C) dorsale Ansicht von hinten. Die Oberfläche einer Figur-of-8 - Spule ist 45 ° auf den Boden gewinkelt das Potenzial , eine direkte Stimulation des kontralateralen Kortex zu minimieren. (D) Eine schematische Darstellung Schein rTMS. Die Spule ist von 2 cm entfernt von und kippbar senkrecht (90 ° -Drehung)auf die Schädelkalotte. Bitte hier klicken um eine größere Version dieser Figur zu sehen.
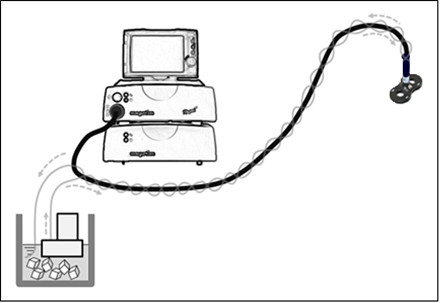
Abbildung 2. Das Kühlsystem verwendet eine Wasserzirkulationspumpe mit Motor. Ice Verpackung auf den Kupferdrähten der Spule ist nicht erforderlich, da das Kühlsystem enwrapping das Kabel der Spule ausreicht, um die Wärme an den Kupferdrähten hergestellt , um abzukühlen. Die Oberfläche der Spule ist nicht in direktem Kontakt mit dem Eiswasser. Das Kühlsystem ist während der Stimulation Sitzungen aktiv.
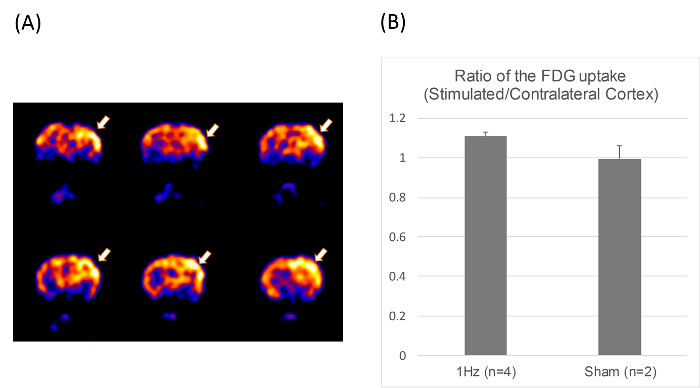
Abbildung 3. Die Positronen - Emissions - Tomographie (PET) Bild. (A) Die Koronalschnitte von Mikro-PET - Bilder voneine Ratte , erhalten unter Verwendung von 2- [F-18] Fluor-Desoxyglucose, erhöhte lokale Glukosestoffwechsel in der stimulierten Kortex zeigt nach 1-Hz rTMS für 10 min bei 100% der MT (Pfeile). (B) Das Verhältnis von FDG - Aufnahme in stimulierte / kontralateralen Kortex in der 1-Hz (n = 4) und Schein rTMS - Gruppe (n = 2). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
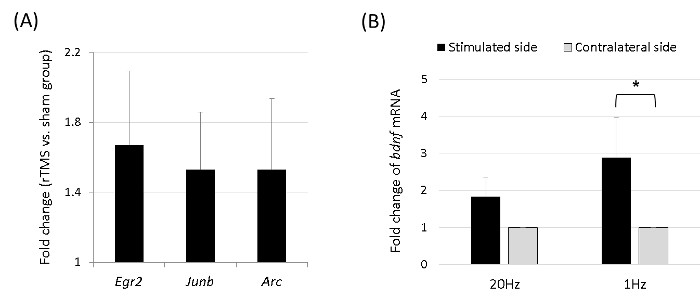
Abbildung 4. Die mRNA Microarray der Immediate Early Gene und BDNF. (A) Arc, Junb und EGR2 unterschiedlich exprimiert wurden, die auf dem Mikroarray erhalten 5 Minuten nach 1 Sitzung von 1-Hz rTMS, geordnet nach fache Änderung identifiziert wurden. Die Expressionsniveaus der Gene waren signifikant höher in der rTMS-Gruppe (n = 4) Than in der Sham - Gruppe (n = 4) (p <0,05 mit Mann-Whitney - U - Test), mit den Ausdrücken der Arc, Junb und EGR2 Gene hochreguliert. (B) Nach 5 aufeinander folgenden Tagen von 20 min 1-Hz rTMS war BDNF - mRNA - Expression signifikant höher in der stimulierten Kortex als in der Gegenseite (* p <0,05, Wilcoxon-Test). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Das primäre Ziel dieser Studie war es, ein Tiermodell der einseitigen rTMS einzuführen. Obwohl einseitige Stimulation eines der grundlegenden Merkmale des menschlichen rTMS Forschung ist, haben viele Studien nicht in kleinen Tieren angenommen. Jedoch Rotenberg et al. 15 aufgezeichnet kontralateralen MEPs mit Stimulation von 100% MT eine Figur-8 - Spule mit einem Außenlappens Durchmesser von 20 mm, während die Stimulation mit 112,5% und 133,3% MT erzeugt ipsilateral sowie kontralateralen MEPs verwenden. Dies könnte sein, da die große induzierte elektrische Feld der kontralateralen Hemisphäre beeinflussen können. So unserer Studie ist eine Erweiterung dieser früheren Arbeit 15,24, durch die Spule mehrere seitliche Verschieben und Kippen es einseitige Stimulation zu betonen. Das primäre Ziel dieser Studie erreicht wurde , weil wir bestätigt , dass Mikro-PET eine lokale Erhöhung des Glukosestoffwechsels in der stimulierten Hirnrinde nach rTMS (Abbildung 3) offenbart.
jove_content "> Lage und Abwinkelung der Spule sind wichtige Schritte in diesem Experiment. Einseitige Stimulation möglich ist, durch die Mitte der rTMS Platzierung Spule 1 cm auf den Scheitelpunkt auf der biauricular Linie lateral und Abwinkeln der Spule 45 ° auf den Boden. Die Stimulation Website kann aus dem primären motorischen Kortex unterschiedlich sein (M1), abhängig von der Bedingung, dass die Ermittler mit rTMS ausrichten möchten. zum Beispiel, Depressionen zu lindern, die dorsolateralen präfrontalen Kortex (DLPFC) mit rTMS stimuliert, aber der Motor Schwelle, die auch in M1 gemessen wird, bestimmt die Stimulationsintensität auch für DLPFC rTMS Ebenso der Hotspot -. 0,5 cm auf den Scheitelpunkt auf der biauricular Linie lateral - verwendet wurde, um den Motor Schwelle in der vorliegenden Studie zur Bestimmung der mehr lateralen Kortex -. 1 cm lateral der Scheitel - wurde absichtlich die Einseitigkeit der Stimulation, um sicherzustellen, ausgewählt und rTMS-induzierte molekulare Veränderungen untersuchen. ve_content "> Wie für die magnetische Feldstärke innerhalb des Gewebes, in einer früheren Finite-Elemente-Modellierung Studie über die induzierte elektrische Feld in dem Gehirn der Maus, das induzierte elektrische Feld, das durch das 70 mm Figur-8-Spule bei 75% MSO V etwa 150 erreicht / m auf der Hirnoberfläche und in der Rinde. die elektrische Feldstärke sank dramatisch Abstand erhöht, die maximale Tiefe mit mehr als 100 V / m Stärke war nur 1,9 mm für die 70 mm Figur-8 - Spule 25. bei einer anderen Ratte zeigt Studie bei 10 mm Tiefe verringert die induzierte elektrische Feldstärke auf 25% derjenigen auf der Hirnoberfläche 26. Interessanterweise ist die Halbleistungsbereich (HPR) so breit war wie ~ 7 x 7 mm (0,51 cm 2) , selbst wenn eine 25 mm Figur-8 - Spule 25 verwendet. Obwohl konkrete Zahlen wurden für die 70 mm Figur-8 - Spule nicht vorgesehen ist , Salvador und Miranda erklärte , dass die HPR für die 70 mm Spule größer war die 25 mm Spule als die. Da wir wollten die HPR verhindern Abdeckung derkontralateralen Hemisphäre, wählten wir einen Punkt 1 cm auf der Mittellinie seitlich. Neigbare war unvermeidlich direkten Kontakt zwischen dem Spulenzentrum und der Oberfläche des Schädels an der Stimulationsstelle zu gewährleisten.Anästhesie kann potenziell neuronaler Erregbarkeit, Glukosestoffwechsel, und die Genexpression drücken. Haghighi et al. dass Isofluran bei einer Konzentration von 0,5% deutlich gedrückt elektrischen transkranielle MEPs ergab , von Ratten 17 aufgezeichnet. Auf der anderen Seite, die Abgeordneten wurden während Propofol - Infusion so hoch wie 40 mg / [kg · h] erhalten, mit Amplituden verbleibenden großen in Ratten 18. In einer Studie am Menschen, keine Aktion Verbindung Muskelpotentiale (CMAP) wurden während Isofluran-Narkose nachgewiesen. Jedoch 333 Hz, Vierimpulsmagnetstimulation evozierte CMAP im hypothenar Muskel in 75% der Patienten, und in der vorderen Tibia - Muskel in 65% der Patienten, während Propofolanästhesie 19. Mit aufgewacht Tiere können eine bessere Wahl in den phys seiniologische Aspekte, aber sie sind nicht leicht während rTMS zu begrenzen und sind anfällig für Stress-Bedingungen.
Als Fehlersuche, dass ein einfacher Kühler eine Wasserzirkulationspumpe verwendet ermöglichte es uns, die Stimulationsdauer für mehr als 20 Minuten, selbst bei einer 20-Hz-Stimulationsfrequenz zu verlängern. Dies ist wichtig, weil es so viele wie Stimulationen in rTMS Protokolle für menschliche Patienten ermöglicht. Die Kühlung der Figur-8-Spule mit nur einem Hand eiskalten Wasserbeutel war nicht ausreichend Stimulation von mehr als 20 min zu gewährleisten. Lange rTMS Dauer bei Kleintieren wird die Gelegenheit für eine eingehende Untersuchung der molekularen Mechanismen der rTMS bieten. Im Handel erhältliche gekühlt Ratte Spulen vernünftige Alternativen sein.
Es gab mehrere Einschränkungen in diesem Experiment. Zunächst wird nur ein zweiphasiger Impuls zur Verfügung, die eine Begrenzung der rTMS Maschine war wir verwendet. Zukünftige Studien die Wirkung von verschiedenen Impulsen und Wellenformen untersuchen die benötigt werden.Zweitens nahmen wir einen pragmatischen Ansatz, um die Motor-Schwelle durch Palpation zu bestimmen. Obwohl diese Methode zu EMG-Techniken in Bezug auf Genauigkeit schlechter sein kann, ist es leicht reproduzierbar und auf viele Forschungshypothesen. Wenn beispielsweise der primäre Zweck eines Forschers zwischen dem primären Motorkortex und benachbarte subcortices in rTMS-induzierte Gen oder Proteinexpression, genauere Bestimmung der Kraftschwelle zu untersuchen Unterschiede waren notwendig wäre. Wenn ein Forscher, wollte jedoch die Analyse-rTMS induzierten Genexpressionsprofile im dorsolateralen präfrontalen kortikalen Gewebe, ist die vorliegende pragmatische Ansatz ausreichen kann, da der Abstand und Winkel zwischen dem Zielgewebe und der Spule leicht während der Bewegung der Spule variieren kann von der M1 auf die DLPFC Bereich. Drittens: Obwohl wir erfolgreich rTMS auf die einseitige Hemisphäre des Rattengehirns angewendet wird, nach wie vor ist die Stimulation nicht als fokale wie rTMS in der Humanforschung. Die induzierte starke elektrische field von ~ 0,5 cm 2 auf weniger als 10 cm 2 der Rattenhirnoberfläche scheint relativ diffuser als in der menschlichen hemisphärischen Oberfläche ~ 2,500 cm 2 27. Wir glauben jedoch, dass das Modell präsentiert hierin verwendet werden können , für die Aufklärung die molekularen Mechanismen der rTMS durch Analyse der inter~~POS=TRUNC Unterschied in der Wirkung zu ermöglichen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by the Korea Research Foundation Grant funded by the Korean Government (KRF-2008-313-E00458). The authors thank Jin-Joo Lee for the technical assistance.
Materialien
| Name | Company | Catalog Number | Comments |
| Homeothermic blanket with a rectal probe | Harvard apparatus | 507222F | |
| Isoflurane (Forane sol.) | Choongwae | ||
| Propofol (Provive Inj. 1% 20 ml) | Claris Lifesciences | ||
| Repetitive magnetic stimulator (Magstim Rapid2) | Magstim Company Ltd | ||
| 25 mm figure-of-8 coil | Magstim Company Ltd | 1165-00 | |
| PET-CT | GE Healthcare | ||
| QIAzol Lysis Reagent | Qiagen | (US Patent No. 5,346,994) | |
| RNeasy Lipid Tissue Mini Kit | Qiagen | 74804 | |
| RNeasy Mini Spin Columns | Qiagen | (Mat No. 1011708) | |
| Agilent 2100 Bioanalyzer | Agilent Technologies | ||
| Ambion Illumina RNA amplification kit | Ambion | ||
| Nanodrop Spectrophotometer | NanoDrop | ND-1000 | |
| Illumina RatRef-12 Expression BeadChip | Illumina, Inc. | ||
| Amersham fluorolink streptavidin-Cy3 | GE Healthcare Bio-Sciences |
Referenzen
- Lefaucheur, J. P., et al. Neurogenic pain relief by repetitive transcranial magnetic cortical stimulation depends on the origin and the site of pain. J Neurol Neurosurg Psychiatry. 75 (4), 612-616 (2004).
- Hirayama, A., et al. Reduction of intractable deafferentation pain by navigation-guided repetitive transcranial magnetic stimulation of the primary motor cortex. Pain. 122 (1-2), 22-27 (2006).
- O'Reardon, J. P., et al. Efficacy and safety of transcranial magnetic stimulation in the acute treatment of major depression: a multisite randomized controlled trial. Biol Psychiatry. 62 (11), 1208-1216 (2007).
- Brighina, F., et al. Facilitatory effects of 1 Hz rTMS in motor cortex of patients affected by migraine with aura. Exp Brain Res. 161 (1), 34-38 (2005).
- Lefaucheur, J. P. Stroke recovery can be enhanced by using repetitive transcranial magnetic stimulation (rTMS). Neurophysiol Clin. 36 (3), 105-115 (2006).
- Khedr, E. M., Ahmed, M. A., Fathy, N., Rothwell, J. C. Therapeutic trial of repetitive transcranial magnetic stimulation after acute ischemic stroke. Neurology. 65 (3), 466-468 (2005).
- Fregni, F., et al. A sham-controlled trial of a 5-day course of repetitive transcranial magnetic stimulation of the unaffected hemisphere in stroke patients. Stroke. 37 (8), 2115-2122 (2006).
- Pascual-Leone, A., Valls-Sole, J., Wassermann, E. M., Hallett, M. Responses to rapid-rate transcranial magnetic stimulation of the human motor cortex. Brain. 117 (4), 847-858 (1994).
- Ridding, M. C., Rothwell, J. C. Is there a future for therapeutic use of transcranial magnetic stimulation). Nat Rev Neurosci. 8 (7), 559-567 (2007).
- Valero-Cabre, A., Payne, B. R., Pascual-Leone, A. Opposite impact on 14C-2-deoxyglucose brain metabolism following patterns of high and low frequency repetitive transcranial magnetic stimulation in the posterior parietal cortex. Exp Brain Res. 176 (4), 603-615 (2007).
- Di Lazzaro, V., et al. The physiological basis of the effects of intermittent theta burst stimulation of the human motor cortex. J Physiol. 586 (16), 3871-3879 (2008).
- Post, A., Keck, M. E. Transcranial magnetic stimulation as a therapeutic tool in psychiatry: what do we know about the neurobiological mechanisms. J Psychiatr Res. 35 (4), 193-215 (2001).
- Muller, P. A., Dhamne, S. C., Vahabzadeh-Hagh, A. M., Pascual-Leone, A., Jensen, F. E., Rotenberg, A. Suppression of motor cortical excitability in anesthetized rats by low frequency repetitive transcranial magnetic stimulation. PLoS One. 9 (3), 91065(2014).
- Funke, K., Benali, A. Modulation of cortical inhibition by rTMS - findings obtained from animal models. J Physiol. 589 (18), 4423-4435 (2011).
- Rotenberg, A., et al. Lateralization of forelimb motor evoked potentials by transcranial magnetic stimulation in rats. Clin Neurophysiol. 121 (1), 104-108 (2010).
- Beom, J., Kim, W., Han, T. R., Seo, K. S., Oh, B. M. Concurrent use of granulocyte-colony stimulating factor with repetitive transcranial magnetic stimulation did not enhance recovery of function in the early subacute stroke in rats. Neurol Sci. 36 (5), 771-777 (2015).
- Haghighi, S. S., Green, K. D., Oro, J. J., Drake, R. K., Kracke, G. R. Depressive effect of isoflurane anesthesia on motor evoked potentials. Neurosurgery. 26, 993-997 (1990).
- Fishback, A. S., Shields, C. B., Linden, R. D., Zhang, Y. P., Burke, D. The effects of propofol on rat transcranial magnetic motor evoked potentials. Neurosurgery. 37 (5), 969-974 (1995).
- Rohde, V., Krombach, G. A., Baumert, J. H., Kreitschmann-Andermahr, I., Weinzierl, M., Gilsbach, J. M. Measurement of motor evoked potentials following repetitive magnetic motor cortex stimulation during isoflurane or propofol anaesthesia. Br J Anaesth. 91 (4), 487-492 (2003).
- Lee, S. A., Oh, B. M., Kim, S. J., Paik, N. J. The molecular evidence of neural plasticity induced by cerebellar repetitive transcranial magnetic stimulation in the rat brain: a preliminary report. Neurosci Lett. 575, 47-52 (2014).
- Fu, Y. K., et al. Imaging of regional metabolic activity by (18)F-FDG/PET in rats with transient cerebral ischemia. Appl Radiat Isot. 67 (18), 1743-1747 (2009).
- Silveyra, P., Catalano, P. N., Lux-Lantos, V., Libertun, C. Impact of proestrous milieu on expression of orexin receptors and prepro-orexin in rat hypothalamus and hypophysis: actions of Cetrorelix and Nembutal. Am J Physiol Endocrinol Metab. 292 (3), 820-828 (2007).
- Zidek, N., Hellmann, J., Kramer, P. J., Hewitt, P. G. Acute hepatotoxicity: a predictive model based on focused illumina microarrays. Toxicol Sci. 99 (1), 289-302 (2007).
- Hsieh, T. H., Dhamne, S. C., Chen, J. J., Pascual-Leone, A., Jensen, F. E., Rotenberg, A. A new measure of cortical inhibition by mechanomyography and paired-pulse transcranial magnetic stimulation in unanesthetized rats. J Neurophysiol. 107 (3), 966-972 (2012).
- Salvador, R., Miranda, P. C. Transcranial magnetic stimulation of small animals: a modeling study of the influence of coil geometry, size and orientation. Conf Proc IEEE Eng Med Biol Soc. 2009, 674-677 (2009).
- Parthoens, J., Verhaeghe, J., Servaes, S., Miranda, A., Stroobants, S., Staelens, S. Performance Characterization of an Actively Cooled Repetitive Transcranial Magnetic Stimulation Coil for the Rat. Neuromodulation. , (2016).
- Toro, R., et al. Brain size and folding of the human cerebral cortex. Cereb Cortex. 18 (10), 2352-2357 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten