Method Article
Sviluppo di un multicellulare tridimensionale Organotipica Modello della mucosa intestinale umana coltivate in microgravità
In questo articolo
Riepilogo
Cellule che crescono in un ambiente tridimensionale (3-D) rappresentano un netto miglioramento rispetto coltura cellulare in ambienti 2-D (ad esempio, flaconi o piatti). Qui si descrive lo sviluppo di un modello 3-D organotipica multicellulare della mucosa intestinale umana coltivate in microgravità fornito ruotando parete dei vasi (RWV) bioreattori.
Abstract
Poiché le cellule che crescono in un ambiente tridimensionale (3-D) hanno il potenziale per colmare molte lacune di coltivazione di cellule in ambienti 2-D (ad es., Flaconi o piatti). In realtà, è ampiamente riconosciuto che le cellule coltivate in fiaschi o piatti tendono a de-differenziarsi e perdere funzioni specializzate dei tessuti da cui sono stati derivati. Attualmente, ci sono principalmente due tipi di sistemi di coltura 3-D dove le cellule vengono seminate in ponteggi che mimano la matrice nativa extracellulare (ECM): modelli (b) utilizzando bioreattori (a) modelli statici e. La prima svolta è stato il modelli statici 3-D. modelli 3-D utilizzando bioreattori come la rotazione-parete del vaso (RWV) bioreattori sono uno sviluppo più recente. Il concetto originale dei bioreattori RWV è stato sviluppato al Johnson Space Center della NASA nei primi anni 1990 e si crede di superare i limiti dei modelli statici, come lo sviluppo di ipossia, nuclei necrotiche. I bioreattori RWV potrebbero aggirare °è problema fornendo fluidodinamica che permettono la diffusione efficiente di nutrienti e ossigeno. Questi bioreattori sono costituiti da una base dei rotatori che serve a sostenere e ruotare due diversi formati di recipienti di coltura che si differenziano per il loro tipo di fonte di aerazione: (1) di tornitura lenti Vessels laterale (STLVs) con un ossigenatore coassiale al centro, o (2 ) Le navi ad alta Aspect Ratio (HARVs) con l'ossigenazione tramite un appartamento, membrana di trasferimento di gas in gomma siliconica. Questi vasi consentono il trasferimento del gas efficiente, evitando la formazione di bolle e la conseguente turbolenza. Queste condizioni determinano flusso laminare e forza di taglio minimo che i modelli di gravità ridotta (microgravità) all'interno del recipiente di coltura. Qui si descrive lo sviluppo di un modello 3-D organotipica multicellulare della mucosa intestinale umana composta di una linea intestinale cellule epiteliali e linfociti umani primari, cellule endoteliali e fibroblasti coltivati in microgravità fornito dal bioreattore RWV. </ P>
Introduzione
Il primo passo avanti nella costruzione di un modello 3-D è stata riportata nei primi anni del 1980, quando gli scienziati hanno iniziato a studiare i diversi tipi di ponteggio (ad es., Laminina, collagene di tipo I, collagene IV, e fibronectina) e cocktail di fattori di crescita per migliorare cellula-cellula e le interazioni ECM di modelli 3-D "statiche" 1-7. Da allora, il problema principale con questi modelli ha limitazioni nel trasferimento dei nutrienti e ossigeno all'interno del mezzo e del tessuto costrutti 8. In contrasto con le cellule per l'ambiente in vivo che riceve un flusso costante di nutrienti e ossigeno dalle reti di vasi sanguigni circostanti, la staticità di questi modelli ostacola la distribuzione effettiva di loro alle cellule. Ad esempio, aggregati di cellule generate in modelli statici in vitro che superano un paio di millimetri invariabilmente sviluppare ipossia, core necrotico 9. I bioreattori RWV potrebbero aggirare questo problemafornendo fluidodinamica che permettono la diffusione efficiente di nutrienti e ossigeno 10-12. Tuttavia, ad oggi, il lavoro utilizzando bioreattori RWV è stato limitato alla iscrizione di uno o due tipi di cellule 13-17. Inoltre, invece di un orientamento spaziale simile a tessuti nativi, quelle cellule formano aggregati cellulari. Il motivo principale di queste limitazioni è stata la mancanza di un ponteggio in grado di incorporare le cellule in modo integrato. I ponteggi utilizzati nei bioreattori RWV fino ad oggi sono costituiti, con poche eccezioni 16-18, principalmente di microsfere sintetiche, cilindri tubolari o piccoli fogli 13-15,19-23. Questi sono materiali rigidi cui composizione e flessibilità non possono essere manipolati, e che le cellule sono attaccate alla loro superficie. Pertanto, è improbabile che questi modelli fornirà un sistema in cui valutare, in modo integrato, i vari componenti cellulari come cellule stromali (ad es., Fibroblasti, cellule immunitarie e endoteliali) che should essere disperso all'interno del patibolo per imitare da vicino il tessuto umano.
Qui si descrive lo sviluppo di un modello 3-D organotipica multicellulare della mucosa intestinale umana composta di una linea intestinale cellule epiteliali e linfociti umani primari, cellule endoteliali e fibroblasti 24. Queste cellule sono state coltivate in microgravità fornire da parte del RWV bioreattore 13,25-30. Nel nostro modello 3-D, il ECM possiede molte proprietà distinte, come un'osmolalità simile al mezzo di coltura (per es., Trascurabili limitazioni diffusionali durante cultura) e la capacità di incorporare cellule e altre proteine della matrice extracellulare pertinenti, nonché la adeguata rigidità da utilizzare in bioreattori 24. I sistemi biologici sono molto complessi, e nel corso degli ultimi anni, c'è stato un cambiamento nel centro di ricerca della mucosa verso l'esame delle interazioni cellulari con l'ambiente circostante, piuttosto che studiare in isolation. In particolare, l'importanza delle interazioni cellula-cellula nell'influenzare sopravvivenza cellulare intestinale e differenziazione è ben documentato 31-34. In particolare, la comunicazione tra le cellule epiteliali e la loro nicchia ha una profonda influenza sulla espansione delle cellule epiteliali e la differenziazione 35. Infatti, è ampiamente riconosciuto che non solo cellula-cellula, ma anche cellula-ECM interazioni sono fondamentali per il mantenimento e la differenziazione delle cellule epiteliali in modelli di coltura 3-D. Studi precedenti hanno dimostrato che le proteine nell'intestino ECM come il collagene I 24,36,37, laminina 38 e fibronectina 39 sono strumentali per influenzare le cellule epiteliali intestinali di acquisire orientamento spaziale simile alla mucosa nativo. Pertanto, lo sviluppo di nuove tecnologie, come il nostro modello 3-D 24, che può imitare è necessaria la diversità fenotipica dell'intestino se i ricercatori intendono ricreare la complessa architettura cellulare e strutturalee funzione del microambiente intestinale. Questi modelli rappresentano uno strumento importante per lo sviluppo e la valutazione di nuovi farmaci per via orale e vaccini candidati.
Protocollo
Dichiarazione etica: Tutti i campioni di sangue sono stati prelevati da volontari che hanno partecipato in numero di protocollo HP-00.040.025-1. L'Università del Maryland Institutional Review Board ha approvato questo protocollo e ha autorizzato la raccolta di campioni di sangue di volontari sani per gli studi inclusi in questo manoscritto. Lo scopo di questo studio è stato spiegato ai volontari, e tutti i volontari ha dato informato, firmato il consenso prima del prelievo di sangue.
Nota: Vedere la Tabella 1 per la preparazione supplemento di media. Vedere la Tabella 2 per la preparazione di terreni di coltura 3-D.
1. Preparazione delle navi Cultura
- Svitare il tappo della porta di riempimento del ml vasi 50 e riempire con 50 ml di terreno di coltura sterile (ad es., RPMI). Eseguire tutte le operazioni in condizioni sterili in una cappa laminare.
- Riposizionare il tappo e pulire qualsiasi mezzo versato su qualsiasi superficie con il 70% di etanolo.
- Permettere alla nave di incubmangiato per almeno 15 minuti per O / N a temperatura ambiente.
- Utilizzare la porta di riempimento di scartare il terreno di coltura e aggiungere 30 ml di terreno di coltura 3-D.
- Pulire qualsiasi mezzo versato su qualsiasi superficie con il 70% di etanolo.
2. Preparazione delle cellule
- Umano linea di cellule epiteliali (HCT-8) 24,40.
- cellule di coltura in RPMI integrato con 100 U / ml di penicillina, 100 ug / ml di streptomicina, 50 mg / ml gentamicina, 2 mM L-glutammina, 1 mM piruvato di sodio, 10 mM tampone HEPES e siero fetale bovino inattivato al calore del 10% (FBS ) (supplemento 1). Al 70% di confluenza, dividere le celle in un rapporto di 1: 5.
- Fibroblasti umani (cellule del colon CCD-18Co) 24,41.
- Cellule di coltura in terreno di basale Aquila arricchita con supplemento 1 alla confluenza, dividere le celle in un rapporto di 1: 3..
- Ombelicale umana Vena cellule endoteliali (HUVEC) 24,42.
- Cellule di coltura in endoteliale basale medio (EBM) di media arricchiti con 100 mg / ml di eparina, 3 mg / ml Endothelial Growth Supplement cellulare (ECGS), e supplemento 1 al 70% confluenza, dividere le celle in un rapporto di 1:. 2.
- Linfociti / monociti
- Isolare le cellule mononucleate del sangue periferico (PBMC) dal sangue mediante centrifugazione in gradiente di densità utilizzando tecniche standard 43.
- Brevemente, utilizzando un ml-pipetta 10, aggiungere con cautela 30 ml di sangue diluito (1: 1 sangue: tampone fosfato (PBS)) in una provetta da 50 ml conica contenente 10 ml di mezzi densità centrifugazione. Dopo la fase di centrifugazione, linfociti e monociti risiederanno nello strato di "bianco" tra i media densità centrifugazione e strati di plasma.
- Raccogliere lo strato bianco con una pipetta di trasferimento. Evitare la contaminazione dei granulociti, limitando la raccolta dei media densità centrifugazione. Dopo il lavaggio 43, use PBMC come è o crioconservati in liquido N 2.
Nota: È importante sottolineare che PBMC consiste principalmente di linfociti e monociti, con una piccola percentuale di cellule dendritiche e altri tipi di cellule.
- Isolare le cellule mononucleate del sangue periferico (PBMC) dal sangue mediante centrifugazione in gradiente di densità utilizzando tecniche standard 43.
- Grow tutte le cellule in condizioni di coltura standard a 37 ° C in atmosfera al 5% di CO 2.
3. Preparazione di cellule collagene-embedded
- Determinare il numero di inserti necessario in base al numero di condizioni sperimentali da set-up. Posizionare il numero appropriato di inserti nei pozzetti di un 6-pozzetti.
- Preparare una sospensione di HUVEC e fibroblasti:
- Lavare i palloni due volte in PBS e staccare le cellule con tripsina, 0,25% (1x) con 0,05% tripsina-tetrasodico etilendiamminatetraacetato (tripsina-EDTA). Aggiungere la soluzione tripsina sufficiente a coprire la totalità della superficie di coltura cellulare. Il distacco di solito avviene entro 5 a 15 min
- Collezionarecellule indipendente in un 50 ml tubo contenente 30 ml di terreno Dulbecco Modified Eagle (DMEM) -30% FBS media.
- Centrifugare la provetta a 500 xg per 10 min.
- Risospendere le cellule in 30 ml di DMEM-30% FBS media.
- Contare il numero totale di cellule vitali diluendo 20 ml di cellule risospese con 20 ml di Trypan colorante blu. Caricare il emocitometro con la miscela di cellule. PBMC vitali saranno bianchi chiari; non vitale PBMC acquisirà il colorante e diventare blu.
- Risospendere ogni tipo di cellula in DMEM-30% FBS mezzo ad una concentrazione di 5 - 8 x 10 7 cellule ml - 1.
- Preparare gel di collagene di cellule contenenti
Nota: Ogni nave richiede la preparazione di ~ 5 ml di gel di collagene di cellule contenenti.- In una provetta da 50 ml conica preparare la miscela di collagene aggiungendo 1 media x DMEM, addizionato con 50 pg / ml gentamicina, 2 mM L-glutammina e 10% calore inactivated FBS più 3 mg / ml bovina collagene-I, 10 ug / laminina ml, 40 mg / ml di collagene IV, 10 ug / ml di fibronectina, 2 mg / ml di eparina solfato proteoglicani e 15 mM NaOH (per raggiungere il pH fisiologico).
- Chiudere la provetta e mescolare capovolgendo più volte fino a quando il composto è completamente omogeneizzato. Evitare la formazione di bolle.
IMPORTANTE: mantenere la miscela in ghiaccio per prevenire gelificazione.- Passaggio fondamentale: Se la miscela sviluppa un aspetto acida (colore giallastro), aggiungere qualche goccia di sterile 1 N NaOH per neutralizzare la miscela.
- Aggiungere HUVEC concentrato e fibroblasti ad una densità di 1,0 - 1,2 e 1,5 - 2,0 x 10 6 cellule / ml, rispettivamente, alla miscela arricchita-collagene (sopra descritto). Chiudere le provette e mescolare capovolgendo più volte fino a quando il composto è completamente omogeneizzato. Evitare la formazione di bolle. IMPORTANTE: mantenere la miscela in ghiaccio per prevenire gelificazione.
- Aggiungere 4 - 5 ml di collagene di cellule contenentigel per ogni inserto, precedentemente caricato in un 6 a micropiastre, e lasciata gelify nella cappa con poco o nessun movimento per 1 ora.
- Dopo 1 ora, trasferire il 6 pozzetti a 37 ° C, 5% CO 2 incubatore per 1 - 2 ore supplementari.
- Riportare la piastra da 6 pozzetti alla cappa, e con l'aiuto di una pinza sterile e bisturi asetticamente cut-off la membrana dall'inserto staccare il gel cella contenente dalla membrana. Tagliare il gel indipendente in piccoli quadrati (~ 5 x 5 mm).
- Aggiungere le piccole piazze di cellule contenenti in un HARV da 50 ml utilizzando la porta di riempimento.
- Preparare una sospensione di HCT-8 cellule epiteliali:
- Lavare i palloni due volte in PBS e staccare le cellule con tripsina, 0,25% (1x) con il trattamento tripsina-EDTA. Aggiungere la soluzione tripsina sufficiente a coprire la totalità della superficie di coltura cellulare. Il distacco di solito si verifica entro 10 o 15 minuti.
- Raccogliere le cellule staccate in 30 ml di DMEM-30% di media FBS.
- centrifuge DMEM-30% di media FBS contenente tubo a 500 xg per 10 min.
- Risospendere le cellule in 30 ml di DMEM-30% FBS media.
- Contare il numero totale di cellule vitali come descritto in 3.2.5.
- Risospendere le cellule epiteliali HCT-8 in DMEM-30% FBS mezzo ad una concentrazione di 10 7 cellule ml - 1.
- Aggiungere 1 ml di concentrato HCT-8 cellule epiteliali in 50 ml HARV utilizzando la porta di riempimento.
- Utilizzando la porta di riempimento, aggiungere ulteriori terreno di coltura in 3-D fino a quando la nave è quasi pieno (~ 20 ml).
- Riposizionare il tappo e pulire il bordo della porta di riempimento con il 70% di etanolo.
- Inserire una siringa in ogni porto siringa del RWV: posto a 5 ml-siringa contenente 3 - 4 ml di terreno di coltura 3-D in una porta e una siringa da 5 ml vuota sull'altra porta.
- Rimuovere eventuali bolle visibili tirando nella siringa vuota mentre circa lo stesso volume di terreno viene iniettato attraverso l'altra porta siringa.
- Posizionare le vessels nel bioreattore, accendere l'alimentazione e impostare la velocità a circa 13 a 14 giri al minuto.
Nota: passaggio fondamentale: velocità di rotazione può essere necessario regolare un paio di volte nel corso di un esperimento per mantenere le cellule in orbita all'interno della nave, evitando in tal modo il contatto con le pareti dei vasi. - Cellule di coltura a 37 ° C, 5% CO 2 sotto microgravità, forniti dal bioreattore RWV.
- Cambiare la cultura media ogni 3 - 4 giorni, sostituendo circa 30 ml con terreno di coltura 3-D fresco.
- Dopo 4 giorni (± 1 giorno), rimuovere le navi dal bioreattore e aggiungere linfociti / monociti ai vasi (2 x 10 7 / nave).
- Posizionare i vasi nel bioreattore a 37 ° C, 5% CO 2 per altri 5 giorni (± 1 giorno).
- Dopo i supplementari di 5 giorni (giorno 9 della cultura), aggiungere linfociti / monociti ai vasi (2 x 10 7 / nave) e continuare le culture per un massimo di 12 giorni aggiuntivi.
- Cambiare la cultura media ogni 3 - 4 giorni, sostituendo circa 30 ml con terreno di coltura 3-D fresco.
4. raccolta 3-D Culture per Istologia
- Con l'aiuto di un raccolto trasferimento pipetta ogni piccolo frammento gel, ora chiamato "costruire", in una piastra di sei pozzetti contenenti 10 ml di tampone di formalina al 10%. Lasciare riposare per 3 ore a temperatura ambiente o per 12 - 16 ore a 4 ° C.
- Preparare la lavorazione dei tessuti e cassette incorporazione mediante l'etichettatura e l'aggiunta di due pezzi di cuscinetti in schiuma biopsia in ogni cassetta.
- Immergere le cassette a 10% buffer di formalina.
- Con l'aiuto di pinze posizionare i costrutti fissi tra le due spugne.
- Immergere le cassette a 10% buffer di formalina.
- Procedere con procedure standard per l'incorporamento, sezionamento, e colorazione 44.
Risultati
Precedentemente abbiamo progettato un modello 3-D organotipica multicellulare della mucosa intestinale umana comprendente una linea intestinale cellule epiteliali e linfociti umani primari, cellule endoteliali e fibroblasti coltivati in condizioni di microgravità 24 (Figura 1). Fibroblasti e cellule endoteliali sono stati incorporati in una matrice di collagene I arricchito con proteine di membrana aggiuntiva intestino seminterrato 45 (es., Laminina, collagene IV, fibronectina e eparina solfato proteoglicani) e aggiunti al RWV bioreattori. Dopo 10 - 15 giorni, analisi colorazione istologica ha dimostrato la presenza di strutture villi-simili nei costrutti. Circa 60 - 80% di queste cellule epiteliali sono stati organizzati come un monostrato di cellule polarizzate con i loro nuclei situati in una posizione vicino al basale ECM, che è una caratteristica importante di cellule ben differenziati (Figura 2).
ent "fo: keep-together.within-page =" 1 ">
Figura 1: Schema della costruzione del modello 3-d. Quattro passi sono necessari per costruire il sistema 3-D. In primo luogo, per ottenere il numero di cellule per generare il modello 3-D, una linea umana intestinale cellule epiteliali enterociti (HCT-8) e cellule endoteliali umane primarie e fibroblasti vengono coltivate come monostrati confluenti 2-D. In secondo luogo, l'ECM composta di collagene-I MATRIX arricchita con proteine di membrana aggiuntiva intestino seminterrato (es., Laminina, collagene IV, fibronectina ed eparina solfato proteoglicani) è preparato. Terzo, fibroblasti e cellule endoteliali sono incorporati in una miscela di collagene-I e aggiunti RWV bioreattori seguiti dall'aggiunta HCT-8 cellule epiteliali. Quarto, linfociti primari sono aggiunti alla coltura a giorni 4 e 9 (± 1 giorno)."> Clicca qui per vedere una versione più grande di questa figura.
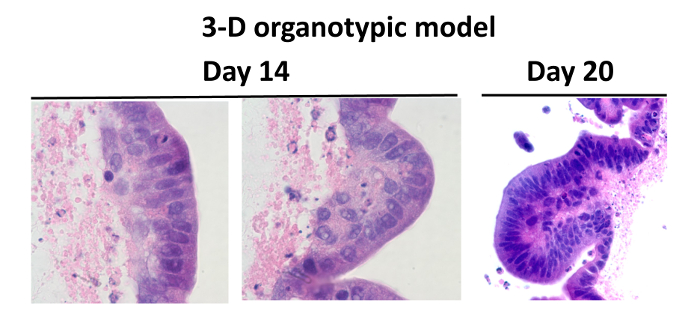
Figura 2: confronto tra la normale Intestino umano ei modelli organotipiche. Colorazione ematossilina-eosina delle cellule in coltura nel modello di microgravità 3-D: tessuti erano macchiati viola e impalcatura macchiati rosa. Le cellule del modello 3-D sono state coltivate per 14 ( "a" e "b") e 20 giorni (c). Venti giorni dopo la semina, il numero di cellule totale sono mantenuti, e le cellule erano caratteristiche dei villi-come mostrare ben differenziati. Le immagini vengono visualizzate a 100X ( "a" e "b") e 40X ( "C") di ingrandimento. Cliccate qui per vedere una versione più grande di questa figura.
| nome del prodotto | Pkg. Dimensione | ricostituzione | concentrazione di lavoro | Conservazione |
| Fibroblast Growth Factor-Basic (bFGF) | 25 mg | Per preparare / ml di soluzione di 25 mg; aggiungere 25 mg di FGF in 1 ml di terreno sterile (RPMI più 1% FCS), turbine per sciogliere, aggiungere 100 ml / aliquota | 5 ng / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| Stem Cell Factor (SCF) | 10 mg | Per preparare / ml di soluzione 10 mg; aggiungere 10 mg di SCF in 1 ml di terreno sterile (RPMI più 1% FCS), turbine per sciogliere, aggiungere 250 ml / aliquota | 5 ng / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| Fattore di crescita degli epatociti (HGF) | 5 mg | Per preparare / ml di soluzione 5 mg; aggiungere 5 mg di HGF in 1 ml di terreno sterile (RPMI più 1% FCS), turbine per sciogliere, aggiungere 200 ml / aliquota | 2 ng / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| endotelina 3 | 50 mg | Per preparare / ml di soluzione 50 mg; aggiungere 50 mg di endoteline in 1 ml di terreno sterile (RPMI più 1% FCS), turbine per sciogliere, aggiungere 100 ml / aliquota | 10 ng / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| laminina | 1 mg | Scongelare lentamente a 2 - 8 ° C, turbolenza e aggiungere 100 ml / aliquota | 10 mg / ml | liquido -20 ° C, lavorando aliquote -20 ° C, evitare di ripetere freEze / disgelo |
| Vascular Endothelial Growth Factor (VEGF) | 10 mg | Per preparare / ml di soluzione 5 mg; aggiungere 10 mg di VEGF in 2 ml di acqua sterile, turbine a sciogliere, aggiungere 100 ml / aliquota | 1 ng / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| Leucemia inibitorio Factor (LIF) | 50 mg | Per preparare / ml di soluzione 20 mg; aggiungere 50 mg di LIF in 2,5 ml di acqua sterile, turbine a sciogliere, aggiungere 100 ml / aliquota | 4 ng / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| adenina | 25 g | Per preparare 0,18 M di soluzione; aggiungere 121.5 mg og adedine in 50 ml di 0,05 M HCl (250 ml di HCl 37,1% in 50 ml di acqua)), agitare per sciogliere, filtrare sterilizzare eAggiungere 1 ml / aliquota | 1,8 x 10 -3 M | polvere di 4 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| Insulina | 50 mg | Per preparare 5 mg / ml di soluzione; aggiungere 50 mg di insulina in 10 ml di 0,005 M HCl (5 ml di HCl 37,1% in 10 ml di acqua)), agitare per sciogliere, filtrare sterilizzare e aggiungere 0,5 ml / aliquota | 5 mg / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| T3 | 100 mg | Per preparare 2 x 10 -8 soluzione madre M; aggiungere 3,4 mg di T3 in 25 ml di 1 M NaOH, diluire 0,1 ml di questa soluzione in 9,9 ml di PBS, diluire nuovamente 0,1 ml di questa soluzione in 9,9 ml di PBS, agitare per sciogliere, filtrare sterilizzare e aggiungere 0,5 ml / aliquota | 2 x 10 -11 M | polvere di -20 ° C, -20 aliquote di lavoro o C, evitare di ripetere il gelo / disgelo |
| la tossina del colera | 5 mg | Per preparare 10 -7 soluzione madre M; aggiungere 5 mg di tossina colerica in 5 ml di DDH 2 O sterile (conservare a -20 ° C); Diluire 50 ml di questa soluzione in 5 ml DDH 2 O, turbine di omogeneizzare, filtro sterilizzare e aggiungere 0,5 ml / aliquota | 10 -10 M | polvere di 4-8 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| fibronectina | 1 mg | Per preparare 1 mg / ml di soluzione; Aggiungere 1 mg di fibronectina in 1 ml di acqua distiled sterile. Consentire 30 min. per il materiale di andare in soluzione. non si agita o turbolenza. Aggiungere 100 ml / aliquota | 10 mg / ml | polvere di 4-8 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| apo-transferrina | 100 mg | Per preparare 5 mg / ml di soluzione (1,000x); aggiungere 100 mg di transferrina in 20 ml di PBS turbine per sciogliere, filtrare sterilizzare e aggiungere 0,5 ml / aliquota | 5 mg / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| eparina | 50 KU | Per preparare 50 mg / ml di soluzione (1,000x); aggiungere 50 mg di eparina in 1 ml di acqua per sciogliere turbolenza, filtro sterilizzare e aggiungere 1 ml / aliquota | 0,1 mg / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
| Eparan solfato proteoglicani | 1 mg | Per preparare 0,1 mg / ml di soluzione; aggiungere 1 mg di eparan solfato in 10 ml di acqua sterile swirl per sciogliere e aggiungere 0,2 ml / aliquota | 2 mg / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitareripetizione gelo / disgelo |
| collagene IV | 5 mg | Per preparare 2 mg / ml di solutin: aggiungere 2 mg di collagene V in 2,5 ml di acido acetico sterile 0,25%. Lasciare 1 - 2 ore per il materiale di andare in soluzione Agitare per una migliore dillution.. Aggiungere 400 ml / aliquota | 80 mg / ml | polvere di -20 ° C, aliquote di lavoro -20 ° C, evitare di ripetere il gelo / disgelo |
Tabella 1: Definito Supplemento Media Preparazione.
| F-12 Media integrato con | |||
| Reagente | Soluzione madre | Soluzione finale | Quantità |
| siero fetale bovino | 10% | 50 ml | |
| piruvato di sodio | 100 mM | 1 mM | 5 ml |
| L-glutammina | 200 mM | 2 mm | 5 ml |
| Hepes | 1 M | 10 mM | 5 ml |
| Gentamicina | 50 mg / ml | 50 mg / ml | 500 microlitri |
| Penicillina / streptomicina | 10.000 U / ml / 10 mg / ml | 100 U / ml / 100 ug / ml | 5 ml |
| Insulina | 5 mg / ml | 5 ug / ml | 500 microlitri |
| T3 | 2 x 10 - 8 M | 2 x 10 -11 M | 500 microlitri |
| adenina | 1.8 x 10-1 M | 1,8 x 10 - 3 M | 5 ml |
| transferrina | 5 mg / ml | 5 ug / ml | 500 microlitri |
| eparina | 50 mg / ml | 0,1 mg / ml | 1 ml |
| ECGS | 3 mg / ml | 3 ug / ml | 5 ml |
| bFGF | 25 mg / ml | 5 ng / ml | 100 pl |
| SCF | 10 mg / ml | 5 ng / ml | 250 microlitri |
| HGF | 5 ug / ml | 2 ng / ml | 200 ml |
| endotelina 3 | 50 mg / ml | 10 ng / ml | 200 ml |
| LIF | 20 mg / ml | 4 ng / ml | 100 pl |
| VEGF | 5 ug / ml | 1 ng / ml | 100 pl |
| La tossina Choleran | 10 -7 M | 10 -10 M | 500 microlitri |
| Nota: La quantità citata è per la preparazione di 500 ml di terreni di coltura 3-D. I supporti devono essere conservati a 4 ° C per non più di 2 settimane | |||
Tabella 2: Preparazione di 3-D di coltura.
Discussione
In questo manoscritto, descriviamo lo sviluppo di un modello bioengineered della mucosa intestinale umana composto di tipi cellulari multipli inclusi linfociti primari umani, fibroblasti e cellule endoteliali, così come le linee di cellule epiteliali intestinali 24. In questo modello 3-D, le cellule sono coltivate all'interno di una matrice extracellulare ricca di collagene in condizioni di microgravità 24.
Come descritto in precedenza, le caratteristiche principali di questo modello sono: (i) la capacità di imitare l'organizzazione tessuto monostrato epiteliale, (ii) l'induzione di appropriata polarità delle cellule epiteliali, giunzioni strette, desmosomi e microvilli, (iii) un lungo cultura termine (fino a 20 giorni) con elevata vitalità delle cellule primarie (es., fibroblasti e cellule endoteliali), (iv) l'espressione dei marcatori di differenziazione dei tessuti simili, ad esempio villin, citocheratina, e-caderina e mucin, (v) la capacità di produrre notevoli quantità di citochine (ad es., IL-8) e fosfatasi alcalina dopo stimolazione antigenica, (vi) il trasporto di nutrienti quali glucosio (es., espressione di disaccaridasi e presenza di zucchero trasportatori), e (vii) la differenziazione multi-lignaggio di cellule epiteliali intestinali (es., enterociti di assorbimento, Globet e cellule M) 24.
E 'importante sottolineare che per ottenere risultati riproducibili usando il nostro modello 3-D il ricercatore deve aderire alle linee guida di buona coltura cellulare 46-48. E 'fondamentale per controllare sistematicamente le cellule per la vitalità, la contaminazione da micoplasma e cambiamenti nel comportamento crescita cellulare. Se viene individuato un problema, in primo luogo garantire che nessun modifiche non autorizzate sono state introdotte al protocollo. Se il problema persiste, passare a un nuovo lotto di vari componenti supporto (inclusa siero) e /o cellule. Una limitazione del nostro modello 3-D è l'uso di tumorigenico HCT-8 linea cellulare epiteliale. Tuttavia, è importante considerare che la presenza della linea HCT-8 offre il vantaggio di essere disponibile in commercio. Inoltre, queste cellule epiteliali non esprimono l'antigene leucocitario umano sia classico o non classica (HLA) di classe I le molecole 49,50. Pertanto, esse consentono la coltura di cellule epiteliali con PBMC di diversi HLA di classe I aplotipi in assenza di epiteliale alloreattività cellule PBMC. Inoltre, quando si confrontano questo sistema con sistemi come cellula staminale intestinale organoidi 51-53, questo modello offre molti vantaggi. Anche se organoidi cellule staminali dell'intestino forniscono preziose informazioni sulla biologia cellulare e la differenziazione intestinale 51-53, questo modello permette l'esposizione diretta apicale ai nutrienti, farmaci e agenti patogeni. Questo modello fornisce anche un facile accesso ai contenuti del lume tali peptidi e citochine anti-microbiche. Al contrario, sono organoidi Compact delle Nazioni Uniteit con una superficie luminale rivolta verso l'interno. Di conseguenza, vi è una quantità limitata di prodotto che può essere introdotto nella organoide lumen 54.
Crediamo che la nostra multicellulare 3-D del modello organotipica della mucosa intestinale umana ha il potenziale di ampio respiro come strumento per la scoperta sia in salute e malattia, compresa l'interazione con agenti patogeni, il traffico di antigene, e infiammatorie ed elabora 24 metabolica. Infine, a causa della natura multicellulare del nostro modello 3-D, il nostro modello potrebbe consentire GAIN- e perdite di studio utilizzando i tipi di cellule del sistema immunitario che possono influenzare il comportamento delle cellule epiteliali in vivo.
Divulgazioni
The authors declare that a US Non-Provisional Patent Application has been filed in the U.S.Patent and Trademark Office (Number: 13/360,539).
Riconoscimenti
This work was supported, in part, by NIAID, NIH, DHHS federal research grants R01 AI036525 and U19 AI082655 (CCHI) to MBS and by NIH grant DK048373 to AF. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institute of Allergy And Infectious Diseases or the National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Quad Rotator/Independent Rotating Wall Vessel (RWV) bioreactor | Synthecon | RCCs-4DQ | For up to 4 vessels. Models with more or less vessels are also available. |
| Disposable 50 ml-vessel | Synthecon | D-405 | Box with 4 vessels |
| HCT-8 epithelial cells | ATCC | CCL-244 | |
| CCD-18Co Fibroblasts | ATCC | CRL-1459 | |
| Human Umbilical Vein Endothelial Cells | ATCC | CRL-1730 | HUVEC |
| Fibroblast Growth Factor-Basic | Sigma | F0291 | bFGF |
| Stem Cell Factor | Sigma | S7901 | SCF |
| Hepatocyte Growth Factor | Sigma | H1404 | HGF |
| Endothelin 3 | Sigma | E9137 | |
| Laminin | Sigma | L2020 | Isolated from mouse Engelbreth-Holm-Swarm tumor |
| Vascular Endothelial Growth Factor | Sigma | V7259 | VEGF |
| Leukemia Inhibitory Factor | Santa Cruz | sc-4377 | (LIF |
| Adenine | Sigma | A2786 | |
| Insulin | Sigma | I-6634 | |
| 3,3',5-triiodo-L-thyronine | Sigma | T-6397 | T3 |
| Cholera Toxin | Sigma | C-8052 | |
| Fibronectin | BD | 354008 | Isolated from human plasma |
| apo-Transferrin | Sigma | T-1147 | |
| Heparin | Sigma | H3149 | |
| Heparan sulfate proteoglycan | Sigma | H4777 | Isolated from basement membrane of mouse Engelbreth-Holm-Swarm tumor |
| Collagen IV | Sigma | C5533 | Isolated from human placenta |
| Heat-inactivated fetal bovine serum | Invitrogen | 10437-028 | |
| D-MEM, powder | Invitrogen | 12800-017 | |
| 10% formalin–PBS | Fisher Scientific | SF100-4 | |
| Bovine type I collagen | Invitrogen | A1064401 | |
| Trypsin-EDTA | Fisher Scientific | MT25-052-CI | |
| Sodium pyruvate | Invitrogen | 11360-070 | |
| Gentamicin | Invitrogen | 15750-060 | |
| Penicillin/streptomincin | Invitrogen | 15140-122 | |
| L-Glutamine | Invitrogen | 25030-081 | |
| Hepes | Invitrogen | 15630-080 | |
| Ham's F-12 | Invitrogen | 11765-054 | |
| Basal Medium Eagle | Invitrogen | 21010-046 | BME |
| RPMI-1640 | Invitrogen | 11875-093 | |
| Endothelial Basal Medium | Lonza | CC-3156 | EBM-2 |
| Endothelial cell growth supplement | Millipore | 02-102 | ECGS |
Riferimenti
- Aumailley, M., Timpl, R. Attachment of cells to basement membrane collagen type IV. J Cell Biol. 103, 1569-1575 (1986).
- Buset, M., Winawer, S., Friedman, E. Defining conditions to promote the attachment of adult human colonic epithelial cells. In Vitro Cell Dev Biol. 23, 403-412 (1987).
- Fitzgerald, T. J., Repesh, L. A., Blanco, D. R., Miller, J. N. Attachment of Treponema pallidum to fibronectin, laminin, collagen IV, and collagen I, and blockage of attachment by immune rabbit IgG. Br J Vener Dis. 60, 357-363 (1984).
- Goetschy, J. F., Ulrich, G., Aunis, D., Ciesielski-Treska, J. Fibronectin and collagens modulate the proliferation and morphology of astroglial cells in culture. Int J Dev Neurosci. 5, 63-70 (1987).
- Paye, M., Lapiere, C. M. The lack of attachment of transformed embryonic lung epithelial cells to collagen I is corrected by fibronectin and FXIII. J Cell Sci. 86, 95-107 (1986).
- Pourreau-Schneider, N., et al. Estrogen response of MCF-7 cells grown on diverse substrates and in suspension culture: promotion of morphological heterogeneity, modulation of progestin receptor induction; cell-substrate interactions on collagen gels. J Steroid Biochem. 21, 763-771 (1984).
- Pratt, B. M., Harris, A. S., Morrow, J. S., Madri, J. A. Mechanisms of cytoskeletal regulation. Modulation of aortic endothelial cell spectrin by the extracellular matrix. Am J Pathol. 117, 349-354 (1984).
- Jessup, J. M., et al. Microgravity culture reduces apoptosis and increases the differentiation of a human colorectal carcinoma cell line. In vitro cellular & developmental biology - Animal. 36, 367-373 (2000).
- Sutherland, R. M., et al. Oxygenation and differentiation in multicellular spheroids of human colon carcinoma. Cancer Res. 46, 5320-5329 (1986).
- Unsworth, B. R., Lelkes, P. I. Growing tissues in microgravity. Nat Med. 4, 901-907 (1998).
- Zwezdaryk, K. J., Warner, J. A., Machado, H. L., Morris, C. A., Honerzu Bentrup, K. Rotating cell culture systems for human cell culture: human trophoblast cells as a model. Journal of visualized experiments : JoVE. , (2012).
- Radtke, A. L., Herbst-Kralovetz, M. M. Culturing and Applications of Rotating Wall Vessel Bioreactor Derived 3D Epithelial Cell Models. Journal of visualized experiments : JoVE. , (2012).
- Barrila, J., et al. Organotypic 3D cell culture models: using the rotating wall vessel to study host-pathogen interactions. Nat Rev Microbiol. 8, 791-801 (2010).
- Honer zu Bentrup, K., et al. Three-dimensional organotypic models of human colonic epithelium to study the early stages of enteric salmonellosis. Microbes and infection / Institut Pasteur. 8, 1813-1825 (2006).
- Nickerson, C. A., et al. Three-dimensional tissue assemblies: novel models for the study of Salmonella enterica serovar Typhimurium pathogenesis. Infect Immun. 69, 7106-7120 (2001).
- Alcantara Warren, C., et al. Detection of epithelial-cell injury, and quantification of infection, in the HCT-8 organoid model of cryptosporidiosis. J Infect Dis. 198, 143-149 (2008).
- Carvalho, H. M., Teel, L. D., Goping, G., O'Brien, A. D. A three-dimensional tissue culture model for the study of attach and efface lesion formation by enteropathogenic and enterohaemorrhagic Escherichia coli. Cell Microbiol. 7, 1771-1781 (2005).
- Lin, H. J., O'Shaughnessy, T. J., Kelly, J., Ma, W. Neural stem cell differentiation in a cell-collagen-bioreactor culture system. Brain Res. Dev Brain Res. 153, 163-173 (2004).
- He, L., et al. Increased proliferation and adhesion properties of human dental pulp stem cells in PLGA scaffolds via simulated microgravity. Intl Endo J. , (2015).
- Straub, T. M., et al. In vitro cell culture infectivity assay for human noroviruses. Emerg Infect Dis. 13, 396-403 (2007).
- Herbst-Kralovetz, M. M., et al. Lack of norovirus replication and histo-blood group antigen expression in 3-dimensional intestinal epithelial cells. Emerg Infect Dis. 19, 431-438 (2013).
- Goodwin, T. J., Schroeder, W. F., Wolf, D. A., Moyer, M. P. Rotating-wall vessel coculture of small intestine as a prelude to tissue modeling: aspects of simulated microgravity. Proc Soc Exp Biol Med. 202, 181-192 (1993).
- Goodwin, T. J., Jessup, J. M., Wolf, D. A. Morphologic differentiation of colon carcinoma cell lines HT-29 and HT-29KM in rotating-wall vessels. In Vitro Cell Dev Biol. 28, 47-60 (1992).
- Salerno-Goncalves, R., Fasano, A., Sztein, M. B. Engineering of a multicellular organotypic model of the human intestinal mucosa. Gastroenterology. 141, 18-20 (2011).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. Am J Physiol Renal Physiol. 281, 12-25 (2001).
- Cherry, R. S., Papoutsakis, E. T. Physical mechanisms of cell damage in microcarrier cell culture bioreactors. Biotech and Bioeng. 32, 1001-1014 (1988).
- Bergmann, S., Steinert, M. From Single Cells to Engineered and Explanted Tissues: New Perspectives in Bacterial Infection Biology. Int Rev Cell Mol Biol. 319, 1-44 (2015).
- Xu, B., et al. Simulated microgravity affects ciprofloxacin susceptibility and expression of acrAB-tolC genes in E. coli ATCC25922. Int J Clin Exp Pathol. 8, 7945-7952 (2015).
- Han, C., Jiang, C., Yu, C., Shen, H. Differentiation of transforming growth factor beta1-induced mesenchymal stem cells into nucleus pulposus-like cells under simulated microgravity conditions. Cell Mol Biol (Noisy-le-Grand, France). 61, 50-55 (2015).
- Wang, C., et al. Microgravity activates p38 MAPK-C/EBPbeta pathway to regulate the expression of arginase and inflammatory cytokines in macrophages. Inflamm Res. 64, 303-311 (2015).
- Iliev, I. D., et al. Human intestinal epithelial cells promote the differentiation of tolerogenic dendritic cells. Gut. 58, 1481-1489 (2009).
- Kerneis, S., Bogdanova, A., Kraehenbuhl, J. P., Pringault, E. Conversion by Peyer's patch lymphocytes of human enterocytes into M cells that transport bacteria. Science. 277, 949-952 (1997).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. , (2010).
- Lei, N. Y., et al. Intestinal subepithelial myofibroblasts support the growth of intestinal epithelial stem cells. PLoS One. 9, e84651(2014).
- Voog, J., Jones, D. L. Stem cells and the niche: a dynamic duo. Cell Stem Cell. 6, 103-115 (2010).
- Jabaji, Z., et al. Use of collagen gel as an alternative extracellular matrix for the in vitro and in vivo growth of murine small intestinal epithelium. Tissue Eng Part C Methods. 19, 961-969 (2013).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9, e107814(2014).
- Rodin, S., Antonsson, L., Hovatta, O., Tryggvason, K. Monolayer culturing and cloning of human pluripotent stem cells on laminin-521-based matrices under xeno-free and chemically defined conditions. Nat Protoc. 9, 2354-2368 (2014).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Exp Biol Med. 239, Maywood, N.J. 1124-1134 (2014).
- Tompkins, W. A., Watrach, A. M., Schmale, J. D., Schultz, R. M., Harris, J. A. Cultural and antigenic properties of newly established cell strains derived from adenocarcinomas of the human colon and rectum. J Natl Cancer Inst. 52, 1101-1110 (1974).
- Hinterleitner, T. A., Saada, J. I., Berschneider, H. M., Powell, D. W., Valentich, J. D. IL-1 stimulates intestinal myofibroblast COX gene expression and augments activation of Cl- secretion in T84 cells. Am J Physiol. 271, 1262-1268 (1996).
- Hoshi, H., McKeehan, W. L. Brain- and liver cell-derived factors are required for growth of human endothelial cells in serum-free culture. Proc Natl Acad Sci U S A. 81, 6413-6417 (1984).
- Salerno-Goncalves, R., Pasetti, M. F., Sztein, M. B. Characterization of CD8(+) Effector T Cell Responses in Volunteers Immunized with Salmonella enterica. Serovar Typhi Strain Ty21a Typhoid Vaccine. J Immunol. 169, 2196-2203 (2002).
- Poggioli, T., Sarathchandra, P., Rosenthal, N., Santini, M. P. Intramyocardial cell delivery: observations in murine hearts. J Vis Exp. , e51064(2014).
- Eastburn, D. J., Mostov, K. E. Laying the foundation for epithelia: insights into polarized basement membrane deposition. EMBO Rep. 11, 329-330 (2010).
- Coecke, S., et al. Guidance on good cell culture practice. a report of the second ECVAM task force on good cell culture practice. Altern Lab Anim. 33, 261-287 (2005).
- Geraghty, R. J., et al. Guidelines for the use of cell lines in biomedical research. Br J Cancer. 111, 1021-1046 (2014).
- Hartung, T., et al. Good Cell Culture Practice. ECVAM Good Cell Culture Practice Task Force Report 1. Altern Lab Anim. 30, 407-414 (2002).
- Blanchet, O., et al. Altered binding of regulatory factors to HLA class I enhancer sequence in human tumor cell lines lacking class I antigen expression. Proc Natl Acad Sci U S A. 89, 3488-3492 (1992).
- Palmisano, G. L., et al. HLA-E surface expression is independent of the availability of HLA class I signal sequence-derived peptides in human tumor cell lines. Hum Immunol. 66, 1-12 (2005).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15, 701-706 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunol. , (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon