Method Article
Desarrollo de un Modelo Organotípicos multicelular tridimensional de la mucosa intestinal humanas cultivadas en condiciones de microgravedad
En este artículo
Resumen
Las células que crecen en un entorno tridimensional (3-D) representan una mejora marcada sobre el cultivo de células en entornos 2-D (por ejemplo, frascos o platos). Aquí se describe el desarrollo de un modelo organotípico 3-D multicelular de la mucosa intestinal humana cultivadas en microgravedad proporcionada por la rotación de la pared de los vasos biorreactores (RWV).
Resumen
Dado que las células que crecen en un entorno tridimensional (3-D) tienen el potencial de salvar muchas lagunas de cultivo celular en ambientes 2-D (por ejemplo., Frascos o platos). De hecho, se reconoce ampliamente que las células cultivadas en frascos o platos tienden a DE-diferenciarse y perder características especializadas de los tejidos de los que se derivaron. Actualmente, existen principalmente dos tipos de sistemas de cultivo de 3-D, donde las células se sembraron en andamios que imitan la matriz nativa extracelular (ECM): (a) modelos estáticos y modelos (b) utilizando biorreactores. El primer gran avance fueron los modelos estáticos en 3-D. modelos en 3-D utilizando biorreactores como la pared de los vasos giratorio (RWV) biorreactores son un desarrollo más reciente. El concepto original de los biorreactores RWV fue desarrollado en el Centro Espacial Johnson de la NASA en la década de 1990 y se cree que superar las limitaciones de los modelos estáticos, tales como el desarrollo de hipoxia, núcleos necróticos. Los biorreactores RWV podrían eludir THes problema proporcionando la dinámica de fluidos que permiten la difusión eficiente de los nutrientes y el oxígeno. Estos biorreactores constan de una base rotador que sirve para soportar y rotar dos formatos diferentes de recipientes de cultivo que se diferencian por su tipo de fuente de aireación: (1) Slow giro Los buques laterales (STLVs) con un oxigenador de co-axial en el centro, o (2 ) Los buques de alta Relación de aspecto (HARVs) con la oxigenación a través de una membrana de transferencia de gas de caucho de silicona plana. Estos recipientes permiten la transferencia de gas eficiente, evitando la formación de burbujas y la consiguiente turbulencia. Estas condiciones resultan en el flujo laminar y la fuerza de corte mínima que los modelos de gravedad reducida (microgravedad) en el interior del recipiente de cultivo. Aquí se describe el desarrollo de un modelo organotípico 3-D multicelular de la mucosa intestinal humana compuesta de una línea de células epiteliales intestinal y linfocitos humanos primarios, células endoteliales y fibroblastos cultivadas en microgravedad proporcionada por el biorreactor RWV. </ P>
Introducción
El primer gran avance en la construcción de un modelo 3-D se informó a principios de la década de 1980 cuando los científicos empezaron a investigar los diferentes tipos de andamio (por ejemplo., Laminina, colágeno tipo I, colágeno IV y fibronectina) y cócteles de factores de crecimiento para mejorar célula a célula y ECM interacciones de modelos en 3-D "estáticos" 1-7. Desde entonces, el principal problema de estos modelos ha sido limitaciones en la transferencia de nutrientes y oxígeno dentro de las construcciones medianas y tejidos 8. En contraste con las células en el entorno in vivo que recibe un flujo constante de nutrientes y el oxígeno de los alrededores de las redes de los vasos sanguíneos, la naturaleza estática de estos modelos dificulta la distribución efectiva de ellos a las células. Por ejemplo, los agregados de células generadas en modelos estáticos in vitro que superan unos pocos milímetros de tamaño invariablemente desarrollar hipoxia, 9 núcleos necróticos. Los biorreactores RWV podrían eludir este problemaproporcionando la dinámica de fluidos que permiten la difusión eficiente de los nutrientes y 10-12 oxígeno. Sin embargo, hasta la fecha, el trabajo usando biorreactores RWV se han limitado a la inclusión de uno o dos tipos de células 13-17. Además, en lugar de una orientación espacial similar a tejidos nativos, las células forman agregados celulares. La razón principal de estas limitaciones ha sido la falta de un andamio capaz de incorporar las células de una manera integrada. Los andamios utilizados en los biorreactores RWV hasta la fecha consisten, con pocas excepciones, 16-18, sobre todo de microperlas sintéticas, cilindros tubulares o pequeñas hojas 13-15,19-23. Estos son materiales rígidos cuya composición y de flexibilidad no puede ser manipulado, y para el cual las células están unidas a su superficie. Por lo tanto, es poco probable que estos modelos proporcionar un sistema en el que evaluar, de una manera integrada, los diversos componentes celulares tales como las células del estroma (por ejemplo., Fibroblastos, células inmunes y endoteliales) que should dispersarse dentro del andamiaje para imitar el tejido humano.
Aquí se describe el desarrollo de un modelo organotípico 3-D multicelular de la mucosa intestinal humana compuesta de una línea de células epiteliales intestinal y linfocitos humanos primarios, células endoteliales, fibroblastos y 24. Estas células se cultivaron en condiciones de microgravedad proporcionar por el biorreactor RWV 13,25-30. En nuestro modelo de 3-D, el ECM posee muchas propiedades distintas, tales como una osmolalidad similar al medio de cultivo (por ejemplo., Las restricciones de difusión despreciables durante el cultivo) y la capacidad de incorporar las células y otras proteínas de la matriz extracelular pertinentes, así como la rigidez apropiado para ser utilizado en los biorreactores de 24. Los sistemas biológicos son muy complejas, y en los últimos años, ha habido un cambio en el foco de la investigación de la mucosa hacia el examen de las interacciones de las células con su entorno en lugar de estudiar en isolationorte. En particular, la importancia de las interacciones célula-célula para influir en la supervivencia celular y la diferenciación intestinal está bien documentada 31-34. En concreto, la comunicación entre las células epiteliales y su nicho tiene una profunda influencia en la expansión de las células epiteliales y la diferenciación 35. De hecho, es ampliamente aceptado que no sólo de célula a célula, pero también las interacciones célula-ECM son críticos para el mantenimiento y la diferenciación de las células epiteliales en modelos de cultivo de 3-D. Estudios previos han demostrado que las proteínas ECM intestino tales como el colágeno I 24,36,37, laminina y fibronectina 38 39 son instrumentales para influir en las células epiteliales intestinales para adquirir la orientación espacial similar a la mucosa nativo. Por lo tanto, el desarrollo de nuevas tecnologías, como nuestro modelo en 3-D 24, que puede imitar es necesaria la diversidad fenotípica del intestino si los investigadores tienen la intención de recrear la arquitectura celular y estructural complejay la función del microambiente intestino. Estos modelos representan una herramienta importante en el desarrollo y evaluación de nuevos fármacos orales y candidatos vacunales.
Protocolo
Declaración de la ética: Todas las muestras de sangre se obtuvieron de voluntarios que participaron en número de protocolo HP-00040025-1. La Universidad de Maryland Junta de Revisión Institucional aprobado este protocolo y autoriza la recogida de muestras de sangre de voluntarios sanos para los estudios incluidos en este manuscrito. El propósito de este estudio fue explicado a los voluntarios, y todos los voluntarios dieron su, firmado el consentimiento antes de la extracción de sangre.
Nota: Véase la Tabla 1 para la preparación suplemento de medio. Véase la Tabla 2 para la preparación de los medios de cultivo 3-D.
1. Preparación de recipientes de cultivo
- Desenroscar el tapón del orificio de llenado del recipiente de 50 ml-y rellenar con 50 ml de medio de cultivo estéril (por ejemplo, RPMI.). Realizar todos los procedimientos en condiciones estériles en una campana laminar.
- Coloque la tapa y limpie cualquier medio derramado sobre cualquier superficie con etanol al 70%.
- Deje que la embarcación incubcomió durante al menos 15 minutos a O / N a temperatura ambiente.
- Utilice el puerto de llenado para desechar el medio de cultivo y añadir 30 ml de medio de cultivo en 3-D.
- Limpie cualquier medio derramado sobre cualquier superficie con etanol al 70%.
2. Preparación de las células
- Línea celular epitelial humana (HCT-8) de 24,40.
- células de cultivo en RPMI suplementado con 100 U / ml de penicilina, 100 mg / ml de estreptomicina, 50 mg / ml de gentamicina, 2 mM L-glutamina, piruvato de sodio 1 mM, HEPES 10 mM tampón y suero bovino fetal inactivado por calor al 10% (FBS ) (suplemento 1). Al 70% de confluencia, las células divididas en una proporción de 1: 5.
- Fibroblastos de colon humano (células CCD-18Co) 24,41.
- Células de cultivo en medio de Basal de Eagle enriquecido con suplemento 1 en confluencia, las células divididas en una proporción de 1: 3..
- Células endoteliales de vena umbilical humana (HUVEC) 24,42.
- Células de cultivo en medio basal endotelial (EBM) medio enriquecido con 100 mg / ml de heparina, 3 mg / ml de suplemento de crecimiento de células endoteliales (ECG), y complementan 1 Al 70% de confluencia, las células divididas en una proporción de 1:. 2.
- Los linfocitos / monocitos
- Aislar las células mononucleares de sangre periférica (PBMC) de la sangre por centrifugación en gradiente de densidad utilizando técnicas estándar 43.
- Brevemente, utilizando una pipeta ml-10, añadir cuidadosamente 30 ml de sangre diluida (1: 1 de sangre: Tampón fosfato salino (PBS)) en un tubo de 50 ml que contiene-cónica 10 ml de medio de centrifugación por densidad. Después de la etapa de centrifugación, los linfocitos y monocitos residirán en la capa de "blanco" entre los medios de centrifugación de densidad y capas de plasma.
- Recoger la capa blanca con una pipeta de transferencia. Evitar la contaminación de granulocitos mediante la limitación de la colección de los medios de densidad de centrifugación. Después de lavar 43, uSE PBMC criopreservados como está o en N2 líquido.
Nota: Es importante destacar que PBMC consiste en gran parte de los linfocitos y monocitos, con una pequeña proporción de las células dendríticas y otros tipos celulares.
- Aislar las células mononucleares de sangre periférica (PBMC) de la sangre por centrifugación en gradiente de densidad utilizando técnicas estándar 43.
- Crecer todas las células bajo condiciones de cultivo estándar a 37 ° C en una atmósfera de CO2 al 5%.
3. Preparación de las células embebidas-colágeno
- Determinar el número de inserciones necesario en base a los números de las condiciones experimentales para ser puesta en marcha. Coloque el número apropiado de insertos en los pocillos de una placa de 6 pocillos.
- Preparar una suspensión de HUVEC y fibroblastos:
- Lavar los matraces dos veces en PBS y separar las células utilizando tripsina, 0,25% (1x) con etilendiaminotetraacetato 0,05% de tripsina-tetrasódico (Tripsina-EDTA). Añadir suficiente solución de tripsina para cubrir la totalidad de la superficie de cultivo celular. El desprendimiento ocurre generalmente dentro de 5 a 15 min
- Recogercélulas separadas en un 50 ml-tubo que contiene 30 ml de medio de Eagle modificado por Dulbecco (DMEM) -30% de SFB medio.
- Centrifugar el tubo a 500 xg durante 10 min.
- Resuspender las células en 30 ml de DMEM-30 medio FBS%.
- Contar el número total de células viables por dilución de 20 l de las células resuspendidas con 20 l de colorante azul de tripano. Cargar el hemocitómetro con la mezcla de células. CMSP viables serán de color blanco claro; inviable PBMC adquirirá el colorante y se convierten en azul.
- Resuspender cada tipo de células en DMEM-30 medio FBS% a una concentración de 5 - 8 x 10 7 células ml - 1.
- Preparar geles de colágeno que contienen células
Nota: Cada recipiente requerirá la preparación de ~ 5 ml de gel de colágeno que contiene células.- En un tubo de 50 ml-cónica preparar la mezcla de colágeno mediante la adición de 1 x medios DMEM, suplementado con 50 g / ml de gentamicina, 2 mM L-glutamina y 10% de calor-inactivated FBS más 3 mg / ml de colágeno bovino-I, 10 g / laminina ml, 40 mg / ml de colágeno IV, 10 mg / ml de fibronectina, 2 mg / ml de proteoglicanos de sulfato de heparina y NaOH 15 mM (para alcanzar el pH fisiológico).
- Cerrar el tubo y mezclar invirtiendo varias veces hasta que la mezcla esté completamente homogeneizada. Evitar la formación de burbujas.
IMPORTANTE: Mantener la mezcla en hielo para evitar la gelificación.- Paso crítico: Si la mezcla se desarrolla una apariencia ácida (color amarillento), añadir unas gotas de NaOH 1 N estéril para neutralizar la mezcla.
- Añadir HUVEC concentrado y fibroblastos a una densidad de 1,0 - 1,2 y 1,5 - 2,0 x 10 6 células / ml, respectivamente, a la mezcla enriquecida en colágeno (descrito anteriormente). Cierre los tubos y mezclar invirtiendo varias veces hasta que la mezcla esté completamente homogeneizada. Evitar la formación de burbujas. IMPORTANTE: Mantener la mezcla en hielo para evitar la gelificación.
- Añadir 4 - 5 ml del colágeno que contiene célulasgel para cada inserción, cargado previamente en un pozo de la placa 6, y se deja gelificar en la campana con poco o ningún movimiento durante 1 hora.
- Después de 1 hora, la transferencia de la placa de 6 pocillos a un 37 ° C, 5% CO2 durante 1 - 2 horas adicionales.
- Devolver la placa de 6 pocillos a la campana, y con la ayuda de unas pinzas esterilizadas y el bisturí asépticamente de corte de la membrana de la pieza de inserción de extraer el gel que contiene células de la membrana. Cortar el gel individual en cuadrados pequeños (~ 5 x 5 mm).
- Añadir los pequeños cuadrados que contienen células en un HARV de 50 ml usando el puerto de llenado.
- Preparar una suspensión de 8-HCT células epiteliales:
- Lavar los matraces dos veces en PBS y separar las células utilizando tripsina, 0,25% (1x) con el tratamiento con tripsina-EDTA. Añadir suficiente solución de tripsina para cubrir la totalidad de la superficie de cultivo celular. El desprendimiento ocurre generalmente dentro de 10 a 15 min.
- Recoger las células desprendidas en 30 ml de DMEM-FBS al 30% medio.
- CentrifUGE DMEM-30% de medio FBS que contiene tubo a 500 xg durante 10 min.
- Resuspender las células en 30 ml de DMEM-30 medio FBS%.
- Contar el número total de células viables como se describe en 3.2.5.
- Resuspender las HCT-8 células epiteliales en DMEM-30 medio FBS% a una concentración de 10 7 células ml - 1.
- Añadir 1 ml de los HCT-8 células epiteliales concentradas en el 50-ml HARV usando el puerto de llenado.
- Al utilizar el puerto de llenado, se añade medio de cultivo adicional 3-D hasta que el recipiente está casi llena (~ 20 ml).
- Coloque la tapa y limpiar el borde del orificio de llenado con un 70% de etanol.
- Colocar una jeringa en cada puerto de jeringa de la RWV: lugar un 5 ml-jeringa que contiene 3 - 4 ml de medio de cultivo 3-D en un puerto y una jeringa de 5 ml vacía en el otro puerto.
- Eliminar las burbujas visibles, tirando en la jeringa vacía mientras que aproximadamente el mismo volumen de medio se inyecta a través del otro puerto de jeringa.
- Coloque los vesseles en el biorreactor, conecte la alimentación y ajuste la velocidad de alrededor de 13 a 14 revoluciones por minuto.
Nota: El paso crítico: puede necesitar velocidad de rotación para ajustar un par de veces durante un experimento para mantener las células en órbita dentro del recipiente, evitando así el contacto con las paredes del recipiente. - Células de cultivo a 37 ° C, 5% de CO 2 en condiciones de microgravedad, proporcionados por el biorreactor RWV.
- Cambio medio de cultivo cada 3 - 4 días mediante la sustitución de aproximadamente 30 ml con medio de cultivo fresco 3-D.
- Después de 4 días (± 1 día), retire los buques del biorreactor y añadir linfocitos / monocitos a los vasos (2 x 10 7 / recipiente).
- Coloque los vasos de nuevo en el biorreactor a 37 ° C, 5% de CO 2 durante 5 días adicionales (± 1 día).
- Después de los 5 días adicionales (día 9 del cultivo), añadir linfocitos / monocitos a los vasos (2 x 10 7 / recipiente) y seguir las culturas de hasta 12 días adicionales.
- Cambio medio de cultivo cada 3 - 4 días mediante la sustitución de aproximadamente 30 ml con medio de cultivo fresco 3-D.
4. Recolección de 3-D Los cultivos para Histología
- Con la ayuda de una pipeta de transferencia de la cosecha cada fragmento de gel pequeño, que ahora se llama "construir", en una placa de seis pocillos que contenía 10 ml de tampón de formalina 10%. Dejar durante 3 horas a temperatura ambiente o por 12 - 16 horas a 4 ° C.
- Preparar el procesamiento de tejidos y cassettes de inclusión mediante el etiquetado y la adición de dos piezas de almohadillas de espuma para biopsia en cada casete.
- Sumergir los casetes en tampón de formalina al 10%.
- Con la ayuda de fórceps colocar los constructos fijas entre las dos almohadillas de espuma.
- Sumergir los casetes en tampón de formalina al 10%.
- Continúe con los procedimientos estándar para la inserción, el seccionamiento y tinción 44.
Resultados
Anteriormente hemos diseñado un modelo organotípico 3-D multicelular de la mucosa intestinal humana compuesta de una línea de células epiteliales intestinal y linfocitos humanos primarios, células endoteliales y fibroblastos cultivados en condiciones de microgravedad 24 (Figura 1). Los fibroblastos y las células endoteliales fueron incorporados en una matriz de colágeno I enriquecido con proteínas de la membrana basal intestino adicional 45 (es decir., Laminina, colágeno IV, fibronectina y sulfato de heparina proteoglicano) y se añaden a RWV biorreactores. Después de 10 - 15 días, el análisis de la tinción histológica demostró la presencia de estructuras de vellosidades-como en las construcciones. Aproximadamente el 60 - 80% de estas células epiteliales se organiza como una monocapa de células polarizadas con sus núcleos situados en una posición basal cerca de la ECM, que es una de las principales características de las células bien diferenciadas (Figura 2).
ent "fo: keep-together.within-page =" 1 ">
Figura 1: Esquema de la construcción del modelo en 3-D. Cuatro pasos son necesarios para construir el sistema 3-D. En primer lugar, para obtener el número requerido de células para generar el modelo de 3-D, una línea celular humana intestinal enterocito epitelial (HCT-8) y las células endoteliales humanas primarias y los fibroblastos se cultivan como monocapas confluentes 2-D. En segundo lugar, el ECM compuesta de colágeno I-matriz enriquecida con proteínas de la membrana basal intestino adicional (es decir., Laminina, colágeno IV, fibronectina y proteoglicanos sulfato de heparina) se prepara. En tercer lugar, los fibroblastos y las células endoteliales están incrustados en una mezcla de colágeno-I y se añaden a RWV biorreactores seguido de la adición-8 HCT células epiteliales. En cuarto lugar, los linfocitos primarios se añaden al cultivo en los días 4 y 9 (± 1 día)."> Haga clic aquí para ver una versión más grande de esta figura.
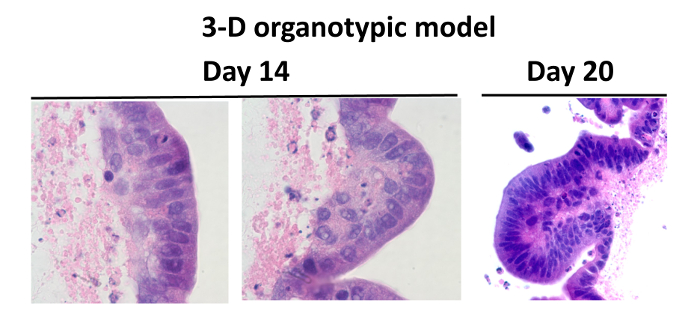
Figura 2: Comparación entre el intestino humano normal y los modelos organotípicos. Hematoxilina y eosina de las células cultivadas en el modelo de microgravedad 3-D: los tejidos se tiñeron de color púrpura y andamio tiñen de color rosa. Las células del modelo en 3-D se cultivaron durante 14 ( "a" y "b") y 20 días (c). Veinte días después de la siembra, el número de células totales se mantienen, y las células fueron características de las vellosidades, que muestra la bien diferenciadas. Las imágenes se muestran a 100X ( "a" y "b") y 40X ( "c") de ampliación. Haga clic aquí para ver una versión más grande de esta figura.
| nombre del producto | Paquete. tamaño | Reconstitución | concentración de trabajo | Almacenamiento |
| Factor de crecimiento fibroblástico-Basic (bFGF) | 25 mg | Para preparar / ml de solución madre de 25 mg; se añaden 25 g de FGF en 1 ml de medio estéril (RPMI más FCS al 1%), remolino para disolver, añadir 100 l / alícuota | 5 ng / ml | -20 ° C, en polvo alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| Factor de células madre (SCF) | 10 mg | Para preparar / ml de solución madre de 10 mg; añadir 10 g de SCF en 1 ml de medio estéril (RPMI más FCS al 1%), remolino para disolver, añadir 250 l / alícuota | 5 ng / ml | -20 ° C, en polvo alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| Factor de crecimiento de hepatocitos (HGF) | 5 mg | Para preparar / ml de solución madre 5 mg; añadir 5 g de HGF en 1 ml de medio estéril (RPMI más FCS al 1%), remolino para disolver, añadir 200 l / alícuota | 2 ng / ml | -20 ° C, en polvo alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| La endotelina 3 | 50 mg | Para preparar / ml de solución madre de 50 mg; se añaden 50 g de endotelina en 1 ml de medio estéril (RPMI más FCS al 1%), remolino para disolver, añadir 100 l / alícuota | 10 ng / ml | -20 ° C, en polvo alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| laminina | 1 mg | Descongelar lentamente a 2 - 8 ° C, remolino y añadir 100 l / alícuota | 10 mg / ml | líquida -20 ° C, trabajando alícuotas de -20 ° C, evitar la repetición freeze / descongelación |
| Vascular Endotelial Growth Factor (VEGF) | 10 mg | Para preparar / ml de solución madre 5 mg; añadir 10 g de VEGF en 2 ml de agua estéril, remolino para disolver, añadir 100 l / alícuota | 1 ng / ml | -20 ° C, en polvo alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| Factor Inhibidor de Leucemia (LIF) | 50 mg | Para preparar / ml de solución madre de 20 mg; añadir 50 g de LIF en 2,5 ml de agua estéril, agitar para disolver, añadir 100 l / alícuota | 4 ng / ml | -20 ° C, en polvo alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| adenina | 25 g | Para preparar la solución madre 0,18 M; añadir 121,5 mg og adedine en 50 ml de HCl 0,05 M (250 l de HCl 37,1% en 50 ml de agua)), agitar para disolver, filtrar y esterilizarañadir 1 ml / alícuota | 1,8 x 10 -3 M | polvo de 4 ° C, alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| Insulina | 50 mg | Para preparar 5 mg solución madre / ml; añadir 50 mg de insulina en 10 ml de HCl 0,005 M (5 l de 37,1% de HCl en 10 ml de agua)), agitar para disolver, filtrar esterilizar y añadir 0,5 ml / alícuota | 5 mg / ml | -20 ° C, en polvo alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| T3 | 100 mg | Para preparar 2 x 10 -8 M solución de reserva; añadir 3,4 mg de T3 en 25 ml de NaOH 1 M, se diluye 0,1 ml de esta solución en 9,9 ml de PBS, se diluye de nuevo 0,1 ml de esta solución en 9,9 ml de PBS, remolino para disolver, filtrar esterilizar y añadir 0,5 ml / alícuota | 2 x 10 -11 M | polvo de -20 ° C, -20 alícuotas de trabajo o C, evitar la repetición de congelación / descongelación |
| La toxina del cólera | 5 mg | Para preparar 10 -7 M solución de reserva; añadir 5 mg de toxina del cólera en 5 ml de ddH 2 O estéril (se almacena a -20 ° C); diluir 50 l de esta solución en 5 ml ddH2O, agitar para homogeneizar, esterilizar el filtro y añadir 0,5 ml / alícuota | 10 -10 M | polvo de 4 - 8 ° C, alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| fibronectina | 1 mg | Para preparar 1 mg solución madre / ml; añadir 1 mg de fibronectina en 1 ml de agua estéril distiled. Permitir 30 minutos. para el material para entrar en solución. No agite o revuelva. Añadir 100 l / alícuota | 10 mg / ml | polvo de 4 - 8 ° C, alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| apo-transferrina | 100 mg | Para preparar 5 mg solución madre / ml (1,000x); se añaden 100 mg de transferrina en 20 ml de PBS para disolver remolino, esterilizar por filtración y añadir 0,5 ml / alícuota | 5 mg / ml | -20 ° C, en polvo alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| La heparina | 50 KU | Para preparar 50 mg solución madre / ml (1,000x); se añaden 50 mg de heparina en 1 ml de agua para disolver remolino, esterilizar por filtración y se añade 1 ml / alícuota | 0,1 mg / ml | -20 ° C, en polvo alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
| proteoglicano heparán sulfato | 1 mg | Para preparar 0,1 mg / ml de solución madre; añadir 1 mg de sulfato de heparán en 10 ml de agua estéril remolino para disolver, y añadir 0,2 ml / alícuota | 2 mg / ml | polvo de -20 ° C, alícuotas de trabajo -20 ° C, evitarla repetición de congelación / descongelación |
| El colágeno IV | 5 mg | Para preparar 2 mg / ml solutin existencia: añadir 2 mg de colágeno V en 2,5 ml de ácido acético estéril 0,25%. Permitir 1 - 2 horas para el material para ir a la solución del remolino por dilución en una mejor.. Añadir 400 l / alícuota | 80 mg / ml | -20 ° C, en polvo alícuotas de trabajo -20 ° C, evitar la repetición de congelación / descongelación |
Tabla 1: Definido suplemento de medio de preparación.
| F-12 suplementado con | |||
| Reactivo | Solución de reserva | Solución final | Cantidad |
| Suero de ternera fetal | 10% | 50 ml | |
| piruvato de sodio | 100 mM | 1 mM | 5 ml |
| L-Glutamina | 200 mM | 2 mM | 5 ml |
| Hepes | 1 M | 10 mM | 5 ml |
| gentamicina | 50 mg / ml | 50 mg / ml | 500 l |
| Penicilina / estreptomicina | 10000 U / ml / 10 mg / ml | 100 U / ml / 100 mg / ml | 5 ml |
| Insulina | 5 mg / ml | 5 mg / ml | 500 l |
| T3 | 2 x 10-8 M | 2 x 10 -11 M | 500 l |
| adenina | 1,8 x 10-1 M | 1,8 x 10-3 M | 5 ml |
| transferrina | 5 mg / ml | 5 mg / ml | 500 l |
| heparina | 50 mg / ml | 0,1 mg / ml | 1 ml |
| ECGS, | 3 mg / ml | 3 mg / ml | 5 ml |
| bFGF | 25 mg / ml | 5 ng / ml | 100 l |
| SCF | 10 mg / ml | 5 ng / ml | 250 l |
| HGF | 5 mg / ml | 2 ng / ml | 200 l |
| La endotelina 3 | 50 mg / ml | 10 ng / ml | 200 l |
| LIF | 20 mg / ml | 4 ng / ml | 100 l |
| VEGF | 5 mg / ml | 1 ng / ml | 100 l |
| La toxina Choleran | 10 -7 M | 10 -10 M | 500 l |
| Nota: La cantidad antes citada es para la preparación de 500 ml de medios de cultivo de 3-D. Medios de comunicación deben ser almacenados a 4 ° C durante no más de 2 semanas | |||
Tabla 2: Preparación de 3-D Medios de Cultivo.
Discusión
En este manuscrito, se describe el desarrollo de un modelo de bioingeniería de la mucosa intestinal humana compuesta de tipos de células incluyendo linfocitos múltiplos primarios humanos, fibroblastos y células endoteliales, así como líneas de células epiteliales intestinales 24. En este modelo 3-D, las células se cultivaron dentro de una matriz extracelular rica en colágeno en condiciones de microgravedad 24.
Como se ha descrito anteriormente, las características principales de este modelo son: (i) la capacidad para imitar la organización monocapa tejido epitelial, (ii) la inducción de la polaridad apropiada de las células epiteliales, las uniones estrechas, desmosomas y microvellosidades, (iii) un largo cultura plazo (hasta 20 días) con una alta viabilidad de las células primarias (es decir., fibroblastos y células endoteliales), (iv) la expresión de los marcadores de diferenciación de tejido similar incluyendo vellosidades, citoqueratina, e-cadherina y mucin, (v) la capacidad de producir cantidades considerables de citoquinas (por ejemplo., IL-8) y la fosfatasa alcalina tras la estimulación antigénica, (vi) el transporte de nutrientes tales como la glucosa (es decir., la expresión de disacaridasas, y la presencia de azúcar transportadores), y (vii) la diferenciación multi-linaje de las células intestinales epiteliales (es decir., enterocito de absorción, y las células globet M) 24.
Es importante resaltar que para lograr resultados reproducibles utilizando nuestro modelo 3-D el investigador deben adherirse a las directrices de cultivo de células 46-48. Es crucial para controlar sistemáticamente las células para la viabilidad, la contaminación por micoplasmas y cambios en el comportamiento de crecimiento de las células. Si se identifica un problema, en primer lugar asegurarse de que no hay cambios no autorizados se han introducido en el protocolo. Si el problema persiste, cambiar a un nuevo lote de los diversos componentes del medio (incluyendo suero) y /o células. Una limitación de nuestro modelo en 3-D es el uso de tumorigénicos línea de células epiteliales HCT-8. Sin embargo, es importante tener en cuenta que la presencia de HCT-8 línea ofrece la ventaja de estar disponible en el comercio. Por otra parte, estas células epiteliales no expresan el antígeno leucocitario humano o bien clásico o no clásico (HLA) -class I moléculas 49,50. Por lo tanto, permiten el cultivo de células epiteliales con PBMC de diferentes HLA de clase I haplotipos en ausencia de epitelio alorreactividad por células PBMC. Además, al comparar este sistema con sistemas tales como el de células madre intestino organoides 51-53, este modelo ofrece muchos beneficios. Aunque organoides de células madre intestino proporcionan una valiosa información acerca de la biología celular y la diferenciación intestinal 51-53, este modelo permite una exposición directa a apical nutrientes, fármacos y agentes patógenos. Este modelo también ofrece un fácil acceso a los contenidos luminales tales péptidos y citocinas anti-microbianas. Por el contrario, son organoides Compact de la ONUsu con una superficie luminal hacia dentro. En consecuencia, hay una cantidad limitada de producto que puede ser introducido en el lumen 54 organoide.
Creemos que nuestro modelo organotípicos 3-D multicelular de la mucosa intestinal humana tiene un potencial de gran alcance como una herramienta para el descubrimiento, tanto en la salud y la enfermedad, incluida la interacción con agentes patógenos, el tráfico de antígeno, y los procesos inflamatorios y metabólicos 24. Por último, debido a la naturaleza de nuestro modelo multicelular 3-D, nuestro modelo podría permitir ganancia y la pérdida estudios utilizando tipos de células inmunes que pueden influir en el comportamiento de las células epiteliales in vivo.
Divulgaciones
The authors declare that a US Non-Provisional Patent Application has been filed in the U.S.Patent and Trademark Office (Number: 13/360,539).
Agradecimientos
This work was supported, in part, by NIAID, NIH, DHHS federal research grants R01 AI036525 and U19 AI082655 (CCHI) to MBS and by NIH grant DK048373 to AF. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institute of Allergy And Infectious Diseases or the National Institutes of Health.
Materiales
| Name | Company | Catalog Number | Comments |
| Quad Rotator/Independent Rotating Wall Vessel (RWV) bioreactor | Synthecon | RCCs-4DQ | For up to 4 vessels. Models with more or less vessels are also available. |
| Disposable 50 ml-vessel | Synthecon | D-405 | Box with 4 vessels |
| HCT-8 epithelial cells | ATCC | CCL-244 | |
| CCD-18Co Fibroblasts | ATCC | CRL-1459 | |
| Human Umbilical Vein Endothelial Cells | ATCC | CRL-1730 | HUVEC |
| Fibroblast Growth Factor-Basic | Sigma | F0291 | bFGF |
| Stem Cell Factor | Sigma | S7901 | SCF |
| Hepatocyte Growth Factor | Sigma | H1404 | HGF |
| Endothelin 3 | Sigma | E9137 | |
| Laminin | Sigma | L2020 | Isolated from mouse Engelbreth-Holm-Swarm tumor |
| Vascular Endothelial Growth Factor | Sigma | V7259 | VEGF |
| Leukemia Inhibitory Factor | Santa Cruz | sc-4377 | (LIF |
| Adenine | Sigma | A2786 | |
| Insulin | Sigma | I-6634 | |
| 3,3',5-triiodo-L-thyronine | Sigma | T-6397 | T3 |
| Cholera Toxin | Sigma | C-8052 | |
| Fibronectin | BD | 354008 | Isolated from human plasma |
| apo-Transferrin | Sigma | T-1147 | |
| Heparin | Sigma | H3149 | |
| Heparan sulfate proteoglycan | Sigma | H4777 | Isolated from basement membrane of mouse Engelbreth-Holm-Swarm tumor |
| Collagen IV | Sigma | C5533 | Isolated from human placenta |
| Heat-inactivated fetal bovine serum | Invitrogen | 10437-028 | |
| D-MEM, powder | Invitrogen | 12800-017 | |
| 10% formalin–PBS | Fisher Scientific | SF100-4 | |
| Bovine type I collagen | Invitrogen | A1064401 | |
| Trypsin-EDTA | Fisher Scientific | MT25-052-CI | |
| Sodium pyruvate | Invitrogen | 11360-070 | |
| Gentamicin | Invitrogen | 15750-060 | |
| Penicillin/streptomincin | Invitrogen | 15140-122 | |
| L-Glutamine | Invitrogen | 25030-081 | |
| Hepes | Invitrogen | 15630-080 | |
| Ham's F-12 | Invitrogen | 11765-054 | |
| Basal Medium Eagle | Invitrogen | 21010-046 | BME |
| RPMI-1640 | Invitrogen | 11875-093 | |
| Endothelial Basal Medium | Lonza | CC-3156 | EBM-2 |
| Endothelial cell growth supplement | Millipore | 02-102 | ECGS |
Referencias
- Aumailley, M., Timpl, R. Attachment of cells to basement membrane collagen type IV. J Cell Biol. 103, 1569-1575 (1986).
- Buset, M., Winawer, S., Friedman, E. Defining conditions to promote the attachment of adult human colonic epithelial cells. In Vitro Cell Dev Biol. 23, 403-412 (1987).
- Fitzgerald, T. J., Repesh, L. A., Blanco, D. R., Miller, J. N. Attachment of Treponema pallidum to fibronectin, laminin, collagen IV, and collagen I, and blockage of attachment by immune rabbit IgG. Br J Vener Dis. 60, 357-363 (1984).
- Goetschy, J. F., Ulrich, G., Aunis, D., Ciesielski-Treska, J. Fibronectin and collagens modulate the proliferation and morphology of astroglial cells in culture. Int J Dev Neurosci. 5, 63-70 (1987).
- Paye, M., Lapiere, C. M. The lack of attachment of transformed embryonic lung epithelial cells to collagen I is corrected by fibronectin and FXIII. J Cell Sci. 86, 95-107 (1986).
- Pourreau-Schneider, N., et al. Estrogen response of MCF-7 cells grown on diverse substrates and in suspension culture: promotion of morphological heterogeneity, modulation of progestin receptor induction; cell-substrate interactions on collagen gels. J Steroid Biochem. 21, 763-771 (1984).
- Pratt, B. M., Harris, A. S., Morrow, J. S., Madri, J. A. Mechanisms of cytoskeletal regulation. Modulation of aortic endothelial cell spectrin by the extracellular matrix. Am J Pathol. 117, 349-354 (1984).
- Jessup, J. M., et al. Microgravity culture reduces apoptosis and increases the differentiation of a human colorectal carcinoma cell line. In vitro cellular & developmental biology - Animal. 36, 367-373 (2000).
- Sutherland, R. M., et al. Oxygenation and differentiation in multicellular spheroids of human colon carcinoma. Cancer Res. 46, 5320-5329 (1986).
- Unsworth, B. R., Lelkes, P. I. Growing tissues in microgravity. Nat Med. 4, 901-907 (1998).
- Zwezdaryk, K. J., Warner, J. A., Machado, H. L., Morris, C. A., Honerzu Bentrup, K. Rotating cell culture systems for human cell culture: human trophoblast cells as a model. Journal of visualized experiments : JoVE. , (2012).
- Radtke, A. L., Herbst-Kralovetz, M. M. Culturing and Applications of Rotating Wall Vessel Bioreactor Derived 3D Epithelial Cell Models. Journal of visualized experiments : JoVE. , (2012).
- Barrila, J., et al. Organotypic 3D cell culture models: using the rotating wall vessel to study host-pathogen interactions. Nat Rev Microbiol. 8, 791-801 (2010).
- Honer zu Bentrup, K., et al. Three-dimensional organotypic models of human colonic epithelium to study the early stages of enteric salmonellosis. Microbes and infection / Institut Pasteur. 8, 1813-1825 (2006).
- Nickerson, C. A., et al. Three-dimensional tissue assemblies: novel models for the study of Salmonella enterica serovar Typhimurium pathogenesis. Infect Immun. 69, 7106-7120 (2001).
- Alcantara Warren, C., et al. Detection of epithelial-cell injury, and quantification of infection, in the HCT-8 organoid model of cryptosporidiosis. J Infect Dis. 198, 143-149 (2008).
- Carvalho, H. M., Teel, L. D., Goping, G., O'Brien, A. D. A three-dimensional tissue culture model for the study of attach and efface lesion formation by enteropathogenic and enterohaemorrhagic Escherichia coli. Cell Microbiol. 7, 1771-1781 (2005).
- Lin, H. J., O'Shaughnessy, T. J., Kelly, J., Ma, W. Neural stem cell differentiation in a cell-collagen-bioreactor culture system. Brain Res. Dev Brain Res. 153, 163-173 (2004).
- He, L., et al. Increased proliferation and adhesion properties of human dental pulp stem cells in PLGA scaffolds via simulated microgravity. Intl Endo J. , (2015).
- Straub, T. M., et al. In vitro cell culture infectivity assay for human noroviruses. Emerg Infect Dis. 13, 396-403 (2007).
- Herbst-Kralovetz, M. M., et al. Lack of norovirus replication and histo-blood group antigen expression in 3-dimensional intestinal epithelial cells. Emerg Infect Dis. 19, 431-438 (2013).
- Goodwin, T. J., Schroeder, W. F., Wolf, D. A., Moyer, M. P. Rotating-wall vessel coculture of small intestine as a prelude to tissue modeling: aspects of simulated microgravity. Proc Soc Exp Biol Med. 202, 181-192 (1993).
- Goodwin, T. J., Jessup, J. M., Wolf, D. A. Morphologic differentiation of colon carcinoma cell lines HT-29 and HT-29KM in rotating-wall vessels. In Vitro Cell Dev Biol. 28, 47-60 (1992).
- Salerno-Goncalves, R., Fasano, A., Sztein, M. B. Engineering of a multicellular organotypic model of the human intestinal mucosa. Gastroenterology. 141, 18-20 (2011).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. Am J Physiol Renal Physiol. 281, 12-25 (2001).
- Cherry, R. S., Papoutsakis, E. T. Physical mechanisms of cell damage in microcarrier cell culture bioreactors. Biotech and Bioeng. 32, 1001-1014 (1988).
- Bergmann, S., Steinert, M. From Single Cells to Engineered and Explanted Tissues: New Perspectives in Bacterial Infection Biology. Int Rev Cell Mol Biol. 319, 1-44 (2015).
- Xu, B., et al. Simulated microgravity affects ciprofloxacin susceptibility and expression of acrAB-tolC genes in E. coli ATCC25922. Int J Clin Exp Pathol. 8, 7945-7952 (2015).
- Han, C., Jiang, C., Yu, C., Shen, H. Differentiation of transforming growth factor beta1-induced mesenchymal stem cells into nucleus pulposus-like cells under simulated microgravity conditions. Cell Mol Biol (Noisy-le-Grand, France). 61, 50-55 (2015).
- Wang, C., et al. Microgravity activates p38 MAPK-C/EBPbeta pathway to regulate the expression of arginase and inflammatory cytokines in macrophages. Inflamm Res. 64, 303-311 (2015).
- Iliev, I. D., et al. Human intestinal epithelial cells promote the differentiation of tolerogenic dendritic cells. Gut. 58, 1481-1489 (2009).
- Kerneis, S., Bogdanova, A., Kraehenbuhl, J. P., Pringault, E. Conversion by Peyer's patch lymphocytes of human enterocytes into M cells that transport bacteria. Science. 277, 949-952 (1997).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. , (2010).
- Lei, N. Y., et al. Intestinal subepithelial myofibroblasts support the growth of intestinal epithelial stem cells. PLoS One. 9, e84651(2014).
- Voog, J., Jones, D. L. Stem cells and the niche: a dynamic duo. Cell Stem Cell. 6, 103-115 (2010).
- Jabaji, Z., et al. Use of collagen gel as an alternative extracellular matrix for the in vitro and in vivo growth of murine small intestinal epithelium. Tissue Eng Part C Methods. 19, 961-969 (2013).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9, e107814(2014).
- Rodin, S., Antonsson, L., Hovatta, O., Tryggvason, K. Monolayer culturing and cloning of human pluripotent stem cells on laminin-521-based matrices under xeno-free and chemically defined conditions. Nat Protoc. 9, 2354-2368 (2014).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Exp Biol Med. 239, Maywood, N.J. 1124-1134 (2014).
- Tompkins, W. A., Watrach, A. M., Schmale, J. D., Schultz, R. M., Harris, J. A. Cultural and antigenic properties of newly established cell strains derived from adenocarcinomas of the human colon and rectum. J Natl Cancer Inst. 52, 1101-1110 (1974).
- Hinterleitner, T. A., Saada, J. I., Berschneider, H. M., Powell, D. W., Valentich, J. D. IL-1 stimulates intestinal myofibroblast COX gene expression and augments activation of Cl- secretion in T84 cells. Am J Physiol. 271, 1262-1268 (1996).
- Hoshi, H., McKeehan, W. L. Brain- and liver cell-derived factors are required for growth of human endothelial cells in serum-free culture. Proc Natl Acad Sci U S A. 81, 6413-6417 (1984).
- Salerno-Goncalves, R., Pasetti, M. F., Sztein, M. B. Characterization of CD8(+) Effector T Cell Responses in Volunteers Immunized with Salmonella enterica. Serovar Typhi Strain Ty21a Typhoid Vaccine. J Immunol. 169, 2196-2203 (2002).
- Poggioli, T., Sarathchandra, P., Rosenthal, N., Santini, M. P. Intramyocardial cell delivery: observations in murine hearts. J Vis Exp. , e51064(2014).
- Eastburn, D. J., Mostov, K. E. Laying the foundation for epithelia: insights into polarized basement membrane deposition. EMBO Rep. 11, 329-330 (2010).
- Coecke, S., et al. Guidance on good cell culture practice. a report of the second ECVAM task force on good cell culture practice. Altern Lab Anim. 33, 261-287 (2005).
- Geraghty, R. J., et al. Guidelines for the use of cell lines in biomedical research. Br J Cancer. 111, 1021-1046 (2014).
- Hartung, T., et al. Good Cell Culture Practice. ECVAM Good Cell Culture Practice Task Force Report 1. Altern Lab Anim. 30, 407-414 (2002).
- Blanchet, O., et al. Altered binding of regulatory factors to HLA class I enhancer sequence in human tumor cell lines lacking class I antigen expression. Proc Natl Acad Sci U S A. 89, 3488-3492 (1992).
- Palmisano, G. L., et al. HLA-E surface expression is independent of the availability of HLA class I signal sequence-derived peptides in human tumor cell lines. Hum Immunol. 66, 1-12 (2005).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15, 701-706 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunol. , (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados