Method Article
Entwicklung eines unter Schwerelosigkeits Vielzellige Dreidimensionale Organotypischen Modell des menschlichen Darmschleimhaut Grown
In diesem Artikel
Zusammenfassung
Zellen in einem dreidimensionalen (3-D) -Umgebung wachsenden stellen eine deutliche Verbesserung gegenüber der Zellkultivierung in 2-D - Umgebungen (beispielsweise Kolben oder Geschirr). Hier beschreiben wir die Entwicklung eines vielzelligen 3-D organotypischen Modell der menschlichen Schleimhaut Darm unter Schwerelosigkeit kultiviert, die von rotierenden Wandgefäß (RWV) Bioreaktoren.
Zusammenfassung
Da die Zellen in einem dreidimensionalen (3-D) Umwelt haben das Potenzial wachsen viele Lücken der Zellkultivierung zu überbrücken , in 2-D - Umgebungen (z. B. Flaschen oder Geschirr). In der Tat ist es allgemein anerkannt, dass in Flaschen oder Geschirr neigen gezüchtete Zellen zu dedifferenzieren und spezielle Funktionen der Gewebe verliert, aus dem sie abgeleitet wurden. Derzeit gibt es im Wesentlichen zwei Arten von 3-D-Kultursysteme, wo die Zellen in Gerüste geimpft werden die native extrazelluläre Matrix (ECM) nachahmt: Bioreaktoren (a) statische Modelle und (b) Modellen. Der erste Durchbruch war die statischen 3-D-Modelle. 3-D-Modelle Bioreaktoren wie der rotierenden Wandgefäß (RWV) Bioreaktoren sind eine neuere Entwicklung verwendet wird. Das ursprüngliche Konzept der RWV Bioreaktoren wurde am NASA Johnson Space Center in den frühen 1990er Jahren entwickelt und wird angenommen, dass die Grenzen der statischen Modelle wie die Entwicklung von hypoxischen, nekrotischen Kerne zu überwinden. Die RWV Bioreaktoren könnten umgehen thist Problem durch Bereitstellung fluid dynamics, die die effiziente Diffusion von Nährstoffen und Sauerstoff erlauben. Diese Bioreaktoren bestehen aus einem Rotator Basis, und drehen Sie zwei verschiedene Formate der Kulturgefäße zur Unterstützung dient , die durch ihre Belüftungsquellentyp unterscheiden: (1) langsames Drehen Lateral Vessels (STLVs) mit einer koaxialen Oxygenator in der Mitte, oder (2 ) Hohe Seitenverhältnis Vessels (HARVs) mit Sauerstoffversorgung über einen flachen, Silikonkautschuk Gasübertragungsmembran. Diese Gefäße ermöglichen eine effiziente Gastransfer während der Blasenbildung und damit Turbulenzen zu vermeiden. Diese Bedingungen führen zu einer laminaren Strömung und minimale Scherkraft, die Modelle der Schwerkraft (Schwerelosigkeit) reduziert im Inneren des Kulturgefäßes. Hier beschreiben wir die Entwicklung eines vielzelligen 3-D organotypischen Modell des menschlichen Darmschleimhaut besteht aus einer intestinalen Epithelzellen Zelllinie und primären humanen Lymphozyten, Endothelzellen und Fibroblasten gezüchtet unter Schwerelosigkeit durch den RWV Bioreaktor zur Verfügung gestellt. </ P>
Einleitung
Der erste Durchbruch beim Aufbau eines 3-D - Modell wurde in den frühen der 1980er Jahre berichtet , als die Wissenschaftler verschiedene Arten des Gerüsts (z. B. Laminin, Kollagen Typ I, Kollagen IV und Fibronektin) und Cocktails von Wachstumsfaktoren zu untersuchen begann zu verbessern Zelle-zu-Zelle und ECM - Wechselwirkungen von "statischen" 3-D - Modelle 1-7. Seitdem hat das Hauptproblem bei diesen Modellen Einschränkungen waren bei der Übertragung von Nährstoffen und Sauerstoff in dem Medium und Gewebekonstrukten 8. Im Gegensatz zu den Zellen in der in vivo Umgebung , die von umgebenden Netzen von Blutgefäßen einen stetigen Fluss von Nährstoffen und Sauerstoff erhält, behindert die statische Natur dieser Modelle , um die effektive Verteilung von ihnen zu den Zellen. Zum Beispiel Zellaggregate in in - vitro - statische Modelle erzeugt , die ein paar Millimeter groß überschreiten wird unweigerlich hypoxischen, nekrotischen Kerne 9 entwickeln. Die RWV Bioreaktoren könnte dieses Problem zu umgehendurch fluid dynamics , vorausgesetzt die effiziente Diffusion von Nährstoffen und Sauerstoff 10-12 ermöglichen. Doch bis heute, die Arbeit mit RWV Bioreaktoren wurden auf die Aufnahme von ein oder zwei Zelltypen 13-17 begrenzt. Außerdem kann anstelle eines räumlichen Orientierung ähnlich zu nativem Gewebe bildeten die Zellen Zellaggregate. Der Hauptgrund für diese Einschränkung ist das Fehlen eines Gerüst Lage, Zellen in einer integrierten Weise zu integrieren. Die Gerüste in den RWV Bioreaktoren bisher verwendet werden , bestehen, mit wenigen Ausnahmen 16-18, vor allem von synthetischen Mikrokügelchen, rohrförmigen Zylinder oder kleine Blätter 13-15,19-23. Diese sind steife Materialien, deren Zusammensetzung und Flexibilität nicht manipuliert werden können, und an die Zellen an ihre Oberfläche gebunden. Somit ist es unwahrscheinlich , dass diese Modelle ein System , in dem bieten wird zu bewerten, in einer integrierten Weise, die verschiedenen Zellkomponenten wie Stromazellen (z. B. Fibroblasten, Immun- und Endothelzellen) , dass should im Gerüst verteilt werden, um eng menschlichem Gewebe nachahmen.
Hier beschreiben wir die Entwicklung eines mehrzelligen 3-D organotypischen Modell der menschlichen Darmschleimhaut , bestehend aus einer intestinalen epithelialen Zelllinie und primären humanen Lymphozyten, Endothelzellen und Fibroblasten 24. Diese Zellen wurden unter Schwerelosigkeit zur Verfügung stellen von der RWV Bioreaktor 13,25-30. Im 3-D - Modell besitzt die ECM viele verschiedene Eigenschaften, wie beispielsweise eine Osmolalität ähnlich dem Kulturmedium (z. B. vernachlässigbaren Diffusionsbeschränkungen während der Kultur) und die Fähigkeit , Zellen und anderen relevanten extrazelluläre Matrixproteine, sowie die einzuarbeiten entsprechende Steifigkeit in Bioreaktoren 24 verwendet werden. Biologische Systeme sind sehr komplex, und in den letzten Jahren hat mit der Umgebung eher eine Verschiebung des Fokus von Schleimhaut Forschung in Richtung auf die Untersuchung von Zell-Wechselwirkungen war, als sie in isolatio Studiumn. Insbesondere wird die Bedeutung der Zell-Zell - Wechselwirkungen bei der Beeinflussung intestinale Zellüberlebens und der Differenzierung gut 31-34 dokumentiert. Insbesondere weist die Verbindung zwischen Epithelzellen und ihre Nische einen profunden Einfluss auf die Epithelzelle Expansion und Differenzierung 35. Tatsächlich ist es allgemein anerkannt, dass nicht nur die Zelle-zu-Zelle, sondern auch Zell-ECM-Wechselwirkungen sind für die Wartung und die Differenzierung von Epithelzellen in 3-D Kulturmodellen. Frühere Studien haben gezeigt, dass gut ECM - Proteine wie Kollagen zeigte ich 24,36,37, Laminin 38 und Fibronektin 39 instrumental sind in intestinalen Epithelzellen beeinflussen räumliche Orientierung ähnlich der nativen Schleimhaut zu erwerben. So kann die Entwicklung neuer Technologien, wie unsere 3-D - Modell 24, dass imitieren die phänotypische Vielfalt des Darms ist erforderlich, wenn die Forscher die komplexe zelluläre und strukturelle Architektur neu zu erstellen beabsichtigenund die Funktion des Darms Mikroumgebung. Diese Modelle stellen ein wichtiges Instrument bei der Entwicklung und Evaluierung von neuen oralen Medikamenten und Impfstoff-Kandidaten.
Protokoll
Ethik Aussage: Alle Blutproben wurden von Freiwilligen gesammelt , die in der Protokollnummer HP-00040025-1 teilgenommen. Die University of Maryland Institutional Review Board genehmigt dieses Protokoll und ermächtigt, die Sammlung von Blutproben von gesunden Freiwilligen für die Studien in diesem Manuskript enthalten. Der Zweck dieser Studie an Freiwilligen wurde erklärt, und alle Freiwilligen gab informiert unterzeichnete Zustimmung vor Ende der Blutentnahme.
Hinweis: Siehe Tabelle 1 für mittlere Ergänzung Vorbereitung. Siehe Tabelle 2 für die Herstellung der 3-D - Kulturmedien.
1. Vorbereitung der Kulturgefäße
- Schrauben Sie den Deckel der Einfüllöffnung des 50 ml-Gefäß füllen und mit 50 ml sterilem Kulturmedium (z. B. RPMI). Führen Sie alle unter sterilen Bedingungen in einer laminaren Haube.
- Setzen Sie die Kappe und wischen Sie verschüttete Medium auf jeder Oberfläche mit 70% Ethanol.
- Lassen Sie das Schiff zu incubmindestens 15 min O / N bei RT aßen.
- Verwenden Sie die Einfüllöffnung des Kulturmediums zu verwerfen und 30 ml 3-D-Kulturmedium.
- Wischen Sie verschüttete Medium auf jeder Oberfläche mit 70% Ethanol.
2. Herstellung der Zellen
- Humanen epithelialen Zelllinie (HCT-8) 24,40.
- Kulturzellen in RPMI, ergänzt mit 100 U / ml Penicillin, 100 ug / ml Streptomycin, 50 ug / ml Gentamicin, 2 mM L-Glutamin, 1 mM Natriumpyruvat, 10 mM HEPES-Puffer und 10% hitzeinaktiviertem fötalem Rinderserum (FBS ) (Beilage 1). Bei 70% Konfluenz, geteilte Zellen in einem Verhältnis von 1: 5.
- Menschliche Kolon - Fibroblasten (CCD-18Co - Zellen) 24,41.
- Kulturzellen in Basal Eagle-Medium , angereichert mit Beiblatt 1 Bei Konfluenz, geteilte Zellen in einem Verhältnis von 1:. 3.
- Nabelvene des Menschen Endothelial (HUVEC - Zellen) 24,42.
- Kulturzellen in Endothelial Basal Medium (EBM) Medium mit 100 ug angereichert / ml Heparin, 3 ug / ml Endothelzellwachstums Supplement (EKGs) und 1 ergänzen Bei 70% Konfluenz, geteilte Zellen in einem Verhältnis von 1:. 2.
- Lymphozyten / Monozyten
- Isolieren Periphere mononukleäre Blutzellen (PBMC) aus dem Blut durch Dichtegradientenzentrifugation unter Verwendung von Standardtechniken 43.
- Kurz gesagt, eine 10 ml-Pipette vorsichtig 30 ml verdünntem Blut (1: 1 Blut: Phosphat-gepufferte Saline (PBS)) in einem 50 ml konischen Röhrchen 10 ml Dichtezentrifugation Medien enthält. Nach dem Zentrifugationsschritt, Lymphozyten und Monozyten werden zwischen den Dichtezentrifugation Medien und Plasma-Schichten in der "weißen" Schicht befinden.
- Sammeln Sie die weiße Schicht eine Transferpipette. Vermeiden Sie Granulozytkontaminierung durch die Sammlung von Dichtezentrifugation Medien zu begrenzen. Nach 43 Waschen, use PBMC wie oder kryokonserviert in flüssigem N 2.
Hinweis: Es ist wichtig zu betonen, dass PBMC besteht im Wesentlichen aus Lymphozyten und Monozyten, mit einem kleinen Anteil von dendritischen Zellen und anderen Zelltypen.
- Isolieren Periphere mononukleäre Blutzellen (PBMC) aus dem Blut durch Dichtegradientenzentrifugation unter Verwendung von Standardtechniken 43.
- Wachsen alle Zellen unter Standardkulturbedingungen bei 37 ° C in einer Atmosphäre von 5% CO 2.
3. Herstellung von Kollagen-eingebetteten Zellen
- Bestimmen Sie die Anzahl der Einsätze auf die Zahlen von experimentellen Bedingungen benötigt Basis-Set-up zu werden. Legen Sie die entsprechende Anzahl von Einsätzen in die Vertiefungen einer 6-Well-Platte.
- Eine Suspension von HUVEC und Fibroblasten:
- Waschen Sie die Kolben zweimal in PBS und lösen die Zellen unter Verwendung von Trypsin, 0,25% (1x) mit 0,05% Trypsin-Tetranatriumethylendiamintetraacetat (Trypsin-EDTA). Fügen Sie genug Trypsinlösung die Gesamtheit der Zellkulturoberfläche zu bedecken. Detachment erfolgt in der Regel innerhalb von 5 bis 15 min
- Sammelnabgelösten Zellen in einer 50 ml-Rohr 30 ml Dulbeccos modifiziertem Eagle-Medium (DMEM) -30% FBS Medium enthält.
- Zentrifugieren Sie die Röhrchen bei 500 g für 10 min.
- Resuspendieren der Zellen in 30 ml DMEM-30% FBS-Medium.
- Zählen der Gesamtzahl der lebenden Zellen durch Verdünnen von 20 & mgr; l der resuspendierten Zellen mit 20 ul Trypan-Blau-Farbstoff. Legen Sie das Hämozytometer mit dem Zellgemisch. Tragfähige PBMCs wird weiß klar; nonviable PBMC wird der Farbstoff und werden blau erwerben.
- Resuspendieren jeden Zelltyp in DMEM-30% FBS - Medium bei einer Konzentration von 5 - 8 x 10 & sup7 ; Zellen ml - 1.
- Bereiten Sie zellhaltigen Collagengele
Hinweis: Jeder Behälter wird die Herstellung von ~ 5 ml zellhaltigen Kollagengel erfordern.- In einem 50 ml-konischen Röhrchen durch Zugabe von 1 x DMEM-Medium, das Kollagen-Mischung herzustellen, ergänzt mit 50 ug / ml Gentamicin, 2 mM L-Glutamin und 10% hitze inactivated FBS plus 3 mg / ml bovinem Kollagen-I, 10 ug / ml Laminin, 40 ug / ml Collagen IV, 10 ug / ml Fibronektin, 2 ug / ml Heparinsulfat-Proteoglykan und 15 mM NaOH (den physiologischen pH zu erreichen).
- Schließen Sie den Schlauch und mischen mehrmals durch Umdrehen, bis die Mischung vollständig homogenisiert. Vermeiden Sie Blasenbildung.
Wichtig: Halten Sie die Mischung auf Eis Gelieren zu verhindern.- Critical Schritt: Wenn die Mischung ein saures Aussehen (gelbliche Farbe) entwickelt, ein paar Tropfen steriler 1 N NaOH das Gemisch zu neutralisieren.
- Konzentrierte HUVEC und Fibroblasten in einer Dichte von 1,0 bis 1,2 und 1,5 bis 2,0 x 10 6 Zellen / ml, jeweils mit dem angereicherten Kollagen-Mischung (oben beschrieben). Schließen Sie die Rohre und mischen mehrmals durch Umdrehen, bis die Mischung vollständig homogenisiert. Vermeiden Sie Blasenbildung. Wichtig: Halten Sie die Mischung auf Eis Gelieren zu verhindern.
- Hinzufügen von 4 bis 5 ml des zellhaltigen KollagenGel nach jedem Einsatz, die zuvor in eine 6-Well-Platte geladen ist, und in der Haube mit wenig oder keiner Bewegung für 1 h zu gelieren gelassen.
- Nach 1 Stunde, übertragen Sie die 6-Well - Platte auf einem 37 ° C, 5% CO 2 Inkubator für 1 - 2 zusätzliche Stunden.
- Bringen Sie den 6-Well-Platte mit der Haube und mit Hilfe einer sterilen Pinzette und Skalpell aseptisch abgeschnittene die Membran von dem Einsatz Lösen der zellhaltigen Gels aus der Membran. Schneiden Sie das freistehende Gel in kleine Quadrate (~ 5 x 5 mm).
- Fügen Sie die kleinen Zellen enthaltende Quadrate in ein 50-ml HARV mit der Füllöffnung.
- Eine Suspension von HCT-8-Epithelzellen:
- Waschen Sie die Kolben zweimal in PBS und lösen die Zellen unter Verwendung von Trypsin, 0,25% (1x) mit Trypsin-EDTA-Behandlung. Fügen Sie genug Trypsinlösung die Gesamtheit der Zellkulturoberfläche zu bedecken. Detachment erfolgt in der Regel innerhalb von 10 bis 15 Minuten.
- Sammeln abgelösten Zellen in 30 ml DMEM-30% FBS-Medium.
- Zentri- fugalkrUGE DMEM-30% FBS-Medium Rohr bei 500 xg für 10 min enthält.
- Resuspendieren der Zellen in 30 ml DMEM-30% FBS-Medium.
- Zählen der Gesamtzahl der lebensfähigen Zellen, wie in 3.2.5 beschrieben.
- Resuspendieren der HCT-8 - Epithelzellen in DMEM-30% FBS - Medium bei einer Konzentration von 10 7 Zellen ml - 1.
- 1 ml der konzentrierten HCT-8-Epithelzellen in die 50-ml HARV mit der Füllöffnung.
- Durch die Verwendung der Einfüllöffnung, fügen Sie weitere 3-D-Kulturmedium, bis der Behälter fast voll ist (~ 20 ml).
- Setzen Sie die Kappe und wischen Sie die Lippe der Einfüllöffnung mit 70% Ethanol.
- Legen Sie eine Spritze in jeder Spritze Port des RWV: Ort, um eine 5 ml-Spritze mit 3 bis 4 ml 3-D-Kulturmedium in einem Hafen und eine 5 ml-leere Spritze in den anderen Port.
- Entfernen Sie alle sichtbaren Blasen, die durch in die leere Spritze ziehen, während etwa das gleiche Volumen des Mediums durch den anderen Spritzenkanal injiziert wird.
- Legen Sie die vesSels im Bioreaktor, schalten Sie das Gerät und stellen Sie die Geschwindigkeit auf etwa 13 bis 14 Umdrehungen pro Minute.
Hinweis: Critical Schritt: Rotation Rate müssen möglicherweise einige Male während eines Experiments eingestellt werden , um die Zellen zu halten innerhalb des Behälters umlaufenden, um dadurch die Vermeidung von Kontakt mit den Gefäßwänden. - Kulturzellen bei 37 ° C, 5% CO 2 unter Schwerelosigkeit, durch den RWV Bioreaktor vorgesehen.
- Ändern Kulturmedium alle 3 - 4 Tage durch das Ersetzen ca. 30 ml mit frischem 3-D-Kulturmedium.
- Nach 4 Tagen (± 1 Tag), die Gefäße aus dem Bioreaktor zu entfernen und Lymphozyten / Monozyten zu den Gefäßen (2 x 10 7 / Schiff) hinzuzufügen.
- Platzieren der Gefäße wieder in dem Bioreaktor bei 37 ° C, 5% CO 2 für weitere 5 Tage (± 1 Tag).
- Nach den weiteren 5 Tagen (Tag 9 der Kultur), Lymphozyten / Monozyten zu den Gefäßen (2 x 10 7 / Gefäß) hinzuzufügen und die Kulturen für 12 weitere Tage fortgesetzt.
- Ändern Kulturmedium alle 3 - 4 Tage durch das Ersetzen ca. 30 ml mit frischem 3-D-Kulturmedium.
4. Ernten 3-D-Kulturen für die Histologie
- Mit Hilfe einer Transferpipette Ernte jeder kleine Gelfragment, jetzt genannt "Konstrukt", in einem Sechs-Well-Platte, enthaltend 10 ml 10% Formalin-Puffer. Verlassen 3 h bei RT oder für 12 bis 16 Stunden bei 4 ° C.
- Bereiten Sie die Gewebeverarbeitung und Einbettkassetten durch Markierung und das Hinzufügen von zwei Stücke von Biopsie Schaumstoffpolster in jeder Kassette.
- Tauchen Sie die Kassetten in 10% Formalin-Puffer.
- Mit Hilfe der Zange stellen die Fest Konstrukten zwischen den beiden Schaumstoffpolster.
- Tauchen Sie die Kassetten in 10% Formalin-Puffer.
- Fahren Sie mit dem Standardverfahren für die Einbettung, Schneiden und Färben 44.
Ergebnisse
Bisher haben wir einen mehrzelligen 3-D organotypischen Modell des menschlichen Darmschleimhaut bestehend aus einer Darmepithel - Zelllinie und primären humanen Lymphozyten, Endothelzellen und Fibroblasten unter Schwerelosigkeit 24 (1) kultiviert entwickelt. Fibroblasten und Endothelzellen wurden in einer Kollagen - Matrix mit zusätzlichen I gut Basalmembranproteine 45 (dh., Laminin, Kollagen IV, Fibronectin und Heparinsulfat - Proteoglykan) und zu RWV Bioreaktoren angereichert eingebettet. Nach 10 bis 15 Tagen ergab die histologische Färbung Analyse das Vorhandensein von Zotten artigen Strukturen in den Konstrukten. Etwa 60 bis 80% dieser Epithelzellen wurden als eine Monoschicht von polarisierten Zellen organisiert mit ihren Kernen in einem basalen Position nahe der ECM liegt, was ein wichtiges Merkmal der gut differenzierten Zellen ist (Abbildung 2).
ent "fo: keep-together.within-page =" 1 ">
Abbildung 1: Schematische Darstellung der Konstruktion des 3-D - Modell. Vier Schritte sind notwendig, um die 3-D-System aufzubauen. Zuerst wird die erforderliche Anzahl von Zellen zu erhalten, die 3-D-Modell, einen humanen intestinalen Enterozyten epithelialen Zelllinie (HCT-8) und primären humanen Endothelzellen und Fibroblasten zu erzeugen, werden als 2-D konfluente Monoschichten gezüchtet. Zweitens bestehen die ECM von Kollagen-I mit zusätzlichen gut Basalmembranproteinen angereicherte Matrix (dh., Laminin, Kollagen IV, Fibronektin und Heparinsulfat - Proteoglykan) hergestellt wird . Drittens, Fibroblasten und Endothelzellen in einem Kollagen-I-Mischung eingebettet und ergänzt durch die Zugabe HCT-8 Epithelzellen gefolgt Bioreaktoren RWV. Viertens sind primäre Lymphozyten zur Kultur an den Tagen hinzugefügt 4 und 9 (± 1 Tag)."> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
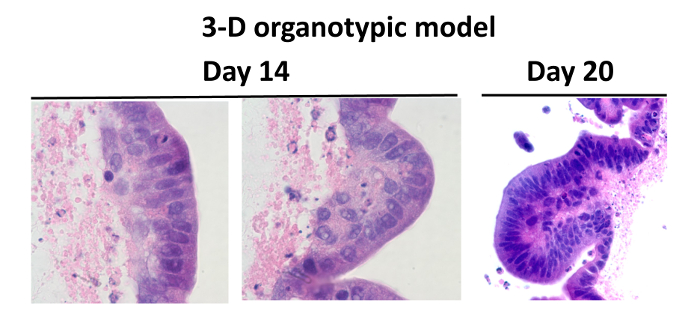
Abbildung 2: Vergleich zwischen der normalen menschlichen Darm und die Organotypischen Models. Hämatoxylin und Eosin-Färbung von kultivierten Zellen in der 3-D-Mikrogravitationsmodell: Gewebe wurden gefärbt lila und Gerüst gefärbt rosa. Zellen aus dem 3-D - Modell wurden für 14 ( "a" und "b") und 20 Tage (c). Zwanzig Tage nach der Aussaat werden Gesamt-Zellzahlen beibehalten, und die Zellen wurden gut differenziert zeigt villus-ähnliche Funktionen. Die Bilder werden bei 100 - facher ( "a" und "b") und 40x ( "c") Vergrößerung angezeigt. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
| Produktname | Pkg. Größe | Rekonstitution | Arbeitskonzentration | Lagerung |
| Fibroblasten-Wachstumsfaktor-Basic (bFGF) | 25 mg | 25 ug / ml Stammlösung herzustellen; werden 25 ug FGF in 1 ml steriles Medium (RPMI plus 1% FCS), Wirbel aufzulösen, 100 & mgr; l / aliquoten | 5 ng / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| Stammzellfaktor (SCF) | 10 mg | 10 ug / ml Stammlösung herzustellen; 10 ug SCF hinzufügen in 1 ml steriles Medium (RPMI plus 1% FCS), Wirbel aufzulösen, fügen Sie 250 ul / aliquoten | 5 ng / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| Hepatozyten-Wachstumsfaktor (HGF) | 5 mg | Zur Herstellung von 5 ug / ml Stammlösung; addieren 5 ug HGF in 1 ml steriles Medium (RPMI plus 1% FCS), Wirbel aufzulösen, 200 & mgr; l / aliquoten | 2 ng / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| Endothelin 3 | 50 mg | 50 ug / ml Stammlösung herzustellen; werden 50 ug Endothelin in 1 ml steriles Medium (RPMI plus 1% FCS), Wirbel aufzulösen, 100 & mgr; l / aliquoten | 10 ng / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| Laminin | 1 mg | Tauen Sie langsam bei 2 - 8 ° C, wirbeln und mit 100 & mgr; l / aliquoten | 10 mg / ml | Flüssigkeit -20 o C, Aliquots -20 o C arbeiten, vermeiden Wiederholung freEze / Tau |
| Vascular Endothelial Growth Factor (VEGF) | 10 mg | Zur Herstellung von 5 ug / ml Stammlösung; 10 ug VEGF in 2 ml sterilem Wasser hinzufügen, Wirbel aufzulösen, 100 & mgr; l / aliquoten | 1 ng / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| Leukemia Inhibitory Factor (LIF) | 50 mg | 20 ug / ml Stammlösung herzustellen; 50 ug LIF in 2,5 ml sterilem Wasser hinzufügen, Wirbel aufzulösen, 100 & mgr; l / aliquoten | 4 ng / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| adenin | 25 g | Zur Herstellung von 0,18 M Stammlösung; hinzufügen 121,5 mg og adedine in 50 ml 0,05 M HCl (250 ul 37,1% HCl in 50 ml Wasser)), Wirbel aufzulösen, Filter sterilisieren und1 ml / aliquoten | 1,8 x 10 -3 M | Pulver 4 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| Insulin | 50 mg | Zu 5 mg / ml Stammlösung herzustellen; werden 50 mg Insulin in 10 ml 0,005 M HCl (5 ul von 37,1% HCl in 10 ml Wasser)), Wirbel aufzulösen, Filter sterilisieren und mit 0,5 ml / aliquoten | 5 mg / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| T3 | 100 mg | Zur Herstellung von 2 x 10 -8 M Stammlösung; fügen 3,4 mg T3 in 25 ml 1 M NaOH, verdünnt mit 0,1 ml dieser Lösung werden in 9,9 ml PBS, verdünnt erneut 0,1 ml dieser Lösung werden in 9,9 ml PBS, Wirbel zu lösen, Filter sterilisieren und mit 0,5 ml / Aliquot | 2 x 10 -11 M | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| Choleratoxins | 5 mg | Zur Herstellung von 10 -7 M Stammlösung; addieren 5 mg Cholera - Toxin in 5 ml sterilem ddH 2 O (bei -20 ° C); verdünnen 50 & mgr; l dieser Lösung in 5 ml ddH 2 O, Wirbel zu homogenisieren, Filter zu sterilisieren und mit 0,5 ml / aliquoten | 10 -10 M | Pulver 4 - 8 ° C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| Fibronektin | 1 mg | Zu 1 mg / ml Stammlösung herzustellen; 1 mg Fibronektin in 1 ml sterilem distiled Wasser. Lassen Sie 30 min. NICHT agitieren bzw. Drall für Material in Lösung zu gehen. DO. 100 l / aliquoten | 10 mg / ml | Pulver 4 - 8 ° C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| apo-Transferrin | 100 mg | Zur Herstellung von 5 mg / ml Stammlösung (1,000x); werden 100 mg Transferrin auf 20 ml PBS Drall aufzulösen, Filter sterilisieren und 0,5 ml / Aliquot fügen | 5 mg / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| Heparin | 50 KU | Zur Herstellung von 50 mg / ml Stammlösung (1,000x); werden 50 mg Heparin in 1 ml Wasser wirbeln zu lösen, Filter sterilisieren und 1 ml / aliquoten hinzufügen | 0,1 mg / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
| Heparansulfat-Proteoglykan | 1 mg | Zu 0,1 mg / ml Stammlösung herzustellen; hinzufügen 1 mg Heparansulfat in 10 ml sterilem Wasser wirbeln zu lösen, und fügen Sie 0,2 ml / aliquoten | 2 mg / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeidenWiederholung Frost / Tau |
| Collagen IV | 5 mg | Zu 2 mg / ml Stamm solutin vorbereiten: in 2 mg Kollagen V in 2,5 ml steriler 0,25% Essigsäure. Dauert ca. 1 - 2 Stunden für das Material in Lösung zu gehen Swirl für eine bessere dillution.. In 400 ul / aliquoten | 80 mg / ml | Pulver -20 o C, Arbeits Aliquots -20 o C, vermeiden wiederholen Frost / Tau |
Tabelle 1: definiertem Medium Supplement Vorbereitung.
| F-12 - Medium mit | |||
| Reagens | Stammlösung | Endgültige Lösung | Menge |
| Fötales Kälberserum | 10% | 50 ml | |
| Natriumpyruvat | 100 mM | 1 mM | 5 ml |
| L-Glutamin | 200 mM | 2 mM | 5 ml |
| Hepes | 1 M | 10 mM | 5 ml |
| Gentamicin | 50 mg / ml | 50 & mgr; g / ml | 500 ul |
| Penicillin / Streptomycin | 10000 U / ml / 10 mg / ml | 100 U / ml / 100 & mgr; g / ml | 5 ml |
| Insulin | 5 mg / ml | 5 & mgr; g / ml | 500 ul |
| T3 | 2 x 10-8 M | 2 x 10 -11 M | 500 ul |
| adenin | 1,8 x 10-1 M | 1,8 x 10-3 M | 5 ml |
| Transferrin | 5 mg / ml | 5 & mgr; g / ml | 500 ul |
| Heparin | 50 mg / ml | 0,1 mg / ml | 1 ml |
| EKGs | 3 mg / ml | 3 & mgr; g / ml | 5 ml |
| bFGF | 25 & mgr; g / ml | 5 ng / ml | 100 ul |
| SCF | 10 & mgr; g / ml | 5 ng / ml | 250 ul |
| HGF | 5 & mgr; g / ml | 2 ng / ml | 200 ul |
| Endothelin 3 | 50 & mgr; g / ml | 10 ng / ml | 200 ul |
| LIF | 20 & mgr; g / ml | 4 ng / ml | 100 ul |
| VEGF | 5 & mgr; g / ml | 1 ng / ml | 100 ul |
| Choleran Toxin | 10 -7 M | 10 -10 M | 500 & mgr; l |
| Anmerkung: Die Menge oben genannten ist zur Herstellung von 500 ml 3-D Kulturmedien. Die Medien müssen nicht länger als 2 Wochen bei 4 ° C gelagert werden | |||
Tabelle 2: Herstellung von 3-D Nährmedien.
Diskussion
In diesem Manuskript beschreiben wir die Entwicklung eines biotechnologisch - Modell der menschlichen Schleimhaut Darm von Multiples Zelle besteht Typen , einschließlich primären humanen Lymphozyten, Fibroblasten und Endothelzellen, sowie Darmepithel - Zelllinien 24. In diesem 3-D - Modell werden die Zellen in einem Kollagen-reiche extrazellulären Matrix unter Schwerelosigkeit 24 kultiviert.
Wie bereits beschrieben, sind die wichtigsten Merkmale dieses Modells: (i) die Fähigkeit , die Epithelgewebe einschichtigen Organisation, (ii) die Induktion von geeigneter Polarität von Epithelzellen, tight junctions, Desmosomen und Mikrovilli, (iii) ein langfris zu imitieren Zeitkultur (bis zu 20 Tage) mit hoher Lebensfähigkeit der Primärzellen (dh., Fibroblasten und Endothelzellen), (iv) die Expression der gewebeähnlichen Differenzierungsmarker einschließlich Zotten, Cytokeratin, E-Cadherin und mucin, (v) die Fähigkeit , große Mengen von Zytokinen zu erzeugen (z. B. IL-8) und alkalischer Phosphatase auf antigenische Stimulation, (vi) den Transport von Nährstoffen, wie Glucose (dh. Expression von Disaccharidasen und Anwesenheit von Zucker Transporter) und (vii) die Multi-lineage Differenzierung von intestinalen Epithelzellen (dh., saugfähig enterocyte, William Hill sowie M - Zellen) 24.
Es ist wichtig , dass die Option reproduzierbare Ergebnisse zu erreichen , um die Ermittler mit unserem 3-D - Modell 46-48 für eine gute Zellkultur - Richtlinien einhalten müssen. Es ist entscheidend, systematisch Zellen zu steuern, um die Lebensfähigkeit, Mykoplasmen und Veränderungen in der Wachstumsverhalten Zelle. Wenn ein Problem erkannt wird, stellen Sie zuerst sicher, dass keine unbefugten Änderungen am Protokoll eingeführt. Wenn das Problem weiterhin besteht, wechseln Sie zu einer neuen Charge der verschiedenen Komponenten des Mediums (einschließlich Serum) und /oder Zellen. Eine Beschränkung unserer 3-D-Modell ist die Verwendung von tumorigenen HCT-8 epithelialen Zelllinie. Jedoch ist es wichtig zu berücksichtigen, dass die Gegenwart von HCT-8-Linien bietet den Vorteil, im Handel erhältlich ist. Hinzu kommt, dass diese Epithelzellen nicht entweder klassisch oder nicht-klassische Human - Leukozyten - Antigen (HLA) exprimieren -Klasse I 49,50 Molekülen. So ermöglichen sie die Kultur von Epithelzellen mit PBMC aus verschiedenen HLA-Klasse-I in Abwesenheit Haplotypen Epithelzelle-PBMC Alloreaktivitat. Darüber hinaus , wenn dieses System mit Systemen wie dem Darm Stammzellen Vergleich Organoiden 51-53, bietet dieses Modell viele Vorteile. Obwohl gut Stammzellen Organoiden wertvolle Informationen über die Biologie Zelle zur Verfügung stellen und Darm-Differenzierung 51-53 erlaubt dieses Modell eine direkte apikal Exposition Nährstoffe, Medikamente und Krankheitserreger. Dieses Modell bietet auch einen einfachen Zugang zu luminalen Inhalte, wie antimikrobielle Peptide und Zytokine. Im Gegensatz dazu sind Organoide compact unseine mit einem nach innen gerichtet luminalen Oberfläche. Folglich gibt es eine begrenzte Menge an Produkt , das in den organoiden Lumen 54 eingeführt werden kann.
Wir glauben , dass unsere vielzelligen 3-D organotypischen Modell des menschlichen Darmschleimhaut hat weitreichende Potenzial als Instrument für die Entdeckung sowohl in Gesundheit und Krankheit, einschließlich der Interaktion mit Pathogenen, Antigen Handel sowie Entzündungs- und Stoffwechselprozesse 24. Schließlich aufgrund der mehrzelligen Wesen unserer 3-D - Modell, könnte unser Modell Verstärkungs- und Verlust-Studien unter Verwendung von Immunzelltypen ermöglichen , die epithelialen Zellverhalten in vivo wahrscheinlich zu beeinflussen sind.
Offenlegungen
The authors declare that a US Non-Provisional Patent Application has been filed in the U.S.Patent and Trademark Office (Number: 13/360,539).
Danksagungen
This work was supported, in part, by NIAID, NIH, DHHS federal research grants R01 AI036525 and U19 AI082655 (CCHI) to MBS and by NIH grant DK048373 to AF. The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Institute of Allergy And Infectious Diseases or the National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| Quad Rotator/Independent Rotating Wall Vessel (RWV) bioreactor | Synthecon | RCCs-4DQ | For up to 4 vessels. Models with more or less vessels are also available. |
| Disposable 50 ml-vessel | Synthecon | D-405 | Box with 4 vessels |
| HCT-8 epithelial cells | ATCC | CCL-244 | |
| CCD-18Co Fibroblasts | ATCC | CRL-1459 | |
| Human Umbilical Vein Endothelial Cells | ATCC | CRL-1730 | HUVEC |
| Fibroblast Growth Factor-Basic | Sigma | F0291 | bFGF |
| Stem Cell Factor | Sigma | S7901 | SCF |
| Hepatocyte Growth Factor | Sigma | H1404 | HGF |
| Endothelin 3 | Sigma | E9137 | |
| Laminin | Sigma | L2020 | Isolated from mouse Engelbreth-Holm-Swarm tumor |
| Vascular Endothelial Growth Factor | Sigma | V7259 | VEGF |
| Leukemia Inhibitory Factor | Santa Cruz | sc-4377 | (LIF |
| Adenine | Sigma | A2786 | |
| Insulin | Sigma | I-6634 | |
| 3,3',5-triiodo-L-thyronine | Sigma | T-6397 | T3 |
| Cholera Toxin | Sigma | C-8052 | |
| Fibronectin | BD | 354008 | Isolated from human plasma |
| apo-Transferrin | Sigma | T-1147 | |
| Heparin | Sigma | H3149 | |
| Heparan sulfate proteoglycan | Sigma | H4777 | Isolated from basement membrane of mouse Engelbreth-Holm-Swarm tumor |
| Collagen IV | Sigma | C5533 | Isolated from human placenta |
| Heat-inactivated fetal bovine serum | Invitrogen | 10437-028 | |
| D-MEM, powder | Invitrogen | 12800-017 | |
| 10% formalin–PBS | Fisher Scientific | SF100-4 | |
| Bovine type I collagen | Invitrogen | A1064401 | |
| Trypsin-EDTA | Fisher Scientific | MT25-052-CI | |
| Sodium pyruvate | Invitrogen | 11360-070 | |
| Gentamicin | Invitrogen | 15750-060 | |
| Penicillin/streptomincin | Invitrogen | 15140-122 | |
| L-Glutamine | Invitrogen | 25030-081 | |
| Hepes | Invitrogen | 15630-080 | |
| Ham's F-12 | Invitrogen | 11765-054 | |
| Basal Medium Eagle | Invitrogen | 21010-046 | BME |
| RPMI-1640 | Invitrogen | 11875-093 | |
| Endothelial Basal Medium | Lonza | CC-3156 | EBM-2 |
| Endothelial cell growth supplement | Millipore | 02-102 | ECGS |
Referenzen
- Aumailley, M., Timpl, R. Attachment of cells to basement membrane collagen type IV. J Cell Biol. 103, 1569-1575 (1986).
- Buset, M., Winawer, S., Friedman, E. Defining conditions to promote the attachment of adult human colonic epithelial cells. In Vitro Cell Dev Biol. 23, 403-412 (1987).
- Fitzgerald, T. J., Repesh, L. A., Blanco, D. R., Miller, J. N. Attachment of Treponema pallidum to fibronectin, laminin, collagen IV, and collagen I, and blockage of attachment by immune rabbit IgG. Br J Vener Dis. 60, 357-363 (1984).
- Goetschy, J. F., Ulrich, G., Aunis, D., Ciesielski-Treska, J. Fibronectin and collagens modulate the proliferation and morphology of astroglial cells in culture. Int J Dev Neurosci. 5, 63-70 (1987).
- Paye, M., Lapiere, C. M. The lack of attachment of transformed embryonic lung epithelial cells to collagen I is corrected by fibronectin and FXIII. J Cell Sci. 86, 95-107 (1986).
- Pourreau-Schneider, N., et al. Estrogen response of MCF-7 cells grown on diverse substrates and in suspension culture: promotion of morphological heterogeneity, modulation of progestin receptor induction; cell-substrate interactions on collagen gels. J Steroid Biochem. 21, 763-771 (1984).
- Pratt, B. M., Harris, A. S., Morrow, J. S., Madri, J. A. Mechanisms of cytoskeletal regulation. Modulation of aortic endothelial cell spectrin by the extracellular matrix. Am J Pathol. 117, 349-354 (1984).
- Jessup, J. M., et al. Microgravity culture reduces apoptosis and increases the differentiation of a human colorectal carcinoma cell line. In vitro cellular & developmental biology - Animal. 36, 367-373 (2000).
- Sutherland, R. M., et al. Oxygenation and differentiation in multicellular spheroids of human colon carcinoma. Cancer Res. 46, 5320-5329 (1986).
- Unsworth, B. R., Lelkes, P. I. Growing tissues in microgravity. Nat Med. 4, 901-907 (1998).
- Zwezdaryk, K. J., Warner, J. A., Machado, H. L., Morris, C. A., Honerzu Bentrup, K. Rotating cell culture systems for human cell culture: human trophoblast cells as a model. Journal of visualized experiments : JoVE. , (2012).
- Radtke, A. L., Herbst-Kralovetz, M. M. Culturing and Applications of Rotating Wall Vessel Bioreactor Derived 3D Epithelial Cell Models. Journal of visualized experiments : JoVE. , (2012).
- Barrila, J., et al. Organotypic 3D cell culture models: using the rotating wall vessel to study host-pathogen interactions. Nat Rev Microbiol. 8, 791-801 (2010).
- Honer zu Bentrup, K., et al. Three-dimensional organotypic models of human colonic epithelium to study the early stages of enteric salmonellosis. Microbes and infection / Institut Pasteur. 8, 1813-1825 (2006).
- Nickerson, C. A., et al. Three-dimensional tissue assemblies: novel models for the study of Salmonella enterica serovar Typhimurium pathogenesis. Infect Immun. 69, 7106-7120 (2001).
- Alcantara Warren, C., et al. Detection of epithelial-cell injury, and quantification of infection, in the HCT-8 organoid model of cryptosporidiosis. J Infect Dis. 198, 143-149 (2008).
- Carvalho, H. M., Teel, L. D., Goping, G., O'Brien, A. D. A three-dimensional tissue culture model for the study of attach and efface lesion formation by enteropathogenic and enterohaemorrhagic Escherichia coli. Cell Microbiol. 7, 1771-1781 (2005).
- Lin, H. J., O'Shaughnessy, T. J., Kelly, J., Ma, W. Neural stem cell differentiation in a cell-collagen-bioreactor culture system. Brain Res. Dev Brain Res. 153, 163-173 (2004).
- He, L., et al. Increased proliferation and adhesion properties of human dental pulp stem cells in PLGA scaffolds via simulated microgravity. Intl Endo J. , (2015).
- Straub, T. M., et al. In vitro cell culture infectivity assay for human noroviruses. Emerg Infect Dis. 13, 396-403 (2007).
- Herbst-Kralovetz, M. M., et al. Lack of norovirus replication and histo-blood group antigen expression in 3-dimensional intestinal epithelial cells. Emerg Infect Dis. 19, 431-438 (2013).
- Goodwin, T. J., Schroeder, W. F., Wolf, D. A., Moyer, M. P. Rotating-wall vessel coculture of small intestine as a prelude to tissue modeling: aspects of simulated microgravity. Proc Soc Exp Biol Med. 202, 181-192 (1993).
- Goodwin, T. J., Jessup, J. M., Wolf, D. A. Morphologic differentiation of colon carcinoma cell lines HT-29 and HT-29KM in rotating-wall vessels. In Vitro Cell Dev Biol. 28, 47-60 (1992).
- Salerno-Goncalves, R., Fasano, A., Sztein, M. B. Engineering of a multicellular organotypic model of the human intestinal mucosa. Gastroenterology. 141, 18-20 (2011).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. Am J Physiol Renal Physiol. 281, 12-25 (2001).
- Cherry, R. S., Papoutsakis, E. T. Physical mechanisms of cell damage in microcarrier cell culture bioreactors. Biotech and Bioeng. 32, 1001-1014 (1988).
- Bergmann, S., Steinert, M. From Single Cells to Engineered and Explanted Tissues: New Perspectives in Bacterial Infection Biology. Int Rev Cell Mol Biol. 319, 1-44 (2015).
- Xu, B., et al. Simulated microgravity affects ciprofloxacin susceptibility and expression of acrAB-tolC genes in E. coli ATCC25922. Int J Clin Exp Pathol. 8, 7945-7952 (2015).
- Han, C., Jiang, C., Yu, C., Shen, H. Differentiation of transforming growth factor beta1-induced mesenchymal stem cells into nucleus pulposus-like cells under simulated microgravity conditions. Cell Mol Biol (Noisy-le-Grand, France). 61, 50-55 (2015).
- Wang, C., et al. Microgravity activates p38 MAPK-C/EBPbeta pathway to regulate the expression of arginase and inflammatory cytokines in macrophages. Inflamm Res. 64, 303-311 (2015).
- Iliev, I. D., et al. Human intestinal epithelial cells promote the differentiation of tolerogenic dendritic cells. Gut. 58, 1481-1489 (2009).
- Kerneis, S., Bogdanova, A., Kraehenbuhl, J. P., Pringault, E. Conversion by Peyer's patch lymphocytes of human enterocytes into M cells that transport bacteria. Science. 277, 949-952 (1997).
- Sato, T., et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. , (2010).
- Lei, N. Y., et al. Intestinal subepithelial myofibroblasts support the growth of intestinal epithelial stem cells. PLoS One. 9, e84651(2014).
- Voog, J., Jones, D. L. Stem cells and the niche: a dynamic duo. Cell Stem Cell. 6, 103-115 (2010).
- Jabaji, Z., et al. Use of collagen gel as an alternative extracellular matrix for the in vitro and in vivo growth of murine small intestinal epithelium. Tissue Eng Part C Methods. 19, 961-969 (2013).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9, e107814(2014).
- Rodin, S., Antonsson, L., Hovatta, O., Tryggvason, K. Monolayer culturing and cloning of human pluripotent stem cells on laminin-521-based matrices under xeno-free and chemically defined conditions. Nat Protoc. 9, 2354-2368 (2014).
- Foulke-Abel, J., et al. Human enteroids as an ex-vivo model of host-pathogen interactions in the gastrointestinal tract. Exp Biol Med. 239, Maywood, N.J. 1124-1134 (2014).
- Tompkins, W. A., Watrach, A. M., Schmale, J. D., Schultz, R. M., Harris, J. A. Cultural and antigenic properties of newly established cell strains derived from adenocarcinomas of the human colon and rectum. J Natl Cancer Inst. 52, 1101-1110 (1974).
- Hinterleitner, T. A., Saada, J. I., Berschneider, H. M., Powell, D. W., Valentich, J. D. IL-1 stimulates intestinal myofibroblast COX gene expression and augments activation of Cl- secretion in T84 cells. Am J Physiol. 271, 1262-1268 (1996).
- Hoshi, H., McKeehan, W. L. Brain- and liver cell-derived factors are required for growth of human endothelial cells in serum-free culture. Proc Natl Acad Sci U S A. 81, 6413-6417 (1984).
- Salerno-Goncalves, R., Pasetti, M. F., Sztein, M. B. Characterization of CD8(+) Effector T Cell Responses in Volunteers Immunized with Salmonella enterica. Serovar Typhi Strain Ty21a Typhoid Vaccine. J Immunol. 169, 2196-2203 (2002).
- Poggioli, T., Sarathchandra, P., Rosenthal, N., Santini, M. P. Intramyocardial cell delivery: observations in murine hearts. J Vis Exp. , e51064(2014).
- Eastburn, D. J., Mostov, K. E. Laying the foundation for epithelia: insights into polarized basement membrane deposition. EMBO Rep. 11, 329-330 (2010).
- Coecke, S., et al. Guidance on good cell culture practice. a report of the second ECVAM task force on good cell culture practice. Altern Lab Anim. 33, 261-287 (2005).
- Geraghty, R. J., et al. Guidelines for the use of cell lines in biomedical research. Br J Cancer. 111, 1021-1046 (2014).
- Hartung, T., et al. Good Cell Culture Practice. ECVAM Good Cell Culture Practice Task Force Report 1. Altern Lab Anim. 30, 407-414 (2002).
- Blanchet, O., et al. Altered binding of regulatory factors to HLA class I enhancer sequence in human tumor cell lines lacking class I antigen expression. Proc Natl Acad Sci U S A. 89, 3488-3492 (1992).
- Palmisano, G. L., et al. HLA-E surface expression is independent of the availability of HLA class I signal sequence-derived peptides in human tumor cell lines. Hum Immunol. 66, 1-12 (2005).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15, 701-706 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunol. , (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten