Method Article
Immunolocalizzazione della membrana esterna proteine mediante citometria di flusso di mitocondri isolati
In questo articolo
Riepilogo
Qui descritto è un metodo per rilevare e quantificare proteine di membrana mitocondriale esterna da immunomarcatura di mitocondri isolati da tessuto roditore e l'analisi mediante citometria a flusso. Questo metodo può essere esteso a valutare aspetti funzionali di sottopopolazioni mitocondriali.
Abstract
Metodi per rilevare e monitorare mitocondriali componenti proteiche della membrana esterna nei tessuti animali sono di vitale importanza per lo studio della fisiologia mitocondriale e fisiopatologia. Questo protocollo descrive una tecnica in cui i mitocondri isolati da tessuto roditori sono immunolabeled e analizzati mediante citometria a flusso. I mitocondri sono isolate dal midollo spinale di roditori e sottoposti ad una fase di arricchimento rapido in modo da rimuovere mielina, un importante contaminante di frazioni mitocondriali preparate da tessuto nervoso. Mitocondri isolati vengono poi etichettati con un anticorpo di scelta e di un anticorpo secondario coniugato fluorescente. L'analisi per flusso citometria verifica la relativa purezza delle preparazioni mitocondriali da colorazione con un colorante specifico mitocondriale, seguita da rilevamento e la quantificazione di proteine immunolabeled. Questa tecnica è rapido, quantificabile e ad alta velocità, consentendo l'analisi di centinaia di migliaia di mitocondri per campione. È applicabile per valutare romanzo proteins sulla superficie mitocondriale in condizioni fisiologiche normali, così come le proteine che possono diventare mislocalized a questo organello durante patologia. È importante sottolineare che questo metodo può essere accoppiato a coloranti indicatori fluorescenti a riferire su determinate attività di sottopopolazioni mitocondriali ed è fattibile per i mitocondri del sistema nervoso centrale (cervello e midollo spinale), così come il fegato.
Introduzione
I mitocondri sono organelli altamente dinamiche che subiscono vari cicli di fissione e fusione, sono trasportati ai siti di domanda di alta energia e di rispondere rapidamente agli stimoli fisiologici 1. Poiché è sempre più riconosciuto che i mitocondri all'interno di diversi tessuti, anche diversi compartimenti cellulari, hanno profili funzionali distinti, nuovi metodi sono necessari per identificare questi sottoinsiemi mitocondriali distinti.
Microscopia fornisce un mezzo attraverso il quale i singoli mitocondri possono essere visualizzati e la presenza di una proteina in o nei mitocondri può essere determinato mediante immunofluorescenza 2. Tuttavia, l'analisi quantitativa con questo metodo è laborioso ed è più adatto per gli esperimenti che utilizzano linee cellulari immortalizzate o primari. Lo studio dei mitocondri individuale derivate da tessuti è molto più difficile e la maggior parte dei metodi non consentono una facile identificazione di sottoinsiemi mitocondriali in concomitanza con la valuzione della funzione mitocondriale 3.
Per far fronte a questo ostacolo, un nuovo metodo per immunolabel mitocondri isolati da tessuti di roditori e successivamente analizzati mediante citometria a flusso è stato sviluppato. Questo permette la rapida individuazione e la quantificazione delle proteine localizzate alla membrana esterna mitocondriale, che rispetto all'analisi al microscopio, è molto meno laborioso e permette l'analisi di migliaia di mitocondri in un singolo campione. Questo test può essere applicato per controllare il destino e la quantità relativa di proteine di membrana esterna mitocondriale che si pensa siano costitutivamente presente alla mitocondri, l'assunzione di proteine alla superficie mitocondriale, o la rilevazione di proteine mislocalized ai mitocondri in condizioni patologiche. Inoltre, l'incorporazione di coloranti convenzionali indicatori fluorescenti consente la valutazione simultanea di alcuni aspetti della funzione mitocondriale in mitocondriale distintosottopopolazioni.
Protocollo
Animali utilizzati in questo studio sono stati trattati in stretta conformità ad un protocollo (N08001CVsr) approvato dal du Centre Hospitalier de l'Université de Montréal (CRCHUM) Comitato istituzionale Centre de Recherche per la protezione degli animali che segue gli standard nazionali, come delineato dalla Canadian Consiglio su Animal Care (CCAC).
Preparare tutti i reagenti necessari per eseguire questo protocollo (Tabella 1). Tutti gli altri dettagli riguardanti attrezzature, forniture e fornitori possono essere trovati nella lista dei materiali.
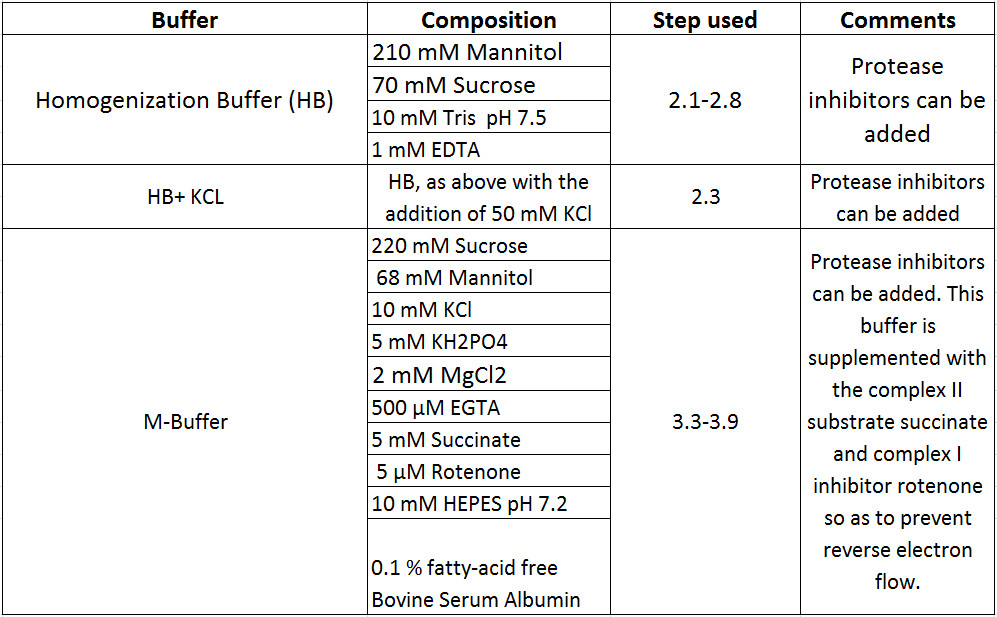
Tabella 1 Buffer Composizioni.
1 Raccolta di Rat Spinal Cord
- Profondamente anestetizzare il ratto (Sprague Dawley) con il 4% isoflorane. Verificare l'anestesia da una mancanza di riflesso su di schiacciamento di the zampa anteriore. Euthanize il ratto per decapitazione mediante ghigliottina. Questo metodo di eutanasia è preferito rispetto ad altri, che potrebbero distorcere il midollo spinale.
- Tagliare la pelle della schiena per esporre la colonna vertebrale. Tagliare la colonna vertebrale con le forbici osso appena sopra l'osso pelvico. Visualizzare l'apertura della colonna vertebrale.
- Inserire una siringa da 10 ml, con una pipetta punta di 200 microlitri (collegato tramite la fusione poco più di fiamma), riempita con tampone fosfato (PBS), nella colonna vertebrale.
- Lavare il midollo spinale, applicando una quantità media di pressione allo stantuffo.
- Se è presente del sangue sul midollo spinale, risciacquare con PBS prima di procedere alla fase successiva.
NOTA: Questo metodo è stato validato anche per il cervello e il fegato. Se tra cui questi tessuti, raccogliere la metà del cervello dal ratto eutanasia e un pezzo di fegato pari in peso al midollo spinale. Tutti gli altri passaggi rimangono identici.
2 Isolamento del midollo spinale Mitochondria (Adattato da Vande Velde et al. 4)
- Raccogliere tutto il midollo spinale intatta e posto in 5 ml omogeneizzatore vetro con 5 volumi (~ 3,25 ml) Omogeneizzazione Buffer (HB). Per il recupero ottimale dei mitocondri isolati, eseguire tutti i passaggi su ghiaccio o in camera fredda. Omogeneizzare i tessuti a mano fino a quando rimangono senza grandi pezzi di tessuto, circa otto colpi. Mettere omogenato in due (2 ml) o tre (1,7 ml) microprovette. Centrifuga 1.300 xg per 10 min a 4 ° C in una microcentrifuga da banco.
- Recuperare il surnatante e posto in un tubo ultracentrifuga 5 ml. Aggiungere 750 ml (~ 0,5 volumi) HB alla provetta-pellet contenente e risospendere delicatamente il pellet. Ripetere la centrifugazione e risospensione passi altre due volte. Pool tutti i surnatanti (S1a e S1b) nella stessa 5 ml tubo ultracentrifuge sopra. Questo passaggio serve per eliminare piccoli detriti.
- Centrifugare riunito S1 utilizzando un'ultracentrifuga dotato di marciume oscillante secchioo e centrifugare a 17.000 xg per 15 min a 4 ° C.
- Tenere surnatante (S2) per l'ulteriore elaborazione se la frazione citosolica è di interesse (ad esempio per le analisi Western blot). Risospendere il pellet (P2), la frazione mitocondriale grezzo, in 4 ml HB + KCl 50 mM. Centrifugare 17.000 xg per 15 min a 4 ° C in un rotore oscillante. Eliminare il supernatante e risospendere delicatamente il pellet (P3) in 800 ml HB.
NOTA: I mitocondri vengono lavati con HB + 50 mM KCl per rimuovere eventuali contaminanti mitocondrialmente associati non specifici. - In un nuovo 5 ml tubo Ultracentrifuge, aggiungere esattamente 800 ml di sedimento risospeso (P3).
- Per aggiungere questo tubo, 200 ml di Iodixanolo (media gradiente di densità), creando così una concentrazione finale del 12% Iodixanolo. Miscelare il contenuto della provetta delicatamente, ma accuratamente mediante pipettaggio con un P1000. Aggiunta di Iodixanolo prima, e poi pellet risospeso (P3) può essere preferibile per facilitare un'accurata miscelazione. Centrifugare in un ultracentrifuge dotato di un rotore benna oscillante a 17.000 xg per 15 min a 4 ° C.
- NOTA: Fegato non contiene mielina e, pertanto, questo passaggio non è necessario se solo il fegato è in fase di elaborazione. Tuttavia, se il fegato sta per essere eseguita in concomitanza con mitocondri del SNC, si raccomanda di trattare tutti i tessuti allo stesso modo.
- Aspirare lo strato di mielina nella parte superiore del tubo e con attenzione rimuovere e scartare il surnatante. Pellet potrebbe essere allentato. Risospendere il pellet in 4 ml di HB. Centrifugare nuovamente a 17.000 xg per 10 min a 4 ° C. Eliminare il supernatante e risospendere il pellet in 4 ml di HB. Ripetere la centrifugazione e rimuovere il surnatante.
- Risospendere il pellet finale (P7) in 100-200 ml HB e trasferire in una provetta da 1,7 ml microcentrifuga. Questo campione contiene mitocondri isolati.
- Procedere alla proteina quantificazione. Diluire i campioni e la curva standard nel 2% sodio dodecil solfato (SDS) per assicurare un'adeguata solubilizzazione dei mitocondri During proteina quantificazione.
3. immunomarcatura di mitocondri isolati per Citometria a flusso
- Per ogni mix colorazione da testare, pipetta 25 mg di mitocondri isolati in una provetta da 1,7 ml microcentrifuga. Includere un campione senza macchia in ogni esperimento; e per ogni anticorpo, essere sicuri di includere un campione per il controllo isotipico appropriato.
- Centrifugare a 17.000 xg per 2 min a 4 ° C in una microcentrifuga da banco.
- Rimuovere il surnatante e risospendere mitocondri isolati in 50 microlitri mitocondri Buffer (Buffer M) supplementato con 10% di BSA libera acidi grassi per 15 min a 4 ° C (blocco passo).
NOTA: Durante l'etichettatura, effettuare incubazioni in frigorifero a 4 ° C. - Aggiungere l'anticorpo primario (coniglio anti-MFN2, 20 mg per ml) per tubo e incubare per 30 minuti a 4 ° C.
NOTA: Determinare la concentrazione ottimale di ciascun anticorpo empiricamente mediante titolazione. A causa della variabilità della concentrazione e / o purezza, diversi lotti dello stesso anticorpo dello stesso produttore possono portare a risultati diversi; pertanto è necessaria titolazione per ciascun nuovo lotto di anticorpi. - Lavare anticorpo primario non legato: Centrifugare a 17.000 xg per 2 min a 4 ° C. Rimuovere il surnatante e risospendere delicatamente il pellet in 200 ml M Buffer. Centrifugare a 17.000 xg per 2 min a 4 ° C. Rimuovere il surnatante e risospendere il pellet in 50 microlitri M tampone.
- Aggiungere l'anticorpo secondario (Donkey anti-coniglio IgG ficoeritrina (PE), 0,5 mg per ml) di tubo e incubare i campioni per 30 minuti a 4 ° C, al riparo dalla luce.
- Lavare anticorpo secondario non legato: Centrifugare a 17.000 xg per 2 min a 4 ° C. Rimuovere il surnatante e risospendere il pellet in 200 ml M Buffer. Centrifugare a 17.000 xg per 2 min a 4 ° C. Rimuovere il surnatante e risospendere il pellet in 500 microlitri M tampone.
- Per assicurare gli eventi sono in realtà mitocondri, macchia isolato mitocondri concolorante mitocondri specifico fluorescente per 15 minuti a temperatura ambiente, al riparo dalla luce. Se si desidera la colorazione di altri parametri funzionali (potenziale transmembrana mitocondriale o di produzione superossido), passare al punto 4 In caso contrario, passare al punto 5 per l'acquisizione.
NOTA: È importante verificare che lo spettro di emissione della anticorpo secondario è compatibile con quella dei coloranti funzionali. Ad esempio, se la verifica purezza mitocondriale con un colorante commerciale con proprietà spettrali simili a potenziale transmembrana con FITC e tetramethylrhodamine estere metilico (TMRM), un anticorpo secondario praticabile sarebbe allophycocyanin (APC: Ex 650 nm / em 660 nm). Aggiungere controlli compensazioni, cioè, un campione immunolabeled o tinto con un unico fluoroforo, quando applicabile. - Trasferire in un tubo adatto per il flusso di carico citometro. (Per facilitare la piccola dimensione del campione, un tubo di microtitolazione è collocato all'interno 3 ml citofluorimetro tubo.) Conservare i campioni in ghiaccio e procedere immediatamente allacitofluorimetro per l'acquisizione.
4 Saggio mitocondriale potenziale transmembrana mitocondriale superossido e Produzione per Citometria a flusso
- Verificare che i mitocondri isolati hanno un potenziale transmembrana intatto dalla colorazione con 100 nM TMRM (Ex 548 nm / 574 nm Em) 5, al punto 3.8, per 15 minuti a temperatura ambiente, al riparo dalla luce. Per il confronto del potenziale transmembrana tra i campioni e popolazioni, l'uso di concentrazioni inferiori / non-tempra di TMRM (da 1 a 30 Nm), può essere più appropriato 6.
- Come controllo per TMRM colorazione, macchia mitocondri isolati con 100 nM TMRM in presenza di 100 mM carbonilico cianuro m-cloro fenil idrazina (CCCP), un disaccoppiatore mitocondriale che depolarizzare mitocondri. La concentrazione di CCCP necessaria per depolarizzare i mitocondri può essere inferiore se si utilizzano più basse concentrazioni di colorante.
- Verificare che i mitocondri isolati producono superossido mitocondriale da staining con un appropriato indicatore superossido mitocondriale 7, anche al punto 3.8, per 15 minuti a temperatura ambiente, al riparo dalla luce.
- Come controllo per la produzione di superossido mitocondriale, macchia mitocondri isolati con colorante in presenza di 10 mM Antimicina A, un inibitore del complesso III della catena respiratoria che aumenterà la produzione di superossido mitocondriale.
5. acquisizione e analisi dei immunolabeled mitocondri isolati da Citometria a flusso
- Strumento costituito: tensioni Passare dalla lineare alla modalità log per facilitare l'analisi dei mitocondri isolati e tensioni previste (FSC: 450; SSC: 250). Assicurarsi che gli eventi sono raccolti in FSC modo A (area) così come FSC-W (larghezza) e FSC-H (altezza), per poter escludere doppietti (cioè due eventi, passano attraverso il rivelatore allo stesso tempo ) nella raccolta di post-analisi dei dati. Impostare il numero di eventi da raccogliere a 100.000. Acquisire i controlli di compensazione, Se applicabile.
- Acquisizione dati: Prima di acquisizione dei dati, evitare vortex campioni. Invece Mescolare agitando leggermente il tubo. Inizialmente la raccolta di eventi a bassa pressione, durante gating. Gate popolazione totale. Regolare le tensioni di istogrammi di conseguenza, di solito il picco del campione non colorato corrisponderà al secondo decennio (10 2). Una volta che cancelli sono stabiliti, ei campioni vengono elaborati, la pressione può essere commutata in alto.
- Analisi: Visualizza doppietti tracciando FSC-W contro FSC. Identificare canottiere e doppiette. Gate canottiere. Selezionare la popolazione mitocondriale da gating su eventi che sono macchiati positivamente con un colorante mitocondriale selettivo.
- Determinare l'etichettatura sfondo da controllo isotipico. Utilizzando il campione di controllo isotipico, determinare la percentuale della popolazione di etichettatura mitocondriale positivo per gli anticorpi MFN2.
Risultati
I mitocondri derivate da midollo spinale di ratto possono essere immunolabeled con un anticorpo mirato al Mitofusin2 (MFN2), una proteina coinvolta nella fusione della membrana esterna dei mitocondri 8. Dopo aver isolato e marcatura con un anticorpo specifico MFN2 e un anticorpo secondario coniugato fluorescente, mitocondri vengono elaborati mediante citometria di flusso (Figura 1). Dopo l'acquisizione dei dati, i campioni vengono analizzati mediante citometria a flusso software di analisi, da prima visualizzando tutti gli eventi raccolti in un diagramma a punti (Figura 2A). Doppietti e canottiere sono differenziati quando gli eventi sono tracciati in FSC, larghezza (W) rispetto a zona (A) (Figura 2B). Una volta canottiere sono selezionati, porta la popolazione mitocondriale tramite FSC / SSC (Figura 2C), e verificare il numero di eventi colorazione positiva per i coloranti specifici per i mitocondri da co-tracciando un istogramma del campione senza macchia con un campione colorato con i mitocondri spe-cifica colorante. Per determinare gli eventi mitocondriali, mettere un cancello nel punto di intersezione dei due picchi (Figura 2D). Per i preparati midollo spinale, tipicamente> 90% degli eventi sono positivi per il colorante specifico-mitocondri. Per altri tessuti come il fegato, ~ 98% degli eventi si etichetta con il colorante (dati non riportati). Dopo aver selezionato solo gli eventi che etichettano positivamente per il colorante specifico per i mitocondri, determinare l'etichettatura di fondo con il controllo isotipico selezionando un cancello (MFN2 +) che comprende 1% o meno di etichettatura isotipo (Figura 2E, a sinistra). Applicare questa porta uniformemente a tutti i campioni marcati con anticorpi MFN2 per determinare la percentuale di mitocondri con MFN2 presenti sulla membrana mitocondriale esterna (Figura 2E, destra). In questo esperimento, il 30% dei mitocondri derivato da etichetta del midollo spinale positivo per MFN2. E 'importante notare qui, che sebbene MFN2 è considerato un mit ubiquitariamente espressaochondrial proteina della membrana esterna, non è stato preventivamente quantificati. Inoltre, l'analisi immunocitochimica di MFN2 in cellule in coltura mostra una etichettatura non omogenea dei mitocondri individuale 9. E 'anche possibile che l'epitopo MFN2 era disponibile a causa di inviare traduzionali o causa di interazioni con se stesso o altri partner vincolanti. Da notare che l'anticorpo in questo studio è stato generato utilizzando un peptide sintetico al N-terminale (aminoacidi 38-55). C'è una variante di splicing previsto di MFN2 mancano i primi 302 aminoacidi, anche se questa variante deve ancora essere confermata sperimentalmente (database UniProt). Pertanto, questo test è in grado di rilevare MFN2 splicing alternativo privo della sequenza N-terminale, dato l'anticorpo utilizzato.
Potenziale mitocondriale transmembrana (ΔΨ m) e la produzione di superossido possono essere valutate in questo saggio. Attraverso la membrana mitocondriale interna, vi è una separazione di carica which spinge la produzione di ATP attraverso la fosforilazione ossidativa. TMRM è un colorante cationico che si accumula all'interno dei mitocondri in un modo dipendente potenziale di membrana 5, e quindi può essere utilizzato come reporter di potenziale transmembrana mitocondriale. La maggioranza dei mitocondri (95%) sono TMRM positive dopo colorazione, rispetto al controllo non colorato (Figura 3A). Tuttavia, quando viene aggiunto il CCCP disaccoppiatore vi è una significativa riduzione del numero di mitocondri in grado di trattenere TMRM (Figura 3A). CCCP permette il libero passaggio di ioni attraverso la membrana mitocondriale interna, essenzialmente distruggendo la separazione di carica e depolarizzante la membrana.
I mitocondri superossido rilascio come un normale sottoprodotto della fosforilazione ossidativa da I e III della catena di trasporto degli elettroni complessa. Superossido mitocondriale può essere misurata tramite una membrana permeabile colorante che si rivolge ai mitocondri e diventa follo fluorescenteala una reazione con superossido 7. Mitocondri funzionali producono una quantità basale di superossido rispetto ai campioni non colorati (Figura 3B). L'aggiunta dell'inibitore complesso III Antimicina A produce un aumento di superossido, come visto da uno spostamento verso destra in fioritura e un maggior numero di mitocondri (tipicamente ~ 10%) che sono fluorescenti con questa mitocondriale superossido colorante indicatore (Figura 3B).

Figura 1 Schema di isolamento, immunomarcatura e l'analisi dei mitocondri. Fase 1: Raccogliere il tessuto e omogeneizzare Passo 2:. La procedura di isolamento contiene otto fasi di centrifugazione. Mielina, un importante contenimento del tessuto del sistema nervoso centrale viene rimosso diluendo mitocondri in Iodixanolo (media gradiente di densità) e Centrifuging, causando la mielina galleggiante all'inizio del tubo, mentre i mitocondri sono pellettati. Fase 3: Dopo isolamento e quantificazione, mitocondri sono bloccati, marcato con l'anticorpo primario e lavato. Viene poi aggiunto un anticorpo secondario coniugato ad un fluoroforo. Anticorpo legato viene lavato via Passo 4:. A questo punto coloranti fluorescenti che riportano sulla purezza mitocondriale, o la funzione mitocondriale può essere aggiunto Passo 5:. Mitocondri sono ora pronti per essere analizzati mediante citometria di flusso.

Figura 2 Strategia per l'analisi dei mitocondri isolati mediante citometria a flusso. Le Forward Scatter (FSC) e Side Scatter (SSC) Tensioni deve essere regolato per piccoli eventi, utilizzando entrambi i parametri in modalità logaritmica. Larghezza FSC (FSC-W) di dati deve essereraccolti da escludere doppietti. Nota, sulla maggior parte citofluorimetri, l'impostazione predefinita per FSC e SSC è la modalità lineare. (A) I dettagli di tutti gli eventi raccolti in un diagramma a punti. (B) Farsetti, due mitocondri passando dal laser, allo stesso tempo, può essere distinto da canottiere di tramando contro FSC FSC-W (modalità lineare). Gli eventi sono esclusi se il valore FSC-W è più del doppio del valore FSC-W media della maggior parte degli eventi, cioè, quelli che fanno parte della nube densa. Eventi in questa soglia sono gated come singoletti. (C) Anche in questo caso, visualizzare gli eventi in un diagramma a punti, e porta sugli eventi rimanenti. (D) Tracciare un istogramma del campione senza macchia (solido, grigio, pieno), campione e colorate con un colorante mitocondriale specifico (MSD: solido, verde). Porta gli eventi colorazione positiva per la MSD (MSD +). (E) Istogramma del controllo isotipico, IgG di coniglio (deluse, nero) e MFN2 campione etichettato (solido, rosa).Impostare la porta in modo da produrre ≤ 1% MFN2 + sulla vetta controllo isotipico e applicare questo stesso cancello campione sperimentale per determinare la percentuale di eventi etichettatura positiva per MFN2 (MFN2 +). Cliccate qui per vedere una versione più grande di questo figura.
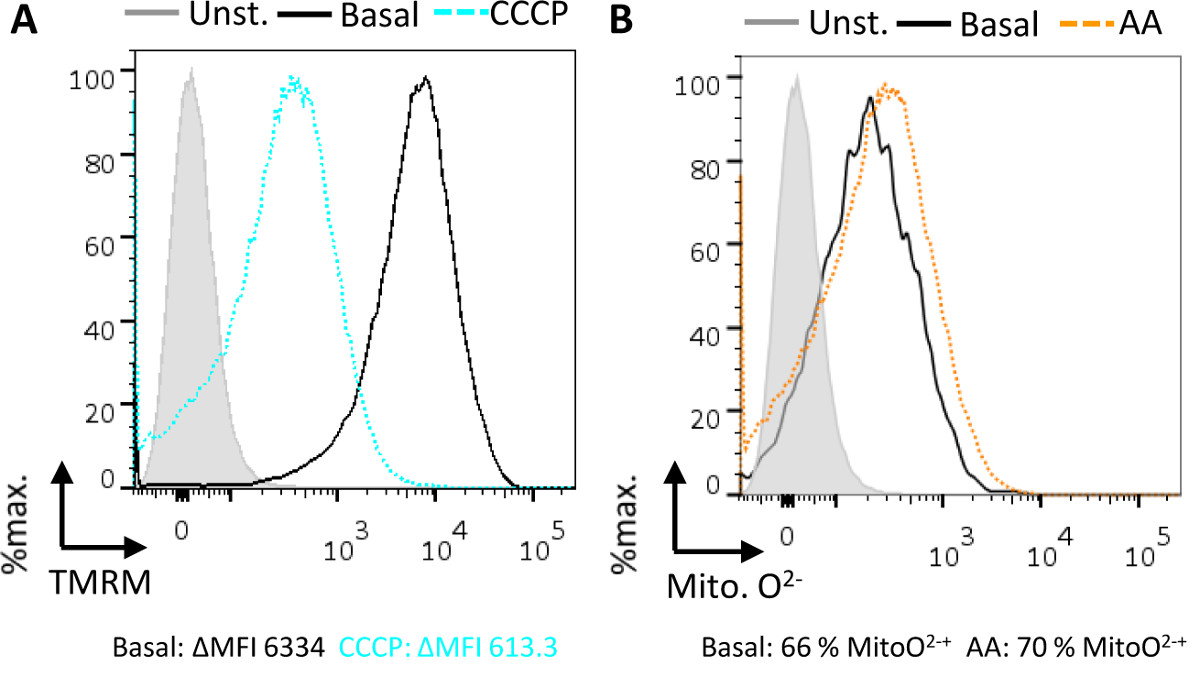
Figura 3 Saggio transmembrana mitocondriale potenziale (ΔΨ m) e superossido produzione in mitocondri isolati mediante citometria di flusso. (A) In condizioni basali tutti i mitocondri attivi si etichetta con TMRM (solido, nero), rispetto al controllo senza macchia (solido, grigio, pieno), in quanto il colorante si accumula nei mitocondri con un potenziale transmembrana. Addi zione del CCCP protonophore (tratteggiata, blu) dissipa il potenziale transmembrana causando i mitocondri di depolarizzazione e mantenere dye meno rispetto alle condizioni basali. I dati viene segnalato come il delta media intensità di fluorescenza (ΔMFI), che è l'intensità di fluorescenza media del controllo senza macchia sottratto dalla intensità della fluorescenza media del campione. (B) In condizioni basali, i mitocondri producono superossido come un sottoprodotto di ossidativa fosforilazione. Questa fonte mitocondriale di superossido può essere dosati con un indicatore mitocondriale superossido, (MitoO 2: solido, nero) rispetto al controllo senza macchia (solido, grigio, riempito). L'aggiunta dell'inibitore complesso III, Antimicina A (tratteggiate, arancione) si traduce in un aumento della produzione di superossido, rispetto ai livelli basali. I dati viene riportato come percentuale di cellule colorazione positiva per l'indicatore MitoO 2.k "> Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
E 'sempre più evidente che i mitocondri sono i principali attori sia normale fisiologia e patologia. Mentre immunoblotting può determinare quali proteine si trovano all'interno dei mitocondri né sulla superficie mitocondriale in una certa condizione, questo metodo relazioni sulla media dell'intera popolazione. Questo metodo non può fornire informazioni sulle abbondanze relative delle sottopopolazioni mitocondriali o sottoinsiemi. Mentre è stato precedentemente ipotizzato che tutti i mitocondri sono creati uguali, il campo sta riconoscendo sempre più che i mitocondri all'interno di una cella di avere una vasta variabilità in termini di morfologia e / o la funzione 10.
Approcci di microscopia a fluorescenza prendono in considerazione l'eterogeneità dei mitocondri. Tuttavia, la quantificazione di questo tipo di dati è laborioso. Inoltre, questo approccio è più adatto a studi utilizzando cellule in coltura, come l'etichettatura dei mitocondri in vivo / in situ è difficile a causa delle excessive numero di mitocondri presenti, rendendo la differenziazione dei singoli organelli intrinsecamente difficile. Nella maggior parte dei protocolli immunocitochimica, non è anche possibile etichettare contemporaneamente proteine di membrana mitocondriale esterna e valutare la funzione mitocondriale a causa della fase di permeabilizzazione cellulare necessaria per l'etichettatura degli anticorpi. L'attuale metodo funziona con mitocondri isolati, e quindi non richiede una fase di permeabilizzazione. Inoltre, la visualizzazione dei singoli mitocondri è possibile solo tramite microscopia elettronica, che non è suscettibile di analisi della funzione mitocondriale. Detto questo, ci rendiamo conto che l'isolamento dei mitocondri dal tessuto porta alla rottura della rete mitocondriale e questo potrebbe influenzare alcuni elementi della funzione mitocondriale. Tuttavia, il confronto di aspetti funzionali di mitocondri isolati dai tessuti che vengono elaborati in modo simile restano valide.
Questo metodo di immunomarcatura di isolat tessuti di derivazioneEd mitocondri e successiva analisi da citometria di flusso permette un metodo rapido e quantificabile per rilevare e monitorare la presenza di una proteina localizzata sulla membrana esterna. Rilevamento di un altamente abbondante proteina mitocondriale (come MFN2) è possibile con questa tecnica. Allo stesso modo, questo metodo può rilevare le proteine a bassa abbondanza che si depositano solo sulla membrana mitocondriale nella malattia, come SOD1 misfolded nel contesto della Sclerosi Laterale Amiotrofica (SLA) 11. Inoltre, questo metodo può essere utile per monitorare le proteine che transitoriamente associano con la superficie mitocondriale come parte della loro normale funzione. Gli esempi includono-Dynamin correlati proteina-1 (DRP1), una proteina citoplasmatica che viene reclutato per i mitocondri per promuovere fissione mitocondriale 12 e il fattore di necrosi tumorale recettore del fattore-associata 6 (TRAF6), che trasloca mitocondri per aumentare mitocondriale di specie reattive dell'ossigeno come una parte di una risposta immunitaria innata 13.
Attualmente questa tecnica è suscettibile soltanto proteine localizzate sulla superficie mitocondriale, come protocolli di permeabilizzazione standard per l'etichettatura intracellulare richiedono un detergente che interrompe l'integrità strutturale dei mitocondri. Mentre un certo numero di possibili reagenti sono stati provati (inedito), un'ulteriore ottimizzazione del protocollo immunomarcatura è ancora necessaria per rendere questo protocollo suscettibili di rilevare componenti intra-mitocondriali.
Questa tecnica ha ampie applicazioni e può essere usato per rilevare la presenza o l'assunzione di una o più proteine ai mitocondri sotto diversi paradigmi sperimentali. Inoltre, i mitocondri possono essere co-etichettati con due anticorpi diversi, nonché con indicatori fluorescenti 11. Altre sonde fluorescenti potrebbero anche essere incorporati per caratterizzare ulteriori aspetti della funzione mitocondriale. Ad esempio, i coloranti disponibili in commercio per monitorare mitocondriale pH 14 , l'assorbimento di calcio con calcio verde-5N 15, e 16 livelli di ATP sono possibili.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Laurie Destroismaisons e Sarah Peyrard per un supporto tecnico e Dr.Alexandre Prat per l'accesso al citofluorimetro. Vorremmo inoltre ringraziare il dottor Timothy Miller per il suo contributo per quanto riguarda la rimozione della mielina dai preparativi. Questo lavoro è stato supportato dal Canadian Institutes of Health Research (CIHR) Neuromuscular Research Partnership, Canadian Foundation for Innovation, ALS Society of Canada, la Fondazione Frick per la SLA Research, CHUM Fondazione e Fonds de la Recherche en Santé du Québec (CVV). Sia CVV e NA sono studiosi di ricerca del Fonds de la Recherche en Santé du Québec e CIHR nuovi ricercatori. SP è sostenuto dalla Tim Noël Studentship dalla ALS Society of Canada.
Materiali
| Name | Company | Catalog Number | Comments |
| Rats | Charles River | Strain code 400 | Adult (9 weeks to 18 weeks) male or female rats can be used for the isolation protocol. Weight of rats is dependent on gender and age (males between 300 to 500 g and females between 200 to 350 g) are typically used. |
| Dounce homogenizer | Kontes Glass Co. | 885450-0022 | Duall 22 |
| Microcentrifuge | Thermo Scientific | Sorvall Legend Micro 17 R | |
| Ultra-Clear Ultracentrifuge tubes | Beckman Coulter | 344057 | Transparent, thin walled |
| Sorvall Ultracentrifuge | Thermo Scientific | Sorvall WX UltraSeries | |
| AH-650 rotor and buckets | Thermo Scientific | ||
| Opti-prep | Axis-Shield | 1114542 | Iodixanol, density gradient medium |
| Fatty acid free Bovine Serum Albumin | Sigma | A8806 | Must be fatty acid free for mitochondria |
| Sodium succinate dibasic hexahydrate | Sigma | S9637 | |
| Rabbit anti-Mitofusin2 antibody | Sigma | M6319 | |
| Rabbit IgG | Jackson Immuno Research | 011-000-003 | |
| Anti-Rabbit IgG PE | eBioscience | 12-4739-81 | |
| Micro titer tube | Bio-Rad | 223-9391 | For sample acquisition by flow cytometry |
| MitoTrackerGreen (MTG) | Invitrogen | M7514 | 100 nM: Ex 490 nm/Em 516 nm |
| TMRM | Invitrogen | T668 | 100 nM: Ex 548 nm/Em 574 nm |
| CCCP | Sigma | C2759 | |
| MitoSOX Red | Invitrogen | M36008 | 5 µM: Ex 540 nm/Em 600 nm |
| Antimycin A | Sigma | A8874 | |
| LSR II flow cytometer | BD | ||
| BD FACSDiva Software | BD | ||
| FlowJo | TreeStar Inc. | Software used for analysis | |
| BCA protein assay kit | Pierce/Thermo Scientific | 23225 | Bradford assay is not recomended as it is not compatible with high concentrations of SDS |
Riferimenti
- Itoh, K., Nakamura, K., Iijima, M., Sesaki, H. Mitochondrial dynamics in neurodegeneration. Trends Cell Biol. 23, 64-71 (2013).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. J Cell Biol. 183, 795-803 (2008).
- Zorov, D. B., Kobrinsky, E., Juhaszova, M., Sollott, S. J. Examining intracellular organelle function using fluorescent probes: from animalcules to quantum dots. Circ Res. 95, 239-252 (2004).
- Vande Velde, C., Miller, T., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proc Natl Acad Sci U S A. 105, 4022-4027 (2008).
- Loew, L. M., Tuft, R. A., Carrington, W., Fay, F. S. Imaging in five dimensions: time-dependent membrane potentials in individual mitochondria. Biophys J. 65, 2396-2407 (1993).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50, 98-115 (2011).
- Xu, X., Arriaga, E. A. Qualitative determination of superoxide release at both sides of the mitochondrial inner membrane by capillary electrophoretic analysis of the oxidation products of triphenylphosphonium hydroethidine. Free Radic Biol Med. 46, 905-913 (2009).
- Otera, H., Ishihara, N., Mihara, K. New insights into the function and regulation of mitochondrial fission. Biochim Biophys Acta. 1833, 1256-1268 (2013).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Wikstrom, J. D., Twig, G., Shirihai, O. S. What can mitochondrial heterogeneity tell us about mitochondrial dynamics and autophagy. Int J Biochem Cell Biol. 41, 1914-1927 (2009).
- Pickles, S., Destroismaisons, L., Peyrard, S. L., Cadot, S., Rouleau, G. A., Brown, R. H. Jr, Julien, J. P., Arbour, N., Vande Velde, C. Mitochondrial damage revealed by immunoselection for ALS-linked misfolded SOD1. Hum Mol Genet. 22, 3947-3959 (2013).
- Frank, S., Gaume, B., Bergmann-Leitner, E. S., Leitner, W. W., Robert, E. G., Catez, F., Smith, C. L., Youle, R. J. The role of dynamin-related protein 1, a mediator of mitochondrial fission, in apoptosis. Dev Cell. 1, 515-525 (2001).
- West, A. P., Brodsky, I. E., Rahner, C., Woo, D. K., Erdjument-Bromage, H., Tempst, P., Walsh, M. C., Choi, Y., Shadel, G. S., Ghosh, S. TLR signalling augments macrophage bactericidal activity through mitochondrial ROS. Nature. 472, 476-480 (2011).
- Abad, M. F., Di Benedetto, G., Magalhães, P. J., Filippin, L., Pozzan, T. Mitochondrial pH monitored by a new engineered green fluorescent protein mutant. J Biol Chem. 279, 11521-11529 (2004).
- Murphy, A. N., Bredesen, D., Cortopassi, G., Wang, E., Fiskum, G. Bcl-2 potentiates the maximal calcium uptake capacity of neural cell mitochondria. Proc Natl Acad Sci U S A. 93, 9893-9898 (1996).
- Tantama, M., Martinez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4, 2550(2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon