Method Article
Immunodetection של החלבונים בממברנה חיצוניים על ידי cytometry הזרימה של מיטוכונדריה מבודדת
In This Article
Summary
שתואר כאן הוא שיטה לאיתור וללכמת חלבוני קרום חיצוני של המיטוכונדריה ידי immunolabeling של מיטוכונדריה מבודדת מרקמת מכרסמים וניתוח על ידי cytometry זרימה. שיטה זו ניתנת להארכה על מנת להעריך היבטים פונקציונליים של אוכלוסיות המיטוכונדריה.
Abstract
שיטות לאיתור ולמעקב אחר רכיבי חלבון קרום חיצוניים של המיטוכונדריה ברקמות של בעלי חיים הן חיוניות כדי ללמוד פיזיולוגיה ופתופיזיולוגיה של המיטוכונדריה. פרוטוקול זה מתאר טכניקה שבה מיטוכונדריה מבודדת מרקמת מכרסם הם immunolabeled ונותחה על ידי cytometry זרימה. המיטוכונדריה הוא מבודד מחוט השדרה של מכרסמים ונתונים לצעד העשרה מהיר כדי להסיר מיאלין, חומר מזהם ביותר של שברים במיטוכונדריה הוכנו מרקמת עצבים. אז מיטוכונדריה המבודדת מסומנות עם נוגדן של בחירה ונוגדנים משני מצומדות fluorescently. ניתוח על ידי cytometry זרימה מאמת את טוהר היחסי של הכנות המיטוכונדריה על ידי צביעה עם צבע ספציפי של המיטוכונדריה, ואחריו איתור וכימות של חלבון immunolabeled. טכניקה זו היא מהירה, לכימות ותפוקה גבוהה, המאפשר לניתוח של מאות אלפי מיטוכונדריה לדגימה. זה ישים להערכת p רומןroteins על פני השטח של המיטוכונדריה בתנאים פיסיולוגיים נורמלים, כמו גם חלבונים שעשויות להפוך mislocalized לאברון זה בפתולוגיה. חשוב לציין, בשיטה זו ניתן מצמידים את צבעי מחוון ניאון כדי לדווח על פעילויות מסוימות של אוכלוסיות המיטוכונדריה ואינה ריאלי למיטוכונדריה ממערכת העצבים המרכזית (מוח וחוט השדרה), כמו גם בכבד.
Introduction
המיטוכונדריה הם אברונים מאוד דינמיים שעוברים סבבים רבים של ביקוע והיתוך, מועברים לאתרים של ביקוש לאנרגיה גבוהה ולהגיב במהירות לגירויים פיסיולוגיים 1. מאז הוא מוכר מיטוכונדריה שיותר ויותר בתוך רקמות שונות, תאים סלולריים שונים אפילו, יש לי פרופילים תפקודיים שונים, יש צורך בשיטות חדשות לזיהוי תת המיטוכונדריה השונה אלה.
מיקרוסקופית מספקת אמצעי לפיו ניתן דמיין המיטוכונדריה פרט ואת הנוכחות של חלבון באו במיטוכונדריה יכול להיקבע על ידי immunofluorescence 2. עם זאת, ניתוח כמותי בשיטה זו הוא עבודה אינטנסיבית ומתאים יותר לניסויים באמצעות שורות תאים הונצחו או עיקריות. המחקר של המיטוכונדריה פרט נגזרת מרקמות הוא באופן משמעותי יותר קשה ורוב השיטות אינן מאפשרות זיהוי קל של תת המיטוכונדריה במקביל לevaluני של פונקציה של המיטוכונדריה 3.
כדי להתמודד עם המשוכה הזאת, שיטה חדשנית לimmunolabel מיטוכונדריה מבודדת מרקמות מכרסמים ולאחר מכן נותחה על ידי cytometry זרימה פותח. זה מאפשר לאיתור והכימות של חלבונים מקומיים לקרום החיצוני של המיטוכונדריה, אשר בהשוואה לניתוח על ידי מיקרוסקופ המהיר, היא הרבה פחות עבודה אינטנסיבית ומאפשרת הניתוח של אלפי מיטוכונדריה במדגם יחיד. assay זה יכול להיות מיושם כדי לפקח על הגורל וכמות היחסית של חלבוני קרום החיצוניים של המיטוכונדריה שנחשבים לconstitutively נוכח במיטוכונדריה, הגיוס של חלבונים על פני השטח של המיטוכונדריה, או זיהוי של חלבוני mislocalized למיטוכונדריה במצבים פתולוגיים. יתר על כן, השילוב של צבעי מחוון ניאון קונבנציונליים מאפשר ההערכה בו זמנית של היבטים מסוימים של תפקוד המיטוכונדריה בהמיטוכונדריה שונהאוכלוסיות.
Protocol
בעלי חיים המשמשים במחקר זה, טופלו לפי קפדן לפרוטוקול (N08001CVsr) שאושר על ידי de l'אוניברסיטת מונטריאול ועדת מרכז דה המשוכללת והנדירה מרכז du Hospitalier (CRCHUM) המוסדית להגנה על בעלי חיים העוקב תקנים לאומיים כפי שתואר על ידי הקנדי מועצה על טיפול בבעלי חיים (CCAC).
הכן את כל חומרים כימיים הנדרשים לביצוע פרוטוקול זה (טבלת 1). ניתן למצוא את כל הפרטים נוספים בנוגע לציוד, אספקה וספקים ברשימה של חומרים.
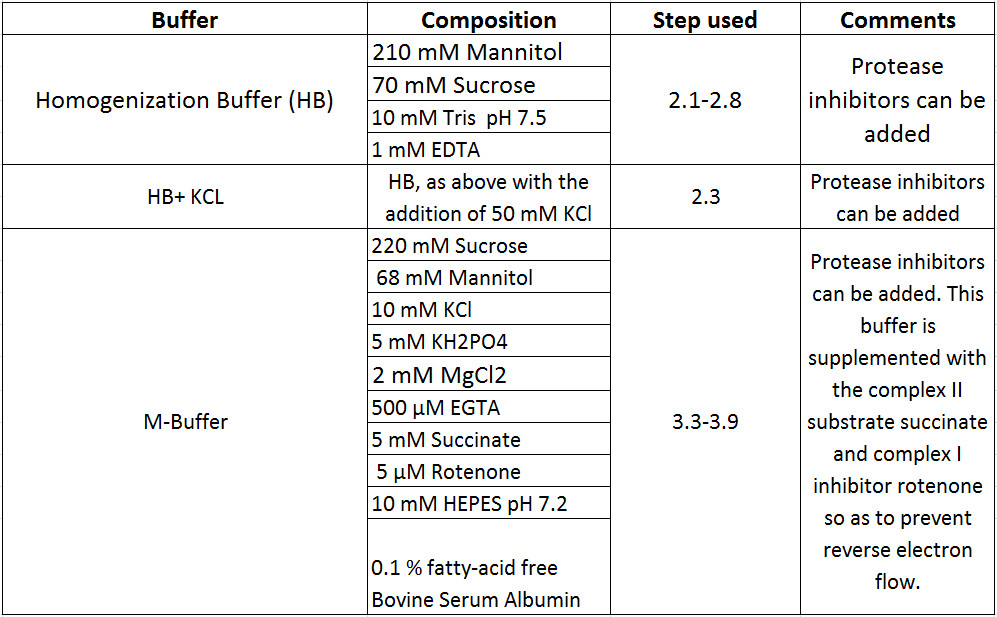
טבלת 1 יצירות הצפת.
1 אוסף של חוט השדרה עכברוש
- עמוק לטשטש את העכברוש (ספראג Dawley) עם isoflorane 4%. ודא הרדמה על ידי היעדר רפלקס על צביטה של הבכפו דואר. להרדים את העכברוש על ידי עריפת ראש באמצעות הגיליוטינה. שיטה זו של המתת חסד עדיפה על פני שעלול לעוות את חוט השדרה, אחרים.
- חותך את העור של הגב לחשוף את עמוד השדרה. חותך את עמוד השדרה במספריים עצם בדיוק מעל עצם האגן. דמיין את הפתיחה של עמוד השדרה.
- הכנס מזרק 10 מ"ל, עם טיפ 200 μl פיפטה (מצורף באמצעות המסת מעט מעל להבה), מלא בופר פוספט (PBS), לעמוד השדרה.
- לשטוף את חוט השדרה על ידי מריחת כמות בינונית של לחץ לבוכנה.
- אם כל דם נמצא על חוט השדרה, לשטוף עם PBS לפני שתמשיך לשלב הבא.
הערה: שיטה זו גם אומתה למוח ובכבד. אם כולל רקמות אלה, לאסוף מחצית המוח מהחולדה מורדמים וחתיכת כבד במשקל שווה לחוט השדרה. כל הצעדים אחרים יישארו זהים.
.2 בידוד של חוט השדרה Mitochondria (מעובד מתוך אל ונדת ולד ואח. 4)
- לאסוף את כל חוט השדרה שלם ומקום בhomogenizer זכוכית 5 מ"ל עם 5 כרכים (~ 3.25 מ"ל) Homogenization חוצץ (HB). להתאוששות אופטימלית של המיטוכונדריה המבודדת, לבצע את כל הצעדים על קרח או בחדר קר. Homogenize רקמה ביד עד שלא חתיכות גדולות של רקמה תישאר, שמונה כ שבץ. הנח homogenate בשני (2 מ"ל) או שלושה (1.7 מ"ל) microcentrifuge צינורות. צנטריפוגה XG 1,300 10 דקות ב 4 ° C בmicrocentrifuge המעבדתיים.
- להתאושש supernatant ומקום בצינור ultracentrifuge 5 מ"ל. הוספת HB 750 μl (~ 0.5 כרכים) לצינור microcentrifuge המכיל גלולה ובעדינות resuspend גלולה. צנטריפוגה וresuspension חזור על השלבים עוד פעמיים. בריכה כל supernatants (S1A וS1b) לתוך צינור ultracentrifuge 5 מ"ל מעל. צעד זה משמש להסרת קטנה פסולת.
- צנטריפוגה נקוותה S1 באמצעות ultracentrifuge מצויד בריקבון דלי מתנדנדאו ו צנטריפוגות ב XG 17,000 עבור 15 דקות ב 4 ° C.
- שמור supernatant (S2) לעיבוד נוסף אם חלק cytosolic הוא עניין (לדוגמא לניתוח כתם מערבי). Resuspend גלולה (P2), את החלק היחסי של המיטוכונדריה הגולמי, בHB מ"ל 4 + 50 מ"מ KCl. צנטריפוגה XG 17,000 עבור 15 דקות ב 4 ° C בהרוטור דלי מתנדנד. בטל supernatant ועדינות resuspend גלולה (P3) ב800 HB μl.
הערה: המיטוכונדריה נשטפים עם HB + 50 מ"מ KCl כדי להסיר כל מזהמי mitochondrially הקשורים שאינם ספציפיים. - בצינור ultracentrifuge 5 מ"ל חדש, להוסיף μl בדיוק 800 של גלולה מושעה (P3).
- לצינור הזה להוסיף, 200 μl של iodixanol (בינוני שיפוע צפיפות), ובכך ליצור ריכוז סופי של 12% iodixanol. מערבבים את התוכן של הצינור בעדינות, אך ביסודיות באמצעות pipetting עם P1000. תוספת של iodixanol הראשון, ולאחר מכן גלולה resuspended (P3) עשויות להיות עדיפות כדי להקל על ערבוב יסודי. צנטריפוגה בultracentrifuge מצויד בהרוטור דלי מתנדנד ב17,000 XG במשך 15 דקות ב 4 ° C.
- הערה: הכבד אינו מכיל מיאלין ולכן בשלב זה הוא לא הכרחי אם רק הכבד נמצא בתהליך עיבוד. עם זאת, אם כבד נמצא בתהליך עיבוד במקביל למיטוכונדריה CNS, מומלץ לטפל בכל הרקמות באופן שווה.
- לשאוב את שכבת המיאלין בחלק העליון של הצינור ובזהירות להסיר ולסלק supernatant. גלולה עשויה להיות רופפת. Resuspend גלולה ב4 HB מ"ל. צנטריפוגה שוב ב17,000 XG 10 דקות ב 4 ° C.. בטל supernatant וresuspend גלולה ב4 HB מ"ל. חזור על צנטריפוגה ולהסיר את supernatant.
- Resuspend גלולה הסופי (P7) ב100-200 HB μl ולהעביר לצינור 1.7 מ"ל microcentrifuge. מדגם זה מכיל מיטוכונדריה המבודדת.
- המשך לכימות חלבון. לדלל דגימות והעקומה סטנדרטית ב2% סולפט dodecyl נתרן (SDS), כדי להבטיח solubilization נאות של duri מיטוכונדריהכימות חלבון ng.
.3 Immunolabeling של מיטוכונדריה מבודדת לcytometry הזרימה
- עבור כל תערובת כתמים להיבדק, פיפטה 25 מיקרוגרם של מיטוכונדריה המבודדת לתוך צינור 1.7 מ"ל microcentrifuge. כולל מדגם בלא כתם בכל ניסוי; ועבור כל נוגדן, הקפד לכלול מדגם לשליטת אלוטיפ המתאים.
- צנטריפוגה ב XG 17,000 עבור 2 דקות ב 4 ° C בmicrocentrifuge ספסל העליון.
- הסר supernatant וresuspend מיטוכונדריה המבודדת ב50 μl המיטוכונדריה חוצץ (M Buffer) בתוספת 10% BSA חופשי חומצות שומן ל15 דקות ב 4 ° C (צעד חסימה).
הערה: במהלך תיוג, לבצע incubations במקרר ב 4 מעלות צלזיוס. - הוספת נוגדן ראשוני (ארנב נגד Mfn2, 20 מיקרוגרם למ"ל) לצינור ודגירה של 30 דקות ב 4 ° C..
הערה: קביעת ריכוז אופטימלי של כל נוגדן באופן אמפירי על ידי טיטרציה. בשל שונות בריכוז ו / או purity, הרבה שונה של אותו הנוגדן מאותו היצרן עלול להוביל לתוצאות שונות; לכן טיטרציה נחוצה לכל מגרש חדש של נוגדן. - לשטוף את הנוגדן מאוגד עיקרי: צנטריפוגה ב 17,000 XG למשך 2 דקות ב 4 ° C. הסר את supernatant ועדינות resuspend גלולה ב200 μl M הצפת. צנטריפוגה ב XG 17,000 עבור 2 דקות ב 4 ° C.. הסר supernatant וresuspend גלולה ב50 μl M הצפת.
- הוספת נוגדנים משני (נגד הארנב IgG החמור Phycoerythrin (PE), 0.5 מיקרוגרם למ"ל) לצינור ודגירת דגימות ל30 דקות ב 4 ° C, מוגן מפני אור.
- לשטוף את הנוגדנים משני מאוגדים: צנטריפוגה ב 17,000 XG למשך 2 דקות ב 4 ° C. הסר את supernatant וresuspend גלולה ב200 μl M הצפת. צנטריפוגה ב XG 17,000 עבור 2 דקות ב 4 ° C.. הסר supernatant וresuspend גלולה ב500 μl M הצפת.
- כדי להבטיח אירועים נמצאים במיטוכונדריה עובדה, מיטוכונדריה כתם מבודד עםצבע מיטוכונדריה ספציפי ניאון ל15 דקות ב RT, המוגן מפני אור. אם הכתמה של פרמטרים אחרים תפקודיים (פוטנציאל הטרנסממברני המיטוכונדריה או ייצור סופראוקסיד) היא רצויה, המשך לשלב .4 אם לא, המשיכו לשלב 5 לרכישה.
הערה: חשוב לוודא שספקטרום הפליטה של הנוגדנים משני בקנה אחד עם זו של הצבעים הפונקציונליים. לדוגמא, אם אימות טוהר המיטוכונדריה עם צבע מסחרי עם תכונות ספקטרליות דומות לפוטנציאל FITC והטרנסממברני עם תיל אסטר Tetramethylrhodamine (TMRM), נוגדנים משני קיימא יהיה allophycocyanin (APC: ננומטר אקס 650 / Em 660 ננומטר). להוסיף בקרות פיצויים, כלומר, מדגם immunolabeled או מוכתם עם fluorophore יחיד, כאשר החלים. - מעבירים צינור מתאים לזרימת טעינת cytometer. (כדי להקל על גודל המדגם הקטן, צינור microtiter ממוקם בתוך 3 מ"ל לזרום cytometer צינור.) שמור על דגימות קרח ולפנות מייד ללזרום cytometer לרכישה.
.4 Assaying מיטוכונדריאלי הטרנסממברני פוטנציאלי ומיטוכונדריאלי Superoxide ייצור על ידי cytometry הזרימה
- ודא שיש לי מיטוכונדריה המבודדת פוטנציאל הטרנסממברני שלם על ידי צביעה עם 100 ננומטר TMRM (548 ננומטר / ננומטר 574 Em Ex) 5, בשלב 3.8, ל15 דקות ב RT, מוגנות מפני אור. לשם השוואה של פוטנציאל הטרנסממברני בין דגימות ואוכלוסיות, שימוש בריכוזים שאינן מרווה / תחתונה של TMRM (1 עד 30 ננומטר), עשוי להיות מתאים יותר 6.
- כביקורת מכתים TMRM, מיטוכונדריה המבודדת כתם עם 100 ננומטר TMRM בנוכחות של הידרזין פניל מ-כלורו ציאניד קרבוניל 100 מיקרומטר (CCCP), uncoupler המיטוכונדריה שdepolarize מיטוכונדריה. הריכוז של CCCP נדרש depolarize מיטוכונדריה עשוי להיות פחות אם ריכוזים נמוכים יותר של צבע משמשים.
- ודא שמיטוכונדריה המבודדת לייצר סופראוקסיד המיטוכונדריה ידי staining עם מחוון סופראוקסיד המיטוכונדריה מתאים 7, גם בשלב 3.8, ל15 דקות ב RT, מוגנות מפני אור.
- כביקורת לייצור סופראוקסיד המיטוכונדריה, מיטוכונדריה המבודדת כתם עם צבע בנוכחות 10 מיקרומטר Antimycin, מעכב של הקומפלקס III של שרשרת הנשימה שתגביר את ייצור סופראוקסיד המיטוכונדריה.
.5 רכישה וניתוח של Immunolabeled מבודד המיטוכונדריה על ידי cytometry הזרימה
- מכשיר להגדיר: מתחי החלף ליניארי כדי להיכנס למצב כדי להקל על ניתוח של מיטוכונדריה המבודדת ומתחים שנקבעו (FSC: 450; SSC: 250). להבטיח כי אירועים נאספים בFSC-מצב (אזור), כמו גם FSC-W (רוחב) וFSC-H (גובה), כדי להיות מסוגל להוציא כפילויות (כלומר, שני אירועים, שעוברים דרך גלאים באותו הזמן ) באוסף של הודעה נתונים ניתוח. הגדר את מספר האירועים שייגבה ל100,000. לרכוש בקרות פיצוי, אם ישים.
- רכישת נתונים: לפני רכישת נתונים, להימנע vortexing דגימות. במקום לערבב בעדינות על ידי הקשה על צינור. בתחילה לאסוף אירועים בלחץ נמוך, בgating. שער באוכלוסייה. התאם מתחים של היסטוגרמות בהתאם, בדרך כלל השיא של המדגם בלא כתם יהיה מתאים לעשור השני (10 2). ברגע שהשערים הוקמו, ודגימות שנמצאות בעיבוד, הלחץ יכול להיות מופעל עד גבוה.
- ניתוח: דמיין כפילויות על ידי התוויית FSC-W לעומת FSC. לזהות singlets וכפילויות. השער בsinglets. בחר את אוכלוסיית המיטוכונדריה על ידי gating על אירועים שהם מוכתמים חיובי עם צבע המיטוכונדריה סלקטיבי.
- לקבוע תיוג רקע משליטת אלוטיפ. שימוש במדגם שליטת אלוטיפ, לקבוע את אחוז תיוג אוכלוסיית המיטוכונדריה החיובי לנוגדני Mfn2.
תוצאות
מיטוכונדריה נובעת ממייתרי השדרה עכברוש ניתן immunolabeled עם נוגדן הממוקד לMitofusin2 (Mfn2), חלבון מעורב באיחוי של הקרום החיצוני של המיטוכונדריה 8. בעקבות בידוד ותיוג עם נוגדן ספציפי Mfn2 ונוגדנים משני מצומדות fluorescently, מיטוכונדריה מעובדות על ידי cytometry זרימה (איור 1). בעקבות רכישת נתונים, דגימות מנותחות באמצעות cytometry זרימת תוכנה לניתוח, על ידי לדמיין את כל האירועים שנאספו על מגרש נקודה (איור 2 א) הראשון. כפילויות וsinglets נבדלים כאשר האירועים נרשמות בFSC, רוחב (W) לעומת אזור (א) (איור 2). ברגע שsinglets נבחרים, שער אוכלוסיית המיטוכונדריה באמצעות FSC / SSC (איור 2 ג), ולאמת את מספר האירועים מכתימים חיובי לצבע מיטוכונדריה הספציפית על ידי שיתוף זומם היסטוגרמה של המדגם בלא כתם עם מדגם מוכתם במיטוכונדריה-SPEצבע cific. כדי לקבוע את האירועים במיטוכונדריה, למקם את שער בצומת של שתי פסגות (איור 2 ד). להכנות חוט השדרה, בדרך כלל> 90% מהאירועים חיוביים לצבע מיטוכונדריה הספציפית. לרקמות אחרות, כגון כבד, ~ 98% מהאירועים יהיו תווית עם הצבע (מידע לא מוצג). לאחר הבחירה רק אירועים שתווית חיובית לצבע מיטוכונדריה הספציפית, לקבוע תיוג רקע עם שליטת אלוטיפ על ידי בחירת שער (Mfn2 +) הכולל 1% או תיוג אלוטיפ פחות (איור 2E, משמאל). החל השער הזה באופן אחיד לכל הדגימות שכותרתו עם הנוגדן Mfn2 כדי לקבוע את האחוז של המיטוכונדריה עם Mfn2 הנוכחי על הממברנה של המיטוכונדריה החיצונית (איור 2E, מימין). בניסוי זה, 30% ממיטוכונדריה נובעים מתווית חוט השדרה חיובית לMfn2. חשוב לציין כאן, כי למרות שMfn2 נחשב mit הביע בכל מקוםחלבון קרום חיצוני ochondrial, זה לא היה לכמת בעבר. יתר על כן, ניתוח immunocytochemical של Mfn2 בתאים בתרבית תערוכות תיוג שאינו הומוגנית של המיטוכונדריה פרט 9. אפשר גם שepitope Mfn2 היה זמין בשל לפרסם שינויי translational או בשל אינטראקציות עם עצמו או שותפים המחייבים אחרים. מן ראוי לציין כי, הנוגדנים במחקר זה נוצר באמצעות פפטיד סינטטי לN-הסופי (חומצות אמינו 38-55). יש גרסת אחוי חזויה של Mfn2 חסרת חומצות אמינו הראשונות 302, למרות שגרסה זו טרם אישרה באופן ניסיוני (מסד נתונים UniProt). לפיכך, assay זה אינו מסוגל לזהות Mfn2 שחבור חלופי חסר רצף N-המסוף, נתן את הנוגדן בשימוש.
פוטנציאל מיטוכונדריאלי הטרנסממברני (מ 'ΔΨ) וייצור סופראוקסיד ניתן להעריך בassay זה. על פני קרום המיטוכונדריה הפנימי, קיימת הפרדת תשלום ש"שich מניע ייצור ATP באמצעות זירחון חמצוני. TMRM הוא צבע קטיוני שמצטבר בתוך המיטוכונדריה באופן תלוי פוטנציאל הממברנה 5, ולכן ניתן להשתמש בו ככתב של פוטנציאל הטרנסממברני המיטוכונדריה. רוב מיטוכונדריה (95%) הם TMRM חיובי לאחר צביעה, בהשוואה לשליטה בלא כתם (איור 3 א). עם זאת, כאשר CCCP uncoupler הוא הוסיף שיש ירידה משמעותית במספרם של המיטוכונדריה מסוגלת לשמור TMRM (איור 3 א). CCCP מאפשר מעבר החופשי של יונים על פני קרום המיטוכונדריה הפנימי, במהות הורס את הפרדת תשלום וdepolarizing הקרום.
סופראוקסיד שחרור המיטוכונדריה כתוצר לוואי נורמלי של זרחון חמצוני מאני מורכב וIII של שרשרת העברת אלקטרונים. סופראוקסיד מיטוכונדריאלי ניתן למדוד באמצעות צבע חדיר קרום שהוא ממוקד למיטוכונדריה והופך follo ניאוןאגף תגובה עם סופראוקסיד 7. מיטוכונדריה פונקציונלית לייצר כמות בסיסית של סופראוקסיד בהשוואה לדגימות בלא כתם (איור 3 ב). תוספת של המעכב המורכב III Antimycin מניבה עלייה בסופראוקסיד, כפי שניתן לראות על ידי תזוזה ימינה בתפרחת ומספר גבוה יותר של מיטוכונדריה (בדרך כלל ~ 10%) כי הם ניאון עם הצבע הזה המיטוכונדריה סופראוקסיד מחוון (איור 3 ב).

איור 1 סכמטי של בידוד, immunolabeling וניתוח של המיטוכונדריה. שלב 1: איסוף רקמות וhomogenize שלב 2:. הליך הבידוד מכיל שמונה שלבי צנטריפוגה. המיאלין, בלימה העיקרית של רקמת מערכת עצבים המרכזית הוסר על ידי דילול מיטוכונדריה בiodixanol (בינוני שיפוע צפיפות) וcentrifuging, וכתוצאה מכך המיאלין צף למעלה של הצינור, תוך המיטוכונדריה pelleted שלב 3:. בעקבות בידוד וכימות, מיטוכונדריה חסומה, שכותרתו עם נוגדן ראשוני ורחץ. נוגדנים משני מצומדת לfluorophore הוא הוסיף לאחר מכן. נוגדן מאוגד נשטף החוצה שלב 4:. בשלב ניתן להוסיף צבעי ניאון שידווחו על טוהר המיטוכונדריה, או פונקציה של המיטוכונדריה זה שלב 5:. המיטוכונדריה הוא עכשיו מוכן להיות מנותח על ידי cytometry זרימה.

אסטרטגיה איור 2 לניתוח מיטוכונדריה המבודדת על ידי cytometry זרימה. המתחים קדימה פיזור (FSC) וצד פיזור (SSC) חייבת להיות מותאם לאירועים קטנים, משתמשים בשתי הפרמטרים במצב לוגריתמים. רוחב FSC נתונים (FSC-W) חייבים להיותנאסף שלא לכלול כפילויות. הערה, ברוב הזרימה cytometers, הגדרת ברירת המחדל עבור FSC ו SSC הוא מצב ליניארי. () דמיינו את כל האירועים שנאספו על מגרש נקודה. (B) כפילויות, שתי המיטוכונדריה עוברת הלייזר באותו הזמן, ניתן להבחין בין singlets על ידי התוויית FSC לעומת FSC-W (מצב לינארי). אירועים אינם נכללים אם ערך FSC-W הוא יותר מכפול מערך FSC-W הממוצע של רוב האירועים, כלומר, אלה שהם חלק מהענן הסמיך. אירועים תחת סף זה הם מגודרים כsinglets. (C) שוב, לדמיין את האירועים בעלילה נקודה, ושער על האירועים שנותרו. (ד) מגרש היסטוגרמה של המדגם בלא כתם מדגם (מוצק, אפור, מלא) ומוכתם עם צבע המיטוכונדריה ספציפי (MSD: מוצק, ירוק). שער האירועים מכתימים חיובי עבור MSD (MSD +). (ה) היסטוגרמה של שליטת אלוטיפ, ארנב IgG (מקווקו, שחורים) ומדגם שכותרתו Mfn2 (מוצק, ורוד).הגדר את השער כדי להניב ≤ 1% + Mfn2 בשיא שליטת אלוטיפ וליישם את אותו השער הזה למדגם ניסיוני על מנת לקבוע את אחוז אירועי תיוג החיובי לMfn2 (Mfn2 +). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של זה דמות.
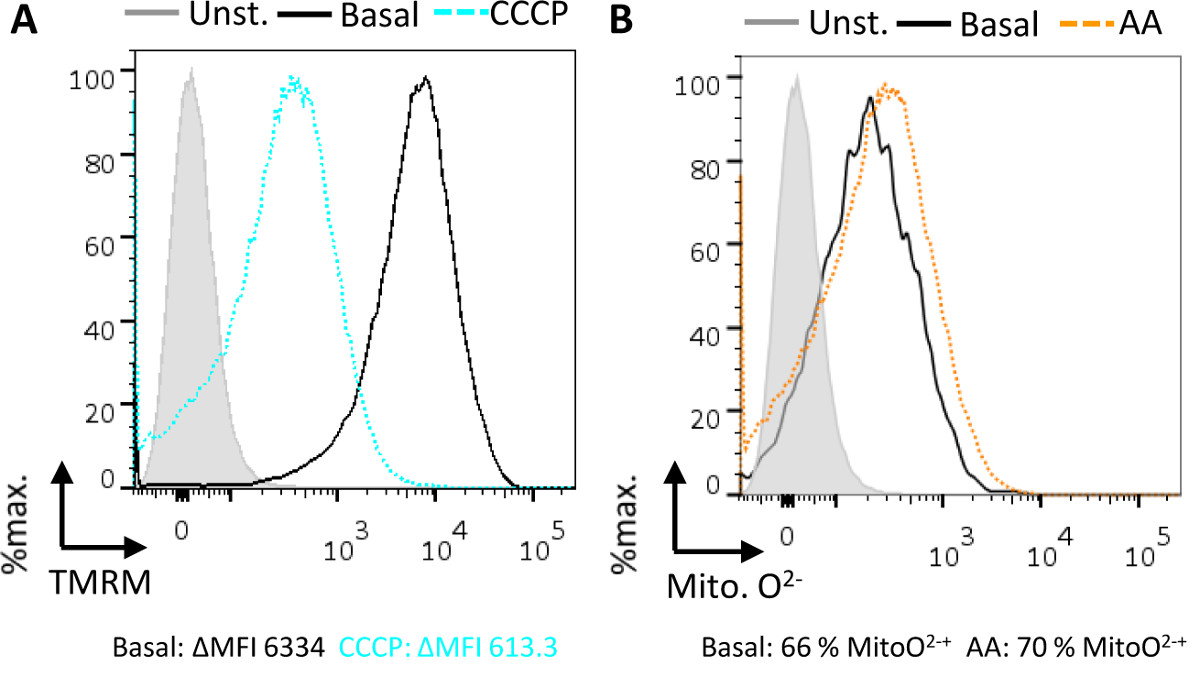
ייצור איור 3 (מ 'ΔΨ) Assaying הטרנסממברני המיטוכונדריה פוטנציאל וסופראוקסיד במיטוכונדריה המבודדת על ידי cytometry זרימה. (א) בתנאים בסיסיים כל המיטוכונדריה הפעילה תהיה תווית עם TMRM (מוצק, שחור), בהשוואה לשליטה בלא כתם (מוצק, אפור, מלא) בגלל הצבע מצטבר במיטוכונדריה עם פוטנציאל הטרנסממברני. Addi tion של CCCP protonophore (מקווקו, הכחול) מתפוגג הפוטנציאל הטרנסממברני גורם מיטוכונדריה לdepolarize ולשמר פחות צבע שהשוואה לתנאים בסיסיים. הנתונים הוא כפי שדווח הדלתא מתכוונים עוצמת ניאון (ΔMFI), המהווה את עוצמת הניאון הממוצעת של השליטה בלא כתם יורדת מעוצמת הניאון הממוצעת של המדגם. (ב ') בתנאים בסיסיים, המיטוכונדריה לייצר סופראוקסיד כתוצר לוואי של חמצון זרחון. מקור המיטוכונדריה זה של סופראוקסיד יכול להיות assayed עם מחוון המיטוכונדריה סופראוקסיד, (MitoO 2: מוצק, שחור) בהשוואה לשליטה בלא כתם (מוצק, אפור, מלא). תוספת של המעכב המורכב III, Antimycin תוצאות (מקווקוים, כתום) בייצור סופראוקסיד מוגבר, בהשוואה לרמות בסיס. הנתונים שדווחו כאחוז מתאים מכתימים חיובי למדד MitoO 2.k "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
זה בא לידי ביטוי יותר ויותר כי המיטוכונדריה הן שחקני מפתח בשני פיזיולוגיה ומחלות נורמליות. בעוד immunoblotting יכול לקבוע אילו חלבונים נמצאים בתוך המיטוכונדריה או על פני השטח של המיטוכונדריה במצב מסוים, דיווחים בשיטה זו בממוצע של האוכלוסייה כולה. שיטה זו לא יכולה להניב מידע על שכיחותם היחסית של תת אוכלוסיות או תת המיטוכונדריה. למרות שזה היה בעבר הניח כי כל מיטוכונדריה נוצרו באותה מידה, השדה הוא הכרת המיטוכונדריה שבתוך תא יותר ויותר יש לי שונות רבות במונחים של מורפולוגיה ו / או פונקציה 10.
גישות מיקרוסקופ פלואורסצנטי לוקחים בחשבון את ההטרוגניות של המיטוכונדריה. עם זאת, כימות של סוג זה של נתונים היא עבודה אינטנסיבית. יתר על כן, גישה זו היא מתאימה יותר למחקרים באמצעות תאים בתרבית, כתיוג של המיטוכונדריה in vivo / באתרו הוא קשה בשל excesמספר sive של המיטוכונדריה הנוכחית, מה שהופך את הבידול של האברונים פרט קשה מטבעו. ברוב פרוטוקולי immunocytochemistry, זה גם לא ניתן לתייג בו זמנית חלבוני קרום המיטוכונדריה חיצוניים ולהעריך את התפקוד המיטוכונדריה בשל צעד permeabilization הסלולרי הנדרש לתיוג נוגדן. השיטה הנוכחית עובדת עם מיטוכונדריה המבודדת, ולכן אינו דורשת צעד permeabilization. בנוסף, ההדמיה של המיטוכונדריה פרט אפשרית רק באמצעות מיקרוסקופ אלקטרונים, שאינו ניתן לניתוח של תפקוד המיטוכונדריה. עם זאת, אנו מכירים בכך שהבידוד של המיטוכונדריה מרקמות גורם לשיבוש של רשת המיטוכונדריה וזה יכול להשפיע על כמה אלמנטים של פונקציה של המיטוכונדריה. עם זאת, השוואות של היבטים פונקציונליים של מיטוכונדריה המבודדת מרקמות שמעובדות באופן דומה יישארו בתוקף.
שיטה זו של immunolabeling של בידוד ע המופק מרקמותמיטוכונדריה ed וניתוח שלאחר מכן על ידי זרימת cytometry מאפשר לשיטה מהירה וכמותיים כדי לזהות ולנטר את הנוכחות של חלבון הממוקם בקרום החיצוני. זיהוי של חלבון המיטוכונדריה נרחב ביותר (כמו Mfn2) אפשרי עם טכניקה זו. בדומה לכך, בשיטה זו ניתן לזהות חלבוני שפע נמוכים שמופקדים רק על הממברנה של המיטוכונדריה במחלה, כמו SOD1 misfolded בהקשר של טרשת לרוחב amyotrophic (ALS) 11. בנוסף, שיטה זו יכולה להיות שימושית כדי לפקח על החלבונים שזמניים לקשר עם משטח המיטוכונדריה כחלק מהתפקוד התקין שלהם. דוגמאות לכך כוללות-קשור dynamin חלבון-1 (Drp1), חלבון cytosolic שגויס למיטוכונדריה כדי לקדם את ביקוע המיטוכונדריה 12 והגורם הקשורים הקולטן לגורם נמק גידול 6 (TRAF6), אשר translocates למיטוכונדריה כדי להגדיל מיני חמצן תגובתי המיטוכונדריה כ חלק מתגובה חיסונית מולדת 13.
כיום טכניקה זו היא נוחה רק לחלבונים המצויים על פני השטח של המיטוכונדריה, כמו פרוטוקולי permeabilization סטנדרטיים לתיוג תאיים דורשים חומר ניקוי שמשבש את השלמות המבנית של המיטוכונדריה. בעוד מספר של חומרים כימיים אפשריים כבר ניסה (לא פורסם), אופטימיזציה נוספת של פרוטוקול immunolabeling יש צורך עדיין לעשות את זה בפרוטוקול ניתן לאיתור רכיבי התוך המיטוכונדריה.
טכניקה זו יש יישומים רחבים וניתן להשתמש בם כדי לזהות את הנוכחות או גיוס של חלבונים אחד או יותר למיטוכונדריה תחת פרדיגמות ניסוי שונות. יתר על כן, יכול להיות שותף שכותרת המיטוכונדריה עם שני נוגדנים שונים, כמו גם עם אינדיקטורים ניאון 11. בדיקות ניאון אחרות גם יכולות להיות משולבות כדי לאפיין היבטים נוספים של תפקוד המיטוכונדריה. לדוגמא, צבעים זמינים מסחרי כדי לפקח pH המיטוכונדריה 14 , ספיגת סידן עם רמות 15 ירוק-5N, וATP סידן 16 אפשרית.
Disclosures
יש לי המחברים אין לחשוף.
Acknowledgements
אנו מודים לורי Destroismaisons ושרה Peyrard לתמיכה טכנית יוצאת מן הכלל וDr.Alexandre פרת לגישה לcytometer הזרימה. אנחנו רוצים גם להודות ד"ר טימותי מילר על תרומתו בעניין הסרת המיאלין מההכנות. עבודה זו נתמכה על ידי המכון הקנדי לבריאות מחקר (CIHR) Neuromuscular מחקר שותפות, קרן הקנדית לחדשנות, חברת ALS של קנדה, הקרן פריק לחקר ALS, צ'אם קרן וFonds דה לה המשוכלל והנדיר en סנטה du קוויבק (CVV). CVV וNA שניהם מחקר חוקרים של Fonds דה לה משוכלל ונדיר en סנטה du קוויבק וCIHR חדשים חוקרים. SP נתמך על ידי טים הנואלים Studentship מהחברה ALS של קנדה.
Materials
| Name | Company | Catalog Number | Comments |
| Rats | Charles River | Strain code 400 | Adult (9 weeks to 18 weeks) male or female rats can be used for the isolation protocol. Weight of rats is dependent on gender and age (males between 300 to 500 g and females between 200 to 350 g) are typically used. |
| Dounce homogenizer | Kontes Glass Co. | 885450-0022 | Duall 22 |
| Microcentrifuge | Thermo Scientific | Sorvall Legend Micro 17 R | |
| Ultra-Clear Ultracentrifuge tubes | Beckman Coulter | 344057 | Transparent, thin walled |
| Sorvall Ultracentrifuge | Thermo Scientific | Sorvall WX UltraSeries | |
| AH-650 rotor and buckets | Thermo Scientific | ||
| Opti-prep | Axis-Shield | 1114542 | Iodixanol, density gradient medium |
| Fatty acid free Bovine Serum Albumin | Sigma | A8806 | Must be fatty acid free for mitochondria |
| Sodium succinate dibasic hexahydrate | Sigma | S9637 | |
| Rabbit anti-Mitofusin2 antibody | Sigma | M6319 | |
| Rabbit IgG | Jackson Immuno Research | 011-000-003 | |
| Anti-Rabbit IgG PE | eBioscience | 12-4739-81 | |
| Micro titer tube | Bio-Rad | 223-9391 | For sample acquisition by flow cytometry |
| MitoTrackerGreen (MTG) | Invitrogen | M7514 | 100 nM: Ex 490 nm/Em 516 nm |
| TMRM | Invitrogen | T668 | 100 nM: Ex 548 nm/Em 574 nm |
| CCCP | Sigma | C2759 | |
| MitoSOX Red | Invitrogen | M36008 | 5 µM: Ex 540 nm/Em 600 nm |
| Antimycin A | Sigma | A8874 | |
| LSR II flow cytometer | BD | ||
| BD FACSDiva Software | BD | ||
| FlowJo | TreeStar Inc. | Software used for analysis | |
| BCA protein assay kit | Pierce/Thermo Scientific | 23225 | Bradford assay is not recomended as it is not compatible with high concentrations of SDS |
References
- Itoh, K., Nakamura, K., Iijima, M., Sesaki, H. Mitochondrial dynamics in neurodegeneration. Trends Cell Biol. 23, 64-71 (2013).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. J Cell Biol. 183, 795-803 (2008).
- Zorov, D. B., Kobrinsky, E., Juhaszova, M., Sollott, S. J. Examining intracellular organelle function using fluorescent probes: from animalcules to quantum dots. Circ Res. 95, 239-252 (2004).
- Vande Velde, C., Miller, T., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proc Natl Acad Sci U S A. 105, 4022-4027 (2008).
- Loew, L. M., Tuft, R. A., Carrington, W., Fay, F. S. Imaging in five dimensions: time-dependent membrane potentials in individual mitochondria. Biophys J. 65, 2396-2407 (1993).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50, 98-115 (2011).
- Xu, X., Arriaga, E. A. Qualitative determination of superoxide release at both sides of the mitochondrial inner membrane by capillary electrophoretic analysis of the oxidation products of triphenylphosphonium hydroethidine. Free Radic Biol Med. 46, 905-913 (2009).
- Otera, H., Ishihara, N., Mihara, K. New insights into the function and regulation of mitochondrial fission. Biochim Biophys Acta. 1833, 1256-1268 (2013).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Wikstrom, J. D., Twig, G., Shirihai, O. S. What can mitochondrial heterogeneity tell us about mitochondrial dynamics and autophagy. Int J Biochem Cell Biol. 41, 1914-1927 (2009).
- Pickles, S., Destroismaisons, L., Peyrard, S. L., Cadot, S., Rouleau, G. A., Brown, R. H., Julien, J. P., Arbour, N., Vande Velde, C. Mitochondrial damage revealed by immunoselection for ALS-linked misfolded SOD1. Hum Mol Genet. 22, 3947-3959 (2013).
- Frank, S., Gaume, B., Bergmann-Leitner, E. S., Leitner, W. W., Robert, E. G., Catez, F., Smith, C. L., Youle, R. J. The role of dynamin-related protein 1, a mediator of mitochondrial fission, in apoptosis. Dev Cell. 1, 515-525 (2001).
- West, A. P., Brodsky, I. E., Rahner, C., Woo, D. K., Erdjument-Bromage, H., Tempst, P., Walsh, M. C., Choi, Y., Shadel, G. S., Ghosh, S. TLR signalling augments macrophage bactericidal activity through mitochondrial ROS. Nature. 472, 476-480 (2011).
- Abad, M. F., Di Benedetto, G., Magalhães, P. J., Filippin, L., Pozzan, T. Mitochondrial pH monitored by a new engineered green fluorescent protein mutant. J Biol Chem. 279, 11521-11529 (2004).
- Murphy, A. N., Bredesen, D., Cortopassi, G., Wang, E., Fiskum, G. Bcl-2 potentiates the maximal calcium uptake capacity of neural cell mitochondria. Proc Natl Acad Sci U S A. 93, 9893-9898 (1996).
- Tantama, M., Martinez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4, 2550 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved