Method Article
La inmunodetección de la membrana externa proteínas por Citometría de Flujo de mitocondrias aisladas
En este artículo
Resumen
Se describe aquí es un método para detectar y cuantificar proteínas de la membrana externa mitocondrial por inmunomarcaje de las mitocondrias aisladas de tejido de roedores y análisis por citometría de flujo. Este método puede ampliarse para evaluar los aspectos funcionales de subpoblaciones mitocondriales.
Resumen
Métodos para detectar y controlar los componentes de proteína de membrana externa mitocondrial en los tejidos animales son vitales para estudiar la fisiología mitocondrial y la fisiopatología. Este protocolo describe una técnica donde las mitocondrias aisladas de tejido de roedores se immunolabeled y se analizaron por citometría de flujo. Las mitocondrias se aislaron a partir de roedores médulas espinales y se sometieron a una etapa de enriquecimiento rápido a fin de eliminar la mielina, un contaminante principal de las fracciones mitocondriales preparadas a partir de tejido nervioso. Mitocondrias aisladas se marcaron a continuación con un anticuerpo de elección y un anticuerpo secundario conjugado con fluorescencia. Análisis por citometría de flujo verifica la pureza relativa de las preparaciones mitocondriales por tinción con un colorante específico mitocondrial, seguido por la detección y cuantificación de la proteína immunolabeled. Esta técnica es rápida, cuantificable y de alto rendimiento, lo que permite el análisis de cientos de miles de mitocondrias por muestra. Es aplicable para evaluar novela proteins en la superficie mitocondrial en condiciones fisiológicas normales, así como las proteínas que pueden convertirse en mislocalized a este orgánulo durante la patología. Es importante destacar que este método puede ser acoplado a colorantes indicadores fluorescentes para informar sobre ciertas actividades de las subpoblaciones mitocondriales y es factible para las mitocondrias del sistema nervioso central (cerebro y médula espinal), así como el hígado.
Introducción
Las mitocondrias son orgánulos muy dinámicos que se someten a múltiples rondas de la fisión y la fusión, son transportados a sitios de alta demanda energética y responder rápidamente a los estímulos fisiológicos 1. Dado que se reconoce cada vez más que las mitocondrias dentro de los diferentes tejidos, incluso diferentes compartimentos celulares, tienen perfiles funcionales distintos, se necesitan nuevos métodos para identificar estos subconjuntos mitocondriales distintos.
Microscopía proporciona un medio por el cual las mitocondrias individuales se pueden visualizar y la presencia de una proteína en, o en las mitocondrias puede ser determinada por inmunofluorescencia 2. Sin embargo, el análisis cuantitativo por este método es laborioso y es más adecuado para experimentos utilizando líneas celulares inmortalizadas o primarios. El estudio de las mitocondrias individuales derivados de tejido es significativamente más difícil y la mayoría de los métodos no permiten una fácil identificación de subconjuntos mitocondriales simultáneamente con la evaación de la función mitocondrial 3.
Para hacer frente a este obstáculo, un nuevo método para inmunomarcador mitocondrias aisladas de tejidos de roedores y posteriormente analizadas por citometría de flujo se ha desarrollado. Esto permite la rápida detección y cuantificación de proteínas localizadas en la membrana mitocondrial externa, que en comparación con el análisis por microscopía, es mucho menos mano de obra intensiva y permite el análisis de miles de mitocondrias en una sola muestra. Este ensayo se puede aplicar para controlar el destino y la cantidad relativa de proteínas de la membrana externa mitocondrial que se cree que son constitutivamente presente en la mitocondria, el reclutamiento de proteínas a la superficie mitocondrial, o la detección de proteínas mislocalized a la mitocondria en condiciones patológicas. Por otra parte, la incorporación de colorantes indicadores fluorescentes convencionales permite la evaluación simultánea de ciertos aspectos de la función mitocondrial en distinta mitocondrialsubpoblaciones.
Protocolo
Los animales utilizados en este estudio fueron tratados en estricta conformidad con un protocolo (N08001CVsr) aprobado por el l'Université de Montréal (CRCHUM) Comité Centre de Recherche du Centre Hospitalier de de Institucional para la Protección de los Animales que sigue los estándares nacionales tal como se indica por la Canadian Consejo de los Animales (CCPA).
Preparar todos los reactivos necesarios para llevar a cabo este protocolo (Tabla 1). Todos los demás detalles relacionados con el equipo, los suministros y proveedores se encuentran en la Lista de Materiales.
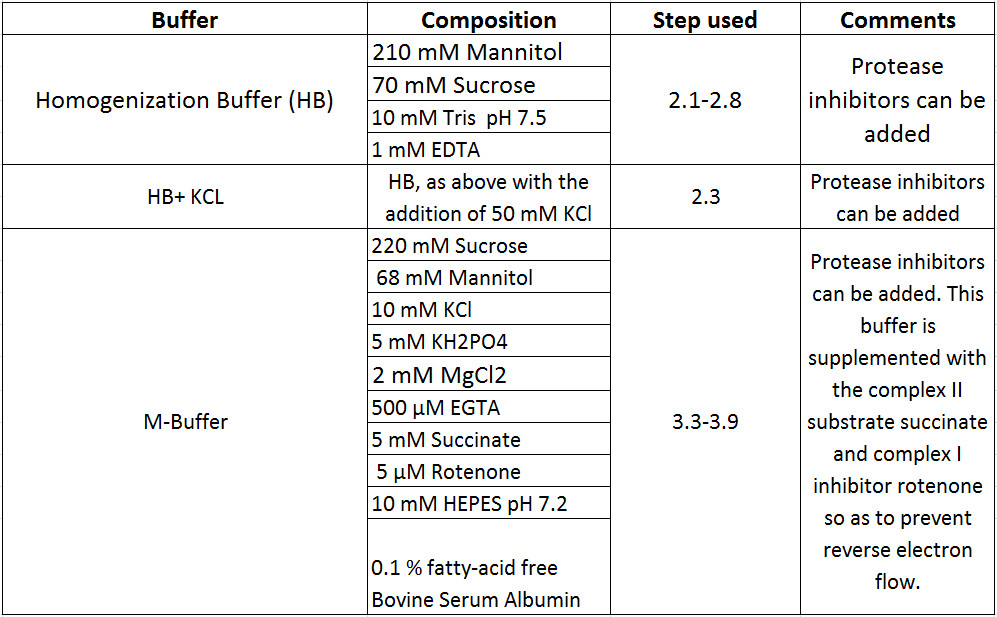
Tabla 1. Buffer composiciones.
1. Colección de rata de la Médula Espinal
- Profundamente anestesiar la rata (Sprague Dawley) con 4% isoflorane. Verifique la anestesia por la falta de reflejo a pellizcos de jue pata. La eutanasia a las ratas por decapitación a través de la guillotina. Se prefiere este método de eutanasia sobre otros, que puedan distorsionar la médula espinal.
- Cortar la piel de la espalda para exponer la columna vertebral. Cortar la columna vertebral con sus tijeras de hueso justo por encima del hueso de la pelvis. Visualice la apertura de la columna vertebral.
- Inserte una jeringa de 10 ml, con una punta de pipeta de 200 l (unido a través de la fusión de un poco más de la llama), lleno de tampón fosfato salino (PBS), en la columna vertebral.
- Enjuague la médula espinal mediante la aplicación de una cantidad media de la presión en el émbolo.
- Si alguno de sangre está presente en la médula espinal, enjuagar con PBS antes de proceder al siguiente paso.
NOTA: Este método también ha sido validado para el cerebro y el hígado. Si estos tejidos incluyendo, recoger media del cerebro de la rata sacrificados y un trozo de hígado igual en peso a la médula espinal. Todos los otros pasos permanecen idénticas.
2. Aislamiento de la médula espinal Mitochondria (Adaptado de Vande Velde et al. 4)
- Recoger toda la médula espinal y el lugar intacto en 5 ml homogeneizador de vidrio con 5 volúmenes (~ 3,25 ml) tampón de homogeneización (HB). Para una recuperación óptima de las mitocondrias aisladas, realizar todos los pasos en el hielo o en la cámara frigorífica. Homogeneizar el tejido a mano hasta que no hay grandes trozos de tejido permanecen, aproximadamente ocho golpes. Coloque homogeneizado en dos (2 ml) o tres (1,7 ml) tubos de microcentrífuga. Centrífuga 1300 xg durante 10 min a 4 ° C en una microcentrífuga de sobremesa.
- Recuperar sobrenadante y colocar en un tubo de ultracentrífuga 5 ml. Añadir 750 l (~ 0,5 volúmenes) HB al tubo de microcentrífuga que contiene pellets y resuspender suavemente el pellet. Repita centrifugación y resuspensión pasos dos veces más. Piscina todos los sobrenadantes (S1a y S1b) en el mismo tubo de ultracentrífuga 5 ml por encima. Este paso sirve para eliminar los desechos pequeños.
- Centrífuga agruparon S1 utilizando una ultracentrífuga equipado con una podredumbre basculanteo y centrifugar a 17.000 xg durante 15 min a 4 ° C.
- Mantenga sobrenadante (S2) para su posterior procesamiento si la fracción citosólica es de interés (por ejemplo, para el análisis de Western blot). Resuspender el precipitado (P2), la fracción mitocondrial crudo, en 4 ml HB + 50 mM de KCl. Centrifugar 17.000 xg durante 15 min a 4 ° C en un rotor de cubeta oscilante. Descartar el sobrenadante y resuspender suavemente el pellet (P3) en 800 l HB.
NOTA: Las mitocondrias se lavaron con mM KCl + HB 50 para eliminar cualquier contaminante asociados mitocondrialmente no específicos. - En un nuevo tubo de ultracentrífuga 5 ml, añadir exactamente 800 l de precipitado resuspendido (P3).
- A este tubo agregar, 200 l de iodixanol (medio de gradiente de densidad), creando así una concentración final de 12% Iodixanol. Mezcle el contenido del tubo suavemente, pero a fondo a través de pipeteo con un P1000. La adición de iodixanol primero, y después se resuspendieron pellets (P3) pueden ser preferibles para facilitar la mezcla completa. Se centrifuga en un ultracentrifuge equipado con un rotor basculante a 17.000 xg durante 15 min a 4 ° C.
- NOTA: Hígado no contiene mielina y, por tanto, este paso no es necesario si se está procesando sólo el hígado. Sin embargo, si el hígado se está procesando al mismo tiempo que las mitocondrias del SNC, se recomienda para el tratamiento de todos los tejidos por igual.
- Aspirar la capa de mielina en la parte superior del tubo y cuidadosamente retirar y desechar el sobrenadante. Pellet puede estar suelto. Resuspender el precipitado en 4 ml HB. Centrifugar de nuevo a 17.000 xg durante 10 min a 4 ° C. Descartar el sobrenadante y resuspender el precipitado en 4 ml HB. Repetir la centrifugación y eliminar el sobrenadante.
- Resuspender el sedimento final (P7) en 100-200 l HB y transferir a un tubo de microcentrífuga de 1,7 ml. Esta muestra contiene mitocondrias aisladas.
- Proceder a la cuantificación de proteínas. Diluir las muestras y la curva estándar en el 2% de dodecilsulfato de sodio (SDS) para asegurar la solubilización adecuada de duri mitocondriasng cuantificación de proteínas.
3. Immunolabeling de mitocondrias aisladas de Citometría de Flujo
- Para cada mezcla de tinción a ensayar, una pipeta 25 g de mitocondrias aisladas en un tubo de microcentrífuga de 1,7 ml. Incluya una muestra sin mancha en cada experimento; y para cada anticuerpo, asegúrese de incluir una muestra para el control de isotipo apropiado.
- Centrifugar a 17.000 xg durante 2 min a 4 ° C en una microcentrífuga de sobremesa.
- Eliminar el sobrenadante y resuspender las mitocondrias aisladas en 50 l Buffer mitocondrias (M Buffer) suplementado con BSA libre de ácidos grasos 10% durante 15 min a 4 ° C (etapa de bloqueo).
NOTA: Durante el etiquetado, realizar incubaciones en un refrigerador a 4 ° C. - Añadir anticuerpo primario (anti-conejo Mfn2, 20 g por ml) al tubo y se incuba durante 30 min a 4 ° C.
NOTA: Determine la concentración óptima de cada anticuerpo empíricamente por titulación. Debido a la variabilidad en la concentración y / o pureza, diferentes lotes del mismo anticuerpo del mismo fabricante pueden llevar a diferentes resultados; Por lo tanto, se necesita de titulación para cada nuevo lote de anticuerpos. - Lave anticuerpo primario no unido: Se centrifuga a 17.000 xg durante 2 min a 4 ° C. Eliminar el sobrenadante y resuspender suavemente el sedimento en 200 l M Buffer. Se centrifuga a 17.000 xg durante 2 min a 4 ° C. Aspirar el sobrenadante y resuspender el precipitado en 50 l M Buffer.
- Añadir anticuerpo secundario (anti-conejo de burro IgG ficoeritrina (PE), 0,5 g por ml) al tubo e incubar las muestras durante 30 min a 4 ° C, protegido de la luz.
- Lave anticuerpo secundario no unido: Se centrifuga a 17.000 xg durante 2 min a 4 ° C. Eliminar el sobrenadante y resuspender el sedimento en 200 l M Buffer. Se centrifuga a 17.000 xg durante 2 min a 4 ° C. Aspirar el sobrenadante y resuspender el sedimento en 500 l M Buffer.
- Para asegurarse de eventos están en la mitocondria hecho, mancha aislada mitocondrias con unamitocondrias colorante fluorescente específico para 15 min a RT, protegido de la luz. Si se desea la tinción de otros parámetros funcionales (potenciales transmembrana mitocondrial o de producción de superóxido), continúe con el paso 4 Si no es así, continúe con el paso 5 para la adquisición.
NOTA: Es importante verificar que el espectro de emisión del anticuerpo secundario es compatible con la de los colorantes funcionales. Por ejemplo, si la verificación de la pureza mitocondrial con un colorante comercial con propiedades espectrales similares a FITC y potencial transmembrana con éster metílico de tetrametilrodamina (TMRM), un anticuerpo secundario viable sería aloficocianina (APC: Ex 650 nm / Em 660 nm). Añadir compensaciones controles, es decir, una muestra immunolabeled o teñido con un solo fluoróforo, cuando sea aplicable. - Transferir a un tubo adecuado para el flujo de carga citómetro. (Para facilitar el tamaño de muestra pequeño, un tubo de microtitulación se coloca dentro de 3 ml citómetro de flujo del tubo.) Mantener las muestras en hielo y se procederá de inmediato acitómetro de flujo para la adquisición.
4. Dosificación mitocondrial potencial transmembrana mitocondrial de superóxido y de Producción por Citometría de Flujo
- Verificar que las mitocondrias aisladas tienen un potencial transmembrana intactas mediante tinción con 100 nM TMRM (Ex 548 nm / Em 574 nm) 5, en el paso 3.8, durante 15 min a RT, protegido de la luz. Para la comparación de potencial transmembrana entre las muestras y las poblaciones, el uso de concentraciones menores / no extinción de la TMRM (1 a 30 nM), puede ser más apropiado 6.
- Como control para la tinción TMRM, aislado mancha mitocondrias con 100 nM TMRM en presencia de 100 mM fenil cianuro de carbonilo m-cloro hidrazina (CCCP), un desacoplador mitocondrial que despolarizar las mitocondrias. La concentración de CCCP requerido para despolarizar las mitocondrias puede ser menor si se utilizan concentraciones más bajas de tinte.
- Verifique que las mitocondrias aisladas producen superóxido mitocondrial por staining con un indicador de superóxido mitocondrial apropiado 7, también en el paso 3.8, durante 15 min a RT, protegido de la luz.
- Como control para la producción de superóxido mitocondrial, aislado mancha mitocondrias con el tinte en presencia de 10 mM antimicina A, un inhibidor del complejo III de la cadena respiratoria que aumentar la producción de superóxido mitocondrial.
5. Adquisición y Análisis de immunolabeled mitocondrias aisladas por citometría de flujo
- Instrumento creado: tensiones cambia de lineal a modo de registro para facilitar el análisis de las mitocondrias aisladas y voltajes establecidos (FSC: 450; SSC: 250). Asegúrese de que los eventos se recogen en el modo de FSC-A (área), así como FSC-W (ancho) y FSC-H (altura), para poder excluir dobletes (es decir, dos acontecimientos, que pasan por el detector al mismo tiempo ) en la recopilación de post-análisis de datos. Establecer el número de eventos que se percibe para 100.000. Adquirir los controles de compensación, En su caso.
- Adquisición de Datos: Antes de la adquisición de datos, evitar vortex muestras. En lugar mezclar golpeando suavemente el tubo. Inicialmente recopilar eventos en una baja presión, durante gating. Puerta en la población total. Ajuste tensiones de histogramas en consecuencia, por lo general el pico de la muestra sin teñir corresponderá a la segunda década (10 2). Una vez establecidas las puertas, y se están procesando las muestras, la presión puede ser cambiado a alta.
- Análisis: Visualice dobletes trazando FSC W frente a FSC. Identificar singletes y dobletes. Puerta en interiores. Seleccione la población mitocondrial, colocando puertas en los eventos que se tiñen positivamente con un tinte mitocondrial selectiva.
- Determinar el etiquetado de fondo de control de isotipo. Usando la muestra de control de isotipo, determinar el porcentaje de la población mitocondrial etiquetado positivo para el anticuerpo Mfn2.
Resultados
Las mitocondrias derivadas de médula espinal de rata se pueden immunolabeled con un anticuerpo dirigido a Mitofusin2 (Mfn2), una proteína implicada en la fusión de la membrana externa de las mitocondrias 8. Tras el aislamiento y el etiquetado con un anticuerpo específico Mfn2 y un anticuerpo secundario conjugado con fluorescencia, las mitocondrias son procesados por citometría de flujo (Figura 1). Después de la adquisición de datos, las muestras se analizaron mediante citometría de flujo de software de análisis, mediante la visualización de primera todos los eventos recogidos en un gráfico de puntos (Figura 2A). Dobletes y singletes se diferencian cuando los eventos se representan en la FSC, anchura (W) frente a área (A) (Figura 2B). Una vez que se seleccionan singletes, puerta la población mitocondrial a través de FSC / SSC (Figura 2C), y verificar el número de eventos tinción positiva para el tinte-mitocondria específica por la co-trazado de un histograma de la muestra sin teñir con una muestra teñida con la mitocondria-SPEtinte especí-. Para determinar los eventos mitocondriales, colocar una puerta en la intersección de los dos picos (Figura 2D). Para las preparaciones de la médula espinal, por lo general> 90% de los eventos son positivos para el tinte-mitocondria específico. Para otros tejidos como el hígado, ~ 98% de los eventos se etiqueta con el tinte (datos no mostrados). Después de seleccionar sólo eventos que etiquetan positivamente para el tinte-mitocondria específico, determinar el etiquetado de fondo con el control de isotipo mediante la selección de una puerta (Mfn2 +) que incluye 1% o menos de etiquetado de isotipo (Figura 2E, izquierda). Aplicar esta puerta de manera uniforme a todas las muestras marcadas con anticuerpo Mfn2 para determinar el porcentaje de las mitocondrias con Mfn2 presentes en la membrana mitocondrial externa (Figura 2E, derecha). En este experimento, 30% de las mitocondrias deriva de la etiqueta de la médula espinal positiva para Mfn2. Es importante señalar aquí, que aunque Mfn2 se considera que es un mit de expresión ubicuaochondrial proteína de membrana externa, no ha sido cuantificado previamente. Por otra parte, un análisis de inmuno Mfn2 en células cultivadas muestra un etiquetado no homogénea de las mitocondrias individuales 9. También es posible que el epítopo Mfn2 no estaba disponible debido a publicar translacional modificaciones o debido a las interacciones con sí mismo u otras parejas de unión. De nota, el anticuerpo en este estudio se generó usando un péptido sintético a la N-terminal (aminoácidos 38-55). Hay una variante de empalme predicho de Mfn2 carece de los primeros 302 aminoácidos, aunque esta variante aún no se ha confirmado experimentalmente (base de datos UniProt). Por lo tanto, este ensayo es incapaz de detectar Mfn2 corte y empalme alternativo carece de la secuencia N-terminal, dado el anticuerpo utilizado.
Potencial mitocondrial transmembrana (ΔΨ m) y la producción de superóxido pueden ser evaluados en este ensayo. Al otro lado de la membrana mitocondrial interna, hay una separación de la carga which impulsa la producción de ATP a través de la fosforilación oxidativa. TMRM es un colorante catiónico que se acumula dentro de las mitocondrias en una forma dependiente de potencial de membrana 5, y por lo tanto puede ser utilizado como un reportero de potencial transmembrana mitocondrial. La mayoría de las mitocondrias (95%) son TMRM después de la tinción positiva, en comparación con el control sin teñir (Figura 3A). Sin embargo, cuando se añade el desacoplador CCCP hay una disminución significativa en el número de mitocondrias capaz de retener TMRM (Figura 3A). CCCP permite el paso libre de iones a través de la membrana mitocondrial interna, esencialmente la destrucción de la separación de la carga y la despolarización de la membrana.
Las mitocondrias de liberación de superóxido como un subproducto normal de la fosforilación oxidativa de los complejos I y III de la cadena de transporte de electrones. Superóxido mitocondrial puede medirse a través de un colorante permeable de la membrana que está dirigida a la mitocondria y se convierte en Follo fluorescenteala una reacción con superóxido 7. Mitocondrias funcionales producen una cantidad basal de superóxido comparación con las muestras no teñidas (Figura 3B). La adición del inhibidor del complejo III antimicina A produce un aumento de la superóxido, como se ve por un desplazamiento hacia la derecha en la fluorescencia y un mayor número de mitocondrias (típicamente ~ 10%) que son fluorescentes con este colorante indicador superóxido mitocondrial (Figura 3B).

Figura 1. esquemática de aislamiento, immunolabeling y el análisis de las mitocondrias. Paso 1: Recopilar tejidos y homogeneizar. Paso 2: El procedimiento de aislamiento contiene ocho pasos de centrifugación. La mielina, una importante contención de tejido del sistema nervioso central se elimina mediante la dilución de las mitocondrias en Iodixanol (medio de gradiente de densidad) y centrifuging, resultando en la mielina flotante a la parte superior del tubo, mientras que las mitocondrias se sedimentan. Paso 3: Tras el aislamiento y la cuantificación, las mitocondrias están bloqueados, marcado con el anticuerpo primario y se lavó. A continuación se añade un anticuerpo secundario conjugado con un fluoróforo. El anticuerpo no unido se lava Paso 4:. En este punto tintes fluorescentes que informan sobre la pureza mitocondrial, o la función mitocondrial se pueden agregar Paso 5:. Mitocondrias están ya listos para ser analizadas por citometría de flujo.

Figura 2 Estrategia para el análisis de las mitocondrias aisladas por citometría de flujo. Los dispersión frontal (FSC) y la dispersión lateral (SSC) Tensiones debe ajustarse para pequeños eventos, utilizando ambos parámetros en modo logarítmico. Ancho FSC datos (FSC-W) debe serrecogido para excluir dobletes. Tenga en cuenta, en la mayoría de citómetros de flujo, la configuración predeterminada de FSC y SSC es el modo lineal. (A) Visualizar todos los eventos recogidos en un gráfico de puntos. (B) Los dobletes, dos mitocondrias que pasan por el láser a la vez, se puede distinguir de singletes por conspirar contra FSC FSC-W (modo lineal). Los eventos se excluyeron si el valor FSC-W es más del doble del valor de FSC-W media de la mayoría de los eventos, es decir, aquellos que son parte de la densa nube. Eventos bajo este umbral son una verja como singletes. (C) Una vez más, visualizar los eventos en un gráfico de puntos, y la puerta a los eventos restantes. (D) Representar la histograma de la muestra sin teñir (sólido, gris, lleno) y la muestra teñidas con un tinte mitocondrial específica (MSD: sólido, verde). Puerta de los eventos con tinción positiva para el MSD (MSD +). (E) Histograma del control de isotipo IgG de conejo (estrellados, negro) y Mfn2 muestra marcada (sólido, de color rosa).Ajuste la puerta a fin de dar ≤ 1% Mfn2 + en el pico de control de isotipo y aplicar esta misma puerta de la muestra experimental para determinar el porcentaje de eventos de etiquetado positivo para Mfn2 (Mfn2 +). Haga clic aquí para ver una versión más grande de este figura.
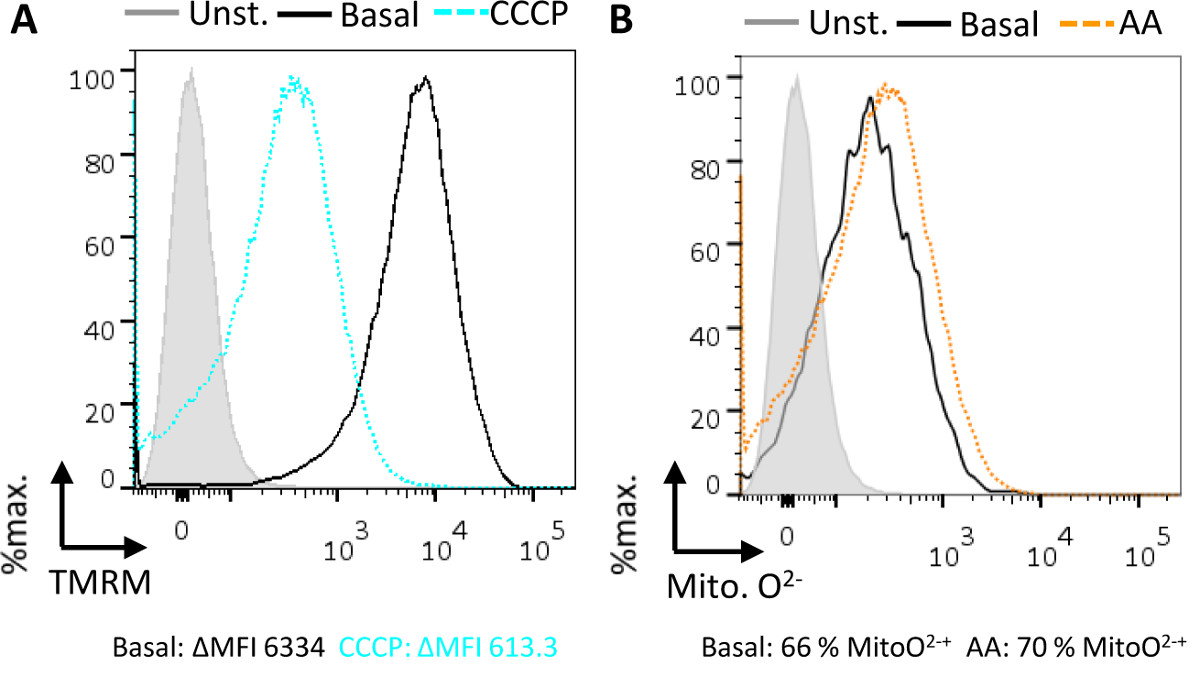
Figura 3. Dosificación potencial transmembrana mitocondrial (ΔΨ m) y producción de superóxido en mitocondrias aisladas mediante citometría de flujo. (A) en condiciones basales todas las mitocondrias activas etiquetar con TMRM (sólido, negro), en comparación con el control sin teñir (sólido, gris, relleno) debido a que el tinte se acumula en la mitocondria con un potencial transmembrana. Addi ción del CCCP protonóforo (discontinua, azul) se disipa el potencial transmembrana que causa la mitocondria para despolarizar y retener menos tinte comparación con las condiciones basales. Los datos se reportan como el delta intensidad media de fluorescencia (ΔMFI), que es la intensidad media de fluorescencia del control sin teñir resta de la intensidad media de fluorescencia de la muestra. (B) en condiciones basales, las mitocondrias producen superóxido como un subproducto de la oxidativo fosforilación. Esta fuente mitocondrial de superóxido se puede ensayar con un indicador de superóxido mitocondrial, (Mitoo 2: sólido, negro) en comparación con el control sin teñir (sólido, gris, rellenos). La adición del inhibidor del complejo III, antimicina A (trazos, naranja) se traduce en el aumento de la producción de superóxido, en comparación con los niveles basales. Los datos se reportan como el porcentaje de células con tinción positiva para el indicador Mitoo 2.k "> Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Es cada vez más evidente que las mitocondrias son actores clave en la fisiología normal y la enfermedad. Mientras inmunotransferencia puede determinar qué proteínas se encuentran dentro de las mitocondrias o en la superficie mitocondrial en una cierta condición, este método informes sobre la media de toda la población. Este método no puede dar información sobre la abundancia relativa de las subpoblaciones o subconjuntos mitocondriales. Si bien ha sido asumido previamente que todas las mitocondrias son iguales, el campo está reconociendo cada vez más que las mitocondrias dentro de una célula tienen una amplia variabilidad en cuanto a morfología y / o la función 10.
Enfoques de microscopía fluorescente tienen en cuenta la heterogeneidad de las mitocondrias. Sin embargo, la cuantificación de este tipo de datos es una labor intensiva. Además, este enfoque es más adecuado para los estudios que utilizan células cultivadas, como el etiquetado de las mitocondrias in vivo / in situ es difícil debido a las EXCESsive número de mitocondrias presentes, por lo que la diferenciación de los orgánulos individuales de por sí difícil. En la mayoría de los protocolos de inmunocitoquímica, tampoco es posible marcar simultáneamente proteínas de la membrana mitocondrial externa y evaluar la función mitocondrial debido a la etapa de permeabilización celular requerida para el etiquetado de anticuerpos. El método actual funciona con mitocondrias aisladas, y por lo tanto no requiere una etapa de permeabilización. Además, la visualización de las mitocondrias individuales sólo es posible a través de microscopía electrónica, que no es susceptible al análisis de la función mitocondrial. Dicho esto, reconocemos que el aislamiento de las mitocondrias del tejido conduce a la interrupción de la red mitocondrial y esto podría afectar a algunos elementos de la función mitocondrial. Sin embargo, las comparaciones de los aspectos funcionales de las mitocondrias aisladas de tejidos que se procesan de manera similar siguen siendo válidas.
Este método de inmunomarcación de isolat derivado de tejidoed mitocondria y posterior análisis por citometría de flujo permite un método rápido y cuantificable para detectar y controlar la presencia de una proteína localizada en la membrana externa. La detección de una proteína mitocondrial muy abundantes (como Mfn2) es posible con esta técnica. Del mismo modo, este método puede detectar las proteínas de baja abundancia que sólo se depositan en la membrana mitocondrial en la enfermedad, como SOD1 mal plegada en el contexto de la esclerosis lateral amiotrófica (ALS) 11. Además, este método podría ser útil para monitorizar las proteínas que transitoriamente se asocian con la superficie mitocondrial como parte de su función normal. Los ejemplos incluyen dynamin relacionados con la proteína-1 (Drp1), una proteína citosólica que se reclutó a la mitocondria para promover la fisión mitocondrial 12 y el factor asociado al receptor del factor de necrosis tumoral 6 (TRAF6), que se transloca a la mitocondria para aumentar las especies de oxígeno reactivas mitocondriales como una parte de una respuesta inmune innata 13.
En la actualidad esta técnica sólo es susceptible a proteínas situadas en la superficie mitocondrial, como protocolos de permeabilización estándar para el etiquetado intracelular requieren un detergente que interrumpe la integridad estructural de las mitocondrias. Mientras que un número de posibles reactivos se han intentado (sin publicar), una mayor optimización del protocolo immunolabeling sigue siendo necesaria para hacer este protocolo susceptible de detectar componentes intra-mitocondrial.
Esta técnica tiene amplias aplicaciones y se puede utilizar para detectar la presencia o el reclutamiento de una o más proteínas a la mitocondria en diferentes paradigmas experimentales. Además, las mitocondrias pueden co-marcaron con dos anticuerpos diferentes, así como con indicadores fluorescentes 11. Otras sondas fluorescentes también se podrían incorporar para caracterizar aspectos adicionales de la función mitocondrial. Por ejemplo, los colorantes disponibles en el mercado para controlar pH mitocondrial 14 , la absorción de calcio con calcio verde-5N 15, y ATP 16 niveles son posibles.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Damos las gracias a Laurie Destroismaisons y Sarah Peyrard de apoyo técnico excepcional y Dr.Alexandre Prat para el acceso al citómetro de flujo. También nos gustaría reconocer el Dr. Timothy Miller, por su contribución relativa a la retirada de la mielina de los preparativos. Esta labor fue apoyada por los Institutos Canadienses de Investigación en Salud (CIHR) Neuromuscular Asociación de Investigación de la Fundación Canadiense para la Innovación, Sociedad ALS de Canadá, la Fundación para la ELA Frick Investigación, Fundación CHUM y Fonds de la Recherche en Santé du Québec (CVV). Tanto CVV y NA son becarios de investigación del Fonds de la Recherche en Santé du Québec y CIHR Nuevos Investigadores. SP es apoyado por el Tim Noël Beca de la Sociedad ALS de Canadá.
Materiales
| Name | Company | Catalog Number | Comments |
| Rats | Charles River | Strain code 400 | Adult (9 weeks to 18 weeks) male or female rats can be used for the isolation protocol. Weight of rats is dependent on gender and age (males between 300 to 500 g and females between 200 to 350 g) are typically used. |
| Dounce homogenizer | Kontes Glass Co. | 885450-0022 | Duall 22 |
| Microcentrifuge | Thermo Scientific | Sorvall Legend Micro 17 R | |
| Ultra-Clear Ultracentrifuge tubes | Beckman Coulter | 344057 | Transparent, thin walled |
| Sorvall Ultracentrifuge | Thermo Scientific | Sorvall WX UltraSeries | |
| AH-650 rotor and buckets | Thermo Scientific | ||
| Opti-prep | Axis-Shield | 1114542 | Iodixanol, density gradient medium |
| Fatty acid free Bovine Serum Albumin | Sigma | A8806 | Must be fatty acid free for mitochondria |
| Sodium succinate dibasic hexahydrate | Sigma | S9637 | |
| Rabbit anti-Mitofusin2 antibody | Sigma | M6319 | |
| Rabbit IgG | Jackson Immuno Research | 011-000-003 | |
| Anti-Rabbit IgG PE | eBioscience | 12-4739-81 | |
| Micro titer tube | Bio-Rad | 223-9391 | For sample acquisition by flow cytometry |
| MitoTrackerGreen (MTG) | Invitrogen | M7514 | 100 nM: Ex 490 nm/Em 516 nm |
| TMRM | Invitrogen | T668 | 100 nM: Ex 548 nm/Em 574 nm |
| CCCP | Sigma | C2759 | |
| MitoSOX Red | Invitrogen | M36008 | 5 µM: Ex 540 nm/Em 600 nm |
| Antimycin A | Sigma | A8874 | |
| LSR II flow cytometer | BD | ||
| BD FACSDiva Software | BD | ||
| FlowJo | TreeStar Inc. | Software used for analysis | |
| BCA protein assay kit | Pierce/Thermo Scientific | 23225 | Bradford assay is not recomended as it is not compatible with high concentrations of SDS |
Referencias
- Itoh, K., Nakamura, K., Iijima, M., Sesaki, H. Mitochondrial dynamics in neurodegeneration. Trends Cell Biol. 23, 64-71 (2013).
- Narendra, D., Tanaka, A., Suen, D. F., Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy. J Cell Biol. 183, 795-803 (2008).
- Zorov, D. B., Kobrinsky, E., Juhaszova, M., Sollott, S. J. Examining intracellular organelle function using fluorescent probes: from animalcules to quantum dots. Circ Res. 95, 239-252 (2004).
- Vande Velde, C., Miller, T., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proc Natl Acad Sci U S A. 105, 4022-4027 (2008).
- Loew, L. M., Tuft, R. A., Carrington, W., Fay, F. S. Imaging in five dimensions: time-dependent membrane potentials in individual mitochondria. Biophys J. 65, 2396-2407 (1993).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50, 98-115 (2011).
- Xu, X., Arriaga, E. A. Qualitative determination of superoxide release at both sides of the mitochondrial inner membrane by capillary electrophoretic analysis of the oxidation products of triphenylphosphonium hydroethidine. Free Radic Biol Med. 46, 905-913 (2009).
- Otera, H., Ishihara, N., Mihara, K. New insights into the function and regulation of mitochondrial fission. Biochim Biophys Acta. 1833, 1256-1268 (2013).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Wikstrom, J. D., Twig, G., Shirihai, O. S. What can mitochondrial heterogeneity tell us about mitochondrial dynamics and autophagy. Int J Biochem Cell Biol. 41, 1914-1927 (2009).
- Pickles, S., Destroismaisons, L., Peyrard, S. L., Cadot, S., Rouleau, G. A., Brown, R. H. Jr, Julien, J. P., Arbour, N., Vande Velde, C. Mitochondrial damage revealed by immunoselection for ALS-linked misfolded SOD1. Hum Mol Genet. 22, 3947-3959 (2013).
- Frank, S., Gaume, B., Bergmann-Leitner, E. S., Leitner, W. W., Robert, E. G., Catez, F., Smith, C. L., Youle, R. J. The role of dynamin-related protein 1, a mediator of mitochondrial fission, in apoptosis. Dev Cell. 1, 515-525 (2001).
- West, A. P., Brodsky, I. E., Rahner, C., Woo, D. K., Erdjument-Bromage, H., Tempst, P., Walsh, M. C., Choi, Y., Shadel, G. S., Ghosh, S. TLR signalling augments macrophage bactericidal activity through mitochondrial ROS. Nature. 472, 476-480 (2011).
- Abad, M. F., Di Benedetto, G., Magalhães, P. J., Filippin, L., Pozzan, T. Mitochondrial pH monitored by a new engineered green fluorescent protein mutant. J Biol Chem. 279, 11521-11529 (2004).
- Murphy, A. N., Bredesen, D., Cortopassi, G., Wang, E., Fiskum, G. Bcl-2 potentiates the maximal calcium uptake capacity of neural cell mitochondria. Proc Natl Acad Sci U S A. 93, 9893-9898 (1996).
- Tantama, M., Martinez-François, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nat Commun. 4, 2550(2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados