Method Article
Assessment of Vascular rigenerazione nel SNC Utilizzo del Retina mouse
In questo articolo
Riepilogo
La retina roditore è da tempo riconosciuta come finestra accessibile al cervello. In questa nota tecnica fornendo un protocollo che utilizza il modello murino di retinopatia indotta da ossigeno per studiare i meccanismi che portano al fallimento di rigenerazione vascolare nel sistema nervoso centrale dopo lesione ischemica. Il sistema descritto può anche essere sfruttata per esplorare le strategie per promuovere la ricrescita dei vasi sanguigni funzionali all'interno della retina e del SNC.
Abstract
La retina roditore è forse il sistema mammiferi più accessibile in cui indagare interazione neurovascolare all'interno del sistema nervoso centrale (CNS). È sempre più riconosciuto che diverse malattie neurodegenerative come l'Alzheimer, la sclerosi multipla e la sclerosi laterale amiotrofica presentano elementi di compromissione vascolare. Inoltre, le cause più importanti di cecità nella popolazione in età pediatrica e di lavoro (retinopatia della prematurità e la retinopatia diabetica, rispettivamente) sono caratterizzate da degenerazione vascolare e il fallimento di fisiologica ricrescita vascolare. Lo scopo di questo documento tecnico è quello di realizzare un protocollo dettagliato per studiare la rigenerazione vascolare CNS nella retina. Il metodo può essere impiegato per chiarire i meccanismi molecolari che portano al fallimento di crescita vascolare dopo la lesione ischemica. Inoltre, i potenziali modalità terapeutiche per accelerare e ripristinare plessi vascolari sani possono essere esplorati. Giudizio richiederlod utilizzando l'approccio descritto può prevedere vie terapeutiche per retinopatie ischemiche come quella del diabete o prematurità ed eventualmente beneficiare di altri disturbi vascolari del sistema nervoso centrale.
Introduzione
Nel corso dello sviluppo del sistema nervoso centrale, nervi, cellule immunitarie e vasi sanguigni istituire reti notevolmente accoppiati per garantire un'adeguata perfusione tissutale e consentire la trasmissione delle informazioni sensoriali 1-5. La ripartizione dei sistemi vascolari risultati dell'ossigenazione tessutale insufficiente e fornitura metabolica compromesso ed è sempre più riconosciuto come un fattore importante per la patogenesi delle malattie neurodegenerative 6. Dropout vascolare e il deterioramento dell'unità neurovascolare all'interno del cervello, per esempio, è associato con demenza vascolare, lesioni vascolari della materia bianca del cervello 7 e il morbo di Alzheimer con stenosi delle arteriole e piccole imbarcazioni 8. Inoltre, alterata funzione barriera vascolare è pensato per contribuire sclerosi multipla 9 e sclerosi laterale amiotrofica 10.
Di rilevanza diretta per il modello retinica descritto in questo protocollo, accecantemalattie come la retinopatia diabetica 11 e retinopatia della prematurità 12, 13 sono caratterizzati da una fase precoce degenerazione vascolare. Lo stress ischemico conseguente sulla retina neurovascolare innesca una seconda fase di eccessiva e patologica neovascolarizzazione che probabilmente nasce come risposta compensatoria a ripristinare ossigeno e fornitura di energia 14-16. Una strategia attraente per superare lo stress ischemico che è fondamentale per la progressione della malattia è ripristinare reti vascolari funzionali specificamente nelle zone ischemiche del neuro-retina (figure 2 e 3). Provocando una risposta angiogenica controllata può venire attraverso come contro-intuitivo per una condizione in cui i trattamenti anti-angiogenici come anti-VEGF sono considerati trattamenti adattati. Eppure, la prova della validità di questo approccio è il montaggio. Ad esempio, aumentando "fisiologica-like" ricrescita vascolare in ischemretinopatie ic è stato elegantemente dimostrata attraverso l'introduzione di cellule precursori endoteliali 17, l'inibizione del VEGF Müller-cell espresso down-regulation indotta da altri fattori angiogenici 18, iniezione di progenitori mieloidi 19, l'inibizione della NADPH ossidasi apoptosi indotta 20, aumentando la dieta ω-3 acidi grassi polinsaturi assunzione di acido 21, il trattamento con un frammento carbossi-terminale del triptofano tRNA sintetasi 22, e somministrazione diretta di VEGF o FGF-2 per la protezione delle cellule gliali 23. Inoltre, abbiamo dimostrato che la modulazione classici spunti di orientamento neuronali quali Semaforine o netrins in retinopatie ischemiche accelera la rigenerazione vascolare dei vasi sani all'interno della retina e di conseguenza riduce angiogenesi patologica 24, 25. Di rilevanza clinica diretta, molti degli studi sugli animali di cui sopra forniscono la prova che la promozione re vascolaregenerazione durante la prima fase ischemica delle retinopatie può ridurre significativamente vista minacciando neovascolarizzazione retinica pre-19, 23, 24, 26, probabilmente attraverso la riduzione degli oneri ischemica.
L'elaborazione di strategie terapeutiche che stimolano la rigenerazione dei vasi funzionali rimane una sfida significativa per biologi vascolari. Qui si descrive un sistema sperimentale che utilizza il modello murino di ossigeno indotta retinopatia (OIR) per esplorare le strategie per modulare la ricrescita vascolare all'interno della retina. Sviluppato da Smith et al. Nel 1994 27, questo modello funge da proxy per retinopatie proliferative umane e consiste nell'esporre cuccioli di topo P7 al 75% O 2 fino a P12 e successivamente re-introdurre i cuccioli di ambiente della stanza O 2-tensione (Figura 1). Questo paradigma imita vagamente uno scenario in cui un neonato prematuro è ventilatocon O 2. L'esposizione dei cuccioli di topo all'iperossia provoca la degenerazione dei capillari retinici e microcircolo, e produce una superficie riproducibile di vaso-obliterazione (VO) in genere valutato caso di uscita dal O 2 a P12, anche se zona VO massima è raggiunta a 48 ore (P9) dopo esposizione a O 2 28. Nel topo, le zone VO avascolari rigenerano spontaneamente nel corso della settimana successiva reintroduzione di aria ambiente ed eventualmente zone VO sono completamente ri-vascolarizzati (Figura 2). Reintroduzione di aria ambiente di topi sottoposti a OIR provoca anche neovascolarizzazione pre-retinica (NV) (massimo a P17) che è in genere valutata per determinare l'efficacia di paradigmi di trattamento anti-angiogenici. Nella sua forma più pura, il modello OIR fornisce uno strumento altamente riproducibile e quantificabile per valutare la degenerazione vascolare indotta da ossigeno e determinare l'entità del distruttiva neovascolarizzazione pre-retinica 29-31.
Diversi paradigmi di trattamento esplorative che modulano la rigenerazione vascolare del SNC può essere studiato utilizzando il modello OIR compreso l'uso di composti farmacologici, terapia genica, delezione genica e altro ancora. La propensione di un determinato approccio di influenzare la ricrescita vascolare è valutata graduale nella finestra tra P12 (VO massimo dopo l'uscita da iperossia) e P17 (NV massima). Valutazione del risultato del trattamento su NV patologica può essere rapidamente e facilmente determinato in parallelo ed è stato accuratamente descritto da Stahl e colleghi 30, 31. Qui forniamo una semplice procedura step-by-step per studiare la modulazione di rivascolarizzazione fisiologico all'interno della retina neurale da composti farmacologici, potenziali terapie, vettori virali o di studiare l'influenza dei geni candidati in transgenici o knockout mice.
Protocollo
Dichiarazione etica: Tutto sperimentazione animale rispetta le linee guida per la cura degli animali, istituito dall'Associazione per la Ricerca e la Visione e Ophthalmology (ARVO) Dichiarazione per l'uso di animali in Oftalmica e Vision Research e del Consiglio canadese delle Animal Care.
1. Ossigeno indotta retinopatia (OIR)
- Data di nascita di cuccioli di topo come P0 Record.
- Registrare tutti i pesi degli animali al momento dell'entrata in O 2 al fine di garantire un adeguato intervallo di peso. Nota: Per C57BL / 6 topi a P17, il peso corporeo deve essere compresa tra 5 e 7,5 g per NV massimo 32. Al fine di mantenere la coerenza ambientale, si raccomanda di utilizzare cucciolata il controllo (per i topi geneticamente modificati, così come i topi ricevere trattamenti sperimentali). Nel valutare gli effetti di un vettore virale, si deve considerare tropismo del virus e consentire un tempo sufficiente per la piena espressione dei transgeni viralmente-consegnati. Rapidamente esprimere viralevettori quali 3 lentivirus terza generazione 24, 25, 33 sono raccomandati.
- Cuccioli posto del mouse a P7 (C57BL / 6 o desiderato deformazione) e una CD1 promozione madre in una camera di ossigeno a 75% O 2 per 5 giorni 27. Umidità ambiente e la temperatura sono stati mantenuti costanti per tutto O 2 esposizione. Nota: Strutture di ricerca equipaggiati con una sorgente centrale di O 2 sono ideali e limitano la sostituzione ingombrante di O 2 serbatoi vuoti. Se si lavora con transgenici o knockout topi, è importante garantire che il controllo e topi sperimentali sono acquisiti dal medesimo fornitore di limitare derive genetiche entro gli stessi ceppi 30, 29.
- A P12, togliere i topi dalla camera di ossigeno e tornare animali ambient O 2.
2. Iniezione intravitreale per la consegna dei composti al Retina interna (WhEffetti en Valutare di un composto farmacologico o proteina ricombinante)
- A P14, anestetizzare i topi con il 2% isoflurano in ossigeno 2 L / min (o di protezione degli animali comitato approvato anestetico di scelta). Al fine di verificare l'efficacia dell'anestesia, in sequenza pizzicare la coda, piede posteriore e l'orecchio con una pinza.
- Posizionare il mouse sulla pancia.
- Usando una siringa sterile 10 microlitri con ago tirato vetro smussato, eseguire una iniezione di un volume massimo di 1 ml di soluzione contenente il composto in fase di studio o veicolo (soluzione fisiologica) al limbus posteriore dell'occhio, con un 45 ° angolo evitando la lente. Nota: Il vetro-ago tirato è attaccato alla siringa con una goccia di resina epossidica.
- Applicare una goccia di lubrificante pomata oftalmica (idealmente con antibiotico) con un tampone per l'occhio del mouse.
- Ritorno il mouse torna alla gabbia con la promozione madre. I topi sono poi accuratamente controllati fino a quando recoperto e completamente ambulatoriale.
3. Valutazione della nave Perfusione e Barrier Function (Integrity) di angiografia con fluoresceina
- Anestetizzare i topi con il 2% isoflurano in ossigeno 2 L / min (o di protezione degli animali comitato approvato anestetico di scelta). Al fine di verificare l'efficacia dell'anestesia, in sequenza pizzicare la coda, piede posteriore e l'orecchio con una pinza. Nota: Questo è in genere eseguita a P17 quando viene valutata la rigenerazione. Carry out anche l'analisi a P19 e P21 per determinare se l'integrità vascolare è conservato nel tempo.
- Una volta anestetizzato, pesare il mouse.
- Effettuare una incisione addominale mediana con le forbici dissezione. Nota: gli strumenti per dissezione devono essere regolarmente controllati e affilate.
- Tagliare costole lateralmente e sollevare la gabbia toracica con l'ausilio di pinze. Nota: È necessario tagliare lateralmente come possibile per evitare danni al cuore.
- Dopo la rimozione peripHeral tessuto dal cuore, bloccare il aorta discendente con una pinza emostatica.
- Iniettare lentamente fluoresceina destrano al ventricolo sinistro utilizzando un ago G 25. Nota: Se la funzione di barriera vascolare è indagato, 70 kDa fluoresceina destrano è impiegato come sarà fuoriuscire delle navi quando integrità imbarcazione è compromessa. Se l'investigatore vuole lanciare vasi sanguigni, viene utilizzato 2 MDa fluoresceina destrano. Passaggi critici: 1) Per garantire una ripartizione omogenea, centrifuga fluoresceina destrano e iniettare il surnatante, 2) Al fine di prevenire la vasocostrizione, iniettare soluzione di fluoresceina destrano riscaldato, 3) Il suo tempo di circolazione non dovrebbe eccesso di 4 min.
- Decapitare topi 2 minuti dopo l'iniezione con le forbici operativi.
4. Enucleazione e la fissazione degli occhi
Nota: Nel valutare i tassi di rigenerazione vascolare, in primo luogo raccogliere retine in P12 e, in aggiunta a P14 e P17. Aumentare il numero di punto temporale campionatos per la determinazione più accurata dei tassi di rivascolarizzazione 24.
- Inclinare la testa del mouse e posizionarlo su un fianco.
- Togliere la pelle e le palpebre che coprono gli occhi con le forbici dissezione.
- Posizionare pinze curve sotto l'occhio e tirare delicatamente fino al nervo ottico è reciso.
- Girare la testa del topo sull'altro lato ed eseguire gli stessi passi (passi 4.2 e 4.3).
- Per garantire una migliore penetrazione del fissativo, perforare un foro nella camera anteriore dell'occhio utilizzando 30 ago G.
- Trasferire occhi in una provetta contenente 4% paraformaldeide (PFA) e fissare per 1 ora a temperatura ambiente.
- Rimuovere e lavare gli occhi PFA 4 volte con una soluzione di PBS ghiacciato.
5. Dissezione della retina
- Mettere gli occhi di topo in una capsula di Petri contenente PBS freddo e di eseguire la dissezione delle retine sotto uno stereomicroscopio.
- Rimuovere il grasso in / tessuto circostante l'occhio con micro-dissezione scissors.
- Tagliare la cornea con le forbici micro-dissezione.
- Utilizzando due coppie di pinze, minuziosamente sbucciare la sclera lontano dalla periferia verso il nervo ottico e scartare.
- Stringere la lente (sfera biancastra sotto la cornea) con una pinza ed estrarlo dalla tazza occhio. Utilizzare un paio di pinze come supporto, e l'altra per afferrare e sollevare con attenzione e rimuovere la lente.
- Staccare i vasi hyaloid dal lato interno della retina con piccoli pennelli (dimensione 0) e pinze.
- Rimuovere fasci di navi hyaloid collegati al disco ottico utilizzando una pinza.
- Trasferimento sezionato retine a 2 tubi ml microcentrifuga contenenti PBS e posto sul ghiaccio prima di avviare la procedura di colorazione.
6. Retina vascolare colorazione
- Incubare retine sezionato notte con delicata agitazione a 4 ° C in una soluzione di fluorescenza accoppiata isolectin B4 (rodamina-lectina o altro) in PBS contenente 1 mM CaCl 2 (a 1:100 diluizione di una soluzione B4 2 mg / ml isolectin raccomandata). Durante l'intera procedura di colorazione, tubi coprire con un foglio di alluminio o un foglio opaco al riparo dalla luce.
- Il giorno seguente, rimuovere la soluzione colorante e lavare retine 3x in PBS per 10 minuti a temperatura ambiente.
7. Preparazione della retina Flatmounts
- Trasferire retine, fotorecettori rivolto verso il basso, su un vetrino da microscopio e fare quattro profonde incisioni radiali equidistanti con un bisturi chirurgico per dividere la retina in quattro quadranti di uguale dimensione. Durante le incisioni, rinforzare la retina con una spazzola in modo che non si muove.
- Utilizzando due spazzole imbevute di PBS, appiattire con attenzione la quadranti fotorecettore lato verso il basso e immergere la retina in mezzo di montaggio per impedire fotometabolismo. Poi posizionare accuratamente un coprioggetto sulla superficie della retina montata senza applicare pressione e fare in modo che le bolle d'aria non si accumulano sotto il vetrino.
8. Imaging e quantificazione dei Vasoobliteration (VO) e neovascolarizzazione (NV), come descritto in precedenza 31
- Prendere immagini di retine intere montato con un microscopio a epifluorescenza con un ingrandimento di 10X.
- Aprire l'immagine retinica in software di editing fotografico, cucire insieme e misurare l'area retinica totale, e la zona avascolare. Area può essere espressa in pixel.
- Determinare misura di VO dividendo il numero di pixel nella zona avascolare per il numero di pixel nell'area retinica totale.
- Determinare misura di NV dividendo il numero di pixel di NV per il numero di pixel per la regione retinica totale come descritto 31.
Risultati
Il modello OIR è ampiamente utilizzato per studiare indotta da ossigeno degenerazione vascolare e neovascolarizzazione patologica indotta da ischemia nella retina ed è stato fondamentale nello sviluppo di attualmente impiegati trattamenti antiangiogenici per le malattie oculari 27, 29, 30. I risultati ottenuti con questo modello possono essere liberamente estrapolati per retinopatie ischemiche come la retinopatia diabetica proliferativa e la retinopatia della prematurità 30.
Qui vi presentiamo un uso alternativo di questo modello per studiare la rigenerazione vascolare. Descriveremo un esempio di una strategia per rigenerare la retina ischemica che è stato recentemente pubblicato dal nostro laboratorio. Nello studio presentato, dimostriamo che sostenuta ischemia neuronale attiva reticolo endoplasmatico (ER) lo stress e attraverso uno dei suoi endoribonucleases effettrici IRE1α, si unirà il mRNA del classico neuronale guida cue netrin-1. Mostriamoche intra-oculare consegna del Netrin-1, stimola un programma di angiogenesi riparativa in cellule mieloidi retiniche e quindi accelera la rivascolarizzazione del tessuto nervoso dopo OIR 25. Inoltre, forniamo un esempio di rigenerazione vascolare accelerata utilizzando lentivirale mediato silenziamento di IRE1α.
I paradigmi sperimentali descritte possono essere modificate per analizzare il trattamento esplorativa di scelta. È importante sottolineare che il punto di tempo di iniezione intravitreale è determinato in base alla natura del composto esplorato e deve tenere in considerazione il meccanismo con cui il trattamento indagato agisce. Ad esempio, per studiare un composto farmacologico (agonista del recettore antagonista, ecc), P14 può essere selezionato in quanto corrisponde ad un punto nel tempo in cui la rivascolarizzazione della retina è ancora accelerando un intervento rapido ad azione può contribuire ad accelerare il tasso di rivascolarizzazione (Figure 2 e 3a). Quando vettori virali sonoimpiegato, il tempo deve essere assegnato a consentire la piena espressione del gene passeggero e un punto temporale precedente può essere selezionato per garantire la piena espressione del transgene o pieno silenziamento del gene bersaglio (Figura 4). Vettori lentivirali base sono particolarmente adatti a questo riguardo per la loro espressione rapida, risposta infiammatoria basso e facilità di produzione 24, 25. E 'inoltre fondamentale accertarsi che il gene bersaglio è consegnato alla popolazione di cellule della retina del caso (RGC, cellule endoteliali, Müller cellulare, ecc), da cui il tropismo del vettore virale selezionato deve essere considerato. In alternativa, studiare il ruolo di un gene nella rigenerazione vascolare utilizzando transgenici o knockout animali offre il vantaggio di non dover effettuare iniezioni intraoculari.

Figura 1. Rappresentazione schematica del modello OIR del mouse. Cuccioli mouse e madri che allattano sono esposti al 75% O 2 da P7 a P12. È necessaria una camera di ossigeno ventilata con costante O 2 consegna e ossimetro. Durante questo periodo iniziale, retina vaso-obliterazione verifica. A P12, i topi vengono restituiti aria ambiente (21% O 2) fino a P17 quando si verifica la massima patologico trapunto pre-retinica. Neovascolarizzazione retrocede nei giorni successivi. Il periodo ideale per indagare la rigenerazione vascolare è la finestra tra P12 e P17. Campionamento e valutazione dei diversi punti di tempo per la portata del vaso-obliterazione è fondamentale per chiarire i tassi accurate di rivascolarizzazione.

Figura 2. Naturalmente il tempo di rivascolarizzazione retinica seguente ossigeno indotta vaso-obliterazione. A) rappresentazione grafica di una procedura flatmounting retinica. Un'incisione è fatta attraverso la parte superiore della cornea (nero-grigio cupola) e la sclera (linee rosse tratteggiate) e la retina è preso in giro. La lente può essere estratto o dopo l'apertura della cornea / sclera o una volta la sclera viene rimosso come mostrato nel diagramma. Navi ialoide vengono poi rimossi e la colorazione dei vasi retinici eseguiti. Una volta che il protocollo di colorazione è finito, la retina viene poi tagliato in 4 sezioni equidistanti e montato su un vetrino da microscopio nave-side-up. B) Lectin-macchiati retine flatmount da topi sottoposti a OIR. Come le navi rigenerano, l'area di vaso-obliterazione (qui massimo a P12) riempie dentro la neovascolarizzazione patologica è massima in P17 e appare come macchie saturi in lectine tinto retine OIR. Con P19-P21, retine hanno pienamente rigenerato le loro reti vascolari. (Questa cifra è stata modificata da Binet et al. Cell Metabolism 2013 25)
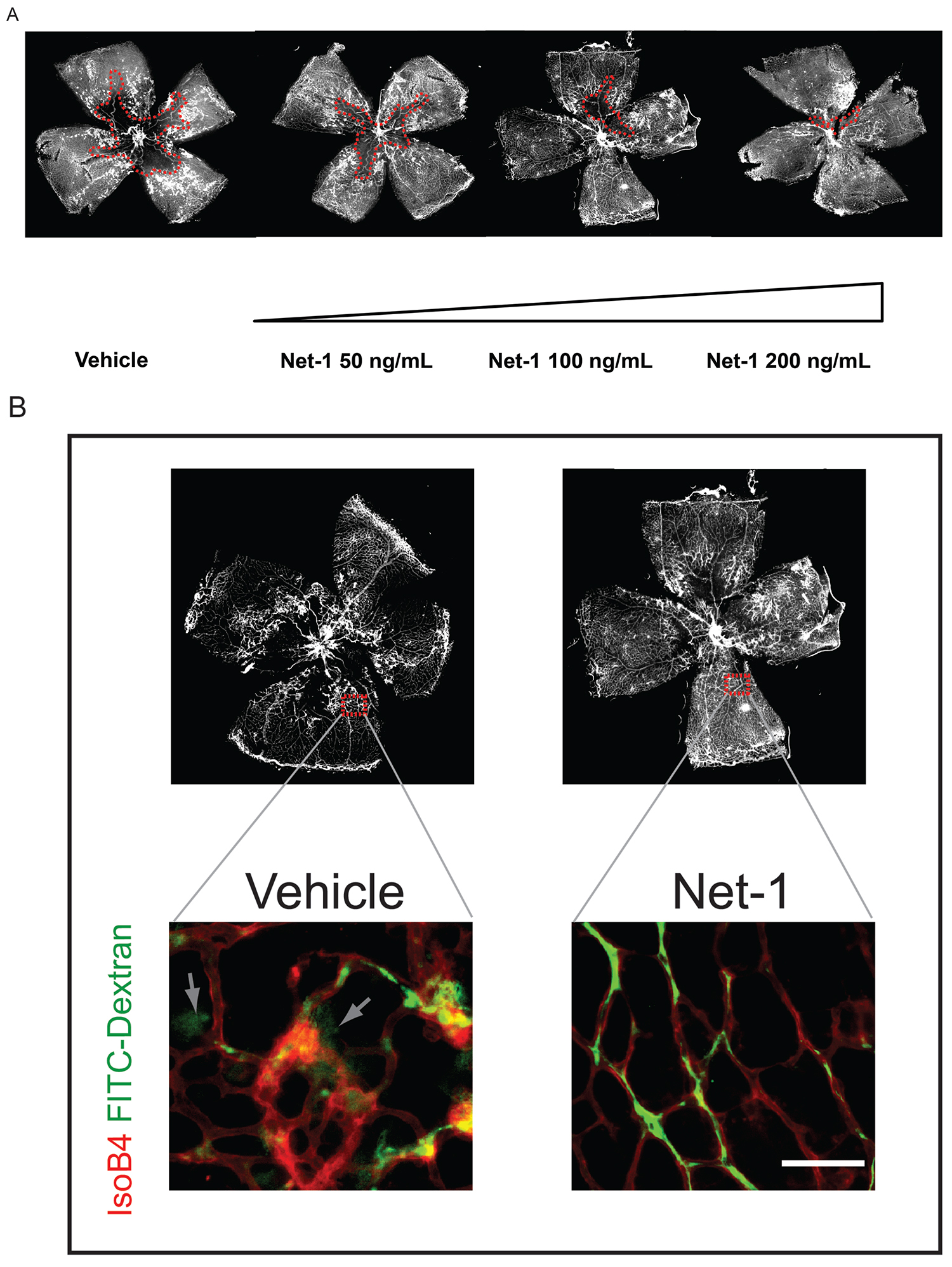
. Figura 3 Esempio di un trattamento iniettabile che accelera la rigenerazione vascolare retinica: Netrin-1. A) Netrin-1 viene iniettato in P14 e l'estensione della ricrescita vascolare valutata a P17. Un aumento dose-dipendente nella rigenerazione vascolare si osserva. Integrità B) vascolare può essere valutata mediante perfusione con un basso peso molecolare fluorescente Dextran. Se le navi mostrano la funzione di barriera compromessa, il destrano fluorescente colerà fuori del vaso (frecce). (Questa cifra è stata modificata da Binet et al. Cell Metabolism 2013 25)
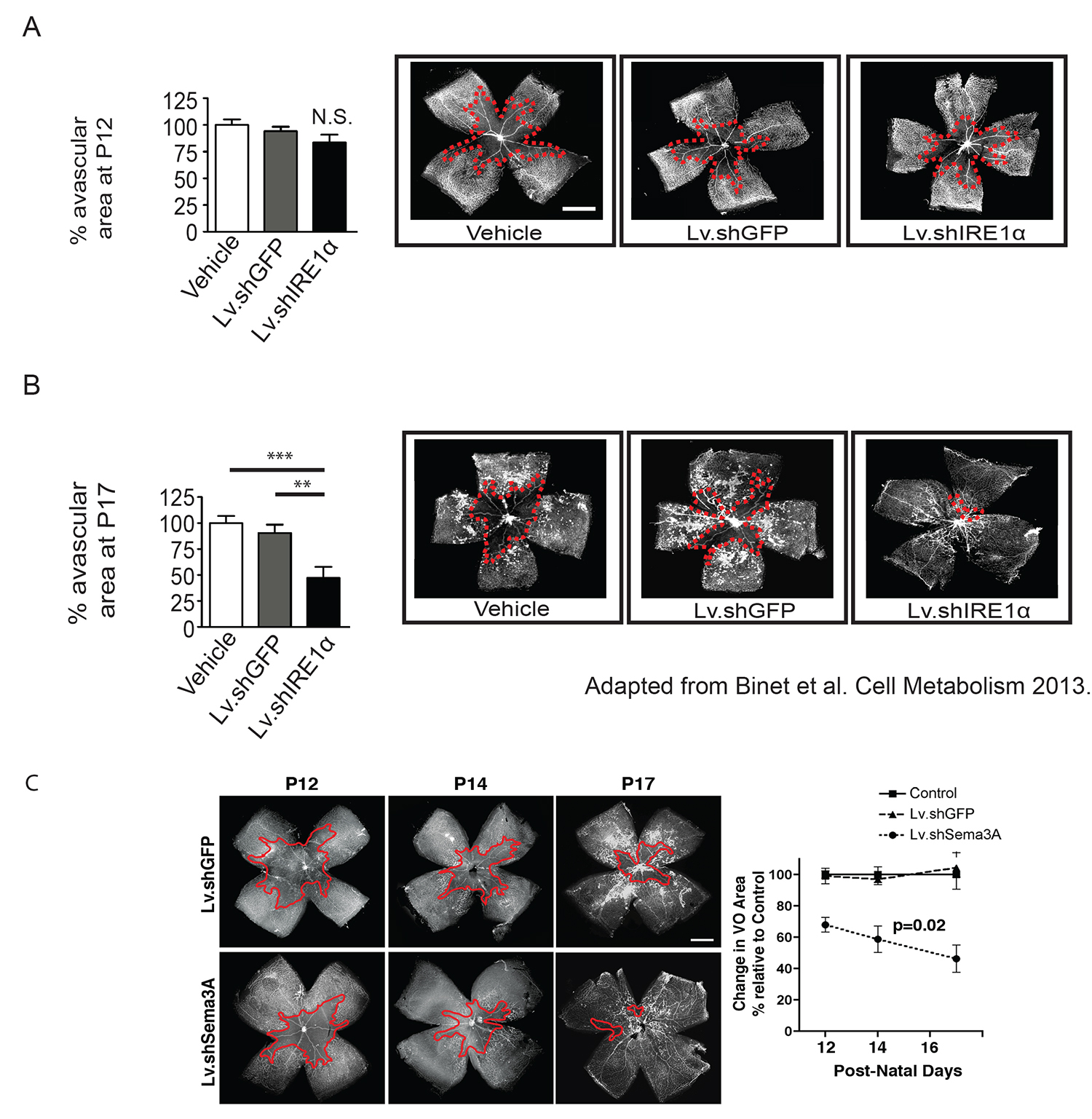
Figura 4. Esempio di silenziamento genico with lentivirali-consegnato shRNAs per la rigenerazione della retina vascolare:. Lv.shIRE1α Per valutare la capacità di silenziamento genico di IRE1α nei neuroni gangliari della retina per aiutare la rigenerazione vascolare, un'iniezione intravitreale di una codifica lentivirus per una shIRE1α è stato iniettato a P3 per consentire un tempo sufficiente per il silenziamento genico quando viene valutata la crescita vascolare e vaso-obliterazione. Il lentivirus 3 ° generazione impiegato in questo esempio contiene una glicoproteina virus della stomatite vescicolare modificate (VSV-G), progettati per indirizzare le membrane plasmatiche. Anche se questi vettori efficacemente infettare le cellule gangliari della retina, espressione può anche notare in altri tipi di cellule locali. (A) Questo trattamento non ha portato a variazioni notevoli in ossigeno indotta vaso-obliterazione, stabilita a P12, a significare che tutti i benefici osservati in vaso-obliterazione misurati in momenti successivi sono dovuti ad un aumento della rigenerazione vascolare. (B) Inibizione della IRE1α in questo paradigma migliorato drasticamente la rigenerazione vascolare nella fase di ricrescita di OIR a P17. (Questa cifra è stata modificata da Binet et al. Cell Metabolism 2013 25) (C) Valutare un punto terza volta di vaso-obliterazione come P14, è necessario per determinare i tassi accurate di rivascolarizzazione. (Questa cifra è stata modificata da Joyal et al. Sangue 2011 24) Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Qual è il modo più efficace per stimolare la crescita di nuovi vasi sani in tessuto nervoso ischemico? È terapeuticamente valida per interferire e accelerare naturalmente ricrescita vascolare? In patologie neuro-ischemica, quali retinopatie ischemiche o ictus, la degenerazione vascolare è associata a una ridotta funzione neuronale 35-38. Quindi, per contrastare il pregiudizio presto, ripristinando regionale micro-circolazione durante il segmento immediato / precoce della malattia può rivelarsi utile. In un contesto oculare, paradigmi sperimentali che accelerano rivascolarizzazione della retina ischemica riducono neovascolarizzazione patologica 21-25, 34 e quindi questo approccio merita ulteriori indagini.
Dalla sua introduzione 20 anni fa, il modello OIR 27 ha rivoluzionato la retina di ricerca angiogenesi 30. Qui forniamo una domanda supplementare di questo modello per lo studio prospettico strattegie di modulare rigenerazione vascolare fisiologico nella retina ischemica. Un modello animale ideale dovrebbe comprendere diversi criteri come la vicinanza agli umani pato-fisiologia, elevata riproducibilità, rapidità di esecuzione e, idealmente, a basso costo. Il modello murino di OIR soddisfa tutti questi criteri e può essere effettuata-out in meno di 3 settimane.
Nonostante i numerosi vantaggi elencati, svantaggi includono l'attuale necessità di sacrificare il mouse prima di analisi e monitoraggio, quindi, precisa longitudinale di un animale non è ancora possibile con strumenti di imaging attuali. Attualmente, vivo tecniche di imaging in quali ottobre o angiografia con fluoresceina sono in gran parte senza successo a causa della limitazione ottica intrinseca dell'occhio mouse (raggio di curvatura e di piccole dimensioni) che riduce la copertura di imaging 39 alle regioni più centrali della retina che non sono rilevanti per prime fasi del modello.
Quando impiegato per studiare la rigenerazione vascolare proposed in questo documento protocollo, tutte le considerazioni che si applicano allo studio della neovascolarizzazione devono essere monitorati. Questi includono registrazione peso animale per stimare la salute metabolica del cucciolo, che influenza fortemente angiogenesi 32. Accurato controllo della tensione di ossigeno nella camera di hyperoxic è anche critico. Variazione della concentrazione di ossigeno ha un impatto diretto sulla vasoobliteration, che può inevitabilmente portare a interpretazioni errate di dati critici. Si raccomanda pertanto di attuare o monitoraggio elettronico continuo della concentrazione di ossigeno da camera o in meno, monitorare le variazioni giornaliere nei livelli di ossigeno e limitare oxycycler apertura della porta per mantenere costanti i livelli di ossigeno. Elaborazione ottimale delle retine prende anche la pratica. Estrazione, il montaggio e la colorazione della retina deve essere eseguito con cura, come la retina relativamente fragile, devono essere trattati con delicatezza. Inoltre, come per tutti gli esperimenti con animali geneticamente modificati, la deriva genetica di una colonia cuna risultati confondenti. In assenza di una forza selettiva (in una colonia mouse, per esempio), il allelica o deriva genetica è un processo casuale che può portare a grandi cambiamenti della popolazione in un breve periodo di tempo. Frequenze alleliche possono cambiare di generazione in generazione e causare la formazione di una sub-colonia 40, 41. Queste mutazioni sono in gran parte inosservabile e pertanto è importante limitare il numero di generazioni prodotte dalle stesse coppie allevatore nella stessa colonia. Il modo più efficace per realizzare la massima stabilità genetica è quello di rinfrescare "scorte" ogni cinque generazioni o procedere alla backcrossing con un mouse acquistato a sfondo identico.
Si raccomanda inoltre di verificare le mutazioni degenerazione retinica (rd) 1 e 8 42, almeno una volta prima di iniziare una nuova linea al fine di evitare confusione fenotipi che possono essere attribuiti alla prematura degenerazione dei fotorecettori. Per gli animali transgenici,è di vitale importanza per garantire che sia di controllo e di topi mutanti sono ottenuti dallo stesso venditore e sono necessariamente sullo stesso background genetico.
Mentre continuiamo a chiarire i meccanismi molecolari della formazione dei vasi sanguigni e la crescita, nuovi approcci per accelerare, rallentare o evitare i vasi sanguigni nascenti stanno sorgendo. Un sistema modello in cui la modulazione della vascolarizzazione può essere esplorato in vivo in un contesto patologico può fornire un valido strumento per esplorare potenziali paradigmi terapeutici per contrastare ischemia neuronale nel sistema nervoso centrale. Adattare il modello OIR del mouse per studiare la rigenerazione vascolare offre un tale luogo e continuerà ad essere un valido strumento per migliorare la nostra comprensione della base molecolare per l'angiogenesi fisiologica e patologica.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
PS detiene una Canada Research Chair in biologia delle cellule della retina e la Alcon Research Institute di New Investigator Award. Questo lavoro è stato sostenuto da sovvenzioni dal Canadian Institutes of Health Research (221.478), la Canadian Diabetes Association (OG-3-11-3329-PS), le scienze naturali e ingegneria Research Council del Canada (418.637) e The Foundation Fighting Blindness Canada. Il sostegno è stato fornito anche dal Reseau de Recherche en Santé de la Vision du Québec.
Materiali
| Name | Company | Catalog Number | Comments |
| C57Bl/6 mice ((Other strains may be used; angiogenic response varies from one strain to the other) | |||
| CD1 nursing mothers | Vendor of choice | ||
| Operating Scissors straight | World Precision Instruments | 14192 | |
| Dissecting Scissors straight | World Precision Instruments | 14393 | |
| Vannas Eye Scissors | Harvard Apparatus | 72-8483 | |
| Iris Forceps, curved, serrated | World Precision Instruments | 15915 | |
| Brushes 362R size 0 | Dynasty | ||
| Dumont Forceps #3; straight | World Precision Instruments | 500338 | |
| Surgical Blade, size 10 | Bard-Parker | 371110 | |
| Rhodamine Griffonia (Bandeiraea) Simplicifolia Lectin I | Vector Laboratories, Inc | RL-1102 | |
| Microscope slides | VWR | 16004-368 | |
| Fluoromount G | Electron Microscopy Sciences | 17984-25 | |
| Zeiss Axio Observer Z1 Inverted Phase and Fluorescence Microscope | Zeiss | ||
| Leica MZ9.5 Stereomicroscope | Leica | ||
| Fluorescein isothicyanate-dextran, 70000 | Sigma-Aldrich | 46945 |
Riferimenti
- Carmeliet, P., Tessier-Lavigne, M. Common mechanisms of nerve and blood vessel wiring. Nature. 436, 193-200 (2005).
- Eichmann, A., Thomas, J. L. Molecular Parallels between Neural and Vascular Development. Cold Spring Harb Perspect Med. 3, (2012).
- Larrivee, B., Freitas, C., Suchting, S., Brunet, I., Eichmann, A. Guidance of vascular development: lessons from the nervous system. Circ Res. 104, 428-441 (2009).
- Stefater Iii, J. A., et al. Regulation of angiogenesis by a non-canonical Wnt-Flt1 pathway in myeloid cells. Nature. 474, 511-515 (2011).
- Checchin, D., Sennlaub, F., Levavasseur, E., Leduc, M., Chemtob, S. Potential role of microglia in retinal blood vessel formation. Invest Ophthalmol Vis Sci. 47, 3595-3602 (2006).
- Quaegebeur, A., Lange, C., Carmeliet, P. The neurovascular link in health and disease: molecular mechanisms and therapeutic implications. Neuron. 71, 406-424 (2011).
- Yamamoto, Y., Craggs, L., Baumann, M., Kalimo, H., Kalaria, R. N. Review: molecular genetics and pathology of hereditary small vessel diseases of the brain. Neuropathol Appl Neurobiol. 37, 94-113 (2011).
- Brun, A., Englund, E. A white matter disorder in dementia of the Alzheimer type: a pathoanatomical study. Ann Neurol. 19, 253-262 (1986).
- Prat, A., et al. Migration of multiple sclerosis lymphocytes through brain endothelium. Arch Neurol. 59, 391-397 (2002).
- Rule, R. R., Schuff, N., Miller, R. G., Weiner, M. W. Gray matter perfusion correlates with disease severity in ALS. Neurology. 74, 821-827 (2010).
- Antonetti, D. A., Klein, R., Gardner, T. W. Diabetic retinopathy. N Engl J Med. 366, 1227-1239 (2012).
- Hartnett, M. E., Penn, J. S. Mechanisms and management of retinopathy of prematurity. N Engl J Med. 367, 2515-2526 (2012).
- Sapieha, P., et al. Retinopathy of prematurity: understanding ischemic retinal vasculopathies at an extreme of life. J Clin Invest. 120, 3022-3032 (2010).
- Chen, J., Smith, L. Retinopathy of prematurity. Angiogenesis. 10, 133-140 (2007).
- Cheung, N. Diabetic retinopathy and systemic vascular complications. Progress in Retinal and Eye Research. 27, 161-176 (2008).
- Smith, L. E. Through the eyes of a child: understanding retinopathy through ROP the Friedenwald lecture. Invest Ophthalmol Vis Sci. 49, 5177-5182 (2008).
- Caballero, S., et al. Ischemic vascular damage can be repaired by healthy, but not diabetic, endothelial progenitor cells. Diabetes. 56, 960-967 (2007).
- Wang, H., et al. VEGF-mediated STAT3 activation inhibits retinal vascularization by down-regulating local erythropoietin expression. Am J Pathol. 180, 1243-1253 (2012).
- Ritter, M. R., et al. Myeloid progenitors differentiate into microglia and promote vascular repair in a model of ischemic retinopathy. J Clin Invest. 116, 3266-3276 (2006).
- Saito, Y., Geisen, P., Uppal, A., Hartnett, M. E. Inhibition of NAD(P)H oxidase reduces apoptosis and avascular retina in an animal model of retinopathy of prematurity. Mol Vis. 13, 840-853 (2007).
- Connor, K. M., et al. Increased dietary intake of omega-3-polyunsaturated fatty acids reduces pathological retinal angiogenesis. Nat Med. 13, 868-873 (2007).
- Banin, E., et al. T2-TrpRS inhibits preretinal neovascularization and enhances physiological vascular regrowth in OIR as assessed by a new method of quantification. Invest Ophthalmol Vis Sci. 47, 2125-2134 (2006).
- Dorrell, M. I., et al. Maintaining retinal astrocytes normalizes revascularization and prevents vascular pathology associated with oxygen-induced retinopathy. Glia. 58, 43-54 (2010).
- Joyal, J. -. S., et al. Ischemic neurons prevent vascular regeneration of neural tissue by secreting semaphorin 3A. Blood. 117, 6024-6035 (2011).
- Binet, F., et al. Neuronal ER Stress Impedes Myeloid-Cell-Induced Vascular Regeneration through IRE1alpha Degradation of Netrin-1. Cell Metab. 17, 353-371 (2013).
- Fukushima, Y., et al. Sema3E-PlexinD1 signaling selectively suppresses disoriented angiogenesis in ischemic retinopathy in mice. J Clin Invest. 121, 1974-1985 (2011).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Invest Ophthalmol Vis Sci. 35, 101-111 (1994).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefes Arch Clin Exp Ophthalmol. 247, 1205-1211 (2009).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4, 1565-1573 (2009).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Invest Ophthalmol Vis Sci. 51, 2813-2826 (2010).
- Stahl, A., et al. Computer-aided quantification of retinal neovascularization. Angiogenesis. 12, 297-301 (2009).
- Stahl, A., et al. Postnatal Weight Gain Modifies Severity and Functional Outcome of Oxygen-Induced Proliferative Retinopathy. Am J Pathol. 177, 2715-2723 (2010).
- Cerani, A., et al. Neuron-Derived Semaphorin 3A is an Early Inducer of Vascular Permeability in Diabetic Retinopathy via Neuropilin-1. Cell Metabolism. 18, 505-518 (2013).
- Sapieha, P. Eyeing central neurons in vascular growth and reparative angiogenesis. Blood. 120, 2182-2194 (2012).
- Dorfman, A., Dembinska, O., Chemtob, S., Lachapelle, P. Early manifestations of postnatal hyperoxia on the retinal structure and function of the neonatal rat. Invest Ophthalmol Vis Sci. 49, 458-466 (2008).
- Dorfman, A. L., Joly, S., Hardy, P., Chemtob, S., Lachapelle, P. The effect of oxygen and light on the structure and function of the neonatal rat retina. Doc Ophthalmol. 118, 37-54 (2009).
- Chopp, M., Zhang, Z. G., Jiang, Q. Neurogenesis, angiogenesis, and MRI indices of functional recovery from stroke. Stroke. 38, 827-831 (2007).
- Li, L., et al. Angiogenesis and improved cerebral blood flow in the ischemic boundary area detected by MRI after administration of sildenafil to rats with embolic stroke. Brain Res. 1132, 185-192 (2007).
- Robinson, R., Barathi, V. A., Chaurasia, S. S., Wong, T. Y., Kern, T. S. Update on animal models of diabetic retinopathy: from molecular approaches to mice and higher mammals. Dis Model Mech. 5, 444-456 (2012).
- Chia, R., Achilli, F., Festing, M. F., Fisher, E. M. The origins and uses of mouse outbred stocks. Nat Genet. 37, 1181-1186 (2005).
- Jenuth, J. P., Peterson, A. C., Shoubridge, E. A. Tissue-specific selection for different mtDNA genotypes in heteroplasmic mice. Nat Genet. 16, 93-95 (1997).
- Mattapallil, M. J., et al. The Rd8 mutation of the Crb1 gene is present in vendor lines of C57BL/6N mice and embryonic stem cells, and confounds ocular induced mutant phenotypes. Investigative ophthalmolog., & visual science. 53, 2921-2927 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon