Method Article
Beurteilung der Gefäß Regeneration im ZNS Verwenden der Maus Retina
In diesem Artikel
Zusammenfassung
Das Nagetier Retina wurde lange als eine zugängliche Fenster zum Gehirn erkannt. In diesem Fachbeitrag stellen wir ein Protokoll, das die Maus-Modell der Sauerstoff-induzierten Retinopathie, die Mechanismen, die zum Versagen der vaskulären Regeneration im zentralen Nervensystem nach einem ischämischen Verletzungen führen studieren beschäftigt. Das beschriebene System kann auch genutzt werden, um Strategien zu erkunden, um das Nachwachsen der funktionellen Blutgefäße in der Netzhaut und ZNS zu fördern.
Zusammenfassung
Das Nagetier Retina ist vielleicht die am besten zugänglichen Säugetiersystem in dem Gefäßnervenzusammenspiel innerhalb des zentralen Nervensystems (ZNS) zu untersuchen. Es wird zunehmend erkannt, dass neurodegenerative Erkrankungen wie Alzheimer, Multiple Sklerose und amyotrophe Lateralsklerose vorliegenden Elemente Blutungsstörungen. Darüber hinaus sind die prominentesten Ursachen von Blindheit bei Kindern und erwerbsfähigen Alter Populationen (Frühgeborenen-Retinopathie und diabetische Retinopathie, respectively) durch vaskuläre Degeneration und Versagen physiologischer Gefäß Nachwachsen aus. Das Ziel dieser Arbeit ist es, technische ein ausführliches Protokoll zu bieten CNS vaskuläre Regeneration in der Netzhaut zu untersuchen. Das Verfahren kann eingesetzt werden, um die molekularen Mechanismen, die zum Ausfall von Gefäßwachstum nach der ischämischen Schädigung führen aufzuklären. Darüber hinaus können potentielle therapeutische Modalitäten zu beschleunigen und Wiederherstellung gesunder Gefäßgeflechte erkundet werden. Würdigung obtained mit dem beschriebenen Ansatz kann therapeutische Wege für ischämische Retinopathien wie die von Diabetes oder Frühgeburten stellen und möglicherweise profitieren andere vaskuläre Erkrankungen des ZNS.
Einleitung
Während ZNS-Entwicklung, Nerven, Immunzellen und Blutgefäße zu etablieren bemerkens Netzwerke gekoppelt, um eine ausreichende Gewebedurchblutung zu gewährleisten und damit die Übertragung von sensorischen Informationen 5.1. Die Aufschlüsselung der Gefäßsysteme führt zu einer unzureichenden Sauerstoffversorgung des Gewebes und Stoffwechselversorgung gefährdet und wird zunehmend als wichtiger Faktor für die Pathogenese von neurodegenerativen Erkrankungen 6 anerkannt. Gefäß Dropout und die Verschlechterung der neurovaskuläre Einheit innerhalb des Gehirns, beispielsweise mit vaskulärer Demenz, vaskuläre Läsionen der weißen Substanz des Gehirns 7 und der Alzheimer-Krankheit mit einer Stenose von Arteriolen und kleinen Gefäße 8 verbunden. Darüber hinaus beeinträchtigt vaskulären Barrierefunktion gedacht, Multiple Sklerose 9 und amyotropher Lateralsklerose 10 beitragen.
Von unmittelbarer Relevanz für die in diesem Protokoll beschrieben, blendendes NetzhautmodellKrankheiten wie diabetischer Retinopathie und 11 Frühgeborenen-Retinopathie 12, 13 sind durch eine Phase der frühen vaskulären Degeneration ist. Die anschließende ischämische Belastung der Gefäß-Nerven-Netzhaut löst eine zweite Phase der übermäßigen und pathologische Gefäßneubildung, die wahrscheinlich stammt als kompensatorische Reaktion auf die wieder einzusetzen Sauerstoff-und Energieversorgung 14-16. Eine attraktive Strategie, um den ischämischen Stress, der zentrale Fortschreiten der Krankheit ist, zu überwinden, ist funktionelle Gefäßnetze insbesondere in den ischämischen Zonen des Neuronetzhaut (Fig. 2 und 3) wiederherzustellen. Eine kontrollierte Provokation angiogene Reaktion kann über so unlogisch für einen Zustand, in dem anti-angiogenen Therapien wie Anti-VEGF-Behandlungen werden als angepasst betrachtet kommen. Doch Beweise für die Gültigkeit dieses Ansatzes ist die Montage. Zum Beispiel, Verbesserung der "physiologischen-like" Gefäß Nachwachsen in ischemic Retinopathien wurde elegant durch die Einführung von endothelialen Vorläuferzellen 17, Hemmung der Müller-Zelle exprimiert VEGF induzierte Herunterregulation der anderen angiogenen Faktoren 18, Injektion von myeloischen Vorläuferzellen 19, Hemmung der NADPH-Oxidase-induzierte Apoptose 20, zunehmende Nahrungs ω-3 mehrfach ungesättigten Fettsäuren nachgewiesen Säurezufuhr 21, die Behandlung mit einer Carboxy-terminale Fragment von Tryptophan tRNA-Synthetase 22 und die direkte Verabreichung von VEGF oder FGF-2 zum Schutz der Gliazellen 23. Darüber hinaus haben wir gezeigt, dass die Modulation der neuronalen klassischen Führungssignale wie Semaphorine oder netrins bei ischämischen Retinopathien beschleunigt vaskuläre Regeneration gesunder Gefäße in der Netzhaut und reduziert pathologische Angiogenese 24, 25. Der direkte klinische Relevanz, mehrere der genannten Tierstudien belegen, dass die Förderung der GefäßwiederGeneration in der frühen Phase der ischämischen Retinopathien deutlich reduzieren kann visusbedrohenden Pre-Netzhaut-Neovaskularisation 19, 23, 24, 26, wahrscheinlich durch die Reduktion von ischämischen Belastung.
Erarbeitung von therapeutischen Strategien, die Regeneration von Gefäßen anregen Funktions bleibt eine große Herausforderung für Gefäßbiologen. Hier beschreiben wir ein experimentelles System, das die Maus-Modell der Sauerstoff-induzierten Retinopathie (ÖIR), um Strategien zu erkunden, um das Nachwachsen der Gefäß in der Netzhaut zu modulieren beschäftigt. Entwickelt von Smith et al. Im Jahr 1994 27, dient dieses Modell als Proxy für den menschlichen proliferative Retinopathie und besteht aus frei P7 Maus Welpen zu 75% O 2 bis P12 und anschließend wieder die Einführung der Welpen auf Umgebungs Raum O 2-Spannung (Abbildung 1). Dieses Paradigma lose imitiert ein Szenario, wo ein Frühgeborenen ist belüftetmit O 2. Die Belichtung der Maus Welpen Hyperoxie provoziert Degeneration der Netzhaut-Kapillaren und Mikrogefäße und führt zu einem reproduzierbaren Bereich der Vaso-Verödung (VO), die typischerweise beim Austritt aus O 2 bei P12 beurteilt, obwohl maximal VO Bereich bei 48 h (P9) nach Erreichen Exposition gegenüber O 2 28. In der Maus, die avaskuläre Zonen VO spontan im Laufe der Woche zu regenerieren folgenden Wiedereinführung der Raumluft und schließlich VO Zonen sind komplett neu vaskularisiert (Abbildung 2). Wiedereinführung der Raumluft von Mäusen OIR unterworfen provoziert auch vorge retinale Neovaskularisation (NV) (maximal bei P17), die normalerweise beurteilt wird, um die Wirksamkeit von anti-angiogenen Behandlung Paradigmen bestimmen. In seiner reinsten Form stellt die OIR Modell eine hoch reproduzierbare und quantifizierbare Werkzeug, um Sauerstoff-induzierten vaskulären Degeneration bewerten und bestimmen das Ausmaß der zerstörerischen Pre-Netzhaut-Neovaskularisation 29-31.
Verschiedene explorative Behandlung Paradigmen, die vaskuläre Regeneration ZNS modulieren kann mit dem Modell OIR einschließlich der Verwendung von pharmakologischen Verbindungen, Gentherapie, Gen-Deletion und mehr untersucht werden. Die Neigung eines bestimmten Ansatz zur Gefäß Nachwachsen beeinflussen bewertet wird schrittweise in das Fenster zwischen P12 (maximal VO nach dem Austritt aus Hyperoxie) und P17 (maximal NV). Auswertung der Behandlungsergebnisse auf pathologische NV kann schnell und einfach ermittelt werden parallel und gründlich von Stahl und Kollegen 30, 31 beschrieben. Hier bieten wir Ihnen einen einfachen Schritt-für-Schritt-Verfahren, um die Modulation der physiologischen Revaskularisierung innerhalb der neuronalen Netzhaut durch pharmakologische Verbindungen, prospektive Therapeutika, virale Vektoren zu untersuchen oder um den Einfluss von Kandidatengenen in transgenen oder Knockout-Mäusen zu studieren.
Protokoll
Ethik-Erklärung: Alle Tierversuche hält die Tierpflege Richtlinien der Association for Research in Vision and Ophthalmology (ARVO) Erklärung für die Nutzung von Tieren in Ophthalmic und Vision Research und der kanadischen Rat der Tierpflege etabliert.
1. Sauerstoff induzierte Retinopathie (ÖIR)
- Rekord Geburtsdatum der Maus Welpen als P0.
- Notieren Sie alle Gewicht der Tiere bei der Einreise in O 2, um eine ausreichende Gewichtsbereich zu gewährleisten. Hinweis: Bei C57BL / 6 Mäusen bei P17, sollte das Körpergewicht zwischen 5 und 7,5 g für maximal 32 NV reichen. Um die Umwelt Konsistenz zu erhalten, empfiehlt es sich, Geschwistern als Kontrolle (für die genetisch veränderten Mäuse sowie Mäuse, die experimentelle Behandlungen) zu verwenden. Bei der Beurteilung der Auswirkungen eines viralen Vektors, muss man Tropismus des Virus zu berücksichtigen und genügend Zeit für vollen Ausdruck Viren-Transgene geliefert. Schnell ausdrücken VirusVektoren, wie der 3. Generation Lentiviren 24, 25, 33 werden empfohlen.
- Bewegen Sie die Maus Welpen bei P7 (C57BL / 6 oder gewünschten Stamm) und eine CD1 Förderung Mutter in eine Sauerstoffkammer bei 75% O 2 für 5 Tage 27 gesetzt. Umwelt Luftfeuchtigkeit und Temperatur wurden während O 2-Exposition konstant gehalten. Hinweis: Forschungseinrichtungen mit einer zentralen Quelle von O 2 ausgestattet sind ideal und die umständliche Austausch der leeren A-2-Panzer zu begrenzen. Bei der Arbeit mit transgenen oder Knockout-Mäusen, ist es wichtig, sicherzustellen, dass Kontroll-und Versuchs Mäuse werden von dem selben Anbieter erworben, um genetische Drift innerhalb der gleichen Stämme 30, 29 zu begrenzen.
- Bei P12, entfernen Mäuse aus der Sauerstoffkammer und Rück Tiere zu O 2 Umgebungs.
2. Intravitreale Injektion für die Lieferung von Verbindungen zum inneren Retina (Whde Beurteilung der Auswirkungen einer Pharmakologische Verbindung oder rekombinantem Protein)
- Bei P14, betäuben Mäuse mit 2% Isofluran in Sauerstoff 2 l / min (oder Tierschutz-Ausschuss genehmigt Betäubung der Wahl). Um die Wirksamkeit der Anästhesie zu überprüfen, nacheinander den Schwanz kneifen, hinteren Fuß und Ohr mit einer Pinzette.
- Platzieren Sie die Maus auf seinem Bauch.
- Verwendung einer sterilen Spritze mit 10 ul einer abgeschrägten zogenen Glasnadel angebracht, führen eine Injektion mit einem maximalen Volumen von 1 &mgr; l der Lösung, die die Verbindung untersucht oder Vehikel (physiologische Kochsalzlösung) an der hinteren Hornhautrand des Auges, mit einem 45 ° Winkel Vermeidung der Linse. Hinweis: Die gezogen Glas-Nadel an der Spritze mit einem Tropfen Epoxidharz befestigt.
- Geben Sie einen Tropfen Schmiermittel Augensalbe (idealerweise mit Antibiotikum) mit einem Tupfer auf das Auge des Maus.
- Bringen Sie die Maus wieder in den Käfig mit der Förderung Mutter. Mäuse werden dann sorgfältig überwacht, bis wiederbedeckt und uneingeschränkt gehfähig.
3. Beurteilung der Perfusion und Vessel Barrier Function (Integrität) durch Fluorescein-Angiographie
- Anesthetize Mäuse mit 2% Isofluran in Sauerstoff 2 l / min (oder Tierschutz-Ausschuss genehmigt Betäubung der Wahl). Um die Wirksamkeit der Anästhesie zu überprüfen, nacheinander den Schwanz kneifen, hinteren Fuß und Ohr mit einer Pinzette. Hinweis: Diese wird typischerweise bei P17 durchgeführt, wenn die Regeneration bewertet. Auch Bring-die Analyse bei P19 und P21 zu bestimmen, ob Gefäßintegrität wird im Laufe der Zeit erhalten.
- Sobald betäubt, wiegen Sie die Maus.
- Machen Sie eine Mittellinie Bauch Schnitt mit Dissektionsscheren. Hinweis: sollte Zergliedern Instrumente regelmäßig überprüft und geschärft werden.
- Schneiden Rippen seitlich und heben Sie den Brustkorb mit Hilfe der Pinzette. Anmerkung: Es ist notwendig, seitlich wie möglich geschnitten, um eine Beschädigung des Herzens zu vermeiden.
- Nach dem Entfernen peripHeral Gewebe aus dem Herzen, klemmen die absteigende Aorta mit Arterienklemmen.
- Langsam injizieren Fluorescein-Dextran an den linken Ventrikel mit einem 25 G-Nadel. Hinweis: Wenn vaskulären Barrierefunktion untersucht wird, ist 70 kDa Fluorescein-Dextran eingesetzt, wie es aus der Schiffe auslaufen, wenn Schiff Integrität gefährdet ist. Wenn die Ermittler, die Blutgefäße werfen will, wird 2 MDa Fluorescein-Dextran verwendet. Kritische Schritte: 1) Um eine homogene Verteilung, Zentrifuge Fluorescein-Dextran gewährleisten und spritzen den Überstand, 2) Um die Gefäßverengung zu verhindern, injizieren erwärmt Fluorescein-Dextran-Lösung, 3) Seine Umlaufzeit nicht Über sollte 4 min.
- Enthaupten Mäuse 2 Minuten nach der Injektion mit Betriebs Schere.
4. Enukleation und Augenfixierung
Anmerkung: Bei der Beurteilung Raten von Gefäßregeneration, erste Netzhaut sammeln sich an P12 und P14 und zusätzlich an P17. Erhöhung der Anzahl der abgetasteten Zeitpunkts zur genaueren Bestimmung der Kurse von 24 Revaskularisation.
- Neigen Sie den Kopf der Maus und legen Sie es auf die Seite.
- Haut und Augenlider für das Auge mit Dissektionsscheren entfernen.
- Zeigen gebogenen Pinzette unter dem Auge und ziehen Sie sie vorsichtig, bis der Sehnerv durchtrennt wird.
- Drehen Sie den Kopf der Maus auf der anderen Seite, und führen Sie die gleichen Schritte (Schritte 4.2 und 4.3).
- Um eine bessere Durchdringung des Fixierungs sicherzustellen, Punktion ein Loch in die Vorderkammer des Auges mit 30 G-Nadel.
- Übertragen Augen in ein Röhrchen mit 4% Paraformaldehyd (PFA) und fixieren 1 h bei Raumtemperatur.
- PFA entfernen und waschen Sie die Augen 4-mal mit einer Lösung von eiskaltem PBS.
5. Retinal Dissection
- Zeigen Maus Augen in einer Petrischale mit kaltem PBS und führen Präparation der Netzhaut unter einem Stereomikroskop.
- Entfernen Sie die zusätzlichen rund um das Auge mit Mikro-Dissektion sci Fett / Gewebessors.
- Schneiden Sie die Hornhaut mit Mikro-Dissektion Schere.
- Mit zwei Paar Zangen, minutiös schälen die Lederhaut weg von der Peripherie zum Sehnerv und entsorgen.
- Klemmen Sie die Linse (weißlich Ball unter der Hornhaut) mit einer Pinzette und entpacken Sie es aus dem Augenbecher. Verwenden Sie eine Pinzette als Unterstützung, und die andere zu greifen und heben Sie vorsichtig und entfernen Sie die Linse.
- Lösen Sie die Glaskörpergefäße von der Innenseite der Netzhaut mit kleinen Bürsten (Größe 0) und Pinzette.
- Bündel von Glaskörpergefäße der Papille mit einer Pinzette entfernen verbunden.
- Über seziert Netzhaut bis 2 ml Mikrozentrifugenröhrchen mit PBS und auf Eis vor dem Start des Färbeverfahren.
6. Retinale Gefäß Färbung
- Inkubieren seziert Retinae Nacht unter leichtem Schütteln bei 4 ° C in einer Lösung von fluoreszenzkoppelten isolectin B4 (Rhodamin-Lectin oder andere) in PBS, enthaltend 1 mM CaCl 2 (eine 1:100 Verdünnung einer 2 mg / ml Lösung isolectin B4 wird empfohlen). Während der gesamten Färbeverfahren, decken Rohre mit Aluminiumfolie oder einer lichtundurchlässigen Folie vor Licht zu schützen.
- Am folgenden Tag, entfernen Farblösung und waschen Netzhaut 3x in PBS für 10 Minuten bei Raumtemperatur.
7. Herstellung von Netzhautflatmounts
- Übertragen Netzhaut, Photorezeptorseite nach unten, auf einen Objektträger und machen vier tiefe Einschnitte gleich weit radial mit einem chirurgischen Skalpell, um die Netzhaut in vier gleich große Quadranten aufteilen. Während die Einschnitte, die die Netzhaut Klammer mit einer Bürste, so dass er sich nicht bewegt.
- Mit zwei Bürsten in PBS eingeweicht, sorgfältig glätten die Quadranten Photorezeptorseite-unten und eintauchen in die Netzhaut Montagemedium auf ein Foto, Bleich verhindern. Dann vorsichtig legen Deckglas auf der Oberfläche der Netzhaut befestigt, ohne Druck und dafür sorgen, dass keine Luftblasen unter dem Deckglas zu akkumulieren.
8. Bildgebung und Quantifizierung von Vasoobliteration (VO) und Neovaskularisation (NV), wie zuvor beschrieben 31
- Nehmen Sie Bilder von ganzen montierten Netzhaut mit einem Auflicht-Fluoreszenz-Mikroskop bei einer Vergrößerung von 10X.
- Öffnen Sie das Netzhautbild in Bildbearbeitungssoftware, Stich zusammen und messen Sie die Netzhautbereich und avaskulären Bereich. Die Umgebung kann in Pixeln angegeben werden.
- Bestimmen Ausmaß VO durch Dividieren der Anzahl von Pixeln in der avaskulären Bereich der Anzahl von Pixeln in dem gesamten Netzhautbereich.
- Bestimmen Ausmaß NV, indem die Anzahl von Pixeln des NV durch die Anzahl von Pixeln in dem gesamten Bereich der Netzhaut, wie beschrieben 31.
Ergebnisse
Die OIR Modell wird häufig zur Sauerstoff-induzierten vaskulären Degeneration und Ischämie-induzierten pathologischen Gefäßneubildung in der Netzhaut zu studieren und war maßgeblich an der Entwicklung der derzeit eingesetzten anti-angiogenen Therapien für Augenkrankheiten 27, 29, 30. Die Ergebnisse unter Verwendung dieses Modells erhalten wird, kann locker mit ischämischen Netzhauterkrankungen wie die proliferative diabetische Retinopathie und Frühgeborenen-Retinopathie 30 hochgerechnet werden.
Hier präsentieren wir Ihnen eine alternative Verwendung dieses Modells auf vaskuläre Regeneration zu studieren. Wir werden ein Beispiel für eine Strategie beschrieben, die ischämische Retina, die kürzlich von unserem Labor veröffentlicht wurde regenerieren. In der vorgestellten Studie zeigen wir, dass nachhaltige neuronale Ischämie aktiviert endoplasmatischen Retikulum (ER) Stress und über eine ihrer Effektor Endoribonukleasen IRE1α, spaltet die mRNA des klassischen neuronalen Signalstoff Netrin-1. Wir zeigendass Augeninnen Lieferung der Netrin-1, stimuliert ein Programm der reparative Angiogenese in der Netzhaut myeloischen Zellen und beschleunigt Nervengewebe nach Revaskularisation OIR 25 so. Darüber hinaus bieten wir ein Beispiel für vaskuläre Regeneration beschleunigt mit lentiviralen vermittelte Silencing IRE1α.
Die beschriebenen experimentellen Paradigmen können geändert werden, um die explorative Therapie der Wahl zu untersuchen. Wichtig ist, dass der Zeitpunkt der intravitrealen Injektion, basierend auf der Art der Verbindung bestimmt erforscht und muss Berücksichtigung der Mechanismus, nach dem die untersuchte Behandlung wirkt nehmen. Zum Beispiel, um eine pharmakologische Verbindung (Rezeptor-Agonist, Antagonist, etc.) zu studieren, P14 kann ausgewählt werden, wie es entspricht einem Zeitpunkt, an dem Netzhaut Revaskularisation noch beschleunigt ein schnell wirkendes Eingriff kann dazu beitragen, die Rate der Revaskularisation (Abbildungen 2 und 3a). Wenn virale Vektorenbeschäftigt, genug Zeit zugeteilt werden muss, um den vollen Ausdruck des Personen Gen und einem früheren Zeitpunkt ermöglichen können ausgewählt werden, um volle Expression des Transgens oder Voll Silencing des Zielgens (Abbildung 4) zu gewährleisten. Lentivirale basierten Vektoren sind besonders gut in dieser Hinsicht aufgrund ihrer schnellen Ausdruck, geringe Entzündungsreaktion und Leichtigkeit der Produktion 24, 25 geeignet. Es ist auch wichtig sicherzustellen, dass das Ziel-Gen mit dem entsprechenden retinalen Zellpopulation (RGC, Endothelzelle, Müller-Zelle, etc.) geliefert, daher muss der Tropismus des ausgewählten Virusvektor betrachtet zu machen. Alternativ studieren mit transgenen oder Knockout-Tieren, die Rolle eines Gens in der Gefäßregeneration bietet den Vorteil, nicht zu müssen intraokularen Injektionen durchzuführen.

Abbildung 1. Schematische Darstellung der Maus OIR Modell. Maus Welpen und stillende Mütter werden auf 75% O 2 von P7 bis P12 ausgesetzt. Eine belüftete Sauerstoffkammer mit stetigen O 2 Lieferung und Oximeter ist nicht erforderlich. Während dieser Anfangsphase tritt retinalen Gefäß Auslöschung. Bei P12 werden die Mäuse auf Raumluft (21% O 2), bis maximal P17, wenn pathologische Vor-Retina-Tufting tritt zurück. Neovaskularisation tritt in den folgenden Tagen. Die ideale Zeit, um vaskuläre Regeneration zu untersuchen ist das Fenster zwischen P12 und P17. Probenahme und Bewertung der verschiedenen Zeitpunkten für Ausmaß der Vaso-Auslöschung ist der Schlüssel zur Aufklärung genaue Raten von Revaskularisation.

Abbildung 2. Zeitverlauf der Netzhaut Revaskularisation folgenden Sauerstoff-induzierte Vaso-obliteRation. A) Grafische Darstellung einer Netzhaut flatmounting Verfahren. Ein Schnitt durch den oberen Rand der Hornhaut (schwarz-grau Kuppel) und der Lederhaut (gestrichelte rote Linien) gemacht und die Netzhaut wird gehänselt. Die Linse kann entweder nach dem Öffnen der Hornhaut / Lederhaut oder Lederhaut, sobald die wie in dem Diagramm gezeigt entfernt extrahiert werden. Glaskörpergefäße werden dann entfernt und Färbung der Netzhautgefäße durchgeführt. Sobald die Färbungsprotokoll abgeschlossen ist, wird die Netzhaut dann in vier gleich beabstandete Abschnitte geschnitten und auf einen Objektträger Schiff-side-up B) Lektin-gefärbten Flatmount Netzhaut von Mäusen zu OIR unterzogen. Montiert. Als Gefäße regenerieren, im Bereich der Gefäß-Verödung (hier maximal bei P12) füllt sich pathologische Neovaskularisation ist maximal bei P17 und erscheint als gesättigter Punkte in Lektin gefärbt OIR Netzhaut. Mit P19-P21, haben die Netzhaut vollständig regeneriert ihre Gefäßnetze. (Diese Zahl hat sich von Binet et al. Cell Metabolism 2013 25 geändert wurde)
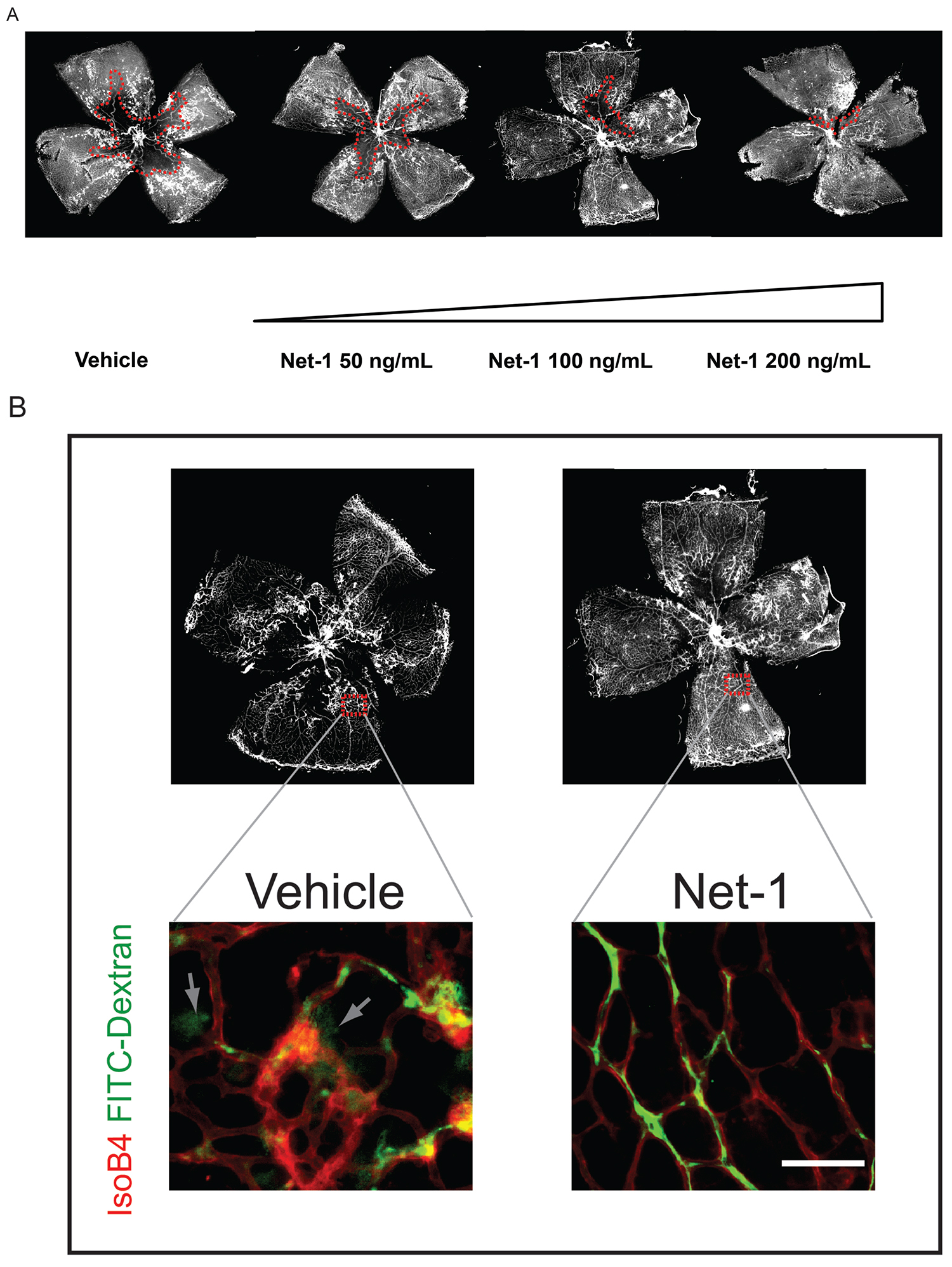
. Abbildung 3: Beispiel eines injizierbaren Behandlung, die Netzhautgefäß Regeneration beschleunigt: Netrin-1. A) Netrin-1 wird bei P14 und das Ausmaß der Gefäß Nachwachsen bei P17 beurteilt injiziert. Eine Dosis-abhängige Zunahme der vaskulären Regeneration beobachtet. B) Gefäßintegrität durch Perfusion mit einem geringen Molekulargewicht Dextran Fluoreszenz beurteilt werden. Wenn Gefäße zeigen eingeschränkter Barrierefunktion, wird die Leuchtstoff Dextran außerhalb des Gefäßes (Pfeile) auslaufen. (Diese Zahl hat sich von Binet et al. Cell Metabolism 2013 25 geändert wurde)
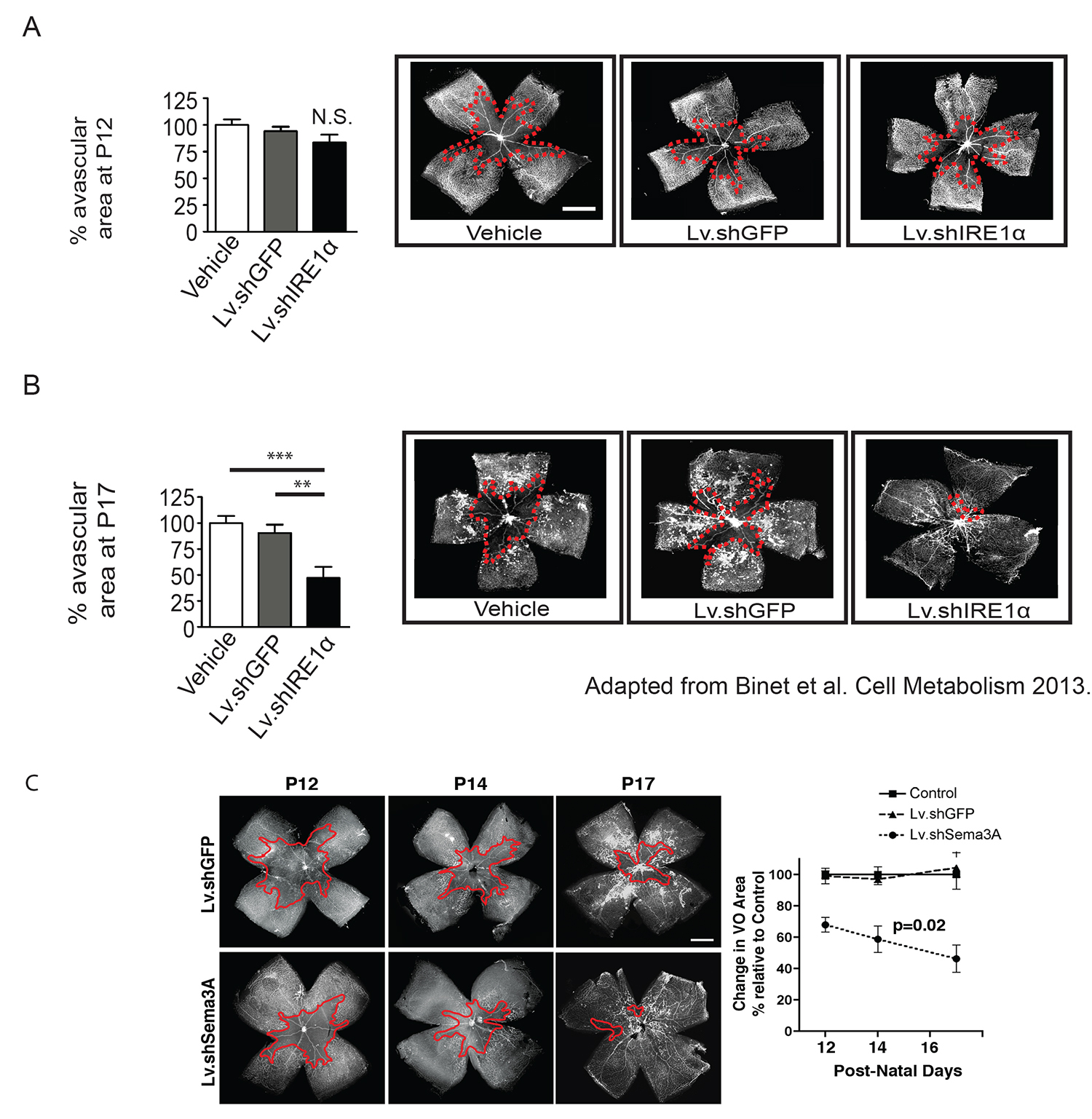
Abbildung 4. Beispiel von Gen-Silencing-with lentiviralen Auslieferungs shRNAs zur retinalen Gefäßregeneration:. Lv.shIRE1α Um die Fähigkeit von Gen-Silencing von IRE1α in retinalen Ganglienneuronen vaskuläre Regeneration unterstützen zu beurteilen, wurde eine intravitreale Injektion eines Lentivirus kodierend für eine shIRE1α P3 eingespritzt, um ausreichend Zeit zu geben für Gen-Stummschaltung, wenn das Gefäßwachstum und Vaso-Verödung bewertet. 3. Generation Lentivirus in diesem Beispiel verwendet eine modifizierte vesikulären Stomatitis-Virus-Glycoprotein (VSV-G), entwickelt, um die Plasmamembranen Ziel. Obwohl diese Vektoren effektiv infizieren retinalen Ganglienzellen, kann der Begriff auch in anderen lokalen Zelltypen festgestellt werden. (A) Diese Behandlung nicht zu spürbaren Veränderungen in Sauerstoff-induzierte Vaso-Verödung, wie bei P12 bestimmt führen, was bedeutet, dass alle beobachteten Vorteile auf Vaso-Auslöschung gemessen zu späteren Zeitpunkten sind aufgrund der erhöhten Gefäßregeneration. (B) Hemmung der IRE1α in dieses Paradigma dramatisch verbessert Gefäßregeneration im Nachwachsen der Phase der OIR auf P17. (C) (Diese Zahl hat sich von Binet et al. Cell Metabolism 2013 25 geändert wurde) Bewertung ein drittes Mal Punkt Vaso-Verödung wie P14, ist erforderlich, um genaue Raten von Revaskularisation zu bestimmen. (Diese Zahl hat sich von Joyal et al. Blut 2011 24 geändert wurde) Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Was ist der effektivste Weg, um das Wachstum neuer Gefäße gesund zu ischämischen Nervengewebe stimulieren? Ist es therapeutisch gültig zu stören und zu beschleunigen, natürlich vorkommenden Gefäß Nachwachsen? In neuro-ischämischen Erkrankungen wie ischämische Retinopathie oder Schlaganfall, Gefäßdegeneration wird mit reduzierten neuronalen Funktion 35-38 verbunden. So früh Verletzungen zu begegnen, Wieder regionalen Mikrozirkulation in der unmittelbaren / frühen Segment der Krankheit kann sich als nützlich erweisen. In einer Augen Zusammenhang experimentellen Paradigmen, die Revaskularisierung des ischämischen Netzhaut beschleunigen reduzieren pathologische Neovaskularisation 21-25, 34 und damit diesen Ansatz weiter untersucht werden.
Seit seiner Einführung vor 20 Jahren hat sich die Netzhaut OIR Modell 27 30 Angiogeneseforschung revolutioniert. Hier bieten wir eine zusätzliche Anwendung für dieses Modell, um potenzielle Strategie studierengien, um physiologische vaskuläre Regeneration in der ischämischen Netzhaut zu modulieren. Ein ideales Tiermodell sollten mehrere Kriterien wie die Nähe zu menschlichen Pathophysiologie, hohe Reproduzierbarkeit, schnelle Ausführung und im Idealfall, niedrige Kosten umfassen. Das Mausmodell der OIR erfüllt alle diese Kriterien und kann in weniger als 3 Wochen vornehmen lassen.
Trotz der zahlreichen Vorteile börsennotierten, Nachteile sind die aktuelle Notwendigkeit, die Maus vor der Analysen zu opfern und damit präzise Längs Überwachung eines Tieres ist noch nicht möglich mit aktuellen Imaging-Tools. Derzeit sind in-vivo-Imaging-Techniken wie Fluoreszenzangiographie oder Oktober weitgehend erfolglos aufgrund der inhärenten optischen Begrenzung der Maus Auge (Krümmungsradius und der geringen Größe), die Bildabdeckung 39 zu den zentralen Regionen der Netzhaut, die nicht relevant sind reduziert die frühen Stadien des Modells.
Wenn sie eingesetzt werden, um Gefäßregeneration p studierenin diesem Protokoll Papier ORGESCHLAGENE sollten alle Überlegungen, die für das Studium Neovaskularisation gelten auch überwacht werden. Dazu gehören die Aufnahme Tiergewicht, um die metabolische Gesundheit der Welpen, die stark beeinflusst Angiogenese 32 schätzen. Eine genaue Steuerung der Sauerstoffspannung in der hyperoxischen Kammer ist ebenfalls kritisch. Variation der Sauerstoffkonzentration hat einen direkten Einfluss auf vasoobliteration, was zwangsläufig zu kritischen Daten Fehlinterpretationen führen kann. Es wird daher empfohlen, entweder implementieren kontinuierliche elektronische Überwachung der Sauerstoffkonzentration oder Kammer im geringsten, überwachen täglichen Änderungen im Sauerstoffgehalt und oxycycler Türöffnung zu begrenzen, um konstante Sauerstoff Niveau zu halten. Optimale Verarbeitung der Netzhaut nimmt auch der Praxis. Extraction, Montage und Färbung der Netzhaut müssen mit Vorsicht, da der relativ fragile Retina ausgeführt werden müssen vorsichtig behandelt werden. Zusätzlich ist, wie für alle Experimente mit gentechnisch veränderten Tieren, die genetische Drift einer Kolonie cein verwechseln Ergebnisse. In Abwesenheit einer selektiven Kraft (in einem Mauskolonie zum Beispiel), ist die allelische oder genetischer Drift ein Zufallsprozess, die zu großen Veränderungen in der Bevölkerung über einen kurzen Zeitraum führen kann. Kann Allel-Häufigkeiten von Generation zu Generation ändern und führen zur Bildung eines Teil Kolonie 40, 41. Diese Mutationen sind weitgehend nicht nachweisbar, und es ist daher wichtig, die Anzahl der Generationen von den gleichen Züchter Paare in derselben Kolonie hergestellt begrenzen. Der effizienteste Weg, um die höchste genetische Stabilität zu erreichen, ist zu erneuern "stocks" alle fünf Generationen Rückkreuzung oder fahren Sie mit einem gekauften Maus von identischen Hintergrund.
Es wird auch empfohlen, für die Netzhautdegeneration Mutationen (rd) 1 und 8 42, zumindest einmal zu testen, bevor eine neue Linie, um zu vermeiden Verwechslung Phänotypen, die zu vorzeitigem Photorezeptordegeneration zugeschrieben werden kann. Für transgene Tiere,es ist wichtig, um sicherzustellen, dass sowohl Steuer und mutierten Mäuse werden von dem selben Anbieter erhalten und sind unbedingt auf dem gleichen genetischen Hintergrund.
Da wir weiterhin die molekularen Mechanismen der Blutgefäßbildung und Wachstum zu klären, neue Ansätze zu beschleunigen, langsamer oder steuern entstehenden Blutgefäße aus. Ein Modellsystem, in der Modulation der Vaskularisierung in vivo in einem pathologischen Kontext erforscht werden kann ein wertvolles Instrument, um potenzielle therapeutische Paradigmen zu erkunden, um neuronale Ischämie im ZNS zu begegnen. Anpassung der Maus OIR Modell vaskuläre Regeneration zu studieren bietet einen solchen Ort und wird auch weiterhin ein wertvolles Werkzeug, um unser Verständnis der molekularen Basis für physiologische und pathologische Angiogenese fördern können.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
PS hält einen Canada Research Chair in Retinal Zellbiologie und die Alcon Research Institute New Investigator Award. Diese Arbeit wurde durch Zuschüsse aus den Canadian Institutes of Health Research (221478) unterstützt, der kanadischen Diabetes Association (OG-3-11-3329-PS), die Natural Sciences and Engineering Research Council of Canada (418.637) und der Foundation Fighting Blindness Kanada. Unterstützung wurde auch von der Reseau de Recherche en Santé de la Vision-du Québec ist.
Materialien
| Name | Company | Catalog Number | Comments |
| C57Bl/6 mice ((Other strains may be used; angiogenic response varies from one strain to the other) | |||
| CD1 nursing mothers | Vendor of choice | ||
| Operating Scissors straight | World Precision Instruments | 14192 | |
| Dissecting Scissors straight | World Precision Instruments | 14393 | |
| Vannas Eye Scissors | Harvard Apparatus | 72-8483 | |
| Iris Forceps, curved, serrated | World Precision Instruments | 15915 | |
| Brushes 362R size 0 | Dynasty | ||
| Dumont Forceps #3; straight | World Precision Instruments | 500338 | |
| Surgical Blade, size 10 | Bard-Parker | 371110 | |
| Rhodamine Griffonia (Bandeiraea) Simplicifolia Lectin I | Vector Laboratories, Inc | RL-1102 | |
| Microscope slides | VWR | 16004-368 | |
| Fluoromount G | Electron Microscopy Sciences | 17984-25 | |
| Zeiss Axio Observer Z1 Inverted Phase and Fluorescence Microscope | Zeiss | ||
| Leica MZ9.5 Stereomicroscope | Leica | ||
| Fluorescein isothicyanate-dextran, 70000 | Sigma-Aldrich | 46945 |
Referenzen
- Carmeliet, P., Tessier-Lavigne, M. Common mechanisms of nerve and blood vessel wiring. Nature. 436, 193-200 (2005).
- Eichmann, A., Thomas, J. L. Molecular Parallels between Neural and Vascular Development. Cold Spring Harb Perspect Med. 3, (2012).
- Larrivee, B., Freitas, C., Suchting, S., Brunet, I., Eichmann, A. Guidance of vascular development: lessons from the nervous system. Circ Res. 104, 428-441 (2009).
- Stefater Iii, J. A., et al. Regulation of angiogenesis by a non-canonical Wnt-Flt1 pathway in myeloid cells. Nature. 474, 511-515 (2011).
- Checchin, D., Sennlaub, F., Levavasseur, E., Leduc, M., Chemtob, S. Potential role of microglia in retinal blood vessel formation. Invest Ophthalmol Vis Sci. 47, 3595-3602 (2006).
- Quaegebeur, A., Lange, C., Carmeliet, P. The neurovascular link in health and disease: molecular mechanisms and therapeutic implications. Neuron. 71, 406-424 (2011).
- Yamamoto, Y., Craggs, L., Baumann, M., Kalimo, H., Kalaria, R. N. Review: molecular genetics and pathology of hereditary small vessel diseases of the brain. Neuropathol Appl Neurobiol. 37, 94-113 (2011).
- Brun, A., Englund, E. A white matter disorder in dementia of the Alzheimer type: a pathoanatomical study. Ann Neurol. 19, 253-262 (1986).
- Prat, A., et al. Migration of multiple sclerosis lymphocytes through brain endothelium. Arch Neurol. 59, 391-397 (2002).
- Rule, R. R., Schuff, N., Miller, R. G., Weiner, M. W. Gray matter perfusion correlates with disease severity in ALS. Neurology. 74, 821-827 (2010).
- Antonetti, D. A., Klein, R., Gardner, T. W. Diabetic retinopathy. N Engl J Med. 366, 1227-1239 (2012).
- Hartnett, M. E., Penn, J. S. Mechanisms and management of retinopathy of prematurity. N Engl J Med. 367, 2515-2526 (2012).
- Sapieha, P., et al. Retinopathy of prematurity: understanding ischemic retinal vasculopathies at an extreme of life. J Clin Invest. 120, 3022-3032 (2010).
- Chen, J., Smith, L. Retinopathy of prematurity. Angiogenesis. 10, 133-140 (2007).
- Cheung, N. Diabetic retinopathy and systemic vascular complications. Progress in Retinal and Eye Research. 27, 161-176 (2008).
- Smith, L. E. Through the eyes of a child: understanding retinopathy through ROP the Friedenwald lecture. Invest Ophthalmol Vis Sci. 49, 5177-5182 (2008).
- Caballero, S., et al. Ischemic vascular damage can be repaired by healthy, but not diabetic, endothelial progenitor cells. Diabetes. 56, 960-967 (2007).
- Wang, H., et al. VEGF-mediated STAT3 activation inhibits retinal vascularization by down-regulating local erythropoietin expression. Am J Pathol. 180, 1243-1253 (2012).
- Ritter, M. R., et al. Myeloid progenitors differentiate into microglia and promote vascular repair in a model of ischemic retinopathy. J Clin Invest. 116, 3266-3276 (2006).
- Saito, Y., Geisen, P., Uppal, A., Hartnett, M. E. Inhibition of NAD(P)H oxidase reduces apoptosis and avascular retina in an animal model of retinopathy of prematurity. Mol Vis. 13, 840-853 (2007).
- Connor, K. M., et al. Increased dietary intake of omega-3-polyunsaturated fatty acids reduces pathological retinal angiogenesis. Nat Med. 13, 868-873 (2007).
- Banin, E., et al. T2-TrpRS inhibits preretinal neovascularization and enhances physiological vascular regrowth in OIR as assessed by a new method of quantification. Invest Ophthalmol Vis Sci. 47, 2125-2134 (2006).
- Dorrell, M. I., et al. Maintaining retinal astrocytes normalizes revascularization and prevents vascular pathology associated with oxygen-induced retinopathy. Glia. 58, 43-54 (2010).
- Joyal, J. -. S., et al. Ischemic neurons prevent vascular regeneration of neural tissue by secreting semaphorin 3A. Blood. 117, 6024-6035 (2011).
- Binet, F., et al. Neuronal ER Stress Impedes Myeloid-Cell-Induced Vascular Regeneration through IRE1alpha Degradation of Netrin-1. Cell Metab. 17, 353-371 (2013).
- Fukushima, Y., et al. Sema3E-PlexinD1 signaling selectively suppresses disoriented angiogenesis in ischemic retinopathy in mice. J Clin Invest. 121, 1974-1985 (2011).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Invest Ophthalmol Vis Sci. 35, 101-111 (1994).
- Lange, C., et al. Kinetics of retinal vaso-obliteration and neovascularisation in the oxygen-induced retinopathy (OIR) mouse model. Graefes Arch Clin Exp Ophthalmol. 247, 1205-1211 (2009).
- Connor, K. M., et al. Quantification of oxygen-induced retinopathy in the mouse: a model of vessel loss, vessel regrowth and pathological angiogenesis. Nature Protocols. 4, 1565-1573 (2009).
- Stahl, A., et al. The mouse retina as an angiogenesis model. Invest Ophthalmol Vis Sci. 51, 2813-2826 (2010).
- Stahl, A., et al. Computer-aided quantification of retinal neovascularization. Angiogenesis. 12, 297-301 (2009).
- Stahl, A., et al. Postnatal Weight Gain Modifies Severity and Functional Outcome of Oxygen-Induced Proliferative Retinopathy. Am J Pathol. 177, 2715-2723 (2010).
- Cerani, A., et al. Neuron-Derived Semaphorin 3A is an Early Inducer of Vascular Permeability in Diabetic Retinopathy via Neuropilin-1. Cell Metabolism. 18, 505-518 (2013).
- Sapieha, P. Eyeing central neurons in vascular growth and reparative angiogenesis. Blood. 120, 2182-2194 (2012).
- Dorfman, A., Dembinska, O., Chemtob, S., Lachapelle, P. Early manifestations of postnatal hyperoxia on the retinal structure and function of the neonatal rat. Invest Ophthalmol Vis Sci. 49, 458-466 (2008).
- Dorfman, A. L., Joly, S., Hardy, P., Chemtob, S., Lachapelle, P. The effect of oxygen and light on the structure and function of the neonatal rat retina. Doc Ophthalmol. 118, 37-54 (2009).
- Chopp, M., Zhang, Z. G., Jiang, Q. Neurogenesis, angiogenesis, and MRI indices of functional recovery from stroke. Stroke. 38, 827-831 (2007).
- Li, L., et al. Angiogenesis and improved cerebral blood flow in the ischemic boundary area detected by MRI after administration of sildenafil to rats with embolic stroke. Brain Res. 1132, 185-192 (2007).
- Robinson, R., Barathi, V. A., Chaurasia, S. S., Wong, T. Y., Kern, T. S. Update on animal models of diabetic retinopathy: from molecular approaches to mice and higher mammals. Dis Model Mech. 5, 444-456 (2012).
- Chia, R., Achilli, F., Festing, M. F., Fisher, E. M. The origins and uses of mouse outbred stocks. Nat Genet. 37, 1181-1186 (2005).
- Jenuth, J. P., Peterson, A. C., Shoubridge, E. A. Tissue-specific selection for different mtDNA genotypes in heteroplasmic mice. Nat Genet. 16, 93-95 (1997).
- Mattapallil, M. J., et al. The Rd8 mutation of the Crb1 gene is present in vendor lines of C57BL/6N mice and embryonic stem cells, and confounds ocular induced mutant phenotypes. Investigative ophthalmolog., & visual science. 53, 2921-2927 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten