Method Article
Misurare gli effetti dei batteri su
In questo articolo
Riepilogo
Un uovo-in-worm (EIW) saggio è un metodo utile per quantificare la deposizione delle uova comportamento. Alterazioni nella deposizione delle uova può essere una risposta comportamentale del modello di organismo Caenorhabditis elegans A sostanze ambientali potenzialmente nocivi come quelli prodotti da batteri patogeni.
Abstract
C. elegans comportamento di deposizione delle uova è influenzato da stimoli ambientali come osmolarità 1 e vibrazioni 2. In totale assenza di cibo C. elegans cessano anche ovodeposizione e conservano le uova fecondate nel loro utero 3. Tuttavia, l'effetto di diverse fonti alimentari, in particolare i batteri patogeni e in particolare Enterococcus faecalis, sul comportamento ovodeposizione non è ben caratterizzata. L'uovo-a-vite senza fine (EIW) saggio è uno strumento utile per quantificare gli effetti di diversi tipi di batteri, in questo caso E. faecalis, il comportamento di deposizione delle uova.
Saggi EIW coinvolgono contando il numero di uova trattenuto nell'utero di C. elegans 4. Il saggio EIW coinvolge lo sbiancamento in scena, gravido adulto C. elegans per rimuovere la cuticola e separare le uova trattenuti dal animale. Prima di sbianca, vermi sono esposti a batteri (o qualsiasi tipo di stimolo ambientale) Per un determinato periodo di tempo. Dopo lo sbiancamento, uno è molto facilmente in grado di contare il numero di uova trattenuti all'interno dell'utero dei vermi. In questo saggio, un incremento quantificabile in ritenzione di uova dopo la E. esposizione faecalis può essere facilmente misurato. Il saggio è un saggio EIW comportamentale che può essere usato per individuare batteri potenzialmente patogeni o la presenza di tossine ambientali. Inoltre, il saggio EIW può essere uno strumento per lo screening per i farmaci che influenzano neurotrasmettitore segnalazione dal comportamento di deposizione delle uova è modulato da neurotrasmettitori come la serotonina e acetilcolina 5-9.
Introduzione
Caenorhabditis elegans, un microscopico, nematodi a vita libera, è un organismo modello tradizionalmente utilizzato per lo studio dello sviluppo delle cellule e dei processi di segnalazione per la sua anatomia trasparente, sviluppo ben caratterizzato, completamente sequenziato genoma, la generazione in tempo breve, e omologia genetica per l'uomo . Più recentemente, C. elegans è diventato un organismo modello nel campo della tossicologia ambientale e di immunità innata 10, 11.
Questi auto-fertilizzanti vermi ermafroditi diventano sessualmente maturi entro due o tre giorni di cova dall'uovo. Durante il suo ciclo di vita, C. elegans passa attraverso quattro stadi larvali (L1-L4), prima di raggiungere l'età adulta. Un isolato ermafrodita in grado di produrre, in media, 300 prole entro tre giorni di picco di fecondità. In riproduttivamente maturo C. elegans ermafroditi, uova fecondate vengono mantenuti all'interno dell'utero per diverse ore prima di essere licenziati. Glinormale numero di uova memorizzati in utero in qualsiasi momento (durante l'alta fecondità) è tra i dieci ei quindici 12. Il numero di uova in utero è funzione sia del tasso di produzione di uova e il tasso di deposizione. Uova fecondate vengono espulsi dall'utero dalla contrazione dei muscoli sedici vulval disposti intorno all'apertura della vulva 13. Motoneuroni Ermafrodito-specifici (HSN di) e motoneuroni VC sinapsi sui muscoli vulvari influenzano la contrazione muscolare e quindi la deposizione delle uova comportamento 5,7,13,14. Espulsione di uova dal dell'utero si verifica a causa di attività coordinata dei neuroni e muscoli.
Culture Lab di C. elegans sono allevati con una dieta di non patogeno Escherichia coli OP50. In ambiente naturale, C. elegans entrano in contatto con una varietà di fonti di cibo, come batteri patogeni, che possono essere potenzialmente dannosi. Quando esposti a sostanze nocive inl'ambiente, C. elegans conservano le uova fino a quando l'ambiente diventa più favorevole. Presumibilmente questo ritenzione uovo è uno sforzo per proteggere la loro progenie.
In questo uovo a vite senza fine (EIW) saggio, C. elegans sono esposti ai batteri potenzialmente patogeni, Enterococcus faecalis, che si trova nell'ambiente. L'esposizione a forme patogeni di E. faecalis possono causare infezione intestinale persistente e persino la morte in C. elegans 15. Esposizione ad altre forme di batteri patogeni hanno mostrato di influenzare la ritenzione dell'uovo 16,17, tuttavia l'effetto non è stato quantificato. Inoltre, l'effetto di lieve patogeni ceppi di E. faecalis, i ceppi che non sono immediatamente letale, sul comportamento delle uova non è stato studiato.
Saggi EIW coinvolgono contando il numero di uova trattenuto nell'utero di C. elegans 4. Anche se C. eleganssono trasparenti, le uova si accumulano in utero possono essere difficili da quantificare in un animale intatto. Il saggio EIW coinvolge lo sbiancamento gravido adulto C. elegans che sono stati esposti ai batteri per un determinato periodo di tempo. La soluzione di candeggina scioglie la cuticola esterna lasciando dietro di sé le uova. Le uova sono refrattiva agli effetti della candeggina per la presenza di un guscio protettivo. Dopo sbianca, uno è molto facilmente in grado di contare il numero di uova rilasciate dall'utero dei vermi su di imbianchimento.
Il saggio descritto è un metodo semplice, economico e rapido per quantificare il numero di uova in utero in una sola volta, e quindi quantificare gli effetti di E. faecalis sulla ritenzione dell'uovo. Il test può essere utilizzato per quantificare l'effetto di altri tipi di batteri, tossine ambientali o farmaci sulla ritenzione uovo. Questa analisi ha anche il potenziale per essere utilizzato come schermo per la patogenicità batterica.
Protocollo
1) Preparazione di nematodi Crescita media (NGM)
- Per fare 50 piatti, aggiungere 1,5 g di NaCl, 8,5 g Ultrapure Agar, e 1,25 g peptone a un 1 Lflask.
- Aggiungere 487,5 ml di dH 2 O a pallone. Agitare delicatamente per mescolare e coprire l'apertura del pallone con un pezzo di foglio di alluminio.
- Sterilizzare la soluzione in autoclave a condizioni standard (121 psi, 120 ° C, 20 min).
- Lasciar raffreddare la soluzione a 45 ° C in un bagno d'acqua.
- Per la soluzione, aggiungere quanto segue in ordine: colesterolo 500 microlitri di una 5 mg / ml soluzione madre (disciolto in etanolo), 500 microlitri 1 M CaCl 2, 500 ml 1 M MgSO4, e 12,5 ml KPO 4 tampone (54.15 g KH 2 PO 4 e 17,8 g di K 2 HPO 4 in 500 ml di dH 2 O), come descritto in 18.
- Usando pipette sterili, aggiungere 10 ml di soluzione di agar per ogni polistirolo piastra di Petri di 60 mm. Lasciare i supporti a solidificare a temperatura ambiente overnight.
2) Preparazione di B Brodo E. coli media
- Per fare cinque culture 100 ml, aggiungere 5,0 g di Bacto Tryptone, 2,5 g di estratto di lievito, 5,0 g di NaCl in un recipiente.
- Aggiungere sterile, acqua distillata fino ad un volume finale di 500 ml. Riscaldare la soluzione su una piastra calda, mescolando, finché i soluti sono dissolti.
- Versare 100 ml di brodo B in cinque bottiglie di vetro (almeno 200 ml di volume).
- Sterilizzare le soluzioni in autoclave a condizioni standard (121 psi, 120 ° C, 20 minuti).
- Lasciare B brodo raffreddare a temperatura ambiente prima dell'uso.
3) Semina C. elegans Piastre di manutenzione
- Dopo aver lasciato piastre NGM ad asciugare a temperatura ambiente per almeno una settimana, inoculare un 100 ml di brodo di coltura B con alcune colonie di E. coli (OP50).
- Crescere E. coli coltura a 37 ° C per una notte.
- Pipetta di one-two gocce (circa 10081; l) di OP50 cultura sul centro di ciascuna piastra NGM. Le piastre sono in genere accatastati coperchio verso l'alto. Quando pipettaggio (semina), iniziare pipettando cultura sulla piastra in fondo alla pila. Il tuo lavoro su ogni pila. Cercare di non spostare le piastre dopo la semina, poiché è importante che la cultura non diventi troppo vicino ai bordi della lastra.
- Lasciare le piastre seminate ad asciugare a temperatura ambiente per almeno una settimana prima di utilizzare.
- Piastre seminate sono memorizzati (invertita) in contenitori di plastica sigillati a temperatura ambiente.
4) Il mantenimento di C. elegans Ceppi
- Per mantenere ben nutrito C. scorte elegans, un verme usano scegliere di spostare tre L4S o adulti gravide di una nuova, testa di serie NGM piastra ogni 3-4 giorni.
- Conservare le piastre (invertito) preferibilmente all'interno di un incubatore a 15 - 22 ° C. Culture in saggi descritti sono stati conservati a 20 ° C. C. sviluppo elegans è dipendente dalla temperatura. Come maintenance temperatura aumenta, il tempo tra fasi di sviluppo diminuisce.
5) Preparazione di Tryptic Soy Agar (TSA) E. faecalis cultura mediatica
- Per fare 50 piastre, misurare 500 ml di acqua distillata sterile in un pallone e portare ad ebollizione, mescolando, su una piastra.
- Aggiungere 20 g di polvere di agar TSA a pallone e permettere la soluzione di sciogliere.
- Sterilizzare le soluzioni in autoclave a condizioni standard (121 psi, 120 ° C, 20 minuti).
- Lasciar raffreddare la soluzione a 45 ° C in un bagno d'acqua.
- Usando pipette sterili, aggiungere 10 ml di soluzione di agar per ogni polistirolo piastra di Petri di 60 mm. Lasciare i supporti a solidificare a temperatura ambiente per una notte.
6) Preparazione di Tryptic Soy Broth (TSB) E. faecalis cultura mediatica
- Per fare 250 provette di coltura, misurare 500 ml di acqua distillata sterile in un pallone e caldo su una piastra mescolando.
- Aggiungere 15 g di agar-agar in polvere TSB al pallone e lasciare che la polvere si dissolva.
- Sterilizzare le soluzioni in autoclave a condizioni standard (121 psi, 120 ° C, 20 minuti).
- Lasciare raffreddare la soluzione a temperatura ambiente, poi pipetta 2 ml in provette, 5 ml sterili.
7) Preparazione di Brain Heart Infusion (BHI) media, con streptomicina, per E. faecalis Cultura
- Misurare 500 ml di acqua distillata sterile in un pallone e portare ad ebollizione, mescolando, su una piastra.
- Aggiungere 26 g di BHI mezzo al pallone e riportare la soluzione a sciogliere.
- Sterilizzare le soluzioni in autoclave a condizioni standard (121 psi, 120 ° C, 20 minuti).
- Lasciare raffreddare la soluzione a 45 ° C in un bagno d'acqua.
- Usando una tecnica sterile, aggiungere 0,5 ml di una soluzione madre e mescolare streptomicina 10 mg / ml.
- Aggiungere 10 ml della soluzione di polistirene ogni piastra di Petri di 60 mm.
- Consenti supporto a solidificare a temperatura ambiente per una notte. Conservare le piastre (invertito) a 4 ° C fino a poche ore prima dell'uso.
8) Il mantenimento di E. faecalis
- Per mantenere E. scorte faecalis, usano un'ansa sterile per striatura singole colonie su agar piatti separati di soia triptici (TSA).
- Grow culture a 37 ° C durante la notte. Memorizzare piastre (invertito) in un sacchetto sigillato o scatola a temperatura ambiente per diverse settimane.
9) Preparazione E. Piastre faecalis per EIW Assay
- Seminare una cultura ml 2 TSB con una colonia di E. faecalis e incubare una notte a 37 ° C.
- Pipettare 20 ml di E. cultura faecalis sul centro di una piastra BHI-streptomicina preparata, e incubare una notte a 37 ° C.
10) Preparazione E. Piastre coli per EIW Assay (placche di comando)
- Seminare una ml B-bro 100Th cultura con una colonia di E. coli OP50 e incubare una notte a 37 ° C
- Pipettare 20 microlitri della cultura OP50 sul centro di una piastra non seminata NGM e permettono le piastre seminate ad asciugare a temperatura ambiente per una notte.
11) Uovo in Worm Assay
- Scegli 15 - 20 in scena-L4 C. elegans (Figura 1) sul centro di un prato di batteri su un preparato BHI-Strep-E. Piastra faecalis. Fare attenzione a non trasferire un sacco di OP50 alla piastra BHI. Scegliere lo stesso numero di l4s a un controllo NGM-OP50 piastra.
- Incubare le piastre per 40 ore a 20 ° C.
- Preparare una soluzione di candeggina al 20%. Mescolare un candeggina commerciale (6,0% ipoclorito di sodio) con l'appropriato volume di acqua distillata.
- Aggiungere 10 gocce microlitri di soluzione di candeggina a dieci posizioni distinte su un coperchio di plastica (di un worm o un piatto batterica).
- Utilizzando un piccone verme, trasferire una vite senza fine in ogni goccia di candeggina. Agitare delicatamente la punta delprendere in gocce di candeggina per assicurarsi che il worm ha lavato via la fine del plettro (confermare osservando la goccia sotto un microscopio da dissezione).
- Lasciare che la cuticola di sciogliere per circa 10 minuti o fino a quando i vermi si spalancò, espellendo le uova (Figura 2). Fare attenzione a non trasferire le uova dalla piastra.
- Utilizzando un microscopio da dissezione, contare le uova in ogni goccia di candeggina.
Risultati
Questo test permette di quantificare il numero di uova trattenuti all'interno C. elegans dopo esposizione a E. faecalis. L4 scena vermi (caratterizzati da trasparente spazi al di sopra loro vulva, Figura 1) sono stati esposti a E. faecalis fino all'età adulta. Dopo 40 ore di esposizione a E. faecalis, lo sbiancamento è stata eseguita. Come la cuticola disintegrato nel droplet candeggina, le uova divennero più evidenti (Figura 2). Il numero di uova a nuovo è stato facilmente quantificato contando durante la visualizzazione sotto microscopio da dissezione.
Più uova sono state mantenute in presenza di E. ceppi testati faecalis, rispetto a E. coli OP50 controlli (Figura 3). Vi è qualche variazione nell'effetto di qualsiasi ceppo di E. faecalis su singoli vermi, come si vede dalle barre di errore. Tuttavia, l'effetto di ceppi di E. faecalis sulla ritenzione uovo all'internouna popolazione di vermi non varia in maniera significativa dai controlli. Il grado di ritenzione dell'uovo suscitata da diversi ceppi di E. faecalis testato può anche variare. Questo effetto può essere variata a causa della espressione di diversi fattori di virulenza in ogni ceppo.

Figura 1. Identificare L4 in scena C. elegans. A. L4 fase C. elegans larve sono il più grande larve presenti su lastre-solo leggermente più corto di vermi adulti. L4s sono più sottili di adulti pure, per l'assenza di uova non distribuiti (che fanno i vermi adulti leggermente più ampio). B. Dopo aver identificato quelle larve che sono leggermente più corto rispetto agli adulti, L4-messa in scena C. elegans sono ulteriormente identificati dal accendino macchia mezzaluna situata nellametà del loro corpo (frecce nere). Questo spot è visibile in piccolo larve (L2 e L3 stadi), ma è assente nell'adulto. Tutte le immagini sono state prese di vermi su piastre NGM, con una telecamera montata su un microscopio da dissezione (ingrandimento 40X e 50X per A e B, rispettivamente). Clicca qui per vedere l'immagine ingrandita .
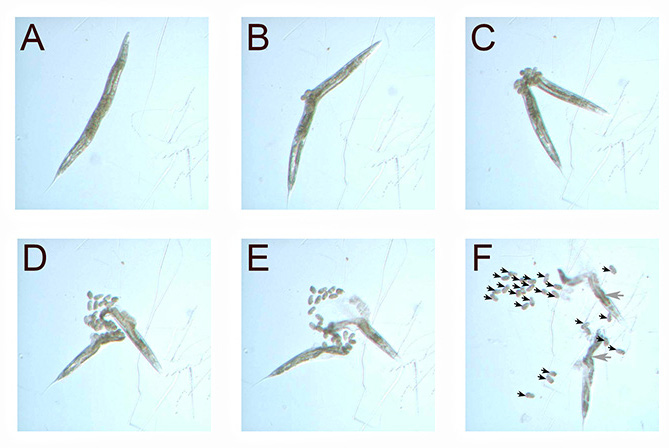
Figura 2. Soluzione di candeggina scioglie il C. elegans cuticola nel tempo. Una scena verme adulto è posto in una goccia di soluzione di candeggina (A). Più di cinque o dieci minuti, la cuticola del worm comincia a dissolversi (BF). Poiché la maggior parte della cuticola è sciolto, le uova diventano visibili (F frecce nere). Depositi di grasso all'interno delle als vite senza fine Ø sciogliere lentamente in candeggina, e rimangono visibili (F, frecce grigie). Tutte le immagini sono state prese di vermi su piastre NGM, con una telecamera montata su un microscopio da dissezione (40X). Clicca qui per vedere l'immagine ingrandita .
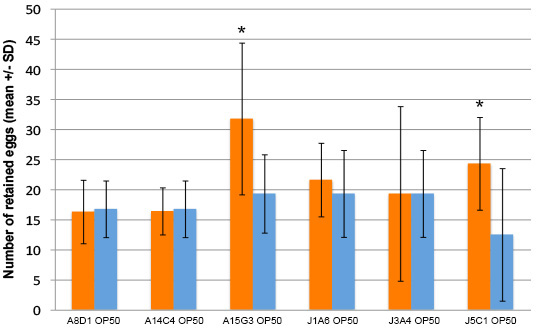
Figura 3. Alcuni E. ceppi faecalis causano una maggiore ritenzione di uova dopo 40 ore di esposizione. Worms esposti a due dei sei E. ceppi faecalis (barre arancioni) ha mostrato un aumento del livello di ritenzione di uova rispetto ai vermi nutriti alla E. coli (OP50) ceppo di controllo (barre blu). Dieci i vermi sono stati nutriti ogni ceppo batterico in ogni prova. Le prove sono state effettuate in triplicato in giorni diversi. * Indica p <0.05 (Student t-test)."> Clicca qui per vedere l'immagine ingrandita.
Discussione
Le fasi più critiche eseguire con successo questo saggio sono: 1) utilizzando grammature ben nutriti di C. elegans, 2) coltivazione di singoli tipi di batteri sulla piastra saggio, 3) identificare accuratamente messo in scena L4 vermi per l'esposizione a E. faecalis, 4) tenere il tempo di esposizione a E. faecalis coerente in tutte le prove e le 5) Tempo di sbiancanti non dovrebbe superare i dieci minuti per evitare la disintegrazione uovo.
Per questo dosaggio è importante scegliere sani, ben nutriti vermi. Fame materna può influenzare la fecondità e la crescita della progenie 19,20, quindi è importante che i vermi sono stati ben nutriti per diverse generazioni prima di eseguire questo test. Un magazzino ben nutrito di vermi è facilmente mantenuta semplicemente trasferendo alcuni vermi adulti di una nuova testa di serie NGM piastra ogni 2-3 giorni. Due giorni prima del test, vermi adulti dovrebbero essere collocati su un fresco prato di OP50 in modo da avere sufficiente L4 progenie disponibile per il test.
E 'anche importante che piastre di saggio EIW promuovono la crescita di un solo tipo di batteri. E. faecalis ceppi sono stati coltivati su piastre BHI. Streptomicina è stata aggiunta alle piastre per selezionare contro E. coli OP50, che viene trasferito con la L4 vermi come sono trasferiti da piastre NGM manutenzione per le piastre di saggio. OP50 cresce anche su piatti BHI. Se non è selezionata contro, C. elegans sarebbero nutrirsi di due tipi di batteri (E. coli e E. faecalis), mentre sulle piastre BHI. I ceppi di E. faecalis usati in questa analisi sono resistenti alla streptomicina. Se sono stati utilizzati diversi tipi di batteri per questo saggio, un antibiotico diverso, e forse differenti terreni di coltura, è utilizzato per selezionare per i batteri di scelta e contro E. coli OP50.
Selezionando accuratamente messo in scena i vermi per questo dosaggio è fondamentale per diversi motivi. Primo, è importante contare ritenzione uovo durante t ha tempo di produzione di uova /, che in auto-fecondante C. elegans. Produzione di uova si verifica solo durante i primi cinque giorni di C. elegans adulta (con un picco intorno a 40 ore post-L4) e rapidamente declina successivamente 4,21. I vermi adulti vivono per una media di due o tre settimane, così tanti vermi adulti vivono per almeno una settimana pur non producendo uova fecondate. Pertanto, è importante assicurarsi che il saggio EIW non viene eseguita su Unstaged vermi adulti di età sconosciuta.
Il secondo motivo è importante utilizzare allestita animali del saggio è EIW modo che il tempo di sviluppo in cui i vermi sono stati esposti al batterio, tossina o farmaco è strettamente controllata. Culture di C. elegans sono tipicamente sincronizzati l'uovo, L1 o L4 stadi. La fase L4 è stato utilizzato per questa analisi per la preoccupazione che l'esposizione a lungo E. faecalis si tradurrebbe in letalità prima che i vermi sono diventati adulti gravide.
tenda "> La durata del worm tempo vengono lasciati in una soluzione di candeggina è anche importante monitorare. Worms dovrebbe dissolversi in genere in meno di dieci minuti, anche se questa volta varia da verme a verme. Uova fecondate vengono poi dissolti da candeggina, ma il processo è più lenta per la cuticola per la presenza di un guscio protettivo. Il guscio inizierà ad essere disciolto dal candeggina se lasciato nella soluzione per più di 10-15 min.Ritenzione dell'uovo riflette l'equilibrio tra la produzione di uova e la deposizione delle uova. Il saggio EIW sola non distingue se il numero di uova trattenuti in utero è dovuta ad alterazioni nella produzione di uova o di deposizione delle uova. Questo è particolarmente un problema se vermi trattati con un ceppo batterico o tossina trattengono meno uova rispetto a quelli del gruppo di controllo. In questi casi in particolare, un saggio di dimensione covata di follow-up dovrebbe essere fatto. Saggi di dimensioni Brood quantificare il numero di uova deposte sopra riproduttiva durata 4 del verme . Se la dimensione covata di vermi nei gruppi sperimentali e di controllo sono gli stessi, quindi le differenze di ritenzione dell'uovo possono essere attribuite a differenze di deposizione delle uova comportamento. Poiché è improbabile che lievemente ceppi batterici patogeni come E. faecalis potrebbero agire per aumentare la produzione di uova, è ragionevole supporre che un aumento della ritenzione uovo dopo esposizione a E. faecalis (come si vede in figura 3) è il risultato della diminuzione comportamento ovodeposizione.
Il saggio EIW inoltre non determina il meccanismo con cui i batteri possono alterare la ritenzione dell'uovo. E 'possibile che C. elegans possono mantenere uova perché i batteri patogeni colpisce alimentazione colonizzando in e bloccando l'apertura della bocca o perché è una fonte di cibo scadente. E 'anche possibile che i batteri possono colonizzare e bloccare l'apertura vulvare, o influenzare la funzione delle cellule nel sistema ovodeposizione. È necessaria un'ulteriore analisi per determinare il meccanismo attraverso il which ritenzione dell'uovo è alterato.
Questo test EIW può essere facilmente modificato per determinare gli effetti di molti tipi di composti sulla ritenzione dell'uovo. Inoltre, questo test è abbastanza semplice che potrebbe essere incorporato in una schermata per identificare i geni, sia l'host (C. elegans) o patogeno (E. faecalis), richiesto per l'effetto del patogeno. Il saggio EIW può essere utilizzato anche per lo screening per geni necessari per la regolazione delle uova stessa. C. elegans comportamento di deposizione delle uova è modulato da neurotrasmettitori come la serotonina e acetilcolina 5-9, e richiede l'attività coordinata di diversi neuroni e gruppi muscolari 12. Saggi EIW sono stati e continuano ad essere utilizzati per identificare i geni importanti per il neurotrasmettitore segnalazione e / o l'attività muscolare. Saggi EIW forniscono un quantitativo, piuttosto che qualitativi, l'analisi di un importante C. elegans comportamento.
Divulgazioni
Riconoscimenti
Gli autori desiderano ringraziare giugno Middleton per la fornitura di E. ceppi faecalis e di orientamento con coltura batterica. C. elegans sono stati forniti dal CGC, che è finanziato dal NIH Ufficio Programmi di un'infrastruttura di ricerca (P40 OD010440).
Materiali
| Name | Company | Catalog Number | Comments |
| Agar, ultrapure | Affymetrix | 10906 | |
| Bacto Peptone | Becton Dickinson | 211677 | |
| Bacto Tryptone | Becton Dickinson | 211705 | |
| Brain Heart Infusion dehydrated medium | Carolina Biological Supply | 781781 | |
| C. elegans, N2 strain | Caenorhabditis Genetics Center | http://www.cbs.umn.edu/cgc | |
| Cholesterol | Alfa Aesar | A11470 | |
| Culture plates for C. elegans | Tritech Research Inc. | T3308 | |
| Culture plates for E. faecalis | Fisher Scientific-Fisherbrand | 875713 | |
| E. coli (OP50) | Caenorhabditis Genetics Center | http://www.cbs.umn.edu/cgc | |
| E. faecalis strains | provided by J. Middleton. All isolates were confirmed as enterococci | ||
| by observing growth on enterococcosel agar (BBL) and in 6% NaCl broth; | |||
| all strains grew at 44.5 ºC and were catalase negative and hydrolyzed esculin. A simplified dichotomous key based on pigmentation and fermentation reactions for six sugars (arabinose, mannitol, methyl-α-D-glucopyranoside (MGP), ribose, sorbose and sorbitol) allowed presumptive identification of all E. faecalis strains (Efs lacks pigmentation and is arabinose, MGP and sorbose negative and sorbitol, mannitol and ribose positive). All presumptive Efs strains were confirmed using the API 20 STREP system (Biomerieux). | |||
| Microscope | Motic | SMZ 168B | any microscope with transmitted illumination and 50X magnification should be sufficient |
| Streptomycin sulfate | Fisher BioReagents | BP910-50 | |
| Tryptic Soy Agar (Soybean-Casein Digest Agar Medium), Difco | Becton Dickinson | 236950 | |
| Trypticase Soy Broth (Soybean-Casein Digest Medium), BBL | Becton Dickinson | 211768 | |
| Yeast extract | Acros | 61180-1000 | |
Riferimenti
- Horvitz, H. R., Chalfie, M., Trent, C., Sulston, J. E., Evans, P. D. Serotonin and octopamine in the nematode Caenorhabditis elegans. Science. 216, 1012-1014 (1982).
- Sawin, E. R. Genetic and cellular analysis of modulated behaviors in Caenorhabditis elegans [dissertation]. , Massachusetts Institute of Technology. Cambridge, MA. (1996).
- Trent, C. Genetic and behavioral studies of the egg-laying system of Caenorhabditis elegans [dissertation]. , Massachusetts Institute of Technology. Cambridge, MA. (1982).
- Chase, D. L., Koelle, M. R. Genetic analysis of RGS protein function in Caenorhabditis elegans. Methods Enzymol. 389, 305-320 (2004).
- Trent, C., Tsuing, N., Horvitz, H. R. Egg-laying defective mutants of the nematode Caenorhabditis elegans. Genetics. 104, 619-647 (1983).
- Weinshenker, D., Garriga, G., Thomas, J. H. Genetic and pharmacological analysis of neurotransmitters controlling egg laying in Caenorhabditis elegans. J. Neurosci. 15, 6975-6985 (1995).
- Waggoner, L. E., Zhou, G. T., Schafer, R. W., Schafer, W. R. Control of alternative behavioral states by serotonin in Caenorhabditis elegans. Neuron. 21, 203-214 (1998).
- Bany, A., Dong, M., Koelle, M. R. Genetic and cellular basis for acetylcholine inhibition of Caenorhabditis elegans egg-laying behavior. J. Neurosci. 23, 8060-8069 (2003).
- Dempsey, C. M., Mackenzie, S. M., Gargus, A., Blanco, G., Sze, J. Y. Serotonin (5HT), fluoxetine, imipramine and dopamine target distinct 5HT receptor signaling to modulate Caenorhabditis elegans egg-laying behavior. Genetics. 169, 1425-1436 (2005).
- Leung, M. C., Williams, P. L., Bennedetto, A., Au, C., Helmcke, K. J., Aschner, M., Meyer, J. N. Caenorhabditis elegans: an emerging model in biomedical and environmental toxicology. Toxicol. Sci. 106, 5-28 (2008).
- Mylonakis, E., Aballay, A. Worms and flies as genetically tractable animal models to study host-pathogen interactions. Infect. Immun. 73, 3833-3841 (2005).
- Schafer, W. R. WormBook. , WormBook. (2005).
- White, J., Southgate, E., Thomson, N., Brenner, S. The structure of the Caenorhabditis elegans nervous system. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 314, 1-340 (1986).
- Desai, C., Garriga, G., McIntire, S. L., Horvitz, H. R. A genetic pathway for the development of the Caenorhabditis elegans HSN motor neurons. Nature. 336, 638-646 (1988).
- Garsin, D. A., Sifri, C. D., Mylonakis, E., Qin, X., Singh, K. V., Murray, B. E., Calderwood, S. B., Ausubel, F. M. A simple model host for identifying Gram-positive virulence factors. Proc. Natl. Acad. Sci. U.S.A. 98, 10892-10897 (2001).
- Aballay, A., Yorgey, P., Ausubel, F. A. Salmonella typhmurium proliferates and establishes a persistent infection in the intestine of Caenorhabditis elegans. Curr. Biol. 10, 1539-1542 (2000).
- O'Quinn, A. L., Wiegand, E. M., Jeddeloh, J. A. Burkholderia pseudomallei kills the nematode Caenorhabditis elegans using an endotoxin-mediated paralysis. Cell. Microbiol. 3, 381-393 (2001).
- Brenner, S. Genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Harvey, S. C., Shorto, A., Orbidans, H. E. Quantitative genetic analysis of life- history traits of Caenorhabditis elegans in stressful environments. BMC Evol. Biol. 8, 15(2008).
- Harvey, S. C., Orbidans, H. E. All eggs are not equal: the maternal environment affects progeny reproduction and developmental fate in Caenorhabditis elegans. PLoS One. 6, e25840(2011).
- Klass MR, Aging in the nematode Caenorhabditis elegans: major biological and environmental factors influencing life span. Mech. Ageing. Dev. 6, 413-429 (1977).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.