Method Article
Medición de los efectos de las bacterias en
En este artículo
Resumen
Un ensayo de huevo-en-gusano (EIW) es un método útil para cuantificar el comportamiento de puesta de huevos. Las alteraciones de la postura de huevos pueden ser una respuesta de comportamiento del organismo modelo Caenorhabditis elegans A sustancias ambientales potencialmente nocivas, tales como las producidas por bacterias patógenas.
Resumen
C. elegans comportamiento de puesta de huevos se ve afectada por señales ambientales tales como la osmolaridad 1 y la vibración 2. Ante la falta total de alimentos C. elegans también dejan la puesta de huevos y retienen los huevos fertilizados en el útero 3. Sin embargo, el efecto de diferentes fuentes de alimentos, especialmente bacterias patógenas y en particular de Enterococcus faecalis, en el comportamiento de puesta de huevos no está bien caracterizado. El ensayo de huevo-en-gusano (EIW) es una herramienta útil para cuantificar los efectos de diferentes tipos de bacterias, en este caso E. faecalis, en el comportamiento de puesta de huevos.
EIW ensayos implican contando el número de huevos retenidos en el útero de C. elegans 4. El ensayo consiste en EIW blanqueo etapas, grávido adultos C. elegans para quitar la cutícula y se separan los huevos retenidos desde el animal. Antes de blanqueo, los gusanos están expuestos a las bacterias (o cualquier tipo de señal ambiental) Durante un período de tiempo fijo. Después del blanqueo, uno es muy fácilmente capaz de contar el número de huevos retenidos en el interior del útero de los gusanos. En este ensayo, un aumento cuantificable en la retención de huevo después de E. la exposición faecalis se puede medir fácilmente. El ensayo EIW es un ensayo de comportamiento que puede ser utilizado para la detección de bacterias potencialmente patógenas o la presencia de toxinas del medio ambiente. Además, el ensayo de EIW puede ser una herramienta para la detección de drogas que afectan neurotransmisor de señalización ya que el comportamiento puesta de huevos es modulada por los neurotransmisores como la serotonina y la acetilcolina 5-9.
Introducción
Caenorhabditis elegans, un gusano redondo microscópica, de vida libre, es un organismo modelo utilizado tradicionalmente para estudiar los procesos de desarrollo y la señalización celular, debido a su anatomía transparente, el desarrollo bien caracterizado, totalmente secuenciado del genoma, en tiempo de generación corto, y la homología genética de los seres humanos . Más recientemente, C. elegans se ha convertido en un organismo modelo en el campo de la toxicología del medio ambiente y la inmunidad innata 10, 11.
Estos gusanos hermafroditas auto-fertilizantes alcanzan la madurez sexual a los dos o tres días de la eclosión del huevo. Durante su ciclo de vida, C. elegans pasa por cuatro estadios larvales (L1-L4), antes de llegar a la edad adulta. Un aislado hermafrodita puede producir, en promedio, 300 crías dentro de los tres días de la fecundidad alta. En la madurez reproductiva C. elegans hermafroditas, los huevos fertilizados son retenidos dentro del útero durante varias horas antes de ser establecido. Lanúmero normal de los huevos almacenados en el útero a la vez (durante el pico fecundidad) es de entre diez y quince 12. El número de huevos en el útero es una función tanto de la tasa de producción de huevos y la tasa de puesta de huevos. Los huevos fertilizados son expulsados del útero por la contracción de los músculos vulvares dieciséis dispuestas alrededor de la abertura de la vulva 13. Motoneuronas Hermafrodita específicos (HSN 's) y neuronas motoras VC sinapsis en los músculos vulvares que afectan a la contracción muscular y por lo tanto la puesta de huevos comportamiento 5,7,13,14. La expulsión de los huevos desde el útero se produce debido a la actividad coordinada de las neuronas y los músculos.
Cultivos de laboratorio de C. elegans se plantean típicamente en una dieta de no patógenas de Escherichia coli OP50. En el medio natural, C. elegans entran en contacto con una variedad de fuentes de alimentos, tales como bacterias patógenas, que pueden ser potencialmente dañinos. Cuando se expone a sustancias nocivas enel medio ambiente, C. elegans retienen los huevos hasta que se convierte en el medio ambiente más favorable. Es de suponer que esta retención de huevo es un esfuerzo para proteger a sus crías.
En este huevo en el ensayo, C. gusano (EIW) elegans están expuestos a las bacterias potencialmente patógenas, Enterococcus faecalis, que se encuentra en el medio ambiente. La exposición a formas patógenas de E. faecalis puede causar una infección intestinal persistente e incluso la muerte en C. elegans 15. La exposición a otras formas de bacterias patógenas han sido demostrado que afectan a la retención de huevo 16,17, sin embargo, el efecto no se cuantificó. Además, el efecto de las cepas patógenas de E. ligeramente faecalis, cepas que no son inmediatamente letal, en el comportamiento de puesta de huevos no se ha estudiado.
EIW ensayos implican contando el número de huevos retenidos en el útero de C. elegans 4. A pesar de que C. elegansson transparentes, los huevos se acumulan en el útero pueden ser difíciles de cuantificar en un animal intacto. El ensayo consiste en EIW blanqueo grávido adultos C. elegans que fueron expuestos a las bacterias por un período fijo de tiempo. La solución de cloro se disuelve la cutícula exterior dejando detrás de los huevos. Los huevos son de refracción a los efectos de cloro debido a la presencia de una cáscara de huevo. Después del blanqueo, uno es muy fácilmente capaz de contar el número de óvulos liberados desde el útero de los gusanos a blanqueo.
El ensayo descrito es un método simple, barato y rápido para cuantificar el número de huevos en el útero de una sola vez, y por lo tanto cuantificar los efectos de E. faecalis sobre la retención de huevos. Este ensayo se puede utilizar para cuantificar el efecto de otros tipos de bacterias, toxinas ambientales o fármacos sobre la retención de huevo. Este ensayo también tiene el potencial para ser utilizado como una pantalla para la patogenicidad bacteriana.
Protocolo
1) Preparación de nematodos Medio de Crecimiento (NGM)
- Para hacer 50 platos, añadir 1,5 g de NaCl, 8,5 g Agar ultrapura, y 1,25 g de peptona al 1 Lflask.
- Añadir 487,5 ml de H 2 O al matraz. Agitar suavemente para mezclar y cubrir la apertura del frasco con un trozo de papel de aluminio.
- Esterilizar la solución en autoclave a condiciones estándar (121 psi, 120 ° C, 20 min).
- Dejar que la solución se enfríe a 45 ° C en un baño de agua.
- A la solución, agregue el siguiente en orden: 500 l de colesterol a 5 mg / ml solución madre (en etanol), 500 l 1 M CaCl2, 500 l 1 M MgSO4, y 12,5 ml KPO4 tampón (54,15 g KH 2 PO 4 y 17,8 g K 2 HPO 4 en 500 ml de H 2 O), como se describe en el 18.
- Uso de pipetas estériles, añadir 10 ml de solución de agar a cada 60 mm de placa de Petri de poliestireno. Permita que el medio a solidificarse a temperatura ambiente Overnight.
2) Preparación de B caldo de E. coli Medios
- Para hacer cinco 100 ml de cultivos, añadir 5,0 g de Bacto triptona, 2,5 g de extracto de levadura, 5,0 g de NaCl a un vaso de precipitados.
- Añadir agua destilada estéril hasta un volumen final de 500 ml. Calentar la solución en una placa caliente, mientras se agita, hasta que los solutos se han disuelto.
- Verter 100 ml de caldo de B en cinco botellas de vidrio (por lo menos 200 ml de volumen).
- Esterilizar en autoclave las soluciones en condiciones normales (121 psi, 120 ° C, 20 minutos).
- Permitir caldo B se enfríe a temperatura ambiente antes de su uso.
3) Siembra C. Placas Mantenimiento elegans
- Después de permitir que NGM placas se sequen a temperatura ambiente durante al menos una semana, uno inocular 100 ml de caldo de cultivo B con unas pocas colonias de E. coli (OP50).
- Crecer E. cultura coli a 37 ° C durante la noche.
- Pipeta una o dos gotas (aproximadamente 10081; l) de OP50 cultura en el centro de cada placa de NGM. Las placas se apilan normalmente tapa hacia arriba. Cuando pipeteado (siembra), comenzar con la pipeta la cultura sobre la placa en la parte inferior de la pila. Su forma de trabajo de cada pila. Trate de no mover las placas después de la siembra, ya que es importante que la cultura no se acerque demasiado a los bordes de la placa.
- Permitir a las placas sembradas se sequen a temperatura ambiente durante al menos una semana antes de usar.
- Placas sembradas se almacenan (invertida) en recipientes de plástico sellados a temperatura ambiente.
4) Mantenimiento C. elegans cepas
- Para mantener bien alimentados C. stocks elegans, un gusano utilizan elegir para pasar tres L4s o adultos grávidas a una nueva, sin semillas NGM placas cada 3-4 días.
- Placas Tienda (invertida) preferentemente dentro de un incubador a 15 - 22 º C. Culturas en los ensayos descritos fueron almacenadas a 20 ° C. C. elegans desarrollo es dependiente de la temperatura. Como maintenana vez que aumenta la temperatura, el tiempo entre las etapas de desarrollo disminuye.
5) Preparación de agar de tripticasa de soja (TSA) E. faecalis Cultura Medios
- Para 50 placas, mida 500 ml de agua destilada estéril en un frasco y llevar a ebullición, mientras se agita, en una placa calefactora.
- Añadir 20 g de agar TSA en polvo a un matraz y permita que la solución para disolver.
- Esterilizar en autoclave las soluciones en condiciones normales (121 psi, 120 ° C, 20 minutos).
- Dejar que la solución se enfríe a 45 ° C en un baño de agua.
- Uso de pipetas estériles, añadir 10 ml de solución de agar a cada 60 mm de placa de Petri de poliestireno. Permita que el medio se solidifican a temperatura ambiente durante la noche.
6) Preparación de caldo de soja tripticasa (TSB) E. faecalis Cultura Medios
- Para hacer 250 tubos de cultivo, mida 500 ml de agua destilada estéril en un frasco y acogedor en una placa calefactora con agitación.
- Añadir 15 g de polvo de agar TSB al matraz y permitir que el polvo se disuelva.
- Esterilizar en autoclave las soluciones en condiciones normales (121 psi, 120 ° C, 20 minutos).
- Deje que la solución se enfríe a temperatura ambiente, a continuación, pipeta 2 ml en tubos de ensayo, 5 ml estériles.
7) Elaboración de medios de infusión cerebro corazón (BHI), con estreptomicina, por E. faecalis Cultura
- Medir 500 ml de agua destilada estéril en un frasco y llevar a ebullición, mientras se agita, en una placa calefactora.
- Añadir 26 g de medio BHI en el matraz y permita que la solución para disolver.
- Esterilizar en autoclave las soluciones en condiciones normales (121 psi, 120 ° C, 20 minutos).
- Deje que la solución se enfríe a 45 ° C en un baño de agua.
- Utilizando una técnica estéril, añadir 0,5 ml de una solución madre de estreptomicina y agitar para mezclar 10 mg / ml.
- Añadir 10 ml de la solución a cada uno de 60 mm de placa de Petri de poliestireno.
- Permita que el medio para solidificar a temperatura ambiente durante la noche. Placas Tienda (invertida) a 4 ° C hasta pocas horas antes de su uso.
8) Mantener E. faecalis cepas
- Para mantener E. stocks faecalis, use un asa estéril de racha colonias individuales en placas de agar de soja tríptico separados (TSA).
- Los cultivos a 37 ° C durante la noche. Placas Tienda (invertida) en una bolsa sellada o caja a temperatura ambiente durante varias semanas.
9) Preparar E. Placas faecalis para EIW Ensayo
- Inocular 2 ml de un cultivo TSB con una colonia de E. faecalis y se incuba durante la noche a 37 ° C.
- Pipetear 20 l de E. cultura faecalis en el centro de una placa de BHI-estreptomicina preparado, y se incuban durante la noche a 37 ° C.
10) Preparación de E. Placas coli para EIW ensayo (placas de control)
- Inocular un ml B-bro 100ª cultivo con una colonia de E. OP50 coli y se incuban durante la noche a 37 ° C
- Pipetear 20 l de la cultura OP50 en el centro de una placa de NGM cabeza de serie y permitir que las placas sembradas se sequen a temperatura ambiente durante la noche.
11) Egg en el Ensayo Gusano
- Elige 15-20 organizado-L4 C. elegans (Figura 1) en el centro de un césped de bacterias en un preparado BHI-Strep-E. placa faecalis. Tenga cuidado de no transferir una gran cantidad de OP50 a la placa BHI. Elija el mismo número de L4s a un control NGM-OP50 plato.
- Incubar las placas durante 40 horas a 20 ° C.
- Prepare una solución de lejía al 20%. Mezclar una lejía comercial (6,0% de hipoclorito de sodio) con el volumen apropiado de agua destilada.
- Añadir 10 l gotas de lejía por diez lugares distintos en una tapa de plástico (de un gusano o placa bacteriana).
- Con una selección de gusano, transferir un gusano en cada gota de lejía. Agite suavemente la punta de larecoger en la gota cloro para asegurarse de que el gusano se ha lavado de la final de la selección (confirmar al ver la gota en un microscopio).
- Permitir la cutícula para disolver durante aproximadamente 10 minutos o hasta que los gusanos se abrieron de golpe, la expulsión de los huevos (Figura 2). Tenga cuidado de no trasladar los huevos a la plancha.
- El uso de un microscopio de disección, contar los huevos en cada gota de lejía.
Resultados
Este ensayo permite cuantificar el número de huevos retenidos en C. elegans después de la exposición a E. faecalis. L4 escena gusanos (caracterizado por el espacio abierto transparente por encima de su vulva, Figura 1) fueron expuestos a E. faecalis a través de la edad adulta. Después de cuarenta horas de exposición a E. faecalis, se llevó a cabo el blanqueo. A medida que la cutícula se desintegró en la gota de lejía, los huevos se hicieron más evidentes (Figura 2). El número de huevos retenidos se cuantificó contando fácilmente mientras ve bajo microscopio de disección.
Más huevos se mantuvieron en la presencia de E. faecalis cepas probadas, en comparación con E. coli OP50 controles (Figura 3). Hay alguna variación en el efecto de cualquier cepa de E. faecalis en gusanos individuales, como se ve desde las barras de error. Sin embargo, el efecto de las cepas de E. faecalis sobre la retención de huevos dentrouna población de gusanos varía significativamente de los controles. El grado de retención de huevos provocada por diferentes cepas de E. faecalis probado también puede variar. Este efecto puede ser variada debido a la expresión de diferentes factores de virulencia en cada cepa.

Figura 1. Identificar L4 organizó C. elegans. A. L4 etapa C. larvas elegans son los más grandes larvas presentes en las placas de sólo un poco más corto en longitud que los gusanos adultos. L4s son más delgados que los adultos, así como debido a la ausencia de huevos retenidos (que hacen que los gusanos adultos ligeramente más ancho). B. Después de identificar aquellas larvas que son un poco más corto que los adultos, L4-etapas C. elegans se identifican más por el terreno de media luna ligera situada en elmedio de su cuerpo (puntas de flecha negras). Este lugar es visible en las larvas más pequeño (fases L3 y L2), pero está ausente en el adulto. Todas las imágenes fueron tomadas de los gusanos en las placas de NGM, con una cámara montada en un microscopio de disección (ampliación 40X y 50X para A y B, respectivamente). Haga clic aquí para ver la imagen más grande .
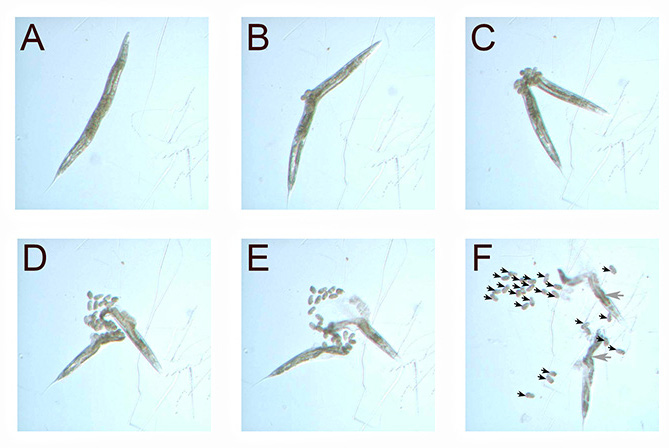
Figura 2. Solución de lejía se disuelve el C. elegans cutícula con el tiempo. Un gusano adulto por etapas se coloca en una gota de solución de lejía (A). Más de cinco a diez minutos, la cutícula del gusano comienza a disolverse (BF). Como la mayoría de la cutícula se disuelve, los huevos se hacen visibles (F flechas negras). Depósitos de grasa dentro de las ALS gusano Ö disolverse lentamente en la lejía, y permanecer visible (F, flechas de color gris). Todas las imágenes fueron tomadas de los gusanos en las placas de NGM, con una cámara montada en un microscopio de disección (40X). Haga clic aquí para ver la imagen más grande .
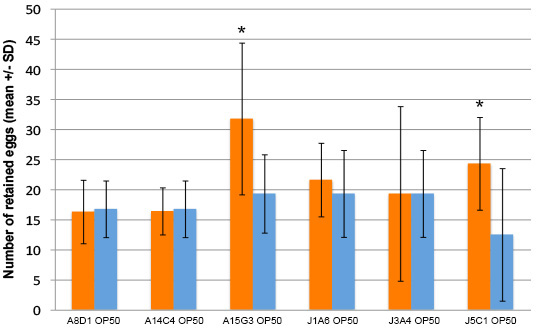
Figura 3. Algunos E. faecalis cepas causan aumento de la retención de huevo después de 40 horas de exposición. gusanos expuestos a dos de los seis E. cepas faecalis (barras de color naranja) mostró un aumento del nivel de retención de huevos en comparación con los gusanos alimentados con la E. coli (OP50) cepa control (barras azules). Diez gusanos se alimentaron cada cepa bacteriana en cada ensayo. Los ensayos se realizaron por triplicado en días diferentes. * Indica p <0,05 (Student t-test)."> Haga clic para ampliar la imagen.
Discusión
Los pasos más importantes en la realización con éxito este ensayo son: 1) el uso de acciones bien alimentados de C. elegans, 2) cultivar tipos individuales de bacterias en la placa de ensayo, 3) identificar con precisión por etapas L4 gusanos para la exposición a E. faecalis, 4) mantener el tiempo de exposición a E. faecalis consistentes en todos los juicios y 5) el tiempo de blanqueo no debe exceder de diez minutos para evitar la desintegración de huevo.
Para este ensayo, es importante escoger saludables, gusanos bien alimentados. Inanición materna puede afectar a la fecundidad y el crecimiento de la progenie 19,20, por lo tanto, es importante que los gusanos han sido bien alimentados durante varias generaciones antes de realizar este ensayo. Una población bien alimentada de gusanos se mantiene fácilmente, simplemente transferir algunos gusanos adultos a una nueva placa de NGM semilla cada 2-3 días. Dos días antes del ensayo, los gusanos adultos se deben colocar en un fresco césped de OP50 con el fin de tener suficiente L4 progenie disponible para el ensayo.
También es importante que las placas de ensayo EIW promueven el crecimiento de sólo un único tipo de bacterias. E. faecalis cepas se cultivaron en placas de BHI. Estreptomicina se añadió a las placas para seleccionar contra E. OP50 coli, que se transfiere con los L4 gusanos medida que se transfieren desde NGM placas de mantenimiento a las placas de ensayo. OP50 también crece en placas de BHI. Si no se selecciona en contra, C. elegans podrían alimentarse de dos tipos de bacterias (E. coli y E. faecalis), mientras que en las placas de BHI. Las cepas de E. faecalis utilizados en este ensayo son resistentes a la estreptomicina. Si se utilizan diferentes tipos de bacterias para este ensayo, un antibiótico diferente, y tal vez diferentes medios de cultivo, se debe utilizar para seleccionar a las bacterias de la elección y contra E. coli OP50.
Seleccionar con precisión por etapas gusanos para este ensayo es crucial, por varias razones. En primer lugar, es importante contar retención de huevos durante t que el tiempo de producción de huevos / que pone en la C. autofertilizante elegans. La producción de huevos se produce sólo durante los primeros cinco días de C. elegans adultez (alcanzando un máximo de alrededor de 40 horas después de la L4) y rápidamente desciende posteriormente 4,21. Los gusanos adultos viven un promedio de dos a tres semanas, por lo que muchos gusanos adultos viven durante al menos una semana para no producir óvulos fertilizados. Por lo tanto, es importante asegurarse de que el ensayo de EIW no se realiza en gusanos adultos unstaged de edad desconocida.
La segunda razón por la que es importante la utilización de animales en escena en el ensayo EIW es por lo que el tiempo en el desarrollo en el que los gusanos han sido expuestos a las bacterias, la toxina o el medicamento está estrechamente controlada. Los cultivos de C. elegans se sincronizan típicamente en el huevo, L1 o L4 etapas. La etapa L4 se utilizó para este ensayo debido a la preocupación de que una exposición más larga a E. faecalis daría lugar a letalidad antes se convirtieron en gusanos adultos grávidas.
tienda de campaña "> La duración de gusanos tiempo se dejan en la solución de cloro también es importante para controlar. gusanos típicamente debe disolver en menos de diez minutos, aunque este tiempo varía de gusano de gusano. Los huevos fertilizados se disuelven con el tiempo por el cloro, pero el proceso es más lento que para la cutícula debido a la presencia de una cáscara de huevo. La cáscara de huevo comenzará a ser disuelto por la lejía si se deja en la solución durante más de 10-15 minutos.Retención de huevos refleja el equilibrio entre la producción de huevos y la puesta de huevos. El ensayo EIW solos no distingue si el número de huevos retenidos en el útero es debido a alteraciones en la producción de huevos o la puesta de huevos. Esto es especialmente una preocupación si gusanos tratados con una cepa bacteriana o una toxina retienen menos huevos que aquellos en el grupo control. En estos casos en particular, un análisis de tamaño de la camada de seguimiento se debe hacer. Ensayos de cría de tamaño cuantificar el número de huevos puestos durante toda la vida reproductiva 4 del gusano . Si el tamaño de la camada de gusanos en los grupos experimentales y de control son los mismos, entonces las diferencias en la retención de huevo se pueden atribuir a las diferencias en el comportamiento de puesta de huevos. Debido a que es poco probable que una ligera cepas bacterianas patógenas como E. faecalis actuarían para aumentar la producción de huevos, es razonable suponer que un aumento de la retención de huevos después de la exposición a E. faecalis (como se ve en la Figura 3) es un resultado del comportamiento de disminución de la puesta de huevos.
El ensayo también EIW no determina el mecanismo por el cual las bacterias pueden alterar retención de huevos. Es posible que C. elegans pueden retener los huevos debido a que las bacterias patógenas afecta a la alimentación mediante la colonización y en el bloqueo de la abertura de la boca o porque es una fuente de alimento pobre. También es posible que las bacterias pueden colonizar y bloquear la apertura vulvar, o afectar a la función de las células en el sistema de puesta de huevos. Se requieren más estudios para determinar el mecanismo por el WHIch retención de huevos se altera.
Este ensayo EIW puede ser fácilmente modificado para determinar los efectos de muchos tipos de compuestos sobre la retención de huevos. Además, este ensayo es lo suficientemente sencillo que podría ser incorporado en una pantalla para identificar los genes, ya sea en el anfitrión (C. elegans) o patógeno (E. faecalis), requerida para el efecto del agente patógeno. El ensayo EIW también se puede utilizar para la detección de los genes necesarios para la regulación de la puesta de huevos en sí. C. elegans comportamiento de puesta de huevos es modulada por los neurotransmisores como la serotonina y la acetilcolina 5-9, y requiere la actividad coordinada de varias neuronas y los grupos musculares 12. EIW ensayos han sido y continúan siendo utilizado para identificar genes importantes para la señalización de neurotransmisores y / o la actividad muscular. EIW ensayos proporcionan una cuantitativa, en lugar de cualitativa, el análisis de un importante C. elegans comportamiento.
Divulgaciones
Agradecimientos
Los autores desean agradecer a junio Middleton para el suministro de E. cepas faecalis y de orientación con cultivo de bacterias. C. elegans fueron proporcionados por la CGC, que es financiado por el NIH Oficina de Programas de Infraestructura de Investigación (P40 OD010440).
Materiales
| Name | Company | Catalog Number | Comments |
| Agar, ultrapure | Affymetrix | 10906 | |
| Bacto Peptone | Becton Dickinson | 211677 | |
| Bacto Tryptone | Becton Dickinson | 211705 | |
| Brain Heart Infusion dehydrated medium | Carolina Biological Supply | 781781 | |
| C. elegans, N2 strain | Caenorhabditis Genetics Center | http://www.cbs.umn.edu/cgc | |
| Cholesterol | Alfa Aesar | A11470 | |
| Culture plates for C. elegans | Tritech Research Inc. | T3308 | |
| Culture plates for E. faecalis | Fisher Scientific-Fisherbrand | 875713 | |
| E. coli (OP50) | Caenorhabditis Genetics Center | http://www.cbs.umn.edu/cgc | |
| E. faecalis strains | provided by J. Middleton. All isolates were confirmed as enterococci | ||
| by observing growth on enterococcosel agar (BBL) and in 6% NaCl broth; | |||
| all strains grew at 44.5 ºC and were catalase negative and hydrolyzed esculin. A simplified dichotomous key based on pigmentation and fermentation reactions for six sugars (arabinose, mannitol, methyl-α-D-glucopyranoside (MGP), ribose, sorbose and sorbitol) allowed presumptive identification of all E. faecalis strains (Efs lacks pigmentation and is arabinose, MGP and sorbose negative and sorbitol, mannitol and ribose positive). All presumptive Efs strains were confirmed using the API 20 STREP system (Biomerieux). | |||
| Microscope | Motic | SMZ 168B | any microscope with transmitted illumination and 50X magnification should be sufficient |
| Streptomycin sulfate | Fisher BioReagents | BP910-50 | |
| Tryptic Soy Agar (Soybean-Casein Digest Agar Medium), Difco | Becton Dickinson | 236950 | |
| Trypticase Soy Broth (Soybean-Casein Digest Medium), BBL | Becton Dickinson | 211768 | |
| Yeast extract | Acros | 61180-1000 | |
Referencias
- Horvitz, H. R., Chalfie, M., Trent, C., Sulston, J. E., Evans, P. D. Serotonin and octopamine in the nematode Caenorhabditis elegans. Science. 216, 1012-1014 (1982).
- Sawin, E. R. Genetic and cellular analysis of modulated behaviors in Caenorhabditis elegans [dissertation]. , Massachusetts Institute of Technology. Cambridge, MA. (1996).
- Trent, C. Genetic and behavioral studies of the egg-laying system of Caenorhabditis elegans [dissertation]. , Massachusetts Institute of Technology. Cambridge, MA. (1982).
- Chase, D. L., Koelle, M. R. Genetic analysis of RGS protein function in Caenorhabditis elegans. Methods Enzymol. 389, 305-320 (2004).
- Trent, C., Tsuing, N., Horvitz, H. R. Egg-laying defective mutants of the nematode Caenorhabditis elegans. Genetics. 104, 619-647 (1983).
- Weinshenker, D., Garriga, G., Thomas, J. H. Genetic and pharmacological analysis of neurotransmitters controlling egg laying in Caenorhabditis elegans. J. Neurosci. 15, 6975-6985 (1995).
- Waggoner, L. E., Zhou, G. T., Schafer, R. W., Schafer, W. R. Control of alternative behavioral states by serotonin in Caenorhabditis elegans. Neuron. 21, 203-214 (1998).
- Bany, A., Dong, M., Koelle, M. R. Genetic and cellular basis for acetylcholine inhibition of Caenorhabditis elegans egg-laying behavior. J. Neurosci. 23, 8060-8069 (2003).
- Dempsey, C. M., Mackenzie, S. M., Gargus, A., Blanco, G., Sze, J. Y. Serotonin (5HT), fluoxetine, imipramine and dopamine target distinct 5HT receptor signaling to modulate Caenorhabditis elegans egg-laying behavior. Genetics. 169, 1425-1436 (2005).
- Leung, M. C., Williams, P. L., Bennedetto, A., Au, C., Helmcke, K. J., Aschner, M., Meyer, J. N. Caenorhabditis elegans: an emerging model in biomedical and environmental toxicology. Toxicol. Sci. 106, 5-28 (2008).
- Mylonakis, E., Aballay, A. Worms and flies as genetically tractable animal models to study host-pathogen interactions. Infect. Immun. 73, 3833-3841 (2005).
- Schafer, W. R. WormBook. , WormBook. (2005).
- White, J., Southgate, E., Thomson, N., Brenner, S. The structure of the Caenorhabditis elegans nervous system. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 314, 1-340 (1986).
- Desai, C., Garriga, G., McIntire, S. L., Horvitz, H. R. A genetic pathway for the development of the Caenorhabditis elegans HSN motor neurons. Nature. 336, 638-646 (1988).
- Garsin, D. A., Sifri, C. D., Mylonakis, E., Qin, X., Singh, K. V., Murray, B. E., Calderwood, S. B., Ausubel, F. M. A simple model host for identifying Gram-positive virulence factors. Proc. Natl. Acad. Sci. U.S.A. 98, 10892-10897 (2001).
- Aballay, A., Yorgey, P., Ausubel, F. A. Salmonella typhmurium proliferates and establishes a persistent infection in the intestine of Caenorhabditis elegans. Curr. Biol. 10, 1539-1542 (2000).
- O'Quinn, A. L., Wiegand, E. M., Jeddeloh, J. A. Burkholderia pseudomallei kills the nematode Caenorhabditis elegans using an endotoxin-mediated paralysis. Cell. Microbiol. 3, 381-393 (2001).
- Brenner, S. Genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Harvey, S. C., Shorto, A., Orbidans, H. E. Quantitative genetic analysis of life- history traits of Caenorhabditis elegans in stressful environments. BMC Evol. Biol. 8, 15(2008).
- Harvey, S. C., Orbidans, H. E. All eggs are not equal: the maternal environment affects progeny reproduction and developmental fate in Caenorhabditis elegans. PLoS One. 6, e25840(2011).
- Klass MR, Aging in the nematode Caenorhabditis elegans: major biological and environmental factors influencing life span. Mech. Ageing. Dev. 6, 413-429 (1977).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados