Method Article
L'identificazione del DNA Mutazioni in depurata ematopoietiche cellule staminali / progenitrici
In questo articolo
Riepilogo
Qui si descrive in vivo mutagenesi saggio per un piccolo numero di cellule ematopoietiche purificate utilizzando il modello di topo transgenico LacI. Il gene LacI può essere isolato per determinare la frequenza, la posizione ed il tipo di mutanti DNA sorto spontaneamente o dopo l'esposizione a genotossine.
Abstract
Negli ultimi anni, è diventato evidente che l'instabilità genomica è strettamente legata a molti disturbi dello sviluppo, tumori e invecchiamento. Dato che le cellule staminali sono responsabili di assicurare l'omeostasi dei tessuti e la riparazione per tutta la vita, è ragionevole ipotizzare che la popolazione di cellule staminali è fondamentale per preservare l'integrità genomica dei tessuti. Pertanto, notevole interesse è sorto nel valutare l'impatto di fattori endogeni ed ambientali sull'integrità del genoma nelle cellule staminali e la loro progenie, al fine di comprendere l'eziologia delle malattie a base di cellule staminali.
Laci topi transgenici portano un recuperabile vettore fago λ codificante il sistema giornalista LacI, in cui il gene LacI serve come il reporter mutazione. Il risultato di un gene mutato LacI è la produzione di β-galattosidasi che un substrato cromogenico, trasformandolo blu. Il sistema giornalista LacI i è effettuatan tutte le cellule, comprese le cellule staminali / progenitrici e può essere facilmente recuperati e utilizzati per infettare successivamente E. coli. Dopo aver incubato infetto E. coli su agarosio contenente il substrato corretta, placche può essere ottenuto; placche blu indicano un gene mutante LacI, mentre placche evidenti porto wild-type. La frequenza di blu (tra chiari) placche indica la frequenza nella popolazione mutante cella originale il DNA è stato estratto da. Sequenziamento del gene mutante LacI mostrerà la posizione delle mutazioni nel gene e il tipo di mutazione.
Il modello di topo transgenico LacI è ormai consolidata come un test in vivo mutagenesi. Inoltre, i topi ed i reagenti per il dosaggio sono disponibili in commercio. Qui si descrive in dettaglio come questo modello può essere adattato per misurare la frequenza di verificarsi spontaneamente mutanti di DNA in cellule staminali arricchita Lin - IL7R - Sca-1 + CKIT + + (LSK) cellule e altri sottopopolazioni del sistema ematopoietico.
Introduzione
Nella maggior parte dei tessuti, cellule differenziate hanno una durata limitata. Per mantenere l'integrità funzionale, le cellule staminali tessuto-specifiche a vita lunga continuamente producono cellule progenitrici che a loro volta danno origine alle cellule completamente differenziate necessari per la funzione di quel particolare tessuto. Le cellule staminali anche ricostituire il proprio scompartimento attraverso un processo chiamato auto-rinnovamento. Pertanto, le cellule staminali sono responsabili del mantenimento dell'integrità funzionale del tessuto in cui risiedono in Pertanto, è imperativo che essi sono dotati di meccanismi solidi di percepire e potenzialmente riparare il DNA danneggiato. In caso contrario, essi possono acquisire più perturbazioni (potenzialmente dannosi) genomiche, che possono essere ereditate dalla loro progenie. Capire come le cellule staminali salvaguardare il loro genoma durante la vita di un organismo è una questione importante e può aiutarci a capire perché l'instabilità genomica è collegata con il cancro e altre malattie legate all'età (recensiti 1,2).
Controllo dell'integrità genomica di un tessuto a livello delle cellule staminali o popolazioni di cellule progenitrici precoce può essere ottenuto sia eliminando stelo difettoso (o progenitore) cellule attraverso la morte cellulare, senescenza o differenziazione, e / o mediante riparazione efficiente DNA danneggiato. Recenti studi hanno dimostrato che è possibile misurare alcuni tipi di riparazione del DNA direttamente in queste rare popolazioni 3-6. Si è constatato che, per esempio nel sistema ematopoietico, doppie rotture del DNA possono essere riparati mediante ricombinazione omologa (HR) o non omologhe fine unione (NHEJ), quest'ultimo è un processo di riparazione di bassa fedeltà e così aumentato rischio di fare errori. Entrambi vengono utilizzati nelle cellule staminali ematopoietiche (HSC) 4,5, tuttavia, in topi sembra che prevalentemente NHEJ in CSE mentre le cellule progenitrici primi utilizzano HR 4. Un'osservazione analoga è stata fatta per le cellule staminali della pelle 6. È interessante notare che, in umana CSE HR, non NHEJ,sembra essere il meccanismo di riparazione di scelta per le pause doppio filamento 3. Se questa differenza funzionale tra le due specie è reale o semplicemente rappresenta una differenza tecnologico o sperimentale resta da vedere.
Il repertorio di una cellula staminale per riparare il DNA danneggiato è probabile che includono altri meccanismi di riparazione del DNA, come riparazione per escissione di base (BER), riparazione per escissione del nucleotide (NER) e mismatch repair (MMR). BER e NER sono responsabili per la riparazione di lesioni singole o multiple di coppie di basi nel DNA a singolo filamento, mentre i disallineamenti correzioni MMR base-base e cicli di inserzione / delezione; questi tipi di danno al DNA non possono essere riparati da NHEJ o HR. A supporto di questa nozione sono diversi studi dal sistema ematopoietico dimostrare un legame fra alterazioni in uno di questi percorsi e anomalie nel vano HSC 7-9, così come un aumentato rischio di sviluppare la sindrome mielodisplastica 10-16, una malattia che ha origine nelHSC e che è associato con l'aumento dell'instabilità genomica come la malattia progredisce 17. Come ancora, non sono stati segnalati misure di BER, NER, e MMR direttamente in CSE.
Oltre a chiarire i vari processi che controllano l'integrità del tessuto ad un livello meccanicistico, è indispensabile per poter misurare l'entità del DNA mutato, in modo che le conseguenze di aberrazioni in uno di questi processi possono essere testati, ad esempio in normali rispetto geneticamente cellule staminali ingegnerizzate o in vecchio contro giovane. Tuttavia, lo sviluppo di un saggio rilevante è difficile a causa della scarsità di cellule staminali tessuto-specifiche e la mancanza di condizioni di coltura che conservano "stemness". Inoltre, tale analisi deve essere modificabili a manipolazioni ambientali e genetici. Una possibile soluzione a queste limitazioni e prescrizioni è l'uso di modelli murini che specificamente sono progettati per rilevare mutazioni del DNA.
Mulsono stati sviluppati teplici modelli di topi transgenici per il rilevamento mutazione. Ad esempio, LacI topi transgenici 18 portano un recuperabile vettore fago λ codificante il sistema giornalista LacI, in cui il gene codifica una LacI soppressore dell'operatore Lac e serve come il reporter mutazione. Su mutazione del gene LacI, l'operatore Lac è attivato e β-galattosidasi viene prodotto. β-galattosidasi scinde il substrato cromogenico X-gal (5-bromo-4-cloro-e-indolil-β-D-galattopiranoside) che trasforma blu. Le cos siti che fiancheggiano il vettore LacI consente un facile recupero da parte lambda proteine fagi e la successiva infezione di E. coli. Dopo aver incubato infetto E. coli su agarosio contenente il substrato X-gal, placche possono essere assegnati. Targhe blu contengono un mutante putativo Lac-I trasportano fago, mentre placche evidenti porto non-mutanti. La frequenza di placche blu (tra the quelli chiari) indica la frequenza nella popolazione mutante cella originale il DNA è stato estratto da. Inoltre, il fago λ ospita il bersaglio LacI può essere facilmente sequenziato utilizzando tecniche di PCR per l'analisi relativamente elevato rendimento. Sequenziamento geni multipli Laci mutanti rivelerà importanti informazioni sulla mutazione spettro, che a sua volta può indicare le eventuali carenze negli specifici percorsi di riparazione del DNA o per eventi specifici genotossici. Il sistema transgenico LacI è stato standardizzato su più laboratori 19 ei reagenti sono disponibili in commercio. Uno dei principali svantaggi del sistema LacI è la limitata capacità di rilevare grandi delezioni o riarrangiamenti, quindi, altri metodi, ad esempio FISH multi-colore su spread metafase devono essere utilizzati per completare questa carenza.
All'interno del vettore fago λ del modello murino LacI, c'è un gene molto più piccolo, CII, Disponibili per l'analisi di mutazione. Le sue dimensioni e il fatto che i mutanti possono essere selezionati rende questo un meno laborioso e più economico dosaggio 20 rispetto all'analisi gene LacI. Tuttavia, il gene LacI è più ampiamente studiato per mutagenesi 21 e la sensibilità del gene per mutazioni è stata ben caratterizzata in modo che vi è una chiara comprensione dei residui amminoacidici che generano una risposta fenotipica su un substrato cromogenico 22-25.
Altri modelli murini per la rilevazione di mutazione includono l'uso della ΦX174 o dei transgeni LacZ. Il ΦX174 modello di topo transgenico, con l'A originale: T → G: C mutazione reversione dosaggio 26 o il forward test di mutazione 27 che permette la rilevazione di uno spettro di sostituzioni di coppie di basi, rappresenta un sistema meno costoso rispetto al modello LacI. Comunque, la schermata mutazionale nel saggio in avanti non è banale e le specifiche mutazioneTrum del transgene ΦX174 non è come ben caratterizzata come quella del LacI. In modelli murini che trasportano transgeni LacZ, il giornalista mutazionale LacZ viene recuperato utilizzando E. cellule ospiti coli che sono sensibili al galattosio e terreno contenente galattosio 28. Un inconveniente di questo sistema è che il recupero del bersaglio LacZ coinvolge anche la digestione di restrizione endonucleasi seguita da ligazione ed elettroporazione di E. coli ospita, rendendo così difficile adattare il sistema per un piccolo numero di cellule. Anche se non è un requisito assoluto per lavorare con popolazioni di cellule staminali / progenitrici (si può sempre iniziare con più topi), se un gran numero di cellule sono necessari (ad es milioni o più) diventa subito poco pratico e un costo proibitivo. Inoltre, le dimensioni relativamente grandi di LacZ, fornendo un reporter mutazionale sensibile, è ingombrante e costosa per l'analisi di sequenza del DNA e determminazione degli spettri mutazione. Uno dei principali vantaggi di questo modello tuttavia, è la sua capacità di rilevare grandi delezioni e inserzioni, nonché riarrangiamenti cromosomici.
Poiché tutte le cellule in modelli murini transgenici LacI, ΦX174 e LacZ portano il sistema giornalista, uno di questi modelli mouse può essere utilizzato per misurare la mutagenesi in qualsiasi tipo di cellula di interesse, comprese le cellule staminali e progenitrici, fintanto che possono essere raccolte in modo affidabile e in numero sufficiente. Perché abbiamo avuto una vasta esperienza con il modello del mouse LacI e il test di mutazione LacI, abbiamo deciso di perseguire questo ulteriore sistema per l'analisi di mutagenesi in staminali ematopoietiche e le popolazioni progenitrici.
Il tessuto emopoietico è ben caratterizzato in termini di superficie delle cellule fenotipo dei suoi singoli componenti, tra cui ripopolamento cellule staminali-lungo termine, che sono identificabili come la popolazione estremamente rara di Lin - IL7R - Sca-1 + CKIT + + (TSS) / Flk2 - CD150 + CD48 - 29 cellule. . Mohrin et al 4 hanno dimostrato che la popolazione leggermente più grande di LSK/Flk2 - le cellule sono ancora buoni rappresentanti per CSE e significativamente diversa da quella più primitiva impegnati progenitore mieloide (CMP) della popolazione quando si tratta di studiare la riparazione del DNA. Inoltre, quando la LSK HSC-arricchito (Flk-2 + e Flk-2 -) le cellule sono state confrontate con la Lin - IL7R - Sca-1-CKIT + + (cellule progenitrici LS-K), c'era ancora una differenza significativa in NHEJ capacità di 5 tra i meno puro, staminali popolazione di TSS cellule arricchito e le cellule progenitrici. Nel nostro studio utilizziamo HSC-arricchito LSK (Flk-2 + e Flk-2 -), le cellule, perché abbiamo scoperto che almeno 2 x 10 5 cellule sono necessari per risultati coerenti e affidabili in questo test di mutagenesi, questo numero di cellulare è estremamente difficileavere quando si ordina la LSK/Flk2 - popolazione CD150 + CD48 o anche il LSK/Flk2 - della popolazione (in termini di topi, costi e praticità). Tale protocollo, basata su quella originariamente sviluppata da Kohler et al. 18 descrive in dettaglio come la frequenza DNA mutante spontaneo può essere determinata in cellule LSK e popolazioni di cellule mieloidi differenziate così come le cellule del midollo osseo non separato e milza definito.
Protocollo
Leucociti dal LacI topi transgenici su un C57BL / 6 sfondo non esprimono Sca-1 (Figura 1). Pertanto, se Sca-1 è un indicatore utilizzato per la purificazione delle cellule, questi topi devono essere attraversato con un ceppo appropriato per ottenere Sca-1, in questo protocollo F1 di un incrocio tra regolari C57BL / 6 (B6) topi e LacI (C57BL / 6) topi transgenici (LacI) è stato usato (Figura 1). Delle popolazioni di cellule utilizzate in questo protocollo, LSKs e CMP rappresentano le più piccole popolazioni nel midollo osseo. Al fine di purificare almeno 2 x 10 5 di ogni / specie, unire il midollo da una decina di topi durante la raccolta del midollo osseo a partire da soli arti posteriori o da almeno quattro topi quando anche la hip-gambe-, anteriori ossa della colonna vertebrale, e lo sterno sono utilizzati.
Fai sospensioni di cellule singole dal midollo osseo e milza. Una piccola parte del midollo osseo è usato come è, la maggior parte viene utilizzata per PURficare LSKs e cellule progenitrici mieloidi differenziate, cioè CMP e granulociti / progenitori monocitiche (GMP) da cellule fluorescenza-attivato (FACS). L'isolamento di cellule di midollo osseo e FACS-purificazione di queste popolazioni è descritto altrove 30-32. Circa sei tipi indipendenti sono tenuti a identificare le differenze significative nella frequenza di mutazione tra le popolazioni.
Il seguente protocollo per misurare la spontanea in vivo frequenza dei mutanti in sottopopolazioni ematopoietiche purificate è adattato da diversi manuali di istruzione Stratagene 33-35, basato sul lavoro originale da Kohler et al. 18 Le differenze più importanti tra i protocolli esistenti 33-35 e questo protocollo , necessaria per l'uso relativamente piccolo numero di cellule, includere differenze nella quantità di reagenti e dei tempi e temperature utilizzate per proteinasi K incubazione.
1. Conservazione dei campioni
Dopo aver raccolto le popolazioni di cellule, le cellule aliquote desiderati in provette a 1 ml (per numero di cellulare per aliquota, vedi Tabella 1). Centrifugare a 266 xg per 7 minuti, a 4 ° C. Aspirare con cura il surnatante. Mettere le provette in azoto liquido per 5 min e poi trasferirli ad un -80 ° C freezer per un ulteriore uso. I campioni possono essere conservati per almeno 6 mesi.
2. Isolamento del DNA genomico
- Prendete i campioni dal -80 ° C freezer. Aggiungere 500 microlitri di tampone di lisi DNA ghiacciata (Tabella 3) al tubo campione. Vortex le provette per 3-5 secondi a media velocità e posizionare le provette in ghiaccio per 10 min.
- Centrifugare le provette per 12 min, 4.000 xg, 4 ° C. Eliminare attentamente ~ 450 ml di surnatante. Spin giù il tubo per 3-5 sec. Utilizzare un tubo capillare di vetro per rimuovere con attenzione il resto del supernatante. Aria asciugare le pareti interne della tegli tubo fino a quando non le goccioline sono più visibili (~ 2 min).
- Aggiungere 2 ml di RNace-It ribonucleasi cocktail e 10 ml di 1 M DTT a 100 ml di tampone di digestione del DNA (Tabella 3). Regolare il volume a seconda del numero di campioni che verranno trattati; è richiesto 20 ml di questa soluzione di digestione di DNA per campione. Dopo l'aggiunta di 20 ml di questo a pellet cellulare, provare a fare il pellet staccarsi dal fondo, toccando delicatamente il tubo con il dito o una penna.
Nota: può essere difficile vedere il pellet causa del basso numero di cellule. - Aggiungere 20 ml soluzione di proteinasi K * (Tabella 3) per ogni campione, molto delicatamente toccare di nuovo il tubo.
* Nota: la soluzione di proteinasi K deve essere riscaldato in un bagno d'acqua a 50 ° C, 2 min prima dell'uso per attivare l'enzima. - Mettere immediatamente la provetta in un bagno d'acqua a 50 °. Digerire il campione secondo le linee guida in Tabella 1. Toccare il tubo molto delicatamente ogni 10 min.
Nota: Con tali piccolo numero di cellule, la temperatura del bagno d'acqua ed i tempi di digestione sono assolutamente essenziale per ottenere successo DNA genomico di alta qualità. - Preparare il sistema di dialisi DNA in camera fredda (Figura 2). Versare 600 ml di tampone TE (Tabella 3) in un becher da 600 ml in vetro, aggiungere una piccola ancoretta magnetica in modo che il buffer può essere agitata durante la dialisi e lasciare che i 0.025 mm (dimensione dei pori) membrane galleggiano sulla superficie del buffer. Una membrana per campione; 1-4 membrane possono essere utilizzate in un unico becher dialisi. Fare un segno sul margine della membrana con le forbici per l'identificazione di ciascun campione.
- Dopo il tempo di digestione appropriata, aggiungere il DNA genomico ora molto viscoso * attenzione al centro della membrana galleggiante (Figura 2). Coprire il becher immediatamente con un foglio di alluminio. Dializzare il DNA genomico a 4 ° C per 16-20 ~hr, mescolare il buffer delicatamente.
* Nota: Quando si lavora con le soluzioni di DNA viscose, utilizzare punte di pipette con un'ampia apertura. - Il giorno dopo versare 600 ml di tampone TE preparata di fresco (Tabella 3) in un recipiente di vetro pulito e trasferire le membrane a una nuova becher con un cucchiaio molta attenzione, e coprire il becher con un foglio. Dializzare per altri 2 hr.
- Rimuovere la membrana di dialisi dal bicchiere con il tampone TE con un cucchiaio e trasferire solo il più viscoso "macchia" della soluzione di DNA per un nuovo, sterile provetta 1 ml. Conservare il campione a 4 ° C. Continua il saggio mutagenesi il giorno successivo o fino a 1,5 mesi più tardi. Per le popolazioni purificate, attendere almeno 1 settimana.
3. Preparazione dei vassoi per la E. coli / fagi Cultura (1 ° giorno)
Ogni vassoio conterrà due diversi strati; uno strato di agar in fondo e uno strato di agarosio in alto che contiene X-gal. Il E.soluzione coli / fago verrà aggiunto a quest'ultimo. Il numero e il tipo di cellule isolate potranno determinare quanti vassoi sarà richiesto. Consultare Tabella 1 per calcolare il numero di vassoi necessari e successive quantità di soluzioni per questa parte del protocollo. Di seguito genererà ~ 60 vassoi, che una persona esperta in grado di elaborare facilmente.
- Preparare i seguenti mezzi:
- per lo strato inferiore, preparare 6 x 2 flaconi L con ciascuna contenente 1600 ml di DDH 2 O. Aggiungere NZY polvere (21 g / L) e agar (15 g / L); mescolare bene.
- per lo strato superiore, preparare 4 x 1 L flaconi con ciascuna contenente 800 ml di DDH 2 O. Aggiungere NZY polvere (21 g / L) e agarosio (7,2 g / L); mescolare bene.
- per la coltura di E. coli, aggiungere 2,5 g di polvere NZY a ciascuno di 2 x 250 ml flaconi e portare il volume a 100 ml con DDH 2 O;
- per i vassoi di conferma utilizzate al punto 8, aggiungere 8,4 g di polvere NZY e 6 g di agar per un pallone da 1 L e portare il volume a 400 ml con DDH 2 O.
- Coprire l'apertura dei flaconi con fogli di alluminio. Mescolare bene e sterilizzare in autoclave a 121 ° C, 15 psi per 30 min.
- Rimuovere i flaconi (molto caldo!) Dalla autoclave. Agitare con cautela i palloni per mescolare l'agar e agarosio, poi metterli in un bagno d'acqua a 50 °. Quando il bagno acqua ha raggiunto nuovamente i 50 ° C, versare dai 2 palloni L (fase 3.1.1) ~ 150 ml di agar NZY in ciascun vassoio (livello di fondo).
- Lasciare l'agar per solidificare a temperatura ambiente per almeno 2 ore, quindi capovolgere e aprire i vassoi. Inserire il fondo dei vassoi sul coperchio, 45 ° fuori centro (Figura 3) e lasciare asciugare per 30 min. Chiudete i vassoi e lasciare O / N a RT.
- Nel frattempo, preparare la SCS-8 E. cultura coli per il giorno successivo. Da uno dei due palloni da 250 ml * (fase 3.1.3), prendere 5 ml NZY brodo (Tabella 3) e trasferire ad una sterile 14 mtubo l. Supplemento con 62,5 ml di maltosio / MgSO 4 soluzione e aggiungere 10 ml di SCS-8 E. glicerolo coli magazzino. Incubare a 37 ° C per 3-4 ore agitando a 250-300 rpm. Utilizzare 15 ml di questa cultura per inoculare 95 ml di brodo NZY (in un pallone braccio laterale 250 ml), coltura O / N a 37 ° C in un incubatore scuotimento (250-300 rpm).
* Nota: l'altro pallone da 250 ml può essere utilizzato successivamente per regolare il diametro della cultura, se necessario (fase 4.1) - Prendere il pallone da 1 L con agar (fase 3.1.4), e versare ~ 6-7 ml di NZY agar in 60 millimetri piatti (questo sarà sufficiente per ~ 50 piatti, necessari per il passaggio 8). Lasciare indurire agar (~ 10 min), poi invertito e avvolgere in plastica. Questi piatti possono essere conservati a 4 ° C per un mese.
4. Preparazione dei vassoi per la E. coli / fagi Cultura (Day 2)
- Controllare il diametro esterno del SCS-8 E. cultura coli (punto 3.5) sul spettrofotometro.Regolare l'OD 600-,6 con NZY brodo (Tabella 3) (fase 3.1.3), e posizionare il pallone sul ghiaccio per fermare la crescita e tenere in ghiaccio fino al momento dell'uso. Questo verrà utilizzato per passi 6.3 e 8.2. Questa cultura può essere conservato per 5 giorni a 4 ° C.
- Air asciugare tutti i vassoi di analisi (versato il giorno prima) per ~ 5 ore (Figura 3).
5. Confezionamento di DNA genomico (Day 2; Continua)
- Prendere il numero richiesto di arancia Transpack provette la -80 ° C freezer e metterli in ghiaccio secco fino al momento dell'uso, prendere uno arancione tubo Transpack per ogni reazione imballaggi da eseguire. Etichettare ogni provetta in modo appropriato. Avere i campioni di DNA genomico (passo 2,9) pronto sul ghiaccio.
- Questa operazione deve essere eseguita una provetta al momento. Termina la fase di completo prima di passare al campione di DNA successivo. Scongelare un tubo arancione * nota 1 in fretta: utilizzare le dita fino a quando la maggior parte di esso è scongelato, poi metteresul ghiaccio. Prendete il campione di DNA genomico corrispondente e trasferire immediatamente 8-12 campione microlitri * nota 2,3 al tubo arancione. Mescolare il contenuto pipettando gentilmente su e giù 3x, così come picchiettando delicatamente la provetta con il dito. Cercate di non introdurre bolle durante la miscelazione. Posizionare il tubo in un bagno d'acqua a 30 ° per 90 min.
* Nota 1: un breve giro in una microcentrifuga può essere necessario raccogliere tutti i contenuti dalle pareti interne e il tappo.
* Nota 2: volume del campione aggiunto dipende dal numero di celle utilizzato per generare il campione: 11-12 ml di campioni preparati 2,0-5,0 x 10 5 cellule; 10 ml di 1,0 x 10 6 cellule-campioni e 8 microlitri di 1,5 x 10 6 cellule-campioni.
* Nota 3: Il DNA è ancora molto viscoso; prendere il DNA out, spingere la punta della pipetta sul fondo della provetta e accuratamente ruotare la punta attorno contro la parete interna del tubo. - Prendere 1 o 2 blu Transpack tubes * l'-80 ° C freezer e metterli in ghiaccio secco fino a nuovo uso. Scongelare rapidamente e trasferire 12 microlitri di ciascun tubo arancione. Miscelare la soluzione pipettando delicatamente su e giù per 3 volte. Gira il tubo obliquo per 2-3 secondi, quindi toccare il tubo con il dito per ulteriore miscelazione e subito ritorno al bagno d'acqua a 30 ° per altri 90 min.
* Nota: Utilizzare 1 tubo blu per 5-6 reazioni e 2 tubi blu per 10-12 reazioni. - Dopo 90 min, diluire ciascuna reazione con 970 microlitri tampone SM * (Tabella 3) per bloccare la reazione e vortice a media velocità per 5 sec. Mettere le provette su ghiaccio fino a un ulteriore uso.
* Nota: se il numero di cellule è ≤ 5 x 10 5, utilizzare 500 microlitri tampone SM (Tabella 3) per bloccare la reazione; 2 tubi (dello stesso campione) possono essere combinati in seguito (passo 6.4).
6. Placcatura Confezionato DNA genomico (Day 2; Continua)
- Chiudere l'agar t invertitaI raggi che sono stati aperti per l'essiccazione del mattino. Etichettare i vassoi per ogni campione.
- Sciogliere 4,8 g di X-gal in 16.8 ml di N, N-dimetilformammide (necessario per la fase 6.5). Mescolare immediatamente e mettere su una piattaforma shaker. Proteggere dalla luce. Soluzione deve essere chiaro in 20-30 min.
- Aliquota della SCS-8 E. coli. Per ciascuna serie di vassoi *, utilizzare uno tubo da 50 ml. Etichettare la provetta con il nome del campione di DNA confezionato. Aggiungere 2 ml di E. sospensione coli per ciascun vassoio.
* Nota: per esempio 3 x 10 5 GMPs richiede un insieme di 8 vassoi (cfr. tabella 1). Così, due aliquote, richiedono 8 x 2 = 16 teglie. Tenere le aliquote separati e quindi si preparano due provette da 50 ml, con l'8 x 2 = 16 ml E. sospensione coli. - Aggiungere i ml 1 * di campione di DNA confezionato (dal punto 5.4) per l'appropriato tubo ml 50, contenente la SCS-8 E. Un'aliquota coli e mescolare bene. Incubare questa E. coli / fago miscela in un incu agitazionebator (250-300 rpm), a 37 ° C per 23 min.
* Nota: Se il DNA è stato estratto da ≤ 5 x 10 5 cellule, 500 ml di tampone SM è stato utilizzato per arrestare la reazione (fase 5.4). A questo punto, i tubi possono essere combinati e aggiunte a un tubo da 50 ml. - Quando la E. miscela coli / fago è in incubazione, avviare i preparativi per lo strato superiore di agarosio. Aggiungere 5 ml di X-gal / N, soluzione di N-dimetilformammide (passo 6.2) a ciascuna beuta da 800 ml di soluzione di agarosio strato superiore (dal punto 3.1.2; mantenuta a 50 ° C). Concentrazione finale di X-gal sarà 1,5 mg / ml. La X-gal può precipitare un piccolo quando aggiunto alla agarosio. Swirl di sciogliere la X-gal e mettere la bottiglia in bagno d'acqua a 50 ° C.
- Prendere la E. coli / fago miscela di fuori dell'incubatore (punto 6.4). Ogni campione richiede più vassoi; ciascun vassoio, richiede 50 ml di soluzione X-gal/agarose (punto 6.5). Versare il volume richiesto di X-gal/agarose per ciascun campione (50 ml xnumero di vassoi) in una bottiglia di plastica sterile grande e aggiungere l'appropriato E. coli / fago miscela. Agitare il flacone per mescolare. Dividete l'impasto in aliquote di 45-50 ml in 50 ml provette coniche. Il numero di tubi deve essere uguale al numero di vassoi richiesti per quel campione.
Nota: La soluzione X-gal/agarose rimanente sarà utilizzata nel passaggio 8.3. La soluzione può essere conservata in un bagno a 50 ° C fino ulteriore uso. - Versare 50 ml di miscela top agarosio tutta la metà inferiore del vassoio dosaggio. Si diffuse rapidamente l'agarosio inclinando leggermente il vassoio di test in una sola direzione.
Nota: l'agarosio si raffredda molto rapidamente e diventerà impossibile sparsi su vassoio. Pertanto, questa fase deve essere eseguita relativamente veloce e in agarosio che è stata mantenuta a 50 ° C. - Consentire l'agarosio top indurire per almeno 15 min. Quindi, capovolgere e aprire i vassoi saggio di lasciarli asciugare all'aria per 30 minuti (Figura 3).
- Chiudere i vassoi, incubare i vassoi saggio invertiti (in basso agar lato livello superiore) a 37 ° C per 15-16 ore. Non impilare più di 5 vassoi.
7. Determinazione di una frequenza putativo Mutant (3 ° giorno)
- Rimuovere i vassoi dal 37 ° C incubatore e lasciarli raffreddare. Contare le traslucido unità formanti placca (PFU) in ogni vassoio, selezionare casualmente due siti sui vassoi, disegnare un quadrato * di 2,5 x 2,5 cm 2 o 5 x 5 cm 2 e contare tutti i PFUs in ogni quadrato con un contatore di cellule marcatura (Figura 4A, B).
* Nota: elaborare l'uso quadrato un dispositivo come illustrato nella Figura 5. Se il numero di contato PFUs è ≥ 40, utilizzare la piazza più piccola, altrimenti utilizzare il più grande. - Prendere la media dei quadrati contati e moltiplicare per 96, se il conteggio con un quadrato più piccolo, o moltiplicare questo numero per 24 se il conteggio con il grande. Aggiungere il numero di PFUs contato per tutti i vassoi dalla saMi campione. Questo è il numero totale di PFUs generato per quel campione.
- Quindi, contare le targhe mutanti in ogni vassoio. I vassoi sono ormai raffreddato, che contribuirà a individuare le placche mutanti. Per facilitare ulteriormente avvistare le targhe blu, spostare il vassoio su una superficie rosso e / o bianco, fogli di carta bianca e rossa lavorare bene. Cerchiare qualsiasi targa blu con un pennarello. Registrare la forma e l'intensità del colore blu di ciascun mutante (es. pieno, cerchio, settore; Figura 4C) 36,37.
- Determinare la frequenza dei mutanti putativo per ogni campione dividendo il numero di mutante PFUs (passo 7.3) per il numero totale di PFUs (passo 7.2).
8. Verifica della putativo Mutant placche (Day 3-5)
- Usando una pipetta Pasteur, nucleo ciascun mutante (blu) PFU e trasferire la spina in 250 microlitri tampone sterile SM (Tabella 3). Aggiungere 25 ml di cloroformio, vortex per 5 secondi und conservare a 4 ° C per continuare il giorno successivo o lasciato per 2 ore a temperatura ambiente prima di continuare con la fase successiva, per verificare che il mutante PFU è infatti un mutante. I campioni possono essere conservati a 4 ° C per almeno 1 anno.
- Etichettare un 1 ml e un 4 ml provetta sterile per ogni mutante che è stato collegato. Nella nuova provetta 1 ml, diluire il fago risospeso rilasciato dalla spina agar (passo 8.1) 1:50 in tampone sterile SM (2 microlitri di campione in 100 microlitri tampone SM (Tabella 3)), vortice brevemente, annullare. Per i 4 ml provetta sterile aggiungere 200 microlitri SCS-8 E. cultura coli (dal punto 4.1) e 2 ml di fago diluito dal corrispondente provetta 1 ml, incubare a 37 ° C per 5-10 min.
- Aggiungere 2,5 ml di agarosio top contenente X-gal (sinistra-over dal punto 6.6) per ogni 4 ml di tubo, tubo turbinio di mescolare e versare su una piastra di agar NZY 60 mm precedentemente versato (fase 3.6). Lasciare agire per 10 minuti (per consentire tegli top agarosio solidificare), capovolgere il piatto e incubare O / N a 37 ° C.
- La mattina seguente, togliere il piatto dal termostato e determinare la percentuale di blu PFUs su ogni piatto (Figura 6). Quando il 70% o più del PFUs sono blu, un mutante è considerata confermata 38,39. Nucleo della placca mutante dal piatto e di mettere in 1,5 ml a vite tubo orizzontale, contenente 250 microlitri di buffer SM (Tabella 3) e 25 microlitri cloroformio, è ora pronto per il sequenziamento.
- Quando il 50% o meno del PFU è blu, non è considerato un vero 38,39 mutante. Quando la frequenza di blu PFUs è tra il 60-70%, controllare con nelle note circa la forma della placca, se la forma del PFU era "pieno", procedere con il sequenziamento.
9. Sequencing per mutazioni nel LacI G ene
- Impostare reazioni PCR in un volume di reazione di 25 microlitri, di cui 1,5 μ; L di placca surnatante (template, passo 8.4), il primer forward SF1 (5'-GGAAACGCCTGGTATCTT-3 ') e la SR2 primer reverse (5'-GCCAGTGAATCCGTAATCA-3'). Utilizzare il kit polimerasi PCR extender Taq secondo le istruzioni del produttore. Condizioni di ciclo sono le seguenti: 94 ° C per 2 min, quindi 35 cicli di 94 ° C per 20 sec, 60 ° C per 20 sec, 72 ° C per 2 minuti, seguita da una fase finale di 72 ° C per 5 min .
- Dai aliquota 5 microlitri di ogni reazione ed eseguito su un gel di agarosio 0,8%, per confermare l'amplificazione.
- Pulire le reazioni PCR utilizzando il kit di pulizia Augencourt secondo le istruzioni del produttore.
- Quantificare Template DNA.
- Utilizzare ~ 100 ng del prodotto di PCR come modello per il sequenziamento del DNA. Ampliconi sequenza in entrambe le direzioni utilizzando gli stessi primer di PCR come primer di sequenziamento (vedi sopra).
- Montare le sequenze e allinearsi con la sequenza di riferimento LacI 40 per rilevare mutations.
Risultati
Il test in vivo mutagenesi misura un evento raro (mutante PFUs) tra i molti eventi (tutto PFUs). Eseguendo i test con piccolo numero di celle, è possibile che il risultato è notevolmente influenzata da risultati falsi positivi e falsi negativi. Per risolvere questo problema abbiamo effettuato un esperimento di diluizione seriale con cellule del midollo osseo non frazionata, raccolte dalle tre diversi animali. Abbiamo misurato la frequenza dei mutanti nel midollo osseo di questi animali con 1,4 x 10 6, 7,0 x 10 5, 3,5 x 10 5, e 1,75 x 10 5 cellule. I risultati (Figura 7) mostrano una relazione lineare tra il numero di cellule di ingresso e il numero di PFU di generato. È importante sottolineare che la frequenza dei mutanti è coerente, se misurata con basso o alto numero di cellule. Anche se non direttamente testata (a causa della scarsità di cellule), non c'è ragione di credere che questo non è il caso per LSKs e GMP.
t "> Il passo più importante in questo saggio mutagenesi è l'isolamento del DNA genomico (fase 2). Anche se la concentrazione di DNA dovrebbe idealmente essere ≥ 500 ng / ml, questo protocollo funziona bene con 40-150 ng / ml. Ancora più importante è il rapporto 260/280 (questo dovrebbe essere> 1.8-2.0) e il peso molecolare (dovrebbe essere intorno a 300-500 kb). E 'consigliato quando non si ha familiarità con il test per controllare la qualità e le dimensioni del DNA isolato . Figura 8 mostra un esempio di una corsa elettroforetica di DNA ad alto peso molecolare.Le marcature dei singoli PFUs su un vassoio mostrato in Figura 4B rappresentano una densità di placche ragionevole e realizzabile quando si parte da un piccolo numero di cellule purificate; un vassoio deve contenere tra 40-150 PFUs / quadratino. In questo particolare esperimento, la piccola piazza in figura 4B contiene 103 placche. L'altro quadrato sul vassoio, indicato nell'angolo superiore della figura 4A conteneva 111 PFUs. Questi due conteggi sono ravvicinati (differenza inferiore al 10%), se questo non è il caso, contare le placche in 5 piazze, estratti a caso sul vassoio, o ripetere l'esperimento, poiché la variazione può essere dovuta a troppo pochi placche su il vassoio. Su questo vassoio esempio, il numero totale di PFUs è ([103 +111] / 2) x 96 = 10.272 PFUs. Questo numero è inferiore ai 12.000 raccomandate PFUs da altri 41, perché usiamo piatti un po 'più piccole e 12.000 PFUs su questi vassoi non ci ha consentire una buona distinzione tra i singoli placche.
Figura 4C mostra esempi dei diversi tipi di targhe blu che possono essere osservati. Nel saggio mutagenesi LacI, la morfologia delle placche (cioè piena, settore o cerchio) è un'indicazione dell'origine della mutazione; completo è una mutazione di origine murina, mentre gli altri due sono probabilmente prodotte in E. coli 36,37. Su replating (vedi also Figura 6), quasi tutti placche "piene" riproducono> 70% placche blu di nuovo, mentre solo una piccola porzione delle placche settore do e praticamente nessuna delle spesso piccole, placche circolari.
Tabella 2 mostra la riproducibilità di formazione della placca con numero relativamente piccolo di cellule purificate rispetto a quello con un numero elevato di cellule di midollo osseo (lo stesso pool di cellule in cui le cellule sono state filtrate da) e cellule di milza.
PFUs Mutant sono confermati, prima di tutto replating (figura 6 mostra esempi rappresentativi di piatti per la conferma del mutante primario (blu) PFUs) e, dall'altro, mediante sequenziamento. I piatti in Figura 6 contenenti> 70% PFUs blu (i due inferiori) confermano che il mutante origine nel topo (e non in E. coli). Tuttavia, il piatto superiore sinistra non mostra PFUs blu e pertanto l'PFU primario non deve essere considerato mutante e sequencing non è necessario. Il piatto destro mostra ~ 65% PFUs blu. A seconda della forma della placca primario, questo campione sarà trasmesso per sequenziamento (vedi passo 8.4). Solo se una mutazione del DNA può essere confermata mediante sequenziamento sarà questo PFU conteggiata come mutante. Se non siete sicuri circa la forma del PFU, sequenza!
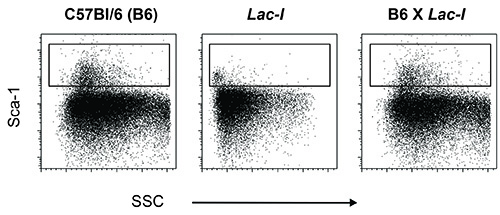
Figura 1. Sca-1 colorazione sulle cellule di midollo osseo da topi wild type C57BL6 (B6), topi transgenici Laci (LacI) e la progenie di un incrocio tra queste due cellule (B6 x LacI). Midollo osseo di topi B6 esprimono Sca- 1 sulla loro superficie delle cellule e questa caratteristica è utilizzata per purificare le cellule staminali e progenitrici. Topi transgenici Laci su uno sfondo B6, tuttavia, non esprimono Sca-1, questo indicatore deve essere stato perso while che istituisce la colonia. Per reintrodurre Sca-1 in topi transgenici Laci, questi topi sono stati incrociati con normali topi B6.

Sistema di Figura 2. Dialisi DNA. Tre membrane in possesso di una soluzione di DNA viscosa in centro (di colore blu per una migliore visualizzazione) sono galleggianti sul buffer TE. Le frecce rosse indicano piccole tacche nella membrana, che vengono utilizzati per l'identificazione del campione.

Figura 3. Efficiente modo per asciugare 60 o più agar / agarosio vassoi contenenti.
gether.within-page = "always"> 
Figura 4. Rilevamento di unità formanti placca (PFUs). Raffigurati sono (parti) grandi vassoi agar (illustrati nella figura 3), con colonie primarie di fago-infettati E. coli. (A) mostrato è un intero piatto con due piccoli quadrati disegnati su di esso per il conteggio placche. L'inserto rosso è mostrata ingrandita in (B). (B) Ogni individuo pennarello punto nero indica una chiara tipo selvatico PFU nella piastra di agar (103 in totale). (C) Forme diverse di PFUs potenzialmente mutanti. Clicca qui per vedere l'immagine ingrandita.
s/ftp_upload/50752/50752fig5highres.jpg "src =" / files/ftp_upload/50752/50752fig5.jpg "/>
Figura 5. Plexiglas conteggio piazze. Raffigurati sono un piccolo e grande piazza conteggio. Le misurazioni interne del grande piazza sono 5 cm x 5 cm, che della piazzetta 2,5 centimetri x 2,5 cm.

Figura 6. Conferma di mutanti unità formanti placca (PFUs). Vengono mostrati 4 piccoli piatti inoculati il giorno prima con un diluente di un PFU blu. Il piatto in alto a sinistra non mostra PFUs blu. Il piatto in alto a destra mostra ~ 65% PFUs blu. I due vassoi inferiori mostrano 80-90% PFUs blu (a sinistra) e il 100% PFUs blu (a destra). Le frecce rosse indicano chiaramente (wild type) PFUs.
re 7 "fo: content-width =" 4in "fo: src =" / files/ftp_upload/50752/50752fig7highres.jpg "src =" / files/ftp_upload/50752/50752fig7.jpg "/>
Figura 7. Frequenza di mutanti non frazionata nel midollo osseo. Raffigurati sono (A) il numero di PFUs, (B) il numero di mutanti e (C) la frequenza mutante misurata in tre differenti animali (24-26 mesi), che sono rappresentati da colori diversi. Per ciascun topo, le misurazioni sono state effettuate su quattro differenti dimensioni del campione: 1,4 x 10 6, 7,0 x 10 5, 3,5 x 10 5, e 1,75 x 10 5 cellule. I dati mostrano che all'interno di questo intervallo di celle, dimensione del campione non influenza significativamente le misure di frequenza mutanti.

Ficoelettroforesi ure 8. Pulsed-field di alto campioni di DNA di peso molecolare isolati da cellule purificate. DNA genomico è stato isolato come descritto al punto 2 del protocollo ed eseguito su un sistema Bio-Rad (CHEF-DR III). I vari campioni caricati sul gel sono campioni di DNA isolato da fegato (Li; corsia 1), cellule del midollo osseo impoverito di lignaggio matura + cellule (LB; corsie 2 e 14), le cellule CD34 + LSK (L; corsia 6), CMP (corsie 7-9), GMP (corsie 11 e 12) e Sca-1 + cellule (S, corsia 15). Corsia 4 detiene la scaletta per alta DNA peso molecolare. La figura mostra che la maggior parte del DNA è elevato peso molecolare (> 600 kb).
Tabella 1. Parametri del campione diversi di popolazioni purificate, tutto il midollo osseo e milza. Utilizzare questa tabella dove indicato nel Protocollo. Per ciascuna popolazione indicata sopra, il numero di cellule (5 x 10) per aliquota, tempo di digestione del DNA, il volume di campione di DNAdopo la dialisi, numero di reazioni necessarie per ciascuna aliquota e numero di vassoi richiesti per aliquota sono indicati sulla sinistra. I tempi di digestione a 50 ° C sono fondamentali per il successo dell'esperimento.
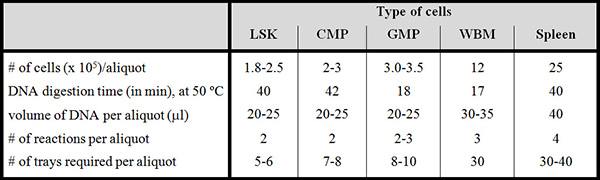
LSK = Lin - Sca-1 + cellule Kit + +; CMP = impegnata progenitore mieloide; GMP = granulociti / monociti progenitore; WBM = (indifferenziati) intero midollo osseo. Cellule della milza sono indifferenziati.
Tabella 2. Efficienza della formazione della placca è paragonabile tra le diverse popolazioni cellulari. Questa tabella mostra la formazione di placche all'interno delle diverse popolazioni. Sei mesi di età C57BL / 6 topi sono stati utilizzati per questi esperimenti (femori e tibie del 10-11 topi per esperimento, 6 esperimenti in totale). Tutto ma una delle popolazioni utilizzati in questi esperimenti gave almeno 1, fino a 24, (confermato) mutante PFUs (Zhou et al., manoscritto in preparazione). Numeri di PFU possono variare secondo ceppo di topi.
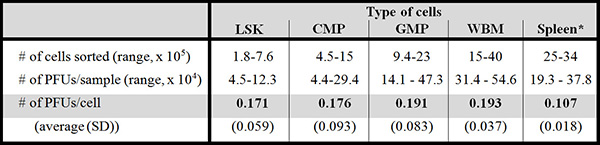
LSK = Lin - Sca-1 + cellule Kit + +; CMP = impegnata progenitore mieloide; GMP = granulociti / monociti progenitore; WBM = (indifferenziati) intero midollo osseo * Le cellule di milza sono indifferenziati.. SD = deviazione standard.
Tabella 3. Istruzioni per la preparazione dei reagenti supplementari.

§ Dal manuale di istruzioni Stratagene del DNA RecoverEase Isolation Kit
¶ Dal manuale di istruzioni Stratagene del Packaging Extract Transpack
Discussione
Il test in vivo mutagenesi qui descritta si basa sul modello di topo transgenico LacI originariamente generato da Kohler et al. 18 Questo modello utilizza un vettore fagico λ trasportano un gene reporter lacI. I due siti cos fiancheggianti il vettore consentire un recupero relativamente semplice e successivo confezionamento in particelle fagiche infettive, utilizzati per infettare E. coli. Una targa blu sarà generato da fago-infetti E. coli che contengono un gene mutato LacI. La targa blu è impostata su uno sfondo incolore, semplificando così enormemente il compito di segnare mutante. Tecniche di sequenziamento del DNA possono essere usate per identificare la posizione e il tipo di mutazione che si è verificato, che può aiutare ulteriori indagini sui meccanismi sottostanti mutagenesi.
Le modifiche che abbiamo fatto al protocollo di questo test di mutagenesi permettono di usarlo con hematopoie FACS-purificatopopolazioni di cellule tic. Tuttavia, abbiamo trovato che un'analisi riproducibile richiede ancora almeno 2 x 10 5 cellule ematopoietiche garantire quantità sufficienti di DNA di alta qualità. Poiché la frequenza a lungo termine ripopolamento CSE è estremamente basso 29, effettuando un'analisi mutagenesi su questi CSE è a questo punto non realizzabile. La popolazione di cellule staminali arricchita usiamo in questo protocollo, le cellule LSK, contiene oltre a Flk-2 - lungo termine ripopolamento CSE, anche FLK-2 - a breve termine ripopolamento CSE e Flk-2 + cellule, che rappresentano il progenitore multipotenziale cellule (PMP) 42. Nonostante questa limitazione riteniamo che l'utilizzo di cellule LSK come un read-out per la CSE in questo saggio mutagenesi è ragionevole poiché è stato dimostrato che le cellule LSK si comportano più come TSS-Flk-2 - CSE in termini di utilizzo NHEJ dalle cellule progenitrici 5. Inoltre, il lavoro di Rossi et al. 8 suggerisce che i PMP sono migliori in copia con danDNA ed oltre CSE, specialmente quando invecchiano, che ci porta a ipotizzare che il numero di mutanti presenti nella popolazione LSK riflette quella del CSE, piuttosto che le MPPs.
Da piccolo numero di cellule filtrate sono disponibili presso ciascun esperimento, un problema importante da considerare nella fase di pianificazione di questo test in vivo mutagenesi, è la dimensione del campione (ossia il numero totale di placche per campione) necessario per raggiungere la significatività statistica. In altre parole, quando l'obiettivo è quello di, per esempio, confrontare la frequenza di mutazione di cellule manipolate LSK alle cellule di controllo LSK wild-type, quanti placche in totale sono richiesti per ogni popolazione TSS per rilevare una differenza di due o tre volte in frequenza di mutazione? Da notare che il numero totale di placche possono essere combinati da tutti gli esperimenti, poiché abbiamo trovato alcuna differenza significativa tra esperimenti smistamento, almeno nelle cellule wild-type, in base ad un'analisi di regressione binomiale negativa 43. Targa numbri sono importanti per sapere perché questo determinerà il numero di ordinamenti che devono essere eseguite (~ 10.000 per WBM e GMP e ~ 7.000 per Spleen, LSKs e CMP). Dal momento che le frequenze di mutazione sono di piccole wild-type tessuti 44, l'approssimazione normale statisticamente confrontando questi non è preciso. Per questo motivo, utilizziamo la distribuzione di Poisson, dato che approssima la reale distribuzione binomiale (della frequenza di mutazioni) quando questa frequenza è piccola e la dimensione del campione è relativamente grande; Huffman 45 prevede una formula (Equazione 4) per calcolare le dimensioni campione basato sulla distribuzione di Poisson. Quando viene applicato a ipotetiche frequenze di mutazione di 2,5, 4, e 7 mutazioni per 100.000 cellule in cellule di controllo 44, abbiamo bisogno di 456.949 piaghe, 285.592 e 163.196 rispettivamente, per individuare una differenza duplice significativa (test a due campioni con due significato coda di 0,05 e potenza di 0,80). Meno placche sono tenuti a rilevare una triplicedifferenza: 122.148, 76.342 e 43.624 rispettivamente. Così, il numero di placche richieste per ogni frazione di interesse (e quindi il numero di tipi necessarie per ottenere abbastanza cellule) dipende dalla frequenza di mutazione che può essere previsto nella popolazione di cellule di controllo e la piega-cambiamento previsto nella popolazione confronto.
Il passo più importante in questo saggio mutagenesi è l'isolamento di DNA genomico (passaggio 2). Anche se è essenziale per iniziare questo protocollo con campioni di DNA di alta qualità (vedi "risultati rappresentativi"), quando si lavora con le cellule ordinati, i numeri di cellulare sono spesso limitate e non possono essere sprecati per determinare la concentrazione di DNA o dimensione. Abbiamo trovato che un altro indice significativo della qualità del campione di DNA è la sua viscosità, al passo 2.9 il campione deve essere estremamente viscoso e difficile da lavorare. Si richiede una certa pratica per ottenere questo diritto passo. Pertanto, si raccomanda di elaborare il protocollo con il numero di cellule di grandi dimensioni, ad esempio, con tutto il midollo osseo o Sca-1 + cellule filtrate, e prendere confidenza con isolare il DNA da questi campioni e imparare a giudicare la qualità del DNA da parte sua viscosità.
La qualità e la dimensione del DNA influisce sul numero di PFUs generato. Quando la fase di isolamento del DNA è perfezionato, il successivo elemento importante di ottimizzazione del saggio è la densità di PFUs per vassoio. Tabella 1 mostra il numero consigliato di vassoi da utilizzare per ogni tipo di campione corrispondente ad un numero ottimale di cellule per quel campione. L'utilizzo di questo orientamento dovrebbe tradursi in vaschette in cui i singoli placche possono ancora essere distinta, ma non sono distribuite troppo sottile. Un vassoio deve contenere tra 40-120 PFUs alla piccola piazza, l'esempio illustrato in Figura 4B rappresenta una densità ragionevole. Con questi aspetti ottimizzazione elaborati, il numero di PFUs generato per campione è altamente efficiente e riproducibile (Tabella 2).
"> Il modello di topo transgenico LacI è stato usato con una varietà di altri tessuti, ma non in combinazione con un numero relativamente ridotto di popolazioni altamente purificate. Quando applicato ad altri (oltre ematopoietiche) popolazioni di cellule staminali tessuto-arricchito-ristretto, si raccomanda a prestare particolare attenzione alla procedura di isolamento del DNA;. possono differire da tipo cellulare a tipo cellulare e la raccomandazione di cellule ematopoietiche non possono necessariamente funzionare per altri tipi di cellule tissutali I fattori critici, come la quantità di reagenti, la temperatura alla quale la proteinasi K digestione ha bisogno di prendere posto e, soprattutto, la proteinasi K tempo di digestione dovrà essere elaborato per ogni tipo di cellula, questo protocollo può servire come punto di partenza.Divulgazioni
Gli autori dichiarano interessi finanziari concorrenti.
Riconoscimenti
Vorremmo ringraziare David R. Rodriguez, MA per la progettazione grafica e la fotografia in questo manoscritto. Questo lavoro è stato sostenuto da un finanziamento della GCCRI, il NIH / NIA (5R21AG033339) e il Cancer Center Support Grant (P30CA054174) per l'impianto UTHSCSA Citometria a flusso Core e il Fondo UTHSCSA avanzata acidi nucleici Core.
Materiali
| Name | Company | Catalog Number | Comments |
| LacI transgenic mice | BioReliance Corporation | ||
| RecoverEase DNA Isolation Kit, including the RNace-It ribonuclease cocktail | Agilent Technologies (Stratagene) | 720202 | |
| Transpack Packaging Extract, including the orange and blue transpack tubes and the SCS-8 E. coli | Agilent Technologies (Stratagene) | 200221 | |
| DNA size standards – lambda ladder | Bio Rad | 170-3635 | |
| 0.025 mM Pore size membranes | Fisher (Millipore) | VSWP 025 00 | |
| 245 mm2 Bioassay dishes (trays) | Fisher (Corning) | 07-200-600 | |
| NZY broth (powder) | Fisher (Teknova) | N1144 | |
| Agar | Fisher | BP1423-500 | |
| Agarose | Fisher | E-3120-500 | |
| N,N-Dimethylformamide | Fisher | AC34843-5000 | |
| X-gal | Research Products Intl Corp (RPI) | B71800-10.0 | |
| Proteinase K | Roche | 3-115-852 | |
| PCR Extender Taq Polimerase kit | 5 PRIME | 2200500 | |
| Agencourt AMPure XP cleanup kit | Beckman/Coulter | A63880 |
Riferimenti
- Maslov, A. Y., Vijg, J. Genome instability, cancer and aging. Biochim. Biophys. Acta. 1790 (10), 963-969 (2009).
- Aguilera, A., Gomez-Gonzalez, B. Genome instability: a mechanistic view of its causes and consequences. Nat. Rev. Genet. 9 (3), 204-217 (2008).
- Milyavsky, M., et al. A distinctive DNA damage response in human hematopoietic stem cells reveals an apoptosis-independent role for p53 in self-renewal. Cell. Stem Cell. 7 (2), 186-197 (2010).
- Mohrin, M., et al. Hematopoietic stem cell quiescence promotes error-prone DNA repair and mutagenesis. Cell. Stem Cell. 7 (2), 174-185 (2010).
- Shao, L., Feng, W., Lee, K. J., Chen, B. P., Zhou, D. A sensitive and quantitative polymerase chain reaction-based cell free in vitro non-homologous end joining assay for hematopoietic stem cells. PLoS ONE. 7 (3), (2012).
- Sotiropoulou, P. A., et al. Bcl-2 and accelerated DNA repair mediates resistance of hair follicle bulge stem cells to DNA-damage-induced cell death. Nat. Cell Biol. 12 (6), 572-582 (2010).
- Prasher, J. M., et al. Reduced hematopoietic reserves in DNA interstrand crosslink repair-deficient Ercc1-/- mice. EMBO J. 24 (4), 861-871 (2005).
- Rossi, D. J., et al. Deficiencies in DNA damage repair limit the function of haematopoietic stem cells with age. Nature. 447 (7145), 725-729 (2007).
- Reese, J. S., Liu, L., Gerson, S. L. Repopulating defect of mismatch repair-deficient hematopoietic stem cells. Blood. 102 (5), 1626-1633 (2003).
- Carney, D. A., et al. Therapy-related myelodysplastic syndrome and acute myeloid leukemia following fludarabine combination chemotherapy. Leukemia. 24 (12), 2056-2062 (2010).
- Jankowska, A. M., et al. Base excision repair dysfunction in a subgroup of patients with myelodysplastic syndrome. Leukemia. 22 (3), 551-558 (2008).
- Tam, C. S., et al. Treatment-related myelodysplasia following fludarabine combination chemotherapy. Haematologica. 91 (11), 1546-1550 (2006).
- Webb, S. Xeroderma pigmentosum. BMJ. 336 (7641), 444-446 (2008).
- Ben-Yehuda, D., et al. Microsatellite instability and p53 mutations in therapy-related leukemia suggest mutator phenotype. Blood. 88 (11), 4296-4303 (1996).
- Casorelli, I., et al. Drug treatment in the development of mismatch repair defective acute leukemia and myelodysplastic syndrome. DNA Repair. 2 (5), 547-559 (2003).
- Olipitz, W., et al. Defective DNA-mismatch repair: a potential mediator of leukemogenic susceptibility in therapy-related myelodysplasia and leukemia. Genes Chrom. Cancer. 34 (2), 243-248 (2002).
- Haase, D., et al. New insights into the prognostic impact of the karyotype in MDS and correlation with subtypes: evidence from a core dataset of 2124 patients. Blood. 110 (13), 4385-4395 (2007).
- Kohler, S. W., et al. Analysis of spontaneous and induced mutations in transgenic mice using a lambda ZAP/lacI shuttle vector. Environ. Mol. Mutagen. 18 (4), 316-321 (1991).
- Rogers, B. J., Provost, G. S., Young, R. R., Putman, D. L., Short, J. M. Intralaboratory optimization and standardization of mutant screening conditions used for a lambda/lacI transgenic mouse mutagenesis assay. 327 (1-2), 57-66 (1995).
- Jakubczak, J. L., et al. Analysis of genetic instability during mammary tumor progression using a novel selection-based assay for in vivo mutations in a bacteriophage lambda transgene target. Proc. Natl. Acad. Sci. U.S.A. 93 (17), 9073-9078 (1996).
- Ward, T. L., Prtenjaca, A., Hill, K. A. A novel Escherichia coli-derived mutation detected with the Big Blue cII mutant selectable assay. Environ. Mol. Mutagen. 51 (4), 344-348 (2010).
- Miller, J. H., Coulondre, C., Farabaugh, P. J. Correlation of nonsense sites in the lacI gene with specific codons in the nucleotide sequence. Nature. 274 (5673), 770-775 (1978).
- Provost, G. S., et al. Transgenic systems for in vivo mutation analysis. Mutat. Res. 288 (1), 133-149 (1993).
- Schaaper, R. M., Danforth, B. N., Glickman, B. W. Mechanisms of spontaneous mutagenesis: an analysis of the spectrum of spontaneous mutation in the Escherichia coli lacI gene. J. Mol. Biol. 189 (2), 273-284 (1986).
- Schaaper, R. M., Dunn, R. L. Spontaneous mutation in the Escherichia coli lacI gene. Genetics. 129 (2), 317-326 (1991).
- Burkhart, J. G., Burkhart, B. A., Sampson, K. S., Malling, H. V. ENU-induced mutagenesis at a single A: T base pair in transgenic mice containing phi X174. Mutat. Res. 292 (1), 69-81 (1993).
- Valentine, C. R., et al. Characterization of mutant spectra generated by a forward mutational assay for gene A of Phi X174 from ENU-treated transgenic mouse embryonic cell line PX-2. Environ. Mol. Mutagen. 39 (1), 55-68 (2002).
- Gossen, J. A., Molijn, A. C., Douglas, G. R., Vijg, J. Application of galactose-sensitive E. coli strains as selective hosts for LacZ- plasmids. Nucleic Acids Res. 20 (12), 3254 (1992).
- Kiel, M. J., et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6674), 193-197 (2000).
- Frascoli, M., Proietti, M., Grassi, F. Phenotypic analysis and isolation of murine hematopoietic stem cells and lineage-committed progenitors. J. Vis. Exp. (65), (2012).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273 (5272), 242-245 (1996).
- Stratagene, Transpack packaging extract for lambda transgenic shuttle vector recovery. Instruction manual. , (2001).
- Stratagene, RecoverEase DNA isolation kit. Instruction manual. , (2009).
- Stratagene, Big Blue transgenic mouse mutagenesis assay system. Instruction manual. , (1992).
- Nishino, H., Buettner, V. L., Sommer, S. S. Towards validation of the Big Blue transgenic mouse mutagenesis assay: the mutational spectrum of ex vivo pinpoint mutant plaques. Muta. Res. 372 (1), 97-105 (1996).
- Stuart, G. R., Gorelick, N. J., Andrews, J. L., de Boer, J. G., Glickman, B. W. The genetic analysis of lacI mutations in sectored plaques from Big Blue transgenic mice. Environ. Mol. Mutagen. 28, 385-392 (1996).
- Bielas, J. H., Heddle, J. A. Proliferation is necessary for both repair and mutation in transgenic mouse cells. Proc. Natl. Acad. Sci. U.S.A. 97 (21), 11391-11396 (2000).
- Paashuis-Lew, Y., Zhang, X. B., Heddle, J. A. On the origin of spontaneous somatic mutations and sectored plaques detected in transgenic mice. Mutat. Res. 373 (2), 277-284 (1997).
- de Boer, J. G., Glickman, B. W. The lacI gene as a target for mutation in transgenic rodents and Escherichia coli. Genetics. 148 (4), 1441-1451 (1998).
- Piegorsch, W. W., et al. Study design and sample sizes for a lacI transgenic mouse mutation assay. Environ. Mol. Mutagen. 25 (3), 231-245 (1995).
- Yang, L., et al. Identification of Lin(-)Sca1(+)kit(+)CD34(+)Flt3- short-term hematopoietic stem cells capable of rapidly reconstituting and rescuing myeloablated transplant recipients. Blood. 105 (7), 2717-2723 (2005).
- Hilbe, J. M. . Negative Binomial Regression. second edn. , (2011).
- de Boer, J. G., Provost, S., Gorelick, N., Tindall, K., Glickman, B. W. Spontaneous mutation in lacI transgenic mice: a comparison of tissues. Mutagenesis. 13 (2), 109-114 (1998).
- Huffman, M. D. An improved approximation to-sample poisson test. Appl. Stat. 33 (2), 224-226 (1984).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon