Method Article
在纯化造血干/祖细胞识别DNA突变
摘要
这里我们描述了对小数目使用了LacI转基因小鼠模型纯化造血干细胞的体内诱变法。该LacI的基因可以分离来确定频率,位置和类型的DNA突变的自发产生或暴露于基因毒素后。
摘要
在最近几年,已经很明显,基因组不稳定性是紧密相关的许多发育障碍,癌症和衰老。由于干细胞有责任确保整个生命组织的平衡和修复,这是合理的假设,该干细胞群是维护组织的基因组的完整性至关重要。因此,显著的兴趣已经出现在评估内源性和环境因素对干细胞基因组的完整性及其后代的影响,旨在了解干细胞基础疾病的病因。
LacI的转基因小鼠携带一个可恢复的λ噬菌体载体编码了LacI报道系统,其中的了LacI基因作为突变记者。突变了LacI基因的结果是产生β-半乳糖苷酶能够水解显色底物,将它的蓝色。该LacI的报告系统是我进行n上的所有细胞,包括干细胞/祖细胞,并可以很容易地回收并用于随后感染大肠杆菌大肠杆菌 。培养大肠杆菌感染后, 大肠杆菌琼脂糖包含正确基板,斑块可以拿下;蓝斑表明突变了LacI基因,同时明确斑块怀有野生型。蓝色(其中清除)斑块的频率指示在原始细胞群的DNA从提取出的突变频率。测序突变了LacI基因将会显示突变的基因中的位置和突变的类型。
该LacI的转基因小鼠模型是行之有效的体内突变检测。此外,小鼠和试剂用于测定是市售的。在这里,我们详细描述了如何这种模式可以用来测量自发发生的DNA突变在干细胞富集的林频- IL7R -的Sca-1 + CKIT +(LSK)细胞和造血系统的其他亚群。
引言
在大多数组织中,分化的细胞具有有限的寿命。为了保持功能完整,长寿命,组织特异性干细胞不断产生祖细胞,这反过来会产生所需的特定的组织的功能的完全分化的细胞。干细胞还可以通过一个叫做自我更新过程中补充自己的车厢。因此,干细胞是负责维护他们居住。因此组织的功能完整,是非常重要的,他们都配备了强大的机制来检测和潜在的修复受损的DNA。如果没有,他们可能获得多个基因(可能有害)的扰动,可以通过他们的后代继承。了解在一个生物体的寿命怎么干细胞的安全,保卫自己的基因组是一个重要的问题,可以帮助我们理解为什么基因组不稳定性与癌症和其他一些与年龄有关的疾病(在1,2审查)相连。
控制一个组织在干细胞或早期祖细胞群的水平的基因组的完整性可以通过经由细胞死亡,衰老或分化消除缺陷的干细胞(或祖细胞),和/或通过高效修复来实现受损的DNA。最近的研究已经表明,它可以直接在这些稀有种群3-6测量某些类型的DNA修复。我们发现,例如,在造血系统中,双链DNA的断裂,可通过同源重组(HR)或非同源末端连接(NHEJ),后者是较低保真度的修复过程,从而使增加的风险修错误。两者都被利用在造血干细胞(HSCs)4,5,然而,在小鼠中,似乎它主要是NHEJ在造血干细胞,而早期祖细胞利用HR 4。类似的观察是为干细胞在皮肤6。有趣的是,在人类造血干细胞的人力资源,而不是NHEJ,似乎是首选的双链断裂3的修复机制。无论这两个物种之间的功能差异是真实的还是仅仅代表一个技术或实验的差异,还有待观察。
干细胞的剧目,以修复受损的DNA很可能包括其它DNA修复机制,如碱基切除修复(BER),核苷酸切除修复(NER)和错配修复(MMR)。 BER和NER负责修理单个或多个碱基对病变的单链DNA,而MMR修复碱基 - 碱基错配和插入/缺失环;这些类型的DNA损伤不能被NHEJ或HR修复。支持这一概念是从造血系统证明在这些途径和异常在HSC室7-9中的一个变化之间的联系,以及显影骨髓增生异常综合征10-16,一种疾病,起源于风险增加若干研究HSC和与增加基因组不稳定性随着病情的发展17有关。到目前为止,还没有报道的误码率,净入学率,和MMR直接在造血干细胞的测量。
除了 阐明了在一个机械控制电平组织完整性的各种处理,就必须能够测量突变的DNA的程度,从而使像差在这些过程中的一个后果可以进行测试, 例如 ,在正常与基因改造的干细胞或老与年轻。然而,有关测定的发展是因为组织特异性干细胞的缺乏及缺乏的培养条件,可以保留"干细胞"的困难。此外,这样的测定应易于进行环境和遗传操作。一种可能的解决方案,这些限制和要求是采用了专门设计的,以检测DNA突变的小鼠模型。
MUL已经开发tiple转基因小鼠模型进行突变检测。例如,LacI的转基因小鼠18携带一个可恢复的λ噬菌体载体编码了LacI报道系统,其中的了LacI基因编码Lac操纵的抑制剂和作为突变记者。待了LacI基因的突变,lac 操纵子被激活,并且β-半乳糖苷酶的生产。 β-半乳糖苷酶裂解产色底物X-gal的(5 - 溴-4 - 氯-E-吲哚基-β-D-吡喃半乳糖苷),它把它的蓝色。该COS的网站侧翼LacI的载体可以轻松地恢复由λ噬菌体的蛋白质和E的后续感染大肠杆菌 。培养大肠杆菌感染后, 大肠杆菌琼脂糖含有X-gal的基板,斑块可以拿下。蓝色斑块含有一个假定的突变紫胶,我携带的噬菌体,而清晰的斑块怀有非突变体。蓝斑的频率(在日ë明确的)指示在原始细胞群的DNA从提取出的突变频率。此外,λ噬菌体托管LacI的目标可以很容易地利用PCR技术进行相对高通量测序分析。测序多个突变了LacI基因将揭示关于突变谱,这反过来又可以指向特定的DNA修复途径可能存在的缺陷,或以特定的基因毒性事件的重要信息。在LacI的转基因系统已经被标准化到多个实验室19和试剂是市售的。在LacI的系统的一个主要缺点是,检测大的缺失或重排的能力有限,因此,其他的方法, 例如 ,多色FISH对中期扩展需要被用来赞美这方面的不足。
内的LacI的小鼠模型中的λ噬菌体载体,有一个更小的基因,CII,可用于突变分析。它的大小和事实,即突变体可以选择使这比LacI的基因分析少,劳动密集和更便宜的检测20。然而,LacI的基因被更广泛地研究用于诱变21和基因突变的敏感性已被很好地表征,以便有氨基酸残基生成的显色底物22-25表型应答的清楚的理解。
其他小鼠模型进行突变检测包括使用ΦX174或LacZ基因的转基因。该ΦX174转基因小鼠模型,与原A:T→G的:C回复突变试验26或正向突变试验27,使检测碱基对替换的频谱的,代表一个成本更低的系统比LacI的模型。然而,在正向测定法的突变屏幕是不平凡的,该突变规格该ΦX174转基因的TRUM不作为良好的特点为,该LacI上的。在进行LacZ的转基因小鼠模型中,LacZ基因突变记者被回收利用E。大肠杆菌宿主细胞,以半乳糖和半乳糖含有28培养基敏感。这个系统的一个缺点是,LacZ基因靶的恢复也涉及到限制性内切酶消化后,通过连接大肠杆菌的和电穿孔大肠杆菌宿主,由此使得难以适应系统以小数量的细胞。虽然它不是用于干/祖细胞群的工作是绝对需要的(一个可以随时开始更加小鼠),如果需要大量的细胞( 例如百万或更多)也将很快成为不切实际,成本太高。此外,LacZ基因的体积比较大,同时提供一个敏感的突变记者,繁琐,更昂贵的DNA序列分析和determ的萌发的突变谱。这种模式的主要优点但是,它能够检测到大缺失和插入,以及染色体重排。
由于所有细胞在LacI上,ΦX174和LacZ转基因小鼠模型进行的报告系统,所有这些小鼠模型可用于测量诱变在任何感兴趣的细胞类型,包括干细胞和祖细胞,只要它们能够可靠地收集以及足够数量的。因为我们与LacI的小鼠模型和LacI的突变分析的丰富经验,我们决定对本系统进一步诱变分析造血干细胞和祖人口。
造血组织是良好的特点在它的各个组成部分,包括长期再植干细胞,这是识别成霖的极为罕见人口的细胞表面表型方面- IL7R -的Sca-1 + CKIT + +(LSK)/ FLK2 - CD150 + CD48 -细胞29。 。Mohrin等[4]表明,LSK/Flk2的稍大人口-细胞仍是良好的造血干细胞代表和显著的不同从最原始的承诺髓系祖(CMP)的人口,当涉及到研究DNA修复。此外,当HSC-富集LSK(的Flk-2 +和的Flk-2 - )细胞相比,林- IL7R -的Sca-1-CKIT + +(LS-K祖细胞),但仍然是在一个显著差异NHEJ低纯度的能力5,干细胞富集的LSK人口和祖细胞。在我们的研究中,我们使用的HSC富集的LSK(的Flk-2 +和的Flk-2 - )细胞,因为我们发现至少有2×10 5细胞都需要一致的,可靠的结果,在这个突变检测,这细胞数目是非常困难的取得时1排序LSK/Flk2 - CD150 + CD48人口甚至LSK/Flk2 -人口(在小鼠中,成本和实用性方面)。此协议的基础上,最初由Kohler 等人开发的18一详细介绍了如何自发的DNA突变频率可以在LSK细胞决定和分化的定义髓系细胞群体以及未分离的骨髓和脾脏细胞。
研究方案
从LacI的转基因小鼠在C57BL / 6背景白细胞不表达的Sca-1( 图1)。因此,如果的Sca-1是用于细胞纯化的标记物,这些小鼠中需要用合适的菌株获得的Sca-1的表达被划线,在这种协议定期的C57BL / 6(B6)小鼠和LacI上的杂交的F1 (C57BL / 6)的转基因小鼠(LacI的 )是使用( 图1)。在这个协议中使用的细胞群,LSKs和中医师表示最小种群骨髓。为了从唯一的后腿,或从至少四个收获小鼠骨髓时,净化至少2×10 5每个/排序,从大约十相结合的小鼠骨髓的时候也臀,前肢-,脊柱骨,和胸骨被使用。
使从骨髓和脾的单细胞悬浮液。骨髓中的一个小部分被用作是,大部分用于PUR通过荧光激活细胞分选(FACS)IFY LSKs和分化的骨髓祖细胞, 即中医和粒细胞/单核细胞祖细胞(总纲图)。骨髓细胞的分离和流式细胞仪净化这些人群的其他地方30-32描述。约六个独立的各种需要,以确定种群间基因突变的频率显著差异。
下面的协议,用于测量自发体内突变频率中纯化造血亚群体适于从几个Stratagene公司的说明书33-35基于来自Kohler 等 18原来工作的现有协议33-35和这个协议之间最重要的区别,用相对较小的数字的单元格时,必需的,包括试剂的体积差异和时间,用于蛋白酶K的孵化温度。
1。样品储存
收集所需的细胞群,分装细胞的1-ml离心管后(每等分细胞数, 见表1)。离心机在266×g离心7分钟,在4℃下小心吸出上清液。把管放入液氮中5分钟,然后将它们传输到-80℃冷冻以供进一步使用。样品可以贮存至少6个月。
2。基因组DNA的分离
- 取样品从-80℃冰箱。加入500μl冰冷的DNA的裂解缓冲液( 表3)的样品管中。涡流管3-5秒中速,并将管置于冰上10分钟。
- 离心管12分钟,4,000×g离心,4°C。小心丢弃〜450μL上清液。降速为3-5秒的管。使用玻璃毛细管小心取出上清液的剩余部分。风干吨的内壁他管,直到没有液滴是可见了(〜2分钟)。
- 加入2μl的RNace,它核糖核酸鸡尾酒和10微升的1 M DTT至100微升的DNA消化缓冲液( 表3)。根据将要处理的样本的数目调整音量; 20微升该DNA消化溶液的每个样本是必要的。加入20微升的这种以细胞沉淀后,尽量让小球从底部脱离本身,轻轻敲击管子用手指或笔。
注意:可能很难看到,因为低细胞数目的颗粒。 - 加入20微升蛋白酶K溶液*( 表3)每个样品,轻轻地再次轻按管。
*注意:该蛋白酶K溶液应预热在50℃的水浴,2分钟,以激活酶后才能使用。 - 在50℃水浴中立即放置管。根据该指引,消解样品表1。点选管轻轻地每10分钟。
注意:对于这种小数量的细胞,该水浴的温度与消化时间是成功地获得高品质的基因组DNA的绝对关键的。 - 制备的DNA的透析系统在冷室( 图2)。倾600毫升TE缓冲液中( 表3)放入600ml玻璃烧杯中,加入一个小的磁力搅拌棒,以使缓冲器可以透析过程中进行搅拌,并让(0.025毫米孔径)膜浮在缓冲器的表面上。每个样品一膜; 1-4膜可以在一个单一的透析烧杯中。就用剪刀识别各样品的膜的边缘的标记。
- 经过适当的消化时间,增加现在非常粘稠的基因组DNA *小心到浮动膜片的中心( 图2)。盖上烧杯立即用铝箔。透析的基因组DNA在4℃〜16-20小时,搅拌缓冲平缓。
*注:当粘性DNA溶液时,使用移液器吸头与宽的开口。 - 第二天倒600毫升新鲜配制的TE缓冲液( 表3),以一个干净的玻璃烧杯,膜,用勺子非常仔细地转移到新的烧杯中,盖上铝箔的烧杯中。透析另外2小时。
- 从与用勺子的TE缓冲液的烧杯中取出透析膜并转移DNA溶液到新的无菌1毫升管只有最粘的"丛"。样品保存在4°C。继续诱变试验,第二天或最多1.5个月后。对于纯化的人群,等待至少1周。
3。对大肠杆菌制备的托盘大肠杆菌 /噬菌体文化(第1天)
每个托盘将包含两个不同的层;琼脂层的底部和琼脂糖层在包含X-gal的顶部。 大肠杆菌大肠杆菌/噬菌体溶液将被加入到后者。细胞中分离出来的数量和类型将决定有多少塔板是必需的。参考表1,计算所需的托盘和这部分协议的解决方案,随后的量数。下面将产生〜60塔板,其中一个有经验的人可以很容易地处理。
- 准备以下介质:
- 用于底层,制备6×2升烧瓶,每个含有1600毫升双蒸2 O。添加NZY粉(21克/ L)和琼脂(15克/升);拌匀。
- 用于顶层,制备4×1升烧瓶,每个含有800毫升双蒸2 O。添加NZY粉(21克/ L)和琼脂糖(7.2克/升);拌匀。
- 为培养大肠杆菌大肠杆菌,加2.5克NZY粉末的每个2×250毫升烧瓶中,并把体积至100ml双蒸2 O;
- 对于在步骤8中使用的确认托盘,添加8.4克NZY粉和6克的AGAr以1升的烧瓶中,使体积为400毫升双蒸2 O。
- 盖上铝箔烧瓶开幕。搅拌均匀,高压灭菌121℃,15磅30分钟。
- 从高压釜中取出烧瓶(非常炎热!)。小心摇动烧瓶混合琼脂和琼脂糖,然后将它们放置在50℃水浴。当水浴已达到50℃再次,从2升瓶(步骤3.1.1)倒入约150ml NZY琼脂在每个托盘(底层)。
- 使琼脂固化在室温下至少2小时,然后反转,打开的托盘。放置在托盘的底部上的盖子,45°偏离中心( 图3),并让干燥30分钟。合上纸盘和离开O / N在室温。
- 同时,准备SCS-8 E.大肠杆菌培养的第二天。从两个250ml烧瓶的1 *(步骤3.1.3),取5毫升NZY培养基( 表3),并转移到一个无菌的14米升管。补充与62.5微升麦芽糖/ 硫酸镁溶液中,加入10微升的SCS-8 E的大肠杆菌甘油。在37℃,在250-300转,而摇晃3-4小时。使用15微升这种文化的接种95毫升NZY肉汤(在250毫升手枪瓶),文化O / N在37℃的摇床(250转)。
*注:其他的250毫升烧瓶中,可用于以后如果需要的话,调整培养物的OD(步骤4.1) - 取1升量瓶中,用琼脂(步骤3.1.4),倒〜6-7毫升NZY琼脂60 mm培养皿(这将是足够的〜50的菜肴,所需要的步骤8)。让琼脂变硬(〜10分钟),然后反转并用塑料。这些菜可以保持在4℃最多一个月。
4。对大肠杆菌制备的托盘大肠杆菌 /噬菌体文化(2天)
- 检查SCS-8 E的外径大肠杆菌培养(步骤3.5)的分光光度计。调整外径600 0.6用NZY培养基( 表3)(步骤3.1.3),然后将烧瓶置于冰上停止增长并保持在冰上,直到准备使用。这将用于步骤6.3和8.2。这种文化可以保存5天,在4°C。
- 空气干燥所有检测托盘(倒前一天)为〜5小时( 图3)。
5。包装基因组DNA(2天;续)
- 拿橙TRANSPACK所需数量的离心管,出-80℃冷冻并把他们放在干冰,直到准备使用;需要一个橙色TRANSPACK管要执行的每个包装反应。适当地标记每个管。有基因组DNA样品(步骤2.9)准备上冰。
- 这一步应该执行一管的时候。完成移动到下一个DNA样本前完成步骤。解冻一根橙色管* 注1快速:用你的手指,直到大部分被解冻,然后把在冰上。采取相应的基因组DNA样品,并立即8-12微升样品* 注2,3转移到橙色管。通过轻轻拍打管,用手指轻轻地上下吹打3倍,以及混合的内容。尽量不要混合时产生气泡。将管置于30℃水浴中90分钟。
*注1:一个快速旋转的离心可能是必要的,以收集从内壁的所有内容和盖。
*注2:添加样品的体积取决于用来产生该样品的细胞数:11-12微升从2.0-5.0×10 5个细胞制备的样品,10微升的1.0×10 6个细胞的样品,和8微升为1.5×10 6个细胞样品。
*注3:DNA仍然是非常粘稠的,采取的DNA出的吸管尖推至样品管的底部,小心地拧绕的前端靠管的内壁。 - 取1或2个蓝色TRANSPACK TUBES *在-80℃冷冻并把他们放在干冰,直到进一步使用。解冻他们迅速和12微升转移到每一个橙色的管子。轻轻吹打向上和向下3次混合的解决方案。旋管下2-3秒,然后点选管,用手指作进一步混合,并立即返回到30℃水浴中另外90分钟。
*注:使用1蓝管5-6反应和2个蓝色管10-12的反应。 - 90分钟后,加入稀释用970微升SM缓冲液*( 见表3)每个反应,使反应停止,并涡旋以中速,持续5秒。把试管置于冰上,直到进一步使用。
*注:如果细胞数是≤5×10 5个,则使用500微升SM缓冲液( 表3),以使反应停止; 2管(同一样品的)然后可以稍后组合(步骤6.4)。
6。电镀包装基因组DNA(第2天;续)
- 关闭倒琼脂吨开设了干燥,早上的光线。标签的托盘每个样品。
- 溶于4.8克X-gal的16.8毫升N,N-二甲基甲酰胺(所需的步骤6.5)。立即搅拌均匀,放在摇床平台。防止光。溶液应澄清在20-30分钟。
- 分装SCS-8 E.大肠杆菌细胞。对于每一组的托盘*,使用一个50ml锥形管中。标签的管与被包装的DNA样品的名称。加入2ml E的菌悬液为每个纸盘。
*注:例如3×10 5的绿化总纲图需要一套8盘( 见表1)。因此,两等份,需要8×2 = 16盘。保持等份分开,从而准备两份50ml试管,每8×2 =16毫升E。菌悬液。 - 加入1毫升包装的DNA样品*(步骤5.4),以适当的50ml管中含有SCS-8 E。大肠杆菌等分拌匀。这孵育E.用颤抖的衍丰大肠杆菌 /噬菌体混合乌兰巴托(250-300转),在37℃下23分钟。
*注意:如果DNA是从≤5×10 5个细胞中提取,将500μl的SM缓冲液,使反应停止(步骤5.4)。在这个步骤中,管可以组合并添加到1 50ml锥形管中。 - 当E。大肠杆菌 /噬菌体混合物孵化,开始筹备顶层琼脂糖层。加入5 ml X-gal的/ N,N-二甲基甲酰胺溶液(步骤6.2),以每800毫升烧瓶的顶层琼脂糖溶液(来自步骤3.1.2;保持在50℃)。的X-gal的最终浓度为1.5毫克/毫升。当加入到琼脂糖的X-gal的可能沉淀一点。漩涡溶解在X-gal和把瓶子放回50℃水浴。
- 就拿E.大肠杆菌 /噬菌体混合出的孵化器(步骤6.4)。每个样本需要多个托盘,每个托盘,需要50毫升X-gal/agarose解决方案(步骤6.5)。倾X-gal/agarose所需的体积为每个样品( 即 50毫升×在托盘的数量)较大的无菌塑料瓶,并添加适当的大肠杆菌大肠杆菌 /噬菌体混合。摇动瓶子混合。在45-50毫升50毫升锥形管等份分割混合物。管的数量应该是相同的要求为该样品托盘的数量。
注意:吃剩的X-gal/agarose解决方案将在步骤8.3中使用。该溶液可以被存储在一个50℃的水浴中,直到进一步使用。 - 倒在底部的检测托盘的一半容量为50毫升顶层琼脂糖混合物。由稍微倾斜试验托盘在一个方向迅速蔓延的琼脂糖。
注:琼脂糖将降温非常迅速,将成为不可能分布在托盘。因此,此步骤需要执行相对快速和琼脂糖是一直保持在50℃。 - 允许顶层琼脂糖硬化至少15分钟。然后,反转并打开检测盘,让他们风干30分钟( 图3)。
- 合上托盘,孵化倒立(顶部底部琼脂层侧)的检测盘在37℃下15-16小时。不要堆叠超过5盘。
7。一个推定的突变频率的测定(3天)
- 从37℃培养箱中取出托盘,让他们冷静下来。算上半透明斑形成单位(PFU)每个托盘上,随机选择托盘上的2个部位,绘制正方形* 2.5×2.5厘米2或5×5厘米2,并计算所有个PFU在每平方米有标记细胞计数器( 图4A,B)。
*注:为了绘制方使用的装置, 如图5。如果计数的个PFU的数量≥40,可使用更小的正方形,否则使用较大。 - 利用计算的平方的平均值,由96如果计算具有较小的平方乘以;或24,如果计数与大的一个乘以这个数。加个PFU数计算所有纸盘从SA我品尝。这是个PFU的该样品所产生的总数量。
- 接着,计数在每一个托盘上的突变斑块。现在的托盘已经冷却下来,这将有助于找出突变斑块。为了进一步方便验出蓝色斑块,移动托盘在红色和/或白色表面,红色和白色的纸张很好地工作。圆圈上的任何蓝斑用标记笔。记录每一个突变体的蓝色的形状和强度( 例如全,圆形,扇形, 图4C)36,37。
- 通过个PFU的总数 (步骤7.2)将突变个PFU的数量(步骤7.3)确定推定的突变频率对于每个样品。
8。假定的突变体斑块(3-5天)的验证
- 使用巴斯德吸管,芯各突变体(蓝色)PFU和插头转移到250微升无菌的SM缓冲液( 表3)。加入25μL氯仿,涡旋,持续5秒在4°C D店继续次日或下一个步骤继续之前离开2小时在室温,以验证该突变PFU确实是一个突变。样品可以储存在4℃下至少1年。
- 标签酮1 ml和1个4毫升的无菌管中插入的每个突变。在新1毫升管,稀释从琼脂塞在无菌的SM缓冲液(步骤8.1)1:50(2微升样品放入100微升SM缓冲液( 表3)),涡旋简要,预留释放的噬菌体悬浮。到4毫升的无菌试管中加入200μl的SCS-8 E.大肠杆菌培养物(来自步骤4.1)和2μl从相应的1毫升管中稀释的噬菌体,在37℃下进行5-10分钟。
- 加2.5毫升含有X-gal的(从左以上从步骤6.6),以每次4毫升管,旋流管混合后,倾注在60毫米NZY琼脂平板上的顶层琼脂糖的预先倾(步骤3.6)。离开10分钟(以令t他最琼脂糖凝固),反转菜和孵化O / N为37°C。
- 第二天早上,从孵化器中取出培养皿,并确定蓝色个PFU对每道菜( 图6)的比例。当个PFU的70%以上是蓝色的,一个突变被认为是证实[38,39]。芯从盘的突变体斑块,放入1.5ml的螺丝顶管,含有250微升SM缓冲液( 表3)和25微升氯仿,它现在已准备好用于测序。
- 当50%或更少的PFU的是蓝色的,它不被认为是真正的突变体38,39。当蓝色个PFU的频率在60-70%之间,回来检查,在对斑块的形状的说明;如果PFU的形状是"全",进行测序。
9。测序在LacI的Ğ烯突变
- 建立PCR反应在25μl反应体系,其中包括1.5μ;升斑块上清液(模板,步骤8.4)中,正向引物SF1(5'-GGAAACGCCTGGTATCTT-3')和反向引物SR2(5'-GCCAGTGAATCCGTAATCA-3')。根据制造商的说明书使用PCR扩Taq聚合酶试剂盒。循环条件如下:94℃2分钟,然后35个循环的94℃20秒,60℃20秒,72℃2分钟,随后72℃5分钟的最后一个步骤。
- 取各反应的5微升的等分试样,并运行在0.8%琼脂糖凝胶上,以确认扩增。
- 清理根据制造商的说明使用Augencourt净化试剂盒的PCR反应。
- 定量模板DNA。
- 使用〜100ng的PCR产物作为模板DNA进行测序。在使用相同的PCR引物作为测序引物(见上文)的两个方向的序列的扩增子。
- 装配序列,并与LacI的参考序列40对齐,以检测穆塔蒂附件。
结果
体内突变分析测量一个罕见的事件(突变个PFU)的许多事件中(所有个PFU)。通过用少量的细胞进行测定,这是有可能的结果是相当受假阳性和假阴性结果的影响。为解决这一问题,我们进行了连续稀释的实验与普通骨髓细胞,从三个不同的动物收获。我们测定了突变体的频率在这些动物的骨髓用1.4×10 6,7.0×10 5,3.5×10 5,1.75×10 5个细胞。结果( 图7)显示输入单元号和生成PFU的数量之间的线性关系。重要的是,突变的频率是一致的,无论是测量低或高数量的细胞。虽然不能直接(由于细胞的缺乏)进行测试,没有理由相信,这是不适合LSKs和总纲图的情况。
T">这个突变试验中最重要的一步就是基因组DNA(步骤2)的隔离。虽然DNA浓度最好应≥500纳克/微升,该协议能够很好地处理40-150纳克/微升。更重要的是在260/280的比例(这应该是> 1.8〜2.0)和分子量(应该在300-500 kb的),建议当一个人不熟悉的检测,以检查分离的DNA的质量和大小图8示出的高分子量DNA的电泳运行的一个例子。个别个PFU对图4B所示的托盘中的标记代表斑块的合理和可实现的密度,当一个人开始用少量纯化的细胞,一个托盘之间应40-150个PFU /小广场举行。在这个特殊的实验中,在图4B的小广场包含103斑块。其他方的托盘上,在图4A的上部角示包含111个PFU。这两个数是并拢(小于10%的差异),如果不是这种情况,算上斑块5格,随意绘制的托盘上,或重复实验,因为变化可能是由于过少的斑块上托盘。在此示例托盘,个PFU的总数是([103 111] / 2)×96 = 10272个PFU。这个数字比建议12,000个PFU别人41下,因为我们使用略小的托盘和12,000个PFU这些托盘上并没有让我们各个斑块之间有良好的区分。
图4C示出了不同类型的蓝色斑的可观察到的例子。在LacI的突变检测,斑块( 即满,部门或圆形)的形态变异的起源的指示,全是从小鼠起源的突变,而另外两个有可能在大肠杆菌产生的大肠杆菌 36,37。当replating(见阿尔斯Ø 图6),几乎所有的"满"牌匾重现> 70%的蓝斑一遍,而斑块部门只有非常小部分做,几乎没有经常较小,圆形斑块。
表2示出的噬菌斑形成具有相对较小的数字纯化的细胞相比,具有高数量的骨髓细胞(细胞,其中将细胞从排序的相同池)和脾细胞的重现性。
突变个PFU被确认,首先由replating( 图6示出的菜肴有代表性的例子进行确认初级突变体(蓝色)个PFU)和第二,通过测序。在图6中含有> 70%的蓝色个PFU(下2)碗碟确认该突变体起源于鼠(而不是在大肠杆菌 )。不过,左上方的菜没有显示出蓝色个PFU,因此,主PFU不应该算作突变和seque通过实践不是必须的。右边显示的菜〜65%的蓝色个PFU。取决于主斑块的形状,该样品将被发送出去进行测序(参见步骤8.4)。只有当一个基因突变可以通过测序来证实将在PFU算作突变。如果不确定的PFU的形状,序列!
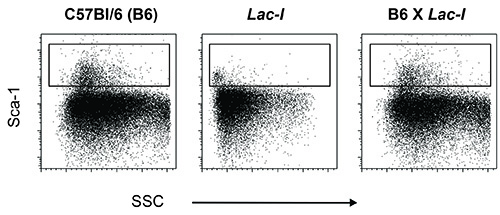
图1的Sca-1染色的来自野生型C57BL6小鼠(B6),转基因LacI的小鼠(LacI的 )和两个(B6 x 了LacI)。骨髓B6小鼠的细胞之间的交叉的后代骨髓细胞表达的Sca- 1在其细胞表面与这个特性被用于纯化的干细胞和祖细胞。转基因小鼠LacI的一个B6的背景,但是,不表达的Sca-1,这个标记必须已经失去了WHILE建立殖民地。重新引入的Sca-1到转基因小鼠LacI的 ,这些小鼠越过定期B6小鼠。

图2。脱氧核糖核酸透析系统,三个膜保持在中心的粘性DNA溶液(颜色为蓝色以便更好地观察)是浮动于TE缓冲液中。红色箭头表示在该膜,它被用于样品识别小缺口。

图3。有效的方式来干60个或更多琼脂/琼脂糖含托盘。
gether.within页="总是"> 
图4。检测的噬斑形成单位(个PFU)描绘的是大琼脂盘( 图3中描绘)与噬菌体感染大肠杆菌的初级菌落(部分) 大肠杆菌 。 (A)显示的是一个完整的板画在它的计数斑块2小方块。冲插入件被放大显示在(B)中。 (二)每个单独的黑色标记点表示在琼脂平板上(总共103),清晰的野生型PFU。 (三)不同的潜在突变个PFU的形状。 点击这里查看大图。
s/ftp_upload/50752/50752fig5highres.jpg"SRC ="/ files/ftp_upload/50752/50752fig5.jpg"/>
图5。有机玻璃计数正方形。描绘的是一个小的和大的计算方。大型广场内的测量有5厘米×5厘米的小广场有2.5厘米×2.5 cm,则。

图6。确认突变体空斑形成单位(个PFU)的。显示的是4小碟接 种的前一天用蓝色PFU的稀释剂。左上角的菜没有显示出蓝色个PFU。右上角显示的菜〜65%的蓝色个PFU。下部的两个托盘显示80-90%的蓝色个PFU(左)和100%的蓝色个PFU(右)。红色箭头表示明确的(野生型)个PFU。
再7"FO:内容宽度="4英寸"FO:SRC ="/ files/ftp_upload/50752/50752fig7highres.jpg"SRC ="/ files/ftp_upload/50752/50752fig7.jpg"/>
图7。突变频率在未分离的骨髓。描绘的是(A)个PFU的数量,(B)中的突变体的数目和(C)的突变频率在三个不同的动物(24-26月龄)进行测定,该值表示通过不同的颜色。每只小鼠中,测量在四个不同的样品体积进行:1.4×10 6,7.0×10 5,3.5×10 5,1.75×10 5个细胞。数据显示,在此范围内的细胞,样本大小不显著影响突变的频率测量。

无花果从纯化的细胞中分离高分子量的DNA样品的 URE 8。 脉冲场电泳基因组DNA,分离出的协议的步骤2中描述的,运行在一个Bio-Rad公司(CHEF-DRⅢ)的系统。在凝胶上加载的各种样品是从肝脏中分离的DNA样品(李,泳道1),贫成熟谱系+细胞的骨髓细胞(LB;泳道2和14),CD34 + LSK细胞(L,泳道6),中医(泳道7-9),总纲图(泳道11和12)以及的Sca-1 +细胞(S,泳道15)。 4车道保持梯子的高分子量DNA。图为,大部分的DNA是高分子量(> 600 kb的)。
表1中。纯化的人群杂样品参 数,全骨髓和脾脏 。使用此表特别注明,本议定书中。对于每个种群表示在顶部,细胞数目(×10 5),每等份试样,DNA的消化时间,DNA样品的体积透析后,需要为每个等分试样每等分试样所需的塔板数和反应的编号显示在左侧。消化倍,在50℃是对实验的成功至关重要。
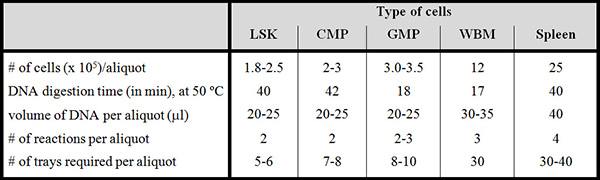
LSK =林-的Sca-1 +套件+细胞; CMP =承诺骨髓祖; GMP =粒细胞/单核细胞祖; WBM =(不排序)全骨髓。脾细胞排序。
表2。斑块形成效率是不同的细胞群之间的可比性。该表显示了不同人群的斑块的形成。六月龄C57BL / 6小鼠被用于这些实验(股骨和每10-11实验小鼠的胫骨,6个实验计)。但所有这些实验GA使用的人群之一已经至少1个,最多24个,(确认)突变的个PFU(Zhou 等 ,撰写中)。 PFU数字可能每个小鼠品系不同而不同。
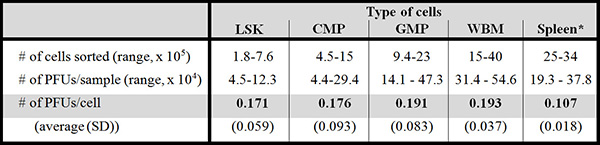
LSK =林-的Sca-1 +套件+细胞; CMP =承诺骨髓祖; GMP =粒细胞/单核细胞祖; WBM =(不排序)全骨髓*脾细胞是未排序的。 SD =标准差。
表3。说明附加试剂的准备工作。

§从RecoverEase DNA提取试剂盒的Stratagene公司说明书
>¶从TRANSPACK包装提取物的Stratagene公司说明书
讨论
本文中描述的体内诱变法是基于最初由Kohler 等人,18该模型利用λ噬菌体载体携带的lacI报告基因产生的LacI的转基因小鼠模型。这两个COS网站侧翼矢量允许一个相对简单的恢复和后续包装成感染性噬菌体颗粒,用来感染大肠杆菌大肠杆菌 。一个蓝色的牌匾将被噬菌体感染的大肠杆菌产生含有突变基因LacI的大肠杆菌 。蓝色的牌匾是对一个无色的背景,从而大大简化了突变的得分任务。 DNA测序技术可被用于识别突变的位置和类型已经发生的是,这可能有助于进一步调查相关突变的机制。
我们这个突变检测的协议所做的修改允许人们使用它与流式细胞仪纯化hematopoie抽动症的细胞群。然而,我们发现,一个可重复的分析仍然需要至少2×10 5的造血细胞,以确保足够数量的高质量的DNA。因为长期再植HSCs的频率极低29,进行诱变分析这些造血干细胞是在这一点上不能达到的。我们在此协议中使用的干细胞富集的人口,LSK细胞,除了包含的Flk-2 -长期再植造血干细胞,还的Flk-2 -短期再植和造血干细胞的Flk-2 +细胞,它代表多能祖细胞(的MPP)42。尽管有此限制,我们觉得利用LSK细胞作为读出的造血干细胞在这个突变检测是合理的,因为它表明,LSK细胞行为更像LSK-FLK-2 -在利用NHEJ方面比造血干祖细胞5。此外,从罗西等人。8的研究表明,MPP时更好的复制与损伤的有限编辑的DNA比造血干细胞,尤其是当他们的年龄,导致我们推测,在LSK人群中发现突变体的数量反映了造血干细胞,而不是的MPP的。
由于小的数字排序的细胞会在每个实验中获得,一个重要的问题需要考虑在这个体内诱变实验的规划阶段,是样本大小( 即每样斑块的总数)要达到统计学意义。换句话说,当目标是,例如,操纵LSK细胞的突变频率进行比较野生型对照LSK细胞,多少斑块总被检测在两个或三个倍的差异所需的每个LSK人口突变的频率是多少?值得注意的是,斑的总数可以从所有实验相结合,因为我们发现分拣实验,至少在野生型细胞中,基于一个负二项回归分析43之间没有显著差异。斑块数的BER是很重要的知道,因为这将决定须(为脾虚,LSKs和中医师〜10,000 WBM和绿化总纲图和〜7,000)进行排序的数量。由于突变频率小于野生型组织44中,正态近似统计学比较,这些是不准确的。为此,我们使用泊松分布的,因为它接近于真实二项式分布(突变频率),当该频率小,样本的大小是相对较大;霍夫曼45提供了式( 式4)来计算样本量基于泊松分布。当施加到2.5假想突变频率,图4,每100,000个细胞在控制细胞44 7的突变,我们需要456949瘟疫,285592和163196,分别检测显著2倍的差异(2样品测试用双尾意义0.05和力量0.80)。少斑须以检测3倍区别:122,148,76,342,和43,624元。因此,需要为每个感兴趣的种群(并因此需要获得足够的细胞种类的数目)噬菌斑的数目依赖于频率突变,可以预计,在控制细胞群和上述预测变化倍数在比较人口。
在此诱变法中最重要的步骤是基因组DNA中(步骤2)的隔离。虽然有必要启动该协议具有较高质量的DNA样品(参见"代表结果"),具有分选的细胞中工作时,细胞数量通常是有限的,不能在确定DNA浓度或大小浪费。我们发现,对于DNA样品的质量又很好的指标是它的粘度,在步骤2.9试样应该是非常粘稠,很难的工作。它需要一些练习来获得这个步骤的权利。因此,建议制定出协议具有大的细胞数, 例如与全骨髓或排序的Sca-1 +细胞,并获得舒适与这些样品中分离DNA,并学习如何判断其粘度DNA的质量。
DNA的质量和大小会影响生成的个PFU数目。当DNA的提取步骤是完善,优化了测定的下一个重要的因素是个PFU的每个托盘的密度如表1所示托盘的推荐数量以用于每种类型的样品的对应细胞的最佳数量为样品。使用本指南应导致托盘,个别斑块还是可以区分开来,但并不过于分散。托盘应每小广场40-120个PFU之间举行,在图4B所示的例子代表一个合理的密度。这些优化方面制定出来的,每个样本产生个PFU的数量是高效的和可重现的( 表2)。
">的LacI的转基因小鼠模型已被用于与各种其他组织,而不是在具有相对小的数字高度纯化种群的结合,当施加到其它(非造血)组织限制性干细胞富集的群体,建议具体注意的DNA分离步骤;他们可能与细胞类型的细胞类型和其他组织的细胞类型为造血细胞的建议也未必正常工作的关键因素,如试剂的量,温度在该的蛋白酶K消化需要发生,而最重要的是,蛋白酶K消化时间将需要被计算出为每个信元类型;这个协议可以作为一个起点。披露声明
作者宣称没有竞争的财务权益。
致谢
我们要感谢大卫·R·罗德里格斯,马的平面设计和摄影在这个手稿。这项工作是由来自GCCRI,美国国立卫生研究院/国家行政学院(5R21AG033339)和癌症中心支援津贴(P30CA054174)到UTHSCSA流式细胞仪核心设施和UTHSCSA先进的核酸核心设施提供资金支持。
材料
| Name | Company | Catalog Number | Comments |
| LacI transgenic mice | BioReliance Corporation | ||
| RecoverEase DNA Isolation Kit, including the RNace-It ribonuclease cocktail | Agilent Technologies (Stratagene) | 720202 | |
| Transpack Packaging Extract, including the orange and blue transpack tubes and the SCS-8 E. coli | Agilent Technologies (Stratagene) | 200221 | |
| DNA size standards – lambda ladder | Bio Rad | 170-3635 | |
| 0.025 mM Pore size membranes | Fisher (Millipore) | VSWP 025 00 | |
| 245 mm2 Bioassay dishes (trays) | Fisher (Corning) | 07-200-600 | |
| NZY broth (powder) | Fisher (Teknova) | N1144 | |
| Agar | Fisher | BP1423-500 | |
| Agarose | Fisher | E-3120-500 | |
| N,N-Dimethylformamide | Fisher | AC34843-5000 | |
| X-gal | Research Products Intl Corp (RPI) | B71800-10.0 | |
| Proteinase K | Roche | 3-115-852 | |
| PCR Extender Taq Polimerase kit | 5 PRIME | 2200500 | |
| Agencourt AMPure XP cleanup kit | Beckman/Coulter | A63880 |
参考文献
- Maslov, A. Y., Vijg, J. Genome instability, cancer and aging. Biochim. Biophys. Acta. 1790 (10), 963-969 (2009).
- Aguilera, A., Gomez-Gonzalez, B. Genome instability: a mechanistic view of its causes and consequences. Nat. Rev. Genet. 9 (3), 204-217 (2008).
- Milyavsky, M., et al. A distinctive DNA damage response in human hematopoietic stem cells reveals an apoptosis-independent role for p53 in self-renewal. Cell. Stem Cell. 7 (2), 186-197 (2010).
- Mohrin, M., et al. Hematopoietic stem cell quiescence promotes error-prone DNA repair and mutagenesis. Cell. Stem Cell. 7 (2), 174-185 (2010).
- Shao, L., Feng, W., Lee, K. J., Chen, B. P., Zhou, D. A sensitive and quantitative polymerase chain reaction-based cell free in vitro non-homologous end joining assay for hematopoietic stem cells. PLoS ONE. 7 (3), (2012).
- Sotiropoulou, P. A., et al. Bcl-2 and accelerated DNA repair mediates resistance of hair follicle bulge stem cells to DNA-damage-induced cell death. Nat. Cell Biol. 12 (6), 572-582 (2010).
- Prasher, J. M., et al. Reduced hematopoietic reserves in DNA interstrand crosslink repair-deficient Ercc1-/- mice. EMBO J. 24 (4), 861-871 (2005).
- Rossi, D. J., et al. Deficiencies in DNA damage repair limit the function of haematopoietic stem cells with age. Nature. 447 (7145), 725-729 (2007).
- Reese, J. S., Liu, L., Gerson, S. L. Repopulating defect of mismatch repair-deficient hematopoietic stem cells. Blood. 102 (5), 1626-1633 (2003).
- Carney, D. A., et al. Therapy-related myelodysplastic syndrome and acute myeloid leukemia following fludarabine combination chemotherapy. Leukemia. 24 (12), 2056-2062 (2010).
- Jankowska, A. M., et al. Base excision repair dysfunction in a subgroup of patients with myelodysplastic syndrome. Leukemia. 22 (3), 551-558 (2008).
- Tam, C. S., et al. Treatment-related myelodysplasia following fludarabine combination chemotherapy. Haematologica. 91 (11), 1546-1550 (2006).
- Webb, S. Xeroderma pigmentosum. BMJ. 336 (7641), 444-446 (2008).
- Ben-Yehuda, D., et al. Microsatellite instability and p53 mutations in therapy-related leukemia suggest mutator phenotype. Blood. 88 (11), 4296-4303 (1996).
- Casorelli, I., et al. Drug treatment in the development of mismatch repair defective acute leukemia and myelodysplastic syndrome. DNA Repair. 2 (5), 547-559 (2003).
- Olipitz, W., et al. Defective DNA-mismatch repair: a potential mediator of leukemogenic susceptibility in therapy-related myelodysplasia and leukemia. Genes Chrom. Cancer. 34 (2), 243-248 (2002).
- Haase, D., et al. New insights into the prognostic impact of the karyotype in MDS and correlation with subtypes: evidence from a core dataset of 2124 patients. Blood. 110 (13), 4385-4395 (2007).
- Kohler, S. W., et al. Analysis of spontaneous and induced mutations in transgenic mice using a lambda ZAP/lacI shuttle vector. Environ. Mol. Mutagen. 18 (4), 316-321 (1991).
- Rogers, B. J., Provost, G. S., Young, R. R., Putman, D. L., Short, J. M. Intralaboratory optimization and standardization of mutant screening conditions used for a lambda/lacI transgenic mouse mutagenesis assay. 327 (1-2), 57-66 (1995).
- Jakubczak, J. L., et al. Analysis of genetic instability during mammary tumor progression using a novel selection-based assay for in vivo mutations in a bacteriophage lambda transgene target. Proc. Natl. Acad. Sci. U.S.A. 93 (17), 9073-9078 (1996).
- Ward, T. L., Prtenjaca, A., Hill, K. A. A novel Escherichia coli-derived mutation detected with the Big Blue cII mutant selectable assay. Environ. Mol. Mutagen. 51 (4), 344-348 (2010).
- Miller, J. H., Coulondre, C., Farabaugh, P. J. Correlation of nonsense sites in the lacI gene with specific codons in the nucleotide sequence. Nature. 274 (5673), 770-775 (1978).
- Provost, G. S., et al. Transgenic systems for in vivo mutation analysis. Mutat. Res. 288 (1), 133-149 (1993).
- Schaaper, R. M., Danforth, B. N., Glickman, B. W. Mechanisms of spontaneous mutagenesis: an analysis of the spectrum of spontaneous mutation in the Escherichia coli lacI gene. J. Mol. Biol. 189 (2), 273-284 (1986).
- Schaaper, R. M., Dunn, R. L. Spontaneous mutation in the Escherichia coli lacI gene. Genetics. 129 (2), 317-326 (1991).
- Burkhart, J. G., Burkhart, B. A., Sampson, K. S., Malling, H. V. ENU-induced mutagenesis at a single A: T base pair in transgenic mice containing phi X174. Mutat. Res. 292 (1), 69-81 (1993).
- Valentine, C. R., et al. Characterization of mutant spectra generated by a forward mutational assay for gene A of Phi X174 from ENU-treated transgenic mouse embryonic cell line PX-2. Environ. Mol. Mutagen. 39 (1), 55-68 (2002).
- Gossen, J. A., Molijn, A. C., Douglas, G. R., Vijg, J. Application of galactose-sensitive E. coli strains as selective hosts for LacZ- plasmids. Nucleic Acids Res. 20 (12), 3254 (1992).
- Kiel, M. J., et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6674), 193-197 (2000).
- Frascoli, M., Proietti, M., Grassi, F. Phenotypic analysis and isolation of murine hematopoietic stem cells and lineage-committed progenitors. J. Vis. Exp. (65), (2012).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273 (5272), 242-245 (1996).
- Stratagene, Transpack packaging extract for lambda transgenic shuttle vector recovery. Instruction manual. , (2001).
- Stratagene, RecoverEase DNA isolation kit. Instruction manual. , (2009).
- Stratagene, Big Blue transgenic mouse mutagenesis assay system. Instruction manual. , (1992).
- Nishino, H., Buettner, V. L., Sommer, S. S. Towards validation of the Big Blue transgenic mouse mutagenesis assay: the mutational spectrum of ex vivo pinpoint mutant plaques. Muta. Res. 372 (1), 97-105 (1996).
- Stuart, G. R., Gorelick, N. J., Andrews, J. L., de Boer, J. G., Glickman, B. W. The genetic analysis of lacI mutations in sectored plaques from Big Blue transgenic mice. Environ. Mol. Mutagen. 28, 385-392 (1996).
- Bielas, J. H., Heddle, J. A. Proliferation is necessary for both repair and mutation in transgenic mouse cells. Proc. Natl. Acad. Sci. U.S.A. 97 (21), 11391-11396 (2000).
- Paashuis-Lew, Y., Zhang, X. B., Heddle, J. A. On the origin of spontaneous somatic mutations and sectored plaques detected in transgenic mice. Mutat. Res. 373 (2), 277-284 (1997).
- de Boer, J. G., Glickman, B. W. The lacI gene as a target for mutation in transgenic rodents and Escherichia coli. Genetics. 148 (4), 1441-1451 (1998).
- Piegorsch, W. W., et al. Study design and sample sizes for a lacI transgenic mouse mutation assay. Environ. Mol. Mutagen. 25 (3), 231-245 (1995).
- Yang, L., et al. Identification of Lin(-)Sca1(+)kit(+)CD34(+)Flt3- short-term hematopoietic stem cells capable of rapidly reconstituting and rescuing myeloablated transplant recipients. Blood. 105 (7), 2717-2723 (2005).
- Hilbe, J. M. . Negative Binomial Regression. second edn. , (2011).
- de Boer, J. G., Provost, S., Gorelick, N., Tindall, K., Glickman, B. W. Spontaneous mutation in lacI transgenic mice: a comparison of tissues. Mutagenesis. 13 (2), 109-114 (1998).
- Huffman, M. D. An improved approximation to-sample poisson test. Appl. Stat. 33 (2), 224-226 (1984).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。